DIAH ANGGRAINI WULANDARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Ekstraksi dan Aktivitas Inhibisi Spirulina platensis terhadap Plasmodium falciparum 3D7 Penyebab
Malaria secara In-vitro” adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Biologi Molekuler Eijkman.
Bogor, Agustus 2016 Diah Anggraini Wulandari NRP C351130091
RINGKASAN
DIAH ANGGRAINI WULANDARI. Ekstraksi dan Aktivitas Inhibisi
Spirulina platensis terhadap Plasmodium falciparum 3D7 Penyebab Malaria
secara In-vitro. Dibimbing oleh IRIANI SETYANINGSIH dan PUJI BUDI
SETIA ASIH.
Malaria adalah penyakit menular yang disebabkan oleh parasit
Plasmodium yang dapat ditularkan melalui gigitan nyamuk Anopheles betina.
Kasus malaria yang terjadi pada tahun 2008-2013 di Indonesia masih cukup banyak yaitu 1.38 per 1000 penduduk dengan daerah yang paling banyak terinfeksi yaitu Papua, Papua Barat dan Nusa Tenggara Timur. Peningkatan kasus malaria disebabkan oleh berbagai faktor salah satunya resistensi parasit terhadap obat malaria misalnya klorokuin dan sulfadoksin pirimetamindi beberapa negara. saat ini telah terdapat pergeseran clearance terhadap obat antimalaria golongan
artemisisnin di beberapa negara antara lain Kamboja, Myanmar, Thailand, Lao
People’s Democratic Republic (PDR) dan Vietnam. Hal ini menjadi tantangan
besar dalam upaya pemberantasan malaria, oleh karena itu perlu adanya penemuan kandidat obat baru salah satunya Spirulina platensis yang bersumber
dari natural product yang diduga dapat menghambat pertumbuhan Plasmodium.
Hasil penelitian menyatakan bahwa fikosianin dan alkaloid dari beberapa tanaman berpotensi sebagai antimalaria. Biopigmen dan senyawa yang sama juga terkandung di dalam S. platensis sehingga diduga bahwa fikosianin, alkaloid
maupun senyawa aktif lain yang terdapat pada S. platensis juga memiliki potensi
yang sama sebagai antimalaria. Penelitian ini bertujuan untuk menentukan metode ekstraksi fikosianin terbaik dengan pelarut berbeda, menentukan eluen dan fraksi terbaik pada isolasi senyawa aktif, menentukan aktivitas inhibisi kapsul Spirulina
komersial, serbuk biomassa, ekstrak kasar, fraksi dan fikosianin dari S. platensis
dalam menghambat pertumbuhan P. falciparum, dan menentukan mekanisme
kerja S. platensis dalam menghambat pertumbuhan P. falciparum menggunakan Transmission Electron Microscope (TEM).
Penelitian ini terdiri atas tiga tahapan yang meliputi kultivasi S. platensis,
ekstraksi komponen aktif dan fikosianin dari S. platensis, isolasi dan fraksinasi
senyawa aktif. Analisis yang dilakukan meliputi analisis kandungan C-fikosianin (C-PC), rendemen fikosianin dan total protein fikosianin, analisis komponen aktif, analisis aktivitas inhibisi kapsul Spirulina komersial, serbuk biomassa, ekstrak kasar,
fraksi dan fikosianin dari S. platensis terhadap pertumbuhan P. falciparum, analisis
morfologi parasit P. falciparum menggunakan mikroskop cahaya dan Transmission Electron Microscope (TEM).
Kandungan C-PC, rendemen dan protein pada fikosianin yang diekstraksi menggunakan bufer fosfat berturut-turut yaitu 8 mg/mL, 20.22 %, 1.88%, fikosianin yang diekstraksi menggunakan air yaitu 6.63 mg/mL, 16.58%, 3.51%, dan fikosianin yang diekstraksi menggunakan aseton amonium sulfat yaitu 2.86 mg/mL, 7.15%, 8.4%. Fikosianin terpilih pada ekstraksi menggunakan tiga jenis pelarut berbeda yaitu fikosianin yang diekstraksi menggunakan bufer fosfat, sedangkan fraksi terpilih dari kombinasi eluen diklorometana: kloroform :n-heksana (3:2:1) yaitu fraksi 08. Kapsul Spirulina komersial, serbuk biomassa,
Spirulina komersial, serbuk biomassa, fraksi 08 dan ekstrak kasar dari S. platensis
dapat menghambat pertumbuhan P. falciparum 3D7 dan berpotensi sebagai
antimalaria pada konsentrasi IC50 berturut-turut yaitu 2.16 µg/mL, 18.04 µg/mL,
11.41 µg/mL dan 19.11 µg/mL. Mekanisme kerja kapsul Spirulina diduga
menghambat pembentukan pigmen malaria (hemozoin) dengan cara membentuk ikatan antara S. platensis dan ferriprotoporin IX pada permukaan membran
plasma dan merusak membran sel parasit P. falciparum 3D7 pada konsentrasi
2.16 µg/mL.
SUMMARY
DIAH ANGGRAINI WULANDARI. Extraction and In vitro-Inhibition Activity
of Spirulina platensis towards Plasmodium falciparum that Caused Malarial
Disease. Supervised by IRIANI SETYANINGSIH and PUJI BUDI SETIA ASIH.
Malaria is an infectious disease caused by parasites Plasmodium that its transmitted through female Anopheles mosquito’s bites. Malarial cases between 2008-2013 in Indonesia were still quite a lot, that were 1.38 per 1000 inhabitants with Papua, West Papua and East Nusa Tenggara as the most affected regions. The increasing of malarial case is caused by various factors, single of those is parasite resistance towards malarial drugs such as chloroquine and sulfadoxine pyrimethamine in some countries. Even nowadays, there has been a shift in anti-malarial drug clearance of artemisin group that has been reported in Cambodia, Myanmar, Thailand, Lao People's Democratic Republic (PDR) and Vietnam. This is a major challenge against malaria, therefore we need to discover new drug candidate espesially from natural product such as S. platensis. Some studies
showed that phycocyanin and alkaloids from several plants had potential as an antimalarial. That compound and biopigment also contain in S. platensis, thus
phycocyanin, alkaloids and other active compound from S. platensis also has a
similar activity to inhibit P. falciparum as an antimalarial. The aims of this study
were to determine the best extraction method of phycocyanin with different solvents, to determine the best fraction on active compounds isolation, to observe the inhibitory activity of commercial Spirulina capsules, biomass powder, crude
extracts, active fractions and phycocyanin of S. platensis in inhibiting the growth
of P. falciparum, and to identify the mechanism of S. platensis in obstructing the
growth of P. falciparum using Transmission Electron Microscope (TEM).
This study consist of three steps included cultivation of S. platensis, active
compound and phycocyanin extraction of S. platensis isolation and fractionation
of the active compound. The analysis include C-PC content, yield and total protein of phycocyanin analysis, active compound analysis, analysis of inhibitory activity of commercial Spirulina capsules, biomass powder, crude extract, active
fractions and phycocyanin of S. platensis to inhibit P. falciparum growth, parasite
morphology analysis of P. falciparum using light microscopy and Transmission
Electron Microscopy (TEM).
The content of C-phycocyanin (C-PC), yield and protein in phycocyanin extracted using phosphate buffer were 8 mg/mL, 20.22%, 1.88% respectively, phycocyanin extracted using water were 6.63 mg/mL, 16.58%, 3.51% and phycocyanin extracted with acetone ammonium sulfate were 2.86 mg/mL, 7.15%, 8.4% appropriately. Phosphate buffer was the best solvent in phycocyanin extraction. Fraction 08 was selected from combination eluent dichloromethane : chloroform: n-hexane (3:2:1). Commercial Spirulina capsules, biomass powder,
crude extract of S. platensis contained alkaloids, saponins and steroids.
Commercial Spirulina capsules, biomass powder, fraction 08 and crude extract of S. platensis were able to inhibit P. falciparum 3D7 and potential as antimalarial
with IC50 2.16 µg/mL, 18.04 µg/mL, 11.41 µg/mL and 19.11 µg/mL respectively.
surface of the plasma membrane and destroyed membrane cell parasite P. falciparum 3D7 at concentration 2.16 µg/mL
Keywords: Action mechanism, malarial activity, phycocyanin, P. falciparum 3D7,
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB dan Lembaga Biologi Molekuler Eijkman.
EKSTRAKSI DAN AKTIVITAS INHIBISI Spirulina platensis
TERHADAP Plasmodium falciparum 3D7 PENYEBAB
MALARIA SECARA IN-VITRO
DIAH ANGGRAINI WULANDARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karuniaNya, sehingga penulisan tesis ini dapat terselesaikan dengan baik. Tema yang dipilih dalam penelitian ini adalah “Ekstraksi dan Aktivitas Inhibisi
Spirulina platensis terhadap Plasmodium falciparum 3D7 Penyebab Malaria
Secara In-vitro” Terima kasih penulis ucapkan kepada seluruh pihak yang
membantu dalam penyelesaian tesis ini. Ucapan terimakasih ini khususnya saya tujukan kepada
1 Dr Ir Iriani Setyaningsih, MS dan Dr Puji Budi Setia Asih, SSi selaku dosen pembimbing yang telah membimbing dengan penuh kesabaran, memberikan motivasi dalam menyelesaikan studi serta memberikan masukan dan saran dalam proses pembuatan tesis ini sehingga tesis ini dapat terselesaikan dengan baik.
2 Dr Kustiariyah, SPi, MSi selaku dosen penguji luar komisi dan Prof Dr Ir Nurjanah, MS selaku perwakilan gugus kendali mutu THP atas masukan dan saran dalam proses penyempurnaan tesis ini.
3 Keluarga ayah dan ibu atas kasih sayang yang berlimpah serta dukungan moril dan materil demi terselesainya tesis ini.
4 Ketua Departemen dan Ketua Program Studi yang memberikan dukungan moril, saran dan nasehat selama penulisan tesis ini.
5 Lembaga Biologi Molekuler Eijkman khususnya Laboratorium malaria dan resistensi vektor yang telah memberikan kesempatan bagi saya untuk melakukan penelitian dan mendukung dana penelitian saya pada pengujian antimalaria.
6 Seluruh keluarga besar Lembaga Biologi Molekuler Eijkman, khususnya peneliti senior Laboratorium Malaria dan Resistensi Vektor, Prof. dr. Syafrudddin, PhD dan asisten peneliti di Laboratorium Malaria dan Resistensi Vektor yaitu Elizabeth Sidharta, Jonathan Marshall Marbun, Silvya Sance Marantina, Anggi Puspa Nur Hidayati, Nia Rachmawati, Nandha Rizky Pratama, Sully Kosasih, Ibu Zubaidah, Bapak Suradi serta kak Dendi atas dukungan serta rasa kekeluargaan yang begitu hangat selama penulis melakukan penelitian. Kesempatan untuk melakukan penelitian di Lembaga ini adalah salah satu kebanggaan bagi penulis. 7 Teman kuliah dan segenap tim Basecamp THP atas motivasi,
persahabatan, kekeluargaan, canda, tawa yang telah dilalui bersama. 8 Seluruh pihak yang membantu atas segala doa dan dukungannya sehingga
tesis ini dapat terselesaikan dengan baik.
Semoga tesis ini bermanfaat bagi kemajuan ilmu pengetahuan khususnya dalam bidang perikanan dan kelautan.
Bogor, Agustus 2016
DAFTAR GAMBAR
Diagram alur penelitian secara keseluruhan
Diagram alir tahap ekstraksi komponen aktif dan fikosianin Skema pengenceran bertingkat pada multiplate 48 well
Diagram alir uji aktivitas inhibisi P. falciparum
Struktur kimia biopigmen fikosianin
Konsentrasi C-phycocyanin pada S. platensis
Rendemen fikosianin pada S. platensis
Total protein fikosianin
Jalur metabolit primer dan skunder pada S. platensis
Kromatogram ekstrak kasar S. platensis
Kromatogram ekstrak S. platensis hasil visualisasi
Morfologi P. falciparum dilihat dengan mikroskop cahaya
Marfologi sel parasit P. falciparum dilihat dengan TEM
6
Rendemen S. platensis yang dikultivasi menggunakan Walne
Komponen aktif S. platensis
Nilai IC50 penghambatan pertumbuhan parasit P. falciparum 3D7
17
Kurva standar pengujian protein Lowry
Hasil Uji statistik RAL C-phycocyanin
Hasil Uji lanjut Duncan C-phycocyanin
Hasil uji statistik RAL rendemen fikosianin Hasil uji lanjut Duncan rendemen fikosianin
Hasil uji statistik RAL protein Lowry pada fikosianin Hasil uji lanjut Duncan protein Lowry pada fikosianin
Kurva pertumbuhan P.falciparum dipaparkan kapsul Spirulina
Kurva pertumbuhan P.falciparum dipaparkan fikosianin
Kurva pertumbuhan P.falciparum dipaparkan ekstrak kasar S. platensis
Kurva pertumbuhan P.falciparum dipaparkan fraksi 08 S. platensis
Kurva pertumbuhan P.falciparum dipaparkan artemisinin
1 PENDAHULUAN
Latar Belakang
Malaria adalah penyakit menular yang disebabkan oleh parasit dari genus
Plasmodium yang ditularkan melalui gigitan nyamuk Anopheles betina. Malaria
juga dapat ditularkan melalui transfusi darah, jarum suntik, serta ibu hamil kepada bayinya (Mackintosh et al. 2004). Ada lima spesies Plasmodium penyebab
malaria pada manusia, yaitu P. vivax, P. falciparum, P. knowlesi, P. malariae, dan P. ovale (Tarmuz et al. 2003). Setiap tahun lebih dari 500 juta penduduk dunia
terinfeksi malaria dan lebih dari 1 000 000 orang meninggal dunia (WHO 2013). Kasus terbanyak terdapat di Afrika dan beberapa negara Asia. Indonesia merupakan negara endemis malaria dengan spesies yang paling banyak dijumpai adalah P. falciparum dan P. vivax. Plasmodium falciparum merupakan spesies
yang paling berbahaya terhadap manusia karena dapat menyebabkan malaria berat dan malaria otak. Kasus malaria yang terjadi pada tahun 2008-2013 masih cukup banyak yaitu 1.38 per 1000 penduduk dengan daerah yang paling banyak terinfeksi yaitu Papua (42.65 per 1000 penduduk), Papua Barat (38.44 per 1000 penduduk) dan NTT (16.37 per 1000 penduduk) (KEMENKES RI 2014).
Peningkatan kasus malaria disebabkan oleh berbagai macam faktor salah satunya resistensi parasit terhadap obat malaria. Resistensi ini muncul pertama kali di Thailand dan Amerika Selatan sedangkan resistensi P. falciparum terhadap
klorokuin di Indonesia pertama kali ditemukan di Kalimantan Timur, kemudian terus meluas ke berbagai provinsi di Indonesia. Angka resistensi di Irian Jaya dan di daerah Mandailing Natal Sumatera Utara sekitar 75% sampai 95% dimana resistensi terhadap klorokuin sekitar 32% dan terhadap sulfadoksin-pirimetamin 29% (KEMENKES RI 2004). World Health Organization (WHO) dan
Departemen Kesehatan Republik Indonesia merekomendasikan artemisinin based combination therapy (ACT) sebagai obat pilihan pengganti klorokuin dan
sulfadoksin pirimetamin (SP) dalam rangka mengatasi kasus resistensi tersebut. Penggunaan obat secara kombinasi dapat mengurangi cepatnya perkembangan resistensi serta meningkatkan efek obat secara sinergis, namun belakangan ini menurut WHO (2015) resistensi terhadap obat antimalaria golongan artemisin telah ditemukan di Kamboja, Myanmar, Thailand, Lao People’s Democratic
Republic (PDR) dan Vietnam.
Hasil penelitian Dondorp et al. (2009) menunjukkan adanya penurunan
efektivitas pengobatan dengan artesunat di daerah perbatasan Kamboja-Thailand yang ditandai oleh clearance parasit yang melambat secara in-vivo. Resistensi
obat berpotensi menyebabkan kematian pada penderita akibat timbulnya berbagai penyakit seperti liver, ginjal, kecacatan lahir, bayi prematur, keguguran pada ibu hamil. Hal ini menimbulkan kekhawatiran bagi masyarakat maupun WHO oleh sebab itu perlu adanya pengembangan obat baru dengan memanfaatkan natural product yang berasal dari alam. Pemilihan obat yang berbasis natural product
diharapkan mampu menurunkan risiko resistensi, dan tidak menimbulkan residu pada penderita malaria. Salah satu natural product yang dapat dikembangkan
adalah Spirulina platensis.
Spirulina platensis merupakan tumbuhan primitif berukuran seluler yang
dapat dimanfaatkan sebagai imunomodulator, antivirus (Basha et al. 2009),
antioksidan (Herrero et al. 2004), antibakteri (Richmond 2004), meningkatkan
hemoglobin, leukosit, dan trombosit serta mampu menstimulasi sistem sel di sum-sum tulang (Cappeli dan Cysewski 2010). Spirulina platensis memiliki
kandungan protein 50-70%, lemak 4-5%, biopigmen 6%, vitamin B, vitamin E, vitamin K, phenolic acids, tocopherol, GLA (Gamma linoleic acid), asam folat,
dan zat besi (Cappeli dan Cysewski 2010). Biopigmen yang paling banyak dihasilkan dari S. platensis per 100 g biomassa yaitu fikosianin (1.4 g), chlorophyll (11 mg), dan β-caroten (33 mg) (Diharmi 2001). Beberapa senyawa
aktif pada S. platensis yang diduga berperan sebagai antimalaria yaitu fikosianin
dan alkaloid.
Fikosianin merupakan senyawa protein yang termasuk ke dalam kelompok fikobilliprotein berwarna biru yang digunakan sebagai penyimpan cadangan nitrogen pada cyanobacter. Spirulina platensis mengandung 20% fikosianin
(pigmen biru) yang stabil pada pH 4.5-8.0 dengan suhu konstan 60 oC dan peka
terhadap cahaya (Cohen 1997), pigmen ini larut dalam air dan pelarut polar lainnya, perbedaan pelarut dan metode ekstraksi akan menghasilkan kuantitas dan kualitas fikosianin yang berbeda. Hasil penelitian Silveira et al. (2007)
menunjukkan bahwa fikosianin yang diekstrak menggunakan air dan bufer fosfat menghasilkan fikosianin yang berbeda yaitu 3.73 mg/mL dan 4.20 mg/mL oleh karena itu perlu dilakukan penelitian lebih lanjut mengenai pelarut yang efektif pada ekstraksi fikosianin.
Menurut Richmond (2004) fikosianin dapat membantu meningkatkan aktivitas unsur-unsur antibodi untuk melawan infeksi yang disebabkan oleh virus, bakteri, maupun parasit, sehingga tubuh memiliki daya tahan yang lebih kuat. Penelitian mengenai fikosianin dalam bidang kesehatan saat ini terus dikembangkan. Gonzalez et al. (2003) melaporkan bahwa 0.2 mg/mL fikosianin
dapat mereduksi kadar AST dan ALT pada sel hati tikus yang diinduksi Gal N dan berperan sebagai hepatoprotektor. Ali dan Saleh (2012) juga menyatakan bahwa polisakarida dan fikosianin yang berasal dari S. platensis dapat menghambat
pertumbuhan sel kanker dengan cara meningkatkan aktivitas enzim pada sel nukleus dan memperbaiki sintesis DNA. Beberapa penelitian juga menyatakan bahwa fikosianin berperan dalam menghambat pertumbuhan Plasmodium. Hasil
penelitian Pankaj et al. (2010) menunjukkan 3 µg/mL fikosianin yang berasal dari Nostoc muscorum. (Cyanobacter) dapat menghambat pertumbuhan parasit Plasmodium dengan nilai IC50 8.4-12.0 µg/mL, sedangkan konsentrasi fikosianin
96 µg/mL dapat mengurangi jumlah parasit Plasmodium hingga mencapai 0
(inhibisi 100%) dengan demikian diduga bahwa fikosianin yang berasal dari S. platensis juga memiliki aktivitas yang sama seperti halnya fikosianin yang berasal
dari Nostoc muscorum.
Senyawa aktif lain yang diduga berperan dalam menghambat pertumbuhan
Plasmodium yaitu alkaloid. Hasil penelitian Lusiana (2009) menunjukkan bahwa
alkaloid yang diekstrak dari tanaman Albertisia papuana dapat menghambat
pertumbuhan skizon galur resisten (W2) P. falciparum pada konsentrasi 1, 10, dan
100 μg/mL dengan nilai inhibisi sebesar 83.9%, 97.75%, dan 100%.
Lohombo-Ekombo et al. (2004) juga melaporkan bahwa alkaloid yang diekstrak
dari tanaman Albertisia villosa dapat menghambat pertumbuhan P. falciparum
alkaloid, fenol, steroid, dan saponin. Alkaloid pada S. platensis diduga memiliki
aktivitas yang sama seperti halnya alkaloid pada tanaman Albertisia papuana
dalam menghambat pertumbuhan P. falciparum. Penelitian mengenai aktivitas
inhibisi P. falciparum dari S. platensis yang berpotensi sebagai antimalaria
maupun komponen aktifnya masih sangat terbatas sehingga perlu dilakukan pengkajian lebih mendalam mengenai aktivitas inhibisi S. platensis terhadap
pertumbuhan P. falciparum dan senyawa aktif yang berperan dalam
penghambatannya.
Rumusan Masalah
Masalah yang terdapat dalam pengobatan malaria adalah terjadinya kasus resistensi obat antimalaria oleh karena itu perlu adanya penemuan kandidat obat baru salah satunya S. platensis yang bersumber dari natural product yang diduga
dapat menghambat pertumbuhan P. falciparum. Spirulina platensis mengandung
fikosianin, alkaloid, dan komponen aktif lain yang berpotensi sebagai antimalaria. Permasalahan pengembangan S. platensis sebagai salah satu kandidat obat baru
yaitu sulitnya mendapatkan ekstrak fikosianin dengan rendemen dalam jumlah besar dan belum adanya deteksi senyawa aktif S. platensis yang berperan dalam
menghambat pertumbuhan P. falciparum. Penggunaan konsentrasi yang tidak
tepat juga dapat mempengaruhi aktivitas penghambatan P. falciparum. Penelitian
ini mengenai pengkajian metode ekstraksi fikosianin menggunakan tiga jenis pelarut untuk mendapatkan hasil fikosianin terbaik, pendeteksian senyawa aktif yang berperan dalam menghambat pertumbuhan P. falciparum yang berpotensi
sebagai antimalaria, penentuan konsentrasi IC50 dan mekanisme penghambatan
pertumbuhan P. falciparum.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1 Menentukan metode ekstraksi fikosianin terbaik dengan pelarut berbeda 2 Menentukan eluen dan fraksi terbaik pada isolasi senyawa aktif
3 Menentukan aktivitas inhibisi kapsul Spirulina komersial, ekstrak kasar, fraksi
dan fikosianin dari S. platensis dalam menghambat pertumbuhan P. falciparum
4 Menentukan mekanisme kerja S. platensis dalam menghambat pertumbuhan P. falciparum menggunakan Transmission Electron Microscope (TEM)
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai aktivitas inhibisi
S. platensis terhadap pertumbuhan P. falciparum, komponen aktif yang berperan
sebagai antimalaria dan mekanisme kerja S. platensis dalam menghambat
Hipotesis Penelitian
Hipotesis yang diajukan dalam penelitian ini adalah:
1 Perbedaan pelarut pada ekstraksi fikosianin berpengaruh terhadap konsentrasi
C-phycocyanin, rendemen dan total protein yang dihasilkan
2 Kapsul Spirulina komersial, ekstrak kasar, fraksi dan fikosianin yang berasal
dari S. platensis dapat menghambat pertumbuhan P. falciparum 3D7
3 Spirulina platensis dapat menghambat pembentukan hemozoin pada P. falciparum.
2 METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari – Oktober 2015 yang bertempat dibeberapa lokasi. Kultivasi S. platensis dilakukan di Laboratorium
Bioteknologi 2 Hasil Perairan. Ekstraksi dan analisis komponen aktif S. platensis
dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Kimia Organik, Laboratorium Kimia Anorganik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Analisis aktivitas inhibisi S. platensis terhadap P. falciparum dan
pengamatan morfologi P. falciparum dilakukan di Laboratorium Malaria dan
Resistensi Vektor, Lembaga Biologi Molekuler Eijkman, Jakarta.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini antara lain kapsul
Spirulina komersial, air tawar, air laut, inokulum S. platensis diperoleh dari Balai
Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara-Jawa Tengah dan media Walne. Bahan ekstraksi meliputi etanol, bufer fosfat, akuades, aseton, dan amonium sulfat, kloroform, metanol, etil asetat, n-heksana, diklorometana. Bahan pengujian senyawa aktif antara lain BSA, Folin-ciocalteu-fenol, Cu alkali, NaOH
4%, Na2CO3 20%, Na K-tartrat 20%, CuSO4.5H2O 5%, FeCl3 1%, larutan
Lieberman-Burchard, HCl 2N, amonia 10%, H2SO4 2N, pereaksi Dragendorff,
Meyer, Wagner dan silika gel PF254.
Bahan pengujian aktivitas inhibisi P. falciparum antara lain kapsul Spirulina komersial, fikosianin, ekstrakkasar, fraksi dari S. platensis, artemisinin, P. falcifarum 3D7 (cloroquine sensitive) yang diperoleh dari Lembaga Biomolekuler
Eijkman, RPMI 1640 (Sigma-Alorich), HEPES (Sigma®), hipoksantin, NaHCO3
(Sigma®), disinfektan (baycline) Na2HPO4 Antibiotik gentamisin injeksi (Sigma®)
G1397), NaCl 3.5 %, sorbitol 5%, serum darah, sel darah merah, antikoagulan sitrat fosfat dektrosa (CPD), pewarna giemsa (Merck KGaA), akuabidestilata, nitrogen
cair, minyak immerse (Merck), alkohol. Bahan pengujian mekanisme obat
(Alorich ®), ethanol 95%, prophylene oxide (Alorich ®),destilated water, osmium (Sigma®), cacodylate acid (Sigma®), lead nitrat, lead acetat, lead citrate (Proscitech), uranyl acetate (Sigma®), spurr’s resin (Proscitech).
Alat yang digunakan meliputi peralatan kultivasi yaitu akuarium, toples,
nylon mesh, selang, aerator, alat gelas, Water Quality Meter (WQM), timbangan
digital (Quattro), Rotary evaporator (Heidolph VV 2000), vortex (thermolyne),
sentrifuse (Heraeus pyco17) dan oven. Alat yang digunakan dalam pengujian
senyawa aktif yaitu plat KLT, plat kaca, UV-vis, penangas/kompor listrik. Alat
yang digunakan dalam pengujian aktivitas inhibisi P. falciparum dan TEM adalah
sentrifuse (Sorvall® RT 6000D), tabung falcon ukuran 10 mL, 15 mL dan 50 mL
(corning), biosafety cabinate (Hera SafeKSP, thermo scientific), multipleplate 96 well (costar 3596,corning), multipleplate 24 well (Nunclon surface), tabung nitrogen
cair (Locator JR), inkubator (Heraeus instrument), TEM cutting microscope (Rechert ultracut 5 Leica), kaca preparat, flask, tabung red blood cell, filter medium
(Nalgene®),Transmission Electron Microscope (TEM) (JEOL, JEM 1010), candle jar, dan microskop cahaya (Zeiss axiokop).
Prosedur Penelitian
Penelitian ini terdiri atas tiga tahapan yang meliputi (1) kultivasi S. platensis,
(2) ekstraksi S. platensis dan fikosianin, (3) isolasi dan fraksinasi senyawa aktif.
Analisis yang dilakukan meliputi (1) analisis kandungan C- PC, rendemen fikosianin dan total protein fikosianin (2) analisis komponen aktif, (3) analisis aktivitas inhibisi kapsul Spirulina komersial, ekstrak kasar, fraksi dan fikosianin dari S. platensis
terhadap pertumbuhan P. falciparum, (4) analisis morfologi parasit P. falciparum
menggunakan mikroskop cahaya dan Transmission Electron Microscope (TEM).
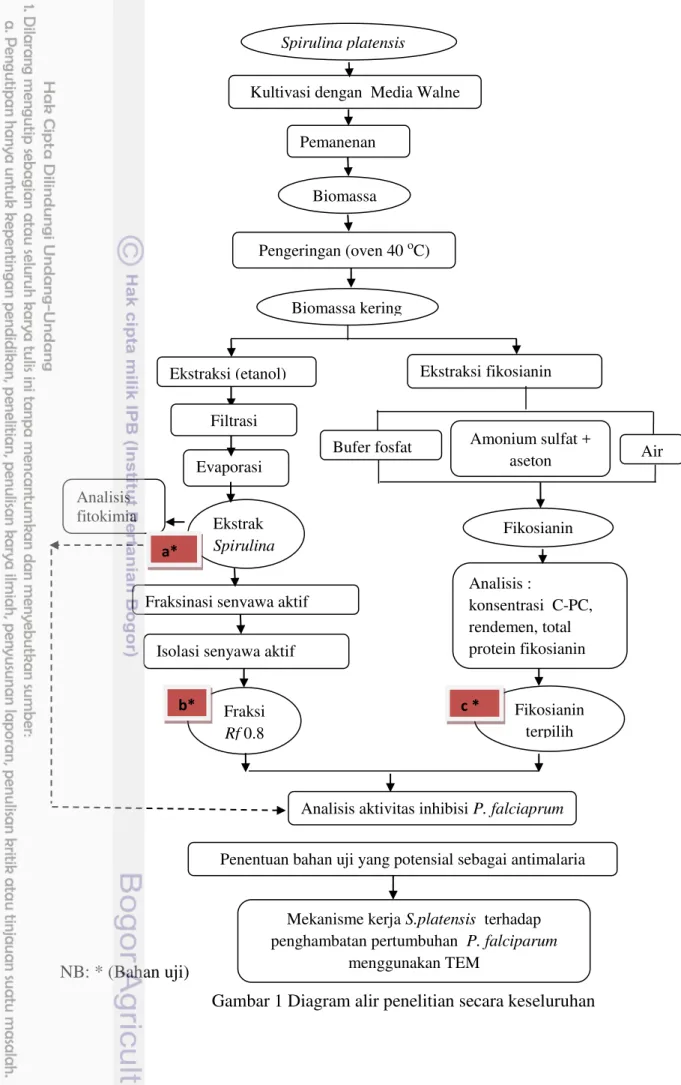
Alur penelitian secara keseluruhan dapat dilihat pada Gambar 1.
Prosedur Kerja
Kultivasi Spirulina platensis
Kultivasi S. platensis dilakukan di Laboratorium Bioteknologi 2 Hasil
Perairan dengan tiga kali ulangan. Spirulina platensis dikultivasi di dalam toples
menggunakan media Walne, suhu 25 oC, intensitas cahaya 3000 lux dengan
perbandingan terang: gelap 16:8 (jam) salinitas air laut 15 ppt dan bibit yang digunakan 20% dari volume kultur yang mengacu pada Diharmi (2001).
Spirulina platensis dipanen pada hari ke 7-8 dengan OD ≥ 0.8 menggunakan nylon mesh dengan ukuran 0.2 μm untuk memisahkan biomassa dan filtratnya.
NB: * (Bahan uji)
Analisis fitokimia
Kultivasi dengan Media Walne
Biomassa kering Pengeringan (oven 40 oC)
Ekstraksi fikosianin
Bufer fosfat Amonium sulfat + aseton
Analisis aktivitas inhibisi P. falciaprum Ekstraksi (etanol)
Air
Fikosianin terpilih Evaporasi
Ekstrak Spirulina
Fraksinasi senyawa aktif
Isolasi senyawa aktif
Fraksi Rf 0.8
Analisis : konsentrasi C-PC,
rendemen, total protein fikosianin
Mekanisme kerja S.platensis terhadap penghambatan pertumbuhan P. falciparum
menggunakan TEM
a*
b* c *
Filtrasi
Spirulina platensis
Fikosianin
Penentuan bahan uji yang potensial sebagai antimalaria Pemanenan
Gambar 1 Diagram alir penelitian secara keseluruhan keseluruhan.
Ekstraksi Spirulina platensis
Ekstraksi S. platensis terdiri atas dua tahap yaitu ekstraksi senyawa aktif S. platensis dan ekstraksi fikosianin. Ekstrak kasar senyawa aktif dan fikosianin
yang diperoleh selanjutnya dianalisis komponen aktif dan aktivitas inhibisinya terhadap pertumbuhan P. falciparum
(1) Ektraksi senyawa aktif
Ekstraksi senyawa aktif S. platensis dilakukan menggunakan pelarut polar
(etanol 96%) dengan konsentrasi 1:10 b/v (S. platensis : etanol) kemudian
dimaserasi selama 3x24 jam pada suhu ruang, selanjutnya sampel dievaporasi sehingga diperoleh ekstrak kasar (crude extract)S. platensis.
(2) Ekstraksi fikosianin
Ekstraksi fikosianin dilakukan menggunakan tiga pelarut yaitu bufer fosfat, air dan amonium sulfat+aseton.
a) Ekstraksi menggunakan bufer fosfat (Silveira et al. 2007)
Serbuk S. platensis diekstraksi menggunakan bufer sodium fosfat
10 mM (pH 7.0). Spirulina platensis kering digerus dan ditambahkan
bufer sodium fosfat dan akuades, masing-masing 1 mL untuk 0.04 g berat kering sampel. Sampel dihomogenkan dan disimpan pada suhu ruang 24 jam setelah itu larutan disentrifugasi dengan kecepatan 12000 rpm, 4 oC selama 15 menit. Supernatan merupakan fikosianinyang akan
digunakan pada pengujian selanjutnya.
b) Ekstraksi menggunakan air (Silveira et al. 2007)
Spirulina platensis kering digerus dan ditambah akuades,
masing-masing 1 mL untuk 0.04 g berat kering sampel. Sampel dihomogenkan menggunakan vortex, kemudian larutan disimpan pada
suhu 4 oC selama 24 jam, kemudian suspensi disentrifugasi dengan
kecepatan 12000 rpm selama 15 menit. Supernatan hasil sentrifugasi merupakan biopigmen fikosianin
c) Ekstraksi menggunakan amonium sulfat dan aseton (Pankaj et al.2010)
Serbuk S. platensis diektraksi menggunakan 20 mL aseton 80%
diinkubasi selama 24 jam dengan suhu 4 oC, kemudian suspensi
disentrifugasi dengan kecepatan 5000 rpm selama 10 menit, pelet hasil sentrifugasi ditambahkan 20 mL air diinkubasi pada suhu 50 oC selama
30 menit, suspensi disentrifugasi kembali dengan kecepatan 5000 g selama 10 menit untuk mendapatkan supernatan yang mengandung
phycobiliproteins. Supernatan dipurifikasi dengan cara phycobiliprotein
kasar dipresipitasi menggunakan (NH4)2SO4, dan disentrifugasi dengan
kondisi yang sama. Pelet hasil sentrifugasi dilarutkan kedalam 50 mM tris bufer pH 7.5 dan diinkubasi 24 jam pada suhu 4 oC. Suspensi
disentrifugasi dengan kecepatan 12000 rpm, 4 oC selama 15 menit.
Supernatan merupakan fikosianin yang akan digunakan pada pengujian selanjutnya.
Pemilihan perlakuan terbaik dari tiga jenis pelarut (air, amonium
sulfat+aseton, dan bufer fosfat) dengan parameter konsentrasi C-fikosianin, rendemen dan total protein fikosianin. Fikosianin yang
dalam analisis aktivitas inhibisi P. falciparum. Alur penelitian tahap
ekstraksi senyawa aktif dan ekstraksi fikosianin dapat dilihat pada Gambar 2.
Gambar 2 Diagram alir tahap ekstraksi senyawa aktif dan fikosianin.
Fraksinasi dan Isolasi Senyawa Aktif S. platensis
Fraksinasi senyawa aktif S. platensis (Gritter et al. 1991)
Fraksinasi atau pemisahan senyawa aktif dari ekstrak kasar S. platensis
dilakukan dengan teknik mencari rasio eluen terbaik menggunakan kromatografi lapis tipis dan diamati pada sinar UV 254 dan 366. Rasio eluen yang digunakan pada fraksinasi ekstrak S. platensis yaitu: A) diklorometana, B) diklorometana:
metanol (4:1), C) diklorometana: n-heksana (3:2), D) diklorometana: kloroform
(1:1), E) metanol: diklorometana: n-heksana (1:3:1), F) diklorometana: kloroform: n-heksana (3:2:1).
Fraksinasi ekstrak S. platensis dilakukan dengan cara lempeng lapis tipis
silika gel G 60 F254 dengan ukuran panjang 10 cm dan lebar 1 cm diberi tanda
garis dengan pensil pada jarak 1 cm dari salah satu ujung lempeng. Ekstrak aktif dilarutkan dalam pelarut asalnya. Eluen yang digunakan dimasukkan ke dalam tabung kemudian ditutup rapat agar jenuh. Larutan ekstrak sampel diteteskan dengan pipa kapiler pada lempeng silika gel. Ujung lempeng yang terdekat pada tempat penetesan dicelupkan ke dalam tabung kromatografi yang sudah jenuh dengan eluen.
Tabung ditutup rapat dan didiamkan hingga pelarut naik sampai batas yang ditentukan yaitu 1 cm dari batas atas. Setelah elusi pada batas tertentu, lempeng diangkat selanjutnya dikeringkan pada suhu ruang selama beberapa menit, kemudian dideteksipada sinar UV dengan panjang gelombang 254 nm dan
Serbuk S. platensis
Ekstraksi fikosianin Ekstraksi S. platensis:
etanol 96% (1:10) , maserasi selama 3x 24 jam
Evaporasi (senyawa aktif)
Ekstrak S. platensis
Bufer fosfat Air
Filtrasi
Amonium sulfat+ aseton
Analisis: - konsentrasi C-phycocyanin, - rendemen fikosianin, - total protein
366 nm dan dihitung nilai Rf nya. Nilai Rf masing-masing spot yang dihasilkan
dihitung menggunakan rumus
Rf = jarak titik pusat bercak dari titik awal
jarak garis depan dari titik awal
Pemilihan fraksi yang akan dianalisis aktivitas inhibisi P. falciparum yaitu
fraksi alkaloid berdasarkan nilai Rf pada uji KLT yang disemprot atau
divisualisasi menggunakan pereaksi warna FeCl3, anesaldehida-sulfat, amonia,
Dragendorff.
Isolasi senyawa aktif S. platensis (Gritter et al. 1991)
Isolasi senyawa aktif pada ekstrak S. platensis dilakukan menggunakan
kromatografi lapis tipis preparatif (KLTP) dengan pelat kaca berukuran 20 x 20 cm2 dengan fase diam silika gel PF
254 yang telah diaktifkan dengan cara
pemanasan pelat kaca selama satu jam pada suhu 110 oC. Ekstrak aktif 20 mg
ditotolkan sepanjang garis pita pada pelat kaca dan dielusi dengan perbandingan eluen terpilih dari hasil KLT, kemudian pelat kaca dikeringkan dan diamati menggunakan sinar UV dengan panjang gelombang 254 nm dan 366 nm berdasarkan nilai Rf nya. Pengambilan senyawa hasil KLTP dilakukan dengan
cara dikerik dan hasilnya dilarutkan dengan pelarut awal ekstrak yaitu etanol, kemudian dikeringkan menggunakan Vacuum dryer.
Prosedur Analisis
Prosedur analisis pada penelitian ini terdiri atas 4 tahapan yaitu (1) analisis fikosianin, (2) analisis komponen aktif S. platensis, (3) analisis aktivitas inhibisi
kapsul Spirulina komersial, ekstrak kasar, fikosianin, dan fraksi dari S. platensis
dalam menghambat pertumbuhan P. falciparum 3D7 (4) analisis morfologi parasit P. falciparum menggunakan mikroskop cahaya dan Transmission Electron Microscope (TEM).
Analisis Fikosianin
Analisis fikosianin yang dilakukan yaitu analisis konsentrasi C-phycocyanin
(C-PC) dan rendemen fikosianin yang mengacu pada Bennet dan Bogoard (1973) serta analisis total protein yang mengacu pada Lowry et al. (1951).
C-phycocyanin (C-PC) dan rendemen fikosianin
C-PC = (OD 615) − 0,474 (OD 652)
5,34 Rendemen = PC x V
DB
Keterangan:
C-PC = Konsentrasi C- fikosianin (mg/mL) V = Volume pelarut (mL)
DB = Biomassa kering (gram)
Total protein fikosianin (Lowry et al. 1951)
Analisis total protein mengacu pada metode Lowry et al. (1951). Larutan
yang diperlukan dalam analisis total potein adalah larutan standar, Cu-alkalin, dan Folin-Ciocalteu-fenol. Larutan standar yang digunakan adalah bovin serum albumin (BSA).
Prosedur pembuatan larutan standar adalah sebagai berikut:
1 Bovin serum albumin (BSA) sebagai standar protein yang digunakan, ditimbang sebanyak 50 mg,
2 Bovin serum albumin (BSA) tersebut dilarutkan menggunakan 100 mL akuades dalam botol reagen dan disimpan pada suhu 0 °C. Catatan: larutan standar harus diperbaharui setiap bulan.
Prosedur pembuatan larutan Cu-alkalin adalah sebagai berikut:
1 Persiapkan larutan NaOH 4%, larutan Na2CO3 20%, larutan Na-K-tartrat 20%, dan larutan CuSO4.5H2O 5%. Larutan ini dapat digunakan dalam kurun waktu 1 bulan,
2 Larutan Cu-alkalin dibuat dengan mencampurkan 20 mL larutan NaOH 4% ditambah 10 mL larutan Na2CO3 20% ditambah akuades hingga volume tepat 100 mL ditambah 1 mL larutan Na-K-tartrat 20% dan 1 mL larutan CuSO4.5H2O 5%. Larutan Cu-alkalin harus dibuat baru setiap kali akan dianalisis.
Penentuan total protein diawali dengan menimbang 4 mg sampel kering pada masing-masing umur panen lalu dilarutkan dalam 20 mL akuades (200 ppm) kemudian 2 mL larutan dimasukkan ke dalam tabung dan ditambahkan larutan Cu-alkali volume 5 mL ke dalam setiap sampel dan standar (0, 5, 10, 20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 300, 400, 500 ppm). Sampel dan standar didiamkan selama 1 jam pada suhu ruang kemudian ditambahkan 2 kali 0.3 mL
Folin-Ciocalteu-fenol. Sampel didiamkan selama 15 menit pada suhu ruang
Analisis Komponen Aktif
Analisis komponen aktif kapsul Spirulina komersial, ekstrak kasar dan
fikosianin dari S. platensis mengacu pada Harborne (1996) yang meliputi analisis
senyawa alkaloid, steroid, saponin, flavonoid, dan fenol hidrokuinon. Senyawa Alkaloid
Uji alkaloid dilakukan dengan cara 1 mg sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Dragendorff, Meyer dan Wagner. Hasil uji dinyatakan positif bila dengan
pereaksi Meyer terbentuk endapan putih kekuningan, dengan pereaksi Wagner
membentuk endapan coklat dan dengan pereaksi Dragendorff membentuk
endapan merah sampai jingga. Senyawa Steroid
Uji steroid dilakukan dengan cara 1 mg sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi. Anhidrida asetat sebanyak 10 tetes dan asam sulfat pekat sebanyak 3 tetes ditambahkan ke dalam campuran tersebut. Hasil uji positif contoh mengandung steroid yaitu terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
Senyawa Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan contoh mengandung saponin.
Flavonoid
Uji flavonoid dilakukan dengan cara 1 mg sampel ditambah serbuk magnesium 0.1 mg dan 0.4 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume sama) dan 4 mL alkohol, kemudian campuran dikocok. Hasil uji positif contoh mengandung flavonoid, yaitu terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
Fenol hidrokuinon
Uji fenol hidrokuinon dilakukan dengan cara 1 mg sampel diekstrak dengan 20 mL etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%. Hasil uji positif contoh
mengandung senyawa fenol, yaitu terbentukya larutan berwarna hijau atau hijau biru.
Analisis Aktivitas Inhibisi P. falciparum
Pengujian aktivitas inhibisi P. falciparum dilakukan terhadap kapsul Spirulina komersial, ekstrak kasar, fikosianin terpilih, dan fraksi dari S. platensis
mengacu pada Jansen (2000). Analisis aktivitas inhibisi P. falciparum terdiri atas
tiga tahap yaitu persiapan media dan sel darah merah, kultur parasit, penetapan konsentrasi bahan uji dan tahap analisis inhibisi P. falciparum secara in-vitro.
Penyiapan media dan sel darah merah
Penyiapan medium Roswell Park Memorial Institute (RPMI)
Medium yang digunakan untuk pemeliharaan parasit P. falciparum galur 3D7
RPMI 1640; 5.96 gram HEPES; 2.1 g natrium bikarbonat; 0.05 g hipoksantin dan 0.5 mL gentamisin ke dalam double destillated H2O (ddH2O). Total volume
larutan ditera hingga 1000 mL. Larutan dihomogenkan menggunakan magnetic stirrer selama ± 3 jam. Larutan RPMI yang telah homogen disaring menggunakan
penyaring dengan diameter 0.ββ μm, kemudian dimasukkan ke dalam wadah steril berukuran masing-masing 250 mL dan disimpan ke dalam lemari es bersuhu 4 oC.
Penyiapan serum darah
Serum darah dibutuhkan dalam pembuatan medium lengkap (complete medium) untuk pemeliharaan kultur parasit. Serum darah manusia
bergolongan AB diperoleh dari Palang Merah Indonesia (PMI). Serum disimpan pada suhu -20 oC.
Penyiapan medium lengkap (complete medium)
Medium lengkap (complete medium) adalah medium yang digunakan untuk
pemeliharaan biakan P. falciparum 3D7. Medium ini dibuat dengan
menambahkan 10 mL serum AB ke dalam 40 mL medium RPMI sehingga diperoleh 50 mL Complate Medium (CM) dengan konsentrasi 20%.
Penyiapan sel darah merah (Red Blood Cell)
Sel darah merah yang digunakan untuk kultur parasit adalah sel darah merah bergolongan A yang diperoleh dari tubuh peneliti. Darah dikumpulkan di dalam tabung kemudian disentrifugasi selama 5 menit pada kecepatan 1500 rpm. Supernatan dibuang kemudian pelet yang tersisa ditambahkan dengan Roswell Park Memorial Institute (RPMI) dengan perbandingan 2:1, kemudian
disentrifugasi selama 5 menit dengan kecepatan 1200 rpm. Pencucian dengan RPMI ini dilakukan sebanyak 2 kali. Supernatan hasil pencucian kedua dibuang, lalu pelet yang tersisa disimpan di dalam lemari pendingin untuk selanjutkan digunakan pada tahap kultivasi parasit.Darah yang sudah dicuci dapat digunakan selama satu bulan.
Penyiapan kultur parasit
Kultur parasit P. falciparum 3D7berasal dari University of Tokyo, Jepang
yang dipropagasi secara teratur di Lembaga Biologi Molekuler Eijkman. Pada penelitian ini sel parasit P. falciparum 3D7 diperbanyak dengan metode in vitro.
Persiapan sel P. falciparum dilakukan melalui proses thawing dan pemeliharaan
sel P. falciparum 3D7. Thawing P. falciparum dilakukan dengan metode NaCl. P. falciparum yang disimpan dalam nitrogen cair suhu -196 oC dikeluarkan dan
disimpan pada suhu ruang selama 1-2 menit, kemudian kultur dipindahkan ke tabung falcon steril 15 mL dan ditambahkan 3.5% NaCl sebanyak 5 mL secara perlahan selama 5-10 menit sambil digoyang. Campuran tersebut dibiarkan selama 5 menit kemudian disentrifugasi pada kecepatan 1500 rpm selama 5 menit pada suhu 37 oC. Supernatan yang terbentuk dibuang dan pelet yang tersisa dicuci
dengan medium RPMI perbandingan 1: 9 v/v kemudian disentrifugasi pada 1500 rpm selama 5 menit pada suhu 37 oC, kemudian dicuci dengan medium
Roswell Park Memorial Institute (RPMI) dilakukan sebanyak dua kali
pengulangan, setelah itu pelet yang tersisa ditambahkan Complete Medium (CM)
Flask yang telah berisi parasit dan CM diinkubasi di dalam candle jar
yang telah dikondisikan pada suhu 37 oC, selanjutnya dilakukan pemeliharaan
kultur parasit hingga memperoleh persen parasitemia yang sesuai untuk pengujian IC50. Kadar parasitemia yang digunakan biasanya berkisar antara 1-2%.
Pemeliharaan kultur dilakukan dengan cara mengganti medium pada flask setiap
harinya dengan CM 10%. Persen parasitemia pada pertumbuhan parasit dapat diketahui dengan membuat apusan darah tipis dan pewarnaan giemsa selama 30 menit kemudian jumlah parasitemia dihitung di bawah mikroskop cahaya.
Penetapan konsentrasi sampel
Kontrol positif yang digunakan pada penelitian ini adalah artemisinin sedangkan bahan uji yang digunakan pada analisis aktivitas inhibisi P. falciparum
yaitu kapsul Spirulina komersial, ekstrak kasar, fikosianin, dan fraksi 08 dari Spirulina yang dikultur menggunakan media Walne.
Penyiapan bahan uji dilakukan dengan pembuatan stok sampel yaitu kapsul Spirulina komerisal, ekstrak kasar, fikosianin, dan fraksi ditimbang 100
mg dilarutkan kedalam 1 mL RPMI (konsentrasi stok 105 μg/mL), sedangkan
konsentrasi stok artemisinin 10-1 M. Konsentrasi yang digunakan dalam pengujian
IC50 pada sampel uji yaitu blanko, 0.01 μg/mL, 0.1 μg/mL, 1 μg/mL, 10 μg/mL,
100 μg/mL, 1000 μg/mL, dan 10 000 μg/mL, sedangkan konsentrasi artemisinin yang digunakan sebagai kontrol positif yaitu blanko, 10-3, 10-4, 10-5, 10-6, 10-7, 10 -8,10-9, 10-10 M. Pengenceran dilakukan secara bertingkat di dalam multiplate
hingga diperoleh konsentrasi yang sesuai.
Analisis aktivitas inhibisi P. falciparum secara in-vitro
Pengujian aktivitas inibisi P. falciparum secara in-vitro dilakukan dengan
penentuan nilai IC50 pada beberapa sampel uji yaitu kapsul Spirulina komersial,
ekstrak kasar, fikosianin, dan fraksi 08 dari S. platensis yang dikultur
menggunakan media Walne. Pengujian ini dilakukan dengan cara kultur sel parasit P. falciparum dipelihara sampai diperoleh kepadatan 1-2% parasitemia.
Kultur sel parasit yang sudah siap dibagi ke dalam 16 (8x2) sumur cawan uji per- sampel dengan volume yang sama yaitu 180 μL kultur sel parasit, sumur pertama berlaku sebagai kontrol negatif, selanjutnya pada sumur ke-8 ditambahkan β0 μL sampel dan dihomegenkan dengan konsentrasi awal 10 000 μg/mL, kemudian dilakukan pengenceran bertingkat dengan cara 20 μL suspensi diambil dari sumur ke-8 dan ditambahkan ke sumur ke-7 sebagai konsentasi 1000 μg/mL, setelah itu
β0 μL suspensi diambil dari sumur ke-6 dan ditambahkan pada sumur ke-5,
selanjutnya dilakukan hal yang sama hingga sumur ke-2 dengan konsentrasi 0.01 μg/mL. Sumur terakhir diambil β0 μL dan dibuang kedalam botol waste.
Metode pengenceran bertingkat ini dilakukan pula pada pengujian artemisinin sebagai kontrol positif. Kultur sel diinkubasi dengan suhu 37 oC
selama 48 jam. Jumlah parasitemia diamati dengan membuat apusan darah tipis yang diberi pewarna giemsa dan dihitung dibawah mikroskop dengan nilai minimum perhitungan 1000 eritrosit. Skema pengenceran bertingkat pada pengujian aktivitas inhibisi P. falciparum secara in-vitro dapat dilihat pada
Gambar 3 Skema pengenceran bertingkat pada multiplate 48 well
Hasil yang diperoleh dari pengujian aktivitas inhibisi P. falciparum
tersebut kemudian dianalisis menggunakan kurva linier antara konsentrasi sampel dan artemisinin terhadap laju pertumbuhan P. falciparum sehingga didapatkan
nilai IC50 nya, selanjutnya dilakukan penentuan sampel yang paling potensial
dalam menghambat pertumbuhan P. falciaparum dengan parameter nilai
IC50 < 10 µg/mL mengacu pada Ramazani et al. (2010) dan kemudian diamati
mekanisme kerja sampel tersebut terhadap pembentukan hemozoin P. falciparum
menggunakan Transmission Electron Microscope (TEM). Diagram alir analisis
aktivitas inhibisi P. falciparum secara in-vitro dapat dilihat pada Gambar 4.
Persentase laju pertumbuhan parasit dapat dilihat sebagai berikut: Parasit (%) = (P/ RBC) x 100%
Penghambatan (%) = 100 % -[(Nt/Nc) x 100 %] Keterangan :
P = Jumlah parasit
RBC = Jumlah sel darah (minimum 1000 eritrosit)
Nt = Jumlah hidup P. falciparum pada sumur pengujian
Nc = Jumlah hidup P. falciparum pada sumur kontrol
Analisis Morfologi Parasit P. falciparum
Penyiapan media dan sel darah merah
Pengamatan mikroskop (apusan tipis) (1-2% parasitemia)
Penyiapan 180 µL parasit kedalam multiplate 48 well
Penambahan 20 µL bahan uji (Sampel) kedalam multiplate 48 well
Inkubasi (37 oC, 48 jam)
Analisis Morfologi Parasit P. falciparum
Morfologi parasit P. falciparum diamati menggunakan mikroskop cahaya
dan Transmission Electron Microscope (TEM) yang mengacu pada
Johannessen (2001). Analisis ini bertujuan untuk mengetahui mekanisme kerja
S. platensis dalam menghambat pertumbuhan P. falciparum. Analisis morfologi
parasit P. falciparum terdiri atas enam tahapan yaitu persiapan sampel, tahap
fiksasi, tahap dehidrasi, infiltrasi, embedding, dan pewarnaan.
Penyiapan sampel uji TEM
Kultur sel parasit diberi perlakuan kapsul Spirulina yang terpilih pada
pengujian aktivitas antimalaria dengan konsentrasi IC50 sebesar 2.61 μg/mL dan
diinkubasi selama 24 jam menggunakan multiplate 12 well. Kultur yang telah
diinkubasi dipindahkan ke tabung falcon berukuran 15 mL kemudian kultur disentrifugasi, supernatan dibuang dan pelet dicuci dengan 500 μL bufer
cacodylate sebanyak tiga kali. Pelet ditambahkan 800 μL Glut 2.5% kemudian
sampel tersebut disimpan pada suhu 4 oC sebelum diamati pada TEM.
Penyiapan sample block untuk TEM Tahap fiksasi
Sampel dilarutkan ke dalam larutan glutaraldehid 2.5% (0.1 M bufer cacodylate + 3% sukrosa) dihomogenkan selama kurang lebih 48 jam pada suhu 4 oC. Sampel dicuci dengan bufer cacodylate 0.1 M + 3% sukrosa dihomogenkan
selama 15 menit, pada suhu 4 oC sebanyak 3 kali. Pelet yang diperoleh
ditambahkan dengan larutan yang mengandung 2% osmium tetroxide 2.5% K3Fe(CN)6 di dalam bufer, kemudian dihomogenkan selama 2 jam pada suhu
4 oC. Setelah diinkubasi, sampel kembali dicuci sebanyak 3 kali dengan bufer
cacodylate 0.1 M dan 3% sukrosa kemudian dihomogenkanselama 15 menit pada suhu 4 oC.
Tahap dehidrasi
Pelet yang diperoleh dari setiap sampel dilarutkan ke dalam etanol konsentrasi bertingkat berturut-turut 10%, 30%, 50%, 70%, 95%, dan etanol absolut. Pelet pertama-tama ditambahkan etanol 10%, kemudian dihomogenkan selama 5 menit pada 4 oC dan disentrifugasi. Hal yang sama dilakukan pada
penambahan etanol 30%, Pelet selanjutnya ditambahkan dengan etanol 50%, dihomogenkan pada suhu 4 oC dan diikubasi selama semalam, kemudian sampel
disentrifugasi dan pelet yang terbentuk ditambahkan etanol 70% dan diinkubasi selama 10 menit, kemudian ditambahkan etanol 95% dan diinkubasi selama 20 menit, selanjutnya ditambahkan etanol absolut sebanyak 2 kali ulangan dan diinkubasi selama 20 menit.
Tahap infiltrasi
Pelet ditambahkan dengan pure propylene oxide kemudian diinkubasi pada
Tahap embedding
Pelet ditambahkan dengan propylene oxide: spurr’s resin (1:1) diinkubasi
pada suhu ruang selama 30 menit dan disentrifugasi, kemudian setengah dari jumlah supernatan yang terbentuk dibuang, selanjutnya pelet diinkubasi selama 30 menit pada suhu ruang dan disentrifugasi kembali. Supernatan dibuang, kemudian pelet ditambahkan dengan pure spurr’s resin selanjutnya diinkubasi dalam vakum selama semalam. Sampel dipindahkan kedalam block tube (tabung eppendolf baru), kemudian pure spurr’s resin dimasukkan ke dalam sampel dan
divakum dengan suhu 70 oC selama satu malam.
Tahap pewarnaan
Pewarnaan sel parasit menggunakan jenis pewarnaan negative staining.
Pewarna menempel di area sekitar spesimen, sehingga ketika terpapar electron beam spesimen tampak lebih terang, meskipun infrastruktur halus kadang terlihat
akibat kemampuan larutan logam berat untuk menembus ke dalam sel. Pewarnaan negatif digunakan untuk keperluan pengamatan partikel subseluler misalnya ribosom, dinding sel, virus, dan makromolekul, misal makromolekul protein. Pewarnaan menggunakan garam uranium. Garam uranium dapat terurai menjadi ion uranil (menggunakan larutan uranil asetat) Pada pH di bawah 4.5 yang secara langsung dapat menembus ke permukaan material dan dapat mewarnai bagian-bagian yang lebih halus, sehingga meningkatkan detail gambar hasil TEM.
Analisis Data
Rancangan percobaan yang digunakan pada analisis data yaitu Rancangan Acak Lengkap (RAL) yang mengacu pada Walpole (1995). Evaluasi data ekstraksi fikosianin melibatkan perbedaan jenis pelarut sebagai perlakuan, sedangkan aktivitas inhibisi P. falciparum dianalisis menggunakan regresi linier.
Data yang diperoleh diuji normalitas dan homogenitasnya sebelum dilakukan analisis ANOVA. Analisis data dilakukan dengan Analysis of Variant (ANOVA)
pada selang kepercayaan 95% (α = 0.05). Perlakuan yang berpengaruh terhadap
respon, selanjutnya diuji lanjut Duncan. Model RAL dengan percobaan dua faktor
adalah sebagai berikut:
Yij = μ + αi + Ɛij
i: 1,2,3 dan j: 1,2,3
keterangan;
μ : rataan fikosianin
Yij : jumlah fikosiain dari perlakuan ke-i, ulangan ke-j
αi : pengaruh dari pelarut ke-I (1: bufer fosfat, 2: amonium sulfat+aseton, 3:air)
3 HASIL DAN PEMBAHASAN
Kultur Spirulina platensis
Spirulina platensis dikultivasi menggunakan media Walne di dalam toples
dan akuarium. Rendemen pada kultivasi S. platensis dapat dilihat pada Tabel 1.
Tabel 1 Rendemen S. platensis yang dikultivasi menggunakan
media Walne
Tempat Volume
(L) Bobot basah (g) Bobot kering (g) Rendemen (g/L)
Toples 2 4.46 0.44 0.22±0.05
Akuarium 40 50.61 5.77 0.14±0.22
Spirulina platensis yang dikultivasi di dalam toples menggunakan media
Walne memiliki rendemen biomassa yang lebih tinggi dibandingkan S. platensis
yang dikultivasi di dalam akuarium. Perbedaan rendemen disebabkan pengaruh bentuk wadah terhadap penetrasi cahaya. Evan dan Benjamin (1981) menyatakan bahwa cahaya yang masuk pada wadah berbentuk silinder bersifat konvergen atau menuju ke satu arah sedangkan penetrasi cahaya pada wadah dengan bentuk persegi panjang cenderung bersifat divergen atau menyebar ke segala arah. Hal ini menyebabkan S. platensis yang dikultur di dalam toples dapat meyerap cahaya
lebih optimal dibandingkan S. platensis yang dikultur di dalam akuarium. Cahaya
merupakan faktor penting dalam pertumbuhan S. platensis yang dibutuhkan pada
proses fotosintesis dan pertumbuhan sel untuk pembentukan metabolit primer dan sekunder. Hasil ini didukung oleh Hu dan Richmond (1996) yang menyatakan
bahwa biomassa Spirulina maxima yang dikultur di dalam roux bottle kapasitas 1
L dengan intensitas cahaya 65.30 J/m2/dtk menghasilkan biomassa kering 350
mg/L, sedangkan S. maxima yang dikultur pada flat-plate photobioreactor
menghasilkan 329 mg/L biomassa kering.
Fikosianin Konsentrasi C-phycocyanin
Fikosianin merupakan protein yang terkandung dalam mikroalga hijau-biru seperti halnya S. platensis. Struktur kimia fikosianin dapat dilihat pada
Gambar 5. Konsentrasi fikosianin pada S. platensis yang diekstraksi
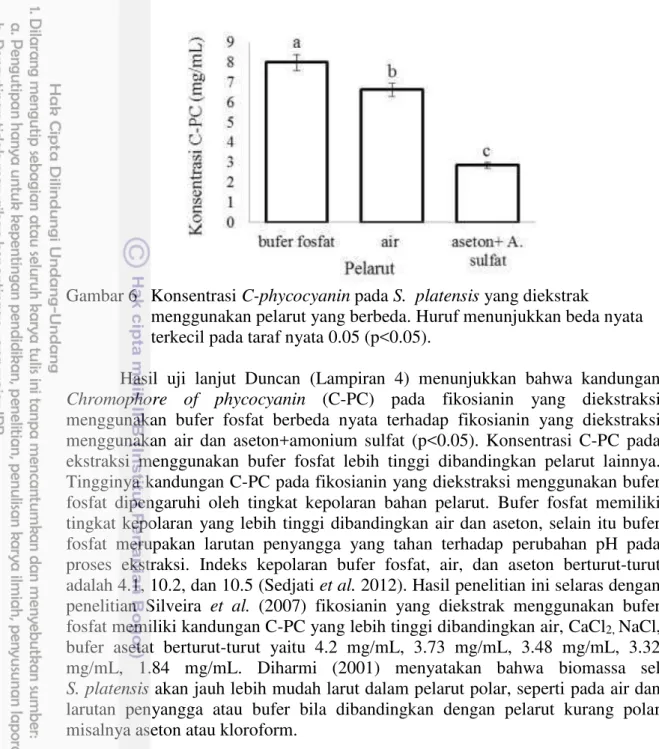
menggunakan tiga jenis pelarut yang berbeda bufer fosfat, air, aseton+amonium sulfat dapat dilihat pada Gambar 6.
Gambar 5 Struktur kimia biopigmen fikosianin
Gambar 6 Konsentrasi C-phycocyanin pada S. platensis yang diekstrak
menggunakan pelarut yang berbeda. Huruf menunjukkan beda nyata terkecil pada taraf nyata 0.05 (p<0.05).
Hasil uji lanjut Duncan (Lampiran 4) menunjukkan bahwa kandungan
Chromophore of phycocyanin (C-PC) pada fikosianin yang diekstraksi
menggunakan bufer fosfat berbeda nyata terhadap fikosianin yang diekstraksi menggunakan air dan aseton+amonium sulfat (p<0.05). Konsentrasi C-PC pada ekstraksi menggunakan bufer fosfat lebih tinggi dibandingkan pelarut lainnya. Tingginya kandungan C-PC pada fikosianin yang diekstraksi menggunakan bufer fosfat dipengaruhi oleh tingkat kepolaran bahan pelarut. Bufer fosfat memiliki tingkat kepolaran yang lebih tinggi dibandingkan air dan aseton, selain itu bufer fosfat merupakan larutan penyangga yang tahan terhadap perubahan pH pada proses ekstraksi. Indeks kepolaran bufer fosfat, air, dan aseton berturut-turut adalah 4.1, 10.2, dan 10.5 (Sedjati et al. 2012). Hasil penelitian ini selaras dengan
penelitian Silveira et al. (2007) fikosianin yang diekstrak menggunakan bufer
fosfat memiliki kandungan C-PC yang lebih tinggi dibandingkan air, CaCl2, NaCl,
bufer asetat berturut-turut yaitu 4.2 mg/mL, 3.73 mg/mL, 3.48 mg/mL, 3.32
mg/mL, 1.84 mg/mL. Diharmi (2001) menyatakan bahwa biomassa sel
S. platensis akan jauh lebih mudah larut dalam pelarut polar, seperti pada air dan
larutan penyangga atau bufer bila dibandingkan dengan pelarut kurang polar misalnya aseton atau kloroform.
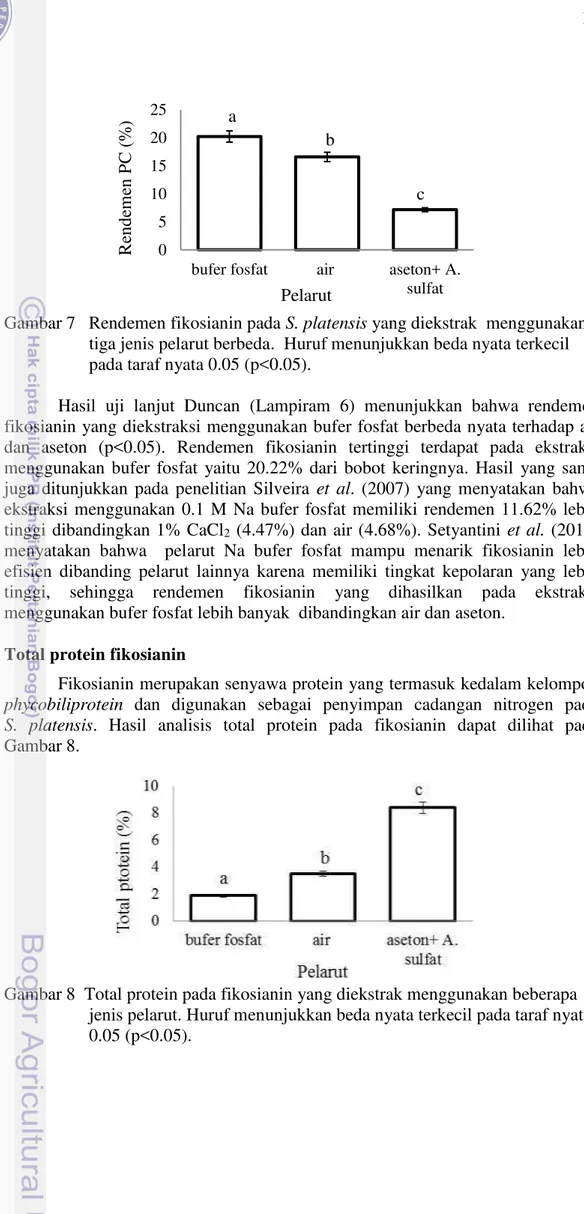
Rendemen fikosianin
Rendemen fikosianin diperoleh berdasarkan perbandingan dari bobot serbuk fikosianin dengan bobot biomassa kering S. platensis (b/b). Rendemen
fikosianinpada S. platensis yang diekstraksi menggunakan tiga jenis pelarut yang
a
b
c
0 5 10 15 20 25
bufer fosfat air aseton+ A. sulfat
R
endem
en
P
C
(%)
Pelarut
Gambar 7 Rendemen fikosianin pada S. platensis yang diekstrak menggunakan
tiga jenis pelarut berbeda. Huruf menunjukkan beda nyata terkecil pada taraf nyata 0.05 (p<0.05).
Hasil uji lanjut Duncan (Lampiram 6) menunjukkan bahwa rendemen fikosianin yang diekstraksi menggunakan bufer fosfat berbeda nyata terhadap air dan aseton (p<0.05). Rendemen fikosianin tertinggi terdapat pada ekstraksi menggunakan bufer fosfat yaitu 20.22% dari bobot keringnya. Hasil yang sama juga ditunjukkan pada penelitian Silveira et al. (2007) yang menyatakan bahwa
ekstraksi menggunakan 0.1 M Na bufer fosfat memiliki rendemen 11.62% lebih tinggi dibandingkan 1% CaCl2 (4.47%) dan air (4.68%). Setyantini et al. (2014)
menyatakan bahwa pelarut Na bufer fosfat mampu menarik fikosianin lebih efisien dibanding pelarut lainnya karena memiliki tingkat kepolaran yang lebih tinggi, sehingga rendemen fikosianin yang dihasilkan pada ekstraksi menggunakan bufer fosfat lebih banyak dibandingkan air dan aseton.
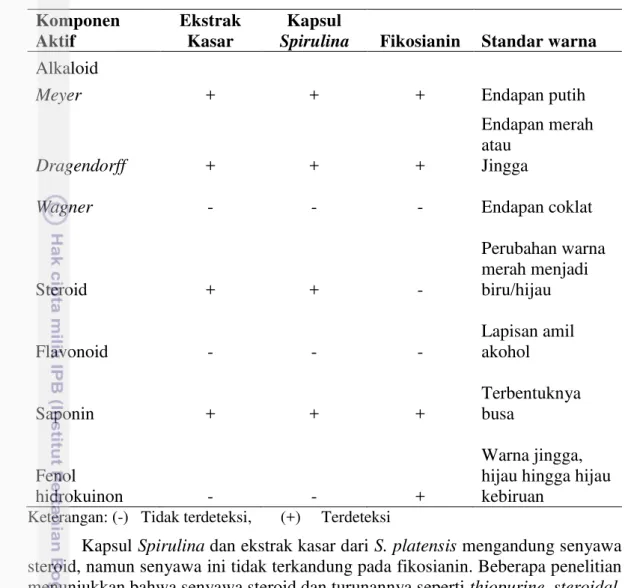
Total protein fikosianin
Fikosianin merupakan senyawa protein yang termasuk kedalam kelompok
phycobiliprotein dan digunakan sebagai penyimpan cadangan nitrogen pada S. platensis. Hasil analisis total protein pada fikosianin dapat dilihat pada
Gambar 8.
Hasil uji Duncan (Lampiran 8) menunjukkan bahwa kandungan protein pada fikosianin yang diekstraksi menggunakan bufer fosfat berbeda nyata terhadap air dan aseton (p<0.05). Kandungan protein terendah terdapat pada ekstraksi fikosianin menggunakan bufer fosfat yaitu 1.88%. Hal ini menunjukkan tingkat kemurnian fikosianin yang diekstraksi menggunakan bufer fosfat lebih tinggi dibandingkan dengan air dan aseton+amonium sulfat. Bufer fosfat merupakan larutan penyangga yang dapat mempertahankan pH dan menjaga kestabilan protein.
Tingginya kandungan protein pada fikosianin yang diekstrak menggunakan aseton + amonium sulfat diduga berkaitan dengan masih adanya komponen zat pengotor yang terdapat pada fikosianin. Hal ini diperkuat oleh Pankaj et al. (2010) yang menyatakan bahwa amonium sulfat dapat
terdekomposisi menjadi ammonia, nitrogen, sulfur dioksida dan air pada suhu tinggi sehingga protein yang terukur bukan hanya fikosianin namun juga hasil dekomposisi dari amonium sulfat.
Hasil analisis pada parameter konsentrasi C-PC, rendemen fikosianin, dan total protein fikosianin menunjukkan bahwa pelarut terbaik dalam ekstraksi fikosianin adalah bufer fosfat dengan konsentrasi C-PC, rendemen fikosianin, dan total protein fikosianin berturut-turut yaitu 8 mg/mL, 20.22 mg/g, dan 1.88%.
Senyawa Aktif Spirulina platensis
Identifikasi senyawa aktif pada kapsul Spirulina, ekstrak kasar dan
fikosianin dari S. platensis dilakukan dengan cara uji fitokimia. Menurut
Ramesha dan Srivinas (2014) analisis fitokimia bertujuan untuk mengetahui adanya senyawa kimia yang bertindak sebagai sumber bahan alami untuk pembuatan obat-obatan dalam bidang farmasi maupun ilmu kesehatan. Pengujian fitokimia yang dilakukan pada kapsul Spirulina, ekstrak kasar, dan fikosianin dari S. platensis meliputi komponen alkaloid, flavonoid, steroid, titerpenoid, dan fenol
hidrokuinon.
Hasil penelitian menunjukkan bahwa kapsul Spirulina, ekstrak kasar, dan
fikosianin mengandung senyawa alkaloid yang positif pada pereaksi Meyer dan Dragendorff (Tabel 2). Alkaloid pada organisme memiliki potensi sebagai
antibakteri, antikanker (Paragathi et al. 2013), antihiperglikemik (Rahman 2011),
hepatoprotektor dan inhibitor HIV (Njamnong et al. 2009). Beberapa peneliti juga
menyatakan bahwa alkaloid dan turunannya dapat berfungsi sebagai antimalaria hal ini didukung oleh Zahari et al. (2014) yang menunjukkan bahwa isoquinoline
alkaloid yang berasal dari tanaman Dehaasia longipediqulata dapat menghambat
pertumbuhan Plasmodium dengan nilai IC50 antara 0.031 hingga 30.4 µM.
Julianti et al. (2014) juga melaporkan bahwa alkaloid carpaine dari daun pepaya
dapat menghambat pertumbuhan P. falciparum dengan konsentrasi IC50 20-5000
ng/mL. Berdasarkan hal tersebut diduga bahwa alkaloid yang berasal dari S. platensis dan turunannya juga dapat menghambat pertumbuhan P. falciparum dan
Tabel 2 Komponen aktif S. platensis
Kapsul Spirulina dan ekstrak kasar dari S. platensis mengandung senyawa
steroid, namun senyawa ini tidak terkandung pada fikosianin. Beberapa penelitian menunjukkan bahwa senyawa steroid dan turunannya seperti thiopurine, steroidal, triazole dapat menghambat pertumbuhan Plasmodium dan direkomendasikan
sebagai obat antimalaria (Reksten et al. 2011; Corrales et al. 2011). Steroid
merupakan produk metabolit sekunder yang dihasilkan dari proses glikolisis yang diubah menjadi Malonyl CoA dan isoprene (Khanam 2007). Senyawa ini berfungsi sebagai immunomodulator, meningkatkan kekebalan tubuh dan stamina, menurunkan kolesterol darah dan mendorong aktivitas antidiabetes (Matsumoto et al. 2002).
Seluruh sampel uji mengandung senyawa saponin. Saponin merupakan komponen lipida polar yang bersifat ampifilik (memiliki gugus hidrofilik dan hidrofobik). Saponin dideteksi berdasarkan kemampuannya dalam membentuk busa atau menghemolisis darah. Senyawa ini memiliki aktivitas sebagai antimikroba, merangsang sistem imun dan mengatur tekanan darah (Muchtadi et al. 2006).
Spirulina platensis dan turunannya tidak mengadung flavonoid. Hasil ini
berbeda dengan penelitian Sari (2011) yang menyatakan S. platensis mengandung
senyawa flavonoid 4.599 mg/g. Hasil yang sama juga ditunjukkan pada penelitian Abd El-Baky et al. (2009) yang menyatakan bahwa S. maxima mempunyai kadar
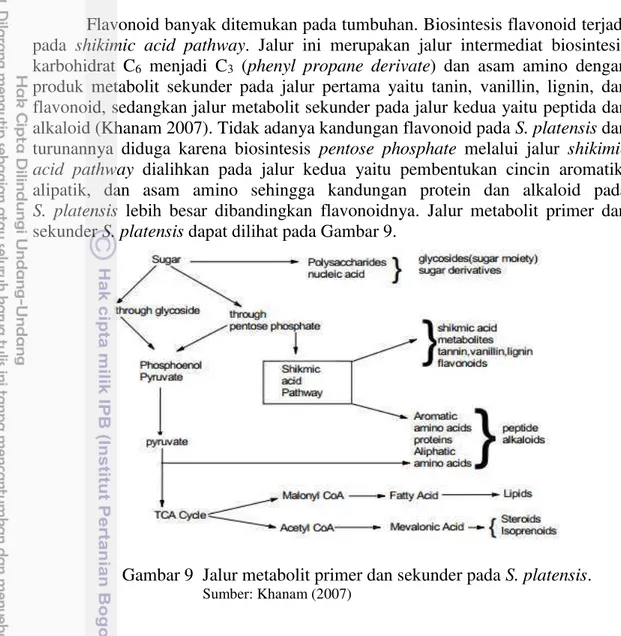
Flavonoid banyak ditemukan pada tumbuhan. Biosintesis flavonoid terjadi pada shikimic acid pathway. Jalur ini merupakan jalur intermediat biosintesis
karbohidrat C6 menjadi C3 (phenyl propane derivate) dan asam amino dengan
produk metabolit sekunder pada jalur pertama yaitu tanin, vanillin, lignin, dan flavonoid, sedangkan jalur metabolit sekunder pada jalur kedua yaitu peptida dan alkaloid (Khanam 2007). Tidak adanya kandungan flavonoid pada S. platensis dan
turunannya diduga karena biosintesis pentose phosphate melalui jalur shikimic acid pathway dialihkan pada jalur kedua yaitu pembentukan cincin aromatik,
alipatik, dan asam amino sehingga kandungan protein dan alkaloid pada S. platensis lebih besar dibandingkan flavonoidnya. Jalur metabolit primer dan
sekunder S. platensis dapat dilihat pada Gambar 9.
Gambar 9 Jalur metabolit primer dan sekunder pada S. platensis.
Sumber: Khanam (2007)
Fraksi Senyawa Aktif Spirulina platensis
Isolasi senyawa aktif S. platensis dilakukan dengan cara fraksinasi
menggunakan kromatografi lapis tipis (KLT). Kromatografi lapis tipis adalah metode pemisahan senyawa kimia secara kimia-fisika berdasarkan kecepatan migrasi atau rasio distribusi dari komponen campuran fase diam dan fase gerak (Hancu et al. 2011). Kromatografi lapis tipis merupakan metode yang relatif
sederhana, cepat dan umum digunakan untuk mengidentifikasi zat farmasi.
Penelitian ini menggunakan enam jenis rasio eluen sebagai fase gerak
yaitu: A) diklorometana: methanol (4:1), B) diklorometana: n-heksana (3:2), C) diklorometana: kloroform (1:1), D) diklorometana: kloroform (1:4), E) methanol: diklorometana: n-heksana (1:3:1), F) diklorometana: kloroform: n-heksana (3:2:1). Berdasarkan perbedaan jenis eluen yang digunakan diperoleh sejumlah fraksi yang ditandai adanya bercak dengan nilai retardation factor (Rf)