OPTIMASI ELEKTROPORASI DENGAN GEN
GREEN
FLUORESCENT PROTEIN
UNTUK TRANSPLANTASI SEL
TESTIKULAR IKAN NILA
EPRO BARADES
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Optimasi Elektroporasi dengan Gen Green Fluorescent Protein untuk Transplantasi Sel Testikular Ikan Nila” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
RINGKASAN
EPRO BARADES. Optimasi Elektroporasi dengan Gen Green Fluorescent Protein untuk Transplantasi Sel Testikular Ikan Nila. Dibimbing oleh ALIMUDDIN dan AGUS OMAN SUDRAJAT.
Teknologi transplantasi merupakan suatu teknologi yang dapat menghasilkan induk pengganti. Sel donor berupa sel germinal yang akan digunakan dalam transplantasi diberi label agar dapat dibedakan dengan sel resipien. Umumnya sel donor diperoleh dari ikan transgenik yang membawa marka atau diwarnai dengan PKH-26. Penelitian ini bertujuan untuk memperoleh metode alternatif dalam memberi label pada sel testikular dengan memanfaatkan elektroporasi untuk memasukkan gen green fluorescent protein (GFP).
Metode dalam penelitian ini meliputi persiapan resipien, persiapan sel donor dan transplantasi sel. Ikan resipien diperoleh dengan mengawinkan induk ikan nila dengan perbandingan jantan dan betina 1:1. Sel donor merupakan sel hasil disosiasi dari testikular ikan nila berumur 4 bulan. Sel donor tersebut dielektroporasi dengan kepadatan sel 104 sel.µL-1, konsentrasi pJfKer-GFP 50 ng.µL-1, dan waktu kejut 20
ms pada tegangan listrik sebesar 0, 100, 200, dan 300 volt dengan ulangan sebanyak tiga kali. Kemudian sel tersebut ditransplantasikan dengan cara menyuntikkan 0.5µL suspensi sel hasil elektroporasi yang membawa 5x103 sel ke dalam rongga intraperitoneal ikan nila resipien yang berumur 3 hari setelah menetas. Parameter yang diamati adalah kelangsungan hidup sel, persentase sel berpendar GFP, dan kolonisasi sel pada ikan resipien.
Hasil penelitian menunjukkan bahwa kelangsungan hidup sel antara kontrol (0 volt) dengan perlakuan kejut 100 dan 200 volt tidak signifikan (p>0,05). Kelangsungan hidup sel menurun secara signifikan pada perlakuan 300 volt (p<0,05). Hal tersebut menunjukkan bahwa tegangan listrik sangat berpengaruh terhadap kelangsungan hidup sel. Peningkatan tegangan listrik akan mengakibatkan semakin meningkatnya mortalitas pada sel. Persentase sel yang berpendar tidak berbeda pada perlakuan 100, 200, dan 300 volt (p>0,05) kecuali pada kontrol. Pada perlakuan kontrol tidak terlihat adanya pendaran GFP, hal tersebut membuktikan bahwa gen GFP tidak mampu melewati membran sel akibat kurang atau tidak adanya tegangan listrik yang diberikan. Sementara itu, persentase kolonisasi sel pada ikan hasil transplan setelah 50 hari pemeliharaan memberikan nilai tertinggi pada perlakuan 200 volt (66,67%). Kesimpulan yang diperoleh dari hasil penelitan adalah perlakuan elektroporasi dengan kejut listrik 100-200 volt dapat digunakan untuk memberi label pada sel testikular yang akan ditransplantasikan.
SUMMARY
EPRO BARADES. Optimization of Electroporation with Green Fluorescent Protein Gene for Testicular Cell Transplant in Nile Tilapia. Supervised by ALIMUDDIN and AGUS OMAN SUDRAJAT.
Transplantation technology can be applied to generate surrogate fish broodstock. Germinal cells as donor used in transplantation are labeled to distinguish with endogenous cells. Donor cells are generally derived from transgenic fish carrying a marker or cells labeled by PKH-26. This study was performed to obtain an alternative method of labeling cells by using electroporation.
The method in this study includes the preparation of the recipient, the donor cell preparation and cell transplantation. Recipient was obtained by mating tilapia males and females with a ratio of 1:1. Testicular cells were taken from 4-month-old Nile tilapia. Electroporation was performed with testicular cell density of 104
cells.µL-1, pJfKer-GFP concentration of 50 ng.µL-1, and a pulse length of 20 ms at 0, 100, 200, and 300 volts. In amount of 5x103 cells at 0.5 µL electroporated testicular cells were then injected into the intraperitoneal cavity of 3-day-old Nile tilapia larva. The parameters measured were cell survival, the percentage of GFP fluorescent cells, and cell colonization in recipient fish.
The results showed that survival of the electroporated cells with 100 and 200 volts was similar (p>0.05), and higher than that of 300 volt treatment (p<0.05). It shows that the voltage is very influential on cell survival. The increase in voltage will result in the increasing mortality in the cell. Number of fluorescent cells was not significantly different among treatments. While the percentage of fluorescent cells did not differ on the treatment of 100, 200, and 300 volts (p> 0.05) except for the control. In the control treatment luminescence GFP was not visible, it is proved that the GFP gene was not able to pass through the cell membrane in the absence of an electric voltage. Percentage colonization of transplanted cells in the fish after 50 days of rearing gave the highest value at 200 volts (66.67%). As conclusion, electroporation within 100-200 volt was a suitable tool to label testicular cells for transplantation.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
OPTIMASI ELEKTROPORASI DENGAN GEN
GREEN
FLUORESCENT PROTEIN
UNTUK TRANSPLANTASI SEL
TESTIKULAR IKAN NILA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Optimasi Elektroporasi dengan Gen Green Fluorescent Protein untuk Transplantasi Sel Testikular Ikan Nila
Nama : Epro Barades NIM : C151110151
Disetujui oleh Komisi Pembimbing
Dr Alimuddin, SPi, MSc Ketua
Dr Ir Agus Oman Sudrajat, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2013 sampai dengan Agustus 2013, bertempatdi Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor adalah optimasi elektroporasi dengan gen green fluorescent protein untuk transplantasi sel testikular ikan nila.
Terima kasih penulis ucapkan kepada Bapak Dr Alimuddin, SPi, MSc dan Bapak Dr Ir Agus Oman Sudrajat, MSc selaku pembimbing yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada staff dan teman-teman dari Laboratorium Reproduksi dan Genetika Organisme Akuatik, serta teman-teman seperjuangan AKU 2011 baik angkatan ganjil maupun genap yang telah memberi dukungan dan bantuan dalam menyelesaikan karya ilmiah ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, istri, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan dan Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Transplantasi Sel 2
Marka Molekuler, Pewarna Sel PKH-26, dan GFP 4
Elektroporasi 6
METODE 6
Persiapan Resipien 6
Persiapan Sel Donor 7
Teknik Transplantasi 7
Deteksi Kolonisasi Sel Donor 8
Analisis Statistik 8
HASIL 8
Persentase Kelangsungan Hidup (KH) 8
Jumlah sel berpendar GFP 9
Kolonisasi sel testikular 9
PEMBAHASAN 11
SIMPULAN 13
DAFTAR PUSTAKA 13
DAFTAR GAMBAR
1 Transplantasi sel germinal rainbow trout (Yoshizaki et al. 2010a) 4 2 Sel germinal ikan nila yang diberi label PKH-26 sebelum
ditransplantasikan. Kiri : tanpa filter; kanan : dengan filter PKH-26
(Lacerda et al. 2006). 5
3 Populasi PGC yang membawa gen GFP dari genital ridges ikan rainbow trout . Kiri : tanpa filter; kanan : dengan filter GFP (Takeuchi
et al.2002). 5
4 Spermatogonia (GFP-positif) yang ditransplantasikan melalui rongga intraperitoneal menyatu di dalam ovari resipien (Yoshizaki et al. 2010)
6 5 Persentase sel testikular ikan nila yang hidup pascaelektroporasi
dengan tegangan listrik yang berbeda. Huruf berbeda di atas bar
menunjukkan berbeda nyata (p<0,05). 8
6 Persentase dan jumlah sel testikular ikan nila berpendar GFP setelah dielektroporasi menggunakan tegangan listrik berbeda dalam larutan mengandung gen GFP. Huruf berbeda di atas bar menunjukkan
berbeda nyata (p<0,05). 9
7 (A) Elektroforegram produk PCR dari sel yang dielektroporasi dengan tegangan listrik 0, 100, 200, 300 volt dan plasmid GFP. Tanda kepala panah hitam di sebelah kanan gambar 7A menunjukkan pita dari gen GFP. (B) Visualisasi pendaran GFP pada larva ikan nila 7 hari setelah transplantasi (atas : foto tanpa filter; bawah : foto dengan filter GFP). Tanda panah putih menunjukkan sel testikular yang berpendar GFP dan tanda panah hitam menunjukkan arah kepala ikan. Garis =50
µm. 10
8 Visualisasi pendaran GFP dalam gonad ikan nila 50 hari setelah transplantasi (atas: foto tanpa filter; bawah: foto dengan filter GFP). Tanda panah menunjukkan sel testikular yang berpendar GFP. Garis
1
PENDAHULUAN
Latar Belakang
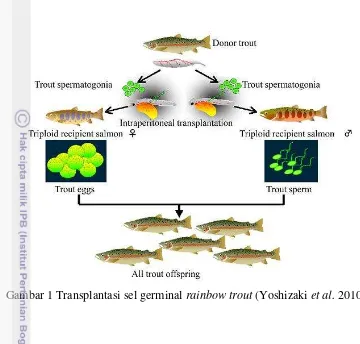
Transplantasi sel germinal merupakan salah satu teknologi yang sedang dikembangkan dalam bidang perikanan untuk menghasilkan induk semang (surrogate broodstock), berpotensi digunakan dalam rekayasa produksi benih ikan dan mempertahankan ikan-ikan yang terancam punah (Achmad 2009; Farlora et al. 2009). Pengembangan teknologi transplantasi sel germinal pada ikan diawali pada ikan rainbow trout (Onchorhynchus mykiss) (Okutsu et al. 2007; Yoshizaki et al.2010), dan telur ikan rainbow trout berhasil diperoleh dari ikan salmon masu (O. masou) triploid steril yang telah ditransplantasi sel germinal ikan rainbow trout. Penggunaan ikan resipien triploid dimaksudkan supaya ovum atau sperma yang dihasilkan semuanya berasal dari sel ikan donor (Okutsu et al.2007).
Keberhasilan transplantasi sel germinal donor pada ikan resipien sulit untuk diamati secara visual, karena morfologi sel donor dan resipien adalah sama. Sel donor umumnya diberi label sebelum ditransplantasikan. Label yang digunakan dapat berupa red fluorescent cell linker kit (PKH-26; Sigma) dan gen green fluorescent protein (GFP). PKH-26 merupakan bahan kimia yang dapat membuat sel berpendar merah dalam jangka waktu tertentu (Sigma). Sementara itu, sel berlabel GFP dapat diperoleh dari ikan transgenik yang membawa gen GFP (Okutsu et al. 2007; Yoshizaki et al. 2010a), atau dari blastodisc embrio yang disuntik dengan mRNA GFP (Yoshizaki et al. 2005). Produksi ikan transgenik yang membawa gen GFP membutuhkan waktu relatif lama, sedangkan pelabelan sel melalui injeksi mRNA GFP ke embrio relatif lebih cepat daripada transgenik tetapi biayanya relatif mahal. Selain itu, ikan yang dihasilkan melalui transplantasi sel dari embrio umumnya dalam bentuk chimera (Hong et al. 2012)
Elektroporasi merupakan salah satu metode yang dapat digunakan untuk memasukkan DNA asing ke dalam sel. Metode elektroporasi memanfaatkan kejut listrik sehingga dinding sel akan terbuka sementara dan dapat dilewati oleh DNA asing. Li et al. (2013) memasukkan plasmid DNA ke dalam sel sertoli tikus dengan cara elektroporasi dan lipofektamin. Hasil yang diperoleh menunjukkan bahwa metode elektroporasi lebih efisien dibandingkan dengan lipofektamin. Keberhasilan ini memberikan harapan baru untuk mempersingkat proses transplantasi sel, dengan tidak menghasilkan ikan transgenik terlebih dahulu. Pada penelitian ini dilakukan transfer gen GFP menggunakan elektroporasi pada sel testikular ikan nila (Oreochromis niloticus) dan ditransplantasikan ke dalam rongga intraperitoneal ikan nila, sehingga diharapkan sel donor dan sel resipien mudah untuk dibedakan.
Perumusan Masalah
2
donor yang membawa GFP umumnya diperoleh dari ikan transgenik yang membawa gen GFP. Hal tersebut mengakibatkan perlu dihasilkan ikan transgenik terlebih dahulu sebelum dilakukan transplantasi sel. Pembuatan ikan transgenik GFP memerlukan waktu cukup lama; 2-3 generasi. Oleh karena itu perlu dicari metode alternatif agar mempercepat proses transplantasi sel. Salah satunya adalah dengan menggunakan elektroporasi untuk memasukkan gen GFP ke dalam sel.
Elektroporasi memanfaatkan tegangan listrik untuk membentuk pori-pori pada membran sel. Semakin besar tegangan listrik yang digunakan, maka ukuran pori-pori yang terbentuk semakin besar. Hal tersebut dapat mengakibatkan kematian pada sel, sedangkan tegangan listrik yang terlalu kecil tidak dapat membentuk pori-pori pada membran sel. Oleh karena itu pengujian tegangan listrik berbeda dalam elektroporasi sangat penting untuk dilakukan.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk memperoleh metode alternatif dalam memberi label pada sel testikular dengan memanfaatkan elektroporasi untuk memasukkan gen GFP. Hasil yang diharapkan dari penelitian ini adalah diperoleh parameter elektroporasi yang menghasilkan banyak sel testikular mengandung gen GFP, dan metode alternatif yang dapat mempersingkat waktu dalam pelaksanaan transplantasi sel.
TINJAUAN PUSTAKA
Transplantasi Sel
Transplantasi sel adalah pemindahan sel yang berasal dari donor ke resipien. Teknologi transplantasi sel dalam rekayasa genetik dan reproduksi perikanan atau teknologi induk pengganti, dilakukan dengan cara menyuntikkan sel germinal berupa primordial germ cells (PGCs) (Takeuchi et al. 2003) atau sel spermatogonia (Okutsu et al. 2006b) ke dalam rongga perut larva ikan resipien. Sel tersebut dapat menjadi sel sperma ataupun sel telur. Menurut Okutsu et al. (2006a) induk pengganti yang sudah ditransplantasikan sel donor tersebut apabila dipijahkan akan menghasilkan ikan donor.
Teknologi transplantasi sel germinal pada ikan pertama kali dikembangkan oleh Prof. Dr. Yoshizaki pada ikan rainbow trout, Oncorhynchus mykiss (Lacerda et al. 2006). Pada awalnya, aplikasi transplantasi sel menggunakan sel PGC sebagai materialnya. Sel PGC rainbow trout ditransplantasikan ke ikan salmon masu sebagai resipien, ternyata sel tersebut mengalami gametogenesis secara normal pada gonad ikan salmon masu (Takeuchi et al. 2004). Pengembangan teknologi transplantasi selanjutnya menggunakan sel testikular yang mengandung sel stem (sel punca) spermatogonia yang belum terdiferensiasi. Transplantasi sel testikular juga telah dilakukan oleh Okutsu et al. (2006b) pada ikan rainbow trout, kurang lebih 104 sel testikular ikan rainbow trout yang ditransplantasikan dapat
3 berkolonisasi dalam gonad embrio dan dapat berdiferensiasi menjadi germinal jantan dan betina. Hal tersebut juga dilakukan oleh Octavera (2012) dengan hasil berupa sel testikular ikan nila putih yang terkolonisasi dan terproliferasi didalam gonad ikan nila hitam triploid.
Hasil penelitian Yoshizaki et al. (2010) dengan memanfaatkan oogonia ikan donor dengan mentransplantasikan PGC (primordial germ cell) yang belum terdiferensiasi dari ikan rainbow trout (donor) ke rongga peritoneal larva ikan salmon masu (resipien) mampu memproduksi sperma dan telur fungsional ikan rainbow trout.
Keberhasilan proses transplantasi sel germinal dari donor menjadi gamet fungsional pada ikan resepien tergantung pada reaksi imunitasnya. Pemilihan resipien yang digunakan dalam teknologi transplantasi perlu diperhatikan terutama terhadap umur resipien. Hal ini terkait dengan adanya perkembangan rejection immune system pada setiap ikan resipien yang mampu menolak sel donor ketika dilakukan transplantasi sehingga sel donor tidak dapat berkembang di dalam tubuh ikan resipien. Takeuchi et al. (2003) menemukan bahwa sel donor tidak terkolonisasi ketika resipien (rainbow trout) yang digunakan telah berumur 45 hari setelah fertilisasi, begitu pula dengan Okutsu et al. (2006a) yang mengatakan bahwa PGC ikan rainbow trout yang ditransplantasikan ke larva ikan salmon yang telah berusia lebih dari 45 hari tidak dapat terkolonisasi karena sistem imunnya telah berkembang dengan sempurna.
Menurut Yoshizaki et al. (2010a) 20 hari setelah transplantasi, PGCs yang dibawa donor ditemukan melekat pada dinding peritoneal. Tiga puluh hari setelah transplantasi, PGCs yang ditransplantasi secara peritoneal sukses bermigrasi ke gonad resipien dan berinkorporasi. Donor yang membawa PGCs memulai gametogenesis sinkron dengan sel germinal resipien dan memproduksi gamet fungsional. Dalam eksperimen tersebut donor pembawa PGCs mengalami oogenesis atau spermatogenesis pada resipien betina atau jantan. Inkorporasi dari donor pembawa PGCs telah diobservasi hanya terjadi bila transplantasi dilakukan pada dua minggu awal setelah menetas, hal ini menjelaskan bahwa gonad resipien kehilangan kemampuan untuk menarik atau menginkorporasi germ cell donor setelah tahap tersebut.
Penelitian yang dilakukan Yoshisaki et al. (2010a) menunjukkan bahwa spermatogonia yang belum terdiferensiasi dapat berdiferensiasi menjadi telur fungsional dan oogonia menjadi sperma fungsional ikan rainbow trout (Gambar 1). Kedua tipe spermatogonia dan oogonia terisolasi dari gonad setelah periode differensiasi kelamin mengandung plastisitas yang tinggi. Spermatogonia yang bisa ditransplantasikan ke resipien triploid dari ikan berbeda spesies (xenotransplantation) antara donor dan resipien jarak genetik kecil seperti donor rainbow trout dan salmon masu (Oncorhynchusmasou) sebagai resipien. Menurut Okutsu et al. (2007) ikan resipien terlebih dahulu harus dibuat steril sebelum dilakukan transplantasi sel, dengan menggunakan metode triploidisasi agar gonad yang berkembang berasal dari ikan donor.
4
Marka Molekuler, Pewarna Sel PKH-26, dan GFP
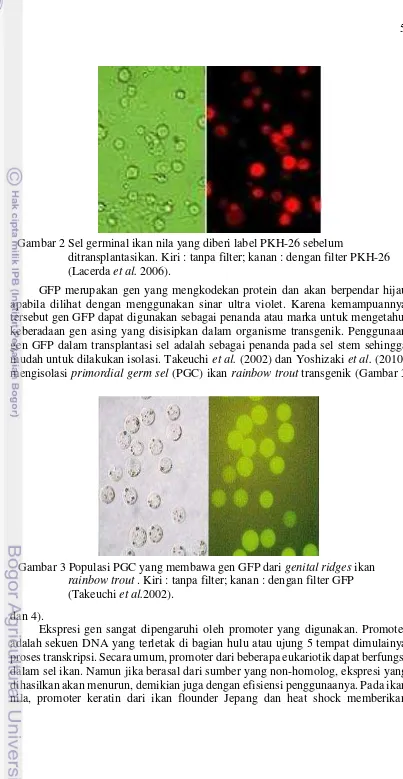
Marka molekuler atau lebih dikenal dengan marker DNA sudah banyak digunakan untuk melihat keragaman dari beberapa spesies ikan (Thanh et al. 2010). Pada transplantasi sel, marka molekuler digunakan untuk mengidentifikasi keberadaan sel donor di dalam sel resipien dengan menggunakan primer spesifik. Menurut Okutsu et al. (2008) bahwa sel germinal donor ikan rainbow trout dapat diidentifikasi menggunakan primer spesifik berdasarkan sekuen gen vasa yang diamplifikasi dengan metode PCR, sehingga hanya DNA dari sel germinal ikan rainbow trout saja yang dideteksi oleh primer tersebut. Menurut Gibson dan Muse (2004) dalam pengembangan marka molekuler ikan nila putih, dan ikan nila hitam dapat menggunakan metode SNP (single nucleotide polymorphism). SNP merupakan salah satu metode untuk skrining genom yang digunakan sebagai penanda yang terkait dengan lokus penanda karakter (quantitative trait loci; QTLs). Pewarna sel PKH-26 merupakan bahan kimia yang tidak beracun dan dapat menandai sel sehingga berpendar fluoresen dalam jangka waktu tertentu. Dalam berbagai penelitian, PKH-26 sering digunakan untuk menandai sel seperti penandaan bakteri yang dilakukan oleh Kollner et al. (2002) yang melabeli bakteri Aeromonas salmonisida dalam penelitiannya untuk mengetahui antibodi monoklonal pada ikan rainbow trout (Oncorhynchus mykiss). Lacerda et al. (2006) menggunakan pewarna PKH-26 pada sel yang akan ditransplantasikan (Gambar 2).
5
GFP merupakan gen yang mengkodekan protein dan akan berpendar hijau apabila dilihat dengan menggunakan sinar ultra violet. Karena kemampuannya tersebut gen GFP dapat digunakan sebagai penanda atau marka untuk mengetahui keberadaan gen asing yang disisipkan dalam organisme transgenik. Penggunaan gen GFP dalam transplantasi sel adalah sebagai penanda pada sel stem sehingga mudah untuk dilakukan isolasi. Takeuchi et al. (2002) dan Yoshizaki et al. (2010) mengisolasi primordial germ sel (PGC) ikan rainbow trout transgenik (Gambar 3
dan 4).
Ekspresi gen sangat dipengaruhi oleh promoter yang digunakan. Promoter adalah sekuen DNA yang terletak di bagian hulu atau ujung 5 tempat dimulainya proses transkripsi. Secara umum, promoter dari beberapa eukariotik dapat berfungsi dalam sel ikan. Namun jika berasal dari sumber yang non-homolog, ekspresi yang dihasilkan akan menurun, demikian juga dengan efisiensi penggunaanya. Pada ikan nila, promoter keratin dari ikan flounder Jepang dan heat shock memberikan
Gambar 2 Sel germinal ikan nila yang diberi label PKH-26 sebelum
ditransplantasikan. Kiri : tanpa filter; kanan : dengan filter PKH-26 (Lacerda et al. 2006).
6
efektivitas yang sama dan lebih baik dibandingkan dengan promoter medaka β -aktin dan tilapia β-aktin dalam mengendalikan ekspresi GFP (Sucipto 2009).
Elektroporasi
Elektroporasi merupakan salah satu metode yang digunakan untuk melakukan transfeksi gen asing ke dalam sel. Menurut Tsong (1991) kejut listrik pada intensitas dalam kilovolt percentimeter selama mikrodetik hingga milidetik mengakibatkan hilangnya semipermeable pada membran sel, mengarah pada bocornya ion keluar dari metabolit dan meningkatnya daya serap terhadap obat-obatan, molekul serta DNA. Sehingga dalam bidang perikanan elektroporasi dapat digunakan untuk menghasilkan ikan transgenik. Menurut Hostetler et al. (2003) elektroporasi lebih efisien dalam menghasilkan ikan transgenik dibandingkan dengan mikroinjeksi.
METODE
Persiapan Resipien
Resipien yang digunakan dalam penelitian adalah larva ikan nila yang berumur tiga hari setelah menetas. Tahap persiapan resipien meliputi pemijahan induk ikan nila secara buatan, dan inkubasi telur hingga menetas menjadi larva dan siap digunakan untuk transplantasi. Proses pemijahan buatan ikan nila dilakukan setelah induk diinduksi secara alami. Induksi alami dilakukan dengan memasukkan masing-masing satu ekor induk ikan nila betina dan jantan yang sudah matang kelamin dalam satu akuarium ukuran 50x60x40 cm3. Setelah 1-2 jam, kedua ikan akan menunjukkan perilaku pemijahan (genital induk jantan dan betina menonjol Gambar 4 Spermatogonia (GFP-positif) yang ditransplantasikan melalui rongga
7 keluar serta membersihkan dasar akuarium secara bersama) dan pada saat inilah kedua induk tersebut diambil, koleksi gamet dan kemudian dilakukan pembuahan buatan.
Transfer gen GFP ke dalam sel testikular dilakukan secara elektroporasi. Kepadatan sel testikular yang digunakan (104 sel.µL-1) sesuai dengan Octavera
(2012), dan vektor ekspresi pJfKer-GFP (Yazawa et al. 2005) 50 ng/µ L sesuai dengan dosis yang digunakan oleh Sucipto (2009). Gen GFP yang digunakan membawa promoter keratin JfKer. Menurut Sucipto (2009) promoter keratin memberikan efektivitas yang lebih baik dibandingkan dengan promoter β-aktin ikan medaka dan ikan nila dalam mengendalikan ekspresi GFP pada ikan nila.
Perlakuan tegangan listrik yang digunakan adalah sebesar 0, 100, 200, dan 300 volt, lama waktu kejut 20 ms sebanyak satu kali kejut, dan setiap perlakuan diberi tiga ulangan. Data yang dikumpulkan berupa persentase sel hidup dan persentase sel membawa gen GFP. Penghitungan jumlah sel dilakukan menggunakan haemositometer dan mikroskop pada perbesaran 400x. Sel hidup dapat dilihat menggunakan pewarna eosin. Pewarna eosin akan mewarnai sel yang mati menjadi warna merah, sedangkan sel yang hidup tidak terwarnai. Kemudian penghitungan sel yang membawa gen GFP dilakukan dengan menggunakan mikroskop yang dilengkapi dengan filter GFP.
Konfirmasi keberhasilan transfer gen GFP ke sel juga dilakukan menggunakan metode PCR dengan primer GFP forward (5’-GGT CGA GCT GGA CGG CGA CG-3’) dan GFP reverse (5’-ACGAACTCCAGCAGGACCAT-3’). Hasil PCR diseparasi menggunakan elektroforesis dengan gel agarosa 2%. Produk amplifikasi gen GFP berada pada ukuran sekitar 600 bp.
Teknik Transplantasi
8
Deteksi Kolonisasi Sel Donor
Deteksi sel donor dilakukan pada ikan resipien pada umur 7 hari dan 50 hari pascatransplantasi. Sel donor dideteksi dengan menggunakan mikroskop fluoresen untuk mengetahui pendaran dari gen GFP. Keberhasilan kolonisasi sel donor dilihat dari persentase ikan yang membawa gen GFP dibandingkan dengan total ikan yang diamati pada ikan umur 50 hari pascatransplantasi. Sel gonad yang membawa gen GFP berpendar warna hijau ketika diamati di bawah mikroskop yang dilengkapi dengan filter GFP.
Analisis Statistik
Data persentase sel yang hidup dan sel membawa gen GFP dianalisis dengan metode sidik ragam (ANOVA), sedangkan keberhasilan transplantasi dianalisis secara deskriptif dan disajikan dalam bentuk tabel, grafik, serta gambar.
HASIL
Persentase Kelangsungan Hidup (KH)
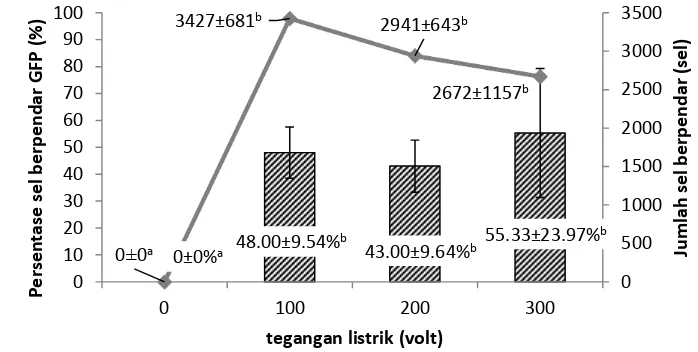
Peningkatan tegangan listrik dalam elektroporasi mengakibatkan penurunan jumlah sel yang hidup. KH terendah (48,28±1,00%) terdapat pada perlakuan 300 volt (p<0,05). KH sel perlakuan 100 dan 200 volt, serta kontrol tidak berbeda secara statistik (p>0,05; Gambar 5).
9
Jumlah sel berpendar GFP
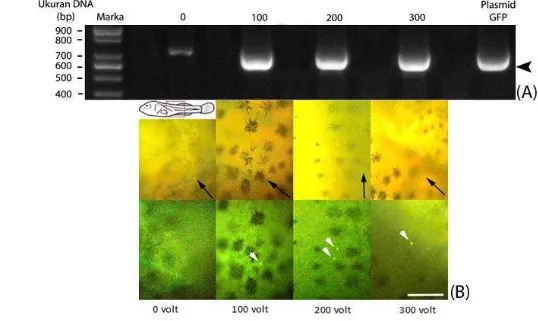
Pengamatan ekspresi gen GFP pada sel testikular ikan nila setelah dielektroporasi menunjukkan bahwa persentase sel berpendar GFP tidak berbeda antar perlakuan tegangan listrik 100-300 volt (p>0,05; Gambar 6). Persentase sel berpendar berturut dari perlakuan 100 volt adalah 48,00%, 43,00%, dan 55,33%. Walaupun persentase sel berpendar tidak berbeda secara statistik, jumlah sel yang memberikan pendaran GFP menurun. Konfirmasi menggunakan metode PCR juga menunjukkan bahwa perlakuan elektroporasi berhasil memasukkan gen GFP ke dalam sel testikular, ditunjukkan oleh pita DNA berukuran 600 bp yang sama ukurannya dengan kontrol plasmid GFP (tanda kepala panah; Gambar 7A).
Kolonisasi sel testikular
Ekspresi gen GFP setelah tujuh hari pascatransplantasi terlihat pada perlakuan 100 volt, 200 volt, dan 300 volt, yakni berupa pendaran di tubuh benih ikan nila (Gambar 7B). Ekspresi gen GFP juga terdeteksi pada ikan nila setelah 50 hari pascatransplantasi pada semua perlakuan tegangan listrik (Gambar 8), terlihat dengan adanya pendaran pada gonad ikan. Pendaran yang terlihat tersebut menunjukkan bahwa sel berhasil terkolonisasi pada ikan resipien. Kolonisasi terjadi pada semua perlakuan kecuali kontrol. Persentase kolonisasi sel tertinggi adalah perlakuan 200 volt, terlihat pada Tabel 1.
10
11 Tabel 1 Persentase kolonisasi sel testikular ikan nila yang ditransplantasi pada
gonad ikan nila umur 50 hari pascatransplantasi
Tegangan listrik
Jumlah ikan yang diamati (ekor)
Jumlah ikan yang mempunyai pendaran GFP (ekor)
Persentase kolonisasi (%)
0 5 0 0
100 4 2 50,0
200 3 2 66,7
300 5 3 60,0
PEMBAHASAN
Elektroporasi adalah metode transfeksi yang efektif untuk memasukkan DNA ke dalam sel, dapat digunakan pada berbagai jenis sel dengan tingkat efisiensi tinggi bahkan pada sel primary yang umumnya susah ditransfeksi, dan memiliki langkah kerja sedikit (Li et al. 2013). Perbedaan sel membutuhkan kondisi elektroporasi yang berbeda. Tegangan listrik merupakan salah satu faktor penting dalam elektroporasi untuk mengontrol efisiensi transfeksi dan menjaga kelangsungan hidup sel.
Peningkatan tegangan listrik dalam penelitian ini mengakibatkan penurunan KH pada sel donor (Gambar 1). KH sel yang diberi perlakuan 300 volt lebih rendah (p<0,05) daripada perlakuan tegangan listrik 100 dan 200 volt. Hal tersebut
12
diakibatkan oleh kerusakan pada membran sel akibat penggunaan tegangan listrik yang tinggi. Tegangan listrik mengakibatkan membran sel mengembang, membentuk pori-pori dan bersifat permeabel saat membran mencapai ambang batas toleransi (Tsong 1983; Martinez dan Hollenbeck 2003). Pembentukan pori-pori pada membran sel mengakibatkan berbagai zat dapat terserap ke dalam sel dan mengubah struktur organel di dalam sel (Knight dan Scrutton 1986; Tsong 1991).
Ekspresi gen sangat dipengaruhi oleh promoter yang digunakan. Secara umum, promoter dari beberapa eukariotik dapat berfungsi dalam sel ikan. Namun jika berasal dari sumber yang non-homolog, ekspresi yang dihasilkan akan menurun, demikian juga dengan efisiensi penggunaanya. Pada ikan nila, promoter keratin dari ikan flounder Jepang memberikan efektivitas yang sama dan lebih baik dibandingkan dengan promoter β-aktin ikan medaka dan tilapia dalam mengendalikan ekspresi GFP (Sucipto 2009). Plasmid pJfKer-GFP menunjukkan adanya ekspresi pada sel setelah diberi perlakuan berupa pendaran warna hijau pada perlakuan tegangan listrik 100-300 volt. Jumlah sel yang membawa gen GFP terus menurun seiring dengan meningkatnya tegangan listrik perlakuan (Gambar 6). Walaupun demikian, persentase dan jumlah sel berpendar yang terlihat tersebut tidak berbeda nyata secara statistik (p>0,05). Kematian sel akibat elektroporasi sangat berhubungan dengan jumlah sel berpendar GFP. Hal tersebut dikarenakan sel yang telah mati tidak dapat menghasilkan protein berpendar warna hijau. Konfirmasi keberhasilan masuknya gen GFP ke dalam sel melalui elektroporasi dibuktikan oleh hasil amplifikasi menggunakan PCR. Perlakuan 100 volt, 200 volt, dan 300 volt memiliki pita DNA 600 bp, yang panjangnya sama dengan kontrol plasmid GFP (Gambar 7A). Perlakuan 0 volt tidak memperlihatkan ekspresi dikarenakan gen GFP tidak mampu melewati membran sel akibat kurang atau tidak adanya tegangan listrik.
Persentase atau jumlah sel yang tidak berbeda nyata dapat disebabkan oleh banyak faktor seperti kepadatan sel, konsentrasi plasmid, waktu penanganan pascatransfeksi, dan bufer yang digunakan dalam elektroporasi. Hasil penelitian yang dilakukan oleh Li et al. (2013) menyimpulkan bahwa bufer dapat menjadi berbahaya, menurunkan efektivitas transfeksi dan mengakibatkan kematian pada sel. Selanjutnya, kepadatan sel yang terlalu tinggi akan mengakibatkan banyak penyatuan sel dan membentuk gumpalan. Optimasi elektroporasi pada sel sertoli tikus, menghasilkan kelangsungan hidup sel 83,9 ± 6,1% dan ekspresi gen GFP 41,8 ± 9,4% pada tegangan listrik 250 volt (Li et al. 2013).
13 Kolonisasi sel tersebut membuktikan bahwa sistem imun (rejection immune system) belum berkembang sempurna pada resipien sehingga tidak ada respons penolakan terhadap sel donor ketika dilakukan transplantasi dan sel donor dapat berkembang dalam resipien. Sel donor tidak akan terkolonisasi ketika resipien yang digunakan telah berumur 45 hari setelah fertilisasi (Takeuchi et al. 2003). Begitu pula dengan Okutsu et al. (2006a) yang mengatakan bahwa primordial germ cells (PGC) ikan rainbow trout yang ditransplantasi ke larva ikan salmon masu yang telah berusia lebih dari 45 hari tidak dapat terkolonisasi karena sistem imunnya telah berkembang dengan sempurna.
Kolonisasi sel yang terlihat dalam penelitian ini memberikan dampak positif terhadap perkembangan metode pemberian label pada sel donor, sehingga proses transplantasi dapat dipersingkat tanpa perlu menghasilkan ikan transgenik yang stabil (generasi kedua atau F2). Selain itu, perkembangan sel yang membawa label GFP dalam resipien memungkinkan untuk diamati tanpa terbatas oleh waktu seperti penggunaan pewarna sel PKH-26. Selanjutnya keturunan dari ikan hasil transplantasi dapat menghasilkan ikan transgenik dari ikan nontransgenik (Yoshizaki et al. 2005) dengan menggunakan gen penyandi karakter penting dalam akuakultur atau mutu ikan budidaya.
SIMPULAN
Metode pelabelan sel testikular ikan menggunakan elektroporasi berpotensi tinggi digunakan untuk mendukung teknologi transplantasi sel germinal. Tegangan listrik yang dapat digunakan untuk pelabelan sel donor ikan nila adalah 100-200 volt.
DAFTAR PUSTAKA
Achmad M. 2009. Pengembangan marka molekuler DNA dalam identifikasi sel gonad ikan gurame (Osphronemus goramy) dan ikan nila (Oreochromis niloticus) menggunakan PCR [tesis]. Bogor (ID): Institut Pertanian Bogor. Farlora R, Kobayashi SI, França LR, Batlouni SR, Lacerda SMSN, Yoshizaki G.
2009. Expression of GFP in transgenic tilapia under the control of the medaka β-actin promoter: establishment of a model system for germ cell transplantation. Anim Reprod. 6:450-459.
Gibson G, Muse SV. 2004. A primer of genome science. Sinauer Associates: Sunderland.
Hong N, Chen S, Ge R, Song J, Yi M, Hong Y. 2012 Interordinal chimera formation between medaka and zebrafish for analyzing stem cell differentiation. Stem Cells and Development. 21:2333-2341. doi: 10.1089/scd.2011.0630.
14
Kim Y, Selvaraj V, Dobrinski I, Lee H, Meentee MC, Travis AJ. 2006. Resipient preparation and mixed germ cell isolation for spermatogonial stem cell transplantation in domestic cats. J. Androl. 27:248–256.
Knight DE, Scrutton MC. 1986. Gaining access to the cytosol: the technique and some application of electropermeabilization. Biochem J. 234:497-506.
Kollner B, Wasserrab B, Kotterba G, Fischer U. 2002. Evaluation of immune functions of rainbow trout (Oncorhynchus mykiss) - how can environmental influences be detected?. Toxicology Letters. 131:83-95.
Lacerda SMSN, Batlouni SR, Silva SBG, Homem CSP, França LR. 2006. Germ cells transplantation in fish: the Nile-tilapia model. Anim Reprod. 3:146-159. Li F, Yamaguchi K, Okada K, Matsushita K, Enatsu N, Chiba K, Yue H, Fujisawa
M. 2013. Efficient transfection of DNA into primarily cultured rat sertoli cells by electroporation. Biology of Reproduction. 88:61. doi:10.1095/biolreprod.112.106260.
Martinez CY, Hollenbeck PJ. 2003. Transfection of primary CNS and PNS neurons by electroporation. Methods in Cell Biology. 71:321-332.
Octavera A. 2012. Kolonisasi dan proliferasi sel testikular ikan nila putih yang ditransplantasikan ke ikan nila hitam triploid [tesis]. Bogor (ID): Institut Pertanian Bogor.
Okutsu T, Suzuki K, Takeuchi Y, Takeuchi T, Yoshizaki G. 2006. Testikular germ cells can colonize sexually undifferentiated embryonic gonad and produce functional egg in fish. PNAS. 103:2725-2729. doi:10.1073/pnas.0509218103. Okutsu T, Yano A, Nagasawa A, Shikina S, Kobayashi T, Takeuchi Y, Yoshizaki
G. 2006a. Manipulation of fish germ cell: visualization, cryopreservation and transplantation. J Reprod Dev. 52:1087-1092.
Okutsu T, Shikina S, Kanno M, Takeuchi Y, Yoshizaki G. 2007. Production of trout offspring from triploid salmon parents. Science. 317:1517. doi:10.1126/science.1145626.
Piferrer F, Beaumont A, Falguière JC, Flajšhans M, Haffray P, Colombo L. 2009. Polyploid fish and shellfish: Production, biology and applications to aquaculture for performance improvement and genetic containment. Aquaculture. 293:125-156.
Sucipto A. 2009. Efektivitas promoter keratin, heat shock, β-aktin pada transgenesis ikan nila (Oreochromis niloticus) [tesis]. Bogor (ID): Institut Pertanian Bogor. Takeuchi Y, Yoshizaki G, Kobayashi T, Takeuchi T. 2002. Mass isolation of
primordial germ cells from transgenic rainbow trout carrying the green fluorescent protein gene driven by the vasa gene promoter. Biology of Reproduction. 67:1087–1092.
Takeuchi Y, Yoshizaki G, Takeuchi T. 2003. Generation of live fry from intraperitoneally transplantation primordial germ cells in rainbow trout. Biology of Reproduction. 69:1142-1149.doi:10.1095/biolreprod.103.017624.
Takeuchi Y, Yoshizaki G, dan Takeuchi T. 2004. Surrogate broodstock produces salmonids. Nature. 430:629-630.
15 Tsong TY. 1983. Voltage modulation of membrane permeability and energy
utilization in cells. Biosci Rep. 3:487-505.
Tsong TY. 1991. Electroporation of cell membranes [minireview]. Biophys J. 60:297-306. doi:10.1016/S0006-3495(91)82054-9.
Yazawa R, Hirono I, Aoki T. 2005. Characterization of promoter activities of four different Japanese flounder promoters in transgenic zebrafish. Mar Biotechnol. 7:625-633. DOI: 10.1007/s10126-005-0011-1.
Yoshizaki G, Tago Y, Takeuchi Y, Sawatari E, Kobayashi E, Takeuchi T. 2005. Green fluorescent protein labeling of primordial germ cells using a nontransgenic method and its application for germ cell transplantation in salmonidae. Biology of Reproduction. 73:88-93. doi:10.1095/biolreprod. 104.034249.
Yoshizaki G, Masaki I, Makoto H, Yoshiko I, Misako M, Shinya S, Tomoyuki O. 2010. Sexual plasticity of ovarian germ cells in rainbow trout. Development. 137:1227-1230.
16