PENGARUH ETIL METAN SULFONAT (EMS) TERHADAP
MIKROALGA SPESIES Dunaliella sp.
AMELIA SALINA GUSTINI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
1Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Etil Metan Sulfonat (EMS) Terhadap Mikroalga Spesies Dunaliella sp. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Amelia Salina Gustini
NIM C54100052
*
ABSTRAK
AMELIA SALINA GUSTINI. Pengaruh Etil Metan Sulfonat (EMS) Terhadap Mikroalga Spesies Dunaliella sp. Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI SUNUDDIN.
Mikroalga spesies Dunaliella sp. memiliki potensi yang besar untuk dimanfaatkan sebagai bahan pakan maupun pangan sehingga dapat dijadikan sebagai komoditi hasil perairan alternatif. Etil metan sulfonat (EMS) merupakan suatu teknik mutagenesis yang banyak digunakan untuk meningkatkan produksi mikroalga. Tujuan penelitian ini adalah menganalisis pengaruh pemberian EMS terhadap mikroalga spesies Dunaliella sp. Metode yang digunakan yaitu dengan cara menambahkan EMS konsentrasi 0.1 M dan 0.5 M pada tahap awal kultivasi mikroalga. Analisis yang dilakukan untuk mengetahui pengaruh dari penambahan EMS yaitu dengan pengamatan ukuran sel, kepadatan sel, karakteristik proksimat, karakteristik asam lemak dan aktivitas antioksidan mikroalga spesies Dunaliella
sp. Hasil menunjukkan bahwa konsentrasi 0.1 M memiliki ukuran sel tiga kali lebih besar dari ukuran sel kontrol dan memiliki persentase asam lemak yang lebih tinggi. Sedangkan perlakuan yang ditambahkan EMS memiliki laju pertumbuhan dan aktivitas antioksidan yang rendah dibandingkan dengan perlakuan kontrol.
Kata kunci: Dunaliella sp., Etil Metan Sulfonat, Mikroalga
ABSTRACT
AMELIA SALINA GUSTINI. Effect of Ethyl Methane Sulfonate (EMS) on Microalgae Species Dunaliella sp. Supervised by MUJIZAT KAWAROE and ADRIANI SUNUDDIN. the effect of EMS on the species microalgae Dunaliella sp. The method used is by adding EMS concentration of 0.1 M and 0.5 M in the early stages of cultivation of microalgae. The analysis conducted to determine the effect of the addition of EMS is the observation cell size, cell density, proximate characteristics, characteristics of fatty acid and antioxidant activity of species microalgae Dunaliella sp. EMS concentration of 0.1 M has a cell size three times larger than the cell size control and have a percentage of higher fatty acids. Meanwhile the EMS treatment had low in growth rate and antioxidant activity compared to the control treatment.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
PENGARUH ETIL METAN SULFONAT (EMS) TERHADAP
MIKROALGA SPESIES Dunaliella sp.
AMELIA SALINA GUSTINI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi: Pengamh Etil Metan Sulfonat (EMS) Terhadap Mikroalga Spesies
Nama NIM
Dunaliella sp.
: Amelia Salina Gustini : C54100052
Disetujui oleh
\
Pembimbing I
Tanggal Lulus:
5
APR 2015
Adriani MSi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas rahmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan September hingga bulan Desember 2014 ini ialah hidrobiologi, dengan judul “Pengaruh Etil Metan Sulfonat (EMS) Terhadap Mikroalga Spesies Dunaliella sp.”
Terima kasih penulis ucapkan kepada Ibu Dr Ir Mujizat Kawaroe, MSi dan Adriani Sunuddin, SPi, MSi selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Bapak Dr Ir I Wayan Nurjaya, MSc selaku ketua Departemen, Bapak Dr Ir Henry M Manik, ST selaku Ketua Komisi Pendidikan S1 ITK, Bapak Beginer Subhan, SPi, MSi selaku dosen penguji dan seluruh staf Departemen Ilmu dan Teknologi Kelautan. Ungkapan terima kasih juga disampaikan untuk angkatan Ilmu dan Teknologi Kelautan tahun 2010, Safirah Tassa, Wida Novasari, Marina Novasari, Abu Rizhal, Nandike Ayudiah Poetri, Fitrianti Sofyan, Deni Yan Koesyana, Nurlita Putri, atas dukungan dan bantuannya serta ayah, ibu, seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2015
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Lokasi dan Waktu Penelitian 2
Prosedur Penelitian 2
Analisis Data 4
HASIL DAN PEMBAHASAN 5
MorfologiSel Mutagenesis Dunaliella sp. 5
Kepadatan Sel Dunaliella sp. 6
Karakteristik Mikroalga Spesies Dunaliella sp. 8 Karakteristik Senyawa Asam Lemak Mikroalga Dunaliella sp. 10
Aktivitas Antioksidan Kultur Dunaliella sp. 11
KESIMPULAN DAN SARAN 12
Kesimpulan 12
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 16
DAFTAR TABEL
1 Fisikokimiawi (%) mikroalga spesies Dunaliella sp. 9
2 Senyawa asam lemak Dunaliella sp. 10
3 Aktivitas antioksidan (%) mikroalga Dunaliella sp. 12
DAFTAR GAMBAR
1 Ukuran sel Dunaliella sp. perbesaran 1000x (a) Kontrol, (b) EMS 0.1
M, dan (c) EMS 0.5 M 5
2 Grafik kepadatan sel Dunaliella sp. pada media kultur 10 ml 6 3 Grafik kepadatan sel Dunaliella sp. pada media kultur 400 ml 7 4 Grafik kepadatan sel Dunaliella sp. pada media kultur 20 liter 8 5 Pengujian aktivitas antioksidan Dunaliella sp. metode DPPH 11
DAFTAR LAMPIRAN
1 Metode analisis proksimat 16
2 Dokumentasi kegiatan 18
3 Uji statistik kepadatan sel pada media kultur 400 ml 20 4 Uji statistik kepadatan sel pada media kultur 20 liter 20
5 Uji statistik kadar air 20
6 Uji statistik kadar abu 21
7 Uji statistik kadar lemak 22
8 Uji statistik kadar protein 22
9 Identifikasi asam lemak Dunaliella sp. 24
10 Nilai absorbansi Dunaliella sp. metode DPPH 26
PENDAHULUAN
Latar Belakang
Mikroalga merupakan mahluk hidup berukuran mikroskopis yang dapat hidup baik di air tawar maupun air laut. Organisme ini merupakan tumbuhan paling primitif yang lebih dikenal dengan sebutan fitoplankton. Zat pigmen klorofil yang dimiliki oleh mikroalga mampu melakukan fotosintesis seperti tumbuhan tingkat tinggi lainnya sehingga menyebabkan mikroalga berperan sebagai produsen di wilayah perairan. Selain itu mikroalga laut merupakan materi organik dalam laut sehingga dapat dijadikan salah satu komponen pembentukan minyak bumi di dasar laut (Kawaroe et al. 2010).
Dunaliella sp. merupakan salah satu jenis mikroalga yang termasuk dalam
kelas alga hijau, pergerakannya motil dengan dua flagella sama panjang. Umumnya bentuk sel dari Dunaliella sp. adalah bulat dengan ukuran lebar 4-15 µm dan panjang 6-25 µm, tetapi tergantung fase pertumbuhan atau kondisi lingkungan. Pada umumnya bentuk sel Dunaliella sp. simetris radial dan sebagian berbentuk simetris bilateral, pipih, bagian atas melengkung atau sedikit asimetris. (Gonzalez et al. 2009). Dunaliella sp. dapat ditemukan di air tawar maupun air laut dan sebagian danau bersalinitas tinggi di seluruh dunia. Suhu, salinitas dan nutrisi merupakan faktor pembatas bagi pertumbuhan dan perkembangan
Dunaliella sp.
Mikroalga jenis Dunaliella sp. memiliki potensi yang besar untuk dimanfaatkan sebagai bahan pakan maupun pangan sehingga dapat dijadikan sebagai komoditi hasil perairan alternatif. Kebanyakan spesies mikroalga menghasilkan produk yang khas seperti asam lemak, antioksidan dan karotenoid (Hossain et al. 2008). Dunaliella sp. merupakan salah satu mikroalga yang cukup banyak diteliti karena kandungan karotenoid dan gliserol nya yang tinggi. Kandungan kimiawi seperti protein, asam amino, vitamin, polisakarida dan karbohidrat yang diekstrak dari mikroalga telah digunakan untuk bahan makanan. Selain untuk pakan maupun pangan, mikroalga dapat dimanfaatkan sebagai penghasil bahan bakar alternatif atau biofuel.
2
Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis pengaruh pemberian Etil Metan Sulfonat (EMS) terhadap mikroalga spesies Dunaliella sp.
METODE
Lokasi dan Waktu Penelitian
Penelitian ini dilakukan selama bulan September hingga Desember 2014, di
Surfactant and Bioenergy Research Center (SBRC), Pusat Studi Biofarmaka,
LPPM, Laboratorium Bioprospecting, Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Laboratorium Pangan Universitas Islam Negeri Syarif Hidayatullah, Jakarta.
Prosedur Penelitian Kultivasi Mikroalga
Kultivasi dilakukan pada skala laboratorium dengan perbandingan 1:3 yaitu sebanyak 100 ml inokulan Dunaliella sp. ditambahkan air laut steril 300 ml, dan tambahkan pupuk walne sebagai media. Sel Dunaliella sp. dikultivasi di dalam erlenmeyer 500 ml dan diletakkan dalam rak kultur dengan pemberian areasi dan penerangan cahaya lampu 1000 lux selama 24 jam.
EMS Mutagenesis
Setelah umur kultivasi mencapai fase logaritmik, sampel mikroalga diambil untuk dimutasi menggunakan Etil Metan Sulfonat (Sigma USA) dan dikocok dengan stabil menggunakan stirer magnetik selama 60 menit. EMS yang digunakan yaitu konsentrasi 0.1 M dan 0.5 M untuk dilihat perbandingannya. Setelah itu sampel mikroalga yang telah diberikan EMS dibilas sebanyak 3 kali ulangan dengan air laut steril untuk menghilangkan EMS yang tersisa pada mikroalga. Selanjutnya sampel tersebut ditambahkan kembali dengan pupuk walne dan di separasi untuk masing-masing perlakuan (EMS 0.1 M, EMS 0.5 M dan kontrol) ke dalam tabung reaksi 10 ml. Mikroalga dipelihara selama 7 hari dan dihitung kepadatan selnya sebelum diseleksi. Tabung yang terseleksi kemudian dikultivasi kembali pada skala yang lebih besar (scaling up).
Pemanenan Mikroalga
Pemanenan mikroalga dilakukan saat umur mikroalga mencapai fase stasioner dan kematian dengan cara filtrasi menggunakan vacuum pump dan kertas whatman berdiameter 90 mm. Biomassa mikroalga yang tersaring dikeringkan menggunakan oven di bawah suhu 105 °C selama ± 1 jam.
Ekstraksi Lemak
3 tersebut dimasukkan ke dalam tabung soxhlet dan tambahkan zat kimia Heksan sebagai pelarut ekstraksi selama 6 jam (Bligh dan Dyer 1959). Ekstrak lemak didestilasi menggunakan soxhlet, kemudian oven lemak yang terekstrak dengan suhu 105 °C selama kurang lebih 1 jam dan selanjutnya ditimbang untuk mendapatkan kadar lemak.
Perhitungan Kepadatan Sel
Perhitungan kepadatan sel Dunaliella sp. pada setiap perlakuan dilakukan setiap hari dengan menggunakan mikroskop elektron dengan perbesaran 10x dan
haemocytometer. Setiap perhitungan dilakukan dengan mencacah 5 lapang
pandang masing- masing 4 kali pengulangan. Sel yang telah tercacah selanjutnya dihitung dengan menggunakan formula sebagai berikut :
Kepadatan sel (sel/ml) = (1)
Keterangan:
n = Jumlah sel yang teramati Penentuan Kadar Air (AOAC 1995)
Keringkan cawan porselen yang digunakan selama 1 jam dalam oven pada suhu 105 °C, lalu didinginkan dalam desikator, kemudian ditimbang. Sebanyak 2-3 gram sampel ditimbang dan dimasukkan ke dalam cawan untuk dikeringkan dalam oven selama 4-6 jam pada suhu 105 °C. Selanjutnya cawan tersebut didinginkan dalam desikator, kemudian ditimbang. Persamaan kadar air terdapat pada Lampiran 1.
Penentuan Kadar Abu (AOAC 1995)
Sampel ditimbang sebanyak 2-3 gram dan dimasukkan ke dalam cawan porselen yang telah diketahui beratnya. Setelah itu cawan dimasukkan ke dalam tanur listrik tipe 1400 fumace dengan suhu 600 °C selama 4-6 jam sampai terjadi pengabuan sempurna. Kemudian diangkat dan didinginkan dalam desikator lalu ditimbang sampai konstan. Persamaan kadar abu terdapat pada Lampiran 1.
Penentuan Kadar Protein Kasar
Timbang sampel sebanyak 0.51 gram dan masukkan ke dalam labu kjeldahl 100 ml. Tambahkan 2 gram campuran selen dan 25 ml H2SO4 pekat kemudian panaskan di atas pemanas listrik atau api pembakar sekitar 2 jam sampai mendidih dan larutan menjadi jernih kehijau-hijauan. Dinginkan, kemudian encerkan dan masukkan ke dalam labu ukur 100 ml, tepatkan sampai tanda garis. Pipet 5 ml larutan dan dimasukkan ke dalam alat penyuling dan tambahkan 5 ml NaOH 30% dan beberapa indikator PP. Sulingkan selama 10 menit, sebagai penampung gunakan 10 ml larutan asam borat 2% yang telah dicampur indikator. Kemudian titrasi dengan larutan HCl 0.001 N. Persamaan kadar protein kasar terdapat pada Lampiran 1.
Esterifikasi
4
memisahkan ester. Sampel ditambahkan NaCl untuk mengapungkan senyawa asam lemak ke atas labu kemudian analisis dengan alat GC-MS (Prommuak et al.
2012)
Metode Kromatografi Gas–Spektrometri Massa (GC-MS)
Analisis kromatografi gas–spektrometri massa (Gas Chromatography –
Mass Spectrometry/ GC-MS) menggunakan kromatografi gas Shimadzu QP2010
yang dilengkapi dengan kolom silika DB-5 ms (panjang 30 m; 0.25 mm diameter dalam; dan 0.25 µm ketebalan lapis film) serta helium sebagai gas pendorong. Kromatografi gas memiliki batas deteksi 0.001 ppb. Kromatografi gas menggunakan mode injeksi split dengan rasio 1 : 200. Suhu oven kromatografi gas di program dari 80 °C dibiarkan konstan selama 2 menit, kemudian dinaikkan 210 °C dengan kecepatan 10°/menit dibiarkan konstan selama 1 menit, kemudian dinaikkan lagi 280 °C dengan kecepatan 6 °C/menit dibiarkan konstan selama 5 menit. Kondisi GC-MS adalah ionisasi potensial/ electron energy 70eV, ion
source temperature 250 °C dan interface temperature 280 °C. Full mass data
dicatat antara 50 – 400 Dalton setiap detik. Waktu retensi dari 0 sampai 32.67 menit. Kemudian data dicatat dan dianalisis dengan peragkat lunak GC-MS Real
Time Analysis dan GCMS Postrun Analysis.
Uji Aktivitas Antioksidan
Larutan 2,2-diphenyl-1-picryl-hydrazyl-hydrate (DPPH) disiapkan dengan melarutkan 0.004 gram DPPH dalam 100 ml metanol (Romeilad et al. 2010; Das
et al. 2011). 1 ml mikroalga disentrifuse dengan kecepatan 10000 rpm pada suhu
4 °C selama 15 menit, kemudian endapan diekstraksi dengan 1 ml etanol kemudian vortex dengan kecepatan stabil. Ekstrak didiamkan pada suhu 4 °C selama 4 jam dan tambahkan 2 ml larutan DPPH. Kemudian campuran diinkubasi selama 30 menit di dalam ruang gelap suhu kamar. Sampel blanko (larutan etanol) merupakan kontrol. Hitung absorbansi pada panjang gelombang 517 nm dengan menggunakan spektrofotometer. Persamaan uji aktivitas antioksidan terdapat pada Lampiran 1.
Analisis Data
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) untuk kepadatan sel dan rancangan acak lengkap faktorial (RALF) untuk uji proksimat dan aktivitas antioksidan (Walpole 1993). Rancangan acak lengkap dilakukan terhadap kultur mikroalga dengan perbedaan perlakuan kontrol, EMS 0.1 M dan EMS 0.5 M. Model rancangannya :
Yij= µ + i+ εij (2)
Keterangan :
Yij = nilai pengamatan perlakuan ke-i, kelompok ke-j µ = rata-rata umum
i = (µi-µ) = pengaruh aditif perlakuan ke-i
5 Rancangan acak lengkap faktorial (RALF) dengan tiga kali ulangan dilakukan pada uji proksimat dan aktivitas antioksidan. Faktor pertama adalah perlakuan kontrol, EMS 0.1 M, dan EMS 0.5 M. Faktor kedua adalah hari panen yaitu pada saat fase stasioner dan fase kematian. Model rancangannya adalah sebagai berikut :
Yijk = µ + αi + βj + αβij+ ε1(ij (3) Keterangan :
Yijk = nilai proksimat dan antioksidan ke-k yang memperoleh kombinasi perlakuan penambahan EMS ke-i dan hari panen ke-j
µ = rata-rata nilai proksimat dan antioksidan sesungguhnya αi = pengaruh perlakuan penambahan EMS ke-i
βj = pengaruh waktu panen ke-j
(αβ)ij = pengaruh perlakuan ke-i dan ke-j
εijk = pengaruh galat perlakuan ke-i dan ke-j pada satuan percobaan ke-k Kedua rancangan ini diolah dengan menggunakan software SAS. Data yang diperoleh dianalisis menggunakan Analisis of Variance (ANOVA) two way
dengan tingkat kepercayaan 95% dan taraf α 0.05 serta dilakukan uji lanjut dengan uji Duncan.
HASIL DAN PEMBAHASAN
Morfologi Sel Mutagenesis Dunaliella sp.
Pada penelitian ini kultivasi mikroalga yang dikombinasikan dengan penambahan EMS berhasil dilakukan. Konsentrasi EMS yang diberikan pada setiap perlakuan berpengaruh terhadap ukuran sel hasil kultur dan kandungan kimia mikroalga. Pengaruh senyawa kimia Etil Metan Sulfonat (EMS) terhadap mikroalga Dunaliella sp. secara kualitatif dapat dilihat dari ukuran sel yang berbeda.
(a) (b) (c)
Gambar 1 Ukuran sel Dunaliella sp. perbesaran 1000x pada kultivasi (a) EMS 0.1 M, (b) EMS 0.5 M, dan (c) Kontrol
6
Gambar 1 merupakan pengamatan sel mikroalga menggunakan mikroskop elektron dengan perbesaran 1000x. Sel Dunaliella sp. perlakuan EMS 0.1 M berukuran 11.09 µm, EMS 0.5 M berukuran 3.89 µm, dan kontrol berukuran 4.09 µm. Penambahan EMS 0.1 M terhadap kultivasi Dunaliella sp. dapat menghasilkan ukuran sel mikroalga yang lebih besar dibandingkan dengan dua perlakuan lainnya. Hal ini sesuai dengan penelitian yang dilakukan oleh Aranez (1981) yaitu, mikroalga spesies Scenedesmus yang diberikan perlakuan EMS memiliki ukuran sel dua kali dan tiga kali dari sel normal. Namun pemberian EMS 0.5 M tidak berpengaruh terhadap ukuran sel mikroalga Dunaliella sp. Hal ini disebabkan karena Dunaliella sp. rentan terhadap konsentrasi 0.5 M.
Perlakuan penambahan EMS 0.5 M memiliki pigmen sel berwarna hijau terang. Pigmen yang berwarna hijau terang ini menunjukkan bahwa kandungan klorofil pada sel tersebut rendah, sehingga menyebabkan kepadatan sel perlakuan EMS 0.5 M juga rendah. Dalam kondisi kultur yang normal mikroalga spesies
Dunaliella sp. memiliki warna yang hijau terang. Sedangkan mikroalga yang telah
mengalami mutasi memiliki pigmen warna yang lebih gelap. Hal ini sesuai dengan penelitian Solomon dan Crane (1968) yaitu, Chlorella yang bermutasi memiliki warna sel yang lebih gelap dibandingkan spesies asli. Selain itu kondisi kultur pada perlakuan penambahan EMS mengalami stress sehingga dapat meningkatkan produksi pigmen pada mikroalga (Pisal dan Lele 2005).
Kepadatan Sel Dunaliella sp.
Kultivasi skala 10 ml merupakan tahap awal dari proses kultur mikroalga
Dunaliella sp. Grafik kultivasi skala 10 ml memperlihatkan kepadatan sel
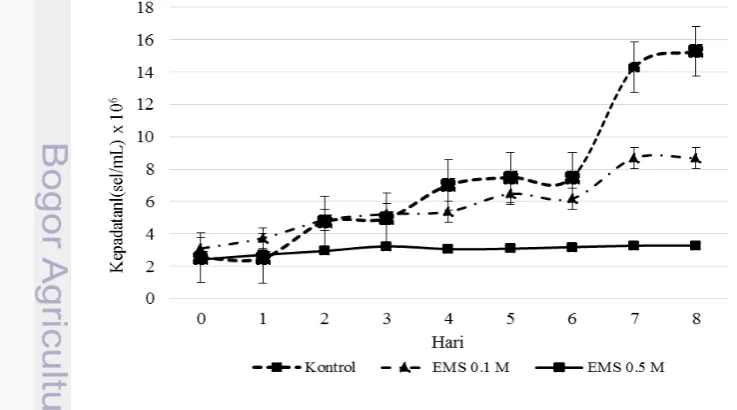
tertinggi terdapat pada perlakuan EMS 0.1 M dengan nilai rata-rata kepadatan sel sebesar 4.85x106 sel/ml, kemudian dilanjutkan dengan perlakuan kontrol dengan nilai rata-rata 4.48x106 sel/ml dan EMS 0.5 M dengan nilai rata-rata kepadatan sel sebesar 2.66x106 sel/ml. Grafik kepadatan sel mikroalga spesies Dunaliella sp. pada skala 10 ml disajikan pada Gambar 2.
7 Gambar 2 menjelaskkan bahwa kepadatan sel terendah dimiliki oleh perlakuan EMS 0.5 M, hal ini diduga karena saat induksi EMS 0.5 M dilakukan jumlah kematian sel mikroalga mengalami peningkatkan hingga 60%. Hal ini diduga karena sifat senyawa EMS sangat asam sehingga dapat menurunkan pH dan ditandai dengan perubahan warna media kultur menjadi putih. Pada proses inkubasi, jumlah sel cenderung tidak bertambah atau berkurang sehingga dapat disimpulkan bahwa keadaan mikroalga tersebut berada pada fase dorman. Penambahan EMS dapat mempengaruhi kondisi derajat keasaman (pH) awal kultur. Laju fotosintesis akan terbatas oleh penurunan karbon dan tingginya nilai pH Dengan demikian perlakuan pada EMS 0.5 M mengalami fase dormansi, sehingga dapat menghambat pertumbuhan sel.
Scale up dilakukan setiap umur kultur mikroalga mencapai hari ke-8. Scale
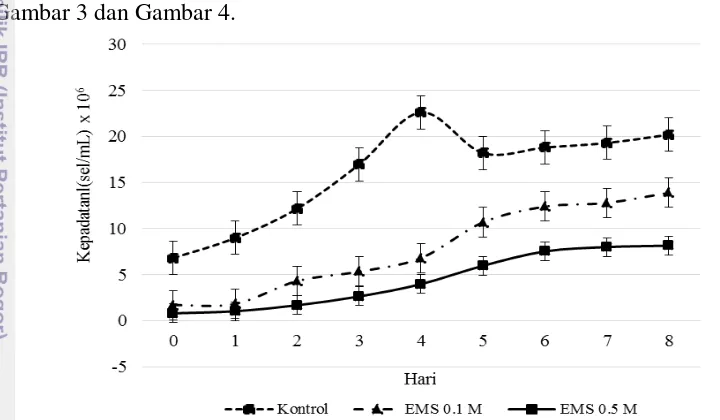
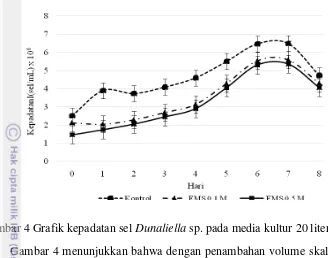
up bertujuan untuk mendapatkan hasil panen yang lebih besar. Grafik kepadatan sel mikroalga spesies Dunaliella sp. skala 400 ml dan 20 liter disajikan pada Gambar 3 dan Gambar 4.
Gambar 3 Grafik kepadatan sel Dunaliella sp. pada media kultur 400 ml
8
Gambar 4 Grafik kepadatan sel Dunaliella sp. pada media kultur 20 liter
Gambar 4 menunjukkan bahwa dengan penambahan volume skala kultivasi 20 liter dapat menurunkan jumlah kepadatan sel mikroalga spesies Dunaliella sp. Hal ini diduga karena pada saat kultivasi skala 20 L, bibit mikroalga Dunaliella
sp. yang digunakan sedang berada pada fase kematian. Salah satu faktor yang menentukan lamanya fase adaptasi adalah umur kultur yang digunakan sebagai inokulum (Prihantini et al. 2005). Gambar kultivasi skala 20 L dapat dilihat pada Lampiran 2.
Hasil uji statistika menunjukkan bahwa pemberian EMS dengan konsentrasi 0.1 M dan 0.5 M dapat mempengaruhi kepadatan sel mikroalga spesies Dunaliella
sp. pada tingkat signifikasi 5%. Hasil uji analysis of variance (ANOVA) RAL memperlihatkan bahwa nilai-P <.0001 lebih kecil dari nilai α = 0.05. Hasil P tersebut menyatakan tolak H0 sehingga cukup bukti bahwa pemberian senyawa EMS dapat mempengaruhi terhadap kepadatan sel mikroalga spesies Dunaliella
sp. Hasil uji Duncan memperkuat hipotesis bahwa pemberian EMS dengan konsentrasi 0.1 M dan 0.5 M dapat memberikan respon yang berbeda nyata terhadap kepadatan sel mikroalga spesies Dunaliella sp. Hasil uji ini dapat dilihat pada Lampiran 3 dan Lampiran 4.
Hasil penelitan Doan dan Obbard (2012) menunjukkan bahwa jumlah kematian kultur sel kontrol sebesar 0.8% dan akan semakin bertambah seiring dengan penambahan konsentrasi EMS. Jumlah kematian sel EMS 0.5 M dan 1 M berturut-turut sebesar 67.3% dan 92%, sedangkan konsentrasi EMS 1.2 M akan menyebabkan kematian pada sel mikroalga Nannochloropsis sp.
9 perlakuan diukur pada dua hari yang berbeda yaitu fase stasioner dan fase kematian, hasil analisis dapat dilihat pada Tabel 1.
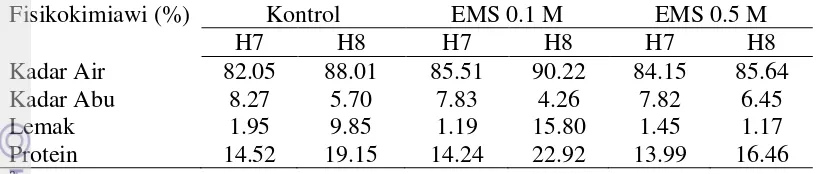
Tabel 1 Fisikokimiawi (%) mikroalga spesies Dunaliella sp
Fisikokimiawi (%) Kontrol EMS 0.1 M EMS 0.5 M
H7 : Panen hari ke-7 (fase stasioner), H8 : Panen hari ke-8 (fase kematian)
Tabel 1 menunjukkan persentase kadar air tertinggi terdapat pada saat fase kematian perlakuan EMS 0.1 M yaitu sebanyak 90.22%. Hal ini cukup jauh berbeda dengan hasil penelitian Yudha (2008) yaitu kandungan kadar air
Dunaliella sp. adalah sebesar 65.22%. Nilai kadar air yang tinggi tersebut, diduga
karena adanya perbedaan kepadatan pada setiap perlakuan. Selain itu jumlah bahan dan permukaan alat atau media yang digunakan untuk pengeringan suatu bahan, akan mempengaruhi kadar air yang diperoleh pada setiap sampel (Buckel
et al. 2007). Kandungan air dalam suatu bahan dapat menentukan kualitas,
kesegaran dan daya tahan bahan tersebut. Hasil analisis statistik menunjukkan bahwa kadar air Dunaliella sp. dengan penambahan EMS tidak berbeda nyata, demikian juga halnya dengan kadar air yang dipanen pada umur yang berbeda. Hasil analisis Duncan memperkuat hipotesis dengan memperlihatkan rata-rata setiap perlakuan yang tidak berbeda nyata. Uji statistik kadar air dapat dilihat pada Lampiran 5.
Analisis kadar abu menunjukkan kandungan mineral yang dimiliki oleh
Dunaliella sp. Kadar abu baik perlakuan kontrol ataupun EMS pada fase stasioner
lebih tinggi dibandingkan fase kematian. Kadar abu tertinggi terdapat pada fase stasioner perlakuan kontrol yaitu sebesar 8.27%. Hasil uji statistik RALF dan uji
Duncan menunjukkan bahwa pemberian EMS tidak mempengaruhi kadar abu
akan tetapi hari panen mempengaruhi kadar abu dari mikroalga. Hasil analisis statistik kadar abu dapat dilihat pada Lampiran 6.
Kadar lemak tertinggi terdapat pada fase kematian perlakuan EMS 0.1 M yaitu sebesar 15.80%. Hal ini sesuai dengan penelitian Doan dan Obbard (2012) yang menunjukkan bahwa lemak total Nannochloropsis sp. spesies mutan baik pada fase eksponesial dan fase stasioner akan lebih tinggi 1 - 2 kali lipat dibandingkan dengan spesies asli. Perbedaan kadar lemak pada setiap perlakuan disebabkan oleh nutrien yang terdapat pada setiap kultivasi. Mikroalga dapat menghasilkan lemak yang lebih banyak apabila mengalami stress (Prartono et al.2010). Hasil analisis statistik menunjukkan bahwa kadar lemak Dunaliella sp.
dengan penambahan EMS tidak berbeda nyata, demikian juga halnya dengan kadar lemak yang dipanen pada umur yang berbeda. Hasil analisis statistik kadar lemak dapat dilihat pada Lampiran 7.
10
mikroalga Dunaliella salina memiliki kandungan protein 57% (berat kering). Namun jika dibandingkan dengan penelitian Yudha (2008) hasil persentase protein Dunaliella sp. tidak berbeda jauh yaitu sebesar 18.12% (berat kering). Hasil uji statistik RALF dan uji Duncan menunjukkan bahwa pemberian EMS tidak mempengaruhi kadar protein akan tetapi hari panen mempengaruhi kadar protein dari mikroalga. Hasil analisis statistik kadar protein dapat dilihat pada Lampiran 8.
Karakteristik Senyawa Asam Lemak Mikroalga Dunaliella sp. Hasil asam lemak Dunaliella sp. setiap perlakuan yang terdeteksi oleh gas kromatografi spektro massa, di identifikasi dengan cara membandingkan nilai spektra dengan wiley libraries. Jenis-jenis asam lemak yang terdeteksi pada fase stasioner maupun kematian, disajikan pada Lampiran 9. Tabel 2 menunjukkan konsentrasi asam lemak tak jenuh paling tinggi yaitu asam Hexadecanoic (metil palmitat) yang teramati pada semua perlakuan kultivasi. Kondisi kultivasi yang berbeda pada setiap perlakuan akan mengakibatkan kandungan senyawa asam lemak yang terbentuk selama kultivasi juga berbeda (Kawaroe et al. 2012).
Tabel 2 Senyawa asam lemak Dunaliella sp.
Senyawa asam lemak Fase stasioner (%)
Hasil penelitian ini menunjukkan bahwa persen area paling tinggi lebih banyak ditemukan pada perlakuan EMS 0.1 M seperti senyawa Hexadecanoic,
Octadecadienoic dan Octadecatrienoic. Hal ini sesuai dengan penelitian Kawaroe
et al. (2014) yaitu perlakuan EMS 0.1 M pada spesies Nannochloropsis sp.
memiliki persenan asam lemak yang lebih banyak jika dibandingkan dengan konsentrasi EMS 0.5 M. Kondisi kultur, fase pertumbuhan, dan faktor lingkungan adalah faktor yang mempengaruhi kandungan lemak dan sifat asam lemak (Yecong et al. 2011).
Perhitungan asam lemak pada biomassa alga merupakan salah satu prosedur untuk mengindikasi lemak yang cocok untuk dikonversi menjadi biodiesel. Pemilihan fase kandungan minyak yang tinggi dan metode pemanenan yang efektif banyak dibutuhkan untuk memproduksi biodiesel dari mikroalga (Parmar
et al. 2011). Hexadecanoic atau yang dikenal dengan asam palmitat adalah asam
lemak yang banyak terkandung pada biodiesel dan memiliki persentase sebesar 23.7% dari total asam lemak pada mikroalga Dunaliella salina (Amini et al.
11 Asam Octadecanoic (asam stearat) pada Dunaliella salina lebih tinggi daripada
Botryococcus braunii, Chlorella vulgaris dan Scenedesmus sp. (Yoo et al. 2010).
Aktivitas Antioksidan Kultur Dunaliella sp.
Antioksidan berfungsi sebagai penangkal radikal bebas yang dapat merusak jaringan tubuh mahluk hidup. Saat ini, pemanfaatan kandungan antioksidan dari mikrobiologi laut banyak dilakukan. Dunaliella sp. merupakan mikroalga hijau dengan kandungan karotenoid yang tinggi. Dunaliella sp. memiliki kandungan beta karoten mencapai 4% berat kering (Barrow dan Shahidi 2008).
Pengujian aktivitas antioksidan dapat ditentukan baik secara kualitatif (reaksi warna) maupun kuantitatif (absorbansi). Hasil kualitatif dibuktikan dengan melihat reaksi warna yang terjadi antara larutan DPPH dengan senyawa yang akan di uji coba. Ketika suatu senyawa dapat meredam larutan DPPH yang berwarna ungu, maka senyawa tersebut memiliki daya peredaman radikal bebas. Berdasarkan hasil penelitian, perlakuan kontrol berwarna hijau dan perlakuan EMS 0.1 M berwarna kuning. Hal ini membuktikan bahwa secara kualitatif mikroalga Dunaliella sp. perlakuan kontrol dan EMS 0.1 M mempunyai daya peredaman radikal bebas terhadap DPPH. Pada perlakuan EMS 0.5 M, ketika larutan ditambahkan DPPH warnanya menjadi ungu. Secara kualitatif Dunaliella
sp. perlakuan EMS 0.5 M tidak memiliki daya peredaman radikal bebas terhadap DPPH. Gambar 5 menunjukkan perubahan warna yang terjadi ketika dilakukan pengujian aktivitas antioksidan Dunaliella sp.
Gambar 5 Pengujian aktivitas antioksidan Dunaliella sp. metode DPPH
12
Tabel 3 Aktivitas antioksidan (%) mikroalga Dunaliella sp. Aktivitas Antioksidan (%)
Fase Kontrol EMS 0.1 M EMS 0.5 M
Stasioner 84.33 54.78 24.63
Kematian 77.76 66.72 29.70
Tabel 3 menjelaskan secara garis besar pengaruh dari konsentrasi EMS terhadap peredaman radikal bebas. Kandungan karotenoid dan pigmen lainya diduga merupakan penyebab aktivitas antioksidan pada kultur mikroalga
Dunaliella sp. Perlakuan kontrol fase stasioner memiliki aktivitas antioksidan
tertinggi yaitu sebesar 84.33%. Sedangkan semakin tinggi konsentrasi EMS maka semakin kecil nilai aktivitas antioksidannya. Hal ini mengindikasikan bahwa konsentrasi EMS yang tinggi dapat meningkatkan toksik yang terkandung dalam bahan kimia tersebut (Aranez 1981).
Kecepatan peredaman warna ungu pada DPPH menunjukkan kekuatan penangkapan radikal bebas dari senyawa antioksidan dan ditandai dengan menurunnya absorbansi pada panjang gelombang 517 nm (Adah et al. 2014). Pada penelitian ini, penambahan EMS memiliki pengaruh yang cukup signifikan terhadap aktivitas antioksidan Dunaliella sp. Penambahan EMS dengan konsentrasi 0.1 M dan 0.5 M fase stasioner membuat aktivitas antioksidan Dunaliella sp. menurun menjadi 54.78% dan 24.63%. Hal ini disebabkan karena EMS bersifat asam, penambahan asam pada suatu sampel akan mempengaruhi aktivitas antioksidan dari sampel tersebut (Purba dan Martosupono 2009).
Nilai absorbansi setiap perlakuan dapat dilihat pada Lampiran 9. Hasil uji statistik menunjukkan bahwa aktivitas antioksidan Dunaliella sp. dengan penambahan EMS hasilnya tidak berbeda nyata, demikian juga halnya dengan aktivitas antioksidan yang dipanen pada umur yang berbeda. Hasil analisis statistik antioksidan dapat dilihat pada Lampiran 10.
SIMPULAN DAN SARAN
Simpulan
Penelitian ini telah memberikan pengaruh pada mikroalga spesies
Dunaliella sp. melalui penambahan Etil Metan Sulfonat (EMS) dengan
13 Saran
Penentuan konsentrasi EMS untuk spesies mikroalga lainnya perlu lebih diperhatikan sehingga untuk penelitian selanjutnya dapat melihat konsentrasi EMS yang masih dapat ditoleransi oleh mikroalga. Selain itu penentuan fase pertumbuhan lainnya juga perlu dilakukan karena fase pertumbuhan dapat mempengaruhi kandungan fisikokimiawi dan asam lemak mikroalga.
DAFTAR PUSTAKA
Adah AM, Fardiaz D, Andarwulan N, Kusnandar F. 2014. Karakteristik warna dan aktivitas antioksidan antosianin ubi jalar ungu. J. Teknol. Dan Industri Pangan. 25(2): 176-184. doi: 10.6066/jtip.2014.25.2.176
Amini SR, Mousavi P, Najafabady NM, Mobasher AM, Mousavi SB, Vosough F, Dabbagh F, Ghasemi Y. 2014. Biodiesel properties on native strain of
Dunaliella salina. International Journal of Renewable Energy Research. (4)1:
39-4.
AOAC. 1995. Official Methods of Analysis of The Association of Official
Agriculture Chemist. Washington DC.
Aranez AT. 1981. The effects of ethyl methane sulfonate on Scenedesmus
quadricauda (Turp.) BREB. Natural and Applied Science Bulletin. Vol.33,
3-4.
Barrow C, Shahidi F. 2008. Marine nutraceuticals and functionl food. Boca Raton (NY): CRC Press.
Bligh EG, Dyer WJ. 1959. A rapid method of total lipid extraction and purification. Canadian Journal of Biochermistry and Physiology. 37(8):911-917. doi: 10.1139/o59-099.
Buckel KA, Edward RA, Fleet GH, Wooton M. 2007. Ilmu pangan. Purnomo H, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Food science.
Chaturvedi R, Fujita Y. 2006. Isolation of enchaned eicosapentaenoic acid producing mutants of Nannochloropsis oculata ST-6 using ethyl methane sulfonate induced mutagenesis techniques and their characterization at mRNA transcript level. Phycological Research. 54: 208-219. doi: 10.1111/j.1440-1835.2006.00428.x
Das KB, Das B, Apita FK, Morshed MA, Uddin A, Bhattacherjee R, Hannan JMA. 2011. Photocemical screening and antioxidant activity of Leucas aspera. IJPSR. 2(7): 1746-1752
Doan TTY, Obbard JP. 2012. Enchaned Intracelullar Lipid in Nannochloropsis sp. via random mutagenesis and flow cytometric cell sorting. Algae research. 1: 17-21. doi: 10.1016/j.algal.2012.03.001
Gonzalez MA, Gomez PI, Polle JEW. 2009. The alga Dunaliella biodiversity,
physiology, genomics and biotechnology. Amotz AB, Polle JEW, Subba Rao
DV, editor. New Hampshire (USA): Science Publisher.
14
Hossain ABMS, Salleh AN, Boyce, Chowdurry P, Naqiuddin M. 2008. Biodiesel Fuel Production From Algae as Renewable Energy. American Journal of
Biochemistry and Biotechnology. 4(3): 250-254. doi:
10.3844/ajbbsp.2008.250.254
Isnansetyo A, Kurniastuty. 1995. Teknik kultur phytoplankton dan zooplankton
pakan alami untuk pembenihan organisme laut. Yogyakarta: Kanisius.
Kawaroe M, Sudrajat AO, Augustine D. 2014. Effect of Ethyl Methanesulfonate on Fatty Acid Characteristic of Nannochloropsis sp. International Journal of
Environment and Bioenergy. 9(3): 196-204.
Kawaroe M, Prartono T, Rachmat A, Sari DW, Augustine D. 2012. Laju pertumbuhan spesifik dan kandungan asam lemak pada mikroalga Spirulina
platensis, Isochrysis sp. dan Porphyridium cruentum. Ilmu Kelautan. 17(3):
125-131.
Kawaroe M, Prartono T, Sunuddin A, Sari DW, Augustine D. 2010. Mikroalga
potensi dan pemanfaatannya untuk produksi bio bahan bakar. Bogor(ID): IPB
Press.
Parmar A, Singh NK, Pandey A, Gnansounou E, Madamwar D. 2011. Cyanobacteria and microalgae: a positive prospect for biofuels. Biores
Technol. 102(22): 10163-72. doi: 10.1016/j.biortech.2011.08.030.
Pisal, DS dan Lele SS. 2005. Carotenoid production from microalga, Dunaliella
salina. Indian Journal of Biotechnology. Vol.4, 476-483.
Prartono T, Kawaroe M, Sari DW, Augustine D. 2010. Fatty acid content of Indonesian aquatic microalgae. Hayati. 12(4): 196-200. doi: 10.4308/hjb.17.4.196.
Prihantini NB, Putri B, Yuniati R. 2005. Pertumbuhan Chlorella sp. dalam Medium Ekstrak Tauge (MET) dengan variasi pH awal. Makara sains. 9(1): 1-6.
Prommuak C, Pavasant P, Quitain AT, Goto M. 2012. Microalgal lipid extraction and evalution of single-step biodiesel production. Journal of Engineering. Vol 16 (5).
Purba ER, Martosupono M. 2009. Kurkumin sebagai senyawa antioksidan.
Seminar Nasional dan Pendidikan Sains IV; 2009 Juni 13; Salatiga, Indonesia.
3: 607-621.
Romeilad RM, Fayed SA, Mahmoud GI. 2010. Chemical compositions, Antiviral and Antioxidant activities of seven essential oils. Journal of Applied Sciences
Research. 6(1): 50-62.
Solomon MJ, Crane FA. 1968. Isolation and characterization of some UV-induced mutants of Chlorella vulgaris. J. Pharm sci. 57: 2038-44.
Utomo MTS, Prabakusuma AS. 2009. Formulasi pembuatan tablet hisap berbahan dasar mikroalga Spirulina platensis sebagai sumber antioksidan alami. J. Sains MIPA. 15(3): 167-176.
Walpole, RE. 1993. Pengantar Statistika. Jakarta: PT Gramedia Pustaka Utama Yecong L, Yi-Feng C, Paul C, Min M, Wenguang Z, Blanca M, Zhu J, Ruan R.
15 Yoo C, Jun SY, Lee JY, Ahn CY, Oh HM. 2010. Selection of microalgae for lipid production under high level carbon dioxide. Biores Technol. 101 Suppl 1:S71-4. doi: 10.1016/j.biortech.2009.03.030
16
LAMPIRAN
Lampiran 1 Metode analisis proksimat Analisis Proksimat
a. Analisis Kadar Air (AOAC 1995)
Penentuan Kadar air dihitung dengan menggunakan formula sebagai berikut:
Keterangan:
x = berat (sampel + cawan) sebelum dikeringkan (gram) y = berat (sampel + cawan) setelah dikeringkan (gram) z = berat sampel (gram)
b. Analisis Kadar Abu (AOAC 1995)
Kadar abu dihitung dengan menggunakan formula sebagai berikut:
Keterangan:
W = berat sampel (gram)
W1 = berat (sampel + cawan) sesudah diabukan (gram) W2 = berat cawan kosong (gram)
c. Analisis Kadar Lemak
Perhitungan kadar lemak yang dihasilkan dihitung menggunakan formula sebagai berikut:
Keterangan:
W = bobot sampel (gram)
W1 = bobot labu lemak sebelum ekstraksi (gram) W2 = bobot labu lemak setelah ekstraksi (gram)
d. Analisis Kadar Protein (Metode Semimikro Kjeldhal)
Perhitungan kadar protein dihitung dengan menggunakan formula sebagai berikut:
Keterangan: W = bobot sampel
V1 = volume HCl 0.01 N yang dipergunakan penitaran contoh V2 = volume HCl yang dipergunakan penitaran blanko
N = normalitas HCl
f.k = faktor konversi untuk protein dan makanan secara umum: 6.25 susu & hasil olahannya: 638 mentega kacang: 5.46
17 Analisis Asam Lemak
Asam lemak diatom diidentifikasi dengan menggunakan kromatografi gas-spektrofotometri masa (GC-MS). Analisis metil ester asam lemak dilakukan dengan membandingkan mass spectra dengan data literatur. Nomor karbon pada senyawa metil ester asam lemak ditentukan dengan cara menghitung bobot molekul yang muncul pada spektra massa. Karakteristik metil ester asam lemak memberikan puncak yang kuat pada m/z = 74 yang merupakan puncak dasar rantai lurus metil ester. Peak terluas pada setiap kelompok mempresentasikan fragmen CnH2n-1O2 dan m/z = 14 (n – 2) + 74. Perhitungan asam lemak secara sederhana dapat dituliskan dalam formula berikut:
Keterangan:
x = nomor karbon (FAME)
m = bobot molekul yang muncul pada peak spektra massa 14 = berat molekul CH2
Analisis Aktivitas Antioksidan
Aktivitas antioksidan dihitung berdasarkan inhibisi radikal bebas DPPH dalam persen. Perhitungan antioksidan dapat dituliskan dengan formula berikut :
Keterangan: I% = inhibisi
18
Lampiran 2 Dokumentasi kegiatan
Keterangan :
a : Inokulan mikroalga; b : Seleksi tabung; c : Kultivasi 20 L; d : Penyaringan; e : Pasta kering mikroalga; f : Proses ekstraksi lemak; g : EMS; h : Spektrofotometer
a b
c d
e f
19 Lanjutan Lampiran 2
Keterangan :
i : Tanur; j : Neraca analitik; k : Autoklaf; l : Oven; m : Larutan DPPH; n : Vortex
i j
k l
20
Lampiran 3 Uji statistik kepadatan sel pada media kultur 400 ml Hasil analysis of variance (ANOVA) kepadatan sel tiap perlakuan
Sumber
Perlakuan 2 2.1133853E14 1.0566926E14 99.73 <.0001
Galat 6 6.3574601E12 1.0595767E12
Total 8 2.1769599E14
Lampiran 4 Uji statistik hasil kepadatan sel pada media kultur 20 liter Hasil analysis of variance (ANOVA) kepadatan sel tiap perlakuan
Sumber
Perlakuan 2 6.0559881E12 3.027994E12 14.00 0.0055
Galat 6 1.2979938E12 216332304687
Total 8 7.3539819E12
Hasil uji Duncan
Lampiran 5 Uji statistik kadar air
Hasil analysis of variance (ANOVA) kadar air tiap perlakuan Sumber
Perlakuan 3 83.8373482 27.9457827 1.83 0.1947
Galat 12 182.8351452 15.2362621
21 Uji Duncan EMS
Pengelompokan Duncan Rata-rata Jumlah Data
Pengelompokan Duncan Rata-rata Jumlah Data
Perlakuan
A 87.623 7 8
A 83.901 9 7
Lampiran 6 Uji statistik kadar abu
Hasil analysis of variance (ANOVA) kadar abu tiap perlakuan Sumber
Perlakuan 3 24.88942586 8.29647529 2.46 0.1125
Galat 12 40.40600579 3.36716715
Pengelompokan Duncan Rata-rata Jumlah Data
Pengelompokan Duncan Rata-rata Jumlah Data
Hari Panen
A 7.9724 9 7
22
Lampiran 7 Uji statistik kadar lemak
Hasil analysis of variance (ANOVA) kadar lemak tiap perlakuan Sumber
Perlakuan 3 184.6392953 61.5464318 1.79 0.2488
Galat 6 206.1402059 34.3567010
Total 9 390.7795011
Pengelompokan Duncan Rata-rata Jumlah Data
Pengelompokan Duncan Rata-rata Jumlah Data
Hari Panen
A 9.169 4 8
A 1.522 6 7
Lampiran 8 Uji statistik kadar protein
Hasil analysis of variance (ANOVA) kadar protein tiap perlakuan Sumber
Keragaman 3 99.2426003 33.0808668 2.88 0.1125
Galat 7 80.3696906 11.4813844
23 Uji Duncan EMS
Pengelompokkan Duncan Rata-rata Jumlah Data
Perlakuan
A 18.578 4 0.1M
A 16.835 4 Kontrol
A 15.633 3 0.5M
Uji Duncan hari panen
Pengelompokkan Duncan Rata-rata Jumlah Data
Hari Panen
A 19.507 6 8
Lampiran 9 Identifikasi asam lemak Dunaliella sp.
Senyawa Asam Lemak Fase Stasioner (%) Fase Kematian(%)
Kontrol EMS 0.1 M EMS 0.5 M Kontrol EMS 0.1 M EMS 0.5 M
Deodecanoic acid methyl ester 0.82 0.86 0.51 0.66
Tetradecanoic acid methyl ester 1.88 1.65 2.07 1.03 0.66
Hexadecanoic acid methyl ester 22.81 23.87 16.57 11.41 19.36
9-Hexadecenoic acid methyl ester 4.4 2.79 1.67 1.81
Octadecanoic acid methyl ester 5.80 5.13 6.88 4.62 2.47 8.57
10,13-Octadecadienoic acid methyl ester 11.67 8,11,14 Docosatrienoic methyl ester 19.59 7,10-Octadecadienoic acid methyl ester 3.24
9-Octadecenoic acid methyl ester 5.98 2.43 2.97
8-Octadecenoic acid methyl ester 14.3
9,12-Octadecadienoic acid methyl ester 15.65 11.36 6.73 8.67 6.63
7-Octadecenoic acid methyl ester 24.75
Methyl Tetradecanoate 1.66
Methyl 3-Acetylhdroxypalmitate 3.05
Pentadecanoic acid, 14-methyl-, methyl ester 25.13
6-Octadecenoic acid methyl ester 23.05
Pentadecanoic acid methyl ester 1.12 0.51 0.69
Eicosanoic acid methyl ester 2.42 1.51 0.67
7,10,13-Hexadecatrienoic acid methyl ester 2.18 1.34
8,11 Eicosadienoic acid methyl ester 0.68 0.69
9,12,15-Octadecatrienoic acid methyl ester 7.63 23.95 12.23
10-Nonadecanoic acid methyl ester 0.73
7,10-Hexadecadienoic acid methyl ester 1.33 1.51
11-Octadecenoic acid methyl ester 2.33 3.24
25
2
Lampiran 9 Lanjutan
Senyawa Asam Lemak Fase Stasioner (%) Fase Kematian(%)
Kontrol EMS 0.1 M EMS 0.5 M Kontrol EMS 0.1 M EMS 0.5 M
11-Eicosenoic 0.92 0.43
4,7,10,13,16,19-Docosahexaenoic acid methyl ester 2.87 5.93
13-Docosaenoic acid methyl ester 1.32 0.72
15-Tetracosenoic acid, methyl ester 0.84 0.55
6,9,12-Octadecatrienoic acid methyl ester 1.51
Tridecanoic acid 12 methyl, methyl ester 0.76
Oxiraneundecanoic acid 0.63
TOTAL 76.20 89.00 76.73 43.66 65.98 52.08
Lampiran 10 Nilai absorbansi Dunaliella sp. metode DPPH
Lampiran 9 Uji statistik aktivitas antioksidan
Hasil analysis of variance (ANOVA) aktivitas antioksidan tiap perlakuan Sumber
Keragaman 3 3570.706170 1190.235390 1.64 0.2566
Galat 8 5820.152966 727.519121
Total 11 9390.859136
Pengelompokkan Duncan Rata-rata Jumlah Data
Pengelompokkan Duncan Rata-rata Jumlah Data Hari Panen
A 68.06 6 8
A 54.58 6 7
2
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 11 Agustus 1992 sebagai putri kedua dari dua bersaudara, dari pasangan Yusuf Suryana dan Nuraeny, SPd. Penulis merupakan lulusan dari Sekolah Menengah Atas Negeri 10 Bandung pada tahun 2010. Pendidikan Sarjana ditempuh di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Semasa kuliah penulis aktif sebagai Asisten mata kuliah Oseanografi Kimia pada tahun ajaran 2013/2014 dan Asisten mata kuliah Biologi Tumbuhan Laut pada tahun 2014-2015.
Prestasi yang telah didapatkan oleh penulis semasa kuliah, yaitu sebagai pemenang Pekan Kreativitas Mahasiswa (PKM) yang didanai oleh Direktorat Jenderal Perguruan Tinggi (DIKTI) di bidang Artikel Ilmiah (PKM-AI) pada tahun 2013.