ISOLASI DAN IDENTIFIKASI BAKTERI ENDOFIT DARI
DAUN SIRSAK
(Annona muricata L.)
PENGHASIL
SENYAWA ANTIBAKTERI
ISRA JANATININGRUM
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul Isolasi dan Identifikasi Bakteri Endofit dari Daun Sirsak (Annona muricata l.) Penghasil Senyawa Antibakteri adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ISRA JANATININGRUM. Isolasi dan Identifikasi Bakteri Endofit dari Daun Sirsak (Annona muricata L.) Penghasil Senyawa Antibakteri. Dibimbing oleh AKHMAD ENDANG ZAINAL HASAN dan ENY IDA RIYANTI.
Bakteri endofit merupakan mikroorganisme yang hidup pada jaringan tanaman secara simbiosis mutualisme. Beberapa jenis bakteri endofit diketahui mampu menghasilkan senyawa aktif yang bersifat antibiotik. Tujuan dari penelitian ini adalah mengisolasi bakteri endofit dari daun tanaman sirsak (Annona muricata L.) yang memiliki aktivitas antibakteri terhadap bakteri penyebab penyakit infeksi dan mengidentifikasi bakteri tersebut secara genetik berdasarkan gen 16S rDNA. Bakteri patogen yang diujikan terdiri atas 5 spesies yaitu Escherichia coli, Pseudomonas aerroginosa, Staphylococcus mutans, dan Streptococcus aureus. Isolat bakteri endofit dengan kode G42 potensial menghambat keempat jenis bakteri uji sedangkan isolat S42 dan S54 berhasil menghambat 3 jenis bakteri uji. Berdasarkan analisis gen 16S rDNA, isolat G42 memiliki persentase kemiripan sebesar 93% dengan Plautia stali symbiont.
Kata kunci: antibakteri, bakteri endofit, sirsak, 16S rDNA
ABSTRACT
ISRA JANATININGRUM. Isolation and Identification of Endophyte Bacteria from Soursoup Leaf (Annona muricata L.) that Produced Antibacteria Compound. Supervised by AKHMAD ENDANG ZAINAL HASAN and ENY IDA RIYANTI
Endophytic bacteria is a microorganism that living in tissue of plant by symbiotic muatualisme. Some endophyte bacteria produce active compound that characterized as antibiotic. The objectives of this research are to isolate endophyte bacteria which have antibacterial activity and to geneticly identify endhophytic bacteria using16S rDNA gene. Five bacterial pathogen were tested as target for affect the antibacterial production which are Escherichia coli, Pseudomonas aerroginosa, Staphylococcus mutans, danStreptococcus aureus. Endophytic bacteria Isolat code G42 pontentialy inhibit 4 spesies pathogenic bacteria. Whereas S54 and S42 can inhibit 3 species pathogenic bacteria. Base on the test result 16S rDNA gene, isolate G42 has 93% correlation with Plautia stali symbiont.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ISOLASI DAN IDENTIFIKASI BAKTERI ENDOFIT DARI
DAUN SIRSAK
(Annona muricata L.)
PENGHASIL
SENYAWA ANTIBAKTERI
ISRA JANATININGRUM
DEPARTEMEN BIOKIMIAFAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas berkat dan karunia-Nya lah, penulis dapat menyelesaikan karya ilmiah yang berjudul “Isolasi dan Identifikasi Bakteri Endofit dari Daun Sirsak (Annona Muricata L.) Penghasil Senyawa Antibakteri. Tak lupa pula, shalawat serta salam penulis panjatkan kepada nabi besar Muhammad SAW yang telah membawa kita dari zaman kegelapan hingga ke zaman penuh rahmat ini dan semoga kita menjadi pengikutnya hingga akhir zaman.
Penulis menyampaikan terima kasih kepada Bapak Dr. Ir Akhmad Endang Zainal Hasan, MSi selaku pembimbing pertama dan Ir Eny Ida Riyanti, PhD selaku pembimbing kedua atas bimbingan, arahan berikut kritik dan sarannya dalam kegiatan karya ilmiah ini. Ucapan terima kasih kepada kedua orang tua dan keluarga atas dukungan dan kasih sayang yang selalu diberikan.Penulis juga mengucapkan terimakasih juga disampaikan untuk seluruh keluarga BEM KM 2014 dan biokimia 48 khususnya Bunga, Carlita, Faisal, dan Mute. Selain itu penulis juga mnegucapkan terima kasih kepada Usep, Azra, Supriyatno, dan Randi. Di samping itu, penghargaan penulis sampaikan kepada para peneliti, staf, serta sesama mahasiswa penelitian di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian.Akhir kata penulis berharap tulisan ini dapat berguna bagi penulis maupun semua pihak demi kemajuan ilmu pengetahuan.
Bogor, Mei 2015
DAFTAR ISI
DAFTAR TABEL iv
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN iv
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 3
Prosedur Penelitian 3
HASIL 5
Isolasi dan Pemurnian Isolat Bakteri Endofit 5
Uji Aktivitas Antibakteri Isolat Bakteri Endofit 6 Isolasi DNA Genom dan Identifikasi Isolat Bakteri Endofit Potensial dengan
Marka 16S rDNA 7
PEMBAHASAN 9
Isolasi Dan Pemurnian Bakteri Endofit 9
Uji Aktivitas Antibakteri Isolat Bakteri Endofit 10 Isolasi DNA Genom dan Identifikasi Isolat Bakteri Endofit Potensial dengan
Marka 16S rDNA 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 17
DAFTAR TABEL
1 Hasil ujiaktivitas antibakteri 6
2 Komposisi Brain Heart Infusion 10
DAFTAR GAMBAR
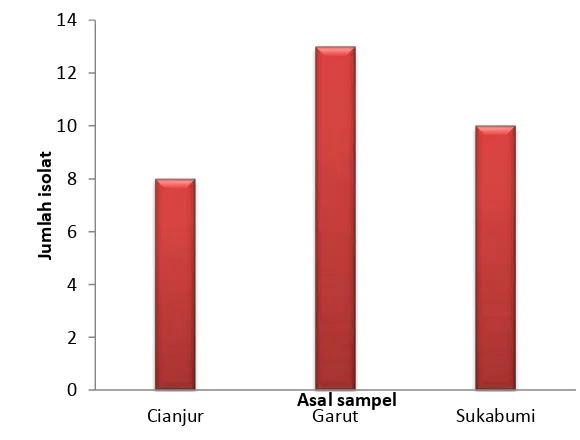
1 Jumlah isolat bakteri endofit dari tiga daerah 5 2 Hasil uji antibakteri isolat kode G42 pada bakteri Staphylococcus aureus
6538 Escherichia coli ATCC8739, Pseudomonas aeroginosa 27853 dan
Streptococcus mutans XC. 7
3 Zona hambat pada ekstrak isolat kode G42 pada bakteri Pseudomonas aeroginosa 27853 dan Streptococcus mutans XC Staphylococcus aureus
6538 dan Escherichia coli ATCC8739 7
4 Hasil elektrogram 18 isolat bakteri endofit tanpa perlakuan RNAse 8 5 Hasil elektrogram isolat bakteri endofit dengan perlakuan RNAse 8 6 Hasil elektrogram amplifikasi gen 16S rDNA isolat G42, S54 dan S52
setelah PCR 8
7 Hasil BLAST sekuen isolat G42 pada website NCBI 9
DAFTAR LAMPIRAN
1 Bagan alir penelitian 17
2 Morfologi koloni isolate bakteri endofit 18
3 Isolar bakteri endofit dari tiga daerah 19
4 Komposisi larutan yang digunakan 20
5 Kromatogram sekuensing dengan primer 27F 21
6 Kromatogram sekuensing dengan primer 1492F 23
PENDAHULUAN
Latar Belakang
Bakteri endofit adalah mikroba yang hidup di dalam jaringan tumbuhan secara simbiotik dengan membentuk koloni selama periode tertentu dari siklus hidupnya (Rahman 2009; Mano dan Morisaki 2008). Mikroorganisme ini dapat hidup tanpa membahayakan dan mengubah bentuk morfologi inangnya (Tianxing et al.2013). Beberapa jenis bakteri endofit diketahui mampu menghasilkan senyawa aktif yang bersifat antifungi (Zhang et al. 2008; Qiao et al. 2006), antibiotik, antioksidan dan memiliki aktivitas sitotoksik (Xiao et al. 2014). Menurut Radji (2005), bakteri endofit menghasilkan senyawa bioaktif yang karakternya mirip atau sama dengan senyawa yang diproduksi oleh inangnya.
Bakteri endofit merupakan sumber keanekaragaman genetik yang kaya dan dapat diandalkan, sebagai sumber berbagai jenis senyawa aktif baru yang belum dideskripsikan (Latupeirisa 2014). Senyawa aktif dari mikroba endofit tumbuhan obat akan memiliki aktivitas yang lebih besar dibandingkan aktivitas senyawa aktif tumbuhan inangnya (Haniah 2008). Dilihat dari segi efesiensi, hal ini sangat menguntungkan karena siklus hidup mikroba endofit lebih singkat dibandingkan siklus hidup tumbuhan inangnya sehingga dapat menghemat waktu produksi dan jumlah senyawa yang diproduksi dapat dibuat dalam skala besar tanpa menggunakan tempat yang luas. Hal ini menjadi salah satu solusi dalam menangani berbagai penyakit infeksi yang banyak berkembang di masyarakat. Keuntungan lain yang diperoleh dari pengembangan bakteri endofit adalah dapat menjaga kelestarian tanaman obat, terutama jenis tanaman obat yang langka, agar tidak dieksploitasi secara terus menerus yang akhirnya akan mengakibatkan kepunahan (Nursulistyarini 2014).
Sirsak (Annona muricata L.) merupakan tanaman yang berasal dari Karibia bagian Amerika Tengah dan Amerika Selatan. Sirsak dapat tumbuh pada daerah tropis dan subtropis (Orwa et al. 2009). Tanaman ini dapat tumbuh subur di ketinggian antara 100 mdpl sampai 300 mdpl (di atas permukaan laut). Suhu udara yang sesuai antara 22oC sampai 32oC dengan curah hujan antara 1500 mm/tahun sampai 3000 mm/tahun (Sunarjono 2005). Buah sirsak memiliki rasa manis agak keasaman yang mengandung serat sebanyak 3.3 g/100 g, karbohidrat terutama fruktosa, vitamin C 20 mg/100 g, B1, dan B2 (Hermawan dan Laksono 2013). Hasil riset menyatakan, sirsak mengandung asetogenin yang mampu melawan 12 jenis sel kanker. Banyaknya manfaat sirsak membuat orang mulai beralih mengkonsumsi sirsak sebagai alternatif pencegahan dan pengobatan konvensional (Adjie 2011).
2
yang disebabkan oleh bakteri seperti pneumonia, diare, infeksi saluran kemih dan beberapa jenis penyakit kulit karena ekstrak dari daun ini memiliki senyawa antibakteri yang berlimpah (Gajalakshmi et al. 2012). Menurut (Vieira et al. 2010), daun sirsak mempunyai aktivitas antibakteri terhadap bakteri Gram positif maupun negatif seperti Staphylococcus aureus,Vibrio cholerae,Escherichia coli,dan Salmonella enteritidis.
Penyakit infeksi pada manusia disebabkan oleh beberapa bakteri patogen, diantaranya E.coli, Pseudomonas aeruginosa, Streptococcus aureus, dan S. mutans. E. coli dapat menyebabkan diare yang ringan sampai sedang, bahkan dapat berakibat fatal (Veling et al. 2002). P. aeruginosa dapat menyebabkan infeksi dan inflamasi pada mata akibat penggunaan lensa kontak yang tidak higienis (Willcox 2007). S. aureus dapat menyebabkan infeksi endokarditis (Nadji et al. 2005) dan infeksi pada saluran pernafasan (Safdar dan Bradley 2008). S. mutans memproduksi enzim glukuronil transferase. Enzim tersebut menghasilkan glukan yang tidak larut dalam air dan berperan dalam menimbulkan plak dan koloni pada permukaan gigi (Zaenab et al. 2004).
Studi terhadap sifat antibakteri telah diteliti dan menunjukkan bahwa daun sirsak mempunyai aktivitas antibakteri terhadap bakteri Gram positif maupun negatif. Penanganan penyakit infeksi dengan antibiotik sintetik dapat menyebabkan dampak negatif bagi tubuh akibat sifat resisten dari bakteri. Perkembangan sifat resisten bakteri patogen terhadap beberapa antibiotik menjadi masalah serius (Krisnaningsih et al. 2005). Melalui penelitian ini diharapkan dapat diperoleh informasi identifikasi bakteri endofit hasil isolasi dari daun sirsak yang memiliki potensi sebagai agen antibakteri khususnya terkait bakteri penyebab penyakit infeksi.
Penelitian ini bertujuan mengisolasi bakteri endofit dari daun tanaman sirsak yang memiliki aktivitas antibakteri dan mengidentifikasi isolat tersebut secara genetik menggunakan marka 16S rDNA. Hasil penelitian ini diharapkan mampu memberikan informasi tentang jenis bakteri endofit pada jaringan daun sirsak yang memiliki aktivitas antibakteri sehingga dapat dipakai sebagai agen antibiotik yang dapat menanggulangi penyakit infeksi.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Januari – Maret 2014 di Laboratorium Biologi Molekuler Balai Besar Penelitian dan Pengembangan Sumberdaya Bioteknologi Genetik Pertanian Bogor.
Bahan
3
(5’AGAGTTTGATCMTGGCTCAG’3), Universal reverse primer (URP) 1492R (5’ CGG TTA CCT TGT TAC GAC TT’3), loading dye, ladder 1 kb, kalium asetat, Tris HCl, EDTA, NaCl, Polivinilpirolidon (PVP), Sodium dedosil sulfat (SDS), etidium bromida (EtBr), gliserol, isolat murni E. coli ATCC8739, P. aeruginosa 27853, S. aureus 6538, dan S. mutans XC.
Alat
Alat-alat yang digunakan adalah neraca analitik, lup inokulasi, pH meter, magnetic stirer, inkubator, inkubator shaker, autoklaf, inkubator, bioseptik kabinet, kulkas, sentrifuse, shaker,kertas cakram, tip, pipet tetes, pipet mikro, mesin Polymerase Chain Reaction PCR BIO-RAD T100, tabung PCR, seperangkat alat elektroforesis, komputer, UV transluminator dan alat-alat gelas.
Prosedur Penelitian
Penapisan Bakteri Endofit
Isolasi bakteri endofit (Modifikasi Desriani et al. 2013). Daun sirsak segar dicuci menggunakan air mengalir lalu dipotong-potong sekitar 3 cm. Potongan daun sirsak tersebut disterilisasi dengan cara dimasukkan ke dalam air steril setelah itu dimasukkan ke dalam etanol 96% selama 30 detik. Potongan daun sirsak tersebut kemudian direndam dalam cairan NaOCl selama 5 menit lalu dibasuh kembali dengan air steril. Daun sirsak yang telah disterilisasi dikering udarakan lalu diiris tipis. Irisan-irisan daun sirsak tersebut ditanam ke dalam cawan Petri yang berisikan media BHI agar secara horizontal (irisan daun ditidurkan). Setiap tahapan dilakukan secara steril di dalam laminar dan dekat api. Satu cawan Petri diisi dengan 5 iris daun sirsak. Setelah itu cawan-cawan Petri yang berisi daun sirsak diinkubasi pada suhu 28oC selama 2 hari.
Pemurnian bakteri endofit (Modifikasi Simarmata et al. 2007). Bakteri yang tumbuh dari sampel tanaman pada media BHI agar dimurnikan dengan cara digores menggunakan ose ke media BHI agar yang baru lalu diinkubasi pada suhu 28oC untuk mendapatkan koloni tunggal. Koloni tunggal yang tumbuh dipisahkan lagi ke media BHI agar baru untuk memastikan kemurniannya. Setelah benar-benar murni, koloni tersebut dipindahkan ke dalam media BHI miring dan disimpan pada lemari pendingin.
Uji Aktivitas Antibakteri Isolat Bakteri Endofit
Penyiapan bakteri patogen (Modifikasi Simarmata et al. 2007). Sebanyak satu ose dari masing-masing bakteri patogen yang berasal dari stok media BHI agar dalam cawan diambil dan ditumbuhkan pada media BHI cair steril. Selanjutnya diinkubasi dalam inkubator shaker dengan suhu 37oC selama 24 jam. Sebanyak 40 µL kultur bakteri patogen yang berasal dari media BHI cair dimasukkan ke dalam 20 mL media BHI agar hangat. Kemudian dituang ke dalam cawan Petri lalu didinginkan hingga memadat.
Aktivitas penghambatan bakteri patogen (Modifikasi Simarmata et al.
4
ke dalam media biakan bakteri endofit yang akan diuji lalu diletakkan pada media yang telah mengandung bakteri patogen yaitu E. coli ATCC8739, P. aeruginosa 27853, S. aureus 6538, dan S. mutans XC. Kultur diinkubasi selama 1 hari. Isolat bakteri endofit dikatakan berpotensi sebagai agen antibakteri dilihat dari kemampuannya menghasilkan zona bening terhadap bakteri patogen. Zona bening atau zona hambat diukur dan ukuran zona tersebut akan berbanding lurus dengan aktivitas antimikrobanya.
Isolasi DNA Genom dari Isolat Bakteri Endofit (Modifikasi Zheng et al. 1995). Penyiapan kultur bakteri. Sebanyak 1.5 mL bakteri endofit yang telah berumur 24 jam dimasukkan ke dalam tabung effendorf. Setelah itu disentrifus dengan kecepatan 5000 rpm selama 3 menit pada suhu 10oC. Supernatan hasil sentrifugasi dibuang dan pelet diambil.
Pemecahan sel bakteri. Pelet hasil sentrifugasi ditambahkan buffer ekstrak (Tris HCl, NaCl, EDTA, PVP, SDS) sebanyak 0.65 mL lalu diinkubasi selama 30 menit pada suhu 65oC. Setelah diinkubasi suspensi didinginkan dan ditambahkan kalium asetat sebanyak 100 µL. Sampel disentrifugasi selama 5 menit dengan kecepatan 13000 rpm pada suhu 4oC. Pelet dipisahkan dari supernatan hasil sentrifugasi.
Pemurnian DNA genom. Supernatan hasil sertrifugasi Hasil ditambahkan etanol sebanyak dua kali volumenya lalu disentrifugasi kembali selama 10 menit dengan kecepatan 10000 rpm pada suhu 4oC. Supernatan hasil sentrifugai dibuang dan peletnya diambil untuk ditambahkan etanol 70% sebanyak 500 µL kemudian disentrifugasi kembali selama 10 menit dengan kecepatan 13000 rpm pada suhu 4oC. Pelet hasil sentrifugasi diambil dan ditambahkan ddH2O sebanyak 20 µL dan RNAse sebanyak 1 µL lalu diinkubasi pada suhu ruang selama 60 menit.
Identifikasi Isolat Bakteri Endofit dengan Marka 16S rDNA (Modifikasi Marchesi et al. 1998).
Amplifikasi gen 16S rDNA dengan teknik PCR. Sebanyak 12.5 µL kappa, 1.25 µL UFP, 1.25 µL URP, 0.5 µL MgCl2, 8.5 µL ddH2O dan 1 µL DNA dicampurkan di dalam tabung PCR hingga total volume sebanyak 25 µL. Setelah itu, sampel dimasukkan ke dalam mesin PCR dengan gen target amplifikasi 16S rDNA. Primer yang digunakan untuk amplifikasi atau penggandaan DNA adalah 27F (5’AGAGTTTGATCMTGGCTCAG’3) dan 1492R (5’CGG TTA CCT TGT TAC GAC TT’3). Proses PCR terdiri dari predenaturasi pada suhu 95oC selama 10 detik, denaturasi pada suhu 95oC 30 detik, annealing pada suhu 55oC selama 60 detik, elongasi pada suhu 72oC selama 60 detik, pasca elongasi pada suhu 72oC selama 10 menit dan pendinginan pada suhu 15oC selama 15 menit. Amplifikasi dilakukan sebanyak 27 kali selama 129 menit.
5
dalam sumur-sumur gel, ladder 1 kb sebagai marker sebanyak 2 µL dimasukkan ke dalam sumur. Setelah semua sumur terisi, sampel dielektroforesis dengan tegangan 100 V selama 30 menit. Gel direndam dalam larutan EtBr selama 5 menit kemudian dicuci dengan akuades selama 5 menit. Visualisasi hasil eletroforesis dilakukan dengan UV transluminator untuk melihat pita DNA yang terbentuk.
Penentuan susunan basa (sequencing) dan analisisnya. Penentuan susunan DNA bakteri endofit dilakukan (Genetika Science) dengan menggunakan alat ABI PRISM. Hasil sequencing dalam bentuk format AB1 diolah dengan program BioEdit 7.2.0 kemudian disimpan dalam format fasta dan diidentifikasi menggunakan program BLASTN pada situs NCBI (www.ncbi.nlm.nih.com) .
HASIL
Isolasi dan Pemurnian Isolat Bakteri Endofit
Bakteri endofit yang diisolasi dari daun sirsak (Annona muricata L.), dimurnikan dari kontaminan yang tumbuh saat bakteri ditanam. Sebanyak 31 isolat bakteri endofit yang berhasil dimurnikan, masing-masing 8 isolat dari daerah Cianjur, 13 isolat dari daerah Garut dan 10 isolat dari daerah Sukabumi (Gambar 1). Karakterisasi awal dari isolat yang diperoleh dari daun sirsak dilakukan secara morfologi. Secara kasat mata, koloni isolat bakteri endofit memiliki bentuk dan warna yang bervariasi. Beberapa isolat menunjukkan karakteristik yang berbeda baik dari bentuk, warna, dan konsistensi koloni. Rata-rata isolat menghasilkan warna putih susu dan kuning, tepian rata, dan berlendir. Namun, ada beberapa isolat yang padat tidak berlendir (Lampiran 2).
6
Uji Aktivitas Antibakteri Isolat Bakteri Endofit
Hasil uji aktivitas antibakteri dapat dihitung melalui zona bening yang terbentuk di sekitar cakram biakan bakteri. Zona bening tersebut dihitung diameternya untuk menentukan aktivitas bakteri yang paling tinggi. Sebanyak 30 isolat bakteri endofit diujikan pada empat bakteri patogen yaitu E. coli ATCC8739, S. aureus 6538, P. aeroginosa 27853, dan S. mutans XC.
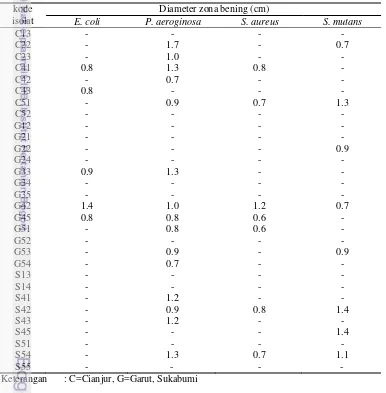
Tabel 1 Hasil Uji Aktivitas Antibakteri Isolat Bakteri Endofit
kode
Keterangan : C=Cianjur, G=Garut, Sukabumi
Sebanyak 18 isolat bakteri endofit menunjukkan adanya aktivitas antibakteri dengan terbentuknya zona bening (Tabel 1). Dari 31 isolat bakteri 15 diantaranya menunjukkan penghambatan terhadap bakteri P. aeroginosa 27853, 5 isolat terhadap E. coli ATCC8739, 7 isolat menghambat S. aureus 6538, dan 8 isolat terhadap S. mutans XC .
7
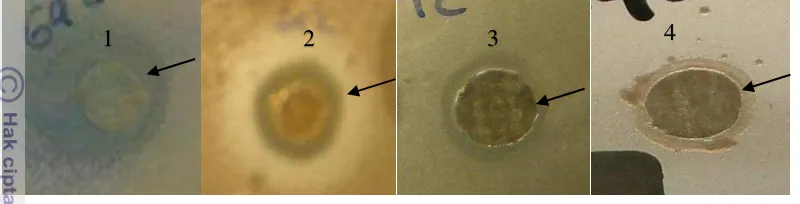
aktivitas paling tinggi dibuktikan dengan diameter zona beningnya yang lebih lebar dibandingkan isolat yang lainnya. Ekstrak isolat bakteri endofit yang berpotensi sebagai agen antibakteri diuji kembali. Ekstrak isolat kode G42 mampu menghambat pertumbuhan bakteri uji dengan menghasilkan zona bening (Gambar 3).
Gambar 2 Hasil uji antibakteri isolat kode G42 pada bakteri Staphylococcus aureus 6538 (1) dan Escherichia coli ATCC8739 (2) Pseudomonas aeroginosa 27853 (3) dan Streptococcus mutans XC (4)
Gambar 3 Zona hambat pada ekstrak isolat kode G42 pada bakteri Pseudomonas aeroginosa 27853 (1) dan Streptococcus mutans XC (2) Staphylococcus aureus 6538 (3) dan Escherichia coli ATCC8739 (4)
Isolasi DNA Genom dan Identifikasi Isolat Bakteri Endofit Potensial dengan Marka 16S rDNA
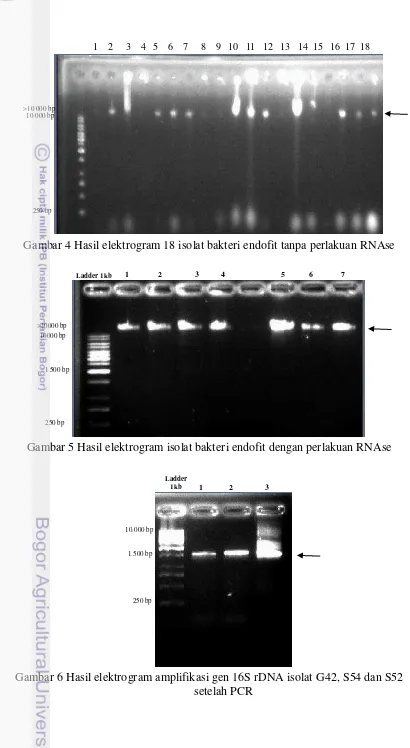
Genom total dari 18 isolat bakteri endofit berhasil di ekstraksi (Gambar 4). Marker yang digunakan adalah ladder 1kb yang memiliki ukuran pita tertinggi sebesar 10000 bp. DNA yang berhasil diekstraksi berukuran lebih dari 10000 bp karena terletak diatas pita tertinggi dari marker yang digunakan. Namun, DNA yang tervisualisasi masih memiliki ekor atau berbayang (smearing). Hal itu menandakan bahwa DNA masih memiliki pengotor berupa RNA yang bobotnya lebih kecil dari DNA. Pembersihan DNA dari RNA dilakukan dengan cara pemberian enzim RNAse. Setelah pemberian RNAse terlihat DNA tidak memiliki smearing lagi yang menandakan bahwa RNA telah terdegradasi (Gambar 5).
1 3
1 3
2 4
8
Gambar 4 Hasil elektrogram 18 isolat bakteri endofit tanpa perlakuan RNAse
Gambar 5 Hasil elektrogram isolat bakteri endofit dengan perlakuan RNAse
Gambar 6 Hasil elektrogram amplifikasi gen 16S rDNA isolat G42, S54 dan S52 setelah PCR
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
10 000 bp
250 bp >10 000 bp
250 bp >10000 bp
10000 bp
1 500 bp
250 bp 10.000 bp
1.500 bp
Ladder
1kb 1 2 3
9
Selanjutnya genom total dari tiga isolat (G42, S54, dan S42) yang memiliki aktivitas antibakteri paling tinggi diamplifikasi. Amplifikasi menggunakan marka 16S rDNA dan dengan teknik PCR. Gen 16S yang ada pada setiap bakteri memiliki ukuran 1500 bp sehingga DNA bakteri endofit yang telah diamplifikasi memiliki ukuran yang sama (Gambar 6). Isolat G42 yang memiliki aktivitas antibakteri paling tinggi sekuen DNA hasil sekuensingnya di BLAST pada web NCBI. Identifikasi sekuen DNA isolate bakteri endofit G42 93% memiliki kemiripan dengan Plautia stali symbiont (Gambar 7).
Gambar 7 Hasil BLAST sekuen isolat G42 pada website NCBI
PEMBAHASAN
Isolasi Dan Pemurnian Bakteri Endofit
Bakteri endofit dapat diisolasi dari tanaman jika organ tanaman tersebut telah di sterilisasi permukaannya dari mikroba lain. Selain itu isolasi bakteri endofit juga dapat dilakukan dengan cara mengekstraksi bagian tanaman tersebut (Mano dan Morisaki 2008). Isolasi pada penelitian ini dilakukan dengan cara mensterilkan permukaan daun sirsak dengan etanol 90% dan natrium hipoklorit (NaOCl). Jika mikroba dari permukaan daun sirsak mati maka kemungkinan besar bakteri yang tumbuh saat inkubasi adalah bakteri endofit (Barac et al. 2004). Bakteri endofit tumbuh pada media pada masa inkubasi 2 hari. Hal ini didukung oleh Zinniel et al. (2002), Simarmata (2007), Arunachalam dan Gayathri (2010), dan Jalgaonwala et al. (2010) yang menyatakan bahwa waktu pemilihan inkubasi selama minimal 2 hari bertujuan untuk memastikan bahwa bakteri yang tumbuh merupakan bakteri endofit, bukan bakteri filosfer, rizosfer atau kontaminan. Densitas bakteri endofit pada jaringan tanaman lebih kecil dibandingkan dengan densitas bakteri rizosfer (Rosenblueth dan Romero 2006).
10
mm/tahun (Yunus 2004). Ketiga kabupaten tersebut memiliki kondisi lingkungan yang baik untuk pertumbuhan tanaman sirsak sehingga menjadi daerah penghasil buah sirsak di Jawa Barat(Sunarjono 2005). Kelompok bakteri endofit yang dihasilkan dari lokasi yang berbeda akan menghasilkan endofit yang berbeda pula (Sun et al. 2013). Isolat yang diperoleh dari daun sirsak pada penelitian ini memiliki morfologi yang berbeda-beda. Berdasarkan tabel 1 morfologi isolat bakteri endofit dari ketiga daerah tersebut rata-rata berwarna kuning dan putih susu. Selain itu bakteri endofit pada satu tanaman inang umumnya terdiri atas beberapa genus dan spesies (Bhore dan Sathisha 2010).
Jumlah bakteri endofit di dalam tanaman tidak dapat ditentukan secara pasti, namun bakteri ini dapat dideteksi dengan mengisolasi pada media agar (Bacon dan Hinton 2006). Media yang digunakan merupakan BHI (Brain Heart Infusion) agar dan broth. Menurut Dwirianti (2014) BHI (Brain Heart Infusion) merupakan media non-selektif yang banyak digunakan untuk isolasi bakteri anaerob dan mikroorganisme lainnya. Media ini memiliki kandungan umum yang dibutuhkan mikroorganisme untuk tumbuh (Tabel 2). Media BHI menunjukkan hasil yang baik untuk mengisolasi bakteri endofit dari daun sirsak.
Tabel 2 Komposisi Brain Heart Infusion
Komposisi Jumlah (gram/liter)
Uji Aktivitas Antibakteri Isolat Bakteri Endofit
Ryan et al. (2008) menyatakan bahwa, bakteri endofit terdiri atas berbagai strain yang bersifat antimikroba dan memiliki aktivitas dalam menghasilkan senyawa antimikroba tersebut. Hasil uji aktivitas antibakteri dari suspensi sel terdapat 17 isolat bakteri endofit yang memiliki aktivitas antibakteri (Tabel 1). Isolat dengan kode G42 memiliki aktivitas tertinggi dengan menghambat 4 bakteri patogen yang diujikan yaitu bakteri E. coli ATCC8739, P. aeroginosa 27853 (Gram negatif), S. aureus 6538 dan S. mutans XC (Gram positif). Isolat S42 dan S54 memiliki aktivitas penghambatan terhadap tiga bakteri patogen P. aeroginosa 27853 (Gram negatif), S. aureus 6538, S. mutans XC (Gram positif). Hasil dari pengujian tersebut menunjukkan bahwa isolat bakteri endofit menghasilkan senyawa antibakteri berspektrum luas. Senyawa antibakteri berspektrum luas merupakan senyawa yang efektif untuk bakteri gram positif dan negatif (Rosidah dan Afizia 2012).
11
Tomita (2003), sekitar 10% - 30% endofit menunjukkan aktivitasantifungal atau antibakteri di dalam supernatan. Isolat bakteri endofit yang tidak mempunyai aktivitas antifungal, kemungkinan mempunyai senyawa aktif dalam jumlah kecil atau aktif melawan mikroba lain yang tidak diujikan.
Hasil penelitian ini sesuai dengan penelitian-penelitian sebelumnya tentang bakteri endofit yang menghasilkan senyawa antibakteri. Bakteri endofit seperti spesies Streptomyces dan Eubacteria memiliki aktivitas antibakteri dan anti fungi (Ghadin et al. 2008). Tanaman Vinca rosea memiliki bakteri endofit yang memiliki morfologi dan sifat biokimia yang sama dengan Bacillus coagulans dapat menghambat pertumbuhan bakteri Gram positif dan Gram negatif (Roy dan Banerjee 2010). Tanaman Piper betle L. diidentifikasi memiliki bakteri endofit yang mirip dengan genus Pseudomonas sp. yang menghasilkan senyawa 1-methyl-2,4-Imidazolidinedione sebesar (9.55%) dan dapat menghambat pertumbuhan bakteri Bacillus cereus, S.aureus, dan E. coli (Purwanto 2014). Daun binahong (Anredera cordifolia) memiliki bakteri endofit yang terindentifikasi mirip genus Pseudomonas, Bacillus, dan Staphylococcus memiliki aktivitas penghambatan terhadap E. coli dan S. aureus (Nursulistyarini 2014).
Menurut Chen et al. (2011), Taechowishan et al. (2005), dan Soca-chafre et al. (2011) bakteri endofit memiliki berbagai macam interaksi dengan tanaman inangnya. Bakteri ini bersimbiosis mutualisme dengan inangnya seperti menstimulasi respon pertahanan tanaman dengan menjaga inang dari serangan penyakit sehingga meningkatkan ketahanan hidup tanaman inangnya. Sebaliknya, bakteri endofit mendapatkan perlindungan dari bahaya lingkungan biotik dan abiotik (Hallman et al. 1997). Bakteri endofit dapat menghasilkan banyak senyawa bioaktif yang sama dengan inangnya yang dapat dijadikan obat (Irawan 2009). Isolasi DNA Genom dan Identifikasi Isolat Bakteri Endofit Potensial dengan Marka 16S rDNA
Berdasarkan hasil isolasi DNA bakteri endofit sebelum diberi RNAse, masih terdapat pengotor seperti RNA dan DNA yang tersegmentasi terlihat dari pita yang masih berbayang (smearing) (Gambar 4). Setelah pemberian RNAse terlihat
smearing pada pita DNA hilang karena terdegradasi (Gambar 5). RNAse digunakan
untuk menghilangkan komponen RNA sehingga DNA dapat diisolasi secara utuh (Rozi 2012). Penentuan ukuran DNA total dilakukan dengan membandingkan pita sampel DNA total dan marker yang digunakan. Penentuan diperoleh dari hubungan yang linier antara jarak migrasi DNA dan ukuran logaritmik dari bobot molekul DNA (Perceka 2014). Ukuran DNA berada pada ukuran diatas 10000 bp karena DNA memiliki bobot lebih besar daripada bobot marker terbesar. Adanya pita pada bagian awal proses migrasi menunjukkan bahwa DNA yang dihasilkan termasuk DNA total (Meryalita 2012).
12
hampir semua bakteri, biasanya berukuran 1500 pb dengan susunan basa yang berbeda satu sama lain. Sekuen 16S rDNA merupakan sekuen DNA pada subunit kecil ribosom bakteri. Ssekuen ini digunakan untuk mengidentifikasi isolat bakteri berdasarkan tingkat homologi sekuen DNA karena bersifat spesifik pada organisme prokariot (Perceka 2014).
Berdasarkan identifikasi menggunakan program BLAST pada situs NCBI isolat bakteri endofit G42 memiliki kemiripan paling dekat dengan Plautia stali
symbiont yaitu bakteri yang bersimbiosis dengan hewan Plautia stali. Nilai E-value
yang dihasilkan bernilai 0 yang artinya isolat identik dengan spesies pembandingnya. Nilai max identity sebesar 93% mengindikasikan bahwa isolat bakteri endofit G4.2 dan Plautia stali symbiont dianggap sebagai genus yang sama. Hal ini sesuai dengan (Drancourt 2000) bahwa berdasarkan data urutan gen 16S
rDNA, homologi ≥ 93% dapat dinyatakan bahwa isolat yang dibandingkan berada
pada family yang sama. Plautia stali adalah hama yang menyerang pohon buah-buahan di Jepang. Serangga ini memiliki ekstraseluler simbion di sekum lambung, pada permukaan posterior pertengahan usus (Abe et al. 1995). Berdasarkan hasil identifikasi isolat bakteri endofit pada daun sirsak teridentifikasi 93% serupa dengan spesies Plautia stali symbiont yang merupakan simbion pada serangga Plautia stali.
SIMPULAN DAN SARAN
Simpulan
Isolasi bakteri endofit daun sirsak (Annona muricata L.) dari tiga daerah (Garut, Cianjur, Sukabumi) telah berhasil dilakukan dengan jumlah 31 isolat. Isolat tersebut terdiri atas 13 isolat dari Garut, 10 isolat dari Sukabumi dan 8 isolat dari Cianjur.Terdapat 17 isolat bakteri endofit yang menunjukkan aktivitas terhadap patogen uji.Isolat dengan kode G42 memiliki aktivitas paling tinggi ditunjukkan dengan kemampuan menghambat keempat patogen uji yaitu E. coli ATCC8739, S. aureus 6538, P. aeroginosa 27853, dan S. mutans XC. Bakteri endofit isolat G42 memiliki persentase kemiripan sebesar 93% dengan spesies Plautia stali symbiont yang merupakan simbion pada serangga Plautia stali.
Saran
Perlu dilakukan isolasi dan identifikasi senyawa yang memiliki aktivitas antibakteri dari isolate G42 sehingga dapat dihasilkan senyawa murni yang dapat dijadikan sebuah produk antibakteri.
DAFTAR PUSTAKA
13
Adjie S. 2011. Dahsyatnya Sirsak Tumpas Penyakit. Jakarta (ID): Pustaka Bunda Adri D, Wikanastri H. 2013. Aktivitas antioksidan dan sifat organoleptik teh daun
sirsak (Annona muricata Lin.) berdasarkan variasi lama pengeringan. J Pangan Gizi.(7):12-17
Arunachalam C, Gayathri P. 2010. Studies on bioprospecting of endophytic bacteria from the medicinal plant of Andrographis paniculata for their antimicrobial activity and antibiotic susceptibility pattern. Int J of Curr Pharm. Res. 2 (4) : 63-68.
Asprey GF, Thornton P. 2000. Medical plants of Jamaica Part 1-11.West Indian Journal2 : 1-86.
Beck HC, Hansen AM, Lauritsen FR. 2003. Novel pyrazine metabolites found in polymyxin biosynthesis by Paenibacillus polymyxa. FEMS Microbiol Lett 220: 67–73. Di dalam : Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. 2008. Bacterial endophytes: recent developments and applications Mini Review. FEMS Microbiol Lett 278 : 1–9.
Chen XY, Qi YD, Wei JH, Zhang Z, Wang DL, Feng JD, Gan BC. 2011. Molecular identification of endophytic fungi from medicinal plant Huperzia serrata based on rDNA ITS analysis. World J. Microbiol Biotechnol. 27:495-503. Bacon CW, Hinton DM. 2006. Bacterial endophytes : the endophytic niche, its
occupants, and its utility. Di dalam : Gnanamanickam SS, editor. Plant- Associated Bacteria.Netherland : Springer.
Barac T, Taghavi S, Borremans B, Provoost A, Oeyen L, Colpaert JV,Vangronsveld J, Ledie VD. 2004. Engineered endophytic bacteria improve phytoremediation of water-soluble, volatile, organicpollutants. Nat
Biotechnol.22:583–588.
Baskar R, Rajeswari V, Kumar TS. 2007. In vitro antioxidant studies in leaves of annona species. Indian J Exp Biol.45(5):480-5
Bhore SJ, Sathisha G. 2010. Screening of endophytic colonizing bacteria for cytokinin-like compounds: crude cell-free broth of endophytic colonizing bacteria is unsuitable in cucumber cotyledon bioassay. World J. Agric. Sci. 6 (4): 345-352.
[BPS] Bada Pusat Statistik Kabupaten Sukabumi. Kabupaten Sukabumi Dalam Angka 2012. Sukabumi (ID): Badan Pusat Statistik.
Desriani, Kusumawati DE, Rivai A, Hasanah N, Amrinola W, Triratna L, Sukma A. 2013. Potential endophytic bacteria for increasing paddy var rojolele productivity. Int. J. on Adv. Sci., Eng. and Information Tech. 3 (1) : 76-78. Dwirianti R. 2014. Label Cerdas Pendeteksi Escherichia coli Dari Berbagai
Indikator Warna [Skripsi]. Bogor (ID): Institut Pertanian Bogor
Ghadin, N, Zin, N. M., Sabaratnam, V., Badya, N., Basri, D. F., Hing, H. L. and Sidik, N. M. 2008. Isolation and characterization of a novel endophytic Streptomyces SUK06 with antimicrobial activity from Malaysian plant.Asian J. Plant Sci 7:2:189-194.
Gajalakshmi S, Vijayalakshmi S, Devi RV. 2012. Phytochemical and pharmacological properties of Annona muricata: A Review. Inter J. PPS. 4(2): 5.
14
Haniah M. 2008. Isolasi Jamur Endofit dari Daun Sirih (Piper betle L.) Sebagai Antimikroba Terhadap Escherichia coli, Staphylococcus aureus, dan Candida albicans [Skripsi].Malang (ID): Universitas Islam Negeri Malang Hermawan GP, Laksono H. 2013. Ekstraksi daun sirsak (Annona muricata L.)
menggunakan pelarut etanol. J Teknol Kim Indust. 2(2):111-115
Irawan D. 2009.Isolasi Aktinomiset Endofit Tanaman Obat yang Berpotensi Sebagai Antidiabetes Melalui Kajian AktivitasΑ-Glukosidase[Skripsi].Bogor (ID): Institut Pertanian Bogor
Jalgaonwala RE, Mohite BV, Mahajan RT. 2010. Evaluation of endophytes for their antimicrobial activity from indigenous medicinal plants belonging to north maharashtra region India. Int. J. Pharm and Biomed Res. 1 (5) : 136-141. Krisnaningsih MMF, Asmara W, Wibowo MH. 2005. Uji sensitifitas isolasi
Escherichia coli patogen pada ayam terhadap beberapa jenis antibiotik. J Sains Vet. 1:13-18
Lans CA. 2006. Ethnomedicines used in Trinidad and Tobago for urinary problems and diabetes mellitus. J. Ethnobiol Ethnomed 2:45-55.
Latupeirisa Y. 2014.Seleksi Dan Identifikasi Bakteri Bermanfaat Asal Tanaman Pisang Tongkat Langit (Musa troglodytarum L.) Untuk Mengendalikan Penyakit Darah Pisang[Tesis].Bogor (ID): Institut Pertanian Bogor.
Lim JS, Choi BS, Choi AY, Kim KD, Kim DI, Choi IY, Ka JO. 2012. Complete genome sequence of the fenitrothion-degrading Burkholderia sp. Strain YI23. J.Bacteriol.194:896-896.
Mano H, Morisaki H. 2008. Minireview: Endophytic bacteria in the rice plant.
Microbes and Environments.23:109-117.
Marchesi JR et al. 1998. Design and evaluation of useful bacterium specific PCR primer that amplify genes coding for bacterial 16SrRNA. Appl Environ Microbiol 64:795-799.
Meryalita R. 2012. Analisis Keragaman Genetik Kunyit (Curcuma Longa Linn) Dan Temulawak (Curcuma Xanthorrhiza Roxb.) Budidaya Tanah Jawa Berdasarkan Penanda Molekuler RAPD [Skripsi]. Bogor (ID): Institut Pertanian Bogor
Nadji G, Remadi JP, Coviaux F. 2005. Comparison of clinical and morphological characteristics of Staphylococcus aureus endocarditis with endocarditis caused by other pathogens.Heart 91 : 932-937.
Nursulistyarini F. 2014. Isolasi dan Identifikasi Bakteri Endofit Penghasil Antibakteri dari Daun Tanaman Binahong (Anredera ccordifolia (Ten.) steenis) [Skripsi].Yogyakarta (ID): Universitas Negeri Sunan Kalijaga
Nurlita AI. 2012. Identifikasi Aktinomiset Endofit Asal Tanaman Obat Berdasarkan 16s rDNA[Skripsi]. Fakultas Bogor (ID): Institut Pertanian Bogor.
Orwa C, Mutua A , Kindt R , Jamnadass R, Simons A. 2009. Agroforestree Database:a tree reference and selection guide version 4.0
Perceka RM. 2014. Identifikasi Bakteri Endofit Isolat Biogen Cc-E76 Dengan Teknik PCR 16s rDNA[Skripsi]. Bogor (ID): Institut Pertanian Bogor
15
Qiao H, Huang L, Kang Z. 2006. Endophytic bacteria isolated from wheat and their antifungal activities to soil-borne disease pathogens. Ying Yong Sheng Tai Xue Bao. 17(4):690-4
Radji M. 2005. Peranan Bioteknologi dan Mikroba Endofit dalam Pengembangan Obat Herbal.MIK. 2(3):113-126.
Rahman MN. 2009. Aktivitas Antibakteri Senyawa Hasil Biotransformasi Kurkumin OlehMikrob Endofit Asal Kunyit[Skripsi].Bogor (ID): Institut Pertanian Bogor
Ramadhani M. 2010. Kuantifikasi Daun Dari Tanaman Berkayu Di Pekarangan Studi Kasus Di Desa Wangunjaya Kecamatan Cugenang Kabupaten Cianjur[Skipsi].Bogor (ID): Institut Pertanian Bogor
Rosenblueth M, Romero EM. 2006. Bacterial endophytes and their interactions with hosts. Mol Plant-MicrobeInteractions 19(8):827-837.
Rosidah, Afizia WM. 2012. Potensi ekstrak daun jambu biji sebagai antibakterialuntuk menanggulangi serangan bakteri Aeromonas hydrophila pada ikan gurame (Osprhonemus gouramy lacepede). J Akuatika. 3(1): 19-27 Roy S, Banerjee D. 2010.Isolation Of Antimicrobial Compound By Endophytic Bacteria FromVinca Rosea. International Journal of Current Research.5:47-51
Rozi F. 2012. Karakterisasi Gen hdc Pengkode Histidin Dekarboksilase Isolat Bakteri Ikan Tongkol Dan Tenggiri Dengan Metode Berbasis PCR[Skripsi].Bogor (ID): Institut Pertanian Bogor
Ryan RP, Germaine K, Franks A, Ryan DJ , Dowling DN. 2008. Mini Review : Bacterial endophytes: recent developments and applications. FEMS Microbiol Lett 278:1–9.
SIFIN. 2006. Brain heart infusion broth.
wwwhttp://www.sifin.de/english/produktinfo/brain-heart-infusion-broth-tn1216.pdf. [Internet]. [diunduh 2015 Februari 26].
Safdar N, Bradley EA. 2008. The risk of infections after nasal colonization with
Staphylococcus aureus.The American Journal of Medicine 121 : 310-315.
Simarmata R, Lekatompessy S, Sukiman H. 2007. Isolasi mikroba endofitik dati tanaman obat sambung nyawa (Gymura procumbens) dan analisis potensinya sebagai antimikroba.Berk Penel Hayati 13 : 85-90.
Soca-Chafre G, Rivera-orduna FN, Hidalgo-lara ME, Hernandez-rodriguez C, Marsch R, Flores-cotera LB. 2011. Molecular phylogeny and paclitaxel screening of fungal endophytes from Taxus globosa.Fungal. Biol. 115:143-256.
Sun H, Yen H, Qing Xiao, Renyuan Y, Yongqiang T. 2013. Isolation, characterization, and antimicrobial activity of endophytic bacteria from Polygonum cuspidatum. Academic J. 7(16): 1496-1504
Sunarjono H. 2005. Sirsak dan Srikaya : Budi Daya untuk Menghasilkan Buah Prima. Bogor (ID): Penebar Swadaya.
Taechowisan T, Lu C, Shen Y, Lumyong S. 2005. Secondary metabolites from endophytic Streptomyces aureofaciens CMUAc130 and their antifungal activity.Microbiology.151:1691-1695
16
Veling J, H.W Barkema, J. van der Schans, F. van Zijderverld, J. Verhoeff. 2002. Herdlevel diagnosis for Salmonella enterica subsp. enterica serovar Dublin infection in bovine dairy herds. Prev. Vet. Med. 14: 31-42.
Vieira GHF, Mourao JA, Angelo AM, Costa RA. 2010. Antibacterial effect (in vitro) of moringa oleifera and Annona muricata against gram positive and gram negative bacteria. Rev. Inst. Med. Trop52(3): 129.
Willcox MDP. 2007. Pseudomonas aeruginosa Infection and Inflammation During Contact Lens Wear : A Review. Optometry and Vision Science 84 (4) : 273-278.
Xiao J1, Zhang Q, Gao YQ, Tang JJ, Zhang AL, Gao JM. 2014. Secondary metabolites from the endophytic Botryosphaeria dothidea of Melia azedarach and their antifungal, antibacterial, antioxidant, and cytotoxic activities. J Agric Food Chem. 62(16):3584-90
Yunus ML. 2004.Faktor-Faktor Yang Berpengaruh Terhadap Pembukaan Lahan Di Hutan Lindung Dra3ad Kecamatan Pasir Wangi, Kabupaten Garut[Tesis].Bogor (ID): Institut Pertanian Bogor
Zaenab, Mardiastuti HW, Anny VP, Logawa B. 2004. Uji antibakteri siwak (Salvadora persica Linn.) terhadap Streptococcus mutans (ATC31987) dan Bacteroides melaninogenicus. MAKARA Kesehatan 8(2):37-40
Zhang SM, Sha CQ, Wang YX, Li J, Zhao XY, Zhang XC. 2008. Isolation and characterization of antifungal endophytic bacteria from soybean. J Microbiol. 35(10):1593-1599
Zheng K, N Huang, J Bennett, GS Khush. 1995. PCR-based marker assisted selection in rice breeding. IRRI discussion paper series No. 12. International Rice Research Institute, P. O. Box 933, Manila, Philippines.
17
LAMPIRAN
Isolasi bakteri endofit
Isolat bakteri endofit
Uji aktivitas antibakteri
Aktivitas antibakteri (zona bening)
Isolasi DNA genom
DNA genom
Amplifikasi menggunakan mesin PCR
Kekerabatan isolat Sekuensing DNA
Urutan basa DNA
18
Lampiran 2 Morfologi koloni isolate bakteri endofit
Ket: C ( Cianjur), G (Garut), S (Sukabumi), 1,2,3 (ulangan) *interaksi ditandai dengan terbentuknya zona hambat Kode
isolat
19
Lampiran 3 Isolar bakteri endofit dari tiga daerah
Gambar isolat bakteri endofit asal Cianjur
Gambar isolat bakteri endofit asal Garut
20
Lampiran 4 Komposisi larutan yang digunakan Kalium Asetat
TAE (Tris-Asetat-EDTA) 50x
Buffer ekstrak
Kappa 2G Fast ReadyMix yang diproduksi oleh KAPABIOSYSTEM
3 M Kalium 5 M Asetat pH 4.8 242 g basa Tris 57.1 mL Asetat glasial 100 mL 0.5 M EDTA Ph 8 100 mM Tris HCl 10 mL 100 mM EDTA 20 mL 250 mM NaCl 5 mL 1 % SDS 5 mL 1 % PVP 1 g
DNA polimerase 0.5 U per 25 µL reaksi
Buffer PCR dNTPs 0.2 mM
21
23
25
Lampiran 7 Sekuen DNA isolat G42
26
RIWAYAT HIDUP
Penulis merupakan anak bungsu dari H. Suwaji dan Hj. Rahma Morawati yang dilahirkan di Pekanbaru pada tanggal 14 Januari 1993. Tahun 2011 penulis lulus dari SMAN 1 Pekanbaru dan ditahun yang sama diterima di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur masuk SNMPTN undangan.
Selama masa perkuliahan, penulis menjadi asisten praktikum mata kuliah Mikrobiologi Dasar pada tahun ajaran 2013/2014 dan Biokimia umum tahun ajaran 2014/2015.Penulis aktif dalam organisasi Dewan Perwakilan Mahasiswa 2011/2012, Badan Eksekutif Mahasiswa FMIPA 2012/2013, dan Badan Eksekutif Mahasiswa Keluarga Mahasiswa IPB 2013/2014. Selain itu penulis pernah meraih prestasi sebagai karya penulisan terbaik oleh Republika Online pada acara “The 6th Journalistic Fair” tahun 2013dan proposal penelitian berjudul “Uji nanopropolis sebagai antibakteri infeksius Klebsiella pneumonia terhadap model zebra fish” yang didanai oleh dikti dalam Pekan Kreativitas Mahasiswa tahun 2015.