RESPONS IMUN DAN DINAMIKA MIKROBA DALAM
BUDIDAYA IKAN LELE
Clarias
sp. SUPER INTENSIF
BERBASIS BIOFLOK DENGAN PENAMBAHAN
BAKTERI L1k
SEPTI NOVIA ALFIANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Respons Imun dan Dinamika Mikroba dalam Budidaya Ikan Lele Clarias sp. Super Intensif Berbasis Bioflok dengan Penambahan Bakteri L1k” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Septi Novia Alfiani
ABSTRAK
SEPTI NOVIA ALFIANI. Respons Imun dan Dinamika Mikroba dalam Budidaya Ikan Lele Clarias Sp. Super Intensif Berbasis Bioflok dengan Penambahan Bakteri L1k. Dibimbing oleh MUNTI YUHANA dan WIDANARNI
Kegiatan budidaya ikan lele (Clarias sp.) super intensif memicu tingginya limbah buangan senyawa nitrogen di dalam perairan. Penelitian ini menggunakan teknologi bioflok dengan penambahan bakteri heterotrofik (Staphylococcus lentus/L1k). Tujuan utama penelitian ini adalah untuk mengevaluasi efek dosis bakteri heterotrofik yang diberikan dan kaitannya dengan gambaran hematologi ikan uji serta menganalisis dinamika mikroba dalam budidaya super intensif. Perlakuan yang diberikan yaitu kontrol (positif dan negatif), teknologi bioflok dengan penambahan bakteri L1k 102 CFU ml-1 (perlakuan A), 104 CFU ml-1 (perlakuan B), 106 CFU ml-1 (perlakuan C). Hasil penelitian menunjukkan bahwa tidak adanya korelasi langsung terhadap gambaran hematologi dan dinamika mikroba dari semua perlakuan. Dosis 104 CFU ml-1 memberikan kelangsungan hidup dan laju pertumbuhan harian terbaik dari semua perlakuan, masing-masing yaitu 92,00% dan 6,07%.
Kata kunci : bioflok, hematologi, heterotrofik, ikan lele, super-intensif
ABSTRACT
SEPTI NOVIA ALFIANI. Immune Response and Microbial Dynamics of Biofloc-based Super Intensive Catfish (Clarias sp.) Culture by Addition of L1k Bacterial. Supervised by MUNTI YUHANA and WIDANARNI.
Super intensive catfish (Clarias sp.) culture may result in toxic nitrogen wastes into their environment. In this study, biofloc-based catfish culture was applied by addition of heterotrophic bacterial cells (Staphylococcus lentus/L1k). The main purpose of this research was to evaluated the effects of addition of heterotrophic bacterial at different dosages and its correlations with hematological profiles and to analyze the microbial dynamics of biofloc-based super intensive culture. The treatments applied in this research consisted of positive and negative controls, biofloc-based system by addition of L1k heterotrophic cells of 102 CFU ml-1 (A treatment), 104 CFU ml-1 (B treatment), and 106 CFU ml-1 (C treatment). The results showed that there were no direct correlations on fish hematological profiles and microbial dynamics of all treatments. Dosage of 104 CFU ml-1 showed the best survival rate and daily growth rate among the treatments i.e 92.00% and 6.07%, respectively.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
SEPTI NOVIA ALFIANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
RESPONS IMUN DAN DINAMIKA MIKROBA DALAM
BUDIDAYA IKAN LELE
Clarias
sp. SUPER INTENSIF
Judul Skripsi : Respons Imun dan Dinamika Mikroba dalam Budidaya MIkan Lele Clarias sp. Super Intensif Berbasis Bioflok Bdengan Penambahan Bakteri L1k
Nama : Septi Novia Alfiani
NIM : C14100097
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr. Munti Yuhana, S.Pi, M.Si Pembimbing I
Dr. Ir. Widanarni, M.Si Pembimbing II
Diketahui oleh
Dr. Ir. Sukenda, M.Sc Ketua Departemen
PRAKATA
Puji syukur kehadirat Allah SWT yang senantiasa melimpahkan rahmat dan karuniaNYA, sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “Respons Imun dan Dinamika Mikroba dalam Budidaya Ikan Lele Clarias sp. Super Intensif Berbasis Bioflok dengan Penambahan Bakteri L1k”. Penelitian dilaksankan pada bulan Desember 2013 sampai Januari 2014, bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ungkapan terimakasih penulis ucapkan kepada:
1. Ibu Dr. Munti Yuhana, S.Pi, M.Si dan ibu Dr. Ir. Widanarni, M.Si selaku dosen pembimbing skripsi yang telah memberikan banyak arahan serta bimbingan selama ini.
2. Bapak Dr. Ir. Muhammad Agus Suprayudi, M.Si selaku dosen penguji tamu dan bapak Dr. Alimuddin, S.Pi, M.Sc. selaku dosen perwakilan dari komisi pendidikan departemen BDP atas kritik dan saran untuk perbaikan skripsi. 3. Bapak Prof. Dr. D. Djokosetiyanto, DEA selaku dosen pembimbing akademik
yang memberikan banyak nasehat dan motivasi.
4. Keluarga tercinta, Ayahanda Rifai dan Ibunda Siti Qomariah, adik-adikku (Arindina dan Aditya) serta semua keluarga yang selama ini telah memberikan
kasih sayang, do’a dan dukungannya.
5. Kak Salamah dan kak Yusuf sebagai satu tim penelitian yang senantiasa membantu dan memberikan semangat dalam penyelesaian penelitian.
6. Bapak Ranta di Laboratorium Kesehatan Ikan yang mendukung selama penelitian, serta semua laboran Pak Wasjan, Mbak Retno, Pak Jajang, Kang Abe.
7. Teman-teman LKI 47 khususnya Ike Dewi, Sita Panca Rini, Enrika Lidiawati, Nadia Aulia, dan Euis Rakhmawati yang membantu serta mendukung selama penelitian.
8. Semua teman-teman BDP 47 yang telah memberikan pengalaman pertemanan, persahabatan sekaligus persaudaraan yang tidak akan pernah bisa dilupakan.
Semoga karya tulis ini dapat bermanfaat bagi para pembaca.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
METODOLOGI ... 2
Rancangan penelitian ... 2
Persiapan wadah dan hewan uji ... 2
Persiapan bakteri heterotrofik ... 3
Prosedur penambahan molase ... 3
Parameter pengamatan ... 3
Analisis data ... 5
HASIL DAN PEMBAHASAN ... 6
Hasil ... 6
Pembahasan ... 11
KESIMPULAN DAN SARAN ... 14
Kesimpulan ... 14
Saran ... 15
DAFTAR PUSTAKA ... 15
LAMPIRAN ... 17
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1. Kadar hematokrit ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k ... 6 2. Kadar hemoglobin ikan lele (Clarias sp.) dalam budidaya super
intensif berbasis bioflok dengan penambahan bakteri L1k ... 7 3. Total eritrosit ikan lele (Clarias sp.) dalam budidaya super intensif
berbasis bioflok dengan penambahan bakteri L1k ... 7 4. Total leukosit ikan lele (Clarias sp.) dalam budidaya super intensif
berbasis bioflok dengan penambahan bakteri L1k ... 8 5. Dinamika populasi bakteri total pada media pemeliharaan ikan lele
(Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k ... 9 6. Dinamika populasi bakteri heterotrofik L1k (Staphylococcus lentus)
pada media pemeliharaan ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k ... 9 7. Kelangsungan hidup ikan lele (Clarias sp.) dalam budidaya super
intensif berbasis bioflok dengan penambahan bakteri L1k ... 8. Laju pertumbuhan harian ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k ...
10 11
1. Perhitungan penambahan molase dalam budidaya ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k .. 17 2. Prosedur parameter gambaran hematologi dalam budidaya ikan lele
(Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k ... 17 3. Hasil uji ANOVA terhadap kelangsungan hidup ikan lele (Clarias
sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k .. 18 4. Hasil uji lanjut Duncan terhadap kelangsungan hidup ikan lele
(Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k ... 18 5. Hasil uji ANOVA terhadap laju pertumbuhan harian ikan lele
6. Hasil uji lanjut Duncan terhadap laju pertumbuhan harian ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k ... 19 7. Persentase diferensial leukosit dalam budidaya ikan lele dumbo
(Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k ... 19 8. Populasi bakteri L1k pada media pemeliharaan sebelum perlakuan
1
PENDAHULUAN
Ikan lele (Clarias sp.) merupakan komoditas perikanan air tawar yang banyak dibudidayakan di Indonesia. Teknologi budidaya ikan ini sudah banyak dikuasai oleh masyarakat. Lele termasuk ikan yang tahan terhadap perubahan lingkungan, selain itu memiliki pertumbuhan yang relatif lebih cepat. Menurut Data Statistik Perikanan Indonesia, jumlah produksi ikan lele pada setiap tahunnya selalu meningkat yaitu dari 75 ribu ton tahun 2006 hingga mencapai 200 ribu ton pada tahun 2010. Data terakhir menunjukkan bahwa jumlah produksi ikan lele di Indonesia mencapai 330 ribu ton pada tahun 2011 (Sidatik 2014). Permintaan ikan lele yang semakin tinggi telah mendorong peningkatan usaha budidaya. Dalam hal ini, dapat menggunakan sistem super intensif dengan menerapkan teknologi bioflok.
Budidaya super intensif merupakan sistem budidaya dengan padat tebar tinggi. Menurut Ebeling et al. (2006), sistem intensif berarti melakukan budidaya dengan kepadatan tinggi, pemberian pakan berprotein tinggi, dan mengelola kualitas air dengan baik. Padat tebar untuk sistem budidaya super intensif yaitu lebih dari 500 ekor m-2, sistem intensif 80-125 ekor m-2, sistem semi intensif 30-80 ekor m-2, dan sistem tradisional kurang dari 10 ekor m-2 (Banun et al. 2007). Peningkatan jumlah pakan protein tinggi bisa menurunkan kualitas air. Menurut Avnimelech (1999), ikan hanya mampu memanfaatkan sekitar 25% dari pakan yang diberikan sedangkan sisanya diekskresikan dalam bentuk amonia dan dibuang dalam bentuk feses. Apabila pakan yang diberikan semakin banyak karena padat tebar juga tinggi, maka dapat menyebabkan limbah amonia semakin tinggi pula. Salah satu usaha untuk mengatasi limbah budidaya yang tinggi dapat menggunakan teknologi bioflok.
Prinsip dari teknologi bioflok adalah mengelola kualitas air yang didasarkan pada kemampuan bakteri heterotrof untuk memanfaatkan N organik dan anorganik yang terdapat di dalam air (Ekasari 2009). Penerapan teknologi ini dilakukan dengan penambahan C organik sebagai sumber karbon yang akan dikonversi menjadi biomassa mikroba heterotrofik sebesar 40-60% (Avnimelech 1999). Bakteri heterotrofik tersebut memanfaatkan C organik yang ditambahkan serta N yang ada di dalam perairan untuk membentuk biomassa bakteri berupa flok yang selanjutnya dapat dimanfaatkan kembali oleh organisme budidaya. Peningkatan absorbsi nitrogen oleh bakteri heterotrofik yang dapat menurunkan jumlah amonia di air lebih cepat dibandingkan bakteri nitrifikasi. Hal tersebut disebabkan laju pertumbuhan dan hasil biomassa mikroba per unit substrat dari bakteri heterotrofik 10 kali lebih tinggi daripada bakteri nitrifikasi (Hargreaves 2006).
2
Padat tebar tinggi yang diiringi limbah nitrogen yang semakin meningkat dapat menyebabkan timbulnya penyakit. Hal tersebut diperlukan adanya metode alternatif untuk menjaga lingkungan mikroba dalam sistem akuakultur agar tetap stabil, salah satunya dengan penambahan inokulan heterotrofik. Salah satu jenis bakteri heterotrofik yang dapat dimanfaatkan adalah Staphylococcus lentus. Bakteri ini bersifat non-patogenik dan proteolitik yang artinya memiliki enzim protease ekstraseluler sehingga akan dapat memecah protein menjadi senyawa-senyawa yang lebih sederhana (Firdaus 2012).
Proliferasi sel mikroba yang sifatnya heterotrofik akibat penambahan karbon organik secara simultan dapat mengurangi senyawa nitrogen anorganik berbahaya dalam air. Bakteri heterotrofik berperan sebagai bakteri menguntungkan dalam mendegradasi bahan organik, meningkatkan kualitas air, mengurangi pencemaran, mengurangi nitrogen anorganik, meningkatkan kekebalan tubuh sehingga akan dapat meningkatkan produksi akuakultur (Sahu et al. 2008). Tujuan utama penelitian ini adalah untuk mengevaluasi efek dosis dan kaitannya dengan respons imun (status kesehatan) ikan lele serta menganalisis dinamika mikroba dalam sistem budidaya super intensif berbasis bioflok, dan kelangsungan hidup serta pertumbuhan harian sebagai parameter penunjang.
METODE
Rancangan Penelitian
Penelitian ini terdiri atas 5 (lima) perlakuan dengan masing-masing 3 (tiga) kali ulangan. Perlakuan tersebut meliputi :
1. Budidaya ikan lele super intensif tanpa bioflok dan tanpa inokulan heterotrofik (K-)
2. Budidaya ikan lele super intensif + bioflok, tanpa inokulan heterotrofik (K+) 3. Budidaya ikan lele super intensif + bioflok + bakteri heterotrofik dengan
Persiapan Wadah dan Hewan Uji
3
Persiapan Bakteri Heterotrofik
Bakteri heterotrofik yang digunakan adalah L1k (Staphylococcus lentus), yang diisolasi dari usus ikan lele (Firdaus 2012) dan sudah dikarakterisasi (Hasibuan 2013). Bakteri tersebut dibuat resisten terhadap antibiotik rifampisin yang dijadikan sebagai penanda molekuler untuk membedakan bakteri yang telah diinokulasi dengan bakteri lain yang ada pada wadah pemeliharaan.
Kultur bakteri L1k dilakukan pada media Triptic Soy Agar (TSA) yang diinkubasi selama 24 jam pada suhu ruang. Selanjutnya bakteri diinokulasi pada media Triptic Soy Broth (TSB) untuk kemudian diletakkan pada waterbath selama 24 jam dengan suhu 29-30oC. Hasil kultur cair L1k didapatkan kepadatan 108 CFU ml-1. Kultur cair tersebut digunakan sebagai bakteri heterotrofik yang akan ditambahkan ke dalam media pemeliharaan sesuai dengan kepadatan yang diinginkan yaitu 106 CFU ml-1, 104 CFU ml-1, dan 102 CFU ml-1. Pada setiap akuarium ditambahkan 1 ml inokulan bakteri dalam 100 L air, dan dilakukan setiap minggu sekali.
Prosedur Penambahan Karbon
Bahan yang digunakan sebagai sumber karbon adalah molase dengan persentase kadar karbon sebesar 35%. Penambahan molase dilakukan setiap hari dengan cara menuangkan molase yang sudah diencerkan ke dalam media pemeliharaan. Perhitungan penambahan molase berdasarkan De Schryver et al. (2008) (Lampiran 1).
Parameter Pengamatan
Parameter yang diamati selama penelitian meliputi analisis hematologi, perhitungan populasi bakteri, kualitas air, tingkat kelangsungan hidup, dan laju pertumbuhan harian.
Analisis Hematologi
Parameter gambaran hematologi yang diamati meliputi kadar hematokrit, kadar hemoglobin, jumlah sel darah merah dan sel darah putih, serta diferensial leukosit. Prosedur pengamatan tertera pada Lampiran 2.
Kadar Hematokrit (He)
Kadar hematokrit dihitung berdasarkan Anderson dan Siwicki (1993) dengan rumus :
Hematokrit Keterangan :
4
Kadar Hemoglobin (Hb)
Prosedur kadar hemoglobin digunakan metode Sahli (Wedemeyer dan Yasutake 1997) dengan melihat pada skala jalur kuning (g%) yang menunjukkan banyaknya hemoglobin dalam gram per 100 ml darah.
Total Sel Darah Merah (eritrosit)
Menurut Blaxhall dan Daisley (1973), total eritrosit dapat dihitung dengan rumus :
∑ Eritrosit =∑ sel terhitung x x faktor pengencer
Total Sel Darah Putih (leukosit)
Menurut Blaxhall dan Daisley (1973), total leukosit dapat dihitung dengan rumus :
∑ Leukosit = ∑ sel terhitung x x faktor pengencer
Diferensial Leukosit
Differensial leukosit dapat dihitung dengan rumus sebagai berikut (Amlacher 1970) :
% Limfosit = ∑
x 100% % Monosit = ∑
x 100% % Neutrofil = ∑
x 100%
Perhitungan Populasi Bakteri Total dan Bakteri L1k pada Media Pemeliharaan
Penghitungan populasi bakteri total dan bakteri L1k pada media pemeliharaan dilakukan setiap 3 hari sehari. Sampel air dari media pemeliharaan (Perlakuan K+, perlakuan A, B, dan C) diambil 1 ml. Selanjutnya dilakukan pengenceran berseri dari 10-1 sampai 10-9 dengan mengambil 0,1 ml dari media pemeliharaan dan dimasukkan dalam media pengencer pertama yang berisi 0,9 ml larutan PBS (Phosphate Buffered Saline), kemudian dari media pengencer pertama diambil 0,1 ml dan dimasukkan ke dalam media pengencer kedua sampai media pengencer terakhir. Setiap pengenceran diambil 0,1 ml untuk selanjutnya disebar ke dalam media TSA (penghitungan populasi bakteri total) dan media TSA+Rifampisin (penghitungan populasi bakteri L1k). Populasi bakteri yang tumbuh ditentukan dalam colony forming unit (CFU) setelah diinkubasi selama 24 jam pada suhu ruang dan dapat dihitung dengan rumus :
Populasi bakteri = jumlah koloni x
5
Kualitas Air
Parameter kualitas air yang diamati selama penelitian meliputi pH dan DO yang dilakukan setiap hari, sedangkan amonia, nitrit, dan nitrat dilakukan setiap 1 minggu sekali.
Kelangsungan Hidup
Kelangsungan hidup merupakan persentase ikan lele yang hidup selama pemeliharaan, dapat dihitung dengan rumus sebagai berikut (Effendie 1997) :
KH =
x 100 Keterangan :
KH = Ttingkat kelangsungan hidup (%)
Nt = Jumlah lele pada akhir pemeliharaan (ekor) No = Jumlah lele pada awal pemeliharaan (ekor)
Laju Pertumbuhan Harian
Laju pertumbuhan harian dihitung dengan menggunakan rumus berdasarkan Huissman (1987):
[√ ]
Keterangan :
= Laju pertumbuhan harian (%)
Wt = Bobot rata-rata lele pada akhir perlakuan (g) Wo = Bobot rata-rata lele pada awal pemeliharaan (g) t = Periode pemeliharaan (hari)
Analisis Data
6
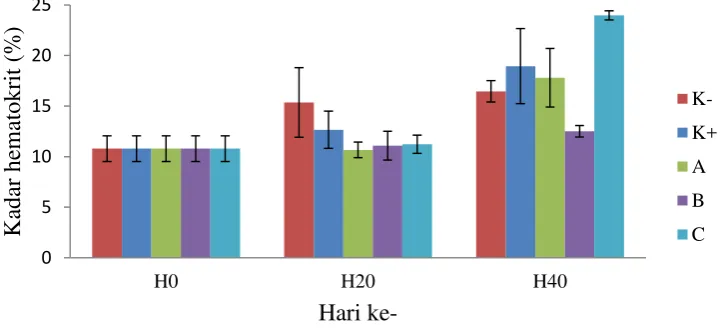
Hasil pengukuran kadar hematokrit yang dilakukan pada awal, tengah, dan akhir selama pemeliharaan yang disajikan pada Gambar 1. Pada pengukuran awal (H0) kadar hematokrit rata-rata mencapai 10,79%. Hari ke-20 nilai kadar hematokrit cenderung turun kecuali perlakuan K- yang memiliki nilai tertinggi yaitu 15,35%. Pada akhir pemeliharaan (H40) terjadi peningkatan kadar hematokrit dengan nilai tertinggi terdapat pada perlakuan C sebesar 23,97% dan nilai terendah terdapat pada perlakuan B yaitu 12,52%.
Kadar Hemoglobin
Pengukuran kadar hemoglobin dilakukan pada awal, tengah, dan akhir pemeliharaan. Hasil pengukuran disajikan pada Gambar 2. Kadar hemoglobin rata-rata ikan uji pada awal (H0) mencapai 3,20 g%. Hari ke-20 terjadi peningkatan kadar hemoglobin kecuali pada perlakuan A yang mengalami penurunan menjadi 2,20 g%. Kadar hemoglobin pada akhir pemeliharaan (H40) mengalami peningkatan untuk semua perlakuan, dengan nilai tertinggi terdapat pada perlakuan A yaitu 6,40 g% dan nilai terendah terdapat pada perlakuan K- yaitu sebesar 4,43 g%.
Keterangan :
(K-) Kontrol negatif; (K+) Kontrol positif; (A) Perlakuan dosis 102 CFU ml-1; (B) Perlakuan dosis 104 CFU ml-1; (C) Perlakuan dosis 106 CFU ml-1
7
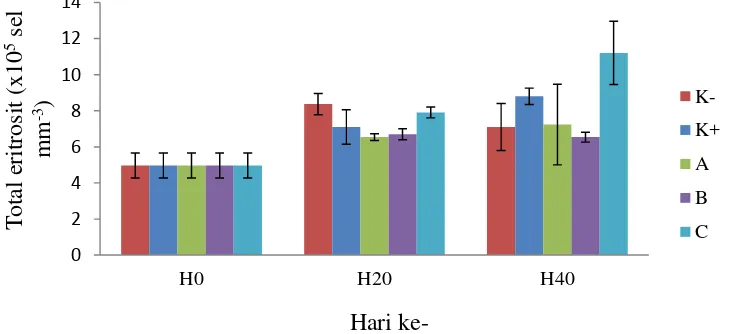
Hasil pengukuran total eritosit ditunjukkan pada Gambar 3. Pengukuran tersebut dilakukan pada awal, tengah, dan akhir perlakuan. Nilai rata-rata total eritrosit awal (H0) mencapai 4,97x105 sel mm-3. Total eritrosit pada hari ke-20 dari semua perlakuan cenderung meningkat dengan nilai tertinggi sebesar 8,37x105 sel mm-3 (perlakuan K-). Total eritrosit di akhir pemeliharaan (H40) dari semua perlakuan memiliki nilai yang beragam, nilai tertinggi terdapat pada perlakuan C sebesar 11,20x105 sel mm-3 dan nilai terendah terdapat pada perlakuan B yaitu 6,53x105 sel mm-3.
Gambar 2 Kadar hemoglobin ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k
Gambar 3 Total eritrosit ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k
8
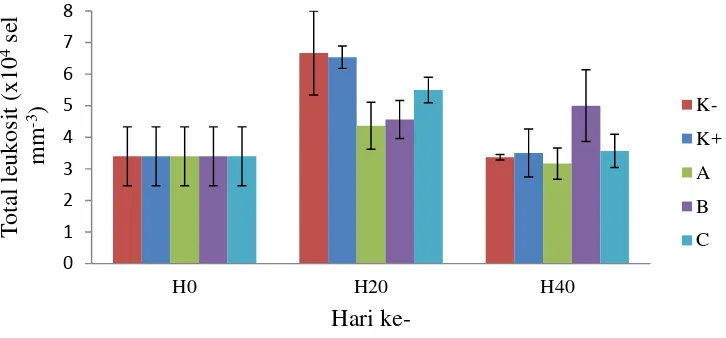
Pengukuran total leukosit dilakukan pada awal, tengah, dan akhir perlakuan. Hasil pengukuran disajikan pada Gambar 4. Rata-rata total leukosit awal (H0) mencapai 3,4x104 sel mm-3. Total leukosit rata-rata pada hari ke-20 untuk semua perlakuan terjadi peningkatan yaitu dengan nilai tertinggi sebesar 6,6x104 sel mm-3 (perlakuan K-). Pada akhir pemeliharaan (H40), nilai total leukosit untuk semua perlakuan mengalami penurunan kecuali pada perlakuan B yang mengalami peningkatan yaitu 5,0x104 sel mm-3.
Penghitungan Populasi Bakteri Total
Penghitungan populasi bakteri total pada media pemeliharaan selama penelitian menunjukkan hasil yang dinamis (Gambar 5). Penghitungan tersebut dilakukan setiap 2 kali dalam seminggu. Populasi bakteri total terlihat tidak ada perbedaan yang signifikan antara semua perlakuan. Pada awal perlakuan kepadatan bakteri total mencapai 105-107 CFU ml-1, sedangkan pada akhir perlakuan kepadatan bakteri total mencapai 106-107 CFU ml-1. Populasi bakteri total dari semua perlakuan memiliki nilai yang tidak berbeda jauh.
Gambar 4 Total leukosit ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k
Keterangan :
9
Penghitungan Populasi Bakteri L1k (Staphylococcus lentus)
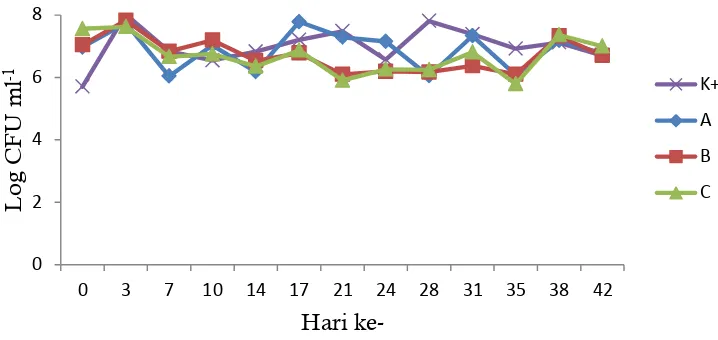
Penghitungan bakteri heterotrofil L1k (Staphylococcus lentus) dilakukan setiap 2 kali dalam seminggu selama 42 hari. Hasil penghitungan bakteri L1k ditunjukkan pada Gambar 6. Dinamika populasi bakteri L1k selama pemeliharaan terlihat dinamis. Populasi bakteri awal mencapai 104 CFU ml-1 dan pada akhir perlakuan populasi bakteri masih pada kisaran 104 CFU ml-1. Penambahan bakteri heterotrofik setiap seminggu sekali (hari ke-0, 7, 14, 21, 28, dan 35). Setiap hari ke-3 setelah penambahan bakteri terlihat adanya peningkatan populasi bakteri (hari ke-3, 10, 17, 24, dan 31).
Gambar 5 Dinamika populasi bakteri total pada media pemeliharaan ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k
Gambar 6 Dinamika populasi bakteri heterotrofik L1k (Staphylococcus lentus) pada media pemeliharaan ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k
10
Hasil pengukuran kualitas air pada semua perlakuan selama pemeliharaan ditunjukkan pada Tabel 1.
Tabel 1 Kisaran kualitas air dalam budidaya ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k
Perlakuan DO K- 4,47-7,67 6,46-7,98 30,8-32,1 0,001-0,016 0,144-1,102 0,187-1,187 K+ 4,80-7,87 6,82-7,87 30,5-32,2 0,001-0,023 0,044-1,458 0,423-1,030 A 5,65-7,50 6,29-8,11 30,9-31,7 0,002-0,080 0,048-1,053 0,361-0,989 B 5,71-7,23 6,37-8,10 30,9-32,2 0,001-0,046 0,085-0,774 0,362-1,161 C 5,79-7,73 6,47-8,14 31,0-32,5 0,002-0,056 0,052-1,062 0,317-1,081
Kelangsungan Hidup
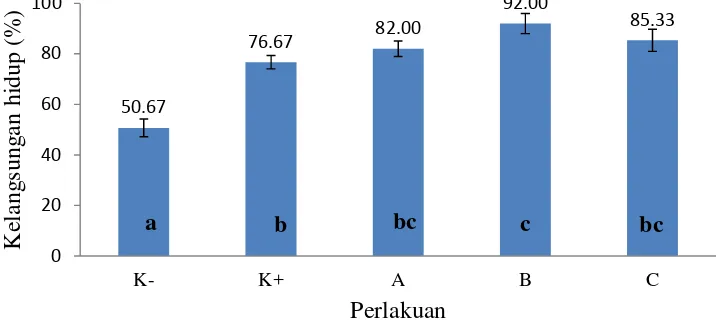
Kelangsungan hidup ikan uji selama pemeliharaan dapat dilihat pada Gambar 7. Hasil yang diperoleh menunjukkan bahwa kelangsungan hidup ikan uji perlakuan berbeda nyata (P<0,05) dengan kontrol positif dan kontrol negatif (Lampiran 3). Kelangsungan hidup rata-rata tertinggi terdapat pada perlakuan B yaitu 92,00% dan berbeda nyata (P<0,05) terhadap kontrol positif dan kontrol negatif yaitu masing-masing 76,67% dan 50,67%. Pada perlakuan A kelangsungan hidup rata-rata mencapai 82,00% sedangkan perlakuan C mencapai 85,33%, dan keduanya berbeda nyata (P<0,05) terhadap kontrol negatif (Lampiran 4).
Gambar 7 Kelangsungan hidup ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k Keterangan :
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
**(K-) Kontrol negatif; (K+) Kontrol positif; (A) Perlakuan dosis 102 CFU ml-1; (B) Perlakuan dosis 104 CFU ml-1; (C) Perlakuan dosis 106 CFU ml-1
Keterangan :
11
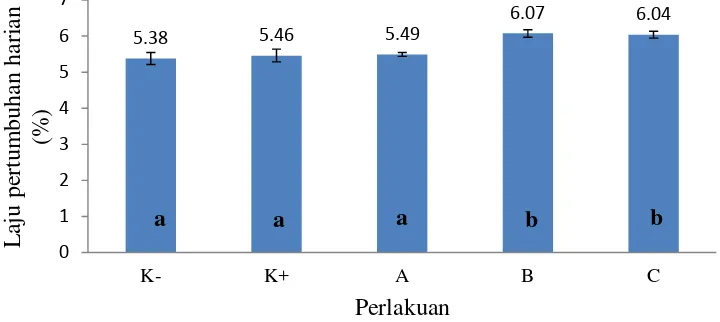
Laju pertumbuhan harian ikan uji selama pemeliharaan dapat diketahui bahwa antara perlakuan dan kontrol berbeda nyata (P<0,05) (Lampiran 5). Hasil yang diperoleh disajikan pada Gambar 8. Laju pertumbuhan harian rata-rata tertinggi terdapat pada perlakuan B yaitu 6,07% dan perlakuan C memiliki nilai laju pertumbuhan harian yang tidak jauh berbeda yaitu 6,04%. Kedua perlakuan tersebut berbeda nyata (P<0,05) terhadap kontrol positif maupun kontrol negatif yang masing-masing 5,46% dan 5,38%. Perlakuan A mencapai 5,49% dan tidak berbeda nyata (P>0,05) terhadap kontrol positif maupun kontrol negatif (Lampiran 6).
PEMBAHASAN
Teknologi bioflok cocok diterapkan dalam sistem budidaya super intensif. Limbah yang dihasilkan dapat dimanfaatkan oleh bakteri heterotrofik yang dapat menurunkan jumlah nitrogen anorganik dalam perairan. Bakteri heterotrofik akan memanfaatkan C organik yang ditambahkan (molase) dan N dalam perairan sehingga terbentuk biomassa mikroba berupa flok (gumpalan) yang dapat dijadikan sumber pakan alami untuk ikan (Crab et al. 2007). Respons imun suatu organisme dapat dilihat salah satunya dari gambaran darah. Parameter yang dapat menunjukkan kondisi tubuh pada darah adalah hemoglobin, hematokrit, total eritrosit, dan total leukosit. Kadar hematokrit merupakan persentase sel darah merah dalam total volume darah. Rata-rata kadar hematokrit awal dari semua perlakuan mencapai 10,79%. Selama 3 kali pengukuran, kadar hematokrit dari
Gambar 8 Laju pertumbuhan harian ikan lele (Clarias sp.) dalam budidaya super intensif berbasis bioflok dengan penambahan bakteri L1k
Keterangan :
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
12
semua perlakuan memiliki nilai yang beragam (Gambar 1). Pada pengukuran akhir (H40) kadar hematokrit tertinggi terdapat pada perlakuan C sebesar 23,97%, dan lebih tinggi dari pada kontrol positif maupun kontrol negatif yang masing-masing 18,95% dan 16,45%. Nilai kadar hematokrit berpengaruh terhadap total eritrosit. Peningkatan total eritrosit akan disertai peningkatan hematokrit dan hemoglobin. Menurut Hastuti dan Subandiyono (2011), ikan lele dumbo ukuran 8-10 cm memiliki nilai kadar hematokrit sebesar 23,33%.
Kadar hemoglobin menunjukkan besar kecilnya kapasitas pengangkutan oksigen oleh darah (Hastuti dan Subandiyono 2011). Berdasarkan pengukuran, rata-rata kadar hemoglobin awal (H0) ikan uji sebesar 3,20 g%. Selama 3 kali pengukuran nilai kadar hemoglobin tidak terlalu fluktuatif dari semua perlakuan (Gambar 2). Pada pengukuran akhir (H40) terlihat bahwa semua perlakuan mengalami peningkatan kadar hemoglobin, dan nilai tertinggi terdapat pada perlakuan A yaitu sebesar 6,40 g% sedangkan nilai terendah terdapat pada perlakuan kontrol negatif yaitu 4,33 g%. Nilai hemoglobin dan hematokrit berkorelasi kuat dengan total eritrosit (Fujaya 2004). Pemberian bakteri L1k dapat meningkatkan kadar hemoglobin ikan. Hal ini sesuai dengan hasil penelitian Hasibuan (2013) bahwa ikan yang diberi bakteri L1k memiliki nilai hemoglobin paling tinggi.
Eritrosit memiliki sitoplasma dengan inti di tengah-tengah, berwarna keunguan dan berbentuk ellips (Affandi dan Tang 2002). Hasil pengukuran menunjukkan bahwa nilai rata-rata total eritrosit awal sebesar 4,97x105 sel mm-3. Selama 3 kali pengukuran, total eritrosit dari semua perlakuan terlihat fluktuatif (Gambar 3). Pada pengukuran akhir (H40) terlihat bahwa total eritrosit pada perlakuan C yaitu 11,2x105 sel mm-3, dan lebih tinggi dari pada kontrol positif maupun negatif yang masing-masing 8,8x105 sel mm-3 dan 7,1x105 sel mm-3. Peningkatan total eritrosit diduga adanya pengaruh bakteri L1k yang dapat meningkatkan aktifitas laju pertumbuhan dan metabolisme, sehingga dapat memproduksi eritrosit dengan baik.
Total leukosit merupakan bagian dari sistem pertahanan tubuh yang menjaga dari organisme patogen dan bersifat non spesifik yang akan mengeliminir patogen melalui proses fagositosis (Fujaya 2004, Lagler et al. 1977). Hasil pengamatan menunjukkan bahwa rata-rata total leukosit awal (H0) mencapai 3,40x104 sel mm-3. Selama dilakukan 3 kali pengukuran, total leukosit dari semua perlakuan memiliki nilai yang beragam (Gambar 4). Pada akhir pengukuran (H40) menunjukkan bahwa nilai rata-rata total leukosit pada pelakuan B mencapai 5,0x104 sel mm-3, dan lebih tinggi dari kontrol positif maupun kontrol negatif yang masing-masing 3,5x104 sel mm-3 dan 3,37x104 sel mm-3. Peningkatan total leukosit diduga karena sistem pertahanan non-spesifik ini bereaksi cepat terhadap masuknya patogen dalam tubuh.
13
pada perlakuan kontrol positif yaitu sebesar 7,33% (Lampiran 7). Neutrofil adalah sel leukosit yang mengandung vakuola berisi enzim yang digunakan untuk membunuh organisme yang dimakannya (Chinabut et al. 1991). Hasil pengukuran neutrofil awal sebesar 13,00%, dan pada pengukuran akhir (H40) berkisar 5,67%-11,00% (Lampiran 7). Peningkatan jumlah neutrofil disebabkan sel tersebut dapat melawan antigen yang masuk ke dalam tubuh, sedangkan penurunan jumlah neutrofil disebabkan sel tersebut berumur pendek dan sudah melakukan fagositosis di dalam sel.
Pada sistem bioflok tidak hanya nilai nutrisinya yang penting, tetapi ada komponen lain yang memiliki manfaat bagi organisme akuatik yaitu Poly-β -hydroxibutirat (PHB). Menurut De Schryver et al. (2010), PHB dihasilkan oleh berbagai mikroorganisme yang berpotensi melindungi organisme akuatik dari serangan patogen. Polimer intraseluler tersebut diprodukdi oleh berbagai mikroorganisme yang memanfaatkan sumber karbon organik dan sebagai penyimpanan energi serta dapat meningkatkan sistem imun ikan (Defoirdt et al. 2007; De Schryver et al. 2008). Menurut Azim et al. (2008), pada bioflok terdapat beberapa organisme yang teridentifikasi yaitu protozoa (Paramecium, Tetrahymena, dan Petalomonas), rotifera (Lecane, Trichocerca, Polyarthra, dan Asplanchna) dan oligochaeta (Tubifex). Pada bioflok juga terdapat beberapa bakteri diantaranya Listeria sp., Bacillus sp., dan Streptobacillus sp. (Sari 2012).
Hasil pengamatan menunjukkan bahwa kelimpahan populasi bakteri total dari semua perlakuan terlihat dinamis sampai akhir pemeliharaan (Gambar 5). Hal tersebut diduga karena adanya penambahan sumber karbon (molase) secara terus-menerus setiap hari pada pagi hari, dan penambahan inokulan bakteri heterotrofik non-patogenik setiap satu minggu sekali. Kelimpahan awal populasi bakteri total adalah 105-107 CFU ml-1 dan pada akhir pemeliharaan mencapai 106-107 CFU ml -1
, sedangkan untuk kelimpahan populasi bakteri L1k dari awal sampai akhir pemeliharaan berkisar 104 CFU ml-1. Berdasarkan hasil pengukuran dapat diketahui bahwa bakteri L1k mampu berkompetisi dengan bakteri lain membentuk flok, sehingga bakteri heterotrofik tersebut berpotensi untuk diterapkan dalam sistem bioflok. Menurut penelitian Sari (2012), bakteri yang teridentifikasi dalam sistem bioflok adalah bakteri heterotrof yang tumbuh menggunakan karbon organik (molase) sebagai sumber karbonnya.
Kelimpahan bakteri heterotrof L1k terlihat dinamis dari awal sampai akhir pemeliharaan (Gambar 6). Peningkatan populasi bakteri terjadi pada hari ke-3 setelah penambahan inokulan bakteri heterotrofik. Hal tersebut juga diamati sebelum perlakuan (Lampiran 8). Pada hari pertama setelah penambahan inokulan bakteri (H-4 perlakuan) populasi bakteri mencapai 103-104 CFU ml-1, kemudian pada hari ke-2 (H-3 perlakuan) masih dalam kelimpahan 103-104 CFU ml-1. Pada hari ke-3 (H-2 perlakuan) populasi bakteri mulai meningkat yaitu pada kelimpahan 106-107 CFU ml-1, sedangkan pada hari ke-4 (H-1 perlakuan) kelimpahan bakteri mulai menurun yaitu menjadi 104-105 CFU ml-1.
14
insang pada chanel catfish. Kadar nitrit berkisar 0,044-1,458 mg L-1 dan kadar nitrat berkisar 0,187-1,187 mg L-1, untuk semua perlakuan. Nilai nitrit dalam budidaya harus kurang dari 1 mg L-1 (Ebeling dan Michael 2007). Kisaran kualitas air selama pemeliharaan untuk semua perlakuan masih dalam kisaran normal (Lampiran 9).
Perlakuan kontrol negatif yang tidak ditambah molase dan tanpa inokulan bakteri memiliki nilai kelangsungan hidup paling rendah. Hal tersebut diduga adanya persaingan makanan, sehingga dapat terjadi kanibalisme antar sesama. Perlakuan dengan penambahan molase dan inokulan bakteri menunjukkan nilai kelangsungan hidup yang lebih baik, hal ini disebabkan adanya peran molase sebagai sumber karbon organik bagi bakteri heterotrofik yang dapat mengurangi kadar nitrogen dalam air. Selain itu terbentuknya flok juga dapat dijadikan sumber pakan alami bagi ikan uji sehingga dapat mengurangi dampak kanibalisme. Kelangsungan hidup ikan uji perlakuan B lebih tinggi yaitu sebesar 92,00% dan berbeda nyata (P<0,05) terhadap kontrol positif dan negatif yang masing-masing sebesar 76,67% dan 50,67%. Kelangsungan hidup ikan uji perlakuan A sebesar 82,00% dan perlakuan C sebesar 85,33%, kedua perlakuan tidak berbeda nyata (P>0,05) dengan kontrol positif tetapi berbeda nyata (P<0,05) dengan kontrol negatif. Kematian ikan pada kontrol negatif banyak terjadi pada minggu ke-2 sampai ke-3 selama pemeliharaan, berdasarkan sampling hal tersebut diduga adanya keberagaman ukuran ikan yang tinggi sehingga tingkat kanibalisme juga tinggi.
Tingkat kelangsungan hidup yang tinggi didukung dengan pertumbuhan yang tinggi. Berdasarkan pengamatan, laju pertumbuhan harian ikan uji perlakuan B sebesar 6,07% dan perlakuan C sebesar 6,04%, kedua perlakuan tersebut berbeda nyata (P<0,05) dengan kontrol positif maupun negatif yang masing-masing 5,46% dan 5,38%. Pertumbuhan ikan perlakuan A sebesar 5,49% dan tidak berbeda nyata (P>0,05) dengan kontrol positif maupun negatif. Penambahan bakteri heterotrof non patogenik pada media pemeliharaan diduga mampu meningkatkan populasi bakteri total. Bakteri yang masuk ke dalam tubuh ikan dapat meningkatkan respon imun dari ikan (De Schryver et al. 2008). Sistem imun/kekebalan di dalam usus disebut GALT (Gut-Associated Limfoid Tissue). Bakteri non-patogenik yang masuk ke dalam usus kemudian menempel di jaringan limfoid usus, keberadaan bakteri tersebut dapat mempercepat rangsangan makrofag untuk mengenali antigen (Nayak 2010).
KESIMPULAN DAN SARAN
Kesimpulan
15
kelangsungan hidup dan laju pertumbuhan harian paling tinggi di antara perlakuan lain.
Saran
Pada penelitian lanjutan diharapkan penambahan bakterinya dilakukan setiap 2-3 kali dalam seminggu supaya dinamika populasi bakterinya stabil.
DAFTAR PUSTAKA
Affandi R dan Tang UM. 2002. Fisiologi Hewan Air. Pekanbaru: Unri Press. Amlacher E. 1970. Textbook of Fish Disease. New York (US): Neptune.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health programs. Aquatic Animal Health and the Environment. 4:24-342.
Avnimelech Y. 1999. Carbon/nitrogen rasio as a control element in aquaculture systems. Aquaculture 176: 227-235.
Azim ME, Little DC. 2008. The biofloc technology (BFT) in indoor tanks: Water quality, biofloc composition, and growth and welfare of Nile tilapia (Oreochromis niloticus). Aquaculture 283: 29-35.
Banun S, Arthana W, Suarna W. 2007. Kajian ekologis pengelolaan tambak udang di dusun dangin marga desa Delodbrawah Kecamatan Mendoyo Kabupaten Jembrana Bali. Ecotrophic 3 (1): 10-15.
Blaxhall PC, Daisley KW. 1973. Routine hematological methods for use with fish blood. Journal Fish Biology. 5:577-581
Boyd CE. 1982. Water quality management in aquaculture and fisheries science. Elsevier Scientific Publishing Company Amsterdam. 3125p.
Chinabut S, Limsuwan C, Sawat PK. 1991. Histology of the walking catfish (Clarias batrachus). Department of Fisheries: Thailand.
Crab R, Avnimelech Y, Defoirdt T, Bossier P, Verstraete W. 2007. Nitrogen removal techniques in aquaculture for a sustainable production. Aquaculture 270: 1-14.
Crab R, Defoirdt T, Bossier P, Verstraete W. 2012. Biofloc technology in aquaculture: Beneficial effects and future challenges. Aquaculture 356–357: 351–356
Defoirdt T, Halet D, Vervaeren H, Boon N, Van de Wiele T, Sorgeloos P, Bossier P, Verstraete W. 2007. The bacterial storage compound of poly- β -hydrobutyrate protects Artemia fransiseana from pathogenic Vibrio campbellii. Environmental Microbiology 9 (2): 445-452.
De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W. 2008. The basics of bioflocs technology: the added value for aquaculture. Aquaculture 277: 125–137.
16
Ebeling JM, Timmons MB, Bisogni JJ. 2006. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal
of ammonia–nitrogen in aquaculture systems. Aquaculture 257: 346-358.
Ebeling JM dan Michael BT. 2007. Recirculating Aquaculture. NRAC
Publication: Cayuga.
Effendie MI. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
Ekasari J. 2009. Teknologi bioflok: teori dan aplikasi dalam perikanan budidaya
sistem intensif. Jurnal Akuakultur Indonesia 8(2): 117-126.
Firdaus R. 2012. Seleksi bakteri probitoik untuk penghambatan patogen
Streptococcus agalactiae tipe non-hemolitik pada ikan nila Oreochromis niloticus secara in vitro dan in vivo [skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Fujaya R. 2004. Fisiologi Ikan: Dasar Pengembangan Teknologi Perikanan.
Jakarta (ID): Rineka Cipta.
Hargreaves JA. 2006. Photosynthetic suspended-growth systems in aquaculture. Aquacultural Engineering 34: 344–363.
Hasibuan UR. 2013. Aplikasi probiotik amilolitik NB21b dan proteolitik L1k
melalui pakan untuk pengendalian Streptococcosis pada ikan nila Oreochromis niloticus [skripsi]. Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Hastuti S dan Subandiyono. 2011. Performa hematologi ikan lele dumbo (Clarias
gariepinus) dan kualitas air media pada sistem budidaya dengan penerapan
kolam biofiltrasi. Jurnal Saintek Perikanan 2(6) : 1-5.
Huissman EA. 1987. Principle of fish production. Departement of Fish Culture and Fisheries, Wageningen Agricultural University, The Netherlands. Lagler KF, Bardach JE, Miller RR, Passiono DR. 1977. Ichtyology. John Wiley
and Sons Inc, New York-London.
Nayak SK. 2010. Probiotic and immunity: A fish perspective. Laboratory of Fish Pathology, Department of Veterinary Medicine, College of Bioresource Sciences. Nihon University. Japan.
Sari NP. 2012. Komposisi mikroorganisme penyusun dan kandungan nutrisi
bioflok dalam media pemeliharaan induk ikan nila (Oreochromis niloticus) dengan aplikasi teknologi bioflok [skripsi]. Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Sahu MK, Swarnakumar NS, Sivakumar K, Thangaradjou T, Kannan L. 2008.
Probiotics in aquaculture: importance and future perspectives. Indian J. Microbial 48:299-308.
Schneider O, Sereti V, Eding EH, Verreth JAJ. 2006. Molasses as C source for heterotrophic bacteria production on solid fish waste. Aquaculture 261: 1239-1248.
[Sidatik] Sumber Informasi Data Statistik. 2014. Statistik Perikanan Budidaya Kolam. [diunduh 26 April 2014] statistik.kkp.go.id
17
LAMPIRAN
Lampiran 1 Perhitungan penambahan molase dalam budidaya ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k Penambahan molase pada media pemeliharaan dilakukan berdasarkan perhitungan De Schryver et al. (2008). Contoh perhitungan dengan asumsi sebagai berikut :
1. Σ pakan = 10 g
2. Kadar protein pakan = 30%
3. Kadar nitrogen dalam protein = 16% 4. Kadar nitrogen yang terbuang ke media budidaya = 75%
5. C/N rasio target = 15
Berdasarkan perhitungan di atas, maka banyaknya molase yang ditambahkan ke dalam media budidaya adalah sebanyak 15,43 g
Lampiran 2 Prosedur parameter gambaran hematologi dalam budidaya ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k
Gambaran darah dilakukan pada awal, tengah, dan akhir perlakuan dengan prosedur sebagai berikut :
Kadar hematokrit (He)
Salah satu ujung tabung mikrohematokrit dicelupkan ke dalam tabung yang berisi darah sehingga darah akan merambat secara kapiler sampai mencapai ¾ bagian tabung, kemudian disumbat crystoceal. Tabung mikrohematokrit disentrifus dengan kecepatan 3000 rpm selama 5 menit. Nilai kadar hematokrit dapat dilihat dengan cara mengukur panjang bagian darah yang mengendap serta panjang total volume darah yang terdapat di dalam tabung.
Kadar hemoglobin (Hb)
Darah dihisap dengan menggunakan pipet Sahli sampai skala 20 mm3 atau skala 0,2 ml. Darah dipindahkan ke dalam tabung Hb-meter yang sudah diisi HCL 0,1 N sampai skala 10, kemudian diaduk selama 3-5 menit. Akuades ditambahkan sampai warna darah dan HCl tersebut berwarna seperti larutan standar yang ada pada Hb meter. Skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan tabung sahli yang dilihat pada skala jalur g% (banyaknya hemoglobin dalam gram per 100 ml darah).
Total sel darah merah (eritrosit)
Darah dihisap dengan pipet yag berisi bulir pengaduk warna merah sampai
skala 0,5 kemudian ditambahkan larutan Hayem’s sampai skala 101. Darah
18
sehingga darah dapat tercampur rata. Dua tetesan pertama dibuang dan selanjutnya diteteskan pada hemasitometer lalu ditutup dengan gelas penutup. Jumlah sel darah merah dihitung dengan bantuan mikroskop pembesaran 400x. Jumlah eritrosit dihitung sebanyak 5 kotak kecil dari 25 kotak pada bagian pojok-pojok, atas bawah dan tengah.
Total sel darah putih (leukosit)
Darah dihisap dengan pipet yang berisi bulir pengaduk warna putih sampai
skala 0,5. Selanjutnya ditambahkan larutan Turk’s sampai skala 11. Pipet
diayunkan dengan membentuk angka delapan agar darah tercampur rata. Dua tetesan pertama dibuang kemudian diteteskan pada hemasitometer lalu ditutup dengan gelas penutup. Jumlah leukosit sel darah putih dapat dihitung dengan bantuan mikroskop perbesaran 400x.
Differensial leukosit
Gelas obyek yang akan digunakan direndam dalam metanol selama 10 menit, lalu dikering anginkan. Darah diteteskan pada gelas obyek di bagian sebelah kanan, setelah itu gelas obyek lain membentuk sudut 30o yang diletakkan disebelah kiri tetesan darah kemudian ditarik sampai menyentuh darah tersebut dan disebarkan tipis secara merata pada gelas obyek. Selanjutnya dikering anginkan lalu direndam kembali dalam larutan metanol (10 menit). Prosedur selanjutnya yaitu perendaman dengan larutan Giemsa selama 15 menit, setelah selesai kemudian dibilas mengunakan akuades dan dikering anginkan. Preparat yang sudah kering dapat diamati dengan bantuan mikroskop.
Lampiran 3 Hasil uji ANOVA terhadap kelangsungan hidup ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k
19 (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k
20
Lampiran 8 Populasi bakteri L1k pada media pemeliharaan sebelum perlakuan dalam budidaya ikan lele (Clarias sp.) super intensif berbasis bioflok dengan penambahan bakteri L1k
Keterangan :
21
RIWAYAT HIDUP
Penulis dilahirkan di Rembang tanggal 2 September 1992 dari bapak Rifai dan ibu Siti Qomariyah. Penulis adalah anak pertama dari tiga bersaudara. Pendidikan yang pernah ditempuh penulis adalah SDN Punjulharjo (1998/2004), SMP N 2 Rembang (2004/2007). Pada tahun 2010 penulis lulus dari SMA N 2 Rembang, dan pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) di jurusan Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan.
Selama menjadi mahasiswa, penulis aktif sebagai pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) pada tahun 2011/2012 dan 2012/2013. Penulis juga aktif di Unit Kegiatan Mahasiswa (UKM) Koperasi Mahasiswa (KOPMA) pada tahun 2012/2013 dan 2013/2014. Penulis menjadi asisten Praktikum Penyakit Organisme Akuatik tahun 2012/2013 dan asisten Manajemen Kesahatan Organisme Akuatik tahun 2013/2014. Penulis pernah mengikuti kegiatan IPB Goes to Field di Desa Pedawang, Pekalongan pada tahun 2012, serta mengikuti Praktik Lapangan Akuakultur di PT. Surya Windu Kartika, Banyuwangi pada tahun 2013.
Tugas Akhir sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan adalah penulis melakukan penelitian dan menyusun skripsi dengan judul “Respons Imun dan Dinamika Mikroba dalam Budidaya Ikan Lele