1
DINAMIKA BIOMASSA BAKTERI DAN
KADAR LIMBAH NITROGEN
PADA BUDIDAYA IKAN LELE
(Clarias gariepinus)
INTENSIF SISTEM HETEROTROFIK
ROSMANIAR
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
2
DINAMIKA BIOMASSA BAKTERI DAN
KADAR LIMBAH NITROGEN
PADA BUDIDAYA IKAN LELE
(Clarias gariepinus)
INTENSIF SISTEM HETEROTROFIK
Skripsi
Sebagai Salah Satu Syarat Untuk memperoleh Gelar Sarjana Sains Pada Program Studi Biologi
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
ROSMANIAR 107095001082
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
4
PERNYATAAN
DENGAN INI SAYA MENYATAKAN KEASLIAN SKRIPSI INI
BENAR-BENAR HASIL KARYA SAYA SENDIRI YANG BELUM PERNAH
DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA
PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, September 2011
5 ABSTRAK
Dinamika Biomassa Bakteri Dan Kadar Limbah Nitrogen Pada Budidaya Ikan Lele (Clarias gariepinus) Intensif Sistem Heterotrofik.
Sistem heterotrofik adalah sistem budidaya perikanan yang menggunakan bakteri heterotrofik untuk pengendalian limbah nitrogen. Sistem heterotrofik diharapkan dapat menurunkan kadar limbah nitrogen pada budidaya perikanan intensif berbasis pellet. Penelitian ini bertujuan untuk mengetahui dinamika populasi bakteri dan dinamika kadar limbah nitrogen pada budidaya ikan lele (Clarias gariepinus) intensif sistem heterotrofik. Rancangan yang digunakan adalah Rancangan Acak Lengkap dengan 4 perlakuan dan 3 ulangan. Adapun perlakuannya adalah perlakuan A (pemberian pakan tanpa bakteri dan molases), perlakuan B (pemberian pakan dengan molases dan tanpa bakteri), perlakuan C (pemberian pakan dengan bakteri dan tanpa molases), perlakuan D (pemberian pakan dengan bakteri dan molases). Nilai pengukuran parameter pada akhir penelitian diuji dengan analysis of variance (ANOVA) satu arah dan uji Duncan untuk parameter kadar amonia, nitrit, dan nitrat, VSS, suhu, pH, dan DO. Hasil pengamatan menunjukkan bahwa perlakuan D (pemberian pakan dengan bakteri dan molasses) yang merupakan sistem heterotrofik dapat menurunkan kadar nitrit, namun kadar amonia, kadar nitrat, dan biomassa bakteri yang terdapat pada system heterotrofik tidak berbeda jauh dengan perlakuan lainnya.
6 ABSTRACT
Biomass Dynamics of Bacteria And Waste Nitrogen Levels In Intensive Catfish (Clarias gariepinus) Culture Using Heterotrophic System.
Heterotrophic system is an aquaculture system that uses heterotrophic bacteria to control nitrogen waste. This study aims to determine the population dynamics of bacteria and the dynamics of waste nitrogen levels in cultured catfish (Clarias gariepinus) intensive heterotrophic system. The design was used Randomized Complete Design with 4 treatments and 3 replications. The treatments were namely A (the feeding without bacteria and molasses), Treatment B (feeding with molasses and without bacteria), Treatment C (feeding with bacteria and without molasses), Treatment D (feeding with bacteria and molasses). Parameter measurement values at the end of the study were tested with analysis of variance (ANOVA) one-way and Duncan test for parameter levels of ammonia, nitrite, nitrate, VSS, temperature, pH, and DO. Observations indicated that the treatment D (feeding with bacteria and molasses), which was a heterotrophic system could decrease levels of nitrite waste, but levels of ammonia, levels of nitrate, and bacterial biomass in heterotrophic system did not different significantly with the other treatments.
7
KATA PENGANTAR
Puji syukur penulis panjatkan atas kehadirat Allah SWT, karena berkat rahmat
dan hidayah dari-Nya penulis dapat menyelesaikan skripsi yang berjudul “Dinamika Biomassa Bakteri dan Kadar Limbah Nitrogen Pada Budidaya Ikan Lele (Clarias
gariepinus) Intensif Sistem Heterotrofik” ini. Shalawat serta salam penulis haturkan kepada baginda Nabi Besar Muhammad SAW yang telah membawa kita ke zaman yang
terang benderang penuh ilmu pengetahuan seperti sekarang ini.
Tentu penulis tidak bisa mengerjakan segala hal tanpa bantuan pihak lain.
Memang demikian yang penulis rasakan dalam penelitian hingga skripsi ini berhasil
diselesaikan, yakni banyak pihak yang mendukung dan membantu, berupa moril dan
materil, baik secara langsung maupun tidak langsung hingga penyusunan skripsi dapat
dilakukan dengan baik, lancar dan rampung sesuai waktu yang ditentukan. Oleh karena
itu, pada kesempatan ini dengan segala kerendahan hati, penulis mengucapkan terima
kasih kepada :
1. Ayahanda Wilherman dan Ibunda Nurmalis, S.sos, M.Si, kedua orang
tuaku tercinta. Terima kasih atas segala dukungan moril, dan materilnya,
kasih sayang yang selalu tercurahkan, yang selalu memberikan arahan,
nasehat, semangat, dan segala sesuatu yang dibutuhkan ananda sampai
8
2. Roosmala Dewi, S.pd dan Chandra Wibawa, S.Ei kedua kakakku
tersayang, terima kasih atas dukungan, arahan, bantuan, semangat, dan
nasehat yang diberikan kepada adinda hingga terselesaikannya penulisan
ini.
3. Dr. Syopiansyah Jaya Putra, M. Sis, selaku Dekan Fakultas Sains dan
Teknologi.
4. Dr. Lily Surayya E.P, M.Env.Stud selaku Ketua Program Studi Biologi
Fakultas Sains dan Teknologi dan selaku pembimbing 2, terima kasih
atas bimbingan, arahan, serta saran-saran yang membangun.
5. Ir. Bambang Gunadi, M.Sc selaku pembimbing 1, terima kasih atas
bimbingan, ilmu, nasihat, dan saran-saran yang diberikan dan sangat
bermanfaat saat sebelum pelaksanaan penelitian, penelitian, penyusunan
skripsi, dan sampai penulisan ini terselesaikan.
6. Megga Ratnasari Pikoli, M.Si, dan Dini Fardila, M.Si selaku penguji 1
dan penguji 2, terima kasih atas arahan dan bimbingannya.
7. Dr. Joni Haryadi, M.Sc selaku penguji seminar hasil 1, terima kasih atas
kesempatan yang telah diberikan dalam penelitian ini serta atas arahan dan
bimbingannya.
8. Dr. Fahma Wijayanti, M.Si selaku penguji seminar hasil 2, terima kasih
atas arahan dan bimbingannya.
9. Priyanti, M.Si selaku pembimbing akademik, terima kasih atas nasihat
9
10. Dr. Imron, S.Pi, M.Si selaku kepala dan Bpk Drs. Wayan Subamia, M.Si selaku
mantan kepala Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air
Tawar Sukamandi Subang Jawa Barat.
11. Rita Febriana, S.Si dan Lamanto, S.Pi, terima kasih atas bantuan, bimbingan, dan
arahan selama penelitian dan penyusunan skripsi.
12. Mas Galih, Mas Ivan, dan Pak Oman, terima kasih atas bantuan yang
diberikan selama pelaksanaan penelitian.
13. Teman-teman Biologi Angkatan 2007 (B1007) ; Kiki, Jael, Seno, Ery,
Ririn, Amal, Ipeh, Ozan, Ulan, Antoz, Puput, Mbul, Yudhi, Galih, Dwi,
Fauzh, Nasti, Thu-thu, dan Ida, terima kasih atas dukungan, bantuan, dan
semangat yang diberikan.
14. Muhammad Iqbal, S.Si, Muhib Radhiyufa, S.Si, Ayudya Safitrie
Iskandar, S.Pi, Efrizal, S.Pi, Yudha Lestira, S.Pi, Musyrikin, S.Pi,
teman-teman UNPAD, dan UNILA, yang selama kurang lebih dua bulan
bersama dalam pelaksanaan penelitian telah banyak memberi bantuan,
semangat, dan dukungan.
15. Muhammad Iqbal, S.Si (Sang 20112007), terima kasih atas dukungan,
semangat, arahan, bantuan dan segala sesuatu yang telah diberikan
selama kurang lebih 4 tahun berada di kampus ini, sekali lagi terima
kasih banyak.
16. Asep Abdurahman As-Syakir , Zihan Oktafina Saleh, S.Si, dan Pihak-pihak lain
yang tidak bisa penulis sebutkan namanya satu persatu, terima kasih atas segala
10
Akhirnya atas bantuan, bimbingan, pengarahan serta dorongan yang diberikan,
semoga mendapatkan balasan yang setimpal dari Allah SWT. Penulis menyadari masih
banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan
kritik serta saran yang membangun untuk kesempurnaan skripsi ini.
Demikianlah skripsi ini disusun, semoga skripsi ini berguna dan bermanfaat bagi
para pembaca untuk menambah bekal ilmu pengetahuan dan untuk penulis khususnya.
Amin.
Jakarta, September 2011
11
2.1 Sistem Heterotrofik... 5
2.2 Proses Penghilangan Amonia Dalam Sistem Akuakultur ... 5
2.2.1 Bakteri Heterotrofik... 6
2.2.2 Bakteri Autotrofik... 7
2.3 Tingkat Teknologi Budidaya Perikanan... 9
2.3.1 Budidaya Perikanan Sistem Ekstensif... 9
2.3.2 Budidaya Perikanan Sistem Semi Intensif... 9
2.3.3 Budidaya Perikanan Sistem Intensif... 10
2.4 Ikan Lele (Clarias gariepinus)... 11
2.5 Limbah Nitrogen... 12
2.5.1 Amonia... 14
2.5.2 Nitrit... 15
13
4.3.1 Oksigen Terlarut... 49
4.3.2 Derajat Keasaman (pH) ... 53
4.3.3 Suhu... 56
BAB V. KESIMPULAN DAN SARAN... 59
5.1 Kesimpulan... 59
5.2 Saran... 59
DAFTAR PUSTAKA... 60
14
DAFTAR GAMBAR
Gambar 1. Ikan Lele (Clarias gariepinus) ... 11
Gambar 2. Bak Fiber Bulat Dengan Dasar Bentuk Corong ... 23
Gambar 3 Skema Letak Corong... 24
Gambar 4. Nilai Volatil Suspended Solid Selama Penelitian... 30
Gambar 5. Nilai Rata-rata VSS Pada Tiap-tiap Perlakuan... 35
Gambar 6. Kadar Amonia Selama Penelitian... 37
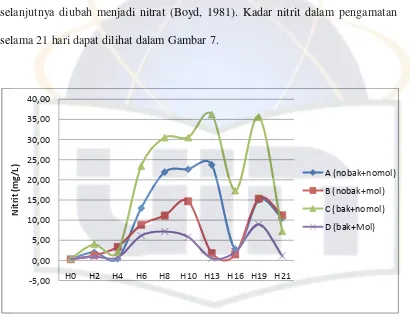
Gambar 7. Kadar Nitrit Selama Penelitian... 40
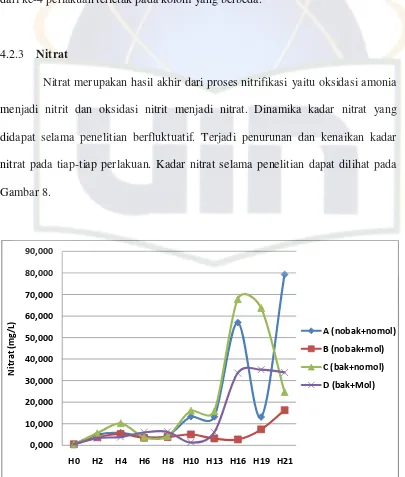
Gambar 8. Kadar Nitrat Selama Penelitian... 44
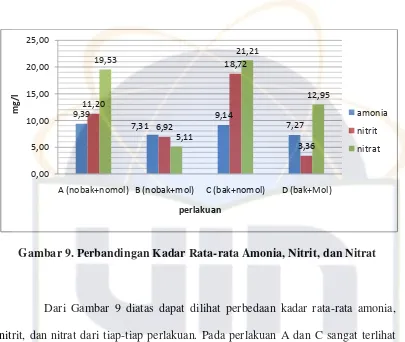
Gambar 9. Perbandingan Kadar Rata-rata Amonia, Nitrit, dan Nitrat ... 47
Gambar 10. Kadar Oksigen Terlarut Selama Penelitian... 50
Gambar 11. Nilai pH Selama Penelitian... 54
15
DAFTAR TABEL
16
DAFTAR LAMPIRAN
Lampiran 1. Peralatan yang Digunakan Selama Penelitian... 66
Lampiran 2. Bahan yang Digunakan Selama Penelitian... 67
Lampiran 3. Perhitungan Inokulasi Bakteri dan Pembuatan Stok Bakteri... 68
Lampiran 4. Perhitungan C/N Rasio... 69
Lampiran 5. Jumlah Pakan yang Diberikan selama Penelitian... 70
Lampiran 6. Jumlah Molases Yang Diberikan Selama Penelitian... 71
Lampiran 7. Hasil Pengamatan VSS, Amonia, Nitrit, dan Nitrat... 72
Lampiran 8. Hasil Pengamatan DO, Suhu, Dan pH... 75
17 BAB I
PENDAHULUAN
1.1Latar Belakang
Seiring dengan pertambahan penduduk dan peningkatan kebutuhan akan
produk ikan dan tingkat konsumsi ikan, budidaya perikanan dituntut untuk
meningkatkan produksinya khususnya dalam budidaya perikanan air tawar.
Kementerian Kelautan dan Perikanan telah menargetkan produksi perikanan
budidaya meningkat hingga 353 persen selama periode tahun 2010 hingga tahun
2014 (Kementerian Kelautan dan Perikanan, 2010).
Ikan lele merupakan salah satu komoditas perikanan yang paling banyak
diminati dan dibudidayakan oleh masyarakat Indonesia. Data Statistik Perikanan
Indonesia menunjukkan bahwa ikan lele menduduki peringkat nomor tiga
produksi budidaya ikan air tawar di Indonesia setelah ikan mas dan nila
(Anonimus, 2008). Di alam maupun di kolam, ikan lele memiliki pertumbuhan
yang cepat dan tahan terhadap lingkungan yang kurang baik. Namun untuk
mendapatkan hasil yang lebih baik diperlukan kondisi tempat atau air yang
mengandung cukup oksigen dan tidak mengandung bahan pencemar, serta
pembudidayaan yang baik. Untuk mencapai target produksi budidaya ikan air
18
Kegiatan budidaya perikanan sistem intensif meliputi penerapan
kepadatan yang tinggi, pemakaian pakan buatan berkadar protein tinggi,
penambahan aerasi, serta penggantian air secara berkala dalam jumlah besar
(Febrianti et al., 2009). Permasalahan utama dalam sistem budidaya intensif
dengan pengendalian mikroorganisme dan tanpa pergantian air seperti kolam,
tambak, tangki dan akuarium adalah konsentrasi limbah budidaya (ammonia,
nitrat, dan nitrit) mengalami peningkatan yang sangat cepat dan berisiko terhadap
kematian ikan.
Proses pengubahan nitrogen dalam pengurangan kandungan amonia
terdiri dari tiga proses, salah satunya dengan proses heterotrofik bakterial yang
mengubah amonia langsung menjadi biomassa bakteri. (Ebeling et al., 2006),
Amonia yang dikeluarkan oleh ikan di dalam air akan membentuk kesetimbangan
dengan ion amonium. Amonia dalam bentuk ion amonium akan mengalami
proses mikrobial oleh bakteri heterotrofik yang menyerap amonium menjadi
biomasa bakteri dengan adanya bahan organik (molases). Bakteri ini bisa
menyerap sampai 50% dari jumlah amonium terlarut dalam air (Montoya dan
Velasco, 2000).
Sistem budidaya perikanan yang menggunakan bakteri heterotrofik dalam
mengubah amonia menjadi biomassa bakteri dengan penambahan bahan karbon
organik tertentu disebut sistem heterotrofik. Sistem ini didasarkan pada konversi
nitrogen anorganik terutama amonia oleh bakteri heterotrofik menjadi biomassa
mikroba yang kemudian dapat dikonsumsi oleh organisme budidaya (Ekasari,
19
Sistem budidaya ini dianggap sangat sesuai dalam upaya menangani
limbah nitrogen pada budidaya intensif. Dengan menggunakan sistem heterotrofik
diharapkan limbah tidak menjadi toksik bagi ikan, menghemat pemakaian air
bersih, serta dapat menghasilkan sistem dan teknolgi budidaya yang lebih efisien.
Dengan demikian, maka perlu dilakukan penelitian lebih lanjut mengenai
dinamika biomassa bakteri dan kadar limbah nitrogen pada budidaya ikan lele
(Clarias gariepinus) intensif sistem heterotrofik.
1.2Rumusan Masalah
1. Bagaimana dinamika biomassa bakteri pada budidaya ikan lele (Clarias
gariepinus) intensif sistem heterotrofik?
2. Bagaimana dinamika kadar limbah nitrogen pada budidaya ikan lele
(Clarias gariepinus) intensif sistem heterotrofik?
1.3Hipotesis
1. Sistem heterotrofik dapat meningkatkan biomassa bakteri pada budidaya
ikan lele (Clarias gariepinus) intensif sistem heterotrofik.
2. Sistem heterotrofik dapat menurunkan kadar limbah nitrogen pada
20 1.4Tujuan Penelitian
1. Mengetahui dinamika biomassa bakteri pada budidaya ikan lele (Clarias
gariepinus) intensif sistem heterotrofik.
2. Mengetahui kadar limbah nitrogen pada budidaya ikan lele (Clarias
gariepinus) intensif sistem heterotrofik.
1.5Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi kepada
masyarakat mengenai teknik budidaya perikanan air tawar khususnya ikan lele
(Clarias gariepinus) dengan menggunakan sistem heterotrofik yang hemat air dan
21 BAB II
TINJAUAN PUSTAKA
2.1Sistem Heterotrofik
Sistem heterotrofik merupakan sistem pemanfaatan limbah nitrogen pada
budidaya ikan air tawar oleh bakteri secara heterotrofik. Pengertian lainnya sistem
heterotrofik adalah sistem budidaya perikanan yang menggunakan bakteri
heterotrofik dalam pengendalian limbah nitrogen dengan penambahan sumber
karbon organik tertentu (Gunadi et al., 2009). Organisme heterotrofik adalah
organisme yang mampu memanfaatkan bahan-bahan organik sebagai bahan
makanannya. Bahan makanan itu disintesis dan disediakan oleh organisme lain
(Riberu, 2002).
Sistem heterotrofik disebut juga sebagai teknologi bioflok (Bioflocs
technology) merupakan salah satu teknologi yang bertujuan untuk memperbaiki
kualitas air dan meningkatkan efisiensi pemanfaatan nutrient. Teknologi ini
didasarkan pada konversi nitrogen anorganik terutama ammonia oleh bakteri
heterotrof menjadi biomassa mikroba yang kemudian dapat dikonsumsi oleh
organisme budidaya (Ekasari, 2009).
2.2Proses Penghilangan Amonia Dalam Sistem Akuakultur
Proses pengubahan nitrogen dalam sistem akuakultur yang berperan dalam
22
fotoautotrofik oleh alga, proses autotrofik bakterial yang mengubah amonia
menjadi nitrat, dan proses heterotrofik bakterial yang mengubah amonia langsung
menjadi biomas bakteri (Ebeling et al., 2006). Pada kondisi alamiah tidak ada
sistem yang murni fotoautotrofik, heterotrofik bakterial maupun autotrofik
bakterial (Wyk and Avnimelech, 2007).
2.2.1 Bakteri Heterotrofik
Bakteri heterotrofik ialah bakteri yang tidak dapat mensintesis
makanannya sendiri. Bakteri heterotrofik dibedakan menjadi bakteri patogen dan
saprofit. Bakteri patogen memperoleh makanan dengan cara mengambil senyawa
organik kompleks dari makhluk hidup lain. Contoh bakteri patogen diantaranya:
Mycobacterium tuberculosis, Clostridium tetani. Bakteri saprofit memperoleh
makanan dari sisa-sisa makhluk hidup yang telah mati atau limbah. Contoh dari
bakteri saprofit adalah: Escherichia coli, Lactobacillus bulgaricus, dan Bacilus sp.
Bakteri heterotrofik merupakan golangan bakteri yang mampu
memanfaatkan dan mendegradasi senyawa organik kompleks yang mengandung
unsur C, H, dan N. Kelompok bakteri ini mengawali tahap degradasi senyawa
organik dengan serangkaian tahapan reaksi enzimatis, dan menghasilkan senyawa
yang lebih sederhana atau senyawa anorganik. Senyawa tersebut digunakan
sebagai sumber energi untuk pembentukan sel-sel baru dan untuk reproduksi yang
menyebabkan pertambahan populasi. Pemecahan senyawa organik dapat
berlangsung lebih cepat apabila tersedia oksigen yang mencukupi (Parwanayoni,
23
yang tidak termakan, feses, dan bahan organik lain sebagai sumber protein untuk
diubah menjadi amonia anorganik (Wyk and Avnimelech, 2007).
Bakteri heterotrofik mempunyai efisiensi produksi sel yang jauh lebih
tinggi dibandingkan dengan bakteri autotrofik yakni 25-100 kali daripada bakteri
Nitrosomonas sp. dan 10-33 kali daripada bakteri Nitrobacter sp. (Montoya and
Velasco, 2000). Proses biosintesis bakteri heterotrofik berlangsung lebih cepat
dibanding dengan proses biosintesis alga maupun proses bakteri nitrifikasi,
dengan waktu regenerasi 10 jam berbanding dengan 24-48 jam (Brune et al.,
2003). Selain lebih cepat tumbuh, bakteri heterotrofik merupakan sumber pakan
yang baik untuk ikan (McGraw, 2002). Mikroorganisme yang termasuk dalam
golongan bakteri heterotrofik antara lain adalah: fungi (Aspergillus) dan bakteri
(Alcaligenes, Arthrobacter spp., dan Actinomycetes) (Puji, 2010).
2.2.2 Bakteri Autotrofik
Bakteri autotrofik adalah bakteri yang mempunyai kemampuan untuk
mengubah senyawa anorganik menjadi senyawa organik seperti protein, lemak,
asam nukleat, dan vitamin. Bakteri pengoksidasi amonia yang bersifat autotrofik
adalah kelompok bakteri yang terutama berperan dalam proses oksidasi amonia
menjadi nitrit pada siklus nitrogen, juga pada proses peruraian nitrogen dalam
sistem pengolahan limbah cair. Bakteri autotrofik yang berperan dalam oksidasi
amonia menjadi nitrit adalah Nitrosomonas, Nitrosococcus, Nitrosospira,
24
Nitrifikasi (oksidasi amonium secara biologi) dilakukan oleh dua
kelompok bakteri autotrofik yang berbeda. Kelompok pertama (oksidasi amonia)
mengkonversi amonium (NH4) menjadi nitrit (NO2), Kelompok kedua adalah
oksidator nitrit yang mengoksidasi lebih lanjut produk menjadi nitrat (Meincke et
al., 1989), dua kelompok bakteri ini disebut ammonia-oxidizing bacteria (AOB)
dan nitriteoxidizing bacteria (NOB) (Prosser, 1989).
Nitrosomonas dan Nitrobacter tergolong ke dalam bakteri kemoautotrof
obligat. Kemoautotrof obligat memerlukan sumber energi yang spesifik, misalnya
saja Nitrosomonas membutuhkan amonium sebagai sumber energi dan
Nitrobacter memerlukan nitrit (Alexander, 1999). Bakteri autotrofik yang
melakukan proses nitrifikasi membutuhkan senyawa anorganik sebagai sumber
energi dan karbondioksida sebagai sumber karbon (Spotte, 1979), serta
mengkonsumsi oksigen pada saat oksidasi amonia dengan produk akhirnya nitrat
(Moriarty, 1996).
Laju pertumbuhan bakteri yang bersifat autotrofik lebih lambat
dibandingkan dengan bakteri heterotrofik. Derajat keasaman merupakan salah satu
faktor lingkungan yang berpengaruh terhadap pertumbuhan dan aktivitas bakteri
pengoksidasi amonia (Esoy et al., 1998). Laju pertumbuhan alga dan bakteri
nitrifikasi hampir sama namun koefisien produksi alga hampir 57 kali lebih tinggi
25 2.3Tingkat Teknologi Budidaya Perikanan
Pada sistem akuakultur terdapat tingkat teknologi budidaya perikanan.
Tingkat teknologi budidaya perikanan ini meliputi: budidaya perikanan ekstensif,
semi-intensif, dan intensif.
2.3.1 Budidaya Perikanan Sistem Ekstensif
Tingkat teknologi budidaya perikanan sistem ekstensif merupakan sistem
bubidaya perikanan yang belum berkembang. Input produksinya sangat
sederhana. Budidaya dengan sistem ini biasanya dilakukan di kolam air tawar dan
di sawah. Pengairan bergantung kepada musim hujan. Kolam yang digunakan
biasanya kolam pekarangan yang sempit. Penggantian air kolam menggunakan air
sumur dan dilakukan seminggu sekali. Hasil ikannya hanya untuk konsumsi
keluarga sendiri.
Ciri-ciri pemberian pakan pada pemeliharaan ikan secara ekstensif adalah:
suplemen pakan yang diberikan tidak optimum, nutrisi pakan biasanya tidak
sempurna dan tidak seimbang (Ditjen Perikanan Budidaya, 2002). Ikan diberi
pakan berupa bahan makanan yang terbuang, seperti sisa-sisa dapur dan limbah
pertanian (dedak, bungkil kelapa, dll.). Perkiraan pemanenan tidak tentu. Ikan
yang sudah agak besar dapat dipanen sewaktu-waktu (Sugiarto, 1988).
2.3.2 Budidaya Perikanan Sistem Semi Intensif
Budidaya perikanan sistem semi intensif dapat dilakukan di kolam, di
26
digunakan untuk pendederan. Dalam sistem ini sudah dilakukan pemupukan dan
pemberian pakan tambahan yang teratur.
Prasarana dalam sistem budidaya intensif ini berupa saluran irigasi yang
cukup baik. Selain itu, penggantian air juga dilakukan secara rutin. Sistem semi
intensif juga dapat dilakukan secara terpadu, artinya kolam ikan dikelola bersama
dengan usaha tani lain maupun dengan industri rumah tangga, misalnya usaha
ternak kambing, itik dan ayam. Kandang dibuat di atas kolam agar kotoran ternak
menjadi pupuk untuk kolam (Sugiarto, 1988).
2.3.3 Budidaya Perikanan Sistem Intensif
Budidaya perikanan sistem intensif adalah sistem budidaya perikanan
paling modern. Budidaya ikan intensif merupakan kegiatan usaha yang efisien
secara mikro tetapi inefisien secara makro, terutama apabila ditinjau dari segi
dampaknya terhadap lingkungan. Sistem budidaya seperti ini akan menghasilkan
total beban limbah pakan yang lebih banyak daripada yang teretensi menjadi
daging ikan. Limbah budidaya yang dimaksud merupakan akumulasi dari residu
organik yang berasal dari pakan yang tidak termakan, ekskresi amoniak, feces dan
partikel-partikel pakan (Avnimelech et al., 1994).
Budidaya perikanan ini dapat dilakukan di kolam atau tambak air payau
dengan pengairan yang baik. Intensifikasi budidaya perikanan ditandai dengan
peningkatan padat penebaran yang diikuti dengan peningkatan pemakaian pakan
27
dicirikan dengan padat penebaran yang tinggi, teknik pemberian pakan dan
manajemen lingkungan yang baik (Gunadi et al., 2009).
Pergantian air pada budidaya perikanan intensif dapat dilakukan sesering
mungkin sesuai dengan tingkat kepadatan ikan. Volume air yang diganti setiap
hari sebanyak 20% atau bahkan lebih. Makanan hariannya 3% dari berat biomassa
populasi ikan per hari. Makanan berupa pelet yang berkadar protein 25-26% dan
lemak 6-8%. Produksi ikan yang dihasilkan cukup tinggi (Sugiarto, 1988).
2.4Ikan Lele (Clarias gariepinus)
Ikan lele merupakan salah satu jenis ikan ekonomis penting di
Indonesia (Sidthinmuka, 1972). Ikan lele (Clarias gariepinus) banyak ditemui di
perairan rawa, sungai, sawah, dan bahkan perairan yang sedikit payau (Smith,
1980), dan juga dalam air limbah (Sumastri dan Djajadiredja, 1982). Ikan lele
(Clarias gariepinus) termasuk jenis ikan yang mempunyai alat pernafasan
tambahan (air breathing fish), sehingga mempunyai daya toleransi yang lebih
baik dibandingkan jenis ikan lainnya terhadap kondisi yang relatif kurang baik.
28
Gambar 1. Ikan lele (Clarias gariepinus)
Sumber : Foto Pribadi
Klasifikasi ikan lele (Clarias gariepinus) menurut Saanin (1984) adalah
sebagai berikut:
Ikan lele berwarna kehitaman atau keabuan, memiliki bentuk badan
yang memanjang pipih ke bawah (depressed), berkepala pipih, tidak bersisik,
memiliki empat pasang kumis yang memanjang sebagai alat peraba, dan
memiliki alat pernapasan tambahan (arborescent organ) (Astuti, 2003). Ikan lele
Kingdom : Animalia
Sub Kingdom : Metazoa Filum : Chordata
Sub Filum : Vertebrata Kelas : Pisces
Sub Kelas : Teleostei Ordo : Ostariophysi Sub Ordo : Siluroidea Famili : Clariidae
29
(Clarias gariepinus) digolongkan dalam kelompok omnivora (pemakan segala)
dan mempunyai sifat scavenger atau pemakan bangkai. Di alam, pakan yang
disukai terdiri atas jasad renik, cacing, jentik nyamuk, siput-siputan, dan ikan
kecil. Ikan lele (Clarias gariepinus) juga menyukai pakan buatan seperti pelet
(Nugroho, 2007).
2.5Limbah Nitrogen
Nitrogen dan senyawanya tersebar dalam biosfer. Pada tumbuhan dan
hewan, senyawa nitrogen ditemukan sebagai penyusun protein dan klorofil. Di
perairan nitrogen berupa nitrogen organik dan anorganik. Nitrogen anorganik
terdiri atas amonia (NH4+), amonium (NH3), nitrit (NO2¯ ), nitrat (NO3¯ ), dan
molekul gas N2, sedikit nitrogen organik berupa protein, asam amino, dan urea
(Effendi, 2003).
Seluruh nitrogen dalam pakan yang diberikan kepada ikan, 25%-nya
akan digunakan ikan untuk tumbuh, 60%-nya akan dikeluarkan dalam bentuk NH3
dan 15%-nya akan dikeluarkan bersama kotoran (Brune et al., 2003). Nitrogen
yang terkandung dalam pakan ikan sebanyak 33% akan diekskresikan oleh ikan
dan dapat didaur ulang (Avnimelech et al., 1992).
Empat jalur utama kehilangan nitrogen dari kolam adalah pemanenan
ikan (31,5 %), denitrifikasi (17,4 %), volatilisasi amonia (12,5%) dan akumulasi
di sedimen dasar (22,6%) (Gross et al., 2000). Nitrogen akan mengalami
transformasi di dalam siklus nitrogen. Transformasi nitrogen ini melibatkan
30
1. Nitrifikasi, yaitu oksidasi amonia menjadi nitrit dan nitrat. Nitrifikasi berjalan
secara optimum pada pH 8. Bakteri nitrifikasi bersifat mesofilik dan menyukai
suhu 30ºC.
2. Denitrifikasi, yaitu reduksi nitrat menjadi nitrit (NO2¯ ), dinitrogen oksida
(N2O), dan molekul nitrogen (N2). Proses ini melibatkan bakteri dan jamur
(Ida, 2009).
2.5.1 Amonia
Amonia (NH4+) yang terkandung dalam suatu perairan merupakan salah
satu hasil dari proses penguraian bahan organik. Amonia biasanya timbul akibat
kotoran organisme dan aktivitas jasad renik dalam proses dekomposisi bahan
organik yang kaya akan nitrogen. Tingginya kadar amonia biasanya diikuti
naiknya kadar nitrit (Boyd, 1981).
Amonia bebas yang tidak terionisasi bersifat toksik terhadap biota dan
toksisitas tersebut akan meningkat jika terjadi penurunan kadar oksigen terlarut.
Ikan tidak dapat bertoleransi terhadap kadar amonia bebas yang terlalu tinggi
karena dapat mengganggu proses pengikatan oksigen oleh darah dan dapat
menyebabkan sufokasi (kematian secara perlahan karena lemas) (Effendi, 2003).
Nitrifikasi
NH4+ →NH2OH → NOH → NO2ˉ → NO3ˉ
Denitrifikasi
NO3ˉ → NO2ˉ → NO →N2O → N2
31
Keberadaan amonia mempengaruhi pertumbuhan karena mereduksi
masukan oksigen akibat rusaknya insang, menambah energi untuk detoksifikasi,
menggangu osmeregulasi dan mengakibatkan kerusakan fisik pada jaringan
(Boyd, 1990).
Puncak ekskresi amonia pada ikan berukuran 4-20 g berlangsung pada
waktu 4-6 jam setelah pemberian pakan dimulai sampai 6-10 jam setelah periode
pemberian pakan berakhir (Merino et al., 2007). Potensi pasokan amonia ke
dalam air budidaya ikan adalah sebesar 75% dari kadar nitrogen dalam pakan.
Sebanyak 70-80% nitrogen dalam pakan diubah menjadi amonia oleh ekskresi
langsung maupun melalui mineralisasi oleh bakteri (Wyk dan Avnimelech, 2007).
Amonia yang dikeluarkan oleh ikan di dalam air akan membentuk
kesetimbangan dengan ion ammonium. Amonia dalam bentuk ion ammonium
akan mengalami proses nitrifikasi oleh bakteri kemoautotrof menjadi nitrit dan
selanjutnya menjadi nitrat. Namun demikian dengan adanya bahan organik, proses
mikrobial yang berlangsung didominasi oleh bakteri heterotrofik yang lebih cepat
menyerap ammonium menjadi biomasa bakteri. Bakteri ini bisa menyerap sampai
50% dari jumlah ammonium terlarut dalam air (Montoya dan Velasco, 2000).
2.5.2 Nitrit
Nitrit merupakan bentuk peralihan (intermediate) antara amonia dan nitrat
(Nitrifikasi) (Ida, 2009). Nitrit juga dikatakan sebagai hasil dari oksidasi amonia
dalam proses nitrifikasi oleh bakteri autotropik Nitrosomonas, yang menggunakan
32
jumlah yang sangat sedikit, lebih sedikit dari pada nitrat karena tidak stabil
dengan keberadaan oksigen (Ida, 2009).
Konsentrasi nitrit maksimum yang diperbolehkan dalam kegiatan
budidaya ikan adalah < 0.06 mg/L (Effendi, 2003). Toksisitas nitrit terhadap ikan
terutama dalam transpor oksigen dan kerusakan jaringan. Nitrit dalam darah
mengoksidasi haemoglobin menjadi methemoglobin yang tidak mampu mengikat
oksigen (Boyd, 1981).
Pada masa pertumbuhan, bakteri heterotrofik mereduksi nitrit menjadi
amonium untuk digunakan dalam sintesis biomasa. Mikroorganisme cenderung
untuk mereduksi nitrit menjadi amonium karena amonium dapat digunakan untuk
sintesis biomassa sel (Gottschalk, 1986). Amonium juga digunakan untuk sintesis
asam amino dan protein melalui glutamine dan glutamat (Joklik et al., 1992).
2.5.3 Nitrat
Senyawa nitrat merupakan hasil akhir dari proses bakteriologis
kemoautotrofik yakni bakteri nitrifikasi. Pada proses ini amonia terlebih dahulu
diubah menjadi nitrit oleh bakteri Nitrosomonas sp. dan selanjutnya nitrit diubah
menjadi nitrat oleh bakteri Nitrococcus sp. (Montoya dan Velasco, 2000).
Berbeda dengan amonia maupun nitrit, nitrat jarang sekali menjadi
masalah dalam budidaya hewan akuatik baik di tawar, payau, maupun laut. Efek
nitrat pada hewan akuatik hampir sama dengan nitrit yaitu pada transportasi
oksigen dan proses osmoregulasi. Kadar nitrat dalam air yang berbahaya bagi ikan
33
keracunan nitrat pada hewan akuatik sangat jarang terjadi (Hanggono, 2004).
Namun untuk ikan budidaya sebaiknya kurang dari 10 ppm (Supratno dan
Kasnadi, 2003).
2.6Sumber Karbon (Molases)
Tetes tebu merupakan hasil samping industri gula yang mengandung
senyawa nitrogen, trace element, dan kandungan gula yang cukup tinggi terutama
kandungan sukrosa sekitar 34% dan kandungan total karbon sekitar 37%
(Suastuti, 1998).
Molases adalah salah satu sumber karbon yang dapat digunakan untuk
mempercepat penurunan konsentarasi N-anorganik di dalam air. Molase
berbentuk cair bewarna coklat seperti kecap dengan aroma yang khas (Suastuti,
1998). Oleh karena itu, penambahan molases ke dalam media budidaya
diharapkan mampu menurunkan amonia dan peningkatan pertumbuhan ikan
sehingga dapat meningkatkan produksi ikan.
2.7Kualitas Air Pendukung
2.7.1 Oksigen Terlarut
Oksigen terlarut merupakan parameter kualitas air yang paling
menentukan pada budidaya ikan. Ketersediaan oksigen menentukan lingkaran
aktivitas ikan. Kadar oksigen terlarut berfluktuasi secara harian dan musiman,
tergantung pada pencampuran dan pergerakan massa air, aktivitas fotosintesis,
34
akan meningkatkan konsumsi oksigen sekitar 10% (Effendie, 2003). Oksigen
dalam perairan berasal dari difusi O2 dari atmosfer serta aktivitas fotosintesis
oleh fitoplankton maupun tanaman lainnya.
Kebutuhan oksigen pada ikan bergantung pada : kebutuhan lingkungan
bagi spesies tertentu dan kebutuhan konsumtif metabolisme tubuh ikan. Fungsi
oksigen bagi ikan yaitu : berperan dalam pembakaran bahan bakarnya (makanan),
dan untuk dapat melakukan aktivitas (berenang, reproduksi, pertumbuhan).
Ketersediaan oksigen bagi ikan menentukan aktivitas ikan, konversi pakan
dan laju pertumbuhan. Pada kondisi DO < 4 ppm, ikan masih mampu bertahan
hidup namun pertumbuhan menurun (tidak optimal). Rentang tingkat DO optimal
yaitu ≥ 5 ppm. Rentang tingkat DO untuk pemeliharaan intensif yaitu 5-8 ppm.
Batas toleransi kadar oksigen terlarut secara umum untuk budidaya tambak
adalah 3 – 10 ppm, sedangkan nilai optimal untuk budidaya di tambak berkisar
antara 4 – 7 ppm (Poernomo, 1992).
Kandungan oksigen terlarut dalam suatu perairan merupakan parameter
kualitas air yang paling kritis dalam budidaya ikan, karena dapat mempengaruhi
kelangsungan hidup ikan yang dipelihara. Oksigen yang terlarut di dalam perairan
sangat dibutuhkan untuk proses respirasi, baik oleh tanaman air, ikan, maupun
organisme lain yang hidup di dalam air (Supratno dan Kasnadi, 2003).
Bakteri heterotrofik dan bakteri autotrofik menggunakan oksigen dalam
proses pemanfaatan ammonia. Bakteri heterotrofik adalah bakteri yang
mengkonsumsi oksigen dalam proses perubahan amonia dengan produk akhir
35
karbondioksida pada saat oksidasi amonia dengan produk akhirnya nitrat
(Moriarty, 1996).
2.7.2 Derajat Keasaman (pH)
pH merupakan suatu ukuran konsentrasi ion H. Secara alamiah perairan
dipengaruhi oleh konsentrasi CO2 dan senyawa yang bersifat asam. Dalam
budidaya ikan lele nilai pH yang dianjurkan adalah 6,5-8,5 (Pescod, 1973).
Air yang mempunyai pH antara 6,7 sampai 8,6 mendukung populasi ikan
dalam kolam. Dalam jangkauan pH tersebut pertumbuhan dan pembiakan ikan
tidak terganggu (Sastrawijaya, 2009). Kisaran pH yang dapat menunjang
pertumbuhan ikan adalah 6.5-9 (Boyd, 1982).
pH merupakan salah satu faktor lingkungan yang berpengaruh terhadap
pertumbuhan dan aktivitas bakteri pengoksidasi amonia (Esoy et al., 1998).
Bakteri nitrifikasi (bakteri pengoksidasi amonia) lebih menyukai lingkungan yang
basa dengan tingkat pH optimal untuk pertumbuhan berkisar antara 7,5-8,5
(Ambarsari, 1999). Nilai pH optimum bagi pertumbuhan bakteri heterotrofik
adalah sekitar 6-7 (Irianto dan Hendrati, 2003).
2.7.3 Suhu
Suhu merupakan salah satu faktor penting dalam kehidupan ikan
terutama dalam proses kimia dan biologi. Ikan akan tumbuh dengan baik pada
suhu 25ºC-32ºC. perubahan suhu yang mendadak dapat menyebabkan ikan stres
36
Suhu mempunyai pengaruh yang besar terhadap kelarutan oksigen.
Setiap spesies mempunyai suhu optimumnya. Ada ikan yang mempunyai suhu
optimum 15ºC, ada yang 24ºC, dan ada yang 32ºC. Jika suhu berbeda jauh dari
optimumnya, hewan itu akan mati atau bermigrasi ke daerah baru. Selisih 5ºC
sudah cukup untuk ikan mengakhiri hidupnya, terutama apabila terjadi serentak
karena limbah panas(Sastrawijaya, 2009).
Suhu merupakan parameter lingkungan yang sangat besar pengaruhnya
pada hewan akuatik. Suhu air sangat berpengaruh terhadap sifat fisik, kimia dan
biologi tambak, yang akibatnya mempengaruhi fisiologis kehidupan hewan
akuatik atau hewan air. Secara umum laju pertumbuhan ikan akan meningkat jika
sejalan dengan kenaikan suhu pada batas tertentu. Jika kenaikan suhu melebihi
batas akan menyebabkan aktivitas metabolisme organisme air atau hewan akuatik
meningkat, hal ini akan menyebabkan berkurangnya gas-gas terlarut di dalam air
yang penting untuk kehidupan ikan atau hewan akuatik lainnya. Walaupun ikan
dapat menyesuaikan diri dengan kenaikan suhu, akan tetapi kenaikan suhu
melebihi batas toleransi ekstrim (35°C) pada waktu yang lama akan menimbulkan
stress atau kematian ikan (Supratno dan Kasnadi, 2003).
2.8Volatil Suspended Solid (VSS)
Solid merupakan materi padat yang terdapat didalam air dan dianalisa
dengan penimbangan, pemanasan atau penguapan. Volatile merupakan materi
organik, materi yang hilang pada penguapan 550ºC setelah dikeringkan terlebih
37
organik yang tersuspensi di dalam air atau zat padat organik yang tertahan pada
filter dan hilang pada suhu 550ºC.
Padatan tersuspensi dibedakan menjadi volatile solid dan non volatile
solids. Volatile solid adalah bahan organik yang teroksidasi pada pemanasan
dengan suhu, sedangkan non volatile solid adalah fraksi bahan anorganik yang
tertinggal sebagai abu pada suhu tersebut (Effendi, 2003). Volatile solid dapat
dijadikan sebagai parameter utama dan penting bagi keberadaan bioflok pada
38 BAB III
METODOLOGI
3.1Waktu dan Tempat
Penelitian ini dilakukan pada bulan Januari sampai Juli 2011. Penelitian
dilakukan di Laboratorium Sistem Budidaya Ikan, Loka Riset Pemuliaan dan
Teknologi Budidaya Perikanan Air Tawar (LRPTBPAT), Sukamandi, Subang,
Jawa Barat.
3.2Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah sebagai berikut: bak
fiber bulat dengan dasar berbentuk corong ukuran 250 L, aerator, jaring penutup,
peralatan lapangan (mangkok, ember, gelas plastik, corong plastik, saringan,
selang, dan plastik kiloan), botol sampel, corong, pipet tetes, gelas ukur, tissue,
erlenmeyer, labu ukur, beaker glass, timbangan digital, timbangan analitik, Water
quality checker, desikator, oven, vakum, pipet volumetrik, kertas saring wathman
no.42, furnance, cawan porselen, dan Spektrofotometer U-I500.
Bahan yang digunakan dalam penelitian ini adalah sebagai berikut: ikan
lele (Clarias gariepinus) ukuran 50 gram/ekor, pakan ikan lele Pro-vite 781,
molases, bakteri komersil minabacto, reagent amonia, reagent nitrit, dan reagent
39 3.3Disain Penelitian
Penelitian ini menggunakan metode eksperimental yaitu menggunakan
Rancangan Acak Lengkap. Pelaksanaan penelitian terdiri dari empat perlakuan
dengan tiga ulangan. Perlakuan yang digunakan adalah:
1. Perlakuan A: pemberian pakan tanpa bakteri dan molases
2. Perlakuan B: pemberian pakan dengan molases dan tanpa bakteri.
3. Perlakuan C: pemberian pakan dengan bakteri dan tanpa molases
4. Perlakuan D: pemberian pakan dengan bakteri dan molases.
Molases sebagai sumber karbon untuk pertumbuhan bakteri, sedangkan
bakteri sebagai agen transformasi limbah nitrogen. Kombinasi molases dan
bakteri merupakan budidaya sistem heterotrofik.
3.4Cara Kerja
3.4.1 Persiapan
Persiapan yang dilakukan dalam penelitian ini adalah persiapan wadah
ikan. Wadah yang digunakan dalam penelitian ini adalah wadah berupa corong
yang terbuat dari fiber berukuran 250 liter. Wadah ini diisi air sebanyak 200
liter. Diatas corong ditutup dengan menggunakan jaring. Jaring dikaitkan dengan
kawat. Jaring ini digunakan untuk mencegah keluarnya ikan dari dalam corong
akibat aktivitas ikan lele. Jumlah corong yang digunakan sebanyak 12 corong.
Aerasi dipasang pada masing-masing corong untuk mensuplai oksigen pada
40
Gambar 2. Bak Fiber Bulat Dengan Dasar Bentuk Corong
Penelitian ini menggunakan empat perlakuan. Dari ke empat perlakuan
masing-masing perlakuan digunakan 3 ulangan, sehingga di peroleh kode
perlakuan sebagai berikut dengan jumlah corong adalah 12 corong :
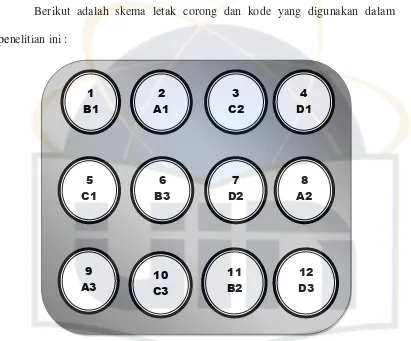
Tabel 1. Kode Perlakuan
Corong Kode Perlakuan Perlakuan
1 B1 Tanpa bakteri + molases
2 A1 Tanpa bakteri + tanpa molases
3 C2 Bakteri + tanpa molases
4 D1 Bakteri + Molases
5 C1 Bakteri + tanpa molases
6 B3 Tanpa bakteri + molases
7 D2 Bakteri + Molases
8 A2 Tanpa bakteri + tanpa molases
9 A3 Tanpa bakteri + tanpa molases
10 C3 Bakteri + tanpa molases
11 B2 Tanpa bakteri + molases
12 D3 Bakteri + Molases
41
Berikut adalah skema letak corong dan kode yang digunakan dalam
penelitian ini :
Gambar 3. Skema Letak Corong
Ikan lele berukuran 50 gram/ekor dimasukan ke dalam corong sebanyak
20 ekor pada masing-masing corong. Sebelum ditebar, ikan diseleksi terlebih
dahulu. Ikan yang layak digunakan adalah ikan yang memiliki organ tubuh yang
lengkap, yang aktif (gesit), ukuran seragam dan tidak ternfeksi penyakit.
3.4.2 Pemberian pakan
Pemberian pakan diberikan pada ikan lele. Jumlah pemberian pakan
adalah sebesar 3% dari bobot biomassa ikan. Pakan diberikan setiap hari selama
21 hari. Pakan yang digunakan berupa pakan komersil yang bersifat mengapung,
42
dengan frekuensi pemberian pakan 3 kali sehari, pagi sekitar pukul 07.00 WIB,
siang sekitar pukul 13.00 WIB, dan sore sekitar pukul 16.00 WIB.
Perhitungan pemberian pakan:
Total pemberian pakan mengikuti pertumbuhan ikan. Biomassa Ikan akan
diukur setiap 7 hari sekali sehingga jumlah pakan yang akan diberikan diganti
setiap 7 hari sekali.
3.4.3 Pemberian Molases dan Inokulasi Bakteri
Inokulasi bakteri dilakukan sekali pada awal penelitian dengan dosis 20
ml dalam 106cfu/ml (Lampiran 3). Inokulasi bakteri hanya dilakukan pada 3
corong sesuai dengan perlakuan. Inokulasi bakteri ini hanya dilakukan sekali pada
awal penelitian.
Molases diberikan setiap pagi sebelum pemberian pakan pada ikan.
Molases diberikan dengan dosis yang disesuaikan dengan bobot ikan per corong
dan sesuai dengan perhitungan C/N Rasio (Lampiran 4). Pemberian molases
hanya diberikan pada 6 corong sesuai perlakuan.
3.4.4 Pengamatan
Parameter yang diamati meliputi: Volatile suspended solid, amonia,
nitrit, nitrat, pH, DO, dan suhu. Parameter-parameter tersebut diukur selama dua
hari sekali pada sepuluh hari pertama dan tiga hari sekali pada sepuluh hari
terakhir. Hal ini dilakukan karena pada sepuluh hari terakhir parameter yang
43
diukur tersebut dianggap sama dengan sepuluh hari pertama sehingga pengukuran
dilakukan tiga kali sehari pada sepuluh hari kedua.
3.4.4.1Pengukuran Amonia
Pengukuran amonia ini dilakukan di laboratorium kimia dengan
menggunakan Spektrofotometer U-I500 dan dilakukan pada H0, H2, H4, H6, H8,
H10, H13, H16, H19, dan H21. Pengambilan sampel air dari tiap-tiap corong pada
jam 06.00 WIB sebelum pemberian pakan dan molases.
Sampel air disaring dengan kertas saring. Sebanyak 5 ml sampel air
dimasukkan dalam tabung reaksi lalu ditambahkan 0,2 ml larutan fenol; 0,2 ml
larutan nitroprussida, dan 0,5 ml larutan oksidan. Lalu dibiarkan warnanya
terbentuk pada suhu ruang (22-27ºC), Kemudian dikocok dan dibiarkan selama
satu jam. Lalu dianalisa dengan spektrofotometer pada panjang gelombang ()
640 m (HACH, 2005).
3.4.4.2Pengukuran Nitrit
Pengukuran nitrit ini dilakukan di laboratorium kimia dengan
menggunakan Spektrofotometer U-I500. Pengukuran ini dilakukan pada H0, H2,
H4, H6, H8, H10, H13, H16, H19, dan H21. Pengambilan sampel air dari tiap-tiap
corong pada jam 06.00 WIB sebelum pemberian pakan dan molases.
Sampel air disaring dengan kertas saring. Sebanyak 5 ml sampel air
dimasukkan dalam tabung reaksi lalu ditambahkan 0,1 ml asam sulfinat, lalu
44
dan dikocok. Lalu dibiarkan selama 10-20 menit dan akan terbentuk warna merah
keunguan. Lalu dianalisa dengan spektrofotometer pada panjang gelombang ()
540 m (HACH, 2005).
3.4.4.3Pengukuran Nitrat
Pengukuran nitrat ini dilakukan di laboratorium kimia dengan
menggunakan Spektrofotometer U-I500 dan dilakukan pada H0, H2, H4, H6, H8,
H10, H13, H16, H19, dan H21. Pengambilan sampel air dari tiap-tiap corong pada
jam 06.00 WIB sebelum pemberian pakan dan molases.
Sampel air disaring dengan kertas saring. Sebanyak 2 ml sampel air
dimasukkan dalam tabung reaksi lalu ditambahkan 0,4 ml larutan Brusin 0,5%.
Kemudian ditambahkan dengan hati-hati 4 ml larutan H2SO4 pekat, dan
dinginkan. Lalu dianalisa dengan spektrofotometer pada panjang gelombang ()
420 m (HACH, 2005).
3.4.4.4Pengukuran DO, Suhu, dan pH
Pengukuran kualitas air pendukung meliputi: DO, suhu, dan pH.
Pengukuran kualitas air pendukung ini dilakukan pada H0, H2, H4, H6, H8, H10,
H13, H16, H19, dan H21 pada jam 06.00 WIB sebelum dilakukan pemberian
pakan dan molases. Pengukuran DO, pH, dan suhu dilakukan dengan
45 3.4.4.5Pengukuran Volatile Suspended Solid
Pengukuran Volatile suspended solid dilakukan pada H0, H2, H4, H6,
H8, H10, H13, H16, H19, dan H21, bertempat di laboratorium kimia.
Pengambilan sampel air dari tiap-tiap corong pada jam 6.00 WIB sebelum
pemberian pakan dan molases.
Sampel air sebanyak 100 ml disaring dengan menggunakan kertas saring
wathman 42 dan divakum. Setelah itu kertas saring (filter) dikeringkan di dalam
oven pada suhu 103°C selama 60 menit. Kertas saring didinginkan dalam
desikator lalu ditimbang (A). Setelah itu kertas saring dimasukkan ke dalam
furnance pada suhu 550°C selama 60 menit. Setelah itu didinginkan dalam
desikator dan ditimbang lagi (B).
Hasil timbangan A dan B dihitung dengan menggunakan rumus:
Keterangan:
A: hasil timbangan filter setelah suhu 103ºC (mg)
B: hasil timbangan filter setelah suhu 550ºC (mg)
V: volume sampel air yang digunakan (100 ml)
(APHA, 2005).
46 3.5Analisis Data
Hasil pengukuran setiap paramater ditampilkan secara grafis untuk melihat
dinamika dari setiap parameter. Nilai pengukuran parameter pada akhir penelitian
diuji dengan analysis of variance (ANOVA) satu arah untuk melihat perbedaan
antara perlakuan variasi pakan, bakteri, dan molases terhadap kadar amonia, nitrit,
47 BAB IV
HASIL DAN PEMBAHASAN
4.1. Dinamika Biomassa Bakteri
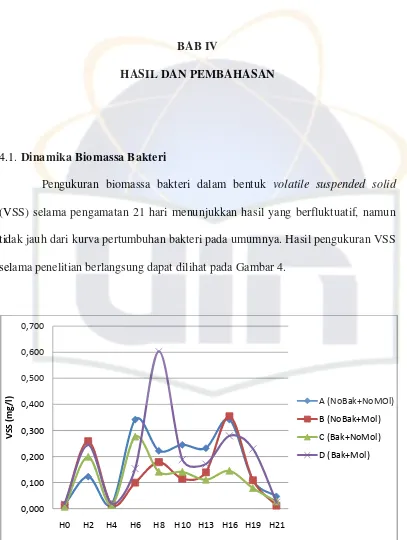
Pengukuran biomassa bakteri dalam bentuk volatile suspended solid
(VSS) selama pengamatan 21 hari menunjukkan hasil yang berfluktuatif, namun
tidak jauh dari kurva pertumbuhan bakteri pada umumnya. Hasil pengukuran VSS
selama penelitian berlangsung dapat dilihat pada Gambar 4.
Gambar 4. Nilai Volatil Suspended Solid Selama Penelitian
Nilai VSS secara keseluruhan dari semua perlakuan yaitu berkisar antara
0,114-0,193 mg/l. Dari hari ke-0 sampai hari ke-21 biomassa bakteri secara
48
akibat berkurangnya sumber energi. Nilai VSS rata-rata pada tiap-tiap perlakuan
adalah sebagai berikut: pada perlakuan A yaitu 0,169 mg/l, pada perlakuan B
yaitu 0,130 mg/l, pada perlakuan C yaitu 0,114 mg/l, dan pada perlakuan D yaitu
0,193 mg/l. Perlakuan D memiliki nilai rata-rata VSS tertinggi sedangkan
perlakuan C memiliki nilai rata-rata VSS terendah.
Pada hari ke-0 sampai hari ke-2 terjadi peningkatan biomassa bakteri
pada tiap-tiap perlakuan. Hal ini diduga karena sudah dilakukannya pemberian
variasi pakan, bakteri, dan molases sehingga bakteri dapat tumbuh. Pada
perlakuan A yang merupakan kontrol (hanya pakan saja) kenaikan populasi
bakteri yang terjadi sangat sedikit bahkan terkecil. Pada perlakuan B yang
dilakukan pemberian molases dan pakan, bakteri heterotrofik alami mulai tumbuh
dengan adanya sumber karbon organik tersebut, sehingga nilai VSS pada
perlakuan B cukup tinggi. Pada perlakuan C yang hanya dilakukan inokulasi
bakteri dan pakan, nilai VSS yang didapat lebih kecil dari perlakuan B dan D,
karena tidak adanya sumber karbon organik yang merupakan sumber energi
penting bagi pertumbuhan bakteri heterotrofik komersil yang diinokulasikan. Pada
perlakuan D yang dilakukan pemberian pakan, molases, dan inokulasi bakteri
heterotrofik komersil, sangat jelas terlihat memiliki nilai VSS yang cukup tinggi.
Nilai VSS pada perlakuan B dan D pada hari tersebut sama.
Pada hari ke-4 terjadi penurunan jumlah biomassa yang sangat signifikan
pada tiap-tiap perlakuan. Hal ini terjadi karena rendahnya kadar oksigen terlarut
pada hari tersebut, sehingga mengakibatkan terganggunya pertumbuhan bakteri
49
terjadi penurunan pada hari ke-8 sampai hari ke-10 sebesar 0.115 mg/l. Pada hari
ke-13 sampai hari ke-16 mengalami kenaikan sebesar 0.355 mg/l. Pada perlakuan
C pada hari ke-6 sampai hari ke-21 mengalami penurunan secara terus-menerus.
Pada hari ke-6 nilai VSS yang didapat sebesar 0.276 mg/l, pada hari ke-21
menjadi 0.021 mg/l. Pada perlakuan D pada hari ke-4 sampai hari ke-8 terus
mengalami kenaikan yang sangat signifikan, yaitu 0.019-0.603 mg/l, namun pada
hari ke-8 sampai hari ke-13 terjadi penurunan yang sangat signifikan yaitu hingga
0.171 mg/l.
Pada hari ke-16 sampai hari ke-21 secara keseluruhan pada tiap-tiap
perlakuan mengalami penurunan yang sangat signifikan. Perlakuan A sebesar
0.047 mg/l, perlakuan B sebesar 0.012 mg/l, perlakuan C sebesar 0.027 mg/l, dan
perlakuan D sebesar 0.024 mg/l.
Proses kehilangan amonia di perairan disebabkan oleh tiga jenis
mikroorganisme, yaitu oleh bakteri autotrofik (nitrifikasi), bakteri heterotrofik,
dan fotoautotrofik. Pada Perlakuan A dan C, nilai VSS pada kedua perlakuan ini
merupakan nilai biomassa bakteri autotrofik. Karena tidak dilakukannya
50
perlakuan ini adalah bakteri autotrofik yang tumbuh dengan menggunakan sumber
karbon anorganik yaitu CO2. Sedangkan pada perlakuan B dan D, nilai VSS pada
kedua perlakuan ini merupakan nilai biomassa bakteri heterotrofik. Karena pada
kedua perlakuan ini diberikan molases yang merupakan sumber karbon organik,
maka bakteri yang tumbuh diasumsikan sebagai bakteri heterotrofik. Hal ini
sesuai dengan pendapat Jenie dan Rahayu (1993) yang menyatakan bahwa bakteri
yang bersifat heterotrofik adalah bakteri yang mampu memanfaatkan senyawa
organik sebagai sumber karbonnya. Sedangkan proses kehilangan amonia oleh
mikrorganisme fotoautotrofik dianggap tidak terjadi, karena penelitian ini
dilakukan di dalam ruangan.
Pada Gambar 4 dapat dilihat bahwa perlakuan A dan C memiliki kurva
pertumbuhan yang hampir sama, namun nilai rata-rata VSS pada perlakuan A
lebih tinggi dibandingkan perlakuan C. Perlakuan C memiliki nilai rata-rata VSS
paling kecil. Pada perlakuan A tidak dilakukan penambahan bakteri, sedangkan
pada perlakuan C diinokulasikan bakteri heterotrofik. Hal ini yang diduga sebagai
akibat rendahnya nilai VSS pada perlakuan C. Bakteri heterotrofik yang
diinokulasikan bersaing dengan bakteri autotrofik alami yang telah ada didalam
corong, karena tidak adanya sumber karbon organik yang diberikan maka bakteri
heterotrofik dianggap tidak dapat bertahan hidup dan kalah bersaing dengan
bakteri autotrofik alami.
Perlakuan B memiliki nilai rata-rata VSS terendah kedua yaitu 0,130
mg/L. Perlakuan B tidak dilakukan inokulasi bakteri komersial dan hanya
51
perlakuan B ini diduga adalah bakteri heterotrofik alami. Penambahan molases
yang merupakan sumber karbon organik dapat memicu pertumbuhan bakteri
heterotrofik alami, namun pertumbuhan bakteri heterotrofik pada perlakuan B ini
cenderung lambat. Hal ini dapat diakibatkan oleh persaingan bakteri heterotrofik
alami dengan bakteri alami lainnya yang berada didalam corong.
Pada perlakuan D yaitu perlakuan dengan pemberian pakan dengan
penambahan bakteri dan molases yang merupakan sistem heterotrofik, hasil nilai
VSS pada perlakuan D ini sesuai dengan yang diharapkan, bahwa pemberian
bakteri heterotrofik komersial dan penambahan molases pada corong dapat
memicu pertumbuhan bakteri heterotrofik dan menurunkan kadar limbah nitrogen.
Hal yang mengakibatkan nilai rata-rata VSS pada perlakuan D menjadi
paling tinggi dibandingkan dengan perlakuan lainnya adalah waktu generasi
bakteri heterotrof yang lebih tinggi dan lebih cepat jika dibandingkan dengan
bakteri autotrof dan juga pemberian molases yang dapat memicu pertumbuhan
bakteri heterotrofik yang diinokulasikan. Bakteri heterotrofik ini menggunakan
amonia sebagai sumber energi untuk memperbanyak sel. Bakteri autotrof juga
menggunakan amonia pada proses nitrifikasi, namun bakteri autotrofik
membutuhkan waktu yang lebih lama untuk tumbuh. Hal ini sesuai dengan
pernyataan Todar (2002) bahwa Bakteri heterotrofik mempunyai waktu generasi
lebih cepat dibandingkan bakteri autotrofik. Ebeling et al., (2006) menyatakan
bahwa bakteri heterotrofik menghasilkan 8.07 g VSS per gram nitrogen,
sedangkan bakteri autotrofik menghasilkan 0.20 g VSS per gram nitrogen dengan
52
sama. Dari pernyataan diatas dapat terlihat jelas bahwa jumlah populasi bakteri
yang dihasilkan bakteri autotrofik sangat jauh jumlahnya dibandingkan dengan
jumlah populasi bakteri heterotrofik.
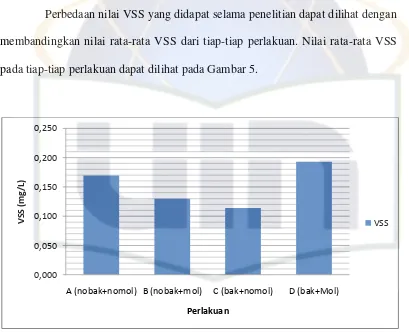
Perbedaan nilai VSS yang didapat selama penelitian dapat dilihat dengan
membandingkan nilai rata-rata VSS dari tiap-tiap perlakuan. Nilai rata-rata VSS
pada tiap-tiap perlakuan dapat dilihat pada Gambar 5.
Gambar 5. Nilai Rata-rata VSS Pada Tiap-tiap Perlakuan
Dari Gambar 5 diatas terlihat bahwa nilai rata-rata VSS tertinggi adalah
perlakuan D. Perlakuan D pada penelitian ini disebut sebagai sistem heterotrofik.
Pada perlakuan D ini terlihat bahwa jumlah biomassa bakteri yang didapat lebih
tinggi dari perlakuan lainnya dengan adanya penambahan molases sebagai sumber
karbon dan inokulasi bakteri komersial, namun nilai VSS yang dihasilkan dari ke
empat perlakuan tidak memiliki perbedaan yang signifikan. Hal ini sesuai dengan 0,000
A (nobak+nomol) B (nobak+mol) C (bak+nomol) D (bak+Mol)
53
hasil uji analisis yang menunjukan bahwa sistem heterotrofik tidak berpengaruh
nyata terhadap nilai VSS, hal ini dapat diperhatikan dari nilai F hitung yang lebih
kecil dari F Tabel dan dari nilai probabilitas (P>0.05) (Lampiran 9). Disamping
itu dari hasil uji Duncan menunjukkan tidak adanya perbedaan nilai VSS yang
nyata pada tiap-tiap perlakuan. Hal ini dapat dilihat dari kolom pada uji Duncan
dimana nilai rata-rata VSS terletak pada kolom yang sama.
4.2. Dinamika Kadar Limbah Nitrogen
Hasil penelitian mengenai dinamika kadar limbah nitrogen selama
penelitian meliputi amonia, nitrit, dan nitrat. Hasil penelitian dinamika limbah
nitrogen selama 21 hari dapat dilihat pada subbab berikut:
4.2.1 Amonia
Amonia merupakan senyawa utama limbah metabolisme ikan dan sering
menjadi masalah dalam budidaya ikan. Amonia merupakan salah satu bentuk
N-anorganik yang berbahaya bagi ikan. Penambahan molases dan bakteri
heterotrofik diharapkan dapat menurunkan jumlah limbah nitrogen yang terdapat
dalam corong, yaitu dengan cara mengubah amonia menjadi biomassa sel dan
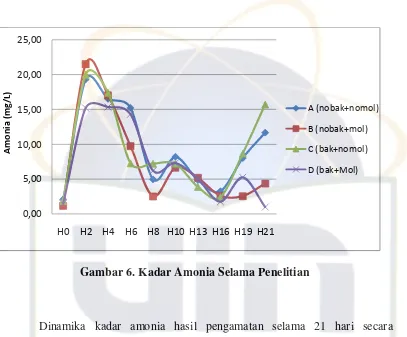
mengoksidasi amonia menjadi nitrit dan nitrat. Kadar amonia hasil pengamatan
54
Gambar 6. Kadar Amonia Selama Penelitian
Dinamika kadar amonia hasil pengamatan selama 21 hari secara
keseluruhan mengalami penurunan. Kisaran kadar amonia secara keseluruhan dari
ke empat perlakuan yaitu 0,98-21,50 mg/L. Kadar amonia rata-rata pada
perlakuan A adalah 9,39 mg/L, pada perlakuan B adalah 7,31 mg/L, pada
perlakuan C adalah 9,14 mg/L, dan pada perlakuan D adalah 7,27 mg/L. Kadar
amonia rata-rata tertinggi yaitu pada perlakuan A sebesar 9,39 mg/L dan terendah
yaitu pada perlakuan D sebesar 7,27 mg/L.
Kadar amonia pada ke-empat perlakuan tidak terlihat adanya perbedaan
yang sangat signifikan. Kehilangan amonia terjadi pada ke-empat perlakuan ini,
namun dalam proses yang berbeda. Pada perlakuan A dan C, proses kehilangan
amonia terjadi melalui proses nitrifikasi oleh bakteri kemoautotrofik yang
mengubah amonia menjadi nitrit dan seterusnya menjadi nitrat. Pada perlakuan B
55
dan D proses kehilangan amonia terjadi karena penggunaan amonia oleh bakteri
heterotrofik sebagai sumber energi yang diubah menjadi biomassa bakteri.
Pada awal penelitian tepatnya pada hari ke-2 kadar amonia sangat tinggi
hingga 21.50 mg/L. Tingginya kadar amonia diakibatkan oleh adanya akumulasi
hasil metabolit ikan dan sisa pakan. Setelah itu terjadi penurunan yang bertahap
pada tiap-tiap perlakuan akibat adanya aktivitas mikroorganisme. Penurunan ini
diakibatkan adanya aktivitas mikroorganisme yang mengoksidasi amonia menjadi
nitrit dan nitrat (bakteri autotrofik nitrifikasi) pada perlakuan A dan C serta yang
mengubah amonia menjadi biomassa bakteri (bakteri heterotrofik) pada perlakuan
B dan D. Hal ini sesuai dengan pernyataan Brune et al., (2003) bahwa penurunan
kadar amonia terjadi antara lain karena adanya pemanfaatan amonia oleh proses
heterotrofik biosintesis bakteri yang menghasilkan biomassa bakteri dan proses
kemoautotrofik nitrifikasi yang menghasilkan senyawa nitrit yang selanjutnya
diubah lagi menjadi nitrat.
Pada perlakuan A dan C terus mengalami penurunan hingga hari ke-16.
Hal ini terjadi karena adanya proses nitrifikasi oleh bakteri autotrofik yang
mengubah amonia menjadi nitrit. Pada hari ke-16 sampai hari ke-21 terjadi
kenaikan kadar amonia kembali yang signifikan pada kedua perlakuan ini. Hal ini
terjadi karena besarnya produksi amonia yang berasal dari hasil metabolisme ikan
dan sisa pakan dibandingkan dengan proses nitrifikasi yang terjadi.
Pada perlakuan B dan D terjadi penurunan terus menerus pada hari ke-4
sampai hari ke-21. Hal ini menunjukan adanya aktivitas bakteri heterotrofik yang
56
et al., (1990) bahwa penurunan kadar amonia disebabkan oleh penggunaan
amonia sebagai sumber energi oleh bakteri heterotrofik untuk sintesis biomassa
sel. Selain itu Montoya dan Velasco (2000) mengatakan bahwa amonia yang
dikeluarkan oleh ikan di dalam air akan membentuk kesetimbangan dengan ion
ammonium. Amonia dalam bentuk ion ammonium akan mengalami proses
nitrifikasi, namun demikian dengan adanya bahan organik, proses mikrobial yang
berlangsung didominasi oleh bakteri heterotrofik yang lebih cepat menyerap
ammonium menjadi biomasa bakteri. Bakteri ini bisa menyerap sampai 50% dari
jumlah ammonium terlarut dalam air. Pernyataan diatas membuktikan bahwa pada
perlakuan B dan D terjadi proses kehilangan amonia oleh bakteri heterotrofik
karena dilakukan perlakuan pemberian molases yang merupakan sumber karbon
organik.
Hasil uji analisis menunjukan bahwa sistem heterotrofik tidak
berpengaruh nyata terhadap kadar amonia, hal ini dapat diperhatikan dari nilai F
hitung yang lebih kecil dari F Tabel dan dari probabilitas (P>0.05) (Lampiran 9).
Di samping itu hasil dari uji Duncan menunjukkan bahwa tidak adanya perbedaan
kadar amonia yang nyata pada tiap-tiap perlakuan. Hal ini dapat dilihat dari kolom
pada uji Duncan dimana semua rata-rata kadar amonia terletak pada kolom yang
57
4.2.2 Nitrit
Nitrit merupakan hasil oksidasi amonia dalam proses nitrifikasi yang
selanjutnya diubah menjadi nitrat (Boyd, 1981). Kadar nitrit dalam pengamatan
selama 21 hari dapat dilihat dalam Gambar 7.
Gambar 7. Kadar Nitrit Selama Penelitian
Dinamika kadar nitrit yang didapat cukup berfluktuatif, namun secara
keseluruhan terjadi kenaikan. Hasil penelitian kadar nitrit yang didapat yaitu
sebesar 0,229-36,216 mg/L. Kadar nitrit rata-rata yang didapat pada tiap-tiap
perlakuan secara berturut-turut adalah sebagai berikut : pada perlakuan A yaitu
11,205 mg/L, pada perlakuan B yaitu 6,916 mg/L, pada perlakuan C yaitu 18,722
mg/L, dan pada perlakuan D yaitu 3,335 mg/L. Kadar nitrit rata-rata tertinggi
yaitu pada perlakuan C dan terendah pada perlakuan D. Konsentrasi nitrit yang
58
pada ikan. Menurut Effendi (2003) konsentrasi nitrit maksimum yang
diperbolehkan dalam kegiatan budidaya ikan adalah < 0.06 mg/L.
Pada Gambar 7 diatas, pada hari ke-0 sampai hari ke-4 kadar nitrit dari
tiap-tiap perlakuan memiliki nilai yang rendah yaitu 0,229-3,331 mg/L. Hal ini
disebabkan oleh aktivitas mikroorganisme yang rendah khususnya pada perlakuan
A dan C. Mikroorganisme pada perlakuan ini diduga berada pada fase adapatasi,
sehingga amonia yang ada belum digunakan dan mengakibatkan kadar nitrit pada
hari tersebut rendah, hal ini dibuktikan dengan kadar amonia yang tinggi pada hari
tersebut.
Pada hari ke-4 kadar nitrit mulai mengalami kenaikan pada tiap-tiap
perlakuan sampai hari ke-13. Hal ini menunjukkan adanya aktivitas
mikroorganisme pada tiap-tiap perlakuan khususnya pada perlakuan A dan C yang
terdapat bakteri autotrofik nitrifikasi yang mengoksidasi amonia menjadi nitrit dan
selanjutnya menjadi nitrat. Pada hari ke-13 sampai hari ke-16 pada perlakuan A
dan C mengalami penurunan kadar nitrit yang signifikan. Hal ini terjadi karena
kadar amonia pada hari tersebut menurun, sehingga bakteri autotrofik hanya dapat
mengubah amonia yang ada dan menghasilkan nitrit dalam jumlah yang sangat
kecil.
Pada hari ke-16 sampai hari ke-19 pada perlakuan A dan C, kadar nitrit
mengalami kenaikan yang signifikan. Hal ini disebabkan oleh tingginya aktivitas
bakteri autotrofik. Pada hari ke-21 terjadi penurunan yang signifikan. Hal ini
disebabkan berkurangnya aktivitas mikroorganisme akibat menurunnya jumlah
59
Pada perlakuan C terjadi proses nitrifikasi yaitu proses oksidasi amonia
menjadi nitrit dan nitrat, sehingga kadar nitrit pada perlakuan ini memiliki nilai
tertinggi. Perlakuan A memiliki kadar nitrit tertinggi kedua setelah perlakuan C.
Pada perlakuan A dan C penyebab tingginya kadar nitrit yang dihasilkan sama
yaitu karena adanya aktivitas bakteri nitrifikasi autotrofik. Bakteri autotrofik
menggunakan amonia sebagai sumber energi dengan cara mengoksidasi amonia
menjadi nitrit, sehingga kadar nitrit menjadi tinggi. Sesuai dengan pernyataan
Boyd (1981) yang menjelaskan bahwa nitrit hasil dari oksidasi amonia dalam
proses nitrifikasi oleh bakteri autotropik Nitrosomonas, yang menggunakan
amonia sebagai sumber energi.
Kadar nitrit pada perlakuan B terlihat cukup tinggi. Dinamika kadar nitrit
pada perlakuan ini berfluktuasi. Pada hari ke-4 sampai hari ke-10 terus mengalami
kenaikan. Pada hari ke-10 sampai hari ke-16 mengalami penurunan yang
signifikan, namun pada hari ke-16 sampai hari ke-21 mengalami kenaikan
kembali. Kadar nitrit yang dihasilkan pada perlakuan B menunjukkan bahwa
adanya aktivitas bakteri autotrof yang berperan melakukan proses nitrifikasi dan
jumlah bakteri tersebut diduga tidak sedikit jika dilihat dari kadar nitrit yang
dihasilkan. Adanya bakteri autotrof ini mengakibatkan adanya persaingan dalam
mengkonsumsi amonia. Persaingan ini mengakibatkan jumlah biomassa bakteri
pada perlakuan B rendah.
Kadar nitrit pada perlakuan D pada hari ke-0 sampai hari ke-4 sangat
rendah. Pada hari ke-4 mengalami kenaikan yang cukup tinggi sampai hari ke-10.