SKRIPSI
PENGARUH PEMBERIAN BAKTERI HETEROTROF TERHADAP KUALITAS AIR PADA BUDIDAYA IKAN LELE DUMBO
(Clarias sp.) TANPA PERGANTIAN AIR
Oleh : DWI ERNAWATI
PONOROGO – JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
SURABAYA 2014
Yang bertanda tangan di bawah ini : N a m a : Dwi Ernawati
N I M : 141011017
Tempat, tanggal lahir : Ponorogo, 27 Mei 1992
Alamat : Dsn. Plongko RT 01/02 Ds. Jurug Kec. Sooko- Ponorogo. Telp./HP : 085733922271
Judul Skripsi : Pengaruh Pemberian Bakteri Hetrotrof Terhadap Kualitas Air Pada Budidaya Lele Dumbo (Clarias sp.) Tanpa Pergantian Air
Pembimbing : 1. Prayogo, S.Pi., MP
2. Boedi Setya Rahadja, Ir. MP
Menyatakan dengan sebenarnya bahwa hasil tulisan laporan Skripsi yang saya buat adalah murni hasil karya saya sendiri (bukan plagiat) yang berasal dari dana pribadi. Didalam skripsi / karya tulis ini tidak terdapat keseluruhan atau sebagian tulisan atau gagasan orang lain yang saya ambil dengan cara menyalin atau meniru dalam bentuk rangkaian kalimat atau simbol yang saya aku seolah-olah sebagai tulisan saya sendiri tanpa memberikan pengakuan pada penulis aslinya, serta kami bersedia :
1. Dipublikasikan dalam Jurnal Ilmiah Perikanan dan Kelautan Fakultas Perikanan dan Kelautan Universitas Airlangga;
2. Memberikan ijin untuk mengganti susunan penulis pada hasil tulisan skripsi / karya tulis saya ini sesuai dengan peranan pembimbing skripsi; 3. Diberikan sanksi akademik yang berlaku di Universitas Airlangga,
termasuk pencabutan gelar kesarjanaan yang telah saya peroleh (sebagaimana diatur di dalam Pedoman Pendidikan Unair 2010/2011 Bab. XI pasal 38 – 42), apabila dikemudian hari terbukti bahwa saya ternyata melakukan tindakan menyalin atau meniru tulisan orang lain yang seolah-olah hasil pemikiran saya sendiri
Demikian surat pernyataan yang saya buat ini tanpa ada unsur paksaan dari siapapun dan dipergunakan sebagaimana mestinya.
Surabaya, 28 Agustus 2014 Yang membuat pernyataan,
Dwi Ernawati NIM. 141011017
SKRIPSI
PENGARUH PEMBERIAN BAKTERI HETEROTROF TERHADAP KUALITAS AIR PADA BUDIDAYA LELE DUMBO (Clarias sp.)
TANPA PERGANTIAN AIR
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Perikanan pada Fakultas Perikanan dan Kelautan Universitas Airlangga
Oleh : DWI ERNAWATI NIM. 141011017 Mengetahui, Komisi Pembimbing Pembimbing Utama Prayogo, S.Pi., MP NIP. 19750522 200312 1 002 Pembimbing Serta
Boedi Setya Rahardja, Ir., MP NIP. 19580117 198601 1 001
SKRIPSI
PENGARUH PEMBERIAN BAKTERI HETEROTROF TERHADAP KUALITAS AIR PADA BUDIDAYA LELE DUMBO (Clarias sp.)
TANPA PERGANTIAN AIR
Oleh : DWI ERNAWATI
NIM. 141011017
Telah diujikan pada
Tanggal : 22 September 2014
KOMISI PENGUJI SKRIPSI
Ketua : Dr. Hj. Gunanti Mahasri, Ir., M.Si Anggota : Dr. Woro Hastuti Satyantini, Ir., M.Si
Abdul Manan., S.Pi., M.Si Prayogo, S.Pi., MP
Boedi Setya Rahrdja, Ir., MP
Dekan
Fakultas Perikanan dan Kelautan Universitas Airlangga
Prof. Dr. Hj. Sri Subekti, drh., DEA NIP. 19520517 197803 2 001
RINGKASAN
DWI ERNAWATI. Pengaruh Pemberian Bakteri Heterotrof Terhadap Kualitas Air Pada Budidaya Lele Dumbo (Clarias sp.) Tanpa Pergantian Air. Dosen Pembimbing: Prayogo, S.Pi., MP., dan Boedi Setya Rahardja, Ir., MP.
Ikan lele dumbo (Clarias sp.) sebagai komoditas air tawar memiliki permintaan yang tinggi. Salah satu cara untuk memenuhi kebutuhan permintaan lele dumbo adalah perbaikan kualitas air sehingga produktifitas ikan semakin meningkat. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh pemberian probiotik yang mengandung bakteri heterotrof berbeda pada perairan dan pengaruhnya terhadap kadar ammonia dan kadar nitrit pada media budidaya lele dumbo.
Penelitian ini menggunakan metode eksperimental, menggunakan Rancangan Acak Lengkap (RAL). Ikan lele dumbo dipelihara selama 30 hari dengan empat perlakuan dan empat ulangan yaitu P1 (kontrol), P2 (probiotik A), P3 (probiotik B), dan P4 (probiotik C). Data yang diperoleh diolah menggunakan Analysis of Variance (ANOVA) dan dilanjutkan Uji Berjarak Duncan karena didapatkan hasil yang berbeda nyata.
Hasil dari penelitian menunjukkan bahwa pemberian probiotik yang mengandung bakteri heterotrof pada perairan mampu menekan produksi amoniak dan nitrit yang berbeda nyata (p<0,05). Produksi kadar ammonia terendah adalah P4 sebesar 0,2093 ± 0.01483, dan tertinggi pada P1 sebesar 0,2641 ± 0,01357. Produksi kadar nitrit terendah pada P4 sebesar 0,0509 ± 0,00644, dan tertinggi pada P1 sebesar 0, 0988± 0,00404. Selama masa pemeliharaan kadar DO dalam media sebesar 6,3mg/L – 9 mg/L, suhu 26,6oC – 30oC, dan pH antara 7,22 – 8,60.
SUMMARY
DWI ERNAWATI. Influence of Heterotrophic Bacteria Giving Against Water Quality of African Catfish (Clarias sp.) Culture With No Water Exchange. Academic Advisors Prayogo, S.Pi., MP., and Boedi Setya Rahadja, Ir., MP.
Freshwater commodity such as the African catfish (Clarias sp.) has the high demand. One way to complete demand is make the good water quality to get the high productivity. The aims of this research is known about the effect of different probiotic used which contain by heterotrophic bacteria against ammonia and nitrite production in the media.
The research using experimental method, with the Completely Randomized Design (CRD). The African catfish kept in 30 days with four treatments and four replications, that is P1 (control), P2 (probiotic A), P3 (probiotic B), and P4 (probiotic C). The obtained data were processed by Analysis of Variance (ANOVA) and followed by Duncan Multiple Range Test because there was significant data.
The result showed that the different probiotic used which contain by heterotrophic bacteria in the media giving the significant effect to ammonia and nitrite concentration. The lowest production of ammonia concentration in the media showed by P4 0,2093±0,01483 and the highest production of ammonia concentration in the media showed by P1 0,2641±0,01357. The lowest production of nitrite concentration in the media showed by P4 0,0509± 0,00644; and the highest production of nitrite concentration in the media showed by P1 0,0988±0,00404. During the research, the concentration of DO (Dissolved Oxygen) is between 6,3 mg/L to 9 mg/L, temperature is 26,6oC to 30oC and pH is 7,22 to 8,26.
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan rahmat dan hidayah Nya, sehingga Skripsi dengan judul “ Pengaruh Pemberian Bakteri Hetrotrof terhadap Kualitas Air pada Budidaya Lele Dumbo (Clarias sp.) tanpa Pergantian Air” ini dapat terselesaikan. Laporan skripsi ini disusun berdasarkan hasil penelitian yang telah dilaksanakan di Laboratorium Pendidikan Fakultas Perikanan dan Kelautan, dan merupakan salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya.
Penulis berharap semoga laporan ini bermanfaat dan dapat memberikan informasi kepada semua pihak, khusus bagi Mahasiswa Program Studi S-1 Budidaya Perairan, Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya untuk kemajuan dan perkembangan ilmu pengetahuan dan teknologi dalam bidang perikanan.
Surabaya, Agustus 2014
UCAPAN TERIMA KASIH
Dengan ucapan syukur Alhamdulillah, atas terselesaikannya laporan ini, tak
lupa ucapan terima kasih disampaikan kepada :
1. Dekan Fakultas Perikanan dan Kelautan, ibu Prof. Dr. Hj. Sri Subekti,drh., DEA
2. Dosen wali, bapak Agustono, Ir., M.Kes atas bimbingan, dan saran selama masa perkuliaahan.
3. Bapak Prayogo, S.Pi., MP., dan bapak Boedi Setya Rahadja, Ir., MP., selaku dosen pembimbing yang telah memberikan bimbingan, arahan dan saran yang
membangun mulai dari penyusunan proposal, penelitian, sampai
terselesaikannya laporan penelitian ini.
4. Ibu Dr. Gunanti Mahasri, Ir., M.Si., ibu Dr. Woro Hastuti S., Ir., M.Si., dan Bapak Abdul Manan, S.Pi., M.Si, selaku selaku dosen penguji yang telah
memberikan saran untuk perbaikan proposal dan laporan skripsi ini.
5. Teman satu tim penelitian Savitri Aprilyana, Nina Agustiningtyas, Id’ham Muhtar, Ahmad Nizar, dan Winda Kusuma yang telah bekerja sama dalam
suka duka selama penelitian ini.
6. Temanku Maratus Solihah, Rinda Rustiani, beserta seluruh keluarga besar Kwarran Sooko 130218, Gantri, Ayu Pus, Ayu Yul, Binti, dan rekan-rekan
7. Kedua orang tua tercinta, Benni dan Katiyah, serta kakak terbaik Bagus dan Irawati yang senantiasa memberikan segala dukungan dan doa hingga skripsi
ini selesai.
8. Semua pihak yang tidak bisa disebutkan, terimakasih atas segala dukungan, bantuan, kritik dan saran hingga skripsi ini selesai.
DAFTAR ISI
Halaman
RINGKASAN ... iv
SUMMARY ... v
KATA PENGANTAR ... vi
UCAPAN TERIMA KASIH ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
I PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 3 1.3 Tujuan ... 3 1.4 Manfaat ... 3 II TINJAUAN PUSTAKA 2.1 Ikan Lele dumbo (Clarias sp.)……… …… 4
2.2.1 Klasifikasi dan Morfologi ………....…...……. 4
2.2.2 Habitat dan Kebiasaan Hidup………….………..… 5
2.2.3 Kualitas Air Untuk Ikan lele ..………... 5
2.2 Bakteri hetertrof ………...…….. 8
2.2.1 Peran Bakteri hetertrof ……….…….. 9
2.3 Budidaya Tanpa Pergantian Air………...…... 10
III KERANGKA KONSEPTUAL DAN HIPOTESIS 3.1 Kerangka Konseptual ... 12
IV METODOLOGI PENELITIAN
4.1 Tempat dan Waktu Pelaksanaan ... 16
4.2 Materi Penelitian ... 16 4.2.1 Alat Penelitian... 16 4.2.2 Bahan Penelitian ……….. .. 16 4.3 Metode Penelitian ... 17 4.3.1 Rancangan Penelitian ... 17 4.4 Prosedur Kerja ... 18
4.4.1 Persiapan Media dan Benih ………... 18
4.4.2 Pemeliharaan ... 19
4.5 Parameter Peneitian ... 21
4.5.1 Pengukuran Kadar Amonia ... 21
4.5.2 Pengukuran Kadar Nitrit ... 22
4.5.3 Pengukuran Suhu, DO, dan pH ... 23
4.6 Analisis Data ... 24
V HASIL DAN PEMBAHASAN 5.1 Hasil ... 25
5.1.1 Kadar Amonia ... 25
5.1.2 Kadar Nitrit ... 26
5.1.3 Suhu, DO, dan pH ... 28
5.2 Pembahasan ... 29
5.2.1 Kadar Amonia ... 29
5.2.2 Kadar Nitrit ... 32
VI SIMPULAN DAN SARAN
6.1 Simpulan ... 37
6.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Tabel Halaman
2.1.Kualitas Air untuk Ikan lele ………5
4.1 Denah Acak Rancangan Penelitian………18 4.2 Parameter kualitas air, satuan, dan alat pengukururan…………21
5.1 Produksi ammonia selama 30 hari ... 25
5.2 Produksi kadar nitrit selama 30 hari .. ... 27
DAFTAR GAMBAR
Gambar Halaman
2.1. Ikan lele dumbo Clarias sp ... 4
3.1 Kerangka konseptual penelitian ... 14
4.1 Diagram Alir Penelitian ... 20
5.1 Grafik Fluktuasi ammonia selama 30 hari…………..………26
DAFTAR LAMPIRAN
Lampiran Halaman
1. Data nilai Absorbansi ammonia pada beberapakonsentrasi……...42
2. Data Nilai Amonia harian pada masing-masing perlakuan ... ……….43
3. Analisa statistik peningkatan kadar NH3 selama 30 hari ... ...44
4. Data nilai Absorbansi Nitrit pada beberapa konsentrasi………. 46
5. Data nilai Nitrit harian ... .47
6. Analisa statistik peningkatan kadar NO2 selama 30 hari ... …… 48
7. Data rata-rata pH selama 30 hari………. 50
8. Data Suhu harian selama 30 hari………...51
9. Data DO harian selama 30 hari ... ...52
10. Analisa proksimat pakan ... ... ...53
I PENDAHULUAN
1.1 Latar Belakang
Dunia akuakultur mengalami perkembangan yang semakin pesat. Salah
satu pendukungnya adalah program penggalakan budidaya perikanan diberbagai
sektor oleh pemerintah. Salah satu sektor yang sedang digalakkan adalah sektor
budidaya perikanan tawar. Peningkatan produktifitas perikanan tawar merupakan
program pemerintah dalam menyongsong program minapolitan (KKP, 2011).
Ikan lele merupakan salah satu spesies ikan air tawar yang banyak
dibudidayakan di Indonesia. Ikan lele dapat dikembangkan di berbagai daerah
untuk penyediaan protein hewani dan peningkatan pendapatan masyarakat.
Produksi ikan lele di Indonesia pada rentang waktu antara tahun 2005-2009
menunjukkan peningkatan produksi rata-rata sebesar 31,55% per tahun, dengan
nilai produksi dari 486.166.245 ton menjadi 1.434.956.984 ton (KKP, 2011).
Ikan lele dumbo (Clarias sp.) merupakan komoditas unggulan air tawar
yang sangat populer serta mempunyai pasar yang baik. Permintaan pasar akan
ikan lele dumbo sekarang ini telah berkembang pesat kenaikan mencapai 18,7 %
per tahun, karena ikan lele dumbo mempunyai keunggulan dibanding dengan
ikan lele lokal yaitu pertumbuhannya lebih cepat, dapat mencapai ukuran lebih
besar dan lebih banyak kandungan telurnya (Mahyuddin, 2007).
Salah satu pendorong pengembangan akuakultur adalah pemanfaatan
lahan sempit dengan pola manajemen akuakultur yang efektif dan efisien (Mukti,
mengakibatkan penambahan area budidaya dan penambahan air. Budidaya lele
tanpa pergantian air dapat menghemat pemakaian air sehingga lebih ekonomis,
dan dapat slakukan secara intensif.
Sisa pakan ikan, hasil ekskresi organisme dan plankton yang mati serta
material organik berupa padatan tersuspensi maupun terlarut yang masuk
melewati sumber air (inflow water) merupakan sumber bahan organik pada media
pemeliharaan. Hal ini menyebabkan akumulasi bahan organik di perairan. Input
bahan organik ini semakin bertambah seiring dengan aktivitas budidaya karena
kebutuhan pakan organisme akuatik mengikuti pertumbuhan biomassanya (Boyd,
1990).
Pada budidaya tanpa pergantian air terjadi masalah kualitas air pada
budidaya lele dumbo. Sistem budidaya tanpa pergantian air menyebabkan
akumulasi sisa pakan, feses, dan kualitas air yang buruk ( Sitompul dkk. 2012).
Selain itu, menurut Spotte (1970), sisa pemberian pakan yang akan menghasilkan
bahan organik yang akan membentuk ammonia, nitrit, dan nitrat.
Ammonia dan nitrit dalam perairan dihasilkan oleh bahan organik yang
terakumulasi dalam perairan. Ammonia pada perairan mampu menyebabkan
kematian pada ikan apabila kandungannya terlalu tinggi, yaitu lebih dari 0,8 mg/L
(Stickney, 2005), sedangkan nitrit akan bersifat toksik apabila kadar nitrit dalam
perairan lebih dari 0,05 mg/L (Moore, 1991).
Bakteri heterotrof merupakan salah satu agen biologis yang berperan
sebagai organisme pengurai sisa pakan dan bahan organik di dasar perairan.
ammonia dan nitrit pada budidaya lele tanpa pergantian air. Menurut Avnimelech
(1999), adanya pemanfaatan nitrogen anorganik oleh bakteri heterotrof mencegah
terjadinya akumulasi nitrogen anorganik pada kolam budidaya yang dapat
menurunkan kualitas air. Bakteri heterotrof memanfaatkan ammonia sebagai
sumber energi untuk regenerasi sel (Todar, 2002).
1.2 Perumusan Masalah
Rumusan masalah yang dalam penelitian ini adalah:
1. Apakah pemberian bakteri heterotrof berpengaruh terhadap kandungan amonia pada budidaya lele dumbo (Clarias sp.) tanpa pergantian air?
2. Apakah pemberian bakteri heterotrof berpengaruh terhadap kandungan nitrit pada budidaya lele dumbo (Clarias sp.) tanpa pergantian air?
1.3 Tujuan
Tujuan dari penelitian ini adalah :
1. Mengetahui pengaruh pemberian bakteri heterotrof terhadap kandungan amonia pada budidaya lele dumbo (Clarias sp.) tanpa pergantian air.
2. Mengetahui pengaruh pemberian bakteri heterotrof terhadap kandungan nitrit pada budidaya lele dumbo (Clarias sp.) tanpa pergantian air.
1.4 Manfaat
Manfaat dari penelitian ini adalah untuk memberikan informasi ilmiah
kepada mahasiswa dan masyarakat umum tentang pengaruh penggunaan bakteri
heterotrof dan peranannya terhadap kualitas air pada budidaya ikan lele dumbo
II TINJAUAN PUSTAKA 2.1 Lele Dumbo (Clarias sp.)
2.1.1 Klasifikasi dan Morfologi Lele Dumbo
Klasifikasi ikan lele (Clarias sp.) menurut Nelson (2006) adalah:
Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Siluriformes Famili : Clariidae Genus : Clarias Spesies : Clarias sp.
Gambar 2.1. Ikan lele dumbo (Clarias sp.) Sumber: http://www.fao.org/fishery/species/2982/en
Diakses pada tanggal: 22 Juli 2014
Ikan lele atau airbreathing catfish merupakan salah satu ikan dari ordo
Siluriformes atau catfish. Salah satu spesies dari ordo Siluriformes adalah genus
Clarias. Ikan dari genus Clarias memiliki bentuk yang panjang, dengan sirip di sepanjang dorsal tubuhnya. Sirip ekornya membulat, berbentuk setengah
lingkaran. Ikan lele memiliki empat kumis atau barbells di bagian mulut dan
memiliki organ pernafasan yang disebut labirin (Nelson, 2006).
Ikan Lele mempunyai ciri-ciri lain yaitu tidak bersisik serta licin
mengeluarkan lendir. Bagian kepala sampai punggung berwarna coklat
kehitaman. Ikan lele memiliki insang dengan yang terletak pada belakang kepala
2.1.2 Habitat dan Kebiasaan Hidup Lele Dumbo
Habitat ikan lele dumbo adalah di sungai dengan arus air yang perlahan,
rawa, telaga, waduk, sawah yang tergenang air. Ikan lele bersifat noktural, yaitu
aktif bergerak mencari makanan pada malam hari. Pada siang hari, ikan lele
berdiam diri dan berlindung di tempat-tempat gelap. Di alam ikan lele memijah
pada musim penghujan. Ikan lele dapat hidup pada suhu 20 oC, dengan suhu
optimal 25-28 oC. Pertumbuhan larva diperlukan kisaran suhu antara 26-30 oC dan
untuk pemijahan 24-28 oC, pada pH 6,5–9 (Mahyudin, 2008).
Puspowardoyo dan Djariyah (2002) menyatakan ikan lele dumbo cocok
dibudidayakan pada kolam air tenang tanpa penggantian air. Ikan lele menyukai
perairan tenang, dengan tepi yang dangkal, dan terlindung sehingga bisa membuat
lubang sebagai sarang untuk melangsungkan pemijahan (Hendrawati, 2011).
2.1.3 Kualitas Air untuk Ikan Lele
Lingkungan perairan berpengaruh terhadap pemeliharaan, pertumbuhan
dan reproduksi ikan budidaya (Forteath et al. 1993). Jika kualitas air melewati
batas toleransi, akan menimbulkan penyakit pada ikan. Kualitas air untukikan lele
dumbo dapat dilihat pada Tabel 2.1.
Tabel 2.1 Kualitas air yang cocok untuk ikan lele
Parameter Kisaran Amoniak (mg/L) < 0,8 (Stickney, 2005) Nitrit (mg/L) < 0,05 (Moore, 1991) Suhu oC 25-30 (Boyd, 1982) pH 6.5- 9 ( Wedemeyer, 1996) DO (mg/L) >5 (Foertheat et.al., 1993)
A. Amoniak (NH3)
Bahan organik yang terakumulasi akan menyebabkan terjadinya
pembentukan senyawa-senyawa yang beracun bagi ikan, mineralisasi nutrien dari
bahan organik dan penyerapan oksigen yang tinggi (Hopkins et al., 1994)
sehingga kualitas air menurun cepat. Mineralisasi bahan organik nitrogen akan
menghasilkan ammonia (NH3), nitrit (NO2) dan nitrat (NO3) (Spotte, 1992). Amonia merupakan bentuk pecahan nitrogen organik yang bersifat toksik
terhadap organisme budidaya. Ikan akan mencerna protein dalam pakan dan
mengekskresikan amonia melalui insang dan feses. Amonia pada lingkungan
budidaya juga berasal dari proses dekomposisi bahan organik seperti sisa pakan,
alga mati dan tumbuhan akuatik (Duborow et al., 1997).
Konsentrasi amonia yang tinggi di dalam air akan mempengaruhi
permeabilitas ikan oleh air dan mengurangi konsentrasi ion didalam tubuh.
Amonia juga meningkatkan konsumsi oksigen di jaringan, merusak insang, dan
mengurangi kemampuan darah mengangkut oksigen (Boyd, 1982). Amonia dapat
menyebabkan kematian pada konsentrasi > 0,8 mg/L (Stickney, 2005).
Nilai ammonia (NH3) tergantung pada nilai pH dan suhu perairan (Van Wyk dan Scarpa, 1999). Semakin tinggi suhu dan pH air, persentase amoniak
semakin tinggi (Boyd, 1990).
B. Nitrit (NO2)
Nitrit merupakan bentuk nitrogen yang relatif tidak stabil dan mudah
teroksidasi, dan biasanya merupakan indikator tingkat polusi. Walaupun dalam
(Metcalf and Eddy, 1991). Dalam lingkungan budidaya akan terjadi akumulasi
nitrit apabila proses lanjutan dari nitrifikasi yang akan mengubah nitrit menjadi
nitrat tidak dapat berjalan ( Van Wyk and Scarpa, 1999). Konsentrasi maksimum
senyawa nitrit di perairan budidaya adalah kurang dari 0,05 mg/L (Moore, 1991).
Senyawa nitrit yang terikat pada darah ikan akan membentuk
Methaemoglobin (Hb + NO 2
-
= Met-Hb). Met-Hb akan mengganggu proses
transportasi oksigen ke jaringan-jaringan ikan sehingga dapat menyebabkan ikan
mengalami hypoxia. Met-Hb dalam darah menyebabkan darah berwarna coklat.
Oleh karenanya keracunan nitrit disebut juga penyakit brown blood (Van Wyk
dan Scarpa, 1999).
C. Suhu
Suhu merupakan faktor pengontrol (controlling factor) dan berperan
dalam sistem resirkulasi. Suhu merupakan efek terbesar dalam fisiologi ikan. Hal
ini karena ikan menyesuaikan suhu tubuhnya mendekati keseimbangan suhu air.
Suhu mempunyai pengaruh yang nyata pada respirasi, pemasukan pakan,
kecernaan, pertumbuhan dan berpengaruh terhadap metabolisme ikan (Forteath
et.al., 1993).
Setiap spesies mempunyai suhu optimum untuk pertumbuhan optimumnya
dan kisaran toleransi suhu agar ikan masih bisa hidup. Suhu di atas dan di bawah
kisaran optimum, menyebabkan pertumbuhan menurun. Metabolisme rendah
atas kisaran optimum konsumsi pakan meningkat untuk mengimbangi kecepatan
metabolisme yang tinggi, dan pertumbuhan tidak meningkat (Stickney, 1979).
D. Derajat keasaman (pH)
Nilai pH (power of hydrogen) merupakan ukuran konsentrasi ion H+ di dalam air (Forteath et al. 1993). Nilai pH yang baik untuk sistem intensif adalah
6,5-9 (Wedemeyer, 1996). Jika pH terlalu tinggi (lebih dari 8) maka toksisitas
amonia meningkat. Menjaga pH air dalam sistem resirkulasi sekitar 7,2 dalam air
tawar dan 7,8-8,2 di air laut merupakan hal penting dalam budidaya ikan (Forteath
et al., 1993). Nilai pH yang kurang dari 6,0 dan lebih dari 9,0 untuk waktu yang cukup lama akan mengganggu reproduksi dan pertumbuhan (Boyd, 1982).
E. Disolved Oxigen (DO)
Oksigen terlarut (DO) merupakan faktor pembatas dalam sistem budidaya.
Oksigen terlarut merupakan variabel kualitas air yang paling penting untuk
dimonitor dalam budidaya ikan. Bila DO tidak dijaga pada nilai yang memenuhi,
maka ikan menjadi stres dan tidak dapat makan dengan baik (Stickney, 1979).
Nilai DO dibawah minimum (kurang dari 5 ppm) dapat menurunkan
kecepatan pertumbuhan organisme dan efisiensi pemasukan pakan yang optimal.
Oksigen dapat hilang atau berkurang dari air sebagai hasil reaksi kimia anorganik
dan dekomposisi bahan organik oleh mikroorganisme (Stickney, 1979). Pada
umumnya jika konsentrasi DO lebih dari 5 mg/L, kondisi ini relatif aman untuk
2.2 Bakteri Heterotrof
Banyak jenis bakteri yang digunakan untuk membuat probiotik. Beberapa
diantaranya adalah dari golongan bakteri heterotrof. Bakteri heterotrof adalah
bakteri yang membutuhkan karbon organik dan nitrogen anorganik sebagai
sumber energi. Selain karbon, bahan yang dibutuhkan oleh bakteri adalah
nitrogen, yang dapat ditemukan pada bahan organik dan anorganik. Bakteri
mampu menggunakan amonium dan nitrat sebagai sumber nitrogen (Parker,
1997).
Menurut Prasad and Power (1997), bakteri heterotrof adalah bakteri
pengurai senyawa organik (mineralisasi).Nitrogen anorganik (ammonia, nitrit,dan
nitrat) yang berasal dari dekomposisi pakan tak termakan (uneaten feed), feses
dan ekskresi ikan dimanfaatkan oleh bakteri heterotrof (Avnimelech, 1999).
2.2.1 Peran Bakteri Heterotrof dalam Perairan
Bakteri heterotrof berperan penting untuk menjaga keseimbangan kualitas
air karena bakteri heterotrof mampu mengasimilasi bahan organik secara langsung
dari lingkungan abiotik, dari materi yang dilepaskan sebagai hasil ekskresi, atau
dari organisme yang mati di dalam ekosistem perairan. Bahan tersebut
dimanfaatkan sebagai sumber energi untuk pertumbuhan bakteri heterotrof (Sugita
et al., 1985) .
Bakteri heterotrof mengawali tahap degradasi senyawa organik dengan
serangkaian tahap reaksi enzimatis. Pemecahan senyawa dapat berlangsung cepat
jika jumlah oksigen dalam perairan mencukupi (Parwanayoni, 2008). Menurut
dari ligkungan abiotik yang berasal dari hasil ekskresi atau organisme yang mati
dalam perairan.
Menurut Woon (2007), pertumbuhan bakteri heterotrof mempengaruhi
jumlah nitrogen dalam perairan. Bakteri heterotrof mampu menyerap sampai 50%
dari jumlah ammonium terlarut dalam air. Bakteri heterotrof menyerap ammonia
dalam perairan untuk digunakan sebagai sumber energi dalam proses regenerasi
sel (Todar, 2002). Selain itu, penyerapan ammonia oleh bakteri heterotrof lebih
cepat dariapada bakteri autotrof pada waktu yang sama (Ebeling et.al., 2006).
Ammonia diperairan yang teroksidasi dapat berubah menjadi nitrit. Nitrit
bersifat toksik bagi ikan dan organisme akuatik lainnya (Metcalf and Eddy, 1991).
Nitrit merupakan produk awal dari proses nitrififikasi dimana ion amonium
dioksidasi oleh bakteri nitrifikasi menjadi nitrat. Menurt Van Wyk and Scarpa
(1999), apabila perubahan dari nitrit menjadi nitrat tidak mampu berjalan bengan
baik, akan terjadi akumulasi nitrit dalam perairan.
Pada masa pertumbuhan bakteri heterotrof mereduksi nitrit menjadi
ammonium untuk digunakan dalam sintesis biomasa (Gottschalk, 1986).
Selanjutnya, ammonium juga digunakan untuk sintesis asam amino dan protein
melalui glutamin dan glutamat (Joklik et.al., 1992).
2.3 Budidaya tanpa Pergantian Air
Pada sistem budidaya, ketersediaan air merupakan hal yang sangat penting
untuk diperhatikan. Penambahan area budidaya menyebabkan penambahan
sempit atau memiliki ketersediaan air yang terbatas, mendorong pemanfaatan
sumberdaya untuk menunjang proses budidaya.
Salah satu pendorong pengembangan dibidang akuakultur adalah
pemanfaatan lahan sempit dengan pola menejemen akuakultur yang efektif dan
efisien (Mukti dkk. 2010). Budidaya tanpa pergantian air merupakan salah satu
sistem budidaya yang dapat menghemat air sehingga lebih ekonomis (Sitompul
dkk. 2012).
Sistem tanpa pergantian air dapat menyebabkan akumulasi sisa pakan,
feses, dan kualitas air memburuk. Buruknya kualitas air pada budidaya tanpa
pergantian air dapat menghambat pertumbuhan ikan lele dumbo (Sitompul dkk.
2012). Sisa pakan menghasilkan bahan organik membentuk amoniak dan nitrit
(Spotte, 1970). Amoniak dan nitrit adalah senyawa beracun yang berbahaya bagi
organisme perairan dan dapat menyebabkan toksisitas apabila melebihi ambang
III KERANGKA KONSEPTUAL DAN HIPOTESIS
3.1 Kerangka Konseptual
Berbagai teknologi diterapkan untuk mendapatkan hasil yang maksimal
dalam budidaya lele salah satunya dengan penerapan sistem tanpa pergantian air.
Sistem tanpa pergantian air cocok untuk diaplikasikan pada lahan sempit dan
terbatas, pada lingkungan pedesaan yang miskin air maupun penerapan budidaya
dilingkungan perkotaan yang padat.
Pergantian air tidak dilakukan selama masa budidaya. Hal ini
menyebabkan penumpukan bahan organik, yang berasal dari sisa pakan, kotoran
ikan, maupun bahan organik terlarut lainnya pada dasar kolam. Menurut Hopkins
et., al (1994) salah satu akibat dari akumulasi bahan organik adalah terbentuknya senyawa yang beracun bagi ikan. Bahan organik perairan mampu menghasilkan
amoniak, dan nitrit (Spotte, 1992). Amoniak dan nitrit adalah senyawa beracun
yang terbentuk dari sisa bahan organik yang menumpuk dan mempengaruhi
kulitas air pada media hidup ikan.
Bakteri heterotrof merupakan salah satu golongan bakteri penyusun
probiotik. Bakteri heterotrof berperan penting untuk menjaga keseimbangan
kualitas air (Sugita et al. 1985). Menurut Todar (2002) bakteri heterotrof
memanfaatkan ammonia sebagai sumber energy untuk meregenerasi selnya. Pada
waktu yang sama, bakteri heterotrof lebih banyak memanfaatkan ammonia
dibandingkan bakteri autotrof (Ebeling et.al., 2006).
Salah satu jenis bakteri heterotrof yang dimanfaatkan sebagi penyusun
memiliki enzim ekstraseluler yang dapat membatu pencernaan dan mampu
memperbaiki kualitas air melalui penguraian dan perombakan bahan organik
dalam air; selain itu telah diketahui bahwa Bacillus sp. berperan dalam proses
nitrifikasi (Mevel and Prieur, 2000). Menurut Van Wyk and Scarpa (1999),
apabila perubahan dari nitrit menjadi nitrat tidak mampu berjalan bengan baik,
akan terjadi akumulasi nitrit dalam perairan. Dengan penambahan jumlah bakteri
heterotrof diharapkan dapat menurunkan ammonia dan nitrit pada media
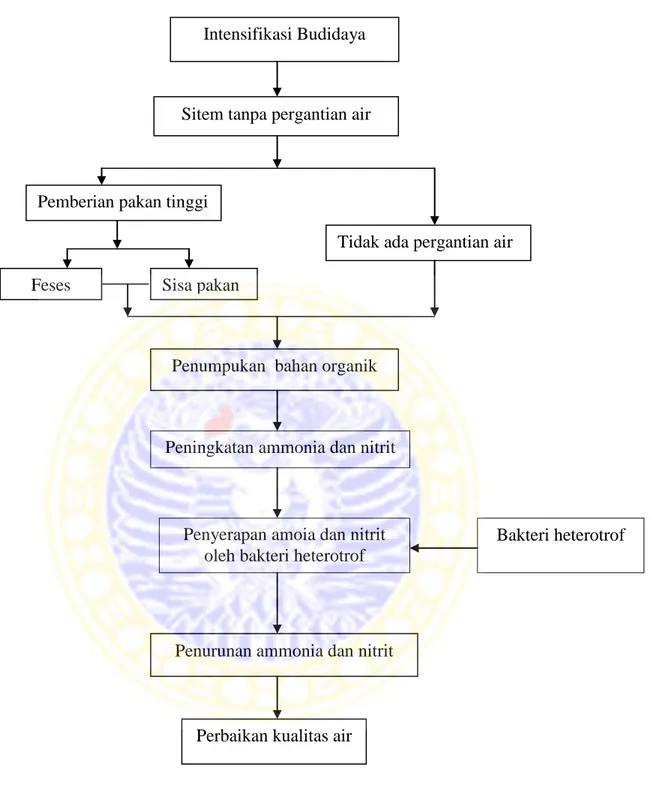
Gambar 3.1 Kerangka Konseptual Penelitian Intensifikasi Budidaya
Sitem tanpa pergantian air
Penumpukan bahan organik
Peningkatan ammonia dan nitrit
Bakteri heterotrof Penyerapan amoia dan nitrit
oleh bakteri heterotrof
Penurunan ammonia dan nitrit
Perbaikan kualitas air Pemberian pakan tinggi
Tidak ada pergantian air
3.2 HIPOTESIS
Hipotesis dari penelitian ini adalah:
H1.1 : pemberian bakteri heterotrof berpengaruh terhadap kadar amonia pada budidaya lele dumbo tanpa pergantian air
H1.2 : pemberian bakteri heterotrof berpengaruh terhadap kadar nitrit pada budidaya lele dumbo tanpa pergantian air
IV METODOLOGI
4.1 Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Pendidikan Fakultas Perikanan
dan Kelautan Universitas Airlangga Surabaya. Penelitian dilakukan pada bulan
Juni – Juli 2014.
4.2 Materi Penelitian 4.2.1 Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah: pH meter,
spektrofotometer, cuvet, tabung reaksi, gelas ukur, DO meter, pH meter, pipet
tetes, termometer, jaring, timbangan digital, penggaris, ember, bak plastik 16 buah
volume 15 L, aerator, selang aerasi dan batu aerasi.
4.2.2 Bahan Penelitian
Bahan yang akan digunakan dalam penelitian ini adalah bakteri probiotik “A” (Bacillus subtilis, Bacillus apiarius, Lactobacillus plantarum, dan
Nitrosomonas eropea) dengan total count 1x106 CFU, “B” (Bacillus subtilis dan
Bacillus licheniformes) dengan total count 1x107 CFU dan “C”, (Bacillus subtilis, dan Bacillus licheniformes) dengan total count 1x1012 CFU, lele dumbo
ukuran 9 cm, larutan Nessler, aquades, NED (Napthil ethilen diamin) -
dihidroklorida, larutan sulfanilamide, larutan standar amonia (0,1; 0,2; 0,3; 0,4;
4.3 Metode Penelitian
Metode penelitian yang digunakan adalah metode eksperimental. Metode
penelitian eksperimental adalah suatu penelitian dengan melakukan kegiatan
percobaan yang bertujuan untuk mengetahui gejala atau pengaruh yang timbul
dari perlakuan tertentu (Notoatmodjo, 2010).
4.3.1 Rancangan Penelitian
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap
(RAL) (Kusriningrum, 2012) dengan perlakuan sebanyak empat, dan ulangan
sebanyak empat kali. Perlakuan dilakukan dengan pemberian bakteri pada
masing-masing media. Perlakuan yang diberikan dalam penelitian ini adalah:
Perlakuan 1 : tanpa pemberian bakteri (kontrol)
Perlakuan 2 : penambahan bakteri probiotik A (B. subtilis, B. apiarius, Lactobacillus plantarum , dan Nitrosomonas europea) 0,03 ml/15L
Perlakuan 3 : penambahan bakteri probiotik B (B. subtilis dan B.acillus licheniformes) 0,03 ml/15L
Perlakuan 4 : penambahan bakteri probiotik C (B. subtilis, dan B. licheniformes,) 0,03 ml/15L
Penepatan perlakuan pada penelitian ini diletakkan secara acak dengan
menggunakan tabel bilangan acak. Denah penelitian dapat dilihat pada skema
dibawah ini.
Tabel 4.1 Denah acak rancangan penelitian
P2.4 P1.1 P1.3 P2.2
P3.1 P2.1 P4.1 P3.2
P1.2 P2.3 P3.2 P4.3
4.4 Prosedur Kerja
4.4.1 Persiapan Media dan Persiapan Benih
Persiapan yang digunakan yaitu bak plastik dengan volume 15 L. Sebelum
digunakan, dilakukan sterilisasi terlebih dahulu. Sterilisasi air media dilakukan
dengan menggunakan Kalium Permanganat dengan dosis 3 g/m3 , selanjutnya didiamkan selama sehari dan dilakukan pergantian air baru (Shaffrudin dkk.,
2006).
Benih yang digunakan disortir berdasarkan kualitas dan ukuran terlebih
dahulu sebelum ditebar dalam kolam pembesaran untuk mengurangi tingkat
kematian benih. Selain itu juga dilakukan penimbangan berat dan pengukuran
panjang awal sebelum benih dipelihara. Benih yang akan digunakan adalah jenis
ikan lele dumbo dengan ukuran panjang 9 cm.
Sebelum ditebar benih diaklimatisasi terlebih dahulu selama 5 menit
sehingga suhu air media selama pengangkutan benih dengan air media pada bak
pemeliharaan sama. Benih ikan lele dumbo kemudian dimasukkan ke dalam bak
plastik, dengan padat tebar masing-masing 1000 ekor/m3 (Shaffrudin dkk., 2006), sehingga didapatkan padat tebar 30 ekor/bak.
4.4.2 Pemeliharaan
Selama pemeliharaan, pemberian pakan ikan lele dumbo dilakukan dengan
frekuensi tiga kali yaitu pada pukul 08.00 pagi, 12.00 siang dan 16.00 sore. Pakan
yang diberikan sejumlah 3% dari berat tubuh ikan, mengacu pada Purnomo
(2012), bahwa pemberian pakan ikan adalah sebanyak 3% - 5% dari berat
tanpa dicampur dengan pakan. Pemberian jenis bakteri heterotrof diberikan
langsung dengan dosis 0,03ml/15L (Andriyanto, 2010).
Pemeliharaan ikan lele dumbo dilakukan selama 30 hari. Pengamatan
dilakukan setiap dua hari sekali. Pengambilan sampel air untuk pengukuran
amoniak dan nitrit dilakukan pada awal setelah benih ditebar, selanjutnya setiap
dua hari sekali untuk mengetahui fluktuasi ammonia dan nitrit dalam media
pemeliharaan. Untuk pengukuran suhu dan DO (Disolved Oxygen) dilakukan
setiap pagi dan sore hari selama pemeliharaan. Diagram alir penelitian dapat
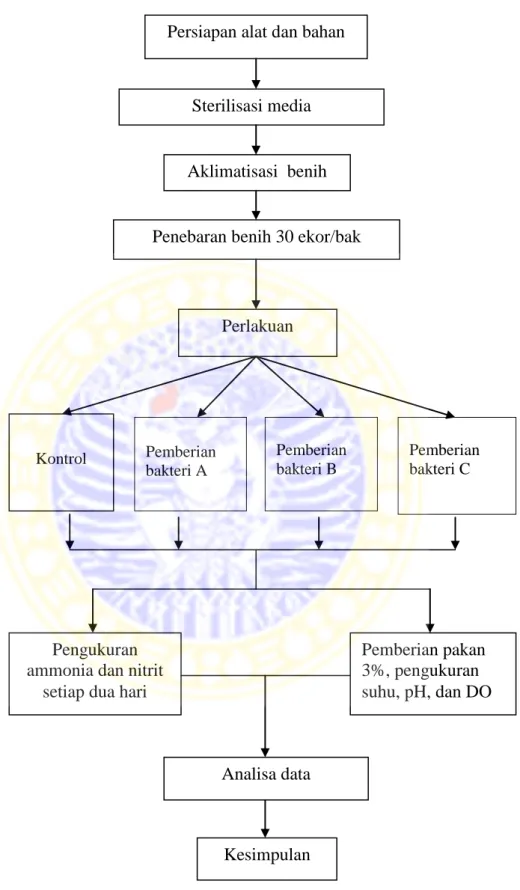
Gambar 4.1 Diagram Alir Penelitian Persiapan alat dan bahan
Sterilisasi media
Penebaran benih 30 ekor/bak
Perlakuan Pemberian bakteri B Pemberian bakteri A Kontrol Pemberian bakteri C Analisa data Aklimatisasi benih Pengukuran ammonia dan nitrit
setiap dua hari
Kesimpulan
Pemberian pakan 3%, pengukuran suhu, pH, dan DO
4.5 Parameter Penelitian
Parameter yang diamati selama penelitian terdiri dari parameter uji utama
dan parameter uji penunjang. Parameter uji utama terdiri dari kandungan
ammonia dan nitrit. Parameter uji penunjang yaitu pH, suhu, dan oksigen terlarut.
Menurut Rosmaniar (2011), parameter uji utama diukur selama dua hari
sekali . Pengambilan sampel air untuk menganalisa kadar amoniak dan nitrit
dilakukan setiap pagi hari sebelum pakan diberikan. Pengukuran ammonia dan
nitrit dilakukan di Laboratorium Pendidikan Fakultas Perikanan dan Kelautan
Universitas Airlangga Surabaya.
Tabel 4.2 Parameter Kualitas air, satuan dan alat pengukuran
Parameter kualitas air Satuan Alat ukur
Ammonia mg/L Spektrofotometer
Nitrit mg/L Spektrofotometer
pH pH meter
Suhu °C Termometer
DO mg/L DO meter
4.5.1 Pengukuran kadar Amonia Penentuan kurva kalibrasi:
a. Menyiapkan larutan standar amoniak dengan konsentrasi 0,1; 0,2; 0,3; 0,4; 0,5 ppm, ppm masing – masing 50 ml.
b. Menambahkan larutan Nessler 1 ml pada masing-masing konsentrasi, di kocok dan didiamkan selama 10 menit.
c. Mengamati absorbansi masing-masing larutan pada panjang gelombang 425 nm, dan membuat kurva kalibrasi.
Pengukuran kadar amoniak dilakukan mengunakan metode Nessler (Sari dkk., 2012):
a. Ambil sampel sebanyak 50 ml, disaring dan dimasukkan kedalam Erlenmeyer 100 ml.
b. Ditambahakan 1 ml larutan Nessler kemudian dikocok dan dibiarkan selama 10 menit.
c. Larutan sampel dimasukkan dalam cuvet, kemudian diukur dengan spektrofotometer dengan panjang gelombang 425 nm.
d. Perhitungan kadar amoniak menggunakan kurva kalibrasi dari larutan standar, dengan persamaan regresi :
𝒚 = 𝒂𝒙 + 𝒃
y = absorbansia = slope
x = konsentasi amoniak b = intersept
4.5.2 Pengukuran Kadar Nitrit
Metode Spektrofotometri (SNI 06-6989.9-2004): Penentuan kurva kalibrasi:
a. Menyiapkan larutan standar nitrit dengan konsentrasi 0,025; 0,05; 0,1; 0,25; 0,5; 0,1 ppm masing – masing 50 ml.
b. Menambahkan larutan sulfanilamide 1 ml pada masing-masing konsentrasi, di kocok dan didiamkan selama dua menit.
c. Ditambahkan 1 ml larutan NED-dihidroklorida, dikocok dan didiamkan selama 10 menit.
d. Mengamati absorbansi masing-masing larutan pada panjang gelombang 543 nm, dan membuat kurva kalibrasi.
Pengukuran kadar absorbansi sampel:
a. Mengambil air sampel sebanyak 50 ml, dan disaring dengan kertas saring, dan dimasukkan dalam Erlenmeyer 100 ml.
b. Sampel ditambah dengan 1 ml larutan sulfanilamide, kemudian akan bereaksi selama 2 menit. Setelah itu ditambahkan 1 ml larutan NED-dihidroklorida
kemudian dihomogenkan selama 10 menit hingga berwarna merah keunguan.
c. Larutan dimasukkan diukur menggunakan spektrofotometer dengan panjang gelombang 543 nm.
d. Perhitungan kadar nitrit menggunakan kurva kalibrasi dari larutan standar, dengan persamaan regresi :
𝒚 = 𝒂𝒙 + 𝒃
y = absorbansia = slope
x = konsentasi amoniak b = intersept
4.5.3 Pengukuran Suhu, pH, dan DO
Pengukuran kualitas air penunjang dilakukan setiap pagi, siang, dan sore
setiap harinya. Pengukuran suhu menggunakan thermometer, DO menggunakan
4.6 Analisis Data
Pengolahan data dilakukan dengan perhitungan statistik menggunakan
metode ANOVA (Analysis of Variance) untuk mengetahui perlakuan yang
diberikan (Kusriningrum, 2012). Data yang diperoleh dari hasil pengukuran setiap
hari dicatat, selanjutnya dianalisis dengan menggunakan ANOVA (pada selang
kepercayaan 99%). Data kualitas air dianalisis secara deskriptif dengan penyajian
V HASIL DAN PEMBAHASAN
5.1 HASIL
5.1.1 Kadar Amonia
Produksi kadar amonia selama 30 hari pada masing-masing perlakuan
dapat dilihat pada Tabel 5.1. Produksi kadar amonia selama 30 hari dihitung
berdasarkan kadar amonia pada hari ke 30. Data kadar amonia rata-rata harian
dihitung setiap dua hari sekali, dapat dilihat pada Lampiran 2, dan analisis statistik
terhadap produksi kadar amonia terdapat pada Lampiran 3.
Tabel 5.1 Produksi kadar amonia selama 30 hari
*) superskrip yang berbeda menunjukkan nilai yang berbeda nyata (p<0,05) Keterangan:
P1: kontrol
P2: penambahan probiotik A 0,03 mL/15L P3: Penambahan Probiotik B 0,03 mL/15L P4: Penambahan Probiotik C 0,03 mL/15L
Uji statistik terhadap produksi amonia menunjukkan adanya perbedaan
yang nyata, dengan p < 0,05. Setelah dilakukan Uji Jarak Berganda Duncan
(Duncan’s Multiple Range Test), dapat diketahui bahwa produksi amonia
tertinggi adalah pada P1 yaitu tanpa pemberian probiotik. Produksi kadar amonia
terendah ditunjukkan oleh P4 dengan pemberian probiotik C. Perlakuan
Perlakuan Produksi amonia selama 30 hari ± SD Transformasi √(y + 0,5) ± SD
P1 0,2641b ± 0,01356 0,8741 ± 0.0078128
P2 0,2159a ± 0,01431 0,8461 ± 0.0084247
P3 0,2182a ± 0,01332 0,8474 ± 0.0078454
kontrol (P1) tanpa pemberian bakteri probiotik berbeda nyata dengan P2, P3, dan
P4 , dimana P2, P3, dan P4 tidak memiliki perbedaan yang nyata.
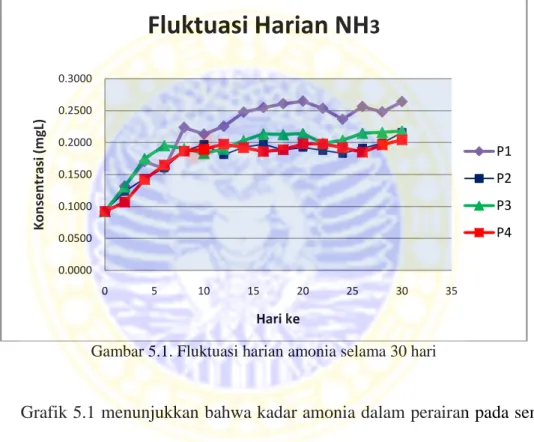
Grafik fluktuasi harian amonia selama masa budidaya dapat dilihat pada
Gambar 5.2. Nilai fluktuasi amonia didapatkan dari hasil pengamatan yang
dilakukan setiap dua hari sekali.
Gambar 5.1. Fluktuasi harian amonia selama 30 hari
Grafik 5.1 menunjukkan bahwa kadar amonia dalam perairan pada semua
perlakuan menunjukkan peningkatan. Pada P1, produksi amonia pada media
adalah yang paling tinggi. Sedangkan produksi amonia terendah ditunjukkan oleh
P4.
5.1.2 Kadar Nitrit
Nilai produksi kadar nitrit selama 30 hari pada masing-masing perlakuan
dapat dilihat pada Tabel 5.2. Nilai produksi kadar nitrit selama 30 hari dihitung
berdasarkan kadar nitrit pada hari ke 30. Data nilai nitrit rata-rata harian dapat 0.0000 0.0500 0.1000 0.1500 0.2000 0.2500 0.3000 0 5 10 15 20 25 30 35 K o n sen tr asi (m gL) Hari ke
Fluktuasi Harian NH
3
P1 P2 P3 P4dilihat pada Lampiran 5, dan analisis statistik terhadap peningkatan kadar nitrit
harian terdapat pada Lampiran 6.
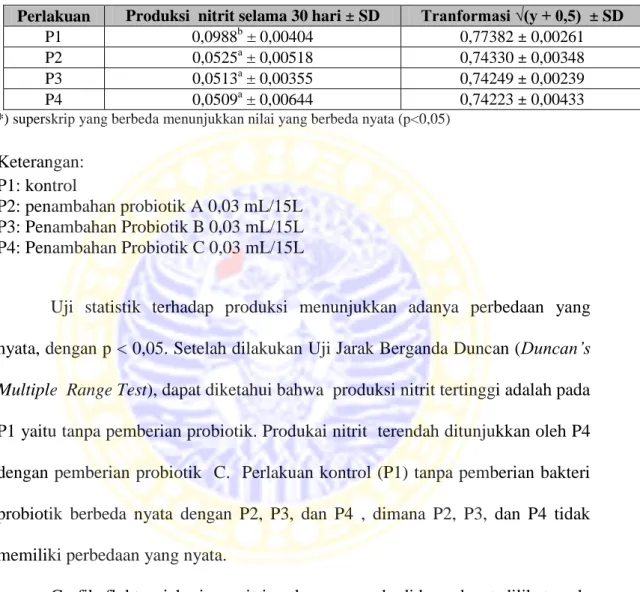
Tabel 5.2 Produksi kadar nitrit selama 30 hari.
Perlakuan Produksi nitrit selama 30 hari ± SD Tranformasi √(y + 0,5) ± SD
P1 0,0988b ± 0,00404 0,77382 ± 0,00261
P2 0,0525a ± 0,00518 0,74330 ± 0,00348
P3 0,0513a ± 0,00355 0,74249 ± 0,00239
P4 0,0509a ± 0,00644 0,74223 ± 0,00433
*) superskrip yang berbeda menunjukkan nilai yang berbeda nyata (p<0,05) Keterangan:
P1: kontrol
P2: penambahan probiotik A 0,03 mL/15L P3: Penambahan Probiotik B 0,03 mL/15L P4: Penambahan Probiotik C 0,03 mL/15L
Uji statistik terhadap produksi menunjukkan adanya perbedaan yang
nyata, dengan p < 0,05. Setelah dilakukan Uji Jarak Berganda Duncan (Duncan’s
Multiple Range Test), dapat diketahui bahwa produksi nitrit tertinggi adalah pada P1 yaitu tanpa pemberian probiotik. Produkai nitrit terendah ditunjukkan oleh P4
dengan pemberian probiotik C. Perlakuan kontrol (P1) tanpa pemberian bakteri
probiotik berbeda nyata dengan P2, P3, dan P4 , dimana P2, P3, dan P4 tidak
memiliki perbedaan yang nyata.
Grafik fluktuasi harian nitrit selama masa budidaya dapat dilihat pada
Gambar 5.2. Nilai fluktuasi nitrit didapatkan dari hasil pengamatan yang
Gambar 5.2. Grafik fluktuasi harian nitrit selama 30 hari.
5.1.3 Suhu, pH, dan DO
Data kisaran kualitas air setelah pemeliharaan selama 30 hari dengan
perlakuan penambahan probiotik yang mengandung bakteri heterotrof, dapat
dilihat pada Tabel 5.3. Pengamatan terhadap suhu, dan DO dilakukan setiap pagi
dan sore. Pengamatan terhadap pH setiap sehari sekali, dan pengamatan terhadap
nitrat setiap dua hari sekali selama masa pemeliharaan.
Tabel 5.3. Kadar Suhu, pH, dan DO selama 30 hari
No Parameter Perlakuan
Kontrol Probiotik A Probiotik B Probiotik C 1 Suhu (oC) 26,6 - 30,0 26,7 - 30,0 26,7 - 30,0 26,6 - 30,0
2 DO (mg/l) 6,3 – 8,9 6,3 – 8,9 6,3 – 9,0 6,4 – 8,4
3 pH 7,23 – 8,26 7,35 – 8,15 7,29 – 8,20 7,22 – 8,26
5.2 PEMBAHASAN 5.2.1 Amonia (NH3)
Hasil pengukuran terhadap produksi amonia selama 30 hari menunjukkan
adanya perbedaan yang nyata antara pelakuan kontrol dengan perlakuan 0 0.02 0.04 0.06 0.08 0.1 0.12 0 5 10 15 20 25 30 35 K o n sen tr asi (m g/ L) Hari ke
Fluktuasi Kadar NO
2 p1 p2 p3 p4pemberian probiotik. Tetapi, pada perlakuan dengan penambahan probiotik A
(Bacillus subtilis, Bacillus apiarius, Lactobacillus plantarum, dan Nitrosomonas
europea 1x106 CFU), B (Bacillus subtilis dan Bacillus licheniformes 1x107 CFU), dan C (Bacillus subtilis, dan Bacillus licheniformes) 1x1012 CFU) tidak berbeda nyata. Akumulasi kadar amonia yang diproduksi oleh ikan selama pemeliharaan
adalah pada perlakuan kontrol sebesar 0,2641 mg/L, perlakuan probiotik B
(Bacillus subtilis dan Bacillus licheniformes) sebesar 0,2182 mg/L, perlakuan probiotik A (Bacillus subtilis, Bacillus apiarius, Lactobacillus plantrarum, dan
Nitrosomonas europea) sebesar 0,2159 mg/l, dan probiotik C (Bacillus subtilis, Bacillus licheniformes) sebesar 0,2093 mg/L.
Kadar amonia pada perlakuan kontrol hari ke 30 mencapai 0,2641 mg/L.
Pada konsentrasi ini, konsentrasi amonia masih dalam ambang yang cocok untuk
kehidupan ikan lele. Menurut Stickney (2005), bahwa kandungan amonia yang
masih bisa di tolerir oleh ikan adalah < 0,8 mg/L. Sehigga konsentrasi amonia
pada perlakuan kontrol masih dapat di tolerir oleh ikan lele. Diduga bahwa
tingginya nilai amonia pada perlakuan kontrol adalah karena menumpuknya sisa
pakan dan feses dalam perairan. Hal ini sesuai dengan pendapat Spotte (1970),
bahwa sisa pemberian pakan menghasilkan bahan organik yang membentuk
amonia, nitrit, dan nitrat pada perairan. Keberadaan amonia dalam perairan
mampu mempengaruhi kehidupan ikan karena mereduksi masukan oksigen akibat
rusaknya insang, menambah energi untuk detoksifikasi, mengganggu
Pada perlakuan dengan pemberian bakteri probiotik A, B, dan C produksi
amonia pada hari ke 30 secara berturut-turut berada pada konsentrasi 0,2159
mg/L; 0,2182 mg/L; dan 0,2093 mg/L. Pada konsentrasi tersebut, kadar amonia
lebih rendah daripada perlakuan kontrol. Sehingga dapat dikatakan bahwa
perlakuan dengan penambahan bakteri probiotik A, B, dan C lebih baik daripada
perlakuan tanpa probiotik. Kadar amonia selama masa pemeliharaan masih berada
pada batas aman untuk kehidupan ikan lele sesuai dengan pendapat Stickney
(2005) yaitu <0,8 mg/L.
Akumulasi amonia pada perlakuan menggunakan probiotik C (Bacillus
subtilis, Bacillus licheniformes) menunjukkan jumlah yang terendah pada akhir pemeliharaan. Hal ini diduga karena jumlah kepadatan bakteri penyusun probiotik
C (Bacillus subtilis, Bacillus licheniformes) lebih tinggi yaitu 1x1012 CFU, sedangkan pada probiotik A (Bacillus subtilis, Bacillus apiarius, Lactobacillus
plantrarum, dan Nitrosomonas europea) hanya memiliki kepadatan 1x106 CFU dan probiotik B (Bacillus subtilis dan Bacillus licheniformes) memiliki kepadatan
1x107 CFU. Tingginya kepadatan bakteri yang diberikan kedalam media, dapat menjadikan akumulasi bahan organik dalam media semakin berkurang karena
pemanfaatan bahan organik oleh bakteri. Sehingga produksi ammonia dan nitrit
dan berasal dari akumulasi bahan organik dapat menurun.
Menurut Ruyitno et al, (1993) bahwa bakteri heterotrofik dalam
pertumbuhannya memerlukan senyawa organik. Sisa pemberian pakan
menghasilkan bahan organik yang membentuk amonia, nitrit, dan nitrat pada
probiotik memanfaatkan bahan organik dalam media. Bahan organik tersebut
dimanfaatkan bakteri sebagai sumber energi untuk pertumbuhan bakteri (Sugita
et.al., 1985).
Bakteri heterotrof mengawali tahap degradasi senyawa organik dengan
serangkaian tahap reaksi enzimatis. Menurut Suarsini (2006), Bacillus sp.
memiliki enzim ekstraseluler yang dapat membatu pencernaan dan mampu
memperbaiki kualitas air melalui penguraian dan perombakan bahan organik
dalam air.
Selain menguraikan bahan organik, penghasil ammonia, nitrit, dan nitrat,
bakteri hetrerotrof juga mampu memperbaiki kualitas air dengan menurunkan
kadar amonia dalam perairan. Hal ini sesuai pendapat Avnimelech (1999), bahwa
bakteri heterotrof mencegah terjadinya akumulasi nitrogen organik dalam media
budidaya yang dapat menurunkan kualitas air.
Pada ketiga probiotik yang digunakan, masing-masing probiotik memiliki
kandungan dua spesies bakteri heterotrof dari golongan Bacillus yaitu Bacillus
subtilis dan Bacillus licheniformes pada probiotik B, dan C, serta Bacillus subtilis dan Bacillus apiarius pada probiotik A.
Dugaan lainya adalah jenis bakteri Bacillus subtilis dan Bacillus
licheniformes pada probiotik B, dan C, serta Bacillus subtilis dan Bacillus apiarius pada probiotik A berperan dalam penyerapan amonia dalam media pemeliharaan. Hal ini didukung oleh pendapat Todar (2002), bahwa bakteri
heterotrof berregenerasi lebih cepat dengan memanfaatkan amonia sebagai
penurunan kadar amonia terjadi antara lain karena adanya pemanfaatan ammonia
oleh proses heterotrofik biosintsis bakteri yang menghasilkan biomasa bakteri.
Sedangkan menurut Ebeling et.al., (2006) proses pengubahan nitrogen dalam
sistem akuakultur salah satunya adalah proses heterotrofik bakterial yang
mengubah amonia langsung menjadi biomasa bakteri. Bakteri heterotrof yang
tumbuh dan berkembang dalam media dapat dimanfaatkan oleh ikan sebagai
sumber pakan (McGraw, 2002).\
5.2.2 Nitrit (NO2)
Hasil pengamatan terhadap produsi kadar nitrit selama 30 hari dapat
dilihat di Lampiran 5. Fluktuasi kadar nitrit harian dapat dilihat pada Gambar 5.
Pada grafik fluktuasi harian nitrit menunjukkan bahwa konsentrasi nitrit pada
perlakuan kontrol lebih tinggi daripada pada perlakuan mengunakan probiotik
A(Bacillus subtilis, Bacillus apiarius, Lactobacillus plantarum, dan Nitrosomonas europea 1x106 CFU), B (Bacillus subtilis dan Bacillus licheniformes 1x107 CFU), dan C (Bacillus subtilis, Bacillus licheniformes 1x1012 CFU) tidak berbeda nyata. Adanya senyawa nitrit pada perairan menunjukkan adanya proses nitrifikasi dalam media pemeliharaan.
Konsentrasi nitrit tertinggi adalah pada perlakuan kontrol, pada hari ke 30,
dengan konsentrasi sebesar 0,0988 mg/L. Kadar nitrit pada perlakuan kontrol
sangat berbahaya bagi ikan. Tingginya kadar nitrit dalam perlakuan kontrol
diduga karena karena tidak adanya organisme yang mengubah atau memanfaatkan
adalah tingginya kadar nitrit yang tinggi pada media. Hal ini sesuai pendapat
Moore (1991), apabila kadar nitrit dalam perairan >0,05 mg/L dapat bersifat
toksik bagi organisme perairan.
Menurut Effendi (2003), pengaruh senyawa nitrit pada ikan adalah
terjadinya perubahan transport oksigen, sehingga terjadi kekurangan oksigen
dalam tubuh ikan. Hal ini disebabkan oleh Haemoglobin dalam darah yang
seharusnya mengikat oksigen berganti mengikat nitrit sehingga masuk kedalam
darah. Menurut Yuningsih (2000), apabila perubahan Hb menjadi MetHb
mencapai 20%-30% dari Hb normal maka akan terjadi hypoxia, yaitu kekosongan
oksigen dalam darah ikan yang keracunan nitrit sehingga darah tidak sanggup lagi
lagi megangkut oksigen. Apabila perubahan Hb menjadi MetHb mencapai
80%-90% maka terjadi kondisi yang dapat menyebabkan keracunan bagi ikan.
Nitrit pada media dihasilkan dari akumulasi bahan organik dalam perairan
yang manghasilkan amonia, dan kemudian mengalami nitrifikasi sehingga
terentuk senyawa nitrit dalam media. Tingginya senyawa nitrit pada perlakuan
kontrol diduga karena akumulasi ammonia yang tinggi dan tidak dimanfaatkan
atau tidak diubah oleh bakteri menjadi bentuk nitrat. Sesuai dengan pendapat Van
Wyk and Scrapa (1999), bahwa akumulasi nitrit pada perairan terjadi apabila
proses lanjutan dari nitrifikasi yang mengubah nitrit menjadi nitrat tidak dapat
berjalan.
Dari hasil Uji Duncan terhadap kadar nitrit pada perlakuan dengan
probiotik A, B, dan C tidak menunjukkan perbedaan yang nyata. Peningkatan
0,0513mg/L; dan 0,0509 mg/L. Pada konsentrasi tersebut, kadar nitrit dalam
perairan mulai berbahaya bagi ikan, karena kadar nitrit dalam media >0,05 mg/L.
Akumulasi nitrit pada perlakuan menggunakan probiotik C (Bacillus
subtilis, Bacillus licheniformes 1x1012 CFU) menunjukkan bahwa kadar nitrit pada media adalah yang terendah pada akhir pemeliharaan. Kemungkinan yang
terjadi adalah rendahnya jumlah ammonia dalam perlakuan dengan pemberian
probiotik C, yang bisa diubah melalui proses nitrifikasi menjadi senyawa nitrit.
Selain itu, senyawa nitrit dapat dimanfaatkan oleh bakteri heterotrof. Pada
masa pertumbuhan bakteri heterotrof mereduksi nitrit menjadi ammonium untuk
digunakan dalam sintesis biomasa (Gottschalk, 1986). Selanjutnya, ammonium
juga digunakan untuk sintesis asam amino dan protein melalui glutamin dan
glutamat (Joklik et.al., 1992).
5.2.3 Suhu, pH, dan DO
Berdasar Tabel 5.3, suhu air media pemeliharaan pada semua perlakuan
berada pada kondisi normal, antara 26,6 oC – 30oC. Fluktuasi suhu harian menunjukkan bahwa suhu pada pagi hari pada kisaran 26-28oC, dan 28-30oC pada sore hari. Konsentrasi suhu ini masih berada dalam batas normal suhu yang
baik untuk ikan, sesuai dengan pendapat Hepher and Pruginin (1981), bahwa
kisaran suhu yang baik bagi pertumbuhan ikan adalah antara 25OC – 30OC. Suhu merupakan faktor penting dan sangat berpengaruh pada kelangsungan hidup dan
pertumbuhan ikan. Menurut Effendi (2003), suhu mempengaruhi laju
Menurut Effendi (2003), suhu mempengaruhi kadar DO dalam air. Pada
saat suhu rendah kadar DO naik, dan pada saat suhu tinggi kadar DO menurun.
Hasil pengamatan terhadap kadar DO selama masa pemeliharaan tersaji dalam
tabel 5.3 dan Lampiran 9. Konsentrasi DO selama pemeliharaan berada pada
kisaran 6,3 - 9,0 mg/L. Kisaran ini hampir sama pada semua perlakuan, dan
masih berada pada batas aman. Hal ini mengacu pada pendapat Fortheath et.al.,
(1993) bahwa kadar aman DO untuk ikan adalah > 5 mg/l. Apabila kadar DO dalam perairan rendah dapat berakibat terhadap pertumbuhan dan penurunan
nafsu makan ikan (Boyd, 1982).
DO memegang peran penting dalam proses budidaya intensif yang
menggunakan tehnologi bioremediasi. Hal ini dikarenakan aktifitas
mikroorganisme pendekomposisi bahan organik memerlukan cukup oksigen. Pada
hasil pengamatan, DO pada sore hari cenderung lebih tinggi daripada pagi hari.
Menurut Maryam (2010), tingginya kadar DO pada siang hingga sore hari adalah
karena adanya aktifitas fotosintesis oleh fitoplankton pada media pemeliharaan,
sedangkan penurunan DO pada malam hingga pagi hari karena tingginya
konsentrasi CO2 hasil dari respirasi ikan, fitoplankton, serta organism lain dalam media pemeliharaan.
Nilai pH dalam perairan menggambarkan tentang kondisi asam basa suatu
perairan. Pada tabel 5.3, menunjukkan bahwa nilai pH dalam perairan pada semua
perlakuan berada dalam kisaran normal, antara 7,22 – 8,26. Menurut Boyd (1982),
reproduksi dan pertumbuhan ikan. Dengan demikian konsentrasi pH pada semua
VI KESIMPULAN DAN SARAN 6.1 Kesimpulan
Dari penelitian ini dapat diambil kesimpulan:
a. Perlakuan dengan pemberian probiotik yang mengandung bakteri heterotrof berpengaruh terhadap produksi kadar amonia, dengan produksi terendah oleh
probiotik C (Bacillus subtilis, dan Bacillus licheniformis, dengan total count
1x1012) sebesar 0,2029 mg/L.
b. Perlakuan dengan pemberian probiotik yang mengandung bakteri heterotrof berpengaruh terhadap produksi kadar nitrit dengan produksi terendah oleh
probiotik C (Bacillus subtilis, dan Bacillus licheniformis, dengan total count
1x1012) sebesar 0,0509 mg/L.
6.2 Saran
Budidaya ikan lele dumbo pada sistem tanpa pergantian air dengan
menggunakan probiotik yang tersusun oleh dominasi bakteri heterotrof jenis
Bacilus dapat diterapkan untuk menanggulangi tingginya akumulasi ammonia dan nitrit selama budidaya.
DAFTAR PUSTAKA
Andriyanto, S., N. Listyanto., dan R. Rahmawati. 2010. Pengaruh Pemberian Probiotik Dengan Dosis yang Berbeda terhadap Sintasan dan Pertumbuhan Benih Patin Jambal (Pangaisus djambal). Prosiding Forum Inovasi Teknologi Akuakultur 2010. 117-122 hal.
Avnimelech, Y. 1999. Carbon Nitrogen Ratio as a Control Element in Aquaculture System. Aquaculture. 176. 227-235 pp.
Boy, C.E. 1982. Water Quality Management for Pond Fish Culture. Elsevier Scientific Publishing. Co. Amsterdam. 319 p.
Boyd, C.E. 1990. Water Quality Management in Aquaculture and Fisheries Science. Elsevier Scientific Publishing Company. Amsterdam. 3125p.
Brune, D.E., G. Schwartz, A.G. Eversole, J.A Collier, and T.E Schwedler. 2003. Intensification of ponds aquaculture and high rate photosynthetic system. Aquaculture Engineering. Vol. 28. 65-86 pp.
Brune, D.E., G. Schwartz, A.G. Eversole, J.A Collier, and T.E Schwedler. 2003. Intensification of pond aquaculture and high rate photosynthetic system. Journal of Aquaculture Engineering. 28. 45-86 pp.
Ebeling, J.M., M.B Timmons., and J.J Bisogni. 2006. Engineering Analysis of Thestoichiometry of Photoautotrophic, Autotrophic, and Heterotrophic Removal of Ammonia-Nitrogen in Aquaculture Systems. Aquaculture. 257: 346-358 pp.
Effendi, H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumber Daya Lingkungan Peraira. Kanisius. Yogyakarta. 257 hal.
Forteath N., L. Wee, and M. Frith. 1993. Water Quality. In: P. Hart and D. O’ Sullivan (eds.). Recirculation Systems: Design, Construction and Management. University of Tasmania at Launceston, Australia.
Gottschalk, G. 1998. Bacterial Metabolism. 2nd Edition. Springer Verlag. New York.
Hendrawati, R. 2011. Pemanfaatan Limbah Produksi Pangan dan Keong Mas Sebagai Pakan Untuk Meningkatkan Pertumbuhan Ikan Lele Dumbo. SRKIPSI. Universitas Sebelas Maret. Surakarta.
Hepher, B., and Y. Pruginin. 1981. Commercial Fish Farming: with Special Reference to Fish Culture in Israel. John Willey and Son. New York. 261p.
Hopkins WD. 1994. Hand preferences for bimanual feeding in 140 captive chimpanzees (Pan troglodytes): rearing and ontogenetic determinants. Dev Psychobiol 27:395–407.
Joklik, W.K.H., H.P Willet., D.B Amos, And C.M Wilfert. 1992. Zinsser Micrbiology. 20th Edition. Aplleton And Lange, Norwalk.
KKP. 2011. Data Statistik Hasil Perikanan dan Kelautan Indonesia Periode 2005-2009. Kementerian Kelautan dan Perikanan. 2011. 11 hal.
Kusriningrum, R. S. 2012. Perancangan Percobaan. Airlangga University Press. Surabaya. 43 hal.
Mahyudin, K. 2008. Panduan Lengkap Agribisnis Lele. Penebar Swadaya. Jakarta.
Maryam, S. 2010. Budidaya Super Intensif Ikan Nila Merah dengan Tehnologi Bioflock: Profil Kualitas Air, Kelangsungan Hidup, dan Pertumbuhan. Skripsi. Institut Pertanian Bogor.
McGraw, W.J. 2002. Utilization Of Heterotrophic And Autotrophic Bacteria In Aquaculture. Global Aquaculture Advocate. December 2002. 82-83 Pp.
Metcalf & Eddy. 1991. Wastewater Engineering: Treatment, Disposal, and Reuse. G. Tchobanoglou, & F.L. Burton (Eds.). Mc Graw-Hill.
Mével, G., and D. Prieur. (2000). Heterotrophic Nitrification by a Thermophilic Bacillus Species as Influenced by Different Culture Conditions. Canadian Journal of Microbiology. Vol: 46(5). 465-473 pp.
Moore, A. 1991. Engineering Analysis of Thestoichiometry of Photoautotrophic, Autotrophic, and Heterotrophic Removal of Ammonia- Nitrogen in Aquaculture Systems. Aquaculture, 257: 346-358 pp.
Mukti, A.T., W. H. Satyantini, dan M. Arief. 2010. Penuntun Praktikum Bioteknologi Akuakultur. Fakultas Perikanan dan Kelautan Universitas Airlangga. 36 hal.
Nelson, J. S. 2006. Fishes of the World. Fourth Edition. John Wiley and Sons, Inc. New Jersey. USA. 315 p.
Notoadmodjo, S. 2010. Metode Penelitian Kesehatan. Rineka Cipta. Jakarta. 139 hal.
Parker, M. M. 1997. Biology of Microorganism. Prentice Hall. United States of America. 175-179 pp.
Parwanayoni, S.M.N. 2008. Pengaruh Populasi Bakteri Heterotrof Alga, Dan Protozoa Di Logoon BTDC Unit Penanganan Limbah Nusa Dua Bali.
Pillay, T. V. R. 1990. Aquaculture: Principle and Practices Fishery New Books. Oxford. London. Edinburg. Cambridge. Victoria.
Prassad, R., and J.F Power. 1997. Soil Fertility Management for Sustainable Agriculture. Lewis publisher. New York. 218 p.
Purnomo, P. D. 2012. Pengaruh Penambahan Karbohidrat pada Media Budidaya Pemeliharaab terhadap Produksi Budidaya Intensif Nila (Oreochromis niloticus). Journal of Aquaculture Management and Technology. Vol 1. No.1.161-179 hal.
Rosmaniar. 2011. Dinamika Biomassa Bakteri dan Kadar Limbah Nitrogen pada Budidaya Ikan Lele (Clarias gariepinus) Intensif secara Sistem Heterotrofik. Skripsi. Universitas Islam Negeri Syarif Hidayatullah. Jakarta.
Sari, N.W., I. Lukistyowati., dan N. Aryani. 2012. Pengaruh pemberian Temulawak (Curcuma xanthorriza Roxb) terhadap Kelulushidupan Ikan Mas (Cyprinus carpio L.) Setelah Diinfeksi Aeromonas hydrophilla. Jurnal Perikanan dan Kelautan. Vol. 17:2. Tahun 2012. 43-59 hal.
Shafrudin, D., Yuniarti dan M. Setiawati. 2006. Pengaruh Kepadatan Benih Ikan Lele Dumbo (Clarias sp.) terhadap Produksi pada Sistem Budidaya dengan Pengendalian Nitrogen Melalui Penambahan Tepung Terigu. Jurnal Akuakultur Indonesia. Vol. 5(2) : 137-147 hal.
Sitompul, S.O., E. Harpeni., dan B. Putri. 2012. Pangaruh Kepadatan Azolla sp. yang Berbeda terhadap Kualitas Air dan Pertubuhan Ikan Lele Dumbo pada Sistema Tanpa Ganti Air. Jurnal Rekayasa Dan Teknologi Budidaya Perairan. Vol.1:1. Oktober.2012.
Spotte, S. H. 1970. Fish and Invertebrate Culture: Water Management in Closed System. Wiley Interscience. New York. 145 p.
Stadar Nasional Indonesia. 2004. Cara Uji Nitrit (NO2) secara Spektrofotometri. dalam : Air dan Limbah: 9. SNI 06-6989.9-2004. Badan Standarisasi Nasional. Jakarta.
Stickney, R. R. 1979. Principles of Warmwater Aquaculture. A Wiley-Interscience Publication, John Wiley & Sons, Inc. New York.125 p.
Stickney, R.R., 2005. Aquaculture: An introductory text. CABI Publishing. USA.256 p.
Suarsini, E. 2006. Bioremediasi Limbah Cair Rumah Tangga menggunakan Konsorsia Bakteri Indigen yang Berpotensi Pereduksi Polutan. Disertasi. Program Studi Pendidikan Biologi. Universitas Negeri Malang.
Sugita, H., U. Satoshi., K. Daiju., and D. Yoshiaki . 1985. Changes in the Bacterial Composition of Water in a Carp Rearing Tank. In: Aquaculture. Elsvier. Amsterdam. 243-247 pp.
Todar, K. 2002. Growth Of Bacterial Population. Texbook Of Bacteria.
Van Wyk P, and J. Scarpa. 1999. Water Quality Requirements and Management. in: P. Van Wyk, R. Davis-Hodgkins, K.L Laramore, J. Main, Mountain, and J. Scarpa. Farming Marine Shrimp in Recirculating Freshwater Systems.
Wedemeyer, G. A. 1996. Physiology of Fish in Intensive Culture Systems. Chapman and Hall. New York. 232 p.
Woon, B.H. 2007. Removal of Nitrat Nitrogen in Convensional Wastewater Treatment Plant. Skripsi. Faculty of Civil Engineering. University Teknologi Malaysia.
Wulandari, D. 2013. Pengaruh Pemberian Probiotik terhadap Penurunan Bahan Organik dalam Air Media Pertumbuhan udang vannamei Litopennaeus vannamei di BBPBAP Jepara. Skripsi. IKIP PGRI. Semarang.
Yuniasari, D. 2009. Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi Serta Molase dengan C/N Rasio yang berbeda terhadap Profil Kualitas Air, Kelangsungan Hidup, dan Pertumbuhan Udang Vaname Litopenaeus vannamei. SKRIPSI. Institut Pertanian Bogor.
Lampiran 1. Data nilai Absorbansi ammonia pada beberapa konsentrasi Konsentrasi Absorbansi 0.1 0.086 0.2 0.142 0.3 0.284 0.4 0.678 0.5 0.721 Kurva Kalibrasi NH3: y = 1.806x - 0.159 R² = 0.912 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 0.1 0.2 0.3 0.4 0.5 0.6 A b sor b an si Konsentrasi (mg/L)