UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIBAKTERI ISOLAT KAPANG
ENDOFIT DARI DAUN TANAMAN PAKU DAUN
KEPALA TUPAI (Drynaria quercifolia (L.)J. Smith)
TERHADAP Escherichia coli, Salmonella typhi,
Staphylococcus aureus, DAN Bacillus subtilis
SKRIPSI
LILIS HERMAWATI
NIM: 1112102000027
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIBAKTERI ISOLAT KAPANG
ENDOFIT DARI DAUN TANAMAN PAKU DAUN
KEPALA TUPAI (Drynaria quercifolia (L.)J. Smith)
TERHADAP Escherichia coli, Salmonella typhi,
Staphylococcus aureus, DAN Bacillus subtilis
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
LILIS HERMAWATI NIM: 1112102000027
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
vi Sm.] terhadap Escherichia coli, Salmonella typhi, Staphylococcus aureus dan Bacillus subtilis.
Tanaman paku daun kepala tupai [Drynaria quercifolia (L.) J. Sm.] merupakan tanaman obat yang sering digunakan secara tradisional untuk mengobati penyakit tuberkulosis, demam, dispepsia, batuk dan demam tifoid. Kapang endofit hidup pada jaringan tanaman dan dapat menghasilkan senyawa yang memiliki khasiat sama dengan tumbuhan inangnya. Penelitian ini bertujuan untuk menguji aktivitas antibakteri isolat kapang endofit dari daun tanaman paku daun kepala tupai terhadap Escherichia coli ATCC 25922, Salmonella typhi ATCC 25241,
Staphylococcus aureus ATCC 25923 dan Bacillus subtilis ATCC 19659. Metode yang digunakan dalam penelitian ini adalah isolasi kapang endofit, pemurnian kapang endofit, karakterisasi isolat kapang endofit, seleksi kapang endofit, fermentasi kapang endofit, ekstraksi hasil fermentasi dan uji aktivitas antibakteri. Metabolit sekunder diekstraksi dari media fermentasi menggunakan etil asetat dan n-heksana, serta diekstraksi dari biomasa dengan metanol. Hasil isolasi kapang endofit diperoleh 10 isolat dan 4 diantaranya berpotensi sebagai antibakteri. Hasil uji aktivitas antibakteri kapang endofit menunjukkan bahwa isolat kapang endofit DA3A1, DT3B, DB3A dan DT1A1 yang diisolasi dari daun tanaman paku daun kepala tupai mampu menghambat bakteri uji. Ekstrak metanol dan etil asetat dari isolat DT1A1 dan DT3B berpotensi menghambat bakteri Salmonella typhi.
Penelitian ini memperlihatkan bahwa daun Drynaria quercifolia (L.) J. Sm mengandung metabolit sekunder dari kapang endofit yang berpotensi sebagai antibakteri.
vii
UIN Syarif Hidayatullah Jakarta ABSTRACT
Name : Lilis Hermawati
NIM : 11121020000027
Study Program : Farmasi
Title : Antibacterial Activity of Endophytic Fungi from Drynaria quercifolia (L.) J. Sm. Leaves Against Escherichia coli, Salmonella typhi, Staphylococcus aureus and Bacillus subtilis.
Oak leak fern [Drynaria quercifolia (L.) J. Sm.] is a medicinal plant that is often used traditionally to treat tuberculosis, fever, dyspepsia, cough and typhoid fever. Endophytic fungi living on plant tissue and can produce a compound that has properties similar to their host plants. The aim of this experiments was to determine the antibacterial activity of endophytic fungi isolated from leaf
Drynaria quercifolia (L.) J. Sm against Escherichia coli ATCC 25922,
Salmonella typhi ATCC 25241, Staphylococcus aureus ATCC 25923 and Bacillus subtilis ATCC 19659. The method used in this study was the isolation of endophytic fungi, purification endophytic fungi, characterization of endophytic fungi, selection of endophytic fungi, fermentation, extraction fermented, and antibacterial activity test. The secondary metabolites were extracted from fermentation medium with ethyl acetate and n-hexane, also was extraction with methanol from mycelium. The result showed that 4 of the 10 isolates potential as an antibacterial. Antibacterial activity was showed that endophytic fungi DA3A1, DT3B, DT1A1 and DB3A isolated from leaf oak leak fern can inhibit pathogenic bacteria. The methanolic and ethyl acetate extract of isolates DT1A1 and DT3B have a potential to inhibit Salmonella typhi. This study showed that the leaves of
Drynaria quercifolia (L.) J. Sm. contains secondary metabolite from endophytic fungi that have a potential as an antibacterial.
viii
UIN Syarif Hidayatullah Jakarta KATA PENGANTAR
Alhamdulillahirabbil’alamin, puji syukur kehadirat Allah Subhanahu Wa Ta’ala atas segala rahmat, hidayah dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi ini. Salawat serta salam semoga selalu tercurahkan kepada junjungan dan suri tauladan, Nabi Muhammad Shalallahu’alaihi wa sallam beserta keluarga dan para sahabatnya. Skripsi ini berjudul “Uji Aktivitas Antibakteri Isolat Kapang Endofit dari Daun Tanaman Paku Daun Kepala Tupai [Drynaria
quercifolia (L.) J. Smith] terhadap Escherichia coli, Salmonella typhi,
Staphylococcus aureus dan Bacillus subtilis” diajukan sebagai persyaratan untuk memperoleh gelar sarjana farmasi dari Program Studi Farmasi, Fakultas
Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa dalam penulisan skripsi ini banyak mendapat
doa, bantuan, bimbingan dan dukungan dari berbagai pihak. Oleh karena itu,
penulis mengucapkan terimakasih kepada:
1. Kedua orangtua tercinta, Bapak H. Herman Syah dan Ibu Hj. Siti Sunarsih,
yang tiada hentinya memberikan dukungan, doa, nasihat, semangat, dan
bantuan selama penulis melaksanakan penelitian dan penyusunan skripsi
ini, serta kakakku Eka Novita Sari dan Adi Kurniawan dan adikku Fachri
Zakky Achmad yang selalu memberikan semangat dan nasihat.
2. Prof. Dr. Atiek Soemiati, M.S., Apt selaku pembimbing pertama dan Eka
Putri, M.Si., Apt selaku pembimbing kedua yang selalu memberikan
dukungan, saran, semangat, dan solusi selama melaksanakan penelitian
dan penyelesaian skripsi ini.
3. Dr. H. Arif Sumantri, S.KM., M.Kes selaku Dekan Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Dr. Nurmeilis, M.Si., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
xi
UIN Syarif Hidayatullah Jakarta DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.1.Mikroorganisme Endofit ... 4
2.2.Kapang Endofit ... 4
2.2.1.Kapang Endofit Penghasil Antimikroorganisme ... 6
2.2.2.Isolasi Kapang Endofit ... 6
2.2.3.Karakterisasi Berdasarkan Karakter Morfologi Kapang ... 7
2.3.Fermentasi ... 9
2.3.1.Faktor-faktor yang Mempengaruhi Proses Fermentasi ... 10
2.4.Antimikroorganisme ... 11
2.4.1.Mekanisme Kerja Antimikroorganisme ... 11
2.4.2.Pengujian Aktivitas Antimikroorganisme ... 13
2.4.2.1.Metode Difusi ... 13
2.4.2.2.Metode Dilusi ... 14
2.5.Mikroorganisme Uji ... 15
2.5.1.Escherichia coli ... 15
2.5.2.Salmonella typhi. ... 16
2.5.3.Staphylococcus aureus ... 16
2.5.4.Bacillus subtilis. ... 17
2.6.Tanaman Paku Kepala Tupai (Drynaria quercifolia (L.)J. Smith) ... 18
2.6.1.Klasifikasi ... 19
2.6.2.Penggunaan Tradisional Tanaman Drynaria quercifolia (L.)... 19
xii
UIN Syarif Hidayatullah Jakarta
BAB III METODE PENELITIAN ... 21
3.1.Waktu dan Tempat Penelitian ... 21
3.2.Alat dan Bahan ... 21
3.2.1.Alat ... 21
3.2.2.Bahan ... 21
3.2.3.Bakteri Uji ... 22
3.3.Prosedur Penelitian... 22
3.3.1.Sterilisasi Alat ... 22
3.3.2.Pembuatan Media ... 22
3.3.2.1.Pembuatan Media Potato Dextrose Agar (PDA) ... 22
3.3.2.2.Pembuatan Media Mueller Hinton Agar (MHA) ... 22
3.3.2.3.Pembuatan Media Agar Miring PDA ... 23
3.3.2.4.Pembuatan Media Agar Miring NA ... 23
3.3.2.5.Pembuatan Media Potato Dextrose Yeast (PDY) ... 23
3.3.3.Isolasi Kapang Endofit ... 23
3.3.4.Pemurnian Kapang Endofit ... 24
3.3.5.Karakterisasi Isolat Kapang Endofit ... 25
3.3.6.Peremajaan Bakteri Uji ... 25
3.3.7.Identifikasi Kemurnian Bakteri Uji ... 25
3.3.8.Pembuatan Inokulum Bakteri Uji... 26
3.3.9.Seleksi Kapang Endofit yang Berpotensi sebagai Antibakteri ... 26
3.3.10.Fermentasi Kapang Endofit... 27
3.3.11.Ekstraksi Hasil Fermentasi ... 27
3.3.12.Uji Aktivitas Antibakteri ... 28
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1. Determinasi Tanaman ... 29
4.2. Isolasi dan Pemurnian Kapang Endofit... 30
4.3. Karakterisasi Isolat Kapang Endofit ... 33
4.4. Peremajaan Bakteri Uji ... 44
4.5. Identifikasi Kemurnian Bakteri Uji ... 44
4.6. Pembuatan Inokulum Bakteri Uji ... 45
4.7. Seleksi Kapang Endofit yang Berpotensi sebagai Antibakteri ... 45
4.8. Fermentasi Kapang Endofit ... 46
4.9. Ekstraksi Hasil Fermentasi ... 47
4.10. Uji Aktivitas Antibakteri ... 48
BAB V KESIMPULAN DAN SARAN ... 54
5.1. Kesimpulan ... 54
5.2. Saran ... 54
DAFTAR PUSTAKA ... 55
xiii
UIN Syarif Hidayatullah Jakarta DAFTAR TABEL
Halaman
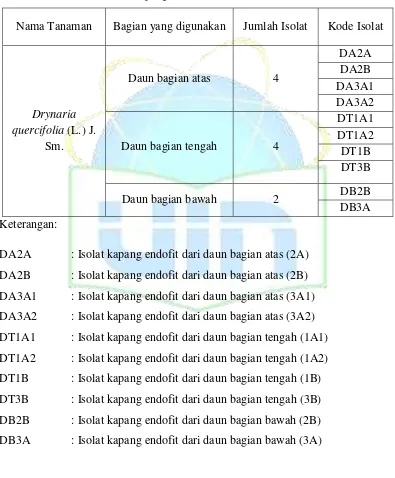
Tabel 4.1 Hasil Pemurnian Kapang Endofit ... 30
Tabel 4.2 Hasil Seleksi Kapang Endofit terhadap Bakteri Uji... 46
Tabel 4.3 Organoleptis Ekstrak ... 48
xiv
UIN Syarif Hidayatullah Jakarta DAFTAR GAMBAR
Halaman
Gambar 2.1: Berbagai bentuk konidia ... 9
Gambar 2.2: Hifa bersekat dan tidak bersekat ... 9
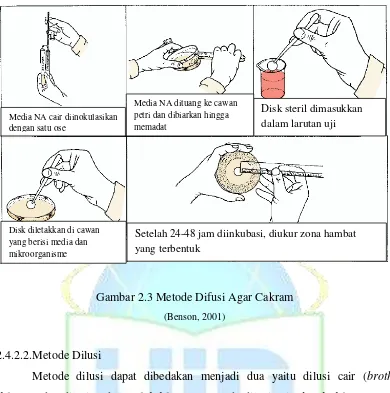
Gambar 2.3: Metode Difusi Agar Cakram ... 14
Gambar 2.4: Tanaman Drynaria quercifolia ... 18
Gambar 4.1: Posisi Penanaman Daun Drynaria quercifolia pada media PDA ... 32
Gambar 4.2: Karakterisasi Makroskopis dan Mikroskopis Isolat DA2A... 34
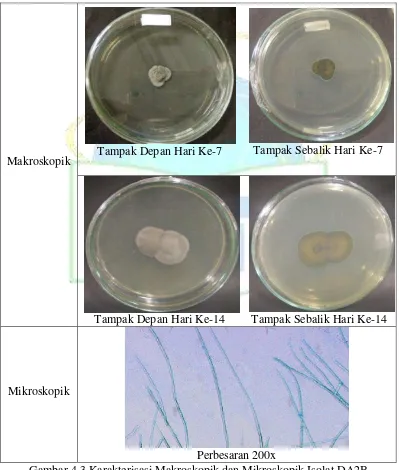
Gambar 4.3: Karakterisasi Makroskopis dan Mikroskopis Isolat DA2B ... 35
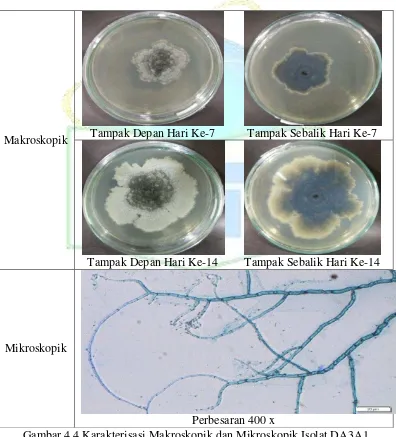
Gambar 4.4: Karakterisasi Makroskopis dan Mikroskopis Isolat DA3A1... 36
Gambar 4.5: Karakterisasi Makroskopis dan Mikroskopis Isolat DA3A2... 37
Gambar 4.6: Karakterisasi Makroskopis dan Mikroskopis Isolat DT1A1 ... 38
Gambar 4.7: Karakterisasi Makroskopis dan Mikroskopis Isolat DT1A2 ... 39
Gambar 4.8: Karakterisasi Makroskopis dan Mikroskopis Isolat DT1B ... 40
Gambar 4.9: Karakterisasi Makroskopis dan Mikroskopis Isolat DT3B ... 41
Gambar 4.10: Karakterisasi Makroskopis dan Mikroskopis Isolat DB2B ... 42
Gambar 4.11: Karakterisasi Makroskopis dan Mikroskopis Isolat DB3A ... 43
Gambar 4.12: Sampel Daun Tanaman Paku Daun Kepala Tupai ... 73
Gambar 4.13: Hasil Isolasi Kapang Endofit Daun bagian Atas Tanaman Drynaria quercifolia ... 74
Gambar 4.14: Hasil Isolasi Kapang Endofit Daun bagian Tengah Tanaman Drynaria quercifolia ... 75
Gambar 4.15: Hasil Isolasi Kapang Endofit Daun bagian Bawah Tanaman Drynaria quercifolia ... 76
Gambar 4.16: Hasil Seleksi Kapang Endofit terhadap Escherichia coli ... 77
Gambar 4.17: Hasil Seleksi Kapang Endofit terhadap Staphylococcus aureus . 78 Gambar 4.18: Hasil Seleksi Kapang Endofit terhadap Bacillus subtilis ... 78
Gambar 4.19: Hasil Seleksi Kapang Endofit terhadap Salmonella typhi ... 79
Gambar 4.20: Hasil Fermentasi Isolat Kapang Endofit Hari Ke-21 ... 80
Gambar 4.21: Pengamatan mikroskopis Bacillus subtilis ... 81
Gambar 4.22: Pengamatan mikroskopis Staphylococcus aures ... 81
Gambar 4.23: Pengamatan mikroskopis Salmonella typhi ... 81
Gambar 4.24: Pengamatan mikroskopis Escherichia coli ... 81
Gambar 4.25: Hasil Ekstrak Metanol, Etil Asetat, dan N-Heksana dari 4 Isolat Kapang Endofit ... 82
Gambar 4.26: Hasil Uji Aktivitas Antibakteri Ekstrak Etil Asetat terhadap bakteri Bacillus subtilis ... 83
Gambar 4.27: Hasil Uji Aktivitas Antibakteri Ekstrak N-Heksana (A) dan Metanol (B) terhadap bakteri Escherichia coli ... 83
Gambar 4.28: Hasil Uji Aktivitas Antibakteri Ekstrak Etil Asetat (A) dan Metanol (B) terhadap bakteri Salmonella typhi ... 84
xv
UIN Syarif Hidayatullah Jakarta DAFTAR LAMPIRAN
Halaman
Lampiran 1: Hasil Determinasi Tanaman ... 61
Lampiran 2: Alur Penelitian ... 62
Lampiran 3: Sterilisasi Permukaan ... 63
Lampiran 4: Pemurnian Kapang Endofit ... 64
Lampiran 5: Karakterisasi Isolat Kapang Endofit ... 65
Lampiran 6: Peremajaan Bakteri Uji... 66
Lampiran 7: Identifikasi Kemurnian Bakteri Uji ... 67
Lampiran 8: Pembuatan Inokulum Bakteri Uji ... 68
Lampiran 9: Seleksi Kapang Endofit yang berpotensi sebagai Antibakteri .... 69
Lampiran 10: Fermentasi Kapang Endofit ... 70
Lampiran 11: Ekstraksi Hasil Fermentasi ... 71
Lampiran 12: Uji Aktivitas Antibakteri ... 72
Lampiran 13: Sampel Daun Tanaman Paku Daun Kepala Tupai ... 73
Lampiran 14: Hasil Isolasi Daun Tanaman Paku Daun Kepala Tupai ... 74
Lampiran 15: Hasil Seleksi Kapang Endofit yang berpotensi sebagai Antibakteri ... 77
Lampiran 16 : Hasil Fermentasi ... 80
Lampiran 17 : Pengamatan Mikroskopis Bakteri Uji ... 81
Lampiran 18 : Hasil Berat Ekstrak ... 82
1
UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN
1.1 Latar Belakang
Penyakit infeksi yang disebabkan oleh mikroorganisme patogen
merupakan salah satu penyakit terbesar di seluruh dunia (Mardiastuti et al., 2007).
Dalam upaya mengobati infeksi tersebut digunakan antibiotik sebagai agen terapi.
Namun dalam beberapa dekade adanya resistensi antibiotik telah menjadi
ancaman terhadap pengobatan efektif dari berbagai infeksi yang disebabkan oleh
bakteri, virus, parasit maupun jamur (WHO, 2014). Adanya resitensi antibakteri
mengakibatkan biaya perawatan penderita semakin tinggi dan meningkatnya
angka kematian. Oleh karena itu, dibutuhkan penemuan antibiotik baru untuk
menangani hal tersebut (Mardiastuti et al., 2007)
Tanaman obat dapat menjadi bahan baku yang digunakan untuk
memproduksi antibakteri. Indonesia memiliki potensi yang cukup bagus untuk
mengembangkan obat dengan bahan baku tanaman karena Indonesia menempati
peringkat kedua terbesar setelah Brazil yang memiliki keanekaragaman hayati
terbesar (Radji, 2005). Pembuatan obat dalam jumlah yang cukup membutuhkan
tanaman yang banyak dan diperlukan waktu yang lama jika tanaman tersebut
termasuk tanaman tahunan, serta penyediaan bahan baku dari tanaman secara
berlebihan dikhawatirkan dapat mengurangi keanekaragaman hayati (Kumala,
2014; Radji, 2005).
Salah satu peluang besar untuk dikembangkan sebagai sumber penghasil
senyawa antibakteri adalah mikroorganisme endofit. Mikroorganisme endofit
merupakan mikroorganisme yang berada dalam jaringan tanaman hidup (Kumala,
2014). Setiap spesies tanaman yang berjumlah hampir 300.000 di bumi,
merupakan host bagi satu atau lebih mikroorganisme endofit (Strobel & Daisy,
2006). Masing-masing bagian tanaman mengandung satu atau lebih
mikroorganisme endofit yang terdiri dari bakteri dan fungi dan salah satunya yang
UIN Syarif Hidayatullah Jakarta
Kapang endofit dapat hidup di dalam jaringan tanaman tanpa
membahayakan inangnya (Radji, 2005). Kapang endofit dapat tumbuh lebih cepat
dan tidak memerlukan lahan yang luas daripada tanaman obat (Kumala, 2014;
Strobel & Daisy, 2003). Pemanfaatan kapang yang diisolasi dari daun, akar,
batang atau bagian lain dari tanaman sebagai sumber bahan baku obat
memungkinkan untuk tidak diperlukannya penebangan tanaman tersebut sehingga
penggunaan bahan alam yang berlebih dan segala akibat buruknya dapat dihindari
(Kumala, 2014).
Salah satu kekayaan alam di Indonesia adalah tanaman paku daun kepala
tupai [Drynaria quercifolia (L.) J. Sm]. Tanaman ini dapat ditemukan di pohon
ataupun di batu (Prasanna et al., 2014). Menurut Strobel & Daisy (2003), salah
satu kriteria tanaman yang dapat dipilih untuk menghasilkan kapang endofit
adalah tanaman yang memiliki sejarah etnobotani seperti digunakan dalam
pengobatan tradisional. Secara empiris, Drynaria quercifolia telah digunakan
untuk mengobati penyakit tuberkulosis, demam, dispepsia dan batuk (Beknal et
al., 2010). Secara spesifik, daunnya digunakan untuk pengobatan demam tifoid
(Kamboj & Kalia, 2014). Di Malaysia, daunnya digunakan untuk pengobatan
demam, dispepsia dan batuk. Di India daunnya digunakan dalam pengobatan
rematik, penyakit kulit, ekspektoran dan obat cacing (Mazumder PB et al., 2011).
Skrining fitokimia dari ekstrak daun Drynaria quercifolia menunjukkan
adanya alkaloid, karbohidrat, fenol, saponin, flavonoid, dan karbohidrat (Runa et
al., 2013). Pada penelitian lainnya telah dilakukan uji aktivitas antibakteri pada
bagian rhizoma Drynaria quercifolia. Potensi antibakteri ekstrak etil asetat dari
rhizoma Drynaria quercifolia telah dilakukan terhadap bakteri Bacillus subtilis,
Staphylococcus aureus, Escherichia coli, Salmonella typhi dan Pseudomonas
aeruginosa (Khan et al., 2012). Telah dilakukan isolasi senyawa asam 3,4
dihidroksibenzoat dari rhizoma D. quercifolia yang memiliki aktivitas antibakteri
terhadap 4 bakteri Gram positif yaitu Bacillus subtilis, Bacillus megaterium,
Staphylococcus aureus, Streptococcus β-haemolyticus dan 6 bakteri Gram negatif yaitu Escherichia coli, Shigella dysenteriae, Shigella sonnei, Shigella flexneri,
UIN Syarif Hidayatullah Jakarta Berdasarkan studi literatur, belum ditemukan adanya laporan penelitian
tentang isolasi kapang endofit pada daun tanaman Drynaria quercifolia. Oleh
karena itu, penelitian ini bertujuan untuk melakukan isolasi dan uji aktivitas isolat
kapang endofit dari daun tanaman paku daun kepala tupai [Drynaria quercifolia
(L.) J. Sm.] terhadap Escherichia coli, Salmonella typhi, Staphylococcus aureus
dan Bacillus subtilis.
1.2 Rumusan Masalah
Apakah isolat kapang endofit dari daun tanaman paku daun kepala tupai
[Drynaria quercifolia (L.) J. Sm.] memiliki aktivitas antibakteri terhadap
Escherichia coli, Salmonella typhi, Staphylococcus aureus dan Bacillus subtilis?
1.3 Hipotesis
Daun tanaman paku daun kepala tupai [Drynaria quercifolia (L.) J. Sm.]
memiliki isolat kapang endofit yang mempunyai aktivitas antibakteri terhadap
bakteri Escherichia coli, Salmonella typhi, Staphylococcus aureus dan Bacillus
subtilis.
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk menguji aktivitas antibakteri isolat kapang
endofit dari daun tanaman paku daun kepala tupai [Drynaria quercifolia (L.) J.
Sm.] terhadap Escherichia coli, Salmonella typhi, Staphylococcus aureus dan
Bacillus subtilis.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah
mengenai aktivitas antibakteri kapang endofit yang terdapat dalam daun pada
tanaman paku daun kepala tupai [Drynaria quercifolia (L.) J. Sm.]. sebagai
4
UIN Syarif Hidayatullah Jakarta BAB II
TINJAUAN PUSTAKA
2.1. Mikroorganisme Endofit
Mikroorganisme endofit merupakan mikroorganisme yang hidup di dalam
jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk
koloni dalam jaringan tanaman tanpa membahayakan inangnya (Radji, 2005).
Mikroorganisme endofit dapat hidup bersimbiosis dengan tanaman inangnya dan
dapat menghasilkan metabolit sekunder, termasuk metabolit sekunder yang
memiliki bioaktivitas seperti zat antimikroorganisme, antifungi dan antikanker.
Mikroorganisme endofit termasuk bakteri, kapang atau khamir dapat ditemukan
pada semua jenis tanaman, mulai dari pohon berkayu dan herba sampai
rumput-rumputan (Kumala, 2014).
Mikroorganisme endofit dapat diisolasi dari semua jaringan tanaman.
Bagian organ atau jaringan tanaman tertentu mengandung mikroorganisme endofit
tertentu pula yang berbeda satu dengan yang lainnya. Dalam satu jaringan
tanaman kemungkinan dapat ditemukan beberapa jenis mikroorganisme endofit.
Jumlah isolat yang diperoleh dari satu bagian tanaman inang biasanya amat
banyak, tetapi hanya beberapa mikroorganisme saja yang dominan pada satu
inang (Kumala, 2014).
2.2. Kapang endofit
Dari sekitar 300.000 jenis tanaman yang tersebar di muka bumi,
masing-masing tanaman mengandung satu atau lebih mikroorganisme endofit yang terdiri
dari bakteri atau kapang dan yang paling umum ditemukan adalah dari jenis
kapang (Strobel & Daisy, 2003). Kapang merupakan kelompok mikroorganisme
eukariotik yang tergolong fungi berfilamen dan multiseluler (Kumala, 2014).
Kolonisasi kapang endofit pada jaringan tanaman inang terjadi melalui
penetrasinya ke dalam lapisan tanaman dengan cara pemecahan mekanis jaringan
UIN Syarif Hidayatullah Jakarta epidermis tanaman inang (Kumala et al., 2007). Kapang endofit yang diperoleh
dari daun lebih banyak dibandingkan kapang endofit yang diperoleh dari bunga,
hal ini dikarenakan daun memiliki lapisan kutikula yang tipis dan permukaan daun
yang luas, sehingga kemungkinan mikroorganisme endfit yang dapat berpenetrasi
lebih banyak. Bunga merupakan bagian tanaman yang tumbuh pada waktu
tertentu dan cepat layu, sehingga hanya sedikit mikroorganisme endofit yang
berpenetrasi (Kumala, 2014).
Telah dilaporkan bahwa kapang endofit yang berada pada bagian tanaman
dapat menghasilkan senyawa fungsional yang diduga sebagai akibat koevolusi
atau transfer genetik dari tanaman inangnya ke dalam mikroorganisme endofit
(Radji, 2005). Senyawa yang dihasilkan kapang endofit tersebut dapat berupa
senyawa antikanker, antibakteri, antifungi, antivirus dan lain-lain (Noverita et al.,
2009).
Kapang endofit mampu menghasilkan metabolit sekunder yang sama
dengan inangnya (Strobel & Daisy, 2003), seperti Taxomyces andreanae yang
merupakan kapang endofit yang diisolasi dari tanaman Taxus brevifolia terbukti
dapat menghasilkan taxol yang bersifat antikanker (Kumala, 2014). Kemampuan
kapang endofit tersebut merupakan peluang yang sangat besar dan dapat
diandalkan untuk memproduksi senyawa metabolit sekunder dari kapang endofit.
Kapang endofit dapat menghasilkan berbagai senyawa yang memiliki aktivitas
biologi, diantaranya terpenoid, steroid, xanton, fenol, isokumarin dan sebagainya
(Suryanarayanan et al., 2009).
Hubungan antara kapang endofit dengan tanaman inangnya berupa
simbiosis mutualisme. Pada umumnya, baik kapang maupun tanaman inangnya
saling menunjang satu sama lain. Di satu sisi, kapang endofit akan mendapatkan
nutrisi dari tanaman inangnya, tempat tinggal serta perlindungan dari lingkungan.
Di sisi lain, kapang endofit secara tidak langsung menguntungkan pertumbuhan
tanaman dengan menghasilkan zat metabolit sekunder dan enzim yang berguna
untuk adaptasi tanaman terhadap cahaya, melindungi dari kekeringan, herbivora,
UIN Syarif Hidayatullah Jakarta 2.2.1. Kapang Endofit Penghasil Antimikroorganisme
Menurut Suryanarayanan et al. (2009) banyak metabolit sekunder dari
kapang dengan berbagai struktur kimia dan aktivitas biologi. Metabolit sekunder
dapat didefinisikan sebagai senyawa organik dengan berat molekul rendah yang
dibuat oleh mikroorganisme yang tidak diperlukan untuk pertumbuhan, diproduksi
sebagai adaptasi untuk fungsi tertentu di alam (Strobel & Daisy, 2003). Sekitar
1500 metabolit kapang telah dilaporkan menunjukkan aktivitas anti kapang, anti
tumor dan antibakteri (Pelaez, 2005). Endofit dipercaya dapat mengatasi masalah
resistensi beberapa mikroorganisme patogen dengan memproduksi metabolit
sekunder dengan aktivitas antimikroorganisme.
Beberapa kapang endofit yang mampu menghasilkan produk potensial yaitu
Taxomyces andreanae yang diisolasi dari tanaman Taxus brevifolia telah terbukti
menghasilkan taxol yang bersifat antikanker. Kapang endofit lain, Lastodiplodia
theobromae, yang diisolasi dari tanaman Morinda citrifolia, diketahui
menghasilkan metabolit sekunder yang memiliki aktivitas antikanker menyerupai
taxol. Kapang endofit Cladosporium sp, Aspergillus flavus, Aspergillus sp dan
Curvularia lunata yang diisolasi dari tanaman obat Kigelia Africana (Lam) Beth.
diketahui memiliki aktivitass antibakteri terhadap Staphylococcus aureus, Bacillus
subtilis dan Escherichia coli. Dari kapang Fusarium sp tumbuh di dalam tanaman
Mirabilis jalapa L. dapat diisolasi metabolit sekunder yang memiliki aktivitas
terhadap bakteri Gram positif dan Gram negatif (Kumala, 2014).
2.2.2. Isolasi Kapang endofit
Endofit dapat diisolasi dari berbagai bagian tanaman seperti biji, daun, akar,
buah dan batang (Izza, 2011). Isolasi merupakan cara untuk memisahkan suatu
mikroorganisme dari lingkungannya, sehingga diperoleh biakan yang sudah tidak
tercampur dengan biakan lain atau disebut biakan murni (Listiandiani, 2011).
Pemilihan tanaman yang dipakai untuk isolasi endofit harus terlihat sehat dan
bebas dari penyakit tanaman, hal ini untuk meminimalkan keberadaan patogen
tanaman dan untuk mencegah isolasi mikroorganisme patogen. Sampel tanaman
UIN Syarif Hidayatullah Jakarta sesegara mungkin dilakukan isolasi untuk menghindari kontaminasi oleh
mikrospora melalui udara (Selim et al., 2012).
Langkah yang paling penting untuk isolasi kapang adalah sterilisasi
permukaan dan bagian tanaman yang dipilih harus dipotong kecil untuk
memudahkan sterilisasi dan proses isolasi (Selim et al., 2012). Metode tersebut
bertujuan menghilangkan mikroorganisme yang berada di permukaan tumbuhan,
sehingga koloni yang diperoleh merupakan koloni endofit yang berasal dari dalam
jaringan tumbuhan (Strobel & Daisy, 2003).
Metode sterilisasi permukaan menggunakan etanol 70% dan natrium
hipoklorit 5,25% sebagai disinfektan (Listiandini, 2011). Disinfektan adalah
senyawa kimia yang digunakan dalam proses disinfeksi, yaitu proses mengurangi
mikroorganisme patogen termasuk spora bakteri pada permukaan suatu objek
(Rao, 2008). Alkohol dan hipoklorit yang digunakan memiliki spektrum aktivitas
yang berbeda. Alkohol mendenaturasikan protein dengan cara dehidrasi dan
menginaktifkan enzim (Rutala et al., 2008). Efek dari etanol 70% lebih baik
dibandingkan alkohol murni, karena protein didenaturasi lebih cepat dengan
adanya air (Rutala et al., 2008). Natrium hipoklorit merupakan senyawa yang
mengandung klorin yang bekerja dengan mengoksidasi secara irreversible gugus
sulfihidril pada enzim dan menganggu fungsi metabolik dari sel bakteri (Valera,
2008; Rutala et al., 2008).
Isolasi kapang endofit dapat dilakukan dengan teknik penanaman langsung
dari bagian tanaman yang sudah disterilisasi terlebih dahulu permukannya. Media
isolasi yang biasa digunakan adalah media PDA (Potato Dextrose Agar). Media
ini bersifat selektif terhadap kapang dan mengandung kentang sebagai sumber
karbohidrat yang merupakan sumber nutrisi bagi kapang (Ariyono et al., 2014).
2.2.3. Karakterisasi Berdasarkan Karakter Morfologi Kapang
Karakterisasi kapang secara konvensional dapat dilakukan dengan
pengamatan karakter morfologi. Tujuan dari pengamatan morfologi adalah
UIN Syarif Hidayatullah Jakarta tersebut. Pengamatan karakter morfologi dilakukan secara mikroskopik dan
makroskopik (Gandjar et al., 1999).
Pengamatan secara makroskopik dapat dilihat dari warna koloni, warna
sebalik koloni, permukaan koloni (granular, seperti tepung, menggunung, licin,
ada atau tidak tetes-tetes eksudat), diameter koloni dan lingkaran-lingkaran
konsentris (Kumala, 2014). Sedangkan pengamatan mikroskopik dilakukan
menggunakan mikroskop. Pengamatan yang dilakukan meliputi ada atau tidaknya
sekat pada hifa, pertumbuhan hifa (bercabang atau tidak bercabang), ada tidaknya
konidia, dan bentuk konidia (Ariyono et al., 2014).
Kapang merupakan fungi yang berfilamen dan multiseluler (Pratiwi, 2008).
Kapang memiliki dua spora aseksual yaitu sporangisopora dan konidia (Benson,
2001). Sporangiospora terbentuk di dalam kantung yang disebut sporangium pada
ujung hifa, sedangkan konidia berupa spora satu sel atau multisel, tidak terdapat
dalam kantung dan terbentuk di ujung hifa (konidiofor) (Pratiwi, 2008). Bentuk
dari konidia bervariasi, dapat berbentuk bulat, semibulat, oval, silindris, elips,
seperti benang (scolecospora), seperti bulan sabit (lunata), seperti ginjal
(reniform), seperti bintang (staurospora), atau berbentuk menggulung
(helicospora) (Gandjar et al., 2006).
Kapang tersusun atas filamen-filamen yang disebut hifa. Kumpulan hifa
yang bercabang-cabang membentuk suatu jala yang disebut miselium. Hifa-hifa
yang telah menjalin suatu jaringan miselium makin lama makin tebal dan akan
membentuk suatu koloni yang dapat dilihat dengan kasat mata (Gandjar et al.,
2006). Hifa dapat dibedakan dengan ada atau tidaknya septum atau sekat. Hifa
yang memiliki sekat disebut juga hifa septat. Sekat membagi hifa menjadi
kompartemen-kompartemen (Benson, 2001), dan di dalam setiap kompartemen
terdapat satu inti sel (Gandjar et al., 2006). Hifa yang tidak bersekat disebut hifa
aseptat, memiliki sejumlah inti sel yang tersebar di dalam sitoplasma sehingga
UIN Syarif Hidayatullah Jakarta Gambar 2.1 Berbagai bentuk konidia
(Gandjar et al., 2006)
Gambar 2.2 Hifa bersekat dan tidak bersekat
(Hogg, 2005)
2.3. Fermentasi
Produk metabolit sekunder kapang endofit dapat diperoleh dari hasil
fermentasi. Terhadap produk tersebut dapat dilakukan pengujian berbagai
aktivitas biologis. Istilah fermentasi digunakan sebagai proses untuk penguraian
metabolik senyawa organik oleh mikroorganisme yang menghasilkan energi
(Kumala, 2014). Fermentasi dapat menghasilkan biomassa, enzim, metabolit baik
UIN Syarif Hidayatullah Jakarta sekunder (Sulistyaningrum, 2008). Berdasarkan jenis media, fermentasi dapat
dibedakan menjadi dua (Kumala, 2014), yaitu:
a. Fermentasi media padat adalah proses fermentasi dengan substrat tidak larut
dan tidak mengandung air bebas, tetapi cukup mengandung air untuk
keperluan mikroorganisme. Mikroorganisme ditumbuhkan pada permukaan
media padat, sehingga fermentasi jenis ini disebut fermentasi permukaan.
Fermentasi media padat digunakan untuk produksi enzim dan asam organik
yang menggunakan kapang.
b. Fermentasi media cair adalah proses fermentasi dengan substrat yang larut
atau tersuspensi dalam fasa cair. Fermentasi media cair disebut fermentasi
kultur terendam. Sebagai inokulum pada fermentasi ini digunakan bakteri,
kapang dan khamir.
Berdasarkan metodenya, fermentasi dibagi menjadi dua yaitu fermentasi
metode goyang dan fermentasi metode diam. Fermentasi metode goyang
menggunakan alat pengocok rotary. Pada mesin pengocok rotary, kultur akan
berputar perlahan di dalam labu. Sebagai wadah fermentasi digunakan labu
erlenmeyer atau tabung reaksi besar. Fermentasi metode diam menggunakan labu
erlenmeyer sebagai wadah yang didiamkan selama masa inkubasi tanpa ada
goncangan (Kumala, 2014).
2.3.1. Faktor-Faktor yang Mempengaruhi Proses Fermentasi (Kumala, 2014) a) Substrat dan nutrisi
Medium fermentasi harus menyediakan semua nutrisi yang dibutuhkan
untuk pertumbuhan dan memperoleh energi. Dalam fermentasi, dibutuhkan
substrat yang murah, mudah didapat dan efisien penggunaannya. Beberapa
substart yang dapat digunakan sebagai sumber karbon adalah kentang dan
dekstrosa, sedangkan sebagai sumber nitrogen dapat digunakan ekstrak
UIN Syarif Hidayatullah Jakarta b) Keasaman (pH)
Pengukuran pH dilakukan agar medium dapat dipertahankan berada pada
pH optimum selama fermentasi. Bakteri memiliki pH optimum 6,7-7,5; pada
pH di bawah 5,5 dan di atas 8,5, bakteri tidak dapat tumbuh dengan baik.
Khamir dapat tumbuh padda pH 2,5-8,5. Sementara kapang memiliki pH
optimum antara 5-7.
c) Suhu
Fermentasi dilakukan pada suhu dimana pertumbuhan sel atau produksi
metabolit tertinggi. Sebagian besar mikroorganisme dapat tumbuh pada
suhu 20-30oC.
2.4. Antimikroorganisme
Salah satu jenis metabolit sekunder yang dihasilkan oleh kapang endofit
adalah senyawa antimikroorganisme (Radji, 2005). Senyawa antimikroorganisme
merupakan senyawa kimia yang memiliki kemampuan dalam membunuh atau
menghambat pertumbuhan mikroorganisme. Berbagai golongan senyawa
antimikroorganisme dari kapang endofit yang berhasil diperoleh antara lain:
alkaloid, steroid, terpenoid, quinon, dan flavonoid (Yu et al., 2010).
2.4.1. Mekanisme Kerja Antimikroorganisme
Senyawa antimikroorganisme dapat diklasifikasikan berdasarkan spektrum
ataupun mekanisme kerjanya. Berdasarkan spektrum kerjanya, senyawa
antimikroorganisme dibedakan menjadi spektrum sempit (narrow spectrum) dan
spektrum luas (broad spectrum). Senyawa antibakteri berspektrum sempit hanya
mampu menghambat satu golongan bakteri saja, seperti hanya mampu
menghambat atau membunuh bakteri Gram positif saja. Sedangkan senyawa
antibakteri spektrum luas dapat menghambat atau membunuh bakteri dari
golongan Gram positif maupun Gram negatif (Pratiwi, 2008)
Berdasarkan mekanisme aksinya, senyawa ini dibedakan menjadi lima
UIN Syarif Hidayatullah Jakarta a. Senyawa yang dapat menghambat sintesis dinding sel
Senyawa ini merusak lapisan peptidoglikan yang menyusun dinding sel
bakteri Gram negatif maupun Gram positif. Contoh antibiotik yang memiliki
mekanisme penghambatan sintesis dinding sel adalah penisilin, sefalosporin,
vankomisin, isoniazid (INH) dan karbapenem.
b. Senyawa yang dapat merusak membran plasma
Membran plasma bersifat semipermeabel dan mengendalikan transpor
berbagai metabolit ke dalam dan ke luar sel. Adanya gangguan atau
kerusakan struktur pada membran plasma dapat menghambat atau merusak
kemampuan membran plasma sebagai penghalang (barrier) osmosis dan
mengganggu sejumlah proses biosintesis yang diperlukan dalam membran.
Antibiotik yang bersifat merusak membran plasma terdapat pada antibiotik
golongan polipeptida yang bekerja dengan mengubah permeabilitas
membran plasma sel. Contohnya adalah polimiksin B yang melekat pada
fosfolipid membran, amfoterisin B yang akan bergabung dengan ergosterol
yang terdapat pada membran sel kapang dan menimbulkan gangguan dan
kebocoran sel.
c. Senyawa yang dapat menghambat sintesis protein
Penghambatan sintesis protein pada bakteri terjadi karena beberapa senyawa
antibakteri bekerja dengan berikatan pada ribosom subunit 30S (beberapa
terikat juga pada subunit 50S ribosom) dan mengubah sintesis protein yang
pada akhirnya menyebabkan kematian sel. Contoh senyawa tersebut adalah
aminoglikosida.
d. Senyawa yang mengambat sintesis asam nukleat
Penghambatan pada sintesis asam nukleat berupa penghambatan terhadap
transkripsi dan replikasi mikroorganisme. Yang termasuk antibiotik
penghambat sintesis asam nukleat adalah golongan kuinolon dan rifampin.
Rifampin menghambat sintesis mRNA dengan cara mengikat subunit
UIN Syarif Hidayatullah Jakarta e. Senyawa yang menghambat sintesis metabolit esensial
Penghambatan terhadap sintesis metabolit esensial antara lain dengan
adanya kompetitor berupa antimetabolit, yaitu agen yang secara kompetitif
menghambat metabolit mikroorganisme, karena memiliki struktur yang
mirip dengan substrat normal bagi enzim metabolisme. Termasuk
didalamnya adalah sulfanilamid dan asam para amino benzoat.
2.4.2. Pengujian Aktivitas Antimikroorganisme
Penentuan aktivitas antimikroorganisme terdiri dari dua metode (Pratiwi,
2008) yaitu:
2.4.2.1.Metode difusi
Metode ini menggunakan cakram berisi agen antimikroorganisme yang
diletakkan pada media agar yang telah ditanami mikroorganisme (Pratiwi, 2008).
Senyawa antimikroorganisme yang terkandung dalam kertas cakram akan
berdifusi ke segala arah (radial). Aktivitas antimikroorganisme dari metode difusi
agar cara cakram ditandai dengan terbentuknya zona hambat atau zona bening di
sekitar cakram yang mengindikasikan terhambatnya pertumbuhan
mikroorganisme oleh senyawa antimikroorganisme tersebut. Diameter zona
hambat yang terbentuk menunjukkan aktivitas suatu senyawa antimikroorganisme
UIN Syarif Hidayatullah Jakarta Gambar 2.3 Metode Difusi Agar Cakram
(Benson, 2001)
2.4.2.2.Metode Dilusi
Metode dilusi dapat dibedakan menjadi dua yaitu dilusi cair (broth
dilution) dan dilusi padat (solid dilution). Metode dilusi cair (broth dilution test)
digunakan untuk mengukur Kadar Hambat Minimun (KHM) dan Kadar Bunuh
Minimum (KBM). Cara yang dilakukan adalah dengan membuat seri pengenceran
agen antimikroorganisme pada medium cair yang ditambahkan dengan
mikroorganisme uji. Larutan uji agen antimikroorganisme pada kadar terkecil
yang terlihat jernih tanpa adanya pertumbuhan mikroorganisme uji ditetapkan
sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut selanjutnya
dikultur ulang pada media cair tanpa penambahan mikroorganisme uji ataupun
agen antimikroorganisme dan diinkubasi selama 18-24 jam. Media cair yang tetap
terlihat jernih setelah inkubasi ditetapkan sebagai KBM.
Metode dilusi padat (solid dilution test), metode ini serupa dengan metode
dilusi cair namun menggunakan media padat (solid). Keuntungan metode ini Setelah 24-48 jam diinkubasi, diukur zona hambat
yang terbentuk Disk diletakkan di cawan
yang berisi media dan mikroorganisme
Disk steril dimasukkan dalam larutan uji Media NA dituang ke cawan
petri dan dibiarkan hingga memadat
UIN Syarif Hidayatullah Jakarta adalah satu konsentrasi agen antimikroorganisme yang diuji dapat digunakan
untuk menguji beberapa mikroorganisme uji.
2.5. Mikroorganisme Uji
Mikroorganisme yang digunakan dalam pengujian aktivitas senyawa
antimikroorganisme adalah bakteri Gram negatif Escherichia coli, bakteri Gram
positif Staphylococcus aureus, dan Bacillus subtilis. Berikut ini adalah penjelasan
tentang mikroorganisme uji.
2.5.1. Escherichia coli
Klasifikasi Escherichia coli adalah sebagai berikut:
Kingdom : Bacteria
Subkingdom : Negibacteria
Phylum : Proteobacteria
Class : Gammaproteobacteria
Order : Enterobacteriales
Family : Enterobacteriaceae
Genus : Escherichia
Species : Escherichia coli
Escherichia coli merupakan bakteri Gram negatif, berbentuk batang pendek
berukuran 0,5 μm x (1,0-3,0) μm, mampu memfermentasi berbagai macam gula (glukosa, galaktosa, fruktosa, laktosa, maltosa) menghasilkan asam dan gas.
Pertumbuhan bakteri yang baik yaitu pada suhu 37oC (Hidayahti, 2010). E. coli
merupakan mikroflora alami yang dapat ditemukan pada saluran pencernaan
manusia (Listiandiani, 2011). Keberadaan flora normal dalam saluran pencernaan
akan memberikan keuntungan berupa menghambat pertumbuhan bakteri patogen,
menghasilkan vitamin B kompleks dan vitamin K (Jauhari, 2010). Dalam kondisi
dimana kekebalan tubuh inang dari flora tersebut lemah, maka flora normal dapat
menjadi patogen. E.coli yang bersifat patogen dapat menyebabkan penyakit diare
UIN Syarif Hidayatullah Jakarta ditularkan melalui air atau makanan yang terkontaminasi dengan feses hewan atau
manusia (Ryan & Ray, 2004).
2.5.2. Salmonella typhi
Klasifikasi Salmonella typhi sebagai berikut:
Kingdom : Bacteria
Subkingdom : Negibacteria
Phylum : Proteobacteria
Class : Gammaproteobacteria
Order : Enterobacteriales
Family : Enterobacteriaceae
Genus : Salmonella
Species : Salmonella typhi
S. typhi adalah bakteri yang selnya berbentuk batang, bersifat Gram negatif,
bergerak dengan flagel peritrik. Bakteri ini membutuhkan suhu 37oC untuk
pertumbuhannya. Bakteri Salmonella typhi termasuk anggota familia
Enterobacteriaceae yang merupakan strain bakteri penyebab terjadinya demam
tipoid. Bakteri akan masuk ke dalam tubuh manusia melalui makanan dan
minuman yang telah terkontaminasi oleh bakteri tersebut dan mengakibatkan
terjadinya demam tipoid. Selain itu Salmonella typhi dapat menyebabkan
gastroenteritis (keracunan makanan) dan septikemia (Darmawati, 2009).
2.5.3. Staphylococcus aureus
Klasifikasi Staphylococcus aureus adalah sebagai berikut:
Kingdom : Bacteria
Subkingdom : Posibacteria
Phylum : Firmicutes
Class : Bacilli
Order : Bacillales
UIN Syarif Hidayatullah Jakarta Genus : Staphylococcus
Species : Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram positif berbentuk bulat
berdiameter 1 μm, tersusun dalam kelompok-kelompok yang tidak teratur seperti
buah anggur (Plata et al., 2009). Bakteri ini sering ditemukan pada kulit, selaput
lendir terutama di hidung orang sehat (Plata et al., 2009). Koloni pada media
kaya nutrisi berwarna kuning (Stark, 2013). Bakteri ini tumbuh pada suhu
optimum 37ºC.
S. aureus merupakan salah satu dari berbagai spesies umum yang
menyebabkan infeksi nosokomial. Infeksi nosokomial S. aureus mempengaruhi
aliran darah, kulit, jaringan lunak dan saluran pernapasan bagian bawah. S. aureus
juga dapat menyebabkan infeksi serius seperti endokarditis dan osteomielitis
(Schito, 2006). S. aureus juga menyebabkan keracunan makanan, sindrom toxic
shock (suatu keadaan yang ditandai dengan panas mendadak, diare dan syok)
melalui produksi racun (Plata et al., 2009).
2.5.4. Bacillus subtilis
Klasifikasi Bacillus subtilis adalah sebagai berikut:
Kingdom : Bacteria
Subkingdom : Posibacteria
Phylum : Firmicutes
Class : Bacilli
Order : Bacillales
Family : Bacillaceae
Genus : Bacillus
Species : Bacillus subtilis
Bacillus subtilis adalah bakteri aerobik Gram positif, mempunyai ciri-ciri
sel berbentuk batang pendek, jarang membentuk rantai, permukaan spora
UIN Syarif Hidayatullah Jakarta bakteri pada medium agar berbentuk bundar, tepi tidak teratur, permukaan tidak
mengkilap, menjadi tebal dan keruh, kadang-kadang mengkerut dan berwarna
krem atau kecoklatan. Bentuk koloni agak bervariasi pada media yang berbeda
(Jauhari, 2010). Kisaran suhu pertumbuhan B. subtilis adalah 5-55ºC, dengan suhu
optimum 20-45ºC. Bakteri tersebut diketahui sebagai penyebab kontaminasi dan
kerusakan produk makanan (Listiandiani, 2011)
2.6. Tanaman Paku Kepala Tupai (Drynaria quercifolia L.)
Gambar 2.4 Tanaman Drynaria quercifolia (Sumber: Koleksi Pribadi)
Drynaria quercifolia (L.) J. Sm., umumnya dikenal sebagai tanaman paku
daun kepala tupai (Ahmed et al., 2015). Drynaria quercifolia (L.) J. Sm. dikenal
juga sebagai Gurar. Tanaman ini ditemukan di pohon atau di batu dan menyukai
tempat yang lembab (Hartini, 2006; Prasanna, Chitra, & Suvitha, 2014).
Drynaria quercifolia memiliki akar rhizoma setebal 2-3 cm atau lebih,
menjalar pendek, panjang ruas sampai 10 cm, sisik coklat kehitaman. Permukaan
daun berwarna hijau kusam. Jenis tumbuhan ini tidak memiliki batang, daun
memenuhi seluruh tulang daun utama. Daunnya terdiri dari dua tipe yaitu daun
steril dan daun fertil. Daun sterilnya berukuran pendek dan berubah menjadi
coklat ketika tua. Daun fertil berukuran panjang, bertangkai 15-35 cm, helaian
daun menjari, panjang 40-150 cm, tanpa atau dengan sorus. Sorus tersusun dalam
2 barisan yang teratur atau kadang tidak teratur, dekat dengan tulang daun,
UIN Syarif Hidayatullah Jakarta permukaan daun, dengan bentuk bulat. Pada saat masih muda, sorus memiliki
warna hijau sedangkan jika sudah matang berwarna coklat. Tanaman ini sering
digunakan sebagai tanaman hias (Arini & Kinho, 2012).
2.6.1. Klasifikasi (Ahmed et al., 2015)
Family : Polypodiaceae
Genus : Drynaria (Bory) J. Sm.
Species : Drynaria quercifolia (L.) J. Sm.
2.6.2. Penggunaan Tradisional Tanaman Drynaria quercifolia L
Secara tradisional, tanaman ini dapat digunakan untuk mengobati penyakit
tuberkulosis, demam, dispepsia dan batuk (Beknal et al., 2010). Daun tanaman ini
digunakan untuk pengobatan demam tifoid (Kamboj & Kalia, 2014). Di Malaysia
digunakan untuk pengobatan demam, dispepsia dan batuk. Di India daunnya
digunakan dalam pengobatan rematik, penyakit kulit, ekspektoran dan obat cacing
(Mazumder PB et al., 2011). Rhizomanya dapat digunakan untuk mengobati
tuberkulosis, kehilangan nafsu makan, batuk, kebotakan dan demam berdarah
(Khan et al., 2007). Di Asia Tenggara, rebusan rhizoma D. quercifolia digunakan
sebagai antipiretik dan juga digunakan secara topikal dalam pengobatan Cina
untuk menstimulasi pertumbuhan rambut dan mengobati kepala botak (Ahmed et
al., 2015).
2.6.3. Kandungan Kimia dan Aktivitas Biologi
Skrining fitokimia dari daun D. quercifolia menunjukkan adanya alkaloid,
UIN Syarif Hidayatullah Jakarta ekstrak methanol dari rhizoma. Asam 3,4 dihidroksibenzoat dan acetyl lupeol
telah diisolasi dari rhizoma D. quercifolia (Ahmed et al., 2015).
Pada penelitian lainnya telah dilakukan uji aktivitas antibakteri pada
rhizoma D. quercifolia. Potensi antibakteri ekstrak etil asetat dari rhizoma D.
quercifolia telah dilakukan terhadap bakteri Bacillus subtilis, Staphylococcus
aureus, Escherichia coli, Salmonella typhi dan Pseudomonas aeruginosa (Khan et
al., 2012).
Asam 3,4 dihidroksibenzoat telah diisolasi dari rhizoma D. quercifolia
dengan aktivitas antibakteri yang signifikan terhadap 4 bakteri Gram positif yaitu
Bacillus subtilis, Bacillus megaterium, Staphylococcus aureus, Streptococcus β -haemolyticus dan 6 bakteri Gram negatif yaitu Escherichia coli, Shigella
dysenteriae, Shigella sonnei, Shigella flexneri, Pseudomonus aeruginosa,
21
UIN Syarif Hidayatullah Jakarta BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Farmakognosi dan Fitokimia,
Universitas Islam Negeri Syarif Hidayatullah Jakarta. Waktu penelitian dimulai
pada bulan Februari hingga bulan Juli 2016.
3.2 Alat dan Bahan 3.2.1 Alat
Laminar Air Flow (Minihelic), inkubator (France Etuves), autoklaf (ALP
Ogawa Seiki), timbangan analitik (AND GH-202), mikroskop cahaya (Shimadzu),
cover glass, kaca objek, bunsen dan pemantik api, cawan petri, jarum ose, mikro
pipet (Microscientific), paper disc 6mm (Oxoid), labu Erlenmeyer (Schott Duran),
beaker glass (Pyrex), tabung reaksi, gelas ukur (Pyrex), spatula, hot plate
(Cimarec), magnetik stirer, kertas saring, kaca arloji, pinset, pipet tetes, pisau, tisu
steril, kapas, kasa, alumunium foil, plastic wrap, perkamen, botol kaca dan
sedotan steril.
3.2.2 Bahan
Bahan dan media yang digunakan adalah etanol 70%, natrium hipoklorit
(NaOCl) 5,25%, akuades steril, Potato Dextrose Agar (Merck), Nutrient Agar
(Merck), Dextrose (Merck), Yeast Extract (Merck), Mueller Hinton Agar (Merck),
kalsium karbonat (CaCO3), etanol 96%, safranin, lugol, metanol, etil asetat,
n-heksana, NaCl 0,9%, standar McFarland 3, methylene blue, kentangdancakram
kloramfenikol.
Sampel tanaman yang digunakan dalam penelitian ini adalah daun dari
tanaman paku daun kepala tupai [Drynaria quercifolia (L.) J. Sm.] yang diambil
pada hari Kamis, 11 Februari 2015 di Puri Bunga Seruni, Jalan Cemara Nomor 7,
Ciputat Tangerang Selatan. Tanaman ini telah dideterminasi di Lembaga Ilmu
UIN Syarif Hidayatullah Jakarta 3.2.3 Bakteri uji
Escherichia coli ATCC 25922, Salmonella typhi ATCC 25241,
Staphylococcus aureus ATCC 25923 dan Bacillus subtilis ATCC 19659 yang
diperoleh dari Laboratorium Mikrobiologi, IPB Bogor.
3.3 Prosedur Penelitian 3.3.1 Sterilisasi Alat
Alat-alat yang tidak tahan terhadap suhu tinggi, sterilisasi dilakukan dengan
menggunakan autoklaf pada suhu 121oC selama 15 menit. Alat-alat yang tahan
terhadap panas dapat disterilisasi dengan oven pada suhu 160oC selama 2 jam.
Alat-alat logam (jarum ose, pinset) disterilkan dengan cara dipijarkan atau
dilewatkan pada nyala Bunsen (Kumar, 2012).
3.3.2 Pembuatan Media
3.3.2.1 Pembuatan Media Potato Dextrose Agar (PDA)
Berdasarkan prosedur yang tertera pada kemasan, media PDA dibuat
dengan cara serbuk PDA sebanyak 39 gram dilarutkan dalam 1000 mL akuades.
Media tersebut dicampur hingga merata dengan menggunakan hot plate dan
magnetic stirrer. Campuran media kemudian disterilisasi dalam autoklaf pada
suhu 121oC selama 15 menit. Media kemudian dituang ke dalam cawan petri dan
dibiarkan hingga memadat (Merck).
3.3.2.2 Pembuatan Media Mueller Hinton Agar (MHA)
Berdasarkan prosedur yang tertera dalam kemasan, media MHA dibuat
dengan cara sebanyak 38 gram bubuk Mueller Hinton Agar (MHA) dilarutkan
dalam 1000 mL akuades. Media tersebut dicampur hingga merata dengan
menggunakan hot plate dan magnetic stirrer. Campuran media kemudian
disterilisasi dalam autoklaf pada suhu 121oC selama 15 menit. Media kemudian
UIN Syarif Hidayatullah Jakarta 3.3.2.3 Pembuatan Media Agar Miring Potato Dextrose Agar (PDA)
Berdasarkan prosedur yang tertera pada kemasan, media PDA dibuat
dengan cara PDA sebanyak 39 gram dilarutkan dalam 1000 mL akuades. Media
tersebut dicampur hingga merata dengan menggunakan hot plate dan magnetic
stirrer. Campuran media kemudian disterilisasi dalam autoklaf pada suhu 121oC
selama 15 menit. Media kemudian dituang ke dalam tabung yang telah diletakkan
dalam posisi miring ±45o dan dibiarkan hingga memadat (Jauhari, 2010).
3.3.2.4 Pembuatan Media Agar Miring Nutrient Agar (NA)
Berdasarkan prosedur yang tertera dalam kemasan, media NA dibuat
dengan cara NA sebanyak 20 gram dilarutkan dalam 1000 mL akuades. Media
tersebut dicampur hingga merata dengan menggunakan hot plate dan magnetic
stirrer. Campuran media kemudian disterilisasi dalam autoklaf pada suhu 121oC
selama 15 menit. Media kemudian dituang ke dalam tabung yang telah diletakkan
pada posisi miring ±45o dan dibiarkan hingga memadat (Jauhari, 2010).
3.3.2.5 Pembuatan Media Potato Dextrose Yeast (PDY)
Satuliter Potato Dextrose Broth dibuat dari 200 gram kentang yang telah
dikupas dan diiris halus, kemudian direbus dalam akuades hingga mendidih.
Ekstrak kentang disaring, kemudian ditambahkan Dextrose 20 gram (Ramesha et
al., 2013) dan Yeast Extract 2 gram lalu ditambahkan akuades hingga 1000 mL
(Ramadhan, 2011). Media tersebut dicampur sampai homogen dengan
menggunakan hot plate dan magnetic stirrer. Sambil diaduk, ditambahkan
kalsium karbonat (CaCO3) ke larutan media hingga mencapai pH 6. Media
kemudian disterilisasi dalam autoklaf pada suhu 121oC selama 15 menit
(Ramadhan, 2011).
3.3.3 Isolasi Kapang Endofit
Isolasi kapang endofit dari daun tanaman Drynaria quercifolia (L.) J. Sm.
diawali dengan proses sterilisasi permukaan. Sampel tanaman yaitu bagian daun
UIN Syarif Hidayatullah Jakarta Sampel daun lalu direndam ke dalam etanol 70% selama 1 menit, kemudian
direndam dalam larutan NaOCl 5,25% selama 5 menit, lalu direndam kembali ke
dalam etanol 70% selama 30 detik dan terakhir dibilas dengan akuades steril
selama 3-5 detik (Radji et al., 2011). Potongan daun yang telah disterilisasi
kemudian diletakkan di atas kertas saring (Goveas et al., 2011). Potongan daun
lalu dipotong menjadi bagian yang lebih kecil dengan ukuran ±1x1 cm2 dengan
pisau steril (Phongpaichit et al., 2006).
Potongan daun ditempatkan pada cawan petri yang berisi media PDA.
Penanaman sampel dilakukan triplo dan tiap cawan berisi dua potongan daun.
Media yang telah diinokulasi dengan potongan daun diinkubasi pada suhu ruang
selama 14 hari (Noverita et al., 2009). Akuades bilasan terakhir diambil dan
diisolasi ke PDA lainnya. Perlakuan ini berfungsi sebagai kontrol sterilisasi
permukaan daun (Bahgat et al., 2014). Semua proses sterilisasi hingga proses
isolasi dilakukan secara aseptis dalam Laminar Air Flow (Noverita et al., 2009).
3.3.4 Pemurnian Kapang Endofit
Kapang endofit yang telah tumbuh di media PDA kemudian dimurnikan ke
dalam media PDA baru dengan cara menginokulasi sedikit hifa dengan ose steril
dari setiap koloni endofit yag berbeda. Kultur kapang endofit diinkubasi selama
14 hari pada suhu ruang (Radji et al., 2011). Pemurnian dilakukan berdasarkan
perbedaan secara makroskopis yaitu warna dan bentuk koloni kapang (Ariyono et
al., 2014).
Pengamatan morfologi dilakukan selama 7-14 hari dan apabila masih
ditemukan pertumbuhan koloni yang berbeda secara makroskopis, maka
dilakukan pemurnian ulang hingga diperoleh isolat murni. Setiap isolat yang
didapat dibuat duplo sebagai working culture dan stock culture (Noverita et al.,
2009). Stock culture diinkubasi pada suhu ruang selama 7 hari, kemudian
UIN Syarif Hidayatullah Jakarta 3.3.5 Karakterisasi Isolat Kapang Endofit
Karakterisasi dari kapang endofit dilakukan dengan mengamati
morfologinya baik secara makroskopik maupun mikroskopik. Pengamatan
karakteristik makroskopik dilakukan dengan mengamati warna koloni, warna
sebalik, permukaan koloni (granular, seperti tepung, menggunung, licin, ada atau
tidak tetes-tetes eksudat), diameter pertumbuhan koloni kapang, dan
lingkaran-lingkaran konsentris (Kumala, 2014).
Pengamatan mikroskopik dilakukan menggunakan mikroskop. Pembuatan
preparat untuk pengamatan menggunakan mikroskop yaitu dengan cara pada kaca
objek yang telah disterilisasi dalam cawan, diteteskan media PDA steril dan
didiamkan hingga memadat. Diletakkan sedikit hifa dengan ose pada media. Kaca
objek lalu ditutup dengan cover glass. Cawan petri yang sebelumnya telah diberi
alas kertas tisu steril dibasahi dengan akuades steril. Preparat diinkubasi selama
5-7 hari pada suhu ruang lalu cover glass dilepaskan, ditetesi dengan 1 tetes etanol
70% dan 1 tetes methylen blue, kemudian ditutup dengan cover glass dan diamati
dengan mikroskop dari perbesaran terkecil hingga terbesar (Kumala, 2014;
Sundari, 2012). Pengamatan yang dilakukan meliputi ada atau tidaknya sekat pada
hifa, pertumbuhan hifa (bercabang atau tidak bercabang), ada tidaknya konidia,
dan bentuk konidia (Ariyono et al., 2014).
3.3.6 Peremajaan Bakteri Uji
Bakteri uji Escherichia coli, Salmonella typhi, Staphylococcus aureus dan
Bacillus subtilis diinokulasikan masing-masing sebanyak satu ose pada media
agar NA miring, kemudian diinkubasi selama 24 jam pada suhu 37oC (Jauhari,
2010).
3.3.7 Identifikasi Kemurnian Bakteri Uji
Identifikasi kemurnian bakteri uji dilakukan secara mikroskopik pada
bakteri uji yang berusia 24 jam. Pengamatan mikroskopik dilakukan dengan
metode Pewarnaan Gram. Langkah metode pewarnaan Gram adalah kaca objek
UIN Syarif Hidayatullah Jakarta dan dibiarkan dingin sebelum digunakan. Preparat sampel disiapkan dalam bentuk
suspensi di atas kaca objek lalu difiksasi dengan melewatkan kaca objek pada api
bunsen.
Preparat kemudian diwarnai dengan larutan kristal violet 0,5% dan
dibiarkan selama 1 menit, lalu dicuci dengan air mengalir selama 5 detik,
diteteskan larutan lugol dan dibiarkan selama 1 menit, lalu dicuci kembali dengan
air mengalir. Preparat kemudian dibilas dengan etanol 96% selama 30 detik
sampai tidak ada lagi zat warna lugol, lalu dicuci dengan air mengalir. Preparat
selanjutnya diteteskan larutan safranin selama 45 menit. Dicuci kembali dengan
air mengalir. Preparat dikeringkan dengan cara diletakkan di atas tisu steril dan
diamati dengan mikroskop cahaya dari perbesaran terkecil hingga terbesar
(Kumala et al., 2006).
3.3.8 Pembuatan Inokulum Bakteri Uji
Suspensi bakteri dibuat dengan cara, satu ose masing-masing bakteri uji
pada media agar NA miring yang telah diinkubasi selama 24 jam diinokulasikan
ke dalam larutan 9 mL NaCl 0,9%. Kekeruhannya diseragamkan dengan
menggunakan standar McFarland 3 (109 CFU/mL) (Noverita et al., 2009).
Suspensi bakteri 109 CFU/mL kemudian diencerkan sehingga diperoleh suspensi
bakteri 106 CFU/mL. Pengenceran dilakukan dengan cara dari suspensi bakteri
109 dipipet 1 mL dan dimasukkan ke dalam tabung yang berisi 9 mL NaCl 0,9%
sehingga diperoleh suspensi bakteri 108 CFU/mL. Suspensi bakteri 108 dipipet
1mL ke dalam tabung reaksi yang berisi 9 mL NaCl 0,9%, sehingga diperoleh
suspensi bakteri 107 CFU/mL. Dari suspensi bakteri 107 diambil 1 mL ke dalam
tabung reaksi yang berisi 9 mL NaCl 0,9% sehingga diperoleh suspensi bakteri
106 CFU/mL (Andidha, 2015).
3.3.9 Seleksi Kapang Endofit yang Berpotensi sebagai Antibakteri
Seleksi kapang endofit penghasil antibakteri dilakukan dengan
menginokulasikan satu potongan agar isolat kapang murni yang berumur 7-14 hari
UIN Syarif Hidayatullah Jakarta mengandung 106 CFU/mL bakteri uji. Kultur diinkubasi pada suhu 37oC selama
24 jam. Aktivitas antibakteri kapang endofit dilihat dari zona hambat yang
terbentuk disekitar potongan isolat kapang (Elfina et al., 2014). Isolat yang
menunjukkan zona hambat dipilih untuk dilakukan fermentasi.
3.3.10 Fermentasi Kapang Endofit
Fermentasi dilakukan dengan fermentasi cair menggunakan media Potato
Dextrose Yeast (PDY) (Kumala & Pratiwi, 2014). Koloni kapang murni penghasil
zona hambat yang berumur 7-14 hari (Radji et al., 2011) diambil sebanyak 3
potongan biakan kapang menggunakan sedotan steril lalu diinokulasikan ke dalam
media fermentasi cair PDY. Volume media yang diisikan ke dalam botol
fermentasi adalah 300 mL (Radji et al., 2011). Setiap isolat dilakukan fermentasi
secara triplo. Selanjutnya diinkubasi secara statis selama 21 hari pada suhu ruang
(Phongpaichit et al., 2006).
3.3.11 Ekstraksi Hasil Fermentasi
Hasil fermentasi yang diperoleh disaring menggunakan kertas saring untuk
memisahkan biomassa dan media. Bagian media dilakukan partisi dengan pelarut
n-heksan. Hasilnya akan diperoleh dua bagian yaitu fraksi n-heksana dan fraksi
air. Fraksi n-heksana yang diperoleh dipekatkan dengan rotary evaporator dan
didapatkan ekstrak kental n-heksana (EH). Fraksi air yang didapat dipartisi
kembali menggunakan pelarut etil asetat. Hasilnya akan diperoleh fraksi etil asetat
dan fraksi air (FA). Fraksi etil asetat dipekatkan menggunakan rotary evaporator
hingga didapatkan ekstrak kental etil asetat (EE).
Bagian biomassa yang didapat dari hasil fermentasi dihaluskan
menggunakan lumpang dan alu, kemudian diekstraksi dengan pelarut metanol.
Maserat yang diperoleh dipekatkan menggunakan rotary evaporator dan
UIN Syarif Hidayatullah Jakarta 3.3.12 Uji Aktivitas Antibakteri
Inokulum bakteri uji yang setara dengan 106 CFU/mL diambil 1 mL
kemudian diteteskan ke dalam cawan petri steril dan selanjutnya ditambahkan
media MHA cair sebanyak ±10 mL lalu digoyangkan sampai suspensi bakteri
merata di seluruh media, didiamkan sampai membeku dan media siap digunakan
(Rachmayani, 2008). Pengujian aktivitas antimikroba dari hasil ekstraksi kapang
endofit dilakukan dengan metode difusi cakram (disc diffusionmethods).
Masing-masing ekstrak kental (EH, EE dan EM) dibuat dalam konsentrasi 1000 ppm. Dari
masing-masing ekstrak kental dan fraksi air, dipipet 20 µL dan diserapkan pada
kertas cakram steril berdiameter 6 mm (Radji et al., 2011). Cakram yang telah
berisi masing-masing esktrak uji kemudian didiamkan selama 15 menit sebelum
diletakkan pada media uji. Masing-masing cakram diletakkan pada permukaan
media MHA padat yang sebelumnya telah diinokulasi bakteri uji (Escherichia
coli, Salmonella typhi, Staphylococcus aureus dan Bacillus subtilis). Dalam satu
cawan petri dapat diletakkan 6-7 buah cakram kertas. Jarak antara cakram harus
diatur agar posisinya tidak terlalu berdekatan (Noverita et al., 2009)
Sebagai kontrol positif digunakan cakram kloramfenikol dengan konsentrasi
30 µg/cakram dan sebagai kontrol negatif digunakan etil asetat, n-heksana,
metanol dan akuades yang diserapkan pada cakram dan dikeringkan.
Media biakan uji dinkubasi selama 24 jam pada suhu 37oC. Setelah
inkubasi, dilakukan pengukuran diameter zona hambat yaitu zona bening yang
terbentuk di sekitar cakram, dengan menggunakan jangka sorong (Radji et al.,
29
UIN Syarif Hidayatullah Jakarta BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan untuk mengetahui aktivitas antibakteri isolat
kapang endofit terhadap beberapa bakteri patogen. Sampel tanaman yang
digunakan adalah tanaman paku daun kepala tupai [Drynaria quercifolia (L.) J.
Sm.] yang diperoleh dari Puri Bunga Seruni, Ciputat, Tangerang Selatan.
Tanaman ini telah banyak digunakan secara tradisional untuk mengobati berbagai
penyakit. Menurut Strobel & Daisy (2003), salah satu kriteria tanaman yang dapat
dipilih untuk menghasilkan kapang endofit adalah tanaman yang memiliki sejarah
etnobotani seperti digunakan dalam pengobatan tradisional. Secara empiris,
tanaman paku daun kepala tupai digunakan untuk mengobati penyakit
tuberkulosis, demam, dispepsia dan batuk (Beknal et al., 2010). Daunnya
digunakan untuk pengobatan demam tifoid (Kamboj & Kalia, 2014).
Secara garis besar penelitian ini terbagi menjadi beberapa tahap, yaitu
tahap isolasi dan pemurnian kapang endofit dari sampel tanaman, tahap
karakterisasi isolat kapang endofit, tahap seleksi kapang endofit yang berpotensi
sebagai antibakteri, tahap fermentasi kapang endofit, tahap ekstraksi senyawa
metabolit sekunder kapang endofit, dan pengujian aktivitas antibakteri dari
ekstrak hasil fermentasi kapang endofit.
4.1. Determinasi Tanaman
Tanaman Drynaria quercifolia yang digunakan dalam penelitian ini telah
dilakukan determinasi di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Pusat
Konservasi Tumbuhan Kebun Raya Bogor. Hasil determinasi menunjukkan
bahwa sampel tanaman yang digunakan adalah Drynaria quercifolia (L.) J. Sm.,
suku Polypodiaceae, paku daun kepala tupai. Hasil determinasi tanaman paku