INTRODUKSI GEN PaCS PENYANDI Sitrat Sintase
KE DALAM RUMPUT LAUT Kappaphycus alvarezii
MENGGUNAKAN Agrobacterium tumefaciens
RISTANTI FRINRA DAUD
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Introduksi gen PaCS penyandi sitrat sintase ke dalam rumput laut Kappaphycus alvarezii menggunakan Agrobacterium tumefaciens”adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RISTANTI FRINRA DAUD. Introduksi Gen PaCS Penyandi Sitrat Sintase ke dalam Rumput Laut Kappaphycus alvarezii Menggunakan Agrobacterium tumefaciens. Dibimbing oleh UTUT WIDYASTUTI dan SUHARSONO.
Penyakit ice-ice dapat menyebabkan menurunnya kualitas rumput laut. Penyakit ini kemungkinan besar lebih banyak disebabkan oleh cekaman lingkungan dari pada serangan patogen. Hal ini didukung dengan ditemukan fakta bahwa ice-ice lebih menonjol pada lingkungan yang kualitas airnya rendah, pergantian air sedikit, salinitas rendah dan perubahan suhu air serta kandungan logam berat yang tinggi di perairan. Sitrat diketahui sebagai asam organik yang paling kuat dalam mengikat logam berat seperti aluminium. Asam sitrat mempunyai peranan yang sangat penting di dalam siklus Kreb atau siklus asam sitrat. Enzim yang terlibat dalam sintesis asam sitrat adalah sitrat sintase.
Gen sitrat sintase asal Pseudomonas aeuginosa (PaCS) telah berhasil diintroduksikan ke dalam genom tanaman tembakau (Nicotiana tabacum) dan Jatropha curcas melalui perantaraan Agrobacterium tumefaciens. Tanaman tembakau transgenik yang mengandung gen PaCS lebih toleran terhadap cekaman Al dibandingkan dengan tanaman nontransgenik. Penelitian ini bertujuan untuk mengintroduksikan gen sitrat sintase ke dalam genom tanaman rumput laut Kappaphycus alvarezii melalui perantara Agrobacterium tumefaciens.
Potongan talus berukuran 0,5 cm digunakan sebagai eksplan. Eksplan direndam di dalam Agrobacterium tumefaciens selama 15 menit dan dikokultivasi selama 3 hari di media padat PES dengan agar 0,3% di dalam ruang gelap. Setelah ditanam pada media pemulihan, talus diseleksi di media selektif padat PES yang mengandung 10 mg/l higromisin.
Berdasarkan eksplan yang tahan pada media seleksi, efisiensi transformasi pada K. alvarezii adalah sebesar 7,5 %. Efisiensi regenerasi tunas transgenik putatif adalah sebesar 100%, sama dengan efisiensi regenerasi tunas non transgenik. Analisis molekular menggunakan teknik PCR menunjukkan bahwa satu dari lima K. alvarezii transgenik putatif mengandung transgen PaCS di bawah kendali promoter 35S CaMV.
SUMMARY
RISTANTI FRINRA DAUD. Introduction of PaCS gene encoding Citrat Synthase to Kappaphycus alvarezii using Agrobacterium tumefaciens. Supervised by Utut Widyastuti and Suharsono.
Ice-ice is a disease that reduces the quality of seaweed. This disease is mainly caused by environmental stress rather than pathogen. This is supported by the fact that ice-ice disease is prevalent in the environment where the water have low quality, poor circulation, low salinity and changement of temperature, and high content of heavy metals. Citric acid is known to be a strong chelating agent for aluminum. Citric acid has a very important role in the Kreb cycle. The enzyme involved in the synthesis of citric acid is citrate synthase.
Citrate synthase genes from Pseudomonas aeruginosa (PaCS) has been successfully introduced into genome of tobacco (Nicotiana tabacum) and Jatropha curcas using Agrobacterium tumefaciens. Tobacco transgenic plants containing PaCS gene are more tolerant to Al stress compared to non-transgenic plants. This research aims to introduce the citrate synthase gene into genome of seaweed Kappaphycus alvarezii by using Agrobacterium tumefaciens.
Cutting Thallus of 0,5 cm were used as explants. Explants were inoculated by Agrobacterium tumefaciens for 15 minutes and then co-cultivated in PES media containing 0,3% agar for 3 days in the dark. The selection of putative transgenic K. alvarezii was carried out in PES agar selective medium containing 10 mg/l hygromicin.
Based on hygromicin resistant explant on hygromicin selective medium, the transformation efficiency in K. alvarezii was 7.5 %. The efficiency of shoot regeneration of putative transgenic was 100%, and same as the regeneration efficiency of non transgenic ones. Molecular analysis by PCR showed that one of five putative transgenic K. alvarezii was confirmed as transgenic thallus containing PaCS transgene under the control of 35S CaMV promoter.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
INTRODUKSI GEN PaCS PENYANDI Sitrat Sintase
Ke DALAM RUMPUT LAUT Kappaphycus alvarezii
MENGGUNAKAN Agrobacterium tumefaciens
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Introduksi Gen PaCS Penyandi Sitrat Sintase ke dalam Rumput Laut Kappaphycus alvarezii Menggunakan Agrobacterium tumefaciens
Nama : Ristanti Frinra Daud NIM : P051100141
Disetujui oleh Komisi Pembimbing
Dr Ir Utut Widyastuti, MS Ketua
Prof Dr Ir Suharsono, DEA Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan Kehadirat Tuhan Yang Maha Kuasa atas berkat dan limpahan rahmat-Nya sehingga penulis dapat menyelesaikan tesis ini.
Penulis menyadari sepenuhnya bahwa tesis ini dapat terselesaikan karena adanya bantuan dari berbagai pihak.Penelitian ini didanai atas kerjasama Balai Riset Keluatan dan Perikanan Air Payau (BRKP) Maros dan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi dan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor an. Dr. Ir. Utut Widyastuti. Oleh karena itu, dengan segala kerendahan hati penulis menghaturkan rasa hormat dan terima kasih yang tulus kepada :
1. Ibu Dr. Ir. Utut Widyastuti,M.Si. selaku pembimbing utama dan Prof. Dr. Ir. Suharsono, DEA selaku anggota pembimbing yang telah memberikan petunjuk, bimbingan dan bantuan kepada penulis. 2. Kedua Orang tua tercinta, ayahanda Daud Somba, SKM dan ibunda
Netty Rasinan, saudara-saudaraku yang saya kasihi, kakak Maiercherinra Daud dan adik-adikku Hatri Ninra Daud, Riknal Christan Daud dan Amrival Hernan Daud, serta Miftah Sudirman atas doa tulus, kasih sayang dan pengorbanan moril dan materi yang telah diberikan kepada penulis.
3. Rekan-rekan mahasiswa dan teknisi laboratorium di Pusat Penenlitian Sumberdaya Hayati dan Bioteknologi yang telah memberikan bantuan dan dukungan selama penulis melakukan penelitian.
4. Ibu dan Bapak Pimpinan BRAP Maros atas bantuan dan fasilitasnya selama penulis melakukan magang.
5. Sahabat-sahabat BTK “10” yang tidak disebut satu persatu, Trimakasih atas dukungannya
Penulis menyadari bahwa tesis ini masa sangat jauh dari kesempurnaan, Oleh karena itu kritik dan saran yang sifatnya membangun sangat penulis harapkan untuk kesempurnaan penulisan selanjutnya. Akhirnya semoga tesis ini bermanfaat bagi pembaca terutama bagi penulis sendiri.AMIN.
Bogor, Oktober 2013
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
Rumput Laut (Kappaphycus alvarezii) 3
Sitrat Sintase 5
Transformasi Genetik Rumput Laut 6
3 BAHAN DAN METODE 8
Waktu dan Tempat 8
Bahan Penelitian 8
Persiapan eksplan 8
Kultur A. tumefaciens 8 Transformasi Genetik Kappaphycus alvarezii 9 Analisis Integrasi Gen PaCS di dalam K. alvarezii 9
4 HASIL DAN PEMBAHASAN 10
Transformasi Genetik Kappaphycus alvarezii dengan Gen PaCS 10 Analisis Integrasi Gen PaCS di dalam K. alvarezii 12
5 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Hasil transformasi dan regenerasi rumput laut Kappaphycus
DAFTAR GAMBAR
1 2 3 4 5 6 7
Siklus hidup Kappaphycus alvarezii
Rumput laut yang terserang ice-ice (Tissera & Naguit 2009)
Konstruksi gen PaCS di dalam vektor ekspresi pMSH (Tistama 2012).
Tahapan transformasi genetik rumput laut K. alvarezii
Perkembangan eksplan nontransgenik dan putatif transgenik di media higromisin
Hasil elektroforesis DNA genom rumput laut K. alvarezii
Hasil analisis integrasi gen PaCS di dalam K. alvarezii dengan PCR
DAFTAR LAMPIRAN
1. 2.
Komposisi Antibiotik Mix
Komposisi media dasar Provasoly enrichment seawater (PES) dalam 1 liter air laut
1
1 PENDAHULUAN
Latar Belakang
Kappaphycus alvarezii (Doty) merupakan salah satu rumput laut merah yang bernilai ekonomis penting yang dinding selnya mengandung polisakarida tinggi, dan menjadi sumber penting karagenan di dunia (Bixler 1996). Indonesia merupakan salah satu produsen rumput laut dengan rata-rata volume produksi 2.143.126 ton/tahun sejak tahun 2005 hingga 2010. Kebutuhan rumput laut dunia terus meningkat sekitar 27,63%, namun dalam menghadapi pangsa pasar tersebut Indonesia belum mampu memanfaatkannya secara optimal (FAO 2010).
Rendahnya produksi dan kualitas rumput laut salah satunya disebabkan oleh penyakit ice-ice. Penyakit tersebut kemungkinan besar lebih banyak disebabkan oleh cekaman lingkungan dari pada serangan patogen. Hal ini didukung dengan ditemukan fakta bahwa ice-ice lebih menonjol pada lingkungan yang kualitas airnya rendah, pergantian air sedikit, salinitas rendah, perubahan suhu air serta kandungan logam berat yang tinggi di perairan (Mtolera et al. 1995). Logam berat yang banyak ditemukan di perairan adalah Pb, Mn, Cu, Cd dan Al (Jickells 1955; De Baar & La roche 2003).
Cekaman logam berat berupa Aluminium (Al) menyebabkan perubahan struktur sel yang meliputi reduksi jumlah butir pati dalam nukleoplas, inti sel tersegmentasi, dan adanya kondensasi kromosom pada inti (Nagy et al. 2004), serta kerusakan pada membran plasma. Cekaman Al mengakibatkan membran plasma kehilangan integritasnya (Yamamoto et al. 2001), yang selanjutnya memicu gangguan penyerapan hara dan air sehingga menyebabkan defisiensi unsur hara. Cekaman logam berat berupa timbal (Pb) dan tembaga (Cu) pada Halophila ovalis menyebabkan aktivitas metabolisme terhambat sehingga berdampak pada ukuran daun mengecil (Ambo-Rappe et al. 2011). Oleh karena itu perlu dilakukan suatu upaya untuk meningkatkan ketahanan rumput laut terhadap cekaman logam berat, salah satunya adalah dengan meningkatkan produksi asam sitrat rumput laut K. alvarezii.
Sitrat diketahui sebagai asam organik yang paling kuat dalam mengikat logam berat seperti aluminium. Asam sitrat dihasilkan dari siklus Kreb atau siklus asam sitrat. Siklus ini diawali dengan perubahan pirufat menjadi asetil KoA dengan melepaskan CO2. Asetil KoA akan bereaksi dengan oksaloasetat yang
2
sebagai promoter konstitutif adalah 35S CaMV, 35S CaMV omega, Ubiquitin (UBQ1) dan tionin (BTH6). Promoter 35S CaMV merupakan promoter paling kuat ekspresinya di antara keempat promoter konstitutif tersebut (Holtorf et al. 1995), sedangkan promoter induktif adalah promoter yang hanya mengekspresikan gen jika diinduksi oleh kondisi tertentu, misalnya promoter heat shock (Holtorf et al. 1995).
Untuk meningkatkan dan mempertahankan produksi rumput laut nasional perlu dilakukan upaya-upaya dalam mengatasi permasalahan dalam budidaya, rendahnya mutu genetik rumput laut, permasalahan penyakit dan lingkungan (Largo et al. 1997; Vairappan 2006) melalui beberapa pendekatan teknologi, antara lain rekayasa genetik melalui transformasi genetik. Beberapa peneliti telah menggunakan A. tumefaciens sebagai perantara transformasi, seperti yang dilakukan oleh Cheng et al. (2011) pada mikroalaga Schizochytrium. Pengembangan teknologi kultur jaringan merupakan salah satu teknologi yang mendukung rekayasa genetik pada tanaman. Teknik kultur jaringan rumput laut Kappaphycus alvarezii telah dikembangkan oleh Suryati & Mulyaningrum (2009).
Tujuan Penelitian
3
2 TINJAUAN PUSTAKA
Rumput Laut (Kappaphycus alvarezii)
Kappaphycus alvarezii merupakan rumput laut merah yang memiliki nilai ekonomis penting, yang sangat dibutuhkan karena dinding sel nya mengandung polisakarida dan merupakan sumber penting kappa karagenan. Jumlah kebutuhan dunia akan rumput laut ini sangat besar dan telah banyak dibudidayakan di Indonesia serta menjadi sasaran produksi rumput laut prioritas dalam program revitalisasi perikanan domestikasi dari 2009.
Rumput laut K. alvarezii bila diklasifikasikan berdasarkan pigmentasi termasuk jenis alga merah (Rhodophyceae). Ganggang merah yang hidup di laut dan tergolong dalam thallophyta ini tidak memperlihatkan perbedaan akar, batang dan daun seperti tanaman tingkat tinggi. Keseluruhan tanaman merupakan batang yang dikenal sebagai talus. Berdasarkan pada bentuk dan anatomi serta karakter biokimia, dimana derivat kappa carageenan yang lebih dominan dari pada iota dan beta carageenan yang ditemukan oleh seorang ahli dari Filipina bernama Alvarez, maka nama ilmiah dari E. cottonii berubah menjadi K. alvarezii (Atmadja et al. 1996 & Silva et al. 1996).
Ciri ciri rumput laut K. alvarezii adalah talus silindris, permukaan licin, menyerupai tulang rawan/muda (cartilageneus), serta berwarna hijau terang, hijau kuning, dan coklat kemerahan. Percabangan keberbagai arah dengan batang batang utama keluar saling berdekatan didaerah pangkal (basal). Percabangan talus berujung runcing atau tumpul, ditumbuhi tonjolan-tonjolan (nodulus) dan duri lunak/tumpul untuk melindungi gametangia. Percabangan bersifat berseling, (alternatus), tidak teratur, serta dapat bersifat percabangan dua-dua (dichotomus) atau percabangan tiga-tiga (trichotomus). Tumbuh melekat pada substrat, cabang cabang pertama dan kedua tumbuh rimbun dan mengarah ke datangnya sinar matahari (Parenrengi et al. 2010).
Perkembangbiakan rumput laut baik dari kelompok Glacilaria maupun Kappaphycus/Euchema dikenal dalam dua bentuk reproduksi yakni dengan seksual (generatif) dan aseksual (vegetatif). Secara generatif, rumput laut diploid (2n) menghasilkan spora yang haploid (n). Spora ini kemudian menjadi dua jenis yaitu jantan dan betina yang masing-masing bersifat haploid (n) selanjutnya rumput laut jantan akan menghasilkan sperma dan rumput laut betina menghasilkan telur. Apabila kondisi lingkungan memenuhi syarat akan menghasilkan suatu perkawinan dengan terbentuknya zigot yang akan tumbuh menjadi tanaman baru (Gambar 1). Reproduksi rumput laut secara vegetatif adalah proses perbanyakan tanpa melalui perkawinan. Setiap bagian rumput laut yang dipotong akan tumbuh menjadi rumput laut muda yang mempunyai sifat seperti induknya. Perkembangbiakan secara vegetatif lebih umum dilakukan dengan cara stek dari cabang-cabang talus yang muda, masih segar, warna cerah, dan memiliki percabangan yang rimbun, serta terbebas dari penyakit (Parenrengi et al. 2010).
4
lain: (1) terlindung dari gelombang besar dan badai, sebab rumput laut mudah patah apabila terus menerus dihantam gelombang; (2) terlindung dari ancaman predator, seperti ikan buntal, ikan beronang, bintang laut, bulu babi, penyu dan ikan besar lainnya serta burung laut; (3) terlindung dari ancaman pencemaran seperti dekat muara sungai, buangan limbah industri, aktivitas pertanian dan limbah rumah tangga; dan (4) terlindung dari hilir mudik lalu lintas kapal karena selain akan menimbulkan riak-riak gelombang juga buangan kapal (minyak, solar, dan lain-lain) akan mencemari area pemeliharaan. Selain faktor tersebut, ketersediaan bibit alami rumput laut, dasar perairan yang berupa pecahan-pecahan karang dan pasir kasar, kedalaman sekitar 2 –15 m, kadar garam 28 –34 ppt dengan nilai optimum 33 ppt, kecerahan lebih dari 1.5 m sangat mempengaruhi pertumbuhan rumput laut (Akma et al.2008).
Gambar 1 Siklus hidup Kappaphycus alvarezii
Salah satu kendala dalam budidaya adalah serangan hama dan penyakit yang dapat menyebabkan kerusakan cukup tinggi. Hama pada tanaman rumput laut umumnya merupakan organisme laut yang memangsa tanaman yang menimbulkan kerusakan fisik. Sedangkan penyakit yang paling serius pada budidaya rumput laut adalah penyakit ice-ice yang diakibatkan oleh kondisi lingkungan yang ekstrim. Penyakit ini menyebabkan kerusakan jaringan pada daerah yang terinfeksi pada budidaya rumput laut. Hal ini ditandai dengan pertumbuhan yang lambat dan jaringan menghijau, kemudian kerusakan bagian permukaan jaringan diikuti dengan melunaknya bagian percabangan. Kemudian berkembang bintik putih pada jaringan rumput laut yang mati. Hal ini mengakibatkan terjadinya fragmentasi dan berkurangnnya biomassa dari hasil budidaya (Trono 1974; Uyenco et al. 1981 ; Ganzon-Fortes et al. 1993). Ice-ice lebih menonjol pada lingkungan yang kualitas airnya rendah, pergantian air
Gametofit jantan
Gametofit Betina
Tetraspora
5
sedikit, salinitas rendah dan perubahan suhu air serta kandungan logam berat yang tinggi di perairan (Mtolera et al. 1995). Logam berat yang banyak ditemukan di perairan adalah Pb, Mn, Cu, Cd dan Al (Jickells 1955; De Baar & La roche 2003).
Gambar 2 Rumput laut yang terserang penyakit ice-ice (Tisera & Naguit 2009)
Tanaman yang terkena cekaman logam akan memperlihatkan gejala yang berbeda. Cekaman logam berat berupa aluminium (Al) menyebabkan perubahan struktur sel yang meliputi reduksi jumlah butir pati dalam nukleoplas, inti sel tersegmentasi, dan adanya kondensasi kromosom pada inti (Nagy et al. 2004), serta kerusakan pada membran plasma. Cekaman Al mengakibatkan membran plasma kehilangan integritasnya (Yamamoto et al. 2001), yang selanjutnya memicu gangguan penyerapan hara dan air sehingga menyebabkan defisiensi unsur hara. Cekaman logam berat berupa timbal (Pb) dan tembaga (Cu) pada seagrass Halophila ovalis menyebabkan aktivitas metabolisme terhambat sehingga berdampak pada ukuran daun mengecil (Ambo-Rappe et al. 2011).
Penguasaan teknologi sangat mendukung keberhasilan dalam budidaya rumput laut. Upaya penyediaan bibit rumput laut dapat dilakukan dengan penerapan bioteknologi dalam menciptakan bibit unggul dengan pendekatan penyediaan benih melalui kultur in vitro. Propagasi benih merupakan salah satu alternatif yang dapat dilakukan untuk meningkatkan performansi benih rumput laut melalui kultur jaringan rumput laut (Parenrengi et al. 2010). Kultur jaringan rumput laut telah dikembangkan oleh Balai Riset Perikanan Budidaya Air Payau (BRPBAP) Maros. Suryati et al (2006) telah berhasil melakukan regenerasi dari potongan talus menjadi tunas yang mencapai 89.3%.
Sitrat Sintase
Asam sitrat dihasilkan dari siklus asam trikarboksilat (TCA) yang dikenal dengan Siklus Kreb atau siklus asam sitrat. Siklus ini merupakan pusat jalur metabolik untuk semua proses aerobik dalam kehidupan organisme. Siklus TCA diawali dengan pengubahan pirufat menjadi asetil KoA dengan melepaskan CO2.
6
adalah sitrat sintase (Taiz & Zeiger 2002). Pada organisme eukariotik, enzim sitrat sintase ditemukan terutama di dalam mitokondria dan peroksisom pada perkecambahan. Berat molekul sitrat sintase mitokondria lebih besar dibandingkan sitrat sintase glioksisom dan masing-masing terdiri dari dua subunit (Beeckmans 1984).
Asam sitrat banyak digunakan oleh berbagai industri sebagai pengkelat, pengatur pH, pencucian detergen, dan pembersih kimia (Crolla & Kennedy, 2001). Asam sitrat juga digunakan untuk mengekstrak logam seperti magnesium (Mn), zeng (Zn), dan aluminium (Al) (Castro et al. 2000). Mekanisme toleransi tanaman terhadap logam berat pada membran plasma adalah dengan mengurangi penyerapan logam berat atau dengan stimulasi pompa ion terhadap logam berat yang masuk ke dalam sitosol. Selain itu pada protoplas juga terdapat mekanisme toleransi terhadap logam berat diantaranya dengan perbaikan protein yang rusak dibantu heat shock protein atau metallothionein dan pengkelatan logam berat oleh asam organik kemudian dibawa ke vakuola (Hall 2002).
Beberapa penelitian telah menunjukkan bahwa asam sitrat yang disekresikan oleh Pseudomonas dimanfaatkan sebagai pelarut fosfat seperti pada Pseudomonas aeruginosa (Buch et al. 2008). Gen sitrat sintase asal Pseudomonas aeruginosa (PaCS) yang berukuran 1287 pb dan menyandikan 428 asam amino telah berhasil diisolasi dan diintroduksikan ke dalam tanaman tembakau (Nicotiana tabacum) dan Jatropha curcas melalui perantaraan Agrobacterium tumefaciens. Hasil uji tantang tembakau transgenik dengan cekaman Al menunjukkan bahwa tanaman transgenik yang mengandung gen PaCS lebih toleran dibandingkan dengan tanaman nontransgenik (Tistama 2012). Hasil penelitian yang dilakukan oleh Wijarnako (2004), menunjukkan bahwa pada konsentrasi Al yang meracuni tanaman kedelai, pemberian asam sitrat dan P ternyata mampu meningkatkan pertumbuhan tanaman kedelai serta meningkatkan penyerapan P,N,K dan Ca.
Transformasi Genetik Rumput Laut
Transformasi genetik tanaman adalah pengubahan genetik sel tanaman melalui transfer DNA eksogen yang berasal dari spesies yang berbeda atau dari gen sintetik, yang diikuti dengan penyisipan dan ekspresi DNA tersebut ke dalam genom tanaman target (Skrritt 2000). Tanaman transgenik adalah tanaman dengan peningkatan karakteristik, misalnya, resistensi atau toleransi terhadap cekaman biotik maupun abiotik seperti serangga, patogen, kekeringan, salinitas dan suhu (Christou & Capell 2007).
Transfer gen pada tanaman dapat dilakukan dengan beberapa cara yaitu untuk transfer gen secara langsung dilakukan melalui mikroinjeksi, elektroporasi dan partikel bombardment. Teknik transfer gen tersebut memanfaatkan protoplas sebagai sel-sel penerima. Transfer gen juga dapat dilakukan melalui perantara vektor A. tumefaciens. Tanaman transgenik pertama melalui penggunaan Agrobacterium sebagai media transformasi yang berhasil mengekspresikan gen asing adalah tanaman tembakau (Gasser & Fraley 1989).
7
menyebabkan penyakit tumor mahkota (crown gall) bila menginfeksi tanaman. Penggunaan bakteri ini sebagai salah satu sistem transfer gen pertama kali diakui ketika ditemukan fakta bahwa crown gall terjadi sebagai hasil transfer dan integrasi gen dari bakteri ini ke dalam genom sel tanaman (Gasser & Fraley 1989).
A. tumefaciens memiliki plasmid Ti (tumor inducing) yang bertanggung jawab untuk mentransfer DNA ke dalam tanaman. Plasmid Ti memiliki beberapa bagian yang mempunyai fungsi yang berbeda yaitu daerah T-DNA, daerah vir (virulence), daerah replikasi plasmid (Origin of replication – ORI), dan daerah katabolisme opin. Daerah vir berukuran 30 – 40 kb dan berada pada Plasmid Ti. Daerah ini memiliki 6 operon esensial (virA, virB, virC, virD, virE, virG ) dan 2 operon non esensial (virF, virH). Jumlah gen pada setiap operon berbeda beda, virA, virG dan virF hanya memiliki satu gen; virE, virC, virH memiliki dua gen sedangkan virD dan virB memiliki empat dan delapan gen (de la Rival et al 1998).
Proses transfer gen dari A. tumefaciens ke dalam sel tanaman terjadi melalui beberapa tahapan yaitu (1) kolonisasi bakteri, (2) induksi sistem infeksi bakteri, (3) transfer T-DNA, dan (4) integrasi T-DNA ke dalam tanaman. Proses infeksi dimulai dari pelukaan yang menyebabkan tanaman mengeluarkan senyawa fenolik yang akan mengaktifasi gen-gen vir dimulai dengan penerimaan sinyal oleh virA. VirA merupakan protein sensor trans-membran yang diaktifasi oleh pH asam dan senyawa fenolik seperti asetosiringon. Selanjutnya virA mengaktifasi protein virG melalui proses fosforilasi. VirG berfungsi sebagai faktor transkripsi yang akan mengaktifkan ekpresi gen-gen vir lainnya (de la Riva et al 1998). Protein virG akan menginduksi ekspresi gen virD1 yang akan memotong utas T-DNA sehingga menghasilkan utas tunggal. Protein virD2 akan terfosforilasi oleh protein virD1. Asosiasi virD2 melindungi T-DNA dari aktifitas endonuklease pada ujung 5 T-DNA dan juga berfungsi membedakan ujung 5 T-DNA (right border) sebagai ujung yang akan ditransfer terlebih dahulu ke sel tanaman. Sintesis utas T-DNA dimulai dari batas kanan T-DNA dan berlangsung dari arah 5’-3’, kompleks utas tunggal T-DNA-virD2 dibungkus oleh protein virE. Asosiasi protein ini mencegah serangan nuklease dan berfungsi untuk membentangkan utas kompleks T-DNA sehingga mudah melewati kanal membran dan mengarahkan daerah T-DNA menuju nukleus tanaman (de la Riva et al 1998).
8
3 BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan dari bulan September 2011 hingga maret 2013, di Laboratorium Biotechnology Research Indonesia-Netherland (BIORIN), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor.
Bahan Penelitian
Rumput laut merah jenis K. alvarezii yang digunakan sebagai tanaman yang akan diintroduksikan diperoleh dari laboratorium Balai Riset Perikanan Budidaya Air Payau (BRPBAP) Maros. Bakteri A. tumefaciens LBA4404 yang membawa plasmid pMSH-PaCS digunakan untuk menginokulasi rumput laut K. alvarezii. Peta fisik daerah T-DNA yang terdapat gen PaCS di bawah kendali promoter 35S CaMV disajikan pada gambar 3. Primer spesifik PaCS-F (5’ATGGCTG-ACAAAAAAGCGCAG3’),PaCS-R (5’TCAGCCGCGATCCT -TGAGGGC3’) dan 35S-F (5‘AAACCTCCTCGATTCC-ATT3‘) digunakan untuk mengetahui keberadaan gen PaCS di bawah kendali promoter 35S CaMV.
---1630 bp—
Gambar 3 Konstruksi gen PaCS di dalam vektor ekspresi pMSH (Tistama 2012).
Persiapan Eksplan
Talus K. alvarezii yang diperoleh dari laboratorium Balai Riset Perikanan Budidaya Air Payau (BRPBAP) digunakan sebagai eksplan. Talus yang sehat dari penyakit dan bersih dari lumut dipotong sepanjang 5 cm dan dibersihkan dengan air laut yang disaring dengan filter UV. Talus dibersihkan dengan sikat di bawah mikroskop, kemudian disterilisasi dengan betadin 1% (v/v) di dalam air laut steril selama 1 menit, kemudian disterilisasi menggunakan campuran antibiotik (lampiran 1) untuk menghilangkan mikroba permukaan. Untuk inisiasi dan penyesuaian pada kondisi laboratorium, talus yang telah dipotong dikultur pada air laut steril yang diperkaya dengan provasoly enrichment seawater (PES) dengan foto periode 12 jam. Komposisi media PES disajikan pada lampiran 2.
Kultur A. tumefaciens
A. tumefaciens yang membawa gen PaCS dikultur dalam 3 ml media LB (20 % Bacto tryptone,10% Bacto yeast, 20 % NaCl) yang mengandung antibiotik 50 µg/ml streptomisin, 50 µg/ml kanamisin, 50 µg/ml higromisin dan diinkubasi dengan pengocok (shaker) dengan kecepatan 250 rpm, suhu 280C selama 48 jam
9
di ruang gelap. Setelah 48 jam biakan di subkultur lagi di dalam 20 ml LB selama 16 jam dengan kondisi yang sama. Selanjutnya kultur A. tumefaciens dimasukan ke dalam tabung masing-masing 1,5 ml disentrifugasi dengan kecepatan 4000 rpm (Jouan centrifuge BR 4i) selama 5 menit, kemudian endapannya diresuspensi dengan 20 ml media kokultivasi cair (20 ml/l PES; 20 part per thousand (ppt) air laut steril ;100 µM asetosiringon; 0,05 g/100ml glukosa) hingga nilai optical density (OD600) 0,5.
Transformasi genetik Kappaphycus alvarezii
Prosedur transformasi pada rumput laut ini dilakukan dengan menggunakan talus rumput laut yang dipotong - potong dengan ukuran 0.5 cm dan diadaptasikan terlebih dahulu pada media padat PES 0.8 % selama 3-5 hari. Transformasi dimulai dengan mencuci potongan talus menggunakan air laut steril 30 ppt, kemudian dikeringkan pada tisu steril. Talus yang telah dicuci, kemudian diinokulasi dengan cara direndam dalam biakan A. tumefaciens LBA4404 yang membawa plasmid pMSH-PaCS dalam media inokulasi selama 15 menit. Talus selanjutnya dikeringkan pada tisu steril dan dipindahkan dalam media ko-kultivasi padat PES 0,3% dan diinkubasi dalam ruangan gelap selama 2-3 hari. Selanjutnya talus direndam di dalam air laut steril yang mengandung 200 mg/L cefotaxim selama 10 menit. Setelah itu talus dibersihkan dan ditanam dalam media pemulihan (recovery) yaitu PES 0.5%. Setelah 1-2 minggu, talus dipindahkan ke media seleksi padat PES yang mengandung 10 mg/l higromisin. Setelah itu talus tersebut kemudian di biakkan di media PES cair tanpa antibiotik diruang kultur jaringan hingga beregenerasi membentuk tunas.
Analisis integrasi gen PaCS di dalam K. alvarezii
Analisis integrasi gen PaCS di dalam genom K. alvarezii transgenik dilakukan dengan PCR. DNA genom diisolasi menggunakan teknik isolasi Joubert dan Fleurence (2005). Reaksi PCR dilakukan dengan mencampurkan 100 ng DNA genom, 0.5 mM kombinasi primer gen spesifik sitrat sintase PaCS-F dan PaCS-R, serta 0.5 mM kombinasi primer 35s-F dan PaCS-R, 5 µl PCR mix (Fermentas), ditambah dengan ddH2O hingga volume 10 µl. Kondisi PCR adalah
10
4 HASIL DAN PEMBAHASAN
Transformasi genetik Kappaphycus alvarezii dengan gen Sitrat sintase
Introduksi gen PaCS ke dalam genom K.alvarezii dilakukan melalui perantara A. tumefaciens. Transformasi menggunakan A. tumefaciens memiliki beberapa kelebihan yaitu diantaranya mudah dilakukan (Hiei & Komari 2008). Kualitas eksplan yang digunakan dalam transformasi merupakan salah satu faktor yang menentukan keberhasilan transformasi. Eksplan yang digunakan pada penelitian ini adalah potongan talus yang berwarna coklat tua dan tidak ada bagian eksplan yang mengalami perubahan warna setelah ditumbuhkan di media adaptasi. Talus yang mengalami perubahan warna menjadi hijau tidak dapat digunakan dalam proses transformasi karena talus tersebut tidak mampu beradaptasi dengan baik dan rentan terhadap kematian. Menurut Hiei & Komari (2008), eksplan yang mendukung kesuksesan transformasi adalah eksplan yang segar dan sehat.
Transformasi dilakukan berdasarkan kemampuan A. tumefaciens mentransfer T-DNA ke dalam kromosom tanaman. Transformasi genetik menggunakan A. tumefaciens telah dilakukan pada marine makroalaga yaitu Porphyra yezoensis (Cheney et al. 2001). Pada penelitian ini kokultivasi dilakukan dengan perendaman talus pada suspensi A. tumefaciens yang mengandung senyawa asetosiringon 100 µM selama 10 – 15 menit yang selanjutnya dikeringkan kemudian ditanam pada media kokultivasi padat yang juga telah mengandung senyawa asetosiringon 100 µM selama 2-3 hari pada ruang gelap dengan suhu 25oC (Gambar 4). Penambahan asetosiringon pada media kokultivasi padat maupun cair berfungsi untuk menginduksi A. tumefacien agar dapat menginfeksi talus dan mentransfer T-DNA A. tumefaciens ke kromosom K. alvarezii. Senyawa ini meningkatkan ekspresi gen Vir sehingga dapat meningkatkan frekuensi transformasi (de la Riva et al 1998)
11
Setelah dibiakkan di media kokultivasi, bakteri yang masih menempel pada talus dibersihkan dengan perendaman di media yang mengandung cefotaxim. Cefotaxim ini berfungsi untuk membunuh A. tumefaciens tetapi tidak untuk rumput laut. Untuk melakukan regenerasi, talus dipindahkan ke media recovery (Gambar 4). Konsentrasi cefotaxim yang digunakan pada penelitian ini lebih rendah dari pada penggunaan konsentrasi cefotaxim pada penelitian tanaman tingkat tinggi. Konsentrasi cefotaxim yang efektif digunakan untuk mengurangi jumlah bakteri pada tanaman tingkat tinggi berkisar 250-1500 µg/ml (Da silva & Fukai 2001). Pada konsentrasi yang tinggi, cefotaxim dapat merusak jaringan tanaman. Hasil penelitian Okkels & Paderson (1988) menunjukkan bahwa cefotaxim dalam konsentrasi yang tinggi dapat bersifat phytotoxic pada perkembangan tanaman bit (Beta vulgaris). Pada dosis tertentu penggunaan cefotaxim pada proses transformasi tidak menghambat regenerasi tanaman (Koronfel 1998).
12
Gambar 5 Perkembangan eksplan nontransgenik dan putatif transgenik di media higromisin 10 mg/L (+Hyg) dan tanpa hygromisin (-Hyg)
Pertumbuhan talus rumput laut K. alvarezii pada media PES non selektif yang tidak mengandung higromisin memperlihatkan pertumbuhan kristal filamen di sekitar talus (2 minggu), sedangkan talus non transgenik yang ditanam pada media selektif menunjukkan hampir keseluruhan talus mengalami kematian. Talus hasil transformasi yang ditanam pada media selektif menunjukkan pertumbuhan dimana tunas tumbuh semakin panjang (Gambar 5). Sensitifitas sel tanaman terhadap agen seleksi bergantung pada genotipe, tipe eksplan dan kondisi kultur jaringan (Koronfel 1998).
Tabel 1. Hasil transformasi dan regenerasi Rumput Laut Kappaphycus alvarezii
a) Jumlah eksplan tahan higromisin/jumlah eksplan x 100%
b) Jumlah eksplan yang bertunas/jumlah eksplan tahan higromisin x 100%
c) Jumlah eksplan yang bertunas/jumlah eksplan awal yang ditanam pada media tanpa higromisin x 100%
*) Dengan A. tumefaciens
**) Di media yang tidak mengandung higromisin ***) Jumlah tunas dari 1 eksplan yang + PCR
Analisis Integrasi gen PaCS di dalam K. alvarezii
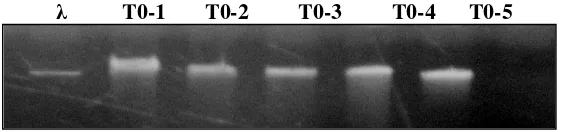
Dari 3 eksplan yang menghasilkan tunas transgenik putatif, secara acak 5 tunas diambil untuk diisolasi DNA nya. Hasil isolasi DNA genom dari kelima tunas K. alvarezii transgenik putatif menunjukkan bahwa DNA tersebut memiliki kualitas yang baik (Gambar 6). DNA genom dari salah satu tunas transgenik putatif selanjutnya digunakan untuk analisis integrasi gen PaCS pada K. alvarezii.
13
Gambar 6 Hasil elektroforesis DNA Genom Rumput laut K. alvarezii hasil isolasi; T0-1 – T0-5 = Tunas transgenik putatif
Analisis integrasi gen PaCS di dalam rumput laut menggunakan teknik PCR dengan primer gen F PaCS dan R PaCS menghasilkan pita berukuran 1300 pb, sedangkan pada K. alvarezii non transgenik tidak menghasilkan pita tersebut. Hal ini menunjukkan bahwa primer tersebut dapat digunakan untuk mengetahui keberadaan transgen PaCS di K. alvarezii transgenik (Gambar 7a). Hasil ini juga menunjukkan bahwa gen Cs rumput laut K. alvarezii mempunyai urutan nukleotida yang berbeda dengan gen PaCS dari Pseudomona aeruginosa. PCR dengan kombinasi primer 35sF dan R PaCS menghasilkan pita berukuran 1630 pb pada K. alvarezii tetapi tidak menghasilkan amplikon pada K. alvarezii non transgenik (Gambar 7b). Hasil analisis ini menunjukkan bahwa tanaman K. alvarezii transgenik tersebut mengandung gen PaCS di bawah kendali promoter 35S CaMV. Jadi, satu tunas K. alvarezii transgenik yang diambil secara acak dari 5 tunas yang telah diisolasi DNA nya adalah transgenik. Kombinasi primer ini
Gambar 7 Hasil analisis integrasi gen PaCS di dalam K. alvarezii dengan PCR. A= menggunakan kombinasi Primer F PaCS dan R PaCS B = menggunakan Primer F 35s dan R PaCS , Lajur M= Marker 1 kb, A = kontrol air, P= kontrol + plasmid, T0-1 = Rumput laut transgenik putatif, Nt= non transgenik
14
5 SIMPULAN DAN SARAN
Simpulan
Gen PaCS telah berhasil diintroduksikan dan terintegrasi di dalam genom rumput laut K. alvarezii di bawah kendali promoter 35S CaMV.
Saran
15
Anggraito YU. 2012. Transformasi genetic Nicotiana benthamiana L. dan kedelai dengan gen MaMt2 penyandi metallothionein tipe II dari Melastoma malabathricum L. Institut Pertanian Bogor. Bogor. [Disertasi].
Atmadja WS, Kadi A, Sulistijo, Rachmaniar. 1996. Pengenalan Jenis-Jenis Rumput Laut Indonesia. Puslitbang Oseanologi – LIPI, Jakarta.
Beeckmans S. 1984. Some structural and regulatory aspects of citrate synthase. Int. J. Biochem. 16(4): 341-351.
Bixler HJ. 1996. Recent developments in manufacturing and marketing carrageenan. Hydrobiologia 326/327: 35– 57. doi: 10.1007/978-94-009-1659-3_5
Buch AD, Archana G, Naresh Kumar G. 2008. Metabolic channeling of glucose towards gluconate in phosphate-solubilizing Pseudomonas aeruginosa p4 under phosporous deficiency. Res. Microb. 159:635-642
Castro IM, Fietto JLR, Vieira RX, Tropia MJM, Campos LMM, Paniago EB, Brandao RL. 2000. Bioleaching of zinc and nickel from silicates using Aspergillus niger cultures. Hydrometallurgy 57: 39-49.
Cheng R, Ruijuan MA, Ke Li , Hui R, Xiangzhi L, Zhaokai W, Shanjun Y, Yong M. 2011. Agrobacterium tumefaciens mediated transformation of marine microalgae Schizochytrium. Micres 25421:1-8. doi:10.1016/j. micres.2011.05.003
Cheney D, Metz B, Stiller J. 2001. Agrobacterium-mediated genetic transformationin the macroscopic marine red alga Porphyra yezoensis. J. Phycol. 37: 11-13
Christou P, Capell T. 2007. Genetically Modified Plants. Encyclopedia of life sciences, John Wiley & Sons, Ltd. www.els.net
16
Da Silva JA, Fukasi S. 2001. The impact of carbenicillin, cefotaxime and vancomycin on chrysanthemun and tobacco morphogenesis and Agrobacterium growth. J. Appl. Hort. 3(I):3-12
De Baar HJW, La Roche J. 2003. Metals in the Oceans; Evolution, Biology and Global Change. Springer Verlag. Berlin (DE):79-105.
De la Riva GA, González-Cabrera J, Vázquez-Padrón R, Ayra-Pardo C. 1998. Agrobacterium tumefaciens: a natural tool for plant transformation. J. Biotech. 1(3): 0717-3458.
[FAO] Food and Agriculture Organization. 2010. FAOSTAT database. [online]. http:/faostat.fao.org.
Ganzon-Fortez E T, Azanza-Corales R, Alianza T. 1993. Comparison of photoshynthetic responses of healthy and ‘diseased’ Kappaphycus alvarezii (doty) doty using p vs i curve. Botanica Marina 33: 503-506. doi 10.1515/botm.1993.36.6.503
Gasser C S, Fraley RT. 1989 Genetically engineering plants for crop improvemen. J. Science 244( 4910): 1293-1299
Hall J.L. 2002. Cellular mechanisms for heavy metal detoxification and tolerance. J. Exper. Bot. 53( 366) : 1–11. doi: 10.1093/jexbot/53.366.1
Handayani T. 2013. Konstruksi vektor biner dan transformasi gen lisozim pada rumput laut Kappaphycus alvarezii menggunakan perantara Agrobacterium tumefaciens. Seminar hasil sekolah pasca sarjana. Bogor(ID). Institut Pertanian Bogor
Hiei Y, Komari T. 2008. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed. Nature Protocol 3(5): 824-826. doi:10.1038/nprot.2008.46
Holtrof S, Apel K, Bohlman H. 1995. Comparison of different constituve and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Mol. Biol. 29(4): 637-646.
Jickells T. 1995. Atmospheric inputs of metals and nutrients to the oceans: their magnitude and effects. Marine Chem. 48 (3-4):199-214.
Joubert Y, Fleurence J. 2005. DNA isolation protocol for seaweeds. Plant Mol. Biol. Rep. 23: 197a-197g. doi:10.1007/BF02772712
17
Largo DB, Faukami K, Adachi M, Nhisijima T. 1997. Direct enumeration of total bacteria from macroalgae by epifluoresecence microscopy asapllied to the flashy red algae Kappaphycus alvarezii and Glacilaria Spp (Rhodophyta). J. Phycol. 33:554-557. doi: 10.1111/j.0022-3646.1997.00554.x
Mayo KJ, Gonzalez BJ, Mason HS. 2006. Genetic transformation of Tobacco NT1 cell with Agrobacterium tumefaciens. Nature Protocol 1(3): 1105 – 1111. doi: 10.1038/nprot.2006.176
Mtolera MSP, Collén J, Pedersen M, Semesi AK . 1995. Destructive hydrogen peroxide production in Eucheuma denticulatum (Rhodophyta) during stress caused by elevated ph, high light intensities and competition with other species. Eur. J. Phycol. 30:289–297
Muzuni. 2011. Isolasi, pengklonan dan konstruksi RNAi gen penyandi H+ -ATPase membrane plasma dari Melastoma malabathricum L. [Disertasi]. Bogor (ID). Institut Pertanian Bogor. Mediated transformation in rice. Nature Protocols 1: 2796-2802. doi:10.1038/nprot.2006.469
Okkels FT, Padersen MG. 1988. The toxicity to plant tissue and to Agrobacterium tumefaciens of some antibiotic. Acta. Hort. 255 : 199-207
Parenrengi A, Syah R, Suryati E. 2010. Budidaya rumput laut penghasil karaginan (Karagenofit). Badan Penelitian dan Pengembangan Kelautan dan Perikanan Kementrian Kelautan dan Perikanan Republik Indonesia. Indonesia.
Piers KL, Heath JD, Liang X, Stephenst KM, Nestert EW. Agrobacterium tumefaciens-mediated transformation of yeast. Proc. Natl. Acad. Sci. USA 93: 1613-1618
Sea Plant. 2004a. Biologi dasar eeuchema dilengkapi glosari dan bibliografi. Sea Plant Net Technical Monograph No. 0804-3a. 72 p
Silva PC, Basson PW and Moe RL. 1996. Cataloque of the benthic marine algae of the India ocean. Univ. Of California Press.
18
Suryati E, Mulyaningrum SRH. 2009. Regenerasi rumput laut Kappaphycus alvarezii (Doty) melalui induksi kalus dan embrio dengan penambahan hormon perangsang tumbuh secara In vitro. J. Ris. Akuakultur 4(1): 39-45 Suryati E, Tenriulo A, Parenrengi A. 2006. Isolasi protoplas rumput laut
Kappaphycus alvarezii menggunakan enzim komersial dan viscera keong mas (Pila polita). Makalah seminar pengembangan akuakultur dan temu bisnis kerapu Pusat Riset Perikanan Budidaya, Denpasar, 9 hal.
Taiz L, Zeiger.2002. Plant Physiolgy. 3th edition. Sinauier Associated Inc. Publishers. Sunderland Massachusetts. 637 p.
Tistama R. 2012. Isolasi dan introduksi gen Sitrat Sintase dari Pseudomonas aeruginosa ke dalam tanaman untuk meningkatkan toleransi terhadap cekaman aluminium [Disertasi]. Bogor (ID): Institut Pertanian Bogor. TiseraWL, Naguit MRA. 2009. Ice-ice disease occurrence in seaweed farms in
bais bay, Negros oriental and Zamboanga Del Norte.The Threshold 4:1-16 Trono GC. 1974 . Euchema Farming in the Philippines. University of the
Philippines Natural Science Research Center. Diliman. Quezon City Uyenco FR , Saniel LS, Jacinto GS. 1981. The "Ice-ice" Problem in Seaweed
Farming. Proc. Int. Seaweed Symp. 10: 625-630.
Vairappan CS. 2006. Seasonal accurrecences of epiphytic algae on the comercially cultivated red algae Kappaphycus alvarezii (Soliriciae, Gigartinales, Rhodophyta). J. Appl. Phycol. 18: 611-617
Wijarnako A. 2004. Pengaruh asam sitrat dan fosfat terhadap detoksifikasi aluminium, serapan hara, dan pertumbuhan kedelai. J. Agrikultura 16(2): 89-95. ISSN: 0853-2885.
Yamamoto Y, Kobayashi Y, Matsumoto H. 2001. Lipid peroxidation is an early symptom triggered by aluminum, but not the primary cause of elongation inhibition in pea roots. Plant Physiol. 125:199-208.
19
Lampiran 1 Komposisi Antibiotik Mix
Bahan Jumlah
Vancomycin hydrochloride 0,3 gr
Polymyxin B sulfate 0,3 gr
Colistine Sulfate 0,3 gr
Erythromycin 0,3 gr
Trime Troprim 0,3 gr
Ampicillin sodium 0,3 gr
Nalidixic Acid 0,3 gr
20
Lampiran 2 Komposisi media dasar Provasoly enrichment seawater (PES) dalam 1 liter air laut
Bahan Konsentrasi
NaNO3 3,5 gr
Β glycerophosphat 0,5 gr
Fe (sebagai EDTA) 25 ml
PII metal
H2EDTA (tritriplex II)
FeCl3
H3BO3
MnCl2
ZnCl2
CaCl2
Aquades steril
250 ml 250 mgr
2,5 mgr 10 mgr 10 mgr 1250 µgr
250 µgr 250 ml
Vit B12 100 µg
Thiamin (B1) 5 mgr
Biotin (B6) 5 µgr
Tris 5 gr
21
RIWAYAT HIDUP