OPTIMASI PROSES PRODUKSI ETANOL DARI
MIKROALGA
Chlamydomonas
sp. ICBB 9113, ICBB 9114 DAN
Synechococcus
sp. ICBB 9111
AIDIL FADLI ILHAMDY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Optimasi Proses Produksi Etanol dari Mikroalga Chlamydomonas sp. ICBB 9113, ICBB 9114 dan
Synechococcus sp. ICBB 9111 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Aidil Fadli Ilhamdy
RINGKASAN
AIDIL FADLI ILHAMDY. Optimasi Proses Produksi Etanol Dari Mikroalga
Chlamydomonas sp. ICBB 9113, ICBB 9114 dan Synechococcus sp. ICBB 9111. Dibimbing oleh TATI NURHAYATI, IRIANI SETYANINGSIH dan DWI ANDREAS SANTOSA
Produksi minyak mentah (crude oil) di Indonesia adalah 860 barrel per hari, maka cadangan minyak bumi di Indonesia sebesar 7.4 milyar barrel kemungkinan akan habis pada tenggang waktu 24 tahun. Kebijakan energi nasional mentargetkan pemanfaatan energi non fosil sebesar 5-20% pada tahun 2005-2020. Bahan baku generasi pertama yang digunakan untuk energi alternatif misalnya kelapa sawit, buah jarak, singkong. Potensi lain selain tanaman terestrial adalah organisme perairan yaitu mikroalga. Komponen makromolekul mikroalga misalnya lipid untuk biodiesel dan karbohidrat untuk etanol. Produksi etanol dari biomassa mikroalga dapat diperoleh melalui tahapan sakarifikasi dan fermentasi. Kendala yang sering ditemukan dalam proses sakarifikasi adalah rendemen gula sederhana yang masih rendah ketika menggunakan hidrolisis asam. Oleh sebab itu, maka perlu dicari alternatif untuk meningkatkan rendemen gula sederhana pada proses hidrolisis yaitu dengan menggunakan enzim.
Penelitian ini terdiri dari empat tahap. Tahap yang pertama berupa peremajaan dan penyediaan stok tiga isolat dalam media BG 11. Tahap kedua yaitu kultivasi dalam media N2P1, N2P2 dan N3P3. Tahap ketiga adalah pengujian aktivitas enzim untuk menentukan suhu dan pH optimum. Tahap keempat adalah proses hidrolisis mikroalga menggunakan enzim komersil α -amilase dan amiloglukosidase. Hasil dari hidrolisis kemudian difermentasi selama tujuh hari untuk produksi etanol.
Mikroalga Chlamydomonas sp. ICBB 9114 memilki yield biomassa tertinggi 0,45 g/L dengan kadar pati 14,16% , sedangkan yield biomassa dan kadar pati terendah pada mikroalga Synechococcus sp. ICBB 9111. Hasil karakterisasi enzim α-amilase optimum pada pH 7 dan suhu 90oC dengan aktivitas enzim sebesar 63,69 U/mL, sedangkan karakterisasi enzim amiloglukosidase terbaik diperoleh pada pH 5,5 dan suhu 60oC dengan aktivitas enzim 148,59 U/mL.
Proses hidrolisis tiga jenis mikroalga dengan menggunakan enzim
α-amilase diperoleh total gula pereduksi tertinggi pada mikroalga
Chlamydomonas sp. ICBB 9114 (5,62 mg/mL), sedangkan total gula pereduksi
terendah diperoleh pada mikroalga Chlamydomonas sp. ICBB 9113 (4,39 mg/mL). Kombinasi dua jenis enzim yaitu α-amilase dan amiloglukosidase
pada proses hidrolisis meningkatkan total gula pereduksi (p<0,05) pada ketiga jenis mikroalga. Total gula pereduksi tertinggi dihasilkan pada mikroalga
Chlamydomonas sp. ICBB 9114 (41,83 mg/mL), sedang gula pereduksi terendah dihasilkan mikroalga Synechococcus sp. ICBB 9111 (35,67 mg/mL). Hasil fermentasi selama 96 jam pada ketiga jenis mikroalga menghasilkan etanol masing-masing Synechococcus sp. ICBB 9111 (920 ppm), Chlamydomonas sp. ICBB 9113 (980 ppm) dan Chlamydomonas sp. ICBB 9114 (516 ppm).
SUMMARY
AIDIL FADLI ILHAMDY. Optimization Process of Ethanol Production from Microalgae Chlamydomonas sp. ICBB 9113, ICBB 9114 and Synechococcus sp. ICBB 9111. Supervised by TATI NURHAYATI, IRIANI SETYANINGSIH and DWI ANDREAS SANTOSA.
The production of crude oil in Indonesia is 860 thousand barrel per day. Total crude oil reserves in Indonesia today is 7,4 billion barrels, and it is estimated to be exhausted in 24 years. National energy policy targets the utilization of non-fossil energy by 5-20% in the year 2005-2020. The first generation of alternative energy materials used are crude palm oil, jatropha, cassava and corn. The potential feedstock other than terrestrial plants are aquatic organisms e.g microalgae. Components of microalgae such as lipids for biodiesel and carbohydrates to ethanol. Ethanol production from biomass of microalgae consist of two stages i.e. saccharification and fermentation. Problem often found in the saccarification process is low reducing sugar when using acid hydrolysis. Therefore, it is necessary to find an alternative approach to increase the sugar yield by using enzymes.
The study consists of four stages. The first was regeneration three isolates in BG 11 medium. The second was cultivation in laboratory using N2P1, N2P2 and N3P3 medium. The commercial enzyme of α-amylase and amyloglucosidase was analyzed to determine the optimal temperature and pH of its activity. The last
was evaluating ethanol production using α-amylase and amyloglucosidase. The results of hydrolysis then fermented for seven days using Saccharomyces cereviceae ICBB 8808 to produce ethanol.
Microalgae Chlamydomonas sp. ICBB 9114 has the highest biomass yield of 0,44 g/L with a 14,16% starch content, whereas the biomass yield and the
Chlamydomonas sp. ICBB 9113 (4,39 mg/mL). The combination of the two types of enzymes α-amylase and amyloglucosidase the hydrolysis process increases the total reducing sugars (P<0,05) in all three types of microalgae. The highest reducing sugars produced in the microalgae Chlamydomonas sp. ICBB 9114 (41,83 mg / mL), whereas the lowest reducing sugar produced microalgae
Synechococcus sp. ICBB 9111 (35,67 mg/mL). After fermentation for 96 hours on three types of microalgae to produce ethanol. Synechococcus sp. ICBB 9111 (920 ppm), Chlamydomonas sp. ICBB 9113 (980 ppm) and Chlamydomonas sp. ICBB 9114 (516 ppm) respectively.
©
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
OPTIMASI PROSES PRODUKSI ETANOL DARI
MIKROALGA
Chlamydomonas
sp. ICBB 9113, ICBB 9114 DAN
Synechococcus
sp. ICBB 9111
AIDIL FADLI ILHAMDY
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa karena berkat rahmat dan
karunianya penulis dapat menyelesaikan tesis dengan judul “Optimasi Proses Produksi Etanol dari Mikroalga Chlamydomonas sp. ICBB 9113, ICBB 9114 dan
Synechococcus sp. ICBB 9111”. Pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaian tesis,
terutama kepada Dr Tati Nurhayati, SPi MSi, Dr Ir Iriani Setyaningsih, MS dan Prof Dr Ir Dwi Andreas Santosa, MS sebagai dosen pembimbing tesis yang
senantiasa memberikan arahan serta bimbingan selama penyusunan tesis ini. Keluarga besar Indonesian Center for Biodiversity and Biotechnology (ICBB) yang menyediakan fasilitas untuk penelitian. Keluarga terutama Ayah, Ibu, Kakak dan Adik-adik yang telah memberikan doa, kasih sayang dan semangat kepada penulis dalam menyelesaikan tesis ini. Patmawati, S.Pi, M.Si selaku rekan penelitian yang selalu bekerjasama dalam menyelesaikan penelitian, teman-teman S2 THP 2010, 2011 dan 2012 atas kerjasama yang baik selama studi dan semua pihak yang tidak dapat disebutkan satu persatu.
Semoga tulisan ini bermanfaat bagi pengembangan ilmu dan praktik produksi bahan bakar alternatif, khususnya etanol dari mikroalga.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR DAFTAR LAMPIRAN
xi xii
1 PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian Manfaat Penelitian
2 2
2 METODE
Lokasi dan Waktu Penelitian 4
Bahan dan Alat 4
Pelaksanaan Penelitian 4
Prosedur Pengujian 8
Analisis Data 11
3 HASIL DAN PEMBAHASAN
Pertumbuhan Mikroalga 12
Karakterisasi Biomassa Mikroalga 14
Karakterisasi Enzim Komersil α-amilase dan Amiloglukosidase 16
Proses Hidrolisis Mikroalga 17
Fermentasi 24
4 KESIMPULAN DAN SARAN
Kesimpulan 26
Saran 26
DAFTAR PUSTAKA 27
LAMPIRAN 33
DAFTAR TABEL
1 Hasil karakterisasi biomassa mikroalga 14
2 Hasil karakterisasi enzim α-amilase 17
3 Hasil karakterisasi enzim amiloglukosidase 17
4 Hasil hidrolisis empat jenis mikroalga menggunakan konsentrasi enzim
Komposisi karbohidrat total setelah proses hidrolisis Hasil etanol dan metanol tiga jenis mikroalga
24 25
DAFTAR GAMBAR
1 Peremajaan isolat Synechoccocus sp.dan Chlamydomonas sp 5
2 Produksi biomassa mikroalga 6
3 Proses produksi etanol 8
4 Kurva pertumbuhan mikroalga pada media BG 11 (a) Synechococcus sp. ICBB 9111; (b) Chlamydomonas sp. ICBB 9113; (c) Chlamydomonas sp.
ICBB 9114 12
5 Kurva pertumbuhan mikroalga pada media teknis (a) Synechococcus sp. ICBB 9111 (N2P1); (b) Chlamydomonas sp. ICBB 9113 (N2P2); (c)
Chlamydomonas sp. ICBB 9114 (N2P3). 13 6 Kadar total gula pereduksi hasil hidrolisis Synecochococcus sp. ICBB
9 Kadar total gula pereduksi hasil hidrolisis kombinasi enzim α-amilase dan amiloglukosidase mikroalga Synecochococcus sp. ICBB 9111 22 10 Kadar total gula pereduksi hasil hidrolisis kombinasi enzim α-amilase dan
amiloglukosidase mikroalga Chlamydomonas sp. ICBB 9113 23 11 Kadar total gula pereduksi hasil hidrolisis kombinasi enzim α-amilase dan
amiloglukosidase mikroalga Chlamydomonas sp. ICBB 9114 23 12 Total gula pereduksi dan nilai pH ketiga jenis mikroalga selama
fermentasi Synecochococcus sp. ICBB 9111,
Chlamydomonas sp. ICBB 9113, Chlamydomonas sp. ICBB 9114; pH hidrolisat Synecochococcus sp ICBB 9111 pH hidrolisat
Chlamydomonas sp. ICBB 9113, pH hidrolisat Chlamydomonas
DAFTAR LAMPIRAN
1 Komposisi media kultur 33
2 Morfologi mikroalga 34
3 4
Hasil pengukuran etanol dan metanol dengan menggunakan HPLC
Perhitungan yield biomassa mikroalga dan presentase etanol dari biomassa kering
1 PENDAHULUAN
Latar belakang
Energi mempunyai peranan penting dalam kehidupan manusia. Jumlah populasi manusia yang terus meningkat dalam beberapa dekade terakhir mengakibatkan berbagai negara dihadapkan dengan krisis energi salah satunya adalah Indonesia. Kebutuhan penting penunjang mobility manusia selain food dan
water adalah energy petroleum. Produksi minyak mentah (crude oil) di Indonesia adalah 860 ribu barrel per hari maka cadangan minyak bumi di Indonesia sebesar 7,4 milyar barrel kemungkinan akan habis pada tenggang waktu 24 tahun (KESDM 2012). Fakta ini merupakan tantangan bagi bangsa Indonesia untuk mengelola dan menjamin kebutuhan energi 238 juta penduduk Indonesia (BPS 2011), khususnya dalam pelaksanaan pembangunan nasional.
Kebijakan energi nasional menargetkan pemanfaatan energi non fosil
sebesar 5-20% pada tahun 2005-2020 yang dalam pelaksanaannya didukung oleh Peraturan Menteri Energi dan Sumber Daya Mineral nomor 25 tahun 2013 mengenai penyediaan bahan bakar nabati (biofuel) untuk menjamin ketersediaan energi nasional. Teknologi pengolahan dan pemanfaatan telah dikuasai dan diterapkan dalam penyediaan bioenergi (biodiesel, etanol, biogas). Bahan baku generasi pertama yang biasa digunakan adalah minyak kelapa sawit, buah kelapa, ubi kayu, buah jarak, jagung. Potensi lain sumber daya energi alternatif yang dapat diperbaharui selain tanaman terestrial terus dikaji. Sumber daya ini menyimpan potensi yang terus dikembangkan, seperti yang dilakukan Chisti (2007) bahwa mikroalga layak dijadikan alternatif sumber bahan baku biofuel
untuk menggantikan bahan bakar fosil (petroleum). Pemanfaatan mikroalga sebagai bahan baku biofuel generasi kedua, diharapkan dapat membantu target kebutuhan energi yang dihasilkan dari bahan baku generasi pertama dalam jangka panjang (Mata et al. 2010). Sumber energi alternatif dari mikroalga dapat berasal dari komponen lipid untuk biodiesel dan karbohidrat untuk etanol.
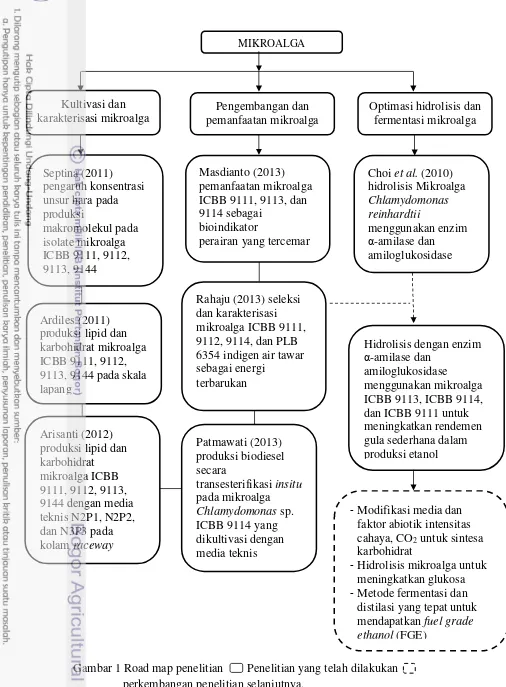
Mikroalga yang berpotensi sebagai sumber bahan baku produksi etanol sangat beragam. Jhon et al. (2011) mengemukakan bahwa terdapat 28 jenis mikroalga sumber bahan baku produksi etanol, misalnya Chlorella, Dunaliella, Chlamydomonas, Scenedesmus, Spirulina yang diketahui mengandung sejumlah karbohidrat (>50% dari berat kering) (Ueda et al. 1996). Hasil penelitian Arisanti (2012) menjelaskan bahwa mikroalga Chlamydomonas sp. ICBB 9113,
Chlamydomonas sp. ICBB 9114 memiliki kandungan karbohidrat sebesar 34,7% dan 39,7% (bk), sedangkan Synechococcus sp. ICBB 9111 memiliki kadar karbohidrat 44,2% (bk).
Produksi etanol dari biomassa mikroalga dapat diperoleh melalui tahapan sakarifikasi dan fermentasi. Hidrolisis mikroalga Chlamydomonas reinhardtii
menggunakan enzim α-amilase dan amiloglukosidase menghasilkan rendemen gula 57 g/L (Choi et al. 2010). Hasil penelitian Nguyen et al. (2009), menyatakan bahwa mikroalga Chlamydomonas reinhardtii yang dihidrolisis menggunakan asam H2SO4 menghasilkan rendemen gula 29,6 g/L. Kendala yang sering
meningkatkan rendemen gula sederhana dengan konsumsi energi yang rendah pada proses hidrolisis yaitu dengan menggunakan enzim. Mojovic’ et al. (2006) menyatakan bahwa hidrolisis menggunakan enzim memiliki beberapa keuntungan yaitu ramah lingkungan, dapat dilakukan pada suhu ruang dan tekanan rendah, dan bersifat lebih spesifik.
Alternatif teknologi bioproses telah banyak dikembangkan diantaranya menggunakan enzim komersial α-amilase dan amiloglukosidase. Penggunaan
enzim α-amilase dan amiloglukosidase pada proses produksi mampu
menghidrolisis fraksi pati menjadi glukosa dengan memutus ikatan α-1,4 dan
α-1,6 glikosidik pada fraksi amilosa dan amilopektin. Mekanisme kerja enzim yang tepat dalam memotong ikatan pada fraksi amilosa dan amilopektin diharapkan dapat meningkatkan rendemen gula pereduksi yang dihasilkan dari mikroalga Chlamydomonas sp. ICBB 9113, Chlamydomonas sp. ICBB 9114 dan
Synechococcus sp. ICBB 9111.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji pengaruh penggunaan enzim komersial α-amilase dan kombinasi antara α-amilase dan amiloglukosidase dalam proses hidrolisis mikroalga Chlamydomonas sp. ICBB 9113,
Chlamydomonas sp. ICBB 9114 dan Synechococcus sp. ICBB 9111 untuk meningkatkan rendemen gula sederhana dalam proses produksi etanol.
Manfaat Penelitian
Gambar 1 Road map penelitian Penelitian yang telah dilakukan cahaya, CO2 untuk sintesa
2 METODE
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan mulai bulan Mei 2012 sampai Agustus 2013 yang bertempat di Indonesian Center for Biodiversity and Biotechnology (ICBB), Cilubang Nagrak, Situgede, Kabupaten Bogor; Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; dan Laboratorium Manajemen Mutu, Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB.
Bahan dan Alat
Bahan yang digunakan pada penelitian adalah dua jenis isolat mikroalga
Chlamydomonas sp. ICBB 9113, Chlamydomonas sp. ICBB 9114 dansatu isolat
Synechococcus sp. ICBB 9111. Proses hidrolisis menggunakan enzim komersial
α-amilase dan amiloglukosidase yang dibeli dari PT. Kreatif Energi Indonesia. Media BG11 digunakan dalam peremajaan dan pada tahap isolasi, selanjutnya media teknis berdasarkan hasil penelitian terbaik Arisanti (2012) digunakan dalam tahap kultivasi skala lapang. Komposisi media BG 11 dan media N2P1, N2P2, N3P3 secara lengkap dapat dilihat pada Lampiran 1.
Alat-alat yang digunakan adalah erlenmeyer, outoclave, shaker,
laminar flow, spektrofotometer MAPADA V1100D, High Performance Liquid Chromatography (HPLC) Waters 1525EF Binary HPLC Pump, neraca analitik, aerator, lampu 2000 lux dan akuarium dengan kapasitas 100 liter dengan sumber cahaya matahari.
Pelaksanaan Penelitian
Penelitian dilakukan dalam 4 tahap. Tahap yang pertama yaitu peremajaan dan penyediaan stok empat isolat dalam media BG 11. Tahap kedua yaitu produksi biomassa pada skala lab dan skala lapang dalam media N2P1, N2P2, dan N3P3. Tahap ketiga adalah pengujian aktivitas enzim α-amilase dan amiloglukosidase dengan menentukan pH dan suhu optimum. Tahap keempat adalah proses produksi etanol menggunakan enzim komersial dengan aktivitas enzim terbaik dari hasil karakterisasi tahap ketiga. Hidrolisat mikroalga yang dihasilkan setelah proses hidrolisis selanjutnya difermentasi menggunakan
Saccharomyces cerevisiae ICBB 8808.
Peremajaan isolat mikroalga
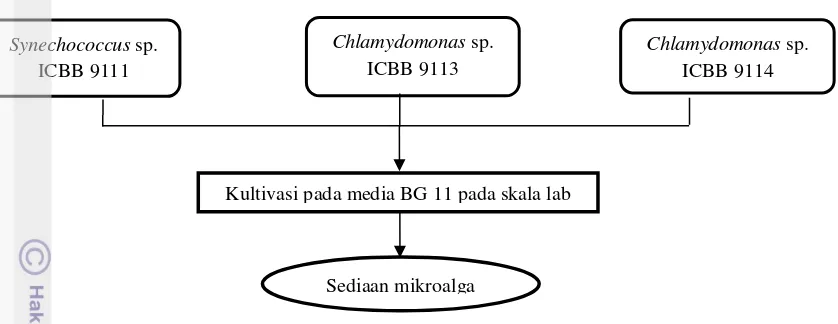
Tahapan peremajaan diawali dengan mempersiapkan media BG 11. Sebanyak 2 mL isolat Chlamydomonas sp. ICBB 9113, Chlamydomonas sp. ICBB 9114 dan satu isolat Synechococcus sp. ICBB 9111 diinokulasikan ke dalam 50 mL media BG11 dalam botol berukuran ±100 mL. Selanjutnya dilakukan proses inkubasi selama 3 minggu dengan cara digoyang (shaker). Proses peremajaan isolat mikroalga dapat dilihat pada Gambar 1.
Gambar 1 Proses peremajaan isolat Synechoccocus sp.dan Chlamydomonas sp.
Produksi biomassa
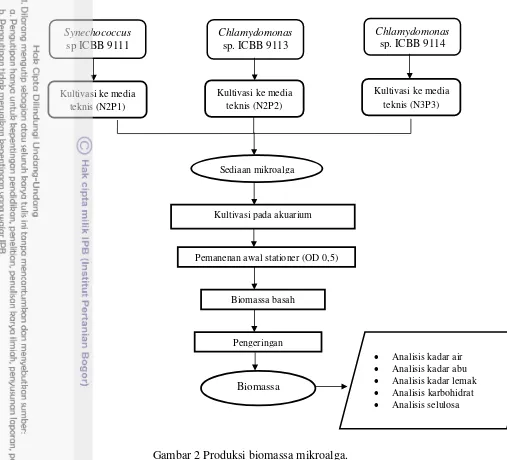
Produksi biomassa pada skala lapang dilakukan menggunakan akuarium. Kultivasi dilakukan dengan menggunakan 20% kultur segar mikroalga ke dalam 80 liter media (N2P1, N2P2 dan N3P3) dan menggunakan cahaya matahari sebagai sumber cahaya dengan suhu berkisar 29-39oC. Synechococcus sp. ICBB 9111 dikultivasi pada media N2P1, Chlamydomonas sp. ICBB 9113 dikultivasi pada media N2P2, Chlamydomonas sp. ICBB 9114 dikultivasi pada media N3P3. Pertumbuhan ketiga isolat mikroalga diukur setiap hari berdasarkan kerapatan optik pada panjang gelombang 620 nm hingga mencapai nilai OD > 0,5 (Arisanti 2012). Nilai OD 0,5 direpresentasikan sebagai nilai kepadatan sel terbaik pada sintesa makromolekul mikroalga untuk dikultivasi atau dilakukan pemanenan (Ardiles 2011). Pemanenan dilakukan pada OD 0,5 dengan menambahkan flokulan Al2(SO4)3 (alumunium sulfat) dengan konsentrasi 0,3 g/L
(desk study). Selanjutnya mikroalga disaring menggunakan kertas saring dan dikeringkan menggunakan oven pada suhu 80oC selama 12-24 jam. Biomassa yang diperoleh dikeringkan dengan oven pada suhu 80oC. Biomassa kering mikroalga, kemudian dianalisis kadar air, kadar abu, kadar gula total, kadar selulosa dan dilakukan perhitungan rendemen. Produksi biomassa mikroalga dapat dilihat pada Gambar 2.
Pengujian aktivitas enzim α-amilase dan amiloglukosidase (Bernfeld 1955)
Aktivitas enzim α-amilase dan amiloglukosidase ditentukan menggunakan metode Bernfeld (1955) menggunakan DNS (3.5-dinitro salicylic acid) dan pati sebagai substrat. Enzim α-amilase komersial digunakan sebagai sampel enzim. Satu unit aktivitas enzim α-amilase didefinisikan sebagai jumlah pati yang
terhidrolisis menjadi glukosa selama masa inkubasi 30 menit. Enzim
α-amlilase dan amiloglukosidase diencerkan menggunakan buffer fosfat sitrat (BSF), kemudian ditambahkan 2 mL soluble starch 2% (b/v) dan diinkubasi pada pH dan suhu yang bervariasi yaitu (5,5, 6, 6,5, 7) dan (60,70, 80, 90)oC, sedangkan enzim amiloglukosidase diinkubasi pada pH (4,5, 5, 5,5) dan suhu (40, 50, 60)oC. Waktu inkubasi dilakukan selama 30 menit. Hasil inkubasi yang diperoleh diukur gula pereduksinya dengan pereaksi DNS. Satu U/mL enzim merupakan 1µmol produk yang terbentuk dalam waktu 1 menit.
Chlamydomonas sp. ICBB 9113
Chlamydomonas sp. ICBB 9114
Synechococcus sp. ICBB 9111
Kultivasi pada media BG 11 pada skala lab
Gambar 2 Produksi biomassa mikroalga.
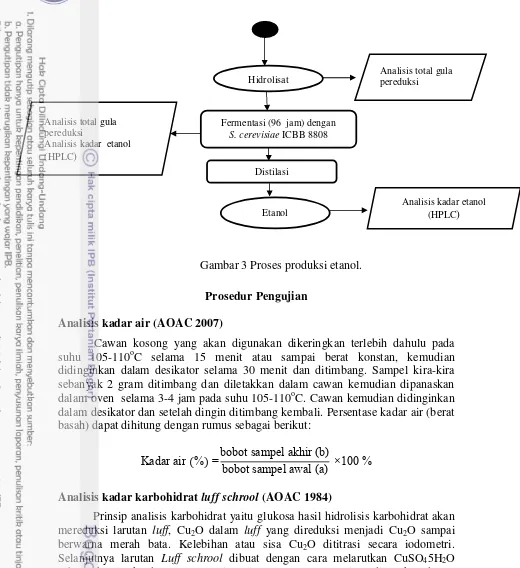
Proses produksi etanol
Proses pembuatan etanol terdiri dari 3 tahap, yaitu likuifikasi, sakarifikasi, dan fermentasi. Likuifikasi dan Sakarifikasi adalah proses hidrolisis karbohidrat menjadi gula sederhana menggunakan enzim α-amilase dan amiloglukosidase. Tahap fermentasi gula sederhana akan dirubah menjadi etanol menggunakan
S. cereviceae ICBB 8808. Pada proses likuifikasi dan sakarifikasi, terlebih dahulu enzim komersial diuji aktivitas enzim dengan menentukan pH dan suhu optimumnya.
Hidrolisis enzim pada mikroalga
Proses hidrolisis mikroalga menggunakan biomassa kering seberat 2,5 g. Biomassa kering ditambahkan akuades dengan rasio padatan 5% (b/v) dalam larutan. Mikroalga yang telah dilarutkan dengan akuades ditambahkan enzim komersial α-amilase (likuifikasi) pada konsentrasi (0,005; 0,010; 0,020; 0,040; 0,060; 0,010%) (v/v) dan kombinasi α-amilase dengan amiloglukosidase (sakarifikasi) pada konsentrasi 0,4% (v/v), kemudian dihidrolisis pada pH dan suhu terbaik pada tahap ketiga. Proses hidrolisis menggunakan enzim α-amilase
Chlamydomonas sp. ICBB 9113
Chlamydomonas sp. ICBB 9114 Synechococcus
sp ICBB 9111
Kultivasi ke media teknis (N2P1)
Kultivasi ke media teknis (N2P2)
Kultivasi ke media teknis (N3P3)
Sediaan mikroalga
Kultivasi pada akuarium
Pemanenan awal stationer (OD 0,5)
Biomassa basah
Pengeringan
Biomassa
kering
Analisis kadar air
Analisis kadar abu
Analisis kadar lemak
Analisis karbohidrat
Analisis selulosa
dilakukan selama 30 menit dan amiloglukosidase selama 55 menit (Choi et al. 2010). Substrat hasil hidrolisis disaring untuk mendapatkan
hidrolisatnya. Analisis total gula pereduksi dilakukan pada hidrolisat hasil proses liquifikasi dan sakarifikasi. Tujuannya untuk mengetahui kemampuan enzim
α-amilase dan amiloglukosidase dalam menghidrolisis substrat mikroalga.
Fermentasi
Gula yang telah terbentuk pada proses sakarifikasi kemudian diproses ke tahap fermentasi menggunakan S. cereviceae ICBB 8808. Isolat S. cereviceae
ICBB 8808 terlebih dahulu diremajakan pada media PDA dan diinkubasi selama 24 jam. Setelah itu isolat ditumbuhkan lagi pada 50 mL media YMGP yang terdiri dari ekstrak yeast 5 g/L, malt 5 g/L, glukosa 10 g/L dan pepton 5 g/L di dalam erlenmeyer 200 mL. Inkubasi dilakukan pada suhu 30oC selama 24 jam dengan
shaker berkecepatan 125 rpm (Yanagisawa et al. 2011). Proses fermentasi gula menjadi etanol dilakukan dengan cara menambahakan kultur cair S.cerevisiae
ICBB 8808 sebanyak 10% dari substrat yang digunakan kemudian diinkubasi selama 96 jam (Arnata 2009). Setiap 24 jam disampling dan dianalisis total gula pereduksi dan perubahan pH. Hasil fermentasi dianalisis menggunakan HPLC untuk mengetahui kadar etanol yang dihasilkan.
Biomassa kering 3 jenis mikroalga 5% (b/v)
Enzim α-amilase
0,005%, 0,010%, 0,020%, 0,040%, 0,060%, 0,1% (v/v) (liquifikasi)
Hidrolisis pH dan suhu terbaik selama 30 menit
Analisis total gula pereduksi
1. Pemanasan 90oC
Hidrolisat
Enzim amiloglukosidase0,40% (v/v) (sakarifikasi)
Prosedur Pengujian
Analisis kadar air (AOAC 2007)
Cawan kosong yang akan digunakan dikeringkan terlebih dahulu pada suhu 105-110oC selama 15 menit atau sampai berat konstan, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang. Sampel kira-kira sebanyak 2 gram ditimbang dan diletakkan dalam cawan kemudian dipanaskan dalam oven selama 3-4 jam pada suhu 105-110oC. Cawan kemudian didinginkan dalam desikator dan setelah dingin ditimbang kembali. Persentase kadar air (berat basah) dapat dihitung dengan rumus sebagai berikut:
Kadar air bobot sampel akhir b bobot sampel awal a
Analisis kadar karbohidrat luff schrool (AOAC 1984)
Prinsip analisis karbohidrat yaitu glukosa hasil hidrolisis karbohidrat akan mereduksi larutan luff, Cu2O dalam luff yang direduksi menjadi Cu2O sampai
berwarna merah bata. Kelebihan atau sisa Cu2O dititrasi secara iodometri.
Selanjutnya larutan Luff schrool dibuat dengan cara melarutkan CuSO45H2O
sebanyak 25 g ke dalam 50 mL air suling, 50 gram asam sitrat dilarutkan dalam
50 mL air suling dan 388 gram Na2CO210H2O dilarutkan ke dalam 400 mL
air suling. Larutan asam sitrat ditambahkan sedikit demi sedikit pada larutan soda. Campuran ditambahkan larutan terusi (CuSO45H2O) dan diencerkan hingga
100 mL ke dalam labu ukur kemudian dimasukkan 2 g sampel kering dan ditambahkan 200 mL HCl 3% serta batu didih. Selanjutnya labu erlenmeyer dipasang pada pendingin tegak dan dihidrolisis selama 3 jam. Larutan kemudian didinginkan dan dinetralkan dengan NaOH dan indikator fenolftalin. Larutan dimasukkan ke dalam labu ukur 500 mL, ditambahkan dengan air suling sampai pada tanda tera kemudian disaring. Sebanyak 10 mL larutan dipipet ke dalam labu erlenmeyer 250 mL dan ditambahkan larutan luff 25 mL serta 15 mL air suling, sedangkan untuk pembuatan blanko dibuat larutan tanpa menambahkan
Fermentasi (96 jam) dengan
S. cerevisiae ICBB 8808
Distilasi
Etanol
Analisis kadar etanol (HPLC)
3.
Analisis total gula pereduksi
2. Hidrolisat
Analisis total gula pereduksi
Analisis kadar etanol (HPLC)
sampel selanjutnya dianalisis. Larutan yang ada dalam labu erlenmeyer dipasang pada pendingin balik dan dididihkan selama 10 menit setelah itu larutan tersebut langsung didinginkan pada air akuades yang mengalir. Selanjutnya ditambahkan larutan Ki 30% dan 25 mL H2SO4 25% ke dalam larutan yang telah didinginkan.
Proses selanjutnya larutan dititrasi sampai reaksi terhenti kemudian dititrasi lagi dengan larutan Na2S2O3 sampai larutan berwarna biru muda. Kadar karbohidrat
dapat dihitung berdasarkan rumus:
Kadar karbohidrat g P
adar pati Pg
Keterangan:
0,9 = Faktor pembanding berat molekul satu unit gula dalam molekul pati G = Glukosa setara dengan mL Na2S2O3 yang dipergunakan untuk titrasi
(mg) setelah gula diperhitungkan P = Pengenceran
g = Bobot sampel (mg)
Kadar ADF (Van Soest 1963)
Sampel dimasukan ke dalam gelas piala 500 mL, kemudian ditambahkan 50 mL larutan ADS. Larutan ADS terdiri atas H2SO4, Cethyle trimethyl
ammonium bromidel (CTAB). Selanjutnya sampel dipanaskan selama 1 jam di atas penangas listrik. Sampel yang telah dipanaskan dicuci dengan aseton dan
air panas, lalu disaring menggunakan pompa vakum dan dimasukkan ke dalam filter glass. Sampel yang telah disaring lalu dicuci dengan aseton dan air panas. Sampel yang berada dalam filter glass ditimbang masing-masing sebagai (a) dan (b). Sampel (a) dan (b) dikeringkan menggunakan oven pada suhu 105oC selama 30 menit dan didinginkan dengan desikator dan ditimbang sebagai (c). Kadar ADF dihitung dengan rumus:
Kadar c ba
Keterangan:
a = bobot sampel (g) b = bobot filter glass (g) c = residu ADF
Kadar selulosa (Van Soest 1963)
Residu ADF sebagai (c) yang berada di dalam filter glass diletakkan di atas nampan yang berisi air setinggi 1 cm, kemudian ditambahkan H2SO4 72% setinggi
Kadar selulosa d ca
Keterangan:
a = bobot sampel (g)
c = bobot filter glass dan residu ADF awal (g)
d = bobot filter glass dan residu ADF setelah dioven (g)
Total gula pereduksi metode DNS (Miller 1959)
Prinsip metode ini adalah dalam suasana alkali gula pereduksi akan mereduksi asam 3,5 – dinitrolisilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
1. Penyiapan pereaksi DNS
Pereaksi DNS dibuat dengan melarutkan 10,6 g asam 3,5 dinitrolisilat dan 19,8 NaOH ke dalam 1416 mL akuades, selanjutnya ditambahkan 306 g Na-K Tatrat, 7,6 g fenol yang dicairkan pada suhu 50oC dan 8,3 g Na-Metabisulfit. Larutan ini diaduk rata, kemudian 3 mL larutan ini dititrasi dengan HCl 0,1 N dengan indikator fenolftalein. Jumlah titran berkisar 5 – 6 mL. Jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap ml kekurangan HCl 0,1 N.
2. Penentuan kurva standar
Kurva standar dibuat dengan mengukur mengetahui nilai gula pereduksi pada glukosa pada selang 0,2 – 0,5 mg/L. Kemudian nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam grafik secara linear. 3. Penetapan total gula pereduksi
Pengujian gula pereduksi menggunakan kurva standar DNS adalah sebagai berikut: 1 mL sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 3 mL pereaksi DNS. Larutan tersebut ditempatkan dalam air mendidih selama 5 menit. Larutan dibiarkan sampai dingin pada suhu ruang. Absorbansi diukur pada panjang gelombang 550 nm.
Kadar Etanol
Pengukuran kadar etanol sampel dilakukan menggunakan HPLC (High Performance Liquid Chromatography). Waters 1525EF Binary HPLC Pump dengan spesifikasi sebagai berikut:
Fase gerak : H2SO4 0,008 N
Kolom : Aminex® HPX-87H, 300 mm x 7,8 mm
Detektor : Reactive Index
Kecepatan aliran : 1 mL/min
Volume injeksi : 20 µL
Suhu kolom : 35 oC
Analisis Data
Proses hidrolisis
Data yang diperoleh dari hasil penelitian dianalisis menggunakan rancangan acak lengkap (RAL). Perlakuan yang digunakan berupa perbedaan konsentrasi enzim α-amilase pada proses likuifikasi serta kombinasi enzim
α-amilase dan amiloglukosidase pada tahap sakarifikasi dengan 2 ulangan. Pengaruh perlakuan terhadap faktor respon kemudian dianalisis menggunakan
Analysis of Variance (ANOVA) (Steel dan Torrie 1991). Yij µ + αi+ βj+ εij
Keterangan:
Yij : nilai pengamatan pada perlakuan jenis pelarut ke-i dan ulangan ke-j
µ : rataan umum
αi : pengaruh perlakuan jenis pelarut ke-i βj : pengaruh ulangan ke-j
εij : pengaruh galat percobaan dari perlakuan jenis pelarut ke-i dan ulangan
ke-j
i : perlakuan jenis pelarut ke-i j : ulangan ke-j
y = 0,007x + 0,0335
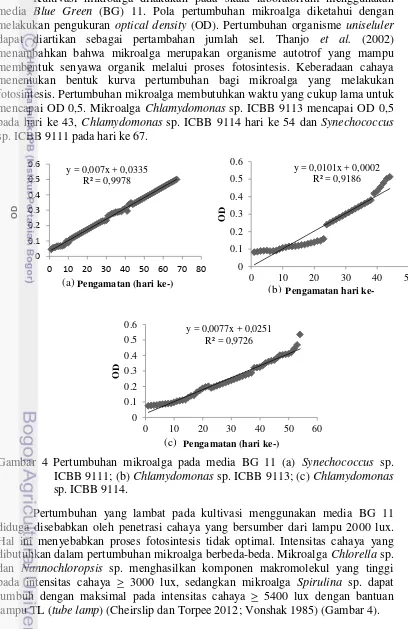
Kultivasi mikroalga dilakukan pada skala laboratorium menggunakan media Blue Green (BG) 11. Pola pertumbuhan mikroalga diketahui dengan melakukan pengukuran optical density (OD). Pertumbuhan organisme uniseluler
dapat diartikan sebagai pertambahan jumlah sel. Thanjo et al. (2002) menambahkan bahwa mikroalga merupakan organisme autotrof yang mampu membentuk senyawa organik melalui proses fotosintesis. Keberadaan cahaya menentukan bentuk kurva pertumbuhan bagi mikroalga yang melakukan fotosintesis. Pertumbuhan mikroalga membutuhkan waktu yang cukup lama untuk mencapai OD 0,5. Mikroalga Chlamydomonas sp. ICBB 9113 mencapai OD 0,5 pada hari ke 43, Chlamydomonas sp. ICBB 9114 hari ke 54 dan Synechococcus
sp. ICBB 9111 pada hari ke 67.
Gambar 4 Pertumbuhan mikroalga pada media BG 11 (a) Synechococcus sp. ICBB 9111; (b) Chlamydomonas sp. ICBB 9113; (c) Chlamydomonas
sp. ICBB 9114.
y = 0,0191x + 0,0623
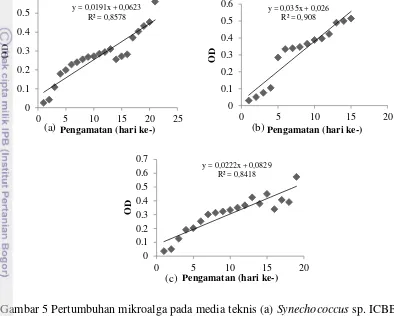
Mikroalga selanjutnya dikultivasi menggunakan media teknis dan dilakukan pada skala lapang. Media teknis yang digunakan untuk pertumbuhan mikroalga Synechococcus sp. ICBB 9111, mikroalga Chlamydomonas sp. ICBB 9113 pada media N2P2, sedangkan mikroalga Chlamydomonas sp. ICBB 9114 dikultivasi pada media N3P3.
Gambar 5 Pertumbuhan mikroalga pada media teknis (a) Synechococcus sp. ICBB 9111 (N2P1); (b) Chlamydomonas sp. ICBB 9113 (N2P2); (c)
Chlamydomonas sp. ICBB 9114 (N3P3).
Kecepatan pertumbuhan mikroalga menggunakan media teknis pada setiap mikroalga berbeda-beda. Mikroalga Chlamydomonas sp ICBB 9113 dan
Chlamydomonas sp ICBB 9114 mencapai OD 0,5 selama 15 dan 19 hari, sedangkan pertumbuhan mikroalga Synechococcus sp ICBB 9111 mencapai OD 0,5 pada hari ke 27. Li et al. (2011) menjelaskan bahwa pertumbuhan dan akumulasi biomassa mikroalga meningkat dipengaruhi oleh faktor eksternal seperti pH, CO2 dan intensitas cahaya selama pertumbuhan. Pertumbuhan
dapat tumbuh optimal pada pH 8. Proses fotosintesis mengambil karbondioksida terlarut dalam air yang mengakibatkan penurunan kandungan CO2 terlarut dalam
air. Penurunan ini akan meningkatkan nilai pH berkaitan dengan keseimbangan
CO2 terlarut, bikarbonat (HCO3-) dan ion karbonat (CO2-) dalam air
(Golman dan Horne 1983).
Karakterisasi Biomassa Mikroalga
Kutivasi mikroalga pada skala lapang menggunakan sistem statis
(batch system), sistem kultivasi ini paling umum digunakan. Pada sistem statis, kultur dikembangkan selama periode tertentu, kemudian dilakukan pemanenan pada kultur secara keseluruhan. Snell (1991) menyatakan bahwa sistem statis ini bersifat ekstensif dan membutuhkan ruang yang luas dalam pengerjaannya. Sistem ini mempunyai kelebihan yaitu mudah untuk dilakukan. Pemanenan mikroalga dilakukan pada saat OD 0,5 dengan menambahkan 0,3 g/L Al2(SO4)3
pada kultur. Penggunaan tawas pada metode pemanenan alga bertujuan untuk membentuk flok mikroalga agar lebih mudah dilakukan pemisahan antara medium kultur dan biomassa. Tenney et al. (1969) menjelaskan bahwa pemanenan dengan cara flokulasi dapat dilakukan pada mikroalga dengan ukuran 5-5 μm (Lampiran 2).
Yield biomassa kering mikroalga Synechococcus sp. ICBB 9111, mikroalga Chlamydomonas sp. ICBB 9113 dan mikroalga Chlamydomonas sp. ICBB 9114 masing-masing sebesar 0,21 g/L; 0,26 g/L; dan 0,45 g/L. Yield
biomassa mikroalga Chlamydomonas sp. ICBB 9114 lebih tinggi dibandingkan mikroalga Synechococcus sp. ICBB 9111, dan mikroalga Chlamydomonas sp. ICBB 9113. Hal ini dipengaruhi oleh perbedaan unsur NaNO3 media teknis yang
digunakan selama kultivasi (Lampiran 1). Makarevičienė et al. (2011) menyatakan bahwa perbedaan unsur NaNO3 0,75 g/L dan 1,5 g/L sebagai sumber
nitrogen pada media kultivasi dapat mempengaruhi pertumbuhan mikroalga dan biomassa yang dihasilkan. Hasil karakterisasi biomassa kering mikroalga dapat dilihat pada Tabel 1.
Tabel 1 Hasil karakterisasi biomassa mikroalga
Komponen Komposisi biomassa mikroalga (%)
Synechococcus
mikroalga berkisar antara 13,13-17,71%. Karbohidrat tertinggi pada mikroalga
Chlamydomonas sp. ICBB 9113 dan karbohidrat terendah mikroalga
Synechococcus sp. ICBB 9111. Akumulasi karbohidrat umumnya terjadi ketika sel-sel mikroalga hidup dalam kondisi stres (keterbatasan nutrisi), namun jika diberikan nutrisi yang terbatas akan berdampak pada pertumbuhan jumlah sel mikroalga. Kandungan karbohidrat dapat ditingkatkan dengan beberapa cara, yaitu radiasi, pengurangan nitrogen, variasi suhu dan pH, serta penambahan CO2.
Ho et al. (2012) menyatakan bahwa meningkatnya produktivitas karbohidrat mikroalga Scenedesmus obliquus jika dikultivasi pada kondisi tinggi CO2 berkisar
140,4-1420,6 mg/L dan intensitas cahaya 420 µmol foton m-2 s-1 atau 21000 lux.
Hasil pengujian karbohidrat total yang dilakukan dengan metode Luff schrool selanjutnya dikonversi untuk mengetahui kandungan pati pada setiap mikroalga. Chlamydomonas sp. ICBB 9113 memiliki kandungan pati tertinggi yaitu 15,94% dan Synechococcus sp. ICBB 9111 dengan kandungan pati 11,82%. Chen dan Zhang (2012) menjelaskan bahwa pati dihasilkan oleh tumbuhan hijau yang digunakan sebagai sumber energi dan disintesis dalam bentuk granula dan selalu bercampur antara amilosa dan amilopektin. Fotosintesis mikroalga
Chlamydomonas sp pada fase log memiliki aktivitas mengumpulkan granular
α- ,4 dan α-1,6 glikosidik yang memilki bentuk, lokasi seluler, dan tempat penyimpanan yang berbeda (Libessart et al.1995). Pati terdiri dari dua fraksi, yaitu fraksi amilosa dan amilopektin. Fraksi amilosa sifatnya larut dalam air panas dan fraksi amilopektin bersifat tidak larut. Amilosa mempunyai struktur lurus
dengan ikatan α-1.4 glikosidik, sedang amilopektin mempunyai cabang dengan
ikatan α-1.6 glikosidik sebanyak 4–5% dari berat total. Metting (1996) menambahkan mikroalga pada divisi Cyanophyta, Synechococcus sp memiliki dinding sel yang tersususun atas lipolisakarida dan peptidoglikan dan divisi Chlorophyta, Chlamydomonas sp. memiliki dinding sel yang tersusun dari selulosa dan hemiselulosa dengan cadangan makanan pati.
Mikroalga yang mengandung glukosa dengan basis karbohidrat merupakan bahan baku yang sesuai untuk produksi etanol. Kandungan glukosa ketiga mikroalga berkisar antara 3,41-7,93%. Glukosa tertinggi terdapat pada mikroalga Chlamydomonas sp. ICBB 9114 dan yang terendah pada
Synechococcus sp. ICBB 9111. Chu et al. (1982) menyatakan bahwa komponen monosakarida pada mikroalga meliputi glukosa. Glukosa merupakan polimer utama yang dibutuhkan dalam proses fermentasi untuk menghasilkan etanol (Wang et al. 2011).
Kadar air ketiga jenis mikroalga berkisar antara 8,5-10,72%.
Synechococcus sp. ICBB 9111 mempunyai kadar air tertinggi dan
Chlamydomonas sp. ICBB 9114 memiliki kadar air terendah. Kadar air mempengaruhi proses penyimpanan. Menurut Hodge dan Osman (1976) gugus hidrofilik pada molekul pati menyebabkan penyerapan air sesuai dengan kelembaban udara disekitarnya. Secara alami pati mengandung air sekitar 12-14%. Kadar air yang relatif tinggi akan mempercepat kemunduran kualitas bahan. Kadar air pada bahan berpati dibutuhkan karena struktur amorf pati yang memilki sifat hidrofilik akan memudahkan proses gelatinisasi sehingga fraksi amilosa dan amilopektin akan lebih mudah pecah sebelum terjadi mekanisme pemotongan oleh enzim. Menurut Van der Veen et al. (2005) produk berpati dengan kadar air 10-15% dapat meningkatkan isomaltosa pada tahap likuifikasi.
Kadar lemak ketiga jenis mikroalga berkisar antara 0,75-3,74%.
Chlamydomonas sp. ICBB 9113 memiliki kadar lemak terendah, sedangkan
Synechococcus sp. ICBB 9111 memiliki kadar lemak tertinggi. Kadar lemak pada mikroalga dipengaruhi oleh pH, suhu yang ekstrim serta kondisi lingkungan mikroalga hidup. Keberadaan kadar lemak yang tinggi dalam proses hidrolisis dapat mengganggu proses gelatinisasi sebab lemak mampu membuat kompleks yang menyebabkan amilosa tidak dapat keluar dari granula pati (Sunarti 2007). Keberadaan lemak yang tinggi dapat mengganggu proses gelatinisasi karena akan diserap oleh permukaan granula sehingga terbentuk lapisan lemak yang bersifat hidrofobik disekeliling granula.
Pada tahap kultivasi skala lapang media yang digunakan merupakan media teknis yang banyak mengandung mineral. Mineral merupakan senyawa anorganik yang tidak ikut terbakar. Hasil dari pembakaran bahan organik akan menyisakan senyawa anorganik yang sering disebut abu (Winarno 2008). Kadar abu ketiga jenis mikroalga berkisar 30,50 – 43,39 %. Kadar abu terendah Chlamydomonas
sp. ICBB 9113 sedangkan yang tertinggi Synechococcus sp. ICBB 9111. Kadar abu menunjukkan kandungan senyawa logam seperti Cu, Fe, Zn dan Mg. Kadar abu yang tinggi pada mikroalga dapat menghambat proses hidrolisis karena senyawa logam misalnya Cu, Fe, Zn, dan Mg diketahui dapat menjadi inhibitor
enzim (Jahan et al. 2012). Hasil penelitian Linden et al. (2003) menerangkan bahwa mineral Zn dan Ca dapat menghambat aktifitas enzim α-amilase yang di hasilkan mikroorganisme Pyrococcus woesei, dan Sudha (2012) menyatakan
logam Fe, Cu, Zn dan Mn dapat menghambat aktivitas enzim α-amilase dari
Bacillus amyloliquefaciens pada konsentrasi 2, 5, dan 7 g/L.
Karakterisasi Enzim Komersial α-amilase dan Amiloglukosidase
Karakterisasi enzim komersial dilakukan sebelum tahap likuifikasi dan sakarifikasi. Tahap likuifikasi menggunakan α-amilase sedangkan proses sakarifikasi menggunakan amiloglukosidase. Karakterisasi enzim dilakukan untuk mengetahui suhu dan pH optimum, sebelum dilakukan proses hidrolisis pada mikroalga. Enzim sebagai katalis memiliki beberapa kelebihan dibandingkan katalis asam. Beberapa kelebihan enzim yaitu tingkat konversi yang tinggi, rendah polutan, dan reaksinya bersifat spesifik. Enzim α-amilase dapat berasal dari hewan, tumbuhan maupun mikoorganisme. Hasil karakterisasi enzim α-amilase (Tabel 2) dan amiloglukosidase (Tabel 3).
-amilase komersial yang mempuyai aktivitas pada suhu tinggi diduga berasal dari mikroorganisme contoh Bacillus licheniformis. Menurut Bozic et al. (2011) enzim
α-amilase yang berasal dari B. licheniformis umumnya memiliki aktivitas optimum pada pH 6,5 dan suhu 90oC. Menurut Naz 2 2 α-amilase yang berasal dari Bacillus licheniformis memiliki pH kisaran optimum pada 5-7.
Tabel 2 Hasil karakterisasi enzim α-amilase
Jenis
Tabel 3 Hasil karakterisasi enzim amiloglukosidase
Jenis
Hasil karakterisasi enzim amiloglukosidase terbaik diperoleh pada pH 5,5
dan suhu 60oC dengan aktivitas enzim 148,59 U/mL. Hasil penelitian Choi et al. (2010) enzim amiloglukosidase memiliki aktivitas enzim terbaik pada
pH 5,5 dengan suhu 55oC. Akyuni (2004) menyatakan bahwa enzim amiloglukosidase optimum pada pH 4,5 dengan suhu 60oC. Naz (2002) menyatakan bahwa enzim amiloglukosidase umumnya diperoleh dari mikroorganisme misalnya kapang atau khamir. Enzim komersial ini biasanya berasal dari Aspergillus niger.
Proses Hidrolisis Mikroalga
Proses hidrolisis diawali menggunakan enzim α-amilase dengan pH dan suhu optimum pada larutan mikroalga. Tahap ini umumnya dikenal dengan tahap likuifikasi. Thomas dan Atwell (1999) menyatakan likuifikasi merupakan proses pencairan pati yang telah mengalami gelatinisasi. Gelatinisasi dapat diperoleh dengan melakukan pemanasan pati di dalam air sehingga granula pati mulai mengembang selanjutnya kekentalannya meningkat. Adanya proses gelatinisasi menyebabkan ikatan antar molekul pati lebih lemah sehingga kerja enzim dapat lebih mudah.
berat kering maka hidrolisis tidak menjadi efisien karena meningkatnya viskositas tergelatinisasi. Produk yang dihasilkan oleh pemotongan enzim α-amilase adalah glukosa, maltosa atau ikatan gula lain yang memiliki rantai lebih panjang (Bastian 2011). Hasil hidrolisis mikroalga Synechococcus sp. ICBB 9111,
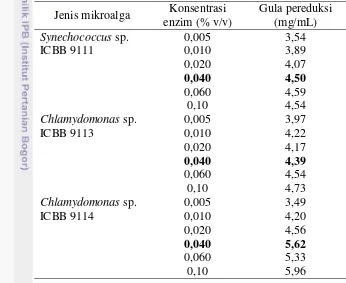
Chlamydomonas sp. ICBB 9113 dan Chlamydomonas sp. ICBB 9114 menggunakan enzim α-amilase dapat dilihat pada Tabel 4.
Tabel 4 Hasil hidrolisis empat jenis mikroalga menggunakan konsentrasi enzim
α-amilase yang berbeda
Hidrolisis dilakukan secara bertingkat disebabkan oleh perbedaan suhu dan pH aktivitas enzim α-amilase dan amiloglukosidase. Suhu dan pH yang
digunakan pada hidrolisis menggunakan enzim α-amilase adalah 90oC dan pH 7, sedangkan enzim amiloglukosidase pada suhu 60oC dan pH 5,5. Perbedaan suhu dan pH mempengaruhi aktivitas atau kinerja enzim dalam proses likuifikasi dan sakarifikasi mikroalga, hal ini menyebabkan kedua enzim tidak dapat digunakan secara simultan. Choi et al. (2010) menjelaskan bahwa hidrolisis enzimatik mikroalga Chlamydomonas reinhardtii secara terpisah membuat struktur karbohidrat mikroalga lebih mudah diakses oleh enzim. Selain itu Montesinos dan Navarro (2000) menambahkan bahwa struktur pati lebih mudah dihidrolisis oleh
enzim α-amilase. Sedangkan Chouvel et al. (1983) proses likuifikasi dengan
1.00
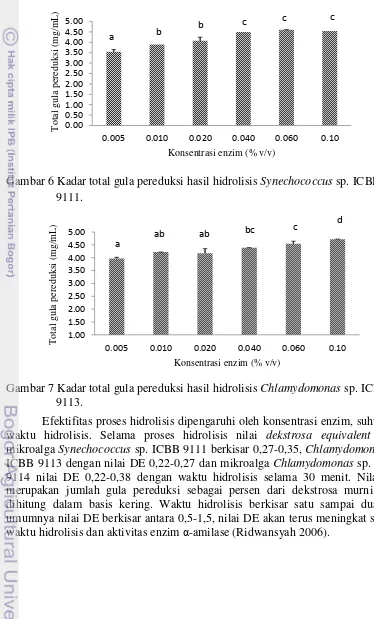
Total gula pereduksi yang dihasilkan berbeda untuk setiap mikroalga. Total gula pereduksi tertinggi yang dihasilkan mikroalga Synechococcus sp. ICBB 9111 4.59 mg/mL pada konsentrasi enzim 0.060%. Hasil analisis ragam terhadap total gula pereduksi menunjukkan perbedaan yang nyata antar perlakuan. Konsentrasi enzim 0.040% merupakan konsentrasi terbaik (p<0.05) pada hidrolisis mikroalga Synechococcus sp. ICBB 9111 (Gambar 6).
Gambar 6 Kadar total gula pereduksi hasil hidrolisis Synechococcus sp. ICBB 9111.
Gambar 7 Kadar total gula pereduksi hasil hidrolisis Chlamydomonas sp. ICBB 9113.
0.00
Gambar 8 Kadar total gula pereduksi hasil hidrolisis Chlamydomonas sp. ICBB 9114.
Mikroalga Chlamydomonas sp. ICBB 9113 memiliki total gula pereduksi yang tidak jauh berbeda dibandingkan dengan mikroalga Synechococcus sp. ICBB 9111 dan Chlamydomonas sp. ICBB 9114. Total gula pereduksi tertinggi terdapat pada isolat mikroalga Chlamydomonas sp. ICBB 9113 adalah 4,73 mg/mL dengan konsentrasi enzim 0,10%. Hasil analisis ragam terhadap total gula pereduksi menunjukkan perbedaan yang nyata antar perlakuan (p<0,05). Konsentrasi enzim 0,040% merupakan konsentrasi terbaik pada hidrolisis mikroalga
Chlamydomonas sp. ICBB 9113 dengan total gula pereduksi sebesar 4,39 mg/mL (Gambar 7), sedangkan pada mikroalga Chlamydomonas sp. ICBB 9114 total gula pereduksi yang dihasilkan berkisar antara 3,49-5,96 mg/mL. Total gula pereduksi
tertinggi dihasilkan oleh hidrolisis enzim α-amilase dengan konsentrasi 0,10%. Hasil analisis ragam terhadap total gula pereduksi menunjukkan perbedaan yang nyata antar perlakuan (p<0,05). Konsentrasi terbaik pada hidrolisis mikroalga
Chlamydomonas sp. ICBB 9114 adalah 0,040% dengan total gula pereduksi 5,62 mg/mL (Gambar 8).
Total gula pereduksi yang dihasilkan selama proses hidrolisis menggunakan enzim α-amilase lebih rendah jika dibandingkan dengan proses hidrolisis mengunakan asam sulfat (H2SO4). Mikroalga Synechococcus sp. ICBB
9111, Chlamydomonas sp. ICBB 9113 dan Chlamydomonas sp. ICBB 9114 yang dihidrolisis menggunakan asam sulfat dengan konsentrasi 0,4 M menghasilkan total gula pereduksi 6,95 mg/mL, 7,53 mg/mL dan 6 mg/mL (desk study). Total gula pereduksi yang rendah disebabkan oleh kinerja enzim α-amilase hanya mampu memutus ikatan α-1,4 glikosidik (Biotol 1991). Hidrolisis menggunakan asam sulfat memungkinkan untuk memutus seluruh ikatan α-1,4 dan α-1,6 glikosidik dan fraksi non pati contoh selulosa.
Proses hidrolisis akan berjalan dengan baik jika dilakukan pada kondisi
suhu, pH, konsentrasi substrat dan dosis enzim yang stabil (Harun dan Danquah 2011). Nilai pH pada ketiga mikroalga mengalami
perubahan setelah proses hidrolisis menggunakan enzim α-amilase. Nilai pH mikroalga Synechococcus sp. ICBB 9111 setelah proses hidrolisis mengalami penurunan berkisar 5,94-6,13, mikroalga Chlamydomonas sp. ICBB 9113 dengan nilai pH berkisar 6,28-6,40, sedangkan mikroalga Chlamydomonas sp. ICBB 9114 nilai pH setelah hidrolisis yaitu 8,32-8,71. Perubahan nilai pH yang bervariasai dapat menyebabkan rendahnya konversi pati khususnya fraksi amilosa pada ketiga
mikroalga selama hidrolisis menggunakan enzim α-amilase. Enzim α-amilase memiliki aktivitas optimum pada pH 7. Bastian (2011) menjelaskan bahwa
menunjukkan mekanisme pemotongan pati yang belum sempurna karena hanya
fraksi amilosa yang dikonversi menjadi gula sederhana oleh enzim α-amilase. Proses hidrolisis dilanjutkan dengan penambahan enzim amiloglukosidase (AMG), tahap ini umumnya dikenal dengan proses sakarifikasi. Sakarifikasi merupakan proses lanjutan setelah likuifikasi yang bertujuan untuk meningkatkan pembentukan gula-gula sederhana dari hasil likuifikasi. Enzim amiloglukosidase dapat memotong fraksi amilopektin. Amilopektin merupakan struktur komposisi terbesar pada pati setelah amilosa. Secara struktural, amilopektin terbentuk dari rantai glukosa yang terikat dengan ikatan α-1,4 glikosidik, sama dengan amilosa. Namun pada amilopektin terbentuk cabang-cabang dengan ikatan α-1,6 glikosidik (Myers et al. 2000).
Konsentrasi enzim amiloglukosidase yang akan digunakan pada proses sakarifikasi terlebih dahulu diuji pada tiga konsentrasi yang berbeda yaitu 0,10%, 0,20% dan 0,40% pada pH 5,5 dengan suhu 60oC selama 55 menit. Hasil analisis ragam terhadap total gula pereduksi menunjukkan perbedaan yang nyata antar perlakuan (p<0,05). Penggunaan enzim amiloglukosidase pada konsentrasi 0,40% menghasilkan total gula pereduksi tertinggi yaitu 43,78 mg/mL, diikuti konsentrasi 0,20% sebesar 37,02 mg/mL dan 0,10% dengan total gula pereduksi
Penambahan enzim α-amilase dan amiloglukosidase tidak dilakukan secara bersamaan selama proses hidrolisis. Enzim α-amilase terlebih dahulu digunakan dengan konsentrasi yang berbeda pada pH 7 dengan suhu 90oC selama 30 menit, dilanjutkan dengan proses hidrolisis menggunakan enzim amiloglukosidase pad kondisi pH 5,5 dengan suhu 60oC selama 55 menit.
Kombinasi hidrolisis enzim α-amilase dan amiloglukosidase pada mikroalga
0
enzim α-amilase dan amiloglukosidase pada hidrolisis mikroalga
Chlamydomonas reinhardtii dapat meningkatkan rendemen gula pereduksi dari 25,21 mg/mL menjadi 57 mg/mL. Konsentrasi enzim amiloglukosidase terbaik
selanjutnya digunakan pada proses hidrolisis dengan kombinasi enzim α-amilase.
Hasil hirolisis dengan kombinasi enzim α-amilase dan amiloglukosidase dapat dilihat pada Tabel 5.
Hidrolisis mikroalga Synechococcus sp. ICBB 9111 menghasilkan total gula pereduksi tertinggi pada penggunaan enzim dengan konsentrasi 0,060% (37,41 mg/mL). Hasil analisis ragam pada total gula pereduksi menunjukkan perbedaan yang nyata antar perlakuan (p<0,05). Perlakuan konsentrasi terbaik pada hidrolisis mikroalga Synechococcus sp. ICBB 9 yaitu , 4 enzim α -amilase yang dikombinasikan dengan enzim amiloglukosidase 0,4% menghasilkan total gula pereduksi 35,64 mg/mL.
Gambar 9 Kadar total gula pereduksi hasil hidrolisis dengan kombinasi enzim
α-amilase dan amiloglukosidase mikroalga Synechococcus sp. ICBB 9111.
Hidrolisis terhadap mikroalga Chlamydomonas sp. ICBB 9113 meningkatkan rendemen total gula pereduksi yang dihasilkan. Total gula pereduksi tertinggi dihasilkan pada konsentrasi 0,060% (40,06 mg/mL). Hasil analisis ragam pada total gula pereduksi menunjukkan perbedaan nyata antar perlakuan (p<0,05). Penggunaan konsentrasi enzim α-amilase 0,040% dengan kombinasi enzim amiloglukosidase 0,4% pada hidrolisis mikroalga
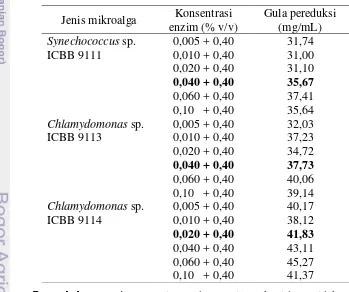
Chlamydomonas sp. ICBB 9113 merupakan perlakuan terbaik (rendemen gula pereduksi 37,73 mg/mL). Peningkatan rendemen gula sederhana yang dihasilkan menunjukkan efektifitas kombinasi kedua enzim. Enzim α-amilase memutus
ikatan α-1,4 glikosidik dengan produk akhir glukosa, maltosa, maltoriosa, maltoheksosa, maltopentosa. Konversi glukosa yang dihasilkan oleh enzim α
0
α-amilase dan amiloglukosidase mikroalga Chlamydomonas sp. ICBB 9113.
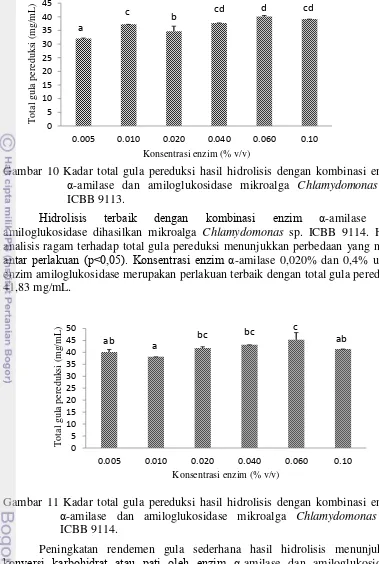
Hidrolisis terbaik dengan kombinasi enzim α-amilase dan amiloglukosidase dihasilkan mikroalga Chlamydomonas sp. ICBB 9114. Hasil analisis ragam terhadap total gula pereduksi menunjukkan perbedaan yang nyata
antar perlakuan p< , 5 . Konsentrasi enzim α-amilase 0,020% dan 0,4% untuk enzim amiloglukosidase merupakan perlakuan terbaik dengan total gula pereduksi 41,83 mg/mL.
Gambar 11 Kadar total gula pereduksi hasil hidrolisis dengan kombinasi enzim
α-amilase dan amiloglukosidase mikroalga Chlamydomonas sp. ICBB 9114.
Peningkatan rendemen gula sederhana hasil hidrolisis menunjukkan
konversi karbohidrat atau pati oleh enzim α-amilase dan amiloglukosidase. Karbohidrat total dan kadar pati pada ketiga mikroalga setelah proses hidrolisis dapat dilihat pada Tabel 6. Konversi pati menjadi gula sederhana pada mikroalga
Synechococcus sp. ICBB 9111, Chlamydomonas sp. ICBB 9113 dan mikroalga
Chlamydomonas sp. ICBB 9114 mencapai 90-93%. Perlakuan terbaik hasil
0
Tabel 6 Komposisi karbohidrat total setelah proses hidrolisis Komponen Synechococcus
Proses fermentasi merupakan proses biokimiawi yang menyebabkan perubahan atau reaksi kimia dengan bantuan agen mikroorganisme. Proses fermentasi mengubah gula sederhana menjadi alkohol (etanol). Proses fermentasi substrat yang digunakan adalah filtrat hasil hidrolisis mikroalga Synechococcus
sp. ICBB 9111, Chlamydomonas sp. ICBB 9113 dan Chlamydomonas sp. ICBB 9114.
Gambar 12 Total gula pereduksi dan nilai pH ketiga jenis mikroalga selama
fermentasi Synechococcus sp. ICBB 9111,
Chlamydomonas sp. ICBB 9113, Chlamydomonas sp. ICBB 9114; pH hidrolisat Synechococcus sp ICBB 9111,
pH hidrolisat Chlamydomonas sp. ICBB 9113, pH hidrolisat Chlamydomonas sp. ICBB 9114. .
Selama proses fermentasi terjadi penurunan gula pereduksi untuk ketiga jenis mikroalga. Laju fermentasi ketiga jenis mikroalga pada fase awal sampai memasuki 24 jam ditandai dengan penurunan gula sederhana yang cepat. Konsentrasi gula sederhana pada hidrolisat ketiga mikroalga pada awal fermentasi berkisar 40,4 – 48,5 mg/mL dan terus menurun sampai pada hari ke-4 menjadi 15,5 - 18 mg/mL, selanjutnya proses penurunan gula pereduksi cenderung statis. Arnata (2009) menyatakan laju fermentasi yang lambat mengindikasikan terbentuknya etanol, asam, dan menurunnya konsentrasi substrat (Gambar 1).
Selama proses fermentasi nilai pH terjadi perubahan. pH ideal untuk fermentasi alkoholik adalah pH 4-6 (Adams et al. 2011).
Fermentasi alkohol dipengaruhi oleh substrat atau jenis gula yang
digunakan, karena tidak semua gula sederhana dapat dikonsumsi oleh
Saccharomyces cereviceae. Jenis gula sederhana yang dapat digunakan dalam proses fermentasi adalah glukosa, fruktosa, dan galaktosa. Selama empat hari proses fermentasi gula sederhana yang tersisa dari hidrolisat ketiga jenis mikroalga adalah maltoheptosa berkisar 0,30-0,39%. Hal ini menunjukkan proses hidrolisis enzimatik belum berjalan dengan sempurna. Maltoheptosa merupakan komponen oligosakarida yang memiliki rantai karbon lebih panjang. Komponen gula yang merupakan non fermentable sugar misalnya maltoheptosa tidak dapat dimanfaatkan oleh khamir untuk diubah menjadi etanol (Rusdianto 2010). Hasil fermentasi selama 96 jam pada tiga mikroalga dapat dilihat pada Tabel 7.
Tabel 7 Hasil etanol dan metanol tiga jenis mikroalga
Jenis mikroalga
Rendemen etanol tertinggi selama fermentasi pada mikroalga
Chlamydomonas sp. ICBB 9113 sebesar 980 ppm atau 49% dari 2 g biomassa mikroalga, sedangkan rendemen etanol terendah pada mikroalga Chlamydomonas
sp. ICBB 9114 sebesar 516 ppm atau 25,8% dari 2 g biomassa mikroalga. Hasil penelitian Choi et al. (2010) menjelaskan bahwa hidrolisis dan fermentasi terpisah mikroalga Chlamydomonas reinhardtii menghasilkan etanol 23.5% dari 1 g biomassa. Jenis alkohol lain yang ditemukan pada hidrolisat ketiga mikroalga setelah proses distilasi adalah metanol berkisar 4,8-5,9%. Jenis mikroorganisme dalam proses fermentasi merupakan faktor yang mempengaruhi produk alkohol yang dihasilkan. Efremenko et al. (2012) menjelaskan bahwa proses fermentasi anaerob menggunakan bakteri Clostridium acetobutylicum pada mikroalga
Spirulina platensis menghasilkan alkohol jenis butanol. Kim et al. (2011)
menjelaskan bahwa sakarifikasi dan fermentasi simultan menggunakan
S. cerevieae dan E.coli KO11 selama 116 jam pada alga Laminaria japonica
menghasilkan etanol 0,4 g/g gula. Hasil penelitian Harun et al. (2010) menyatakan bahwa fermentasi yang dilakukan menggunakan Saccharomyces bayanus selama 60 jam pada mikroalga Chlorococum sp. menghasilkan etanol dengan konsentrasi 3,83 g/L.
Efisiensi proses fermentasi yang rendah dalam konversi gula sederhana oleh S.cereviceae ICBB 8808 menjadi etanol diduga disebabkan tingginya konsentrasi gula dan proses pemanasan pada saat sterilisasi hidrolisat mikroalga. Scragg (1991) menyatakan bahwa substrat misalnya glukosa yang tinggi dapat menghambat proses pertumbuhan. Konsentrasi gula yang tinggi (40-300 mg/mL) akan menyebabkan tekanan osmotik dalam media menyebabkan sel mengalami dehidrasi (plasmolisis). Proses pemanasan dapat mengubah kandungan gula dalam substrat menjadi senyawa inhibitor contohnya furfural dan hydroxymethylfurfural
4 KESIMPULAN DAN SARAN
Kesimpulan
Penggunaan kombinasi enzim komersial α-amilase dan amiloglukosidase menghasilkan nilai gula pereduksi yang lebih tinggi jika dibandingkan dengan menggunakan satu jenis enzim komersial α-amilase pada proses hidrolisis. Konsentrasi enzim α-amilase terbaik untuk mikroalga Synechococcus sp. ICBB 9111, Chlamydomonas sp. ICBB 9113, dan Chlamydomonas sp. ICBB 9114 berturut-turut adalah 0,040; 0,040; dan 0,020% yang dikombinasi dengan enzim amiloglukosidase 0,4% menghasilkan gula pereduksi masing-masing sebesar 35,67; 37,73; dan 41,83 mg/mL, sedangkan hasil fermentasi pada ketiga jenis mikroalga dihasilkan masing-masing etanol sebesar 928 ppm, 980 ppm, dan 516 ppm. Gula sederhana yang tersisa dalam proses fermentasi yaitu maltoheptosa sebesar 4820 -5860 ppm dari ketiga mikroalga menunjukkan proses hidrolisis dan fermentasi belum berjalan dengan efektif.
Saran
Kadar karbohidrat yang rendah merupakan salah satu faktor penyebab rendahnya rendemen etanol yang dihasilkan selain faktor hidrolisis dan fermentasi. Kadar karbohidrat yang rendah pada mikroalga dapat disebabkan oleh media kultivasi, intensitas cahaya yang fluktuatif selama kultivasi, atau rendahnya CO2 pada perairan yang belum tepat, sehingga disarankan pada penelitian
selanjutnya untuk melakukan:
1 Optimasi media pertumbuhan mikroalga serta perlakuan kondisi abiotik seperti intensitas cahaya, CO2 dalam kultivasi untuk meningkatkan kadar
karbohidrat mikrolaga.
2 Kajian penggunaan metode pemanenan yang tepat misalnya elektrokoagulan, ultrafiltrasi, dan flokulasi untuk mendukung produksi biomassa yang lebih besar dan ekonomis.
3 Optimasi hidrolisis menggunakan enzim β-amilase dan enzim pullunase yang
dikombinasikan dengan enzim α-amilase dan amiloglukosidase sehingga hasil gula pereduksi yang dihasilkan lebih spesifik yaitu glukosa.
DAFTAR PUSTAKA
Adams JM, Toop TA, Gallagher JM, Donnison LS. 2011. Seasonal variation in
Laminaria digitata and its impact on biochemical conversion routes to biofuels. Bioresource Technology Journal. 102: 9976–9984. doi:10.1016/j.biortech.2011.08.032.
[AOAC] Association of Official Analytical Chemist. 2007. Official of Analysis of
the Association of Official Analytical of Chemist. Arlington (USA). The Association of Official Analytical of Chemist, Inc.
[AOAC] Association of Official Analytical Chemist. 1984. Official Methods of Analysis. Official of Analysis of the Association of Official Analytical of Chemist. Arlington. The Association of Official Analytical of Chemist, Inc.
Ardiles S. 2011. Produksi lipid dan karbohidrat ganggang mikro asal sawah dan perairan tawar yang dikultivasi pada skala lapang [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Allard B, Tazi A. 1993. Influence of growth status on composition of extracellular polysaccharides from two Chlamydomonas species. Phytochemistry Journal. 32: 41–7.
Arisanti D. 2012. Produksi karbohidrat, protein, dan lipid mikroalga terseleksi pada kolam sistem raceway: penggunaan kombinasi Za-NaNO3 dan
SP-36-K2HPO4 sebagai unsur Hara N dan P [tesis]. Bogor (ID): Institut Pertanian
Bogor.
Arnata IW. 2009. Pengembangan alternatif teknologi bioproses pembuatan etanol dari ubi kayu menggunakan Trichoderma viride, Aspergillus niger dan
Saccharomyces cerevisiae [tesis]. Bogor (ID): Institut Pertanian Bogor. Bastian F. 2011. Teknologi Pati dan Gula. Makassar (ID). Universitas
Hasanuddin
Bernfeld P. 955. mylase α and β. Methods in Enzymology. 1: 149-151. doi:10.1016/0076-6879(55)01021-5.
Blinks LR.1963.The effect of pH upon the photosynthesis of littoral marine algae.
Protoplasma Journal. 57: 126-136.
Bozic N, Ruiz J, Lopez-Santin J, Vujcic Z. 2011. Production and properties of the
highly efficient raw starch digesting α-amylase from a Bacillus licheniformis
ATCC 9945. Biochemical Engineering. 53: 203–209. doi:10.1016/j.bej.2010.10.014.
Chandel AK, Chan ES, Rudravaram R, Narasu ML, Rao1 LV and Ravindra P. 2007. Economics and environmental impact of bioethanol production technologies: an Appraisal. Biotechnology and Molecular Biology Journal.
2(1): 014-032.
Cheirsilp B, Torpee S. 2012. Enhanced growth and lipid production of microalgae under mixotrophic culture condition: Effect of light intensity, glucose concentration and fed-batch cultivation. Bioresource Technology Journal.
110: 510–516. doi:10.1016/j.biortech.2012.01.125.
Chen G, Zhang B. 2012.Hydrolysis of granular corn starch with controlled pore size. Chen G, Zhang B. Journal of Cereal Science. 56: 316-320. doi:10.1016/j.jcs.2012.01.011.
Chisti Y. 2007. Biodiesel from microalgae. Biotechnology Advances Journal.
25: 294-306.doi:10.1016/j.biotechadv.2007.02.001.
Choi SP, Nguyen MT, Sim SJ. 2010. Enzymatic pretreatment of
Chlamydomonas reinhardtii biomass for ethanol production. Bioresource Technology Journal. 101: 5330-5336.doi:10.1016/j.biortech.2010.02.026. Chouvel H, Chay PB, Cheftel JC. 1983. Enzymatic hydrolysis of starch and cereal
flours at intermediate moisture contents in a continuous extrusion reactor.
Lebensmittel Technology .16:346 –53.
Chu FLE, Dupuy JL, Webb KL. 1982. Polysaccharide composition of five algal species used as food for larvae of the American oyster, Crassostrea virginica.
Aquaculture Journal. 29: 241-252.
Demirbas A. 2005. Bio-ethanol from cellulosic materials: a renewable motor fuel from biomass. Energy Source Journal. 27: 327-37. doi: 10.1080/00908310390266643.
Dubois M, Gilles KK, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric Method for Determination of Sugars and Related Substances. Analytical Chemistry Journal. 28 : 350.
Goldman CR dan Horne R. 1983. Limnology. New York (US): Mc. Graw Hill International Book Company.
Efremenko E, Nikolskaya A, Lyagin I, Senko O, Makhlis T, Stepanov N, Maslova O, Mamedova F, Varfolomeev S. 2012. Production of biofuels from pretreated microalgae biomass by anaerobic fermentation with immobilized
Clostridium acetobutylicum cells. Bioresource Technology Journal. 114: 342-348.http://dx.doi.org/10.1016/j.biortech.2012.03.049.
Harun R, Danquah MK. 2011. Enzymatic hydrolysis of microalgal biomass for bioethanol production. Chemical Engineering Journal. 168: 1079-1084. doi:10.1016/j.cej.2011.01.088.
Hodge JE dan EM Osman. 1976. Carbohydrates, p.41. In OR Fennema. Principle of Food Science. New York: Marcel Dekker Inc.
Ho SH, Chen CY, Lee DJ, Chang JS. 2011. Perspectives on microalgal CO2-emission mitigation systems -A review. Biotechnology Advances Journal.
29: 189-198.doi:10.1016/j.biotechadv.2010.11.001.
Ho SH, Chen CY, Chang JS. 2012. Effect of light intensity and nitrogen starvation on CO2 fixation and lipid/carbohydrate production of an indigenous microalga Scenedesmus obliquus CNW-N. Bioresource Technology Journal. 113: 244-52. doi:10.1016/j.biortech.2011.11.133.
Horvarth HS, Franzen CJ, Taherzadeh MJ, Niklasson C, Liden G. 2003. Effect of fulfural on the respitory metabolism of S. cerevisiae in glucose-limited chemostats. Applied and Environmental Microbiology Journal. 69 (7): 4076-4086.doi: 10.1128/AEM.69.7.4076–4086.2003.
Jahan SMG, Pervin MS, M. Shovon S, Dev Sharma SC, Roy N, Rahman MH. 2012. Effect of metal ions, chelating agent and sh-reagents on radish (Raphanus sativus L.) root β-Amylase. Journal of Stress Physiology & Biochemistry. 8: 3.
John RP, Anisha GS. Nampoothiri KM ,Pandey A. 2011. Micro and macroalgal biomass: A renewable source for bioethanol. Bioresource Technology Journal. 102: 186–193. doi:10.1016/j.biortech.2010.06.139.
[KESDM] Kementrian Energi dan Sumber Daya Mineral. 2013. Peraturan Menteri Energi dan Sumber Daya Mineral Nomor 25 tentang pemanfaatan, dan tata niaga bahan bakar nabati (biofuel) sebagai bahan bakar lain. Jakarta. [KESDM] Kementrian Energi dan Sumber Daya Mineral. 2012. Direktorat
Jenderal Minyak dan Gas . Statistik minyak bumi. Jakarta.
Kim NJ, Li H, Jung K, Chang HN, Lee PC. 2011. Ethanol production from marine algal hydrolysates using Escherichia coli KO11. Bioresource Technology Journal. 102: 7466–7469. doi:10.1016/j.biortech.2011.04.071.
Kumar P, Barrett DM, Delwiche MJ, Stroeve P. 2009. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production,
Industrial & Engineering Chemistry Research Journal. 48: 3713–3729. doi: 10.1021/ie801542g.