AKTIVITAS PENGHAMBATAN
Candida
albicans
OLEH
EKSTRAK DAUN SIRIH HIJAU (
Piper betle
, Linn)
DWI FAUZIAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul AKTIVITAS PENGHAMBATAN Candidaalbicans OLEH EKSTRAK DAUN SIRIH HIJAU (Piper betle, Linn) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
Dwi Fauziah
ABSTRAK
DWI FAUZIAH. AKTIVITAS PENGHAMBATAN Candida albicans OLEH EKSTRAK DAUN SIRIH HIJAU (Piper betle, Linn). Dibimbing oleh MARIA BINTANG dan SYAEFUDIN.
Daun sirih hijau dikenal sebagai desinfektan yang mampu menghambat pertumbuhan bakteri dan jamur. Penelitian sebelumnya menunjukkan bahwa ekstrak air dan etanol daun sirih hijau mempunyai aktivitas menghambat C. albicans. Penelitian ini bertujuan untuk mengukur aktivitas penghambatan C. albicans dari ekstrak daun sirih hijau dengan menggunakan pelarut yang berbeda secara in vitro dan menentukan Konsentrasi Hambat Minimum (KHM) serta menentukan senyawa bioaktif yang berperan menghambat C. albicans. Ekstrak daun sirih hijau yang digunakan adalah ekstrak akuades, etanol 70 %, dan aseton. Konsentrasi yang digunakan adalah 25, 50, 100, 200, dan 400 mg/mL. Hasil uji menunjukkan ekstrak aseton memiliki aktivitas penghambatan yang terbaik pada konsentrasi 400 mg/mL dengan diameter zona hambat 23.483 mm dan nilai KHM 12.5 mg/mL dengan diameter zona hambat 1.742 mm. Analisis statistik menunjukkan bahwa perbedaan dari pelarut dan variasi konsentrasi yang diujikan memberikan pengaruh nyata terhadap diameter zona hambat. Ekstrak aseton dianalisis dengan Pyrolysis GC-MS menghasilkan tiga senyawa terbesar yaitu turunan asam benzoat, fenol, dan eikosena yang bersifat sebagai menghambat C. albicans.
Kata kunci: antijamur, C. albicans, ekstrak daun sirih hijau
ABSTRACT
DWI FAUZIAH. Inhibitory activity of Candida albicans by using of green betel leaf extract (Piper betle, Linn). Supervised by MARIA BINTANG and SYAEFUDIN
Green betel leaf is knowed as disinfectant and able to inhibit bacterial and fungi. The last research showed that green betel leaf extract by aquadest and ethanol had inhibitory activity of C. albicans. The aims of this research was to measure of inhibitory activity of C. albicans from green betel leaf extract in vitro
and the Minimum of Inhibitory Concentrtation (MIC) with to decide bioactive compounds that inhibit C. albicans. This study used green betel leaf extracted by aquadest, 70 % ethanol, and acetone. The concentration of each extract used from 25, 50, 100, 200, 400 mg/mL and showed that the optimum activity occurred on the acetone extract at a concentration of 400 mg/mL with diameter of inhibition 23.483 mm and at MIC 12,5 mg/mL with diameter of inhibition 1.742 mm. Statistical analysis the difference solvents and variation of concentration showed significant effect on diameter of inhibition. Acetone extract was analyzed by
Pyrolysis GC-MS and produced inhibitor compounds namely derivative of benzoic acid, phenol, and eicosene.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS PENGHAMBATAN
Candida albicans
OLEH
EKSTRAK DAUN SIRIH HIJAU (
Piper betle
, Linn)
DWI FAUZIAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas penghambatan Candida albicans oleh ekstrak daun sirih hijau (Piper betle, Linn)
Nama : Dwi Fauziah NIP : G84100065
Disetujui oleh
Prof Dr drh Maria Bintang, MS Pembimbing I
Syaefudin, SSi, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika M App Sc Ketua Departemen
PRAKATA
Puji dan syukur kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga karya ilmiah yang berjudul Aktivitas Penghambatan
Candida albicans oleh Ekstrak Daun Sirih Hijau (Piper betle, Linn) dapat terselesaikan dengan baik. Karya ilmiah ini memberikan deskripsi mengenai topik penilitian yang telah dilakukan dari bulan Desember 2013 hingga April 2014 di Laboratorium Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Diagnostik Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada pembimbing penelitian dan skripsi Prof Dr drh Maria Bintang MS dan Syaefudin SSi M.Si atas segala arahan dan bimbingannya kepada penulis. Ucapan terima kasih tak lupa penulis berikan kepada Mba Eli, Pak Agus, Kak Merry Bik 46, Bu Merri, Pak Nana, dan Pak Yadi, serta teman – teman Biokimia 47 terutama teman-teman satu penelitian (Dwi Ayu, Puji, dan Nazula). Terakhir penulis ucapkan terimakasih kepada ibu dan kakak serta keluarga yang senantiasa selalu mendukung dan memberi motivasi setiap harinya. Semoga karya ilmiah ini dapat bermanfaat baik bagi penulis maupun pembaca.
Bogor, April 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Waktu dan Tempat 2
Alat dan Bahan 2
Prosedur Percobaan 2
HASIL 6
Kadar Air, Kadar Abu, Kadar Abu Bobot Kering, dan Rendemen 6
Senyawa Fitokimia Ekstrak Daun Sirih Hijau 7
Aktivitas Penghambatan C. albicans Ekstrak Daun Sirih Hijau 7
Konsentrasi Hambat Minimum(KHM) 8
Analisis GC-MS Ekstrak Aseton Daun Sirih Hijau 9
PEMBAHASAN 11
Kadar Air, Kadar Abu, Kadar Abu Bobot Kering, dan Rendemen 11
Senyawa Fitokimia Ekstrak Daun Sirih Hijau 12
Aktivitas Penghambatan C. albicans Ekstrak Daun sirih Hijau dan KHM 14
Analisis GC-MS Ekstrak Aseton Daun Sirih Hijau 15
SIMPULAN 15
SARAN 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1 Kadar air, kadar abu, kadar abu bobot kering simplisia daun sirih hijau
dan rendemen 7
2 Analisis uji fitokima ekstrak daun sirih hijau 7
3 Senyawa-senyawa yang diduga dari masing-masing puncak pada
kromatogram ekstrak aseton daun sirih hijau 11
DAFTAR GAMBAR
1 Diameter zona hambat C. albicans 8
2 Diameter zona hambat minimum C. albicans pada ekstrak akuades 9 3 Diameter zona hambat minimum C. albicans pada ekstrak etanol 70 % 9 4 Diameter zona hambat minimum C. albicans pada ekstrak aseton 10 5 Kromatogram kromatografi gas ekstrak aseton daun sirih hijau 10
DAFTAR LAMPIRAN
1 Rendemen simplisia daun sirih hijau 20
2 Analisis kadar air 20
3 Analisis kadar abu dan kadar abu bobot kering 20
4 Aktivitas diameter zona hambat terhadap C.albicans 21 5 Analisis statistik diameter zona hambat terhadap C. albicans
21 6 Diameter zona hambat KHM ekstrak akuades terhadap C. albicans 22 7 Analisis statistik KHM ekstrak akuades terhadap C. albicans 23 8 Diameter zona hambat KHM ekstrak etanol 70 % terhadap C.albicans 23 9 Analisis statistik KHM ekstrak etanol 70 % terhadap C. albicans 24 10 Diameter zona hambat KHM aseton terhadap C.albicans 24 11 Analisis statistik KHM ekstrak aseton terhadap C. albicans 25
12 Diameter zona hambat nistatin 1.028 mg/mL 25
13 Dokumentasi penelitian uji antijamur 26
PENDAHULUAN
Candidiasis merupakan penyakit yang disebabkan infeksi jamur Candida albicans yang bersifat akut atau sub akut sebagai infeksi candidiasis kulit (Jawetz
et al. 2005). Infeksi C. albicans pada rongga mulut tampak sebagai bercak putih pada gingiva, lidah, dan membran mukosa oral yang jika dikerok meninggalkan permukaan merah dan berdarah dengan faktor utama candidiasis adalah rendahnya daya tahan tubuh hospes (Leepel et al. 2009). Kasus infeksi yang disebabkan oleh
Candida meningkat dua dekade terakhir 70-80 % yang disebabkan oleh C. albicans akibat meningkatnya penggunaan antibiotik spektrum luas dan peningkatan kasus defisiensi imun (Herawati 2006). Kondisi normal, jamur ini terdapat di kulit maupun dalam liang kemaluan wanita. Keputihan menjadi salah satu tanda atau gejala adanya kelainan pada organ reproduksi wanita. Candida
tumbuh paling subur pada permukaan yang hangat dan basah. Secara mikroskopik, lesi pada infeksi Candida mengandung sel-sel jamur, hifa dan pseudohifa dengan inflamasi akut serta kronik (Mitchell et al. 2006).
Obat tradisional merupakan salah satu warisan budaya bangsa Indonesia yang sudah digunakan selama berabad-abad. Adanya kecenderungan “back to nature” membawa tumbuhan untuk kembali dimanfaatkan sebagai obat herbal.
Umumnya, pemanfaatan tumbuhan sebagai obat herbal dikarenakan adanya metabolit sekunder yang terbentuk dalam tumbuhan tingkat tinggi, misalnya flavonoid yang merupakan metabolit sekunder dari suatu tumbuhan turunan senyawa fenolik. Menurut Tian et al. (2009), senyawa flavonoid bersifat sebagai antijamur. Salah satu kelompok flavonoid yang banyak dimanfaatkan sebagai antijamur untuk menghambat keputihan adalah tanin (Puspitasari 2009).
Pengujian antijamur dapat dilakukan dengan in vivo atau in vitro. Metode in vitro dilakukan dengan menggunakan beragam pendekatan diantaranya metode pengenceran (dilution broth), metode difusi agar berupa difusi sumur atau difusi cakram. Prinsip metode difusi sumur dan difusi cakram adalah serupa yaitu ekstrak yang diujikan ditempatkan dalam sumur atau kertas cakram yang telah diinokulasi oleh mikroorganisme dan daya hambatnya diamati dengan terbentuknya zona bening (Fathia 2011).
Keputihan merupakan penyakit yang sering terjadi sebagian besar pada wanita. Adanya obat sintentik kimia dapat menyebabkan iritasi pada vagina yang terinfeksi, sehingga diperlukan upaya obat alternatif untuk antijamur tanpa menyebabkan iritasi. Menurut Sudiarti (2010) daun sirih mengandung zat antiseptik pada seluruh bagiannya yang mampu membunuh kuman, diantaranya dapat mematikan jamur C. albicans. Secara empiris masyarakat Indonesia sudah menggunakan air rebusan daun sirih hijau untuk mencegah keputihan. Daun sirih hijau mempunyai kandungan minyak atsirinya yang terdiri atas senyawa golongan fenol, seperti kavikol, karvakol, sineol, metil kavikol, euganol dan kalvibetol yang berfungsi sebagai antiseptik. Sifat antifungi yang dihasilkan minyak atsiri daun sirih hijau lebih besar dibandingkan dengan minyak atsiri daun sirih merah (Maytasari 2010).
2
pelarut etanol dan air rebusan sehingga penelitian ini meneruskan untuk mengetahui penghambatan C. albicans dengan pelarut berbeda yaitu aseton dengan air rebusan sebagai pembanding. Penelitian ini merupakan penelitian dasar yang bertujuan untuk mengukur aktivitas penghambatan C. albicans dari ekstrak daun sirih hijau dengan menggunakan pelarut yang berbeda secara in vitro dan menentukan Konsentrasi Hambat Minimum (KHM) serta menentukan senyawa bioaktif yang berperan menghambat C. albicans.
METODE
Waktu dan Tempat
Penelitian ini dilakukan dari bulan Desember 2013 hingga April 2014. Penelitian dilaksanakan di Laboratorium Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Diagnostik Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah oven, tanur, water bath, mesin penggiling, eksikator, cawan porselin, shaker, erlenmeyer, gelas piala, gelas ukur, hot plate, neraca analitik, tube, sudip, batang pengaduk, cawan petri, jarum ose, pipet mikro, pipet tetes, pipet Mohr, kapas, kertas saring, alumunium foil, autoklaf, rotary evaporator, inkubator, jangka sorong, dan GC-MS.
Bahan-bahan yang digunakan dalam penelitian ini adalah daun sirih hijau yang diperoleh dari tanaman keluarga di Depok, akuades, etanol 70 %, aseton, NaCl steril, nistatin 500.000 IU (102.8 mg), PDA (potato dextrose agar), akuades steril, kultur C. albicans INACC y16, H2SO4 pekat, metanol, etanol 30 %,
pereaksi Dragendorff, pereaksi Wagner, pereaksi Meyer, H2SO4 2M, FeCl3,
kloroform, amoniak, asam asetat anhidrat, dan eter teknis.
Prosedur Percobaan
Pembuatan simplisia serbuk (Puspitasari et al 2009)
Daun sirih hijau dicuci dengan air dan dikeringkan dalam oven pada suhu 45-50 ºC selama enam hari. Simplisia daun sirih hijau yang sudah kering dilakukan penggilingan untuk mendapatkan ukuran 100 mesh. Penggilingan dilakukan di Teknologi Hasil Hutan Fakultas Kehutanan Institut Pertanian Bogor.
Uji kadar air (AOAC 2005)
3 selama 3 jam dan dipindahkan ke dalam eksikator selama 15 menit. Cawan berisi simplisia tersebut kemudian ditimbang lagi. Perlakuan dilakukan sebanyak tiga kali ulangan.
Kadar air (%) = – { – } x 100 % Uji kadar abu (AOAC 2005)
Cawan porselin yang sudah dibersihkan disimpan dalam oven 105 ºC selama 1 jam lalu dipindahkan ke dalam eksikator selama 15 menit. Simplisia daun sirih hijau ditimbang sebanyak 2 gram pada cawan porselin yang sudah dikeringkan, kemudian diarangkan di atas bunsen hingga tidak terbentuk asap dan diabukan dalam tanur listrik pada suhu 441-601 ºC sampai pengabuan sempurna. Selanjutnya abu didinginkan dalam eksikator dan ditimbang bobotnya.
Kadar abu (%) = { – }
x 100 %
Kadar abu bobot kering (%) =
x 100%
Pembuatan ekstrak
Ekstrak air rebusan (BPOM 2004). Simplisia serbuk daun sirih sebanyak 10 gram ditambahkan dengan akuades dengan perbandingan 1:10 lalu direbus dalam keadaan tertututp sampai mendidih dan dibiarkan mendidih selama 10 menit. Setelah itu campuran disaring dan proses diulangi tiga kali dengan jumlah akuades yang sama. Filtrat yang dikumpulkan dipekatkan dan diuapkan dengan
rotary evaporator pada suhu 60 ºC hingga diperoleh ekstrak kental. Ekstrak air rebusan dibuat sebanyak tiga ulangan.
Rendemen (%) =
x 100 %
Ekstrak etanol 70 % (BPOM 2004). Simplisia daun sirih hijau sebanyak 10 gram diekstraksi dengan perbandingan 1:10 antara sampel dan pelarut. Ekstraksi menggunakan metode maserasi selama 20 jam dengan orbital shaker
dan campuran didiamkan 4 jam agar simplisia mengendap. Maserat difiltrasi dan proses diulangi tiga kali dengan jenis dan jumlah pelarut yang sama. Semua filtrat dikumpulkan dan diuapkan dengan rotary evaporator pada suhu 56 ºC hingga diperoleh ekstrak kental. Ekstrak etanol 70 % dibuat tiga kali ulangan.
Rendemen (%) =
x 100 %
Ekstrak aseton. Perlakuan untuk ekstrak aseton mengacu pembuatan ekstrak etanol menurut BPOM 2004 namun, terdapat modifikasi yaitu pelarut etanol digantikan dengan aseton. Simplisia daun sirih hijau sebanyak 10 gram diekstraksi dengan perbandingan 1:10 antara sampel dan pelarut. Ekstraksi menggunakan metode maserasi selama 20 jam dengan orbital shaker, kemudian campuran didiamkan 4 jam agar simplisia mengendap. Maserat difiltrasi dan proses diulangi tiga kali dengan jenis dan jumlah pelarut yang sama. Semua filtrat dikumpulkan dan diuapkan dengan rotary evaporator pada suhu 50 ºC hingga diperoleh ekstrak kental. Ekstrak aseton dibuat tiga kali ulangan.
Rendemen (%) =
4 Dragendorf, Wagner, dan Meyer. Hasil positif diperoleh dengan adanya endapan yang terbentuk.
Uji flavonoid. Ekstrak daun sirih hijau dari tiga pelarut masing-masing diambil 0.05 gram dimasukkan ke dalam tabung reaksi. Kemudian tiap tabung ditambahkan 5 mL metanol dan dihomogenkan. Setelah dihomogenkan campuran pada tabung reaksi dipanaskan 50 ºC selama 5 menit, lalu disaring. Filtrat ditambahkan dengan H2SO4 pekat. Hasil positif ditunjukkan dengan adanya
endapan merah.
Uji tanin. Ekstrak daun sirih hijau dari tiga pelarut masing-masing diambil 0.05 gram dimasukkan ke dalam tabung reaksi. Kemudian tiap tabung ditambahkan 5 mL akuades dan dihomogenkan. Setelah dihomogenkan campuran pada tabung reaksi dipanaskan 100 ºC selama 5 menit, lalu disaring. Filtrat ditambahkan dengan 5 tetes FeCl3 1 %. Hasil positif ditunjukkan dengan warna
biru tua atau hitam kehijauan.
Uji saponin. Ekstrak daun sirih hijau dari tiga pelarut masing-masing diambil 0.05 gram dimasukkan ke dalam tabung reaksi. Kemudian tiap tabung ditambahkan 5 mL akuades dan dihomogenkan. Setelah dihomogenkan campuran pada tabung reaksi dipanaskan 70 ºC selama 5 menit dan dikocok selama 5 menit, jika terdapat buih dan bertahan selama 10 menit menunjukkan adanya saponin.
Uji steroid dan terpenoid. Ekstrak daun sirih hijau dari tiga pelarut masing-masing diambil 0.05 gram dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 5 mL etanol 30 % dan dipanaskan 50 ºC selama 5 menit lalu disaring. Filtrat yang terbentuk diuapkan hingga kering. Residu yang terbentuk ditambah 2 mL eter dan dipindahkan ke tabung reaksi lalu ditambahkan pereaksi Lieberman Burchard (3 tetes asam asetat anhidrat dan 1 tetes H2SO4 pekat). Adanya
triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan adanya steroid ditandai dengan warna hijau atau biru.
Pembuatan media Potato Dextrose Agar (PDA)
Sebayak 19.5 gram PDA dilarutkan dengan 500 mL akuades dalam Erlenmeyer, kemudian dipanaskan sambil diaduk sampai homogen. Larutan media dalam Erlenmeyer ditutup kapas dan alumunium foil lalu disterilkan dengan autoklaf pada tekanan 1.5 atm dan suhu 121 ºC selama 15 menit.
Peremajaan Candida albicans (Gozali et al 2009)
5 ke dalam tabung reaksi yang sudah disterilkan dan dimiringkan 30 ºC sambil didiamkan sampai mengeras. Koloni jamur diambil dari murni yang tersedia, dilakukan secara aseptis dengan jarum ose dan digoreskan pada media agar miring kemudian diinkubasi dalam inkubator.
Pembuatan standar kekeruhan Mc. Farland (AOAC 1996)
Larutan 1 % barium klorida (BaCl2.H2O) diambil sebanyak 3 mL dan
ditambahkan ke dalam 97 mL larutan 1% H2SO4 lalu dikocok-kocok sampai keruh.
Kekeruhan ini dipakai sebagai standar kekeruhan jamur Mc Farland 3 yang sesuai dengan 109 cfu/mL.
Pengujian aktivitas penghambatan C. albicans (in vitro) dan penentuan konsentrasi hambat minimum (KHM) difusi agar (Bintang 1993)
Koloni jamur C. albicans yang telah diremajakan diambil sebanyak 3 ose ke dalam larutan 10 mL NaCl steril. Campuran dihomogenkan hingga menjadi keruh lalu disamakan kekeruhannya dengan larutan Mc Farland 2 x 109 cfu/mL (colony forming unit/mL). Kekeruhan C. albicans yang sudah sama dengan Mc Farland 3 kemudian diencerkan dengan NaCl steril sampai menjadi 107 cfu/mL. C. albicans
107 cfu/mL diencerkan kembali ke dalam media PDA steril sehingga diperoleh 106 cfu/mL. PDA yang sudah berisi C. albicans dihomogenkan lalu dituangkan ke dalam cawan Petri yang sudah disterilkan. Cawan Petri didiamkan selama 30 menit sampai mengeras. Setelah agar mengeras, cawan Petri yang berisi PDA dan
C. albicans dibuat lubang sumur dengan menggunakan tabung Durham secara aseptis. Ekstrak daun sirih hijau yang diujikan dengan berbagai konsentrasi dimasukkan ke dalam lubang tersebut sebanyak 50 µL secara aseptis dan diinkubasi selama 20 jam pada suhu 37 ºC. Konsentrasi yang digunakan untuk pengujian ekstrak daun sirih hijau pada masing-masing ekstrak dibuat variasi konsentrasi 400 mg/mL, 200 mg/mL, 100 mg/mL, 50 mg/mL, dan 25 mg/mL dengan tiga kali ulangan. Kontrol negatif yang digunakan yaitu akuades steril untuk pengujian ekstrak akuades dan etanol 70 %, sedangkan pengujian ekstrak aseton menggunakan kontrol negatif aseton. Lubang kedua sebagai kontrol positif yaitu nistatin dengan konsentrasi 1.028 mg/mL.
6
Analisis GC-MS (Gas Chromatography-Mass Spectrophotometer)
Identifikasi senyawa yang berperan menghambat C. albicans dilakukan dengan menggunakan GC-MS. Senyawa yang diidentifikasi adalah ekstrak aseton yang memiliki aktivitas penghambatan C. albicans paling besar dibandingkan dengan ekstrak lain. Ekstrak aseton dianalisis dengan pirolisis kromatografi gas dan spektrofotometri massa (Py-GC-MS) di Laboratorium Pengujian Hasil Hutan Pusat Penelitian dan Pengembangan Keteknikan Kehutan dan Pengelolahan Hasil Hutan. Kondisi operasional alat GC-MS Pyrolisis adalah:
Tipe : Shimadzu Type GCMS-QP2010
Gas : Helium
Detektor : FID (Flame Ionization Detector)
Kolom : Capiler Type Phase Rtx-5MS; 60 m; 0.25 mmID
Analisis statistika (Mattjik dan Sumertajaya 2006)
Analisis statistik yang digunakan adalah rancangan percobaan dua faktor dalam rancangan Split-Plot Design, Rancangan Acak Lengkap (RAL). Model rancangannya:
Yijk = µ + αi + βj + (αβ)ij + εijk
Keterangan:
Yijk = diameter zona hambat pelarut ke–i, konsentrasi ke-j, ulangan ke-k
µ = pengaruh rataan umum
αi = pengaruh utama faktor A (pelarut) βj = pengaruh utama faktor B (konsentrasi)
(αβ)ij = komponen interaksi dari faktor A dan faktor B εijk = pengaruh galat
Rancangan ini digunakan pada nilai diameter zona hambat pengujian aktivitas penghambatan C. albicans. Data yang diperoleh dianalisis dengan program SPSS 16 pada tingkat kepercayaan 95 % dan taraf nyata α 0.05. Pengujian lanjut dilakukan dengan uji Duncan.
HASIL
Kadar Air, Kadar Abu, Kadar Abu Bobot Kering, dan Rendemen
7
Senyawa Fitokimia Ekstrak Daun Sirih Hijau
Analisis kualitatif fitokimia dari ekstrak daun sirih hijau dapat dilihat pada Tabel 2. Hasil uji menunjukkan bahwa tidak terdeteksinya senyawa alkaloid pada ekstrak daun sirih hijau, baik ekstrak akuades, etanol 70 % ataupun aseton, sedangkan senyawa tanin dan saponin terdapat di semua ekstrak daun sirih hijau. Tabel 2 Analisis uji fitokimia ekstrak daun sirih hijau
Uji Ekstrak
Keterangan: + (terdapat senyawa), - (tidak terdapat senyawa)
Aktivitas Penghambatan C. albicans Ekstrak Daun Sirih Hijau
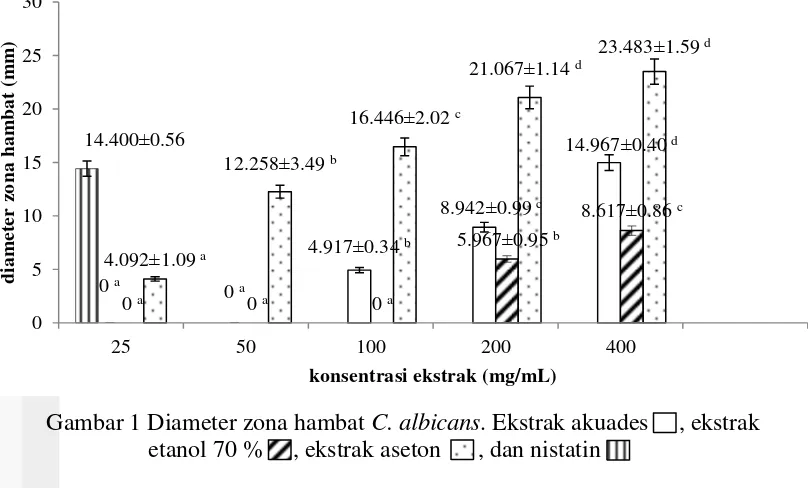
Pengujian aktivitas penghambatan C. albicans menggunakan pelarut yang berbeda yaitu akuades, etanol 70 %, dan aseton, sedangkan konsentrasi yang digunakan pada tiap pelarut adalah 25, 50, 100, 200, dan 400 mg/mL dengan tiga kali pengulangan. Hasil pengujian aktivitas ekstrak daun sirih hijau menunjukkan hasil yang berbeda dari tiap pelarut dan konsentrasi yang diujikan. Hasil pengukuran diameter zona hambat pada C. albicans dapat dilihat pada Gambar 1.
8
Hasil analisis statistik menunjukkan bahwa perbedaan pelarut dan variasi konsentrasi yang digunakan pada pengujian memberikan nilai yang berbeda nyata terhadap diameter zona hambat yang terbentuk pada taraf nyata α 0.05. Uji lanjut Duncan menunjukkan bahwa perbedaan pelarut dan variasi konsentrasi pada masing-masing pelarut memiliki nilai yang berbeda nyata terhadap diameter zona hambat C. albicans. Konsentrasi terendah 25 mg/mL pada ekstrak akuades dan ekstrak etanol 70 % tidak menghasilkan aktivitas penghambatan C. albicans, sedangkan konsentrasi 25 mg/mL ekstrak aseton masih memberikan aktivitas. Sifat aseton yang semipolar memiliki zona hambat yang paling besar dibandingkan dengan akuades dan etanol 70 % yang bersifat polar. Perbedaan konsentrasi pada pelarut yang sama memberikan pengaruh nyata terhadap diameter zona bening dengan semakin besar konsentrasi maka akan semakin besar zona hambat yang terbentuk.
Gambar 1 Diameter zona hambat C. albicans. Ekstrak akuades , ekstrak etanol 70 % , ekstrak aseton , dan nistatin
Konsentrasi Hambat Minimum (KHM)
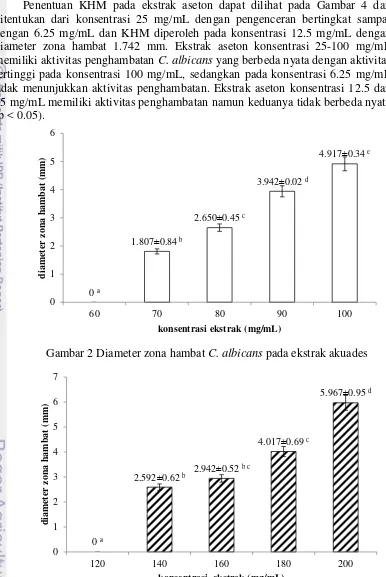
Pengujian konsentrasi hambat minimum dilakukan untuk menentukan konsentrasi terkecil pada ekstrak daun sirih hijau yang dapat menghambat pertumbuhan C. albicans. Ekstrak akuades, etanol 70 %, dan aseton memiliki rentang yang berbeda-beda dalam penentuan KHM. Nilai KHM ekstrak akuades memiliki rentang 60 mg/mL sampai dengan 100 mg/mL dan KHM pada ekstrak akuades terdapat pada konsentrasi 70 mg/mL dengan diameter 1.807 mm (Gambar 2). Ekstrak akuades konsentrasi 70-100 mg/mL memiliki aktivitas penghambatan
C. albicans yang berbeda nyata dengan aktivitas tertinggi pada konsentrasi 100 mg/mL, sedangkan pada konsentrasi 60 mg/mL tidak menunjukkan aktivitas penghambatan.
9 mg/mL memiliki aktivitas penghambatan tertinggi terhadap pertumbuhan C. albicans dan berbeda nyata, sedangkan pada konsentrasi 120 mg/mL tidak menunjukkan aktivitas penghambatan. Ekstrak pada konsentrasi 140-180 mg/mL memiliki aktivitas penghambatan namun tidak berbeda nyata (p < 0.05).
Penentuan KHM pada ekstrak aseton dapat dilihat pada Gambar 4 dan ditentukan dari konsentrasi 25 mg/mL dengan pengenceran bertingkat sampai dengan 6.25 mg/mL dan KHM diperoleh pada konsentrasi 12.5 mg/mL dengan diameter zona hambat 1.742 mm. Ekstrak aseton konsentrasi 25-100 mg/mL memiliki aktivitas penghambatan C. albicans yang berbeda nyata dengan aktivitas tertinggi pada konsentrasi 100 mg/mL, sedangkan pada konsentrasi 6.25 mg/mL tidak menunjukkan aktivitas penghambatan. Ekstrak aseton konsentrasi 12.5 dan 25 mg/mL memiliki aktivitas penghambatan namun keduanya tidak berbeda nyata (p < 0.05).
Gambar 2 Diameter zona hambat C. albicans pada ekstrak akuades
Gambar 3 Diameter zona hambat C. albicans pada ekstrak etanol 70 %
10
Gambar 4 Diameter zona hambat C. albicans pada ekstrak aseton
Analisis GC-MS Ekstrak Aseton Daun Sirih Hijau
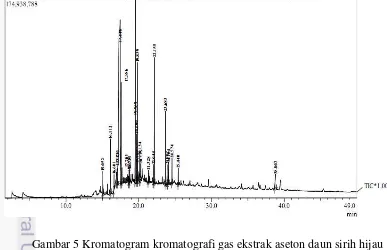
Ekstrak aseton memiliki aktivitas penghambatan yang terbaik terhadap C. albicans dianalisis dengan GCMS Pyrolisis. Hasil analisis ekstrak aseton ditunjukkan pada Gambar 5. Kromatogram menunjukkan 25 puncak yang terdeteksi, selanjutnya puncak dianalisis dengan spektrofotometer massa. Spektrum massa masing-masing puncak dicocokkan dengan data dari Chemical Abstracts Service (CAS) dan merujuk senyawa-senyawa pada Tabel 3. Tiga senyawa yang mempunyai konsentrasi terbesar yaitu asam 2,3-dimetil-benzoat dengan 46.16 %, 3-eikosena dengan 9.79 %, dan fenol, 2-metoksi-4-(2-profenil)-, asetat eugenol dengan 6.29%.
Gambar 5 Kromatogram kromatografi gas ekstrak aseton daun sirih hijau
11 Tabel 3 Senyawa – senyawa yang diduga dari masing – masing puncak pada kromatogram ekstrak aseton daun sirih hijau
Puncak# Rt Luas Kons % Nama
1 15.052 58228716 1.41 Chavicol44
2 16.112 99630735 2.42 Phenol, Phenol, 3-allyl-2-methoxy- 3 2-methoxy-3-(2-propenyl)-
3 16.601 23872589 0.58 TRANS(.BETA.)-CARYOPHYLLENE
4 17.025 108015208 2.62 (+)-Aromadendrene
5 17.133 39289367 0.95 Germacrene D
6 17.446 1900644054 46.16 Benzoic acid, dimethyl- 2,3-Dimethylbenzoic acid
7 17.586 259173205 6.29 Phenol, 2-methoxy-4-(2-propenyl)-, acetate Aceteugenol
8 17.702 72431477 1.76 Dodecanamide,
N,N-bis(2-hydroxyethyl)-
14 19.839 167819175 4.08 2-Hexadecen-1-ol,
3,7,11,15-tetramethyl-, [R-[R*,R*-(E)]]- Phytol
15 20.134 47953232 1.16 (E,E)-7,11,15-Trimethyl-3-methylene-hexadeca-1,6,10,14-tetraene
16 20.275 48049338 1.17 Platambin
17 21.328 23043028 0.56 10,13-Octadecadienoic acid, methyl ester
18 22.044 32149331 0.78 1-Hexadecanol, acetate Cetyl acetate
19 22.155 220784504 5.36 NEOPHYTADIENE
20 23.683 138890049 3.37 Hexanedioic Dioctyl adipate acid, dioctyl ester
21 23.902 41339796 1.00 2-Allyl-6-methoxyphenol
22 24.104 52059696 1.26 Dehydrodieugenol
23 24.574 55475604 1.35 2-Allyl-6-methoxyphenol
24 25.440 32533911 0.79 1,2-Benzenedicarboxylic acid, bis(2-ethylhexyl) ester Bis(2-ethylhexyl )
25 38.802 100748673 2.45 STIGMAST-5-EN-3-OL, OLEAT
PEMBAHASAN
Kadar Air, Kadar Abu, Kadar Abu Bobot Kering, dan Rendemen
12
berbeda meskipun tidak terlalu signifikan yaitu sebesar 12.22 % dan kadar abu bobot kering diperoleh 13.01 %. Menurut Agustin (2005) kandungan mineral yang terdapat dalam daun sirih hijau yodium, kalsium, fosfor, besi dan kalium.
Metode ekstraksi daun sirih hijau untuk uji aktivitas sebagai antijamur menggunakan metode perebusan dan maserasi. Simplisia daun sirih hijau yang akan diekstraksi berukuran 100 mesh, tujuannya adalah semakin kecil ukuran partikelnya, maka semakin luas bidang kontak yang akan mempercepat proses ekstraksi. Metode perebusan pada waktu ekstraksi mempengaruhi terbuka dan pecahnya dinding sel pada kromoplas sehingga dapat memudahkan keluarnya metabolit sekunder (Rodrigues dan Mieko 2004). Maserasi adalah proses pembuatan ekstrak simplisia dengan menggunakan pelarut dan beberapa kali dilakukan pengadukan pada temperatur yang sama (Lumbessy et al. 2013). Proses maserasi bersifat menguntungkan dalam isolasi senyawa bahan alam karena selain murah dan mudah dilakukan, dengan perendaman sampel tumbuhan akan terjadi pemecahan dinding dan membran sel akibat perbedaan antara tekanan di luar dan di dalam sel, sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut (Koirewoa et al. 2012).
Pelarut yang digunakan untuk ekstraksi daun sirih hijau dengan metode maserasi adalah etanol 70 % dan aseton, sedangkan pelarut yang digunakan untuk ekstraksi dengan perebusan adalah akuades. Rendemen merupakan salah satu parameter untuk mengetahui seberapa besar produk yang dihasilkan dari proses produksi, yang dinyatakan dengan perbandingan antara jumlah produk yang dihasilkan dengan jumlah bahan yang digunakan (Satriyanto 2012). Rendemen dari tiap pelarut yang berbeda menghasilkan jumlah rendemen yang berbeda juga. Perbedaan jumlah rendemen yang diperoleh dari tiap pelarut karena proses ekstraksi dipengaruhi dari sifat pelarut, konsentrasi, waktu, dan suhu (Ramadhan dan Haries 2010).
Senyawa Fitokimia Ekstrak Daun Sirih Hijau
Senyawa sekunder atau disebut juga senyawa fitokimia adalah senyawa kimia yang terdapat dalam tanaman dan tidak mempunyai fungsi utama dalam pembentukan sel-sel tanaman melainkan sebagai sumber pertahanan tanaman terhadap serangan predator baik serangga maupun mikroorganisme. Penapisan fitokimia secara kualitatif dilakukan dengan penambahan berbagai pereaksi tertentu ke dalam ekstrak tanaman sehingga menghasilkan warna larutan endapan spesifik yang menandakan keberadaan senyawa tertentu. Penapisan fitokimia bertujuan untuk mengetahui golongan senyawa secara kualitataif di dalam ekstrak kasar (Harmawan 2012).
13 tanin pada ekstrak aseton lebih rendah secara kualitatif dibandingkan ekstrak akuades dan etanol 70 %. Penggunaan akuades pada uji fitokimia tanin menyebabkan akuades tidak dapat melarutkan maksimal ekstrak aseton karena sifat pelarut aseton yang medium polar atau semi polar (Setiaji et al. 2006).
Flavonoid dikenal dengan sebutan bioflavonoid, yaitu kelompok pigmen tanaman yang memberikan perlindungan terhadap serangan radikal bebas yang merusak. Flavonoid dikenal manusia sebagai antiperadangan, antialergi, antivirus, antioksidan dan antikarsinogenik. Menurut Tian et al. (2009) flavonoid bersifat sebagai antijamur. Hasil uji positif flavonoid terdapat pada ekstrak akuades dan ekstrak etanol 70 % yang dibuktikan adanya adanya endapan merah. Senyawa flavonoid bersifat polar sehingga akan mudah terbawa oleh pelarut polar. Pelarut aseton yang bersifat semi polar tidak dapat menarik senyawa polar flavonoid, tetapi dapat membawa senyawa tanin yang termasuk flavonoid dalam jumlah kualitatif yang rendah, karena tanin merupakan zat ekstraktif yang mudah larut pelarut polar dan non plar misalnya eter, alkohol, bensin atau air (Dumanauw 2001).
Aktivitas antimikroba dari flavonoid terjadi karena kemampuannya untuk berikatan dengan polipeptida pada dinding sel dan membrane-bound enzymes. Flavonoid memiliki kemampuan untuk membentuk kompleks dengan protein ekstrakseluler terlarut dan dengan dinding sel (Rachma 2012). Mekanisme kerja tanin sebagai antimikroba menurut Naim (2004) berhubungan dengan kemampuan tanin dalam menginaktivasi adhesi sel mikroba (molekul yang menempel pada sel inang) yang terdapat pada permukaan sel. Tanin yang mempunyai target pada polipeptida dindig sel akan menyebabkan kerusakan pada dinding sel, karena tanin merupakan turunan senyawa fenol. Ion H+ dari senyawa fenol dan turunannya (flavonoid) akan menyerang gugus polar (gugus fosfat) sehingga fosfolipid akan terurai mengakibatkan tidak mampu mempertahankan bentuk membran sel, akibatnya membran akan bocor dan pertumbuhan terhambat bahkan menyebabkan kematian (Dwiyanti et al 2014).
Saponin adalah glikosida triterpena dan sterol yang telah terdeteksi dalam 90 suku tumbuhan. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun dan dapat dideteksi berdasarkan kemampuannya membentuk busa (Mutiatikum et al. 2010). Hasil uji penapisan ekstrak daun sirih hijau dari tiga pelarut yang berbeda mengandung saponin dengan jumlah kualitatif yang berbeda. Keberadaan saponin terdeteksi dengan terbentuk busa yang bertahan selama 10 menit. Menurut Septiadi et al. (2013) saponin berkontribusi sebagai antijamur dengan mekanisme menurunkan tegangan permukaan membran dinding sel C. albicans, sehingga permeabilitasnya meningkat. Permeabilitas yang meningkat mengakibatkan cairan intraseluler yang lebih pekat tertarik keluar sel sehingga zat nutrisi dan metabolit akan keluar dari sel. Protein sel termasuk enzim juga keluar dari sel dan jamur mengalami kematian (Septiadi et al. 2013).
14
menunjukkan hasil positif pada uji steroid dengan warna hijau dan negatif untuk uji triterpenoid. Warna hijau pekat pada ekstrak aseton menunjukkan adanya steroid yang banyak. Sedangkan ekstrak akuades tidak terdapat triterpenoid dan steroid, karena sifat akuades yang polar, sehingga cenderung tidak bisa menarik kedua senyawa tersebut. Terpenoid terdiri atas triterpenoid dan steroid yang merupakan senyawa bioaktif. Senyawa-senyawa ini dapat menghambat pertumbuhan jamur, baik melalui membran sitoplasma maupun mengganggu pertumbuhan dan perkembangan spora (Luftiyanti et al. 2012).
Aktivitas Penghambatan C. albicans Ekstrak Daun Sirih Hijau dan Konsentrasi Hambat Minimum (KHM)
Pengujian aktivitas penghambatan C. albicans dilakukan dengan pelarut yang berbeda yaitu aseton dan etanol 70 % dengan air rebusan sebagai pembanding. Tingkat aktivitas dari ekstrak daun sirih berbeda-beda untuk tiap pelarut yang digunakan. Hasil penapisan menunjukkan ketiga ekstrak memiliki senyawa tanin dan saponin yang diduga berperan sebagai menghambat C. albicans. Ekstrak aseton daun sirih hijau mempunyai aktivitas yang paling besar dibandingkan dengan ekstrak akuades dan ekstrak etanol 70 %. Uji fitokimia yang telah dilakukan menunjukkan bahwa ekstrak aseton memiliki senyawa steroid yang besar, sedangkan ekstrak akuades dan etanol 70 % tidak memiliki senyawa steroid. Hal ini disebabkan steroid mudah terbawa oleh pelarut yang bersifat non polar dan semi polar (Nurjanah et al. 2011). Menurut Subhisha (2005) steroid dapat berfungsi sebagai antijamur karena sifat lipofilik yang dimiliki oleh steroid dapat menghambat perkecambahan spora dan perbanyakan miselium pada jamur.
Konsentrasi yang digunakan pada uji aktivitas penghambatan C. albicans
adalah 25, 50, 100, 200, dan 400 mg/mL dengan kontrol positif nistatin 1.028 mg/mL. Pengujian dilakukan dengan menggunakan metode sumur agar dapat melihat zona bening yang terbentuk di sekitar daerah yang diberi ekstrak. Menurut ketentuan kekuatan antimikroba yang dikemukan oleh David Stout, kategori sangat kuat jika diameter zona hambat ≥ 20 mm, kategori kuat jika diameter zona hambat 10-20 mm, kategori sedang jika 5-10 mm, dan ketegori lemah apabila ≤ 5 mm (Rahayu 2013). Diameter zona hambat terbesar pada ekstrak akuades termasuk kategori kuat dengan diameter 14.967 mm, diameter ekstrak etanol 70 % termasuk kategori sedang dengan diameter 8.617 mm, dan diameter ekstrak aseton termasuk kategori sangat kuat dengan diameter 23.483 mm.
15
Analisis GC-MS Ekstrak Aseton Daun Sirih Hijau
Gas Chromatography-Mass Spectrophotometer (GC-MS) adalah metode pemisahan senyawa organik yang umum dilakukan dengan mengelompokkan puncak-puncak kromatogram yang berubah pada variasi proses. Senyawa dikelompokkan berdasarkan banyaknya atom C pada senyawa dan pola perubahan konsentrasi pada perubahan temperatur (Fatimah dan Jaka 2005). Ekstrak aseton daun sirih hijau yang memiliki aktivitas terbaik dianalisis dengan GC-MS. Instrumentasi yang digunakan adalah Pyrolysis GC-MS dan sehingga dilakukan pembakaran 610 ºC selama 10 detik tanpa oksigen, semua senyawa yang terkandung menjadi volatil dan terdekomposisi menjadi fragmen-fragmen. Gas yang digunakan adalah helium dengan FID (flame ionization detector).
Hasil analisis GC menghasilkan ada 25 puncak yang dideteksi dengan spektrofotometer massa dan diketahui tiga senyawa dengan konsentrasi terbesar yang diduga menghambat C. albicans yaitu 46.16 % asam 2,3-dimetil-benzoat, 9.79 % 3-eikosena, dan6.29 %fenol, 2-metoksi-4-(2-profenil). Waktu retensi atau
retention time (Rt) merupakan analisis kualitatifyaitu dengan membandingkan Rt analit dengan Rt standar, sehingga senyawa tunggal yang keluar akan diketahui namanya dari data Rt standar (Pandiangan 2011).
Senyawa pertama merupakan turunan dari senyawa asam benzoat yaitu asam 2,3-dimetil-benzoat dan muncul pada Rt 17.446. Asam benzoat menurut Duraipandiyan dan Ignacimuthu (2007) merupakan senyawa yang mempunyai aktivitas antijamur. Menurut Rorong (2013) aktivitas asam benzoat sebagai antimikroba dengan cara menembus atau merusak jaringan sel membran mikroba yang mengakibatkan kematian sel. Asam 2,3-dimetil-benzoat adalah asam karboksilat dengan enam karbon dan gugus metil pada karbon nomor 2 dan 3 sehingga akan larut dengan pelarut yang kepolarannya rendah seperti aseton dan kloroform (Lapaugi 2014). Asam 2,3-dimetil-benzoat menurut Matsjeh (2004) merupakan turunan senyawa flavonoid, namun senyawa flavonoid dari penapisan fitokimia ekstrak aseton tidak terdeteksi secara kualitatif, sedangkan tanin yang merupakan turunan flavonoid dapat terdeteksi dalam penapisan fitokimia.
Senyawa kedua merupakan turunan eikosena dan muncul pada Rt 19.565. Eikosena merupakan hidrokarbon dengan jumlah karbon sebanyak 21. Menurut penelitian Verma et al. (2010) eikosena merupakan tiga senyawa utama yang bersifat sebagai antijamur dan merupakan golongan alkana penyusun terpenoid (Balafif et al. 2013). Hasil kualitatif fitokimia ekstrak aseton menunjukkan bahwa ekstrak aseton positif mengandung senyawa terpenoid golongan steroid. Senyawa terakhir adalah turunan fenol dan muncul pada Rt 17.586. Senyawa fenol menurut Hussin et al. (2009) yang terdapat dalam tumbuhan merupakan senyawa antijamur dan hasil kualitatif dari penapisan fitokimia diperoleh senyawa tanin. Fenol bekerja karena ion H+ menyerang gugus polar (gugus fosfat) pada fosfolipid membran sel C. albicans sehingga fosfolipid akan terurai (Dwiyanti et al 2014).
SIMPULAN
16
zona hambat 23.483 mm dan nilai KHM 12.5 mg/mL dengan diameter zona hambat 1.742 mm. Hasil penapisan fitokimia menunjukkan bahwa ekstrak aseton memiliki senyawa steroid yang menghambat pertumbuhan C. albicans dan hasil analisis Pyrolysis GC-MS menghasilkan tiga senyawa terbesar yaitu turunan asam benzoat, fenol, dan eikosena.
SARAN
Berdasarkan penelitian perlu dilakukan penelitian lanjut untuk menentukan konsentrasi bunuh minimum C. albicans dan menghitung jumlah mikroba yang terbunuh. Daun sirih hijau perlu dilakukan pemurnian untuk mengetahui senyawa yang berkerja dalam menghambat C. albicans. Daun sirih hijau memenuhi standar Departemen Kesehatan Republik Indonesia sehingga dapat diproses dan dianalisis tahap lanjut untuk pemurnian sebagai bahan baku obat herbal candidiasis.
DAFTAR PUSTAKA
Agustin DW. 2005. Perbedaan khasiat antibakteri bahan irigasi antara hydrogen peroksida 3 % dan infusum daun sirih 20% terhadap bakteri mix. Maj. Kedokteran Gigi. 38 (1): 45-47.
Andriani R, Lily R. 2010. Nistatin oral sebagai terapi profilaksis infeksi jamur sistemik pada Neonatus Kurang Bulan. Sari Pediarti. 11 (6): 420-427. [AOAC] Association of Official Analytical Chemist. 2005. Official Method of
Analysis of The Association Analytical of Chemist. The Association of Official Analysis Chemist, Inc., Airlington.
[AOAC] Association of Official Analytical Chemist. 1996. Bacteriological Analytical Manual. Gaithersburg (USA): The Association of Official Analysis Chemist, Inc.
Arifin H, Nelvi A, Dian H, Roslinda R. 2006. Standarisasi ekstrak etanol daun
Eugenia cumini Merr. J. Sains Tek. Far. 11 (2): 88-93.
Balafif R, Yayuk, Erin. 2013. Analisis senyawa triterpenoid dari hasil fraksinasi ekstrak air buah buncis (Phaseolus vulgaris, Linn). Chemistry J. 6 (2). Bintang M. 1993. Studi antimikroba dari Streptococcus lactis BCC 2259
[disertasi]. Bandung (ID): Program Doktor Institut Teknologi Bandung. [BPOM] Badan Pengawasan Obat dan Makanan Republik Indonesia. 2004.
Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta (ID) : BPOM RI [Depkes] Departemen Kesehatan. 2008. Farmakope Herbal Indonesia. Jakarta
(ID): Departemen Kesehatan Indonesia.
17 Duraipandiyan V, Ignacimuthu S. 2007. Antibacterial and antifungal activity of
Cassia fistula L.:An ethanomedicinal plant. Journal of Ethnopharmacology. 112 (3): 590-594.
Dwijayanti W, Muslimin I, Guntur T. 2014. Pengaruh efek daun kenikir (Cosmos caudatus) terhadap pertumbuhan bakteri Bacillus cereus secara in vitro. LenteraBio. 3 (1): 1-5.
Fathia S. 2011. Aktivitas antimikroba ekstrak jahe (Zingiber officinale Roscoe) terhadap beberapa bakteri patogen [skripsi]. Bogor (ID): Departemen Ilmu Teknologi Pagan Fakultas Teknologi Pertanian Institut Pertanian Bogor. Fatimah I, Jaka N. 2005. Identifikasi hasil pirolissi serbuk kayu jati menggunakan
Principal Component Analysis. Jurnal Ilmu Dasar. 6(1): 41-47.
Gozali D, Rusmiati D, Utama P. 2009. Formulasi dan uji stabilitas mikroemulsi ketokonazol sebagai antijamur Candida albicans dan Tripcophyton mentagrophytes. Farmaka. 7 (2).
Harborne. 1987. Metode Fitokimia. Penerjemah: Patmawinata K dan Soediro I. Bandung (ID): Penerbit ITB.
Harmawan A, Ali R, Delianis P. 2012. Uji fitokimia dan aktifitas bakteri ekstrak media supernatan bakteri simbion Vibrio sp. Gastropoda Olivia vidua
terhadap bakteri Multi Drug Resistant. Journal of Marine Research. 1 (1): 84-89.
Herawati R, Parwati I, Rita SC. 2006. Hitung koloni Candida albicans di tinja anak gangguan autism spectrum. Indonesia Journal of Clinical and Medical Laboratory. 13 (1).
Hussin NM et al. 2009. Antifungal activity of extracts and phenolic compounds from Barringtonia racemosa L. (Lecythidaceae). African Journal of Biothecnology. 8 (12): 3835-2842.
Inayati A. 2010. Uji efek analgetik dan antiinflamasi ekstrak etanol 70% daun sirih (Piper betle Linn) secara in vivo [skripsi] Jakarta. Jurusan Farmasi Fakultas Kedokteran dan kesehatan Masyarakat Universitas Islam Negeri (UIN) Syarif Hidayatullah.
Jawetz, Melnick, Adelberg. 2005. Mikrobiologi Kedokteran Edisi 1. Jakarta (ID): Salemba Medika.
Koirewoa YA, Fatimawali F, Wiyono W. 2012. Isolasi dan identifikasi senyawa flavonoid dalam daun beluntas (Plunchea indica L.) Pharmacon [internet]. [diacu 2014 April 20]. Tersedia dalam: https://ejournal.unsrat.ac.id/article. Lapaugi VRL. 2014. Penetapan kadar natrium benzoat dalam saus sambal yang
beredar di Kota Gorantalo dengan metode titrasi asam-basa [tesis]. Gorantalo (ID): Universitas Negeri Gorantalo.
Leepel LA, Rahmat H, Ria P, Boy MB. 2009. Efek penambahan glukosa pada
18
Luftiyanti R, Widodo FM, Eko ND. 2012. Aktivitas antijamur senyawa bioaktif ekstrak Gelidium latifolium terhadap Candida albicans. Jurnal Pengolahan dan Bioteknologi Hasil Perikanan. 1 (1): 1-8.
Lumbessy M, Jemmy A, Jessy JEP. 2013. Uji total flavonoid pada beberapa tanaman obat tradisional di Desa Waitina Kecamatan Mangoli Timur Kabupaten Kepulauan Sula Provinsi Maluku Utara. Jurnal MIPA UNSRAT.
2 (1): 50-55.
Matsjeh S. 2004. Sintesis Flavonoid: Potensi Metabolit Sekunder Aromatik dari Sumber Daya Alam Nabati Indonesia [bibliografi]. Yogyakarta (ID): Universitas Gadjah Mada. Catatan.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab, Jilid 1. Bogor (ID): IPB Press.
Maytasari GM. 2010. Perbedaan efek antifungi minyak atsiri daun sirih hijau, minyakatsiri daun sirih merah dan resik-v sabun sirih terhadap pertumbuhan Candida albicans secara in vitro [skripsi]. Surakarta (ID): Fakultas Kedokteran Universitas Sebelas Maret.
Mitchell RN, Kumar, Abbas, Fausto. 2006. Buku Saku dasar Patologis Robbin dan Cotran, Ed.7. Penerjemah : Andry Hartono. Jakarta (ID): EGC.
Mutiatikum D, Sukmayanti A, Yun A. 2010. Standardisasi simplisia dari buah miana (Plectranthus Seutellaroides (L) R.Bth) yang berasal dari 3 tempat tumbuh Menado, Kupang, dan Papua. Buletin Penelitain Kesehatan. 38 (2): 1-16.
Naim. 2004. Senyawa antimikroba dari tanaman [tesis]. Bogor (ID): Fakultas Kedokteran Hewan dan Pascasarjana Institut Pertanian Bogor.
Nurjanah, Laili I, Asadatun A. 2011. Aktivitas antioksidan dan komponen bioaktif kerang pisau (Solen spp). Ilmu Kelautan. 16 (3): 119-124.
Pandiangan D. 2011. Peningkatan produksi katarantin melalui teknik elisitasi pada kultur agregat sel Catharanthus roseus. J. Ilmiah Sains. 11 (2): 140-149. Puspitasari A, Sudarso, Dhiani BA. 2009. Aktivitas antijamur ekstrak etanol
soxhletasi dan maserasi daun mimba (Azadirachta indica) terhadap
Candida albicans. Pharmacy. 6 (2): 6-12.
Rachma LN. 2012. Daya antifungal dekok kayu manis (Cinnamomun burmanni) terhadap Candida albicans secara in vitro. El Hayah. 3 (1): 29-34.
Rahayu T. 2013. Potensi antibiotik isolat Rare Actinomycetes dari material vulkanik Gunung Merapi erupsi tahun 2010. Seminar Nasional X Pendidikan Biologi FKIP UNS.
Rahman T. 2012. Identifikasi senyawa alkaloid pada daun papaya (Carica papaya L.) dengan metode kromatografi lapis tipis [tesis]. Gorantalo (ID): Universitas Negeri Gorantalo.
19 [skripsi]. Semarang (ID): Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro.
Rodriguez DB, Mieko K. 2004. Harvestplus Handbook for Carotenoid Analysis.
Washington (USA): HarvestPlus.
Rorong J. 2013. Analisis asam benzoat dengan perbedaan preparasi pada kulit dan daun kayu manis (Cinnamomun burmanni). Chemistry Prog. 6 (2): 81-85. Satriyanto B, Simon BW, Yunianta. 2012. Stabilitas warna ekstrak buah merah
(Pandanus conoides) terhadap pemanasan sebagai sumber potensial pigmen alami. Jurnal Teknologi Pertanian. 13 (3): 157-168.
Septiadi T, Delianis P, Ocki KR. 2013. Uji fitokimia dan aktivitas antijamur ekstrak teripang keling (Holoturia atra) dari Pantai Bandengan Jepara terhadap jamur Candida albicans.J. of Marine Research. 2 (2): 76-84. Setiaji B, Iqmal T, Dwi R. 2006. Pemisahan komponen tar batubara dengan kolom
fraksinasi menggunakan fasa diam zeolit-Mn. Berkala MIPA. 16(1).
Subhisha S, Subramoniam A. 2005. Antifungal activities of a steroid from Pallavicinia Iyellii a liverwort. J. of Pharmacology. 37 (5): 304-306.
Sudiarti D. 2010. Perbedaan daya hambat ekstrak dan rebusan daun sirih hijau (Piper betle) terhadap pertumbuhan Candida albicans [skripsi] Jember (ID): Program Studi Biologi Jurusan Pendidikan MIPA Fakultas Keguruan dan Ilmu Pendidikan Universitas Jember.
Taofik M, Yulianti E, Barizi A, Hayati EK. 2010. Isolasi dan identifikasi senyawa aktif ekstrak air daun paitan (Thitonia diversifolia) sebagai bahan insektisida botani untuk pengendalian hama tungau Eriophyidae. Alchemy.
2 (1): 104-157.
Tian F, Bo L, Baoping J, Jinhua Y, Guizhi Z, Yang C, Yangchao L. Antioxidant and antimicrobial activities of consecutive from Galla chinensis: the polarity affects the bioactivities. Food Chemistry. 113(1): 173-179.
Verma R, GP Satsangi, dan JN Shirvastava. 2010. Chemical analysis of leaves of weed Calotropis procera (Ait) and its antifungal potential. Chemistry of Phytopotentials: Health, Energy and Enviromental. Hal: 97-100.
20
LAMPIRAN
Lampiran 1 Rendemen simplisia daun sirih hijau
Sampel
Bobot ekstrak = (bobot gelas piala + isi) – (bobot gelas piala kosong)
21 Lampiran 4 Aktivitas diameter zona hambat terhadap C.albicans
Lampiran 5 Analisis statistik aktivitas diameter zona hambat C. albicans
Konsentrasi (mg/mL)
Diameter zona hambat (mm)
Akuades Etanol 70% Aseton
U 1 U 2 U 3 U 1 U 2 U 3 U 1 U 2 U 3
25 0 0 0 0 0 0 3.725 3.225 5.325
50 0 0 0 0 0 0 11.925 8.95 15.900
100 4.550 4.975 5.225 0 0 0 15.875 12.775 18.687
200 8.900 9.950 7.975 5.175 5.700 7.025 21.375 19.800 22.025
22
Keterangan : Angka yang terletak pada satu kolom menyatakan nilai yang tidak berbeda nyata, sedangkan angka yang terletak pada beda kolom menyatakan nilai yang berbeda nyata. Nilai signifikan 1.00 menunjukkan tingkat yang paling berbeda nyata
Lampiran 6 Diameter zona hambat uji KHM ekstrak akuades terhadap C.albicans
Konsentrasi (mg/mL) Diameter zona hambat (mm)
U 1 U 2 U 3
60 0 0 0
70 1.075 1.625 2.725
80 2.200 2.650 3.100
90 3.925 3.925 3.975
23 Lampiran 7 Analisis statistik KHM ekstrak akuades terhadap C.albicans
Keterangan : Angka yang terletak pada satu kolom menyatakan nilai yang tidak berbeda nyata, sedangkan angka yang terletak pada beda kolom menyatakan nilai yang berbeda nyata. Nilai signifikan 1.00 menunjukkan tingkat yang paling berbeda nyata
Lampiran 8 Diameter zona hambat uji KHM ekstrak etanol 70% terhadap
C.albicans
Konsentrasi (mg/mL) Diameter zona hambat (mm)
U 1 U 2 U 3
120 0 0 0
140 2.325 2.150 3.300
160 2.350 3.125 3.350
180 3.225 4.325 4.500
24
Lampiran 9 Analisis statistik KHM ekstrak etanol 70% terhadap C.albicans
Keterangan : Angka yang terletak pada satu kolom menyatakan nilai yang tidak berbeda nyata, sedangkan angka yang terletak pada beda kolom menyatakan nilai yang berbeda nyata. Nilai signifikan 1.00 menunjukkan tingkat yang paling berbeda nyata
Lampiran 10 Diameter zona hambat pada KHM ekstrak aseton terhadap
C.albicans
Konsentrasi (mg/mL) Diameter zona hambat (mm)
U 1 U 2 U 3
6.25 0 0 0
12.5 1.750 1.675 1.800
25 3.725 3.225 5.325
50 11.925 8.950 15.900
25 Lampiran 11 Analisis statistik pada KHM ekstrak aseton terhadap C.albicans
Keterangan : Angka yang terletak pada satu kolom menyatakan nilai yang tidak berbeda nyata, sedangkan angka yang terletak pada beda kolom menyatakan nilai yang berbeda nyata. Nilai signifikan 1.00 menunjukkan tingkat yang paling berbeda nyata
Lampiran 12 Diameter zona hambat nistatin 1.028 mg/mL
Ulangan
Diameter (mm)
U 1 U 2 U 3
14. 900 13.800 14.500
Rataan 14.400±0.57
Contoh perhitungan :
Rata – rata diameter = mm
26
Lampiran 13 Dokumentasi penelitian uji antijamur
Uji KHM ekstrak akuades Uji KHM ekstrak etanol 70 %
Keterangan uji KHM:
Akuades: Etanol: Aseton:
1. Akuades 1. Akuades 1. Aseton
2. Nistatin 1.028 mg/mL 2. Nistatin 1.028 mg/mL 2. Nistatin 1.028 mg/mL
27
Keterangan:
1. Akuades (aktivitas ekstrak akuades dan etanol) dan aseton (ekstrak aseton)
2. Nistatin 1.028 mg/mL
3. 400 mg/mL
4. 200 mg/mL
5. 100 mg/mL
6. 50 mg/mL
7. 25 mg/mL
Lampiran 14 Dokumentasi uji fitokimia
(flavonoid ekstrak akuades U1 dan U2; ekstrak etanol 70 % U1 dan U2; ekstrak aseton U1 dan U2)
(tanin ekstrak akuades U1 dan U2; ekstrak etanol 70 % U1 dan U2; ekstrak aseton U1 dan U2)
(saponin ekstrak akuades U1 dan U2; ekstrak etanol 70 % U1 dan U2; ekstrak aseton U1 dan U2)
28
29
RIWAYAT HIDUP
Penulis merupakan putri dari Bapak Firman (alm) dan Ibu Yusnidar yang lahir pada tanggal 13 Maret 1992 di Bandar Lampung, Lampung. Penulis adalah putri kedua dari dua bersaudara. Penulis memulai pendidikannya di SD Negeri 2 Labuhan Ratu, Bandar Lampung dan lulus pada tahun 2004, dilanjutkan dengan pendidikan menengah di SMP Negeri 22 Bandar Lampung dan lulus pada tahun 2007, penulis melanjutkan ke SMA Negeri 4 Bandar Lampung dan lulus pada tahun 2010 serta berhasil diterima untuk melanjutkan pendidikan tinggi di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).