KARIOTIPE TIKUS (RODENTIA, MURIDAE) DAN KELELAWAR
PEMAKAN BUAH (MEGACHIROPTERA, PTEROPODIDAE) DARI
GUNUNG BAWAKARAENG, SULAWESI SELATAN
HUSNI MUBAROK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kariotipe Tikus (Rodentia, Muridae) dan Kelelawar Pemakan Buah (Megachiroptera, Pteropodidae) dari Gunung Bawakaraeng, Sulawesi Selatan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Husni Mubarok
RINGKASAN
HUSNI MUBAROK. Kariotipe Tikus (Rodentia, Muridae) dan Kelelawar Pemakan Buah (Megachiroptera, Pteropodidae) dari Gunung Bawakaraeng, Sulawesi Selatan. Dibimbing oleh DYAH PERWITASARI dan IBNU MARYANTO.
Mamalia Sulawesi tidak hanya kaya spesies tetapi tingkat endemisitasnya tinggi. Endemisitas tikus (Muridae) dan kelelawar pemakan buah (Pteropodidae) Sulawesi masing-masing mencapai 75.7% dan 10.7%. Studi kromosom maupun data kariotipe untuk spesies tikus dan kelalawar pemakan buah di Indonesia masih sangat kurang. Setidaknya hanya tujuh spesies tikus dan empat spesies kelelawar pemakan buah yang telah dilaporkan status kromosomnya. Hal ini terkait dengan teknik analisis kariotipe yang lebih cocok dilakukan secara laboratorium daripada di lapang. Tikus dan kelelawar telah diperkirakan memiliki laju evolusi kariotipe yang tinggi, sehingga informasi kariotipe baru dan kaitannya dengan filogenetik menjadikan kariotipe sangat penting.
Penelitian ini memiliki dua tujuan utama yaitu: (1) untuk menganalisis kariotipe tikus dan kelelawar pemakan buah Sulawesi menggunakan kromosom sumsum tulang dengan teknik G-banding (Giemsa); (2) untuk menganalisis perbedaan teknik kariotipe laboratorium dan lapang.
Dua jenis analisis kariotipe dilakukan pada penelitian ini yaitu analisis kariotipe laboratorium dan lapang. Analisis laboratorium digunakan sebagai penelitian uji coba sebelum ke lapang. Analisis kariotipe di laboratorium menggunakan spesimen mencit dengan berbagai perlakuan yang mencakup: (1) perbedaan pengaruh pemberian kolkisin 0.005% dengan waktu 2 dan 3 jam; (2) preservasi sumsum tulang pada larutan Phosphate-Buffered Saline (PBS) selama 2 sampai 15 hari dan (3) preservasi suspensi sel sumsum tulang pada larutan Carnoy selama 2 hari (48 jam) dan 4 hari (96 jam).. Analisis kariotipe di lapang dilakukan pada spesimen yang tertangkap di kawasan gunung Bawakaraeng, Sulawesi Selatan tanpa diikuti perlakuan seperti di laboratorium.
Spesimen disuntik menggunakan larutan ragi untuk meningkatkan mitosis dan inhibitor kolkisin untuk menangkap kromosom pada tahap mitosis tersebut. Fiksasi sumsum tulang spesimen dilakukan dengan menggunakan larutan Carnoy. Pewarnaan kromosom menggunakan perwarna Giemsa 4%. Kromosom pada tahap metafase terbaik dipotret dan diketahui jumlah diploid (2n), FN, FNa dan morfologinya. Kualitas kromosom pada perservasi PBS dan Carnoy diamati untuk mengetahui apakah teknik preservasi ini dapat diaplikasikan di lapang.
Kualitas kromosom dengan kolkisin 0.005% selama 2 jam menunjukkan hasil yang lebih baik dibandingkan waktu 3 jam. Sementara itu, kromosom pada preservasi PBS menunjukkan degradasi selama batas waktu preservasi, sehingga preservasi PBS tidak dapat diaplikasikan di lapang. Hal tersebut berbeda dengan preservasi Carnoy yang menunjukkan tampilan kromosom yang baik. Suspensi sel dengan preservasi Carnoy yang telah dibuat di lapang dapat dianalisis kembali di kondisi laboratorium. Teknik kariotipe merupakan teknik yang rentan terhadap kondisi lingkungan dan waktu. Satu spesies tikus dari delapan spesies dan dua spesies kelelawar dari lima spesies yang menunjukkan hasil preparat yang optimal. Hasil preparat kromosom spesimen lapang yang kebanyakan tidak menunjukkan hasil yang optimal diduga karena suhu lingkungan yang rendah. Kondisi lingkungan di laboratorium terutama suhu dapat secara mudah diatur daripada lapang.
SUMMARY
HUSNI MUBAROK. Karyotypes of Rats (Rodentia, Muridae) and Fruit Bats (Chiroptera, Pteropodidae) from Mt. Bawakaraeng, South Sulawesi. Supervised by DYAH PERWITASARI and IBNU MARYANTO.
Mammalian fauna of Sulawesi are not only rich in species but also high endemism level. Indonesian rats (Muridae) and bats (Pteropodidae) show highest endemism in Sulawesi among all islands over 75.7% and 10.7%, respectively. Both study of chromosome and karyotype data for rats and fruit bats in Indonesia are poorly known. Only several karyotype data of Indonesian fruits bats and rats have been studied. At least seven species of rats and four species of fruit bats were recorded succesfully. It due to karyotype techniques in laboratory are more applicable than those in the field. Rats and bats have been estimated to have a high rate of karyotype evolution, therefore the new karyotype information and its relationship to phylogenetic make karyotype become important.
This study study aimed to analyze karyotype of Sulawesi rats and fruit bats using bone marrow chromosomes with G-banding (Giemsa) technique; and to analyze the differences between karyotyping techniques in the laboratory and field.
Two types of karyotype analysis were conducted, those are karyotyping in laboratory and in field condition. Laboratory karyotyping using mice were used as a preliminary study. Some treatments were also conducted in laboratory, including (1) The differences of mitotic inhibitation using Colchicine 0.005% for 2 and 3 hours; (2) Bone marrow preservation using Phosphate-Buffered Saline (PBS) for 2 until 15 days and (3) Fixation of bone marrow using Carnoy for two days (48 hours) and four days (96 hours). Whereas, all of living specimens that were trapped in Mt. Bawakaraeng regions are used for karyotype analysis in the field.
Specimens were injected using yeast solution to increase index mitosis and Colchicine 0.005% to inhibit cellular process in metaphase. Bone marrow fixation of specimens were conducted by Carnoy solutions. Staining were done using Giemsa 4% . The best chromosome in metaphase stage were observed. Diploid number (2n), FN, FNa and its morphology were also determined. Quality of chromosomes in PBS and Carnoy were observed and determined whether or not this technique were applicable in field.
This study showed the quality of chromosomes in laboratory are more optimal than those in the field. Mice has 2n= 40, FN=40, FNa=38 and telocentric chromosomes. Only one species of rat showed the best karyotype namely female
R. hoffmanni (2n= 44, FN = 61, FNa = 59, telocentric X chromosomes). Futhermore, two species of fruit bats that showed the best karyotype, including male B. bidens (2n = 30, FN = 53, FNa = 50, X sub metacentric X chromosome and telocentric Y chromosome) and female T. suhaniahae (2n = 38, FN = 64, FNa = 60, metacentric X chromosomes). While, T. nigriscens has 2n=38 and D. viridis has 2n=34. Karyotypes of four species are described for the first time.
those in PBS. Cell suspension of bone marrow using Carnoy from the field can be re-analyzed in laboratory. Karyotype techniques are affected by environmental condition and times. Only one species of rats and two spesies of fruit bats were showed optimal chromosome preparations result in the field. Mostly chromosome preparations from the field were not optimal. This result suspected to be due the low temperature of environment. While, environmental condition in laboratory can be easily controlled.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biosains Hewan
KARIOTIPE TIKUS (RODENTIA, MURIDAE) DAN KELELAWAR
PEMAKAN BUAH (MEGACHIROPTERA, PTEROPODIDAE)
DARI GUNUNG BAWAKARAENG, SULAWESI SELATAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Kariotipe Tikus (Rodentia, Muridae) dan Kelelawar Pemakan Buah (Megachiroptera, Pteropodidae) dari Gunung Bawakaraeng, Sulawesi Selatan
Nama : Husni Mubarok
NIM : G352120021
Disetujui oleh
Komisi Pembimbing
Dr Ir R.R. Dyah Perwitasari, MSc Ketua
Prof (Ris) Dr Ir Ibnu Maryanto Anggota
Diketahui oleh
Ketua Program Studi Biosains Hewan
Dr Ir R.R. Dyah Perwitasari, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 30 Oktober 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam rangkaian penelitian yang dilaksanakan sejak bulan Maret 2014 ini yaitu kromosom, dengan judul Kariotipe Tikus (Rodentia, Muridae) dan Kelelawar Pemakan Buah (Megachiroptera, Pteropodidae) dari Gunung Bawakaraeng, Sulawesi Selatan.
Terima kasih penulis ucapkan kepada Ibu Dr Ir R.R. Dyah Perwitasari, MSc dan Bapak Prof (Ris) Dr Ir Ibnu Maryanto selaku pembimbing, serta Bapak Prof Dr Ir Cece Sumantri, MAgrSc selaku penguji luar komisi ujian tesis yang telah memberikan saran. Di samping itu, penghargaan penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) untuk Beasiswa Unggulan, Pemerintah Kabupaten Gowa, Sulawesi Selatan, Balai Konservasi dan Sumber Daya Alam (BKSDA) Sulawesi Selatan, Kepala Laboratorium Biologi Universitas Negeri Makassar, Seluruh staf Bidang Zoologi LIPI, Bu Tini dari Laboratorium Mikroteknik Biologi IPB, Joe Chun-Chia Huang PhD Candidate of Biology Texas Tech University yang telah memberikan masukan, Teman-teman Ellena Yusti, Rizaldy Trias, Agmal Qodri dan keluarga Tata’ yang telah membantu dalam pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 4
2 METODE 4
Lokasi dan Waktu Penelitian 4
Koleksi Spesimen 6
Identifikasi Spesimen 8
Analisis Kariotipe 14
Analisis Data 16
3 HASIL 18
Identifikasi dan Pengukuran Morfologi Luar Tikus (Muridae) dan
Kelelawar (Pteropodidae) 18
Analisis Kariotipe Laboratorium 31
Analisis Kariotipe Lapang 36
4 PEMBAHASAN 48
Identifikasi dan Pengukuran Morfologi Luar Tikus (Muridae) dan
Kelelawar (Pteropodidae) 48
Analisis Kariotipe Laboratorium 51
Analisis Kariotipe Lapang 53
Perbandingan Teknik Kariotipe Lapang dan Laboratorium 56
5 SIMPULAN 56
6 SARAN 57
DAFTAR PUSTAKA 57
DAFTAR TABEL
1 Karakter pengukuran morfologi luar (mm) dan singkatan pengukuran
spesimen tikus 9
2 Karakter pengukuran morfologi luar (mm) dan singkatan pengukuran
spesimen kelelawar 9
3 Karakter pengukuran tengkorak (mm) dan singkatan pengukuran spesimen
tikus 11
4 Karakter pengukuran tengkorak (mm) dan singkatan pengukuran spesimen
kelelawar 12
5 Kriteria tipe kromosom menggunakan Levan Plugin 17
6 Jumlah spesies, individu dan jenis kelamin tikus dan kelelawar yang
tertangkap dari kawasan Gunung Bawakaraeng 18 7 Pengukuran morfologi luar (mm) spesimen tikus yang tertangkap 19 8 Pengukuran morfologi luar (mm) spesimen kelelawar yang tertangkap 20 9 Pengukuran tengkorak (mm) spesimen tikus yang tertangkap 24 10 Pengukuran tengkorak (mm) spesimen kelelawar yang tertangkap 26 11 Pengukuran dan tipe kromosom M. musculus betina 32 12 Status kromosom tikus dan kelelawar dari Gunung Bawakaraeng,
Sulawesi Selatan 37
13 Pengukuran dan tipe kromosom R. hoffmanni betina MZB 37043 40 14 Pengukuran dan tipe kromosom B. bidens jantan MZB 37354 43 15 Pengukuran dan tipe kromosom T. suhaniahae betina MZB 37355 46
DAFTAR GAMBAR
1 Situs pengambilan spesimen 5
2 Tata letak perangkap tikus 6
3 Penempatan jaring kabut (mist net) pada koridor terbang kelelawar
(Kunz dan Kurta 1988) 7
4 Karakter pengukuran morfologi luar spesimen tikus (a) panjang kepala dan badan (HBL); (b) panjang ekor (T); (c) panjang telapak kaki belakang (HF); (d) panjang telinga (E) (Herbreteau et al. 2011) 9 5 Karakter pengukuran morfologi luar spesimen kelelawar (Rahman dan
Abdullah 2010) 10
6 Karakter pengukuran tengkorak tikus (Musser dan Durden 2002) 13 7 Karakter pengukuran tengkorak kelelawar (Maharadatunkamsi dan
Maryanto 2002)
DAFTAR GAMBAR (lanjutan)
12 Tengkorak spesimen kelelawar B. bidens dorsal (a1), ventral (a2).
Skala bar 10 mm 29
13 Tengkorak spesimen kelelawar (a) T. suhaniahae dorsal (a1), ventral (a2), (b) T. nigriscens dorsal (b1), ventral (b2), (c) S. wallacei dorsal
(c1), ventral (c2). Skala bar 10 mm 30 14 Kariotipe M .musculus betina perbesaran 1000 kali; Skala bar 2.16µm 31 15 Kromosom pada M. musculus (betina); Perbesaran 100 kali; Skala bar
2.16µm 33
16 Kromosom perbedaan inhibitasi mitosis kolkisin 0.005% (a) kromosom mencit perlakuan 2 jam (a1, a2), (b) kromosom mencit perlakuan 3 jam;
perbesaran 400 kali 34
17 Kromosom perlakuan preservasi PBS (a) kromosom mencit perlakuan 2 hari (a1,a2,a3), (b) kromosom mencit perlakuan 4 hari (b1, b2);
perbesaran 400 kali; Skala bar 2,5 µm 35
18 Kromosom perlakuan preservasi Carnoy (a) kromosom mencit perlakuan langsung (fresh) (a1,a2), (b) kromosom mencit perlakuan 2 hari (48 jam) (b1, b2), (c) kromosom mencit perlakuan 4 hari (96 jam); Perbesaran 400
kali; Skala bar 2,5 µm 36
19 Jumlah tipe kromosom pada spesimen tikus dan kelelawar 37 20 Kariotipe R. hoffmanni betina MZB 37043 perbesaran 1000 kali; Skala bar
3.26 µm 39
21 Beberapa kromosom R. hoffmanni MZB 37043 yang muncul pada
preparat yang telah dibuat; Perbesaran 1000 kali; Skala bar 2.26 µm 39 22 Kariotipe B. bidens jantan MZB 37354 perbesaran 1000 kali; Skala bar
2.17 µm. Panah menunjukkan kromosom tambahan 42 23 Beberapa kromosom B. bidens jantan MZB 37354 yang muncul pada
preparat yang telah dibuat; Perbesaran 100 kali; Skala bar 2.17 µm 42 24 Kariotipe T. suhaniahae betina MZB 37355 perbesaran 1000 kali;
Skala bar 3.16 µm 45
25 T. suhaniahae betina MZB 37355 yang muncul pada preparat;
Perbesaran 100 kali; Skala bar 3.16 µm 45
1 PENDAHULUAN
1.1 Latar Belakang
Tikus dan kelelawar termasuk dalam mamalia kecil (small mammals). Tikus (Ordo Rodentia) memiliki setidaknya 28 famili. Famili Muridae merupakan famili terbesar yang mencakup sub famili Murinae dengan dua genus terbesarnya yaitu Rattus dan Mus (Feldhamer et al. 1999). Murinae tersebar mulai dari Etiopia, Paleartik, Oriental, Australia dan Neartik. Kelelawar (Ordo Chiroptera) memiliki 17 famili yang terbagi menjadi subordo Megachiroptera dan Microchripotera (Feldhamer et al. 1999). Megachiroptera hanya memiliki satu famili yaitu Pteropodidae atau Old World fruit bats yang memiliki 42 genus dan 175 spesies (Corbet & Hill 1992; Feldhamer et al. 1999; Suyanto 2001; Maryanto & Yani 2003). Pteropodidae tersebar mulai dari selatan dan timur padang Sahara Afrika, India, Asia Tenggara, Australia sampai Pulau Caroline dan Cook di Pasifik. Habitat Pteropodidae yaitu hutan atau daerah bersemak pada area tropis dan subtropis yang banyak terdapat buah-buahan (Feldhamer et al. 1999).
Mamalia Sulawesi tidak hanya kaya spesies tetapi tingkat endemisitasnya tinggi. Persentase tikus (Muridae) yang terdistribusi di Indonesia sekitar 55% dari 720 spesies mamalia (LIPI-Bappenas-KLH 2014). Endemisitas tikus dari 16 pulau di Indonesia menunjukkan Sulawesi merupakan pulau yang paling tinggi tingkat endemisitasnya yaitu 75.7%, lebih tinggi dari Irian 73.4%. Endemisitas kelelawar pemakan buah mencapai 10.7% dengan jumlah spesies mencapai 28 spesies (Maryanto dan Higashi 2011).
Endemisitas tikus dan kelelawar pemakan buah di Sulawesi juga ditunjukkan dengan penemuan spesies baru seperti spesies tikus baru
Paucidentomys vermidax dari gunung Latimojong, Sulawesi Selatan dan
Margaretamys christinae dari Pegunungan Mekongga, Sulawesi Tenggara (Esselstyn et al. 2012; Mortelliti et al. 2012). Sementara itu, spesies baru kelelawar pemakan buah Sulawesi yaitu Rousettus linduensis dan Thoopterus suhaniahae. R. linduensis ditemukan di Taman Nasional Lore Lindu, Sulawesi (Maryanto dan Yani 2003). T. suhaniahae merupakan spesies simpatrik dengan T. nigrescens yang juga tersebar di Sulawesi (Maryanto et al. 2012).
Keberhasilan evolusi tikus dan kelelawar membuat takson ini paling menarik untuk studi di tingkat kromosom yaitu pola dan mekanisme perubahan kromosomnya (Romanenko et al. 2007; Wilson dan Reeder 2005). Kromosom merupakan mode pengemasan material inti (DNA), molekul dua utasDNA yang sangat panjang dilipat secara terus menerus membentuk untaian nukleosom dan struktur superkoil. Sebuah kromosom terdiri dari dua kromatid (sister chromatids) yang masing-masing terdiri dari dua utas DNA. Komponen struktural dan fungsional kromosom meliputi sentromer, telomer dan daerah nukleolar (NORs) yaitu satelit dan batang satelit (Gersen dan Keagle 2005). Kromosom memiliki lengan pendek (p) dan lengan panjang (q). Tipe kromosom beragam sesuai dengan letak sentromer yang membagi kedua lengan yaitu metasentrik, sub metasentik, telosentrik, sub telosentrik dan akrosentrik (Levan et al. 1964).
2
(q), panjang total (pq), posisi sentromer dan rasio lengan kromosom (Gersen dan Keagle 2005). Jumlah sel diploid (2n) dan Fundamental Number (FN) juga ditentukan dalam kariotipe. Sel diploid (2n) merupakan jumlah kromosom sel tubuh yang diperoleh dari pembelahan mitosis (Czepulkowski 2001).
Kromosom yang digunakan dalam analisis kariotipe dapat diperoleh dari berbagai jaringan hewan. Beberapa penelitian menggunakan sumsum tulang (Baker et al. 1982; Daele V et al. 2004; Todehdehghan et al. 2011), jaringan paru-paru atau ekor (Li et al. 2008) dan darah (Manosroi et al. 2003). Sumber tersebut masing-masing memiliki kelebihan dan kekurangan dalam teknik pembuatan kromosomnya. Kromosom dari sumsum tulang lebih banyak digunakan dalam penelitian kariotipe. Hal ini dikarenakan sumsum tulang merupakan jaringan yang memiliki sel kekebalan (imun) yang aktif membelah sehingga memberikan banyak mitosis (Dobigny dan Xuereb 2011).
Identifikasi morfologi kromosom kariotipe dapat dilakukan berdasarkan kromosom yang telah diwarnai. Setiap lengan kromosom memiliki dua daerah besar berbentuk pita yang disebut Band dan Sub Band (Gersen dan Keagle 2005). Perwarnaan kedua daerah tersebut disebut dengan Banding. Pola Banding spesifik pada tiap pasangan kromosom. Beberapa teknik pewarnaan kromosom yaitu Cd Staining (Centromeric dot/Kinetochore Staining), G-Banding (Giemsa), Q-Banding (Quinacrine Banding), R-Banding (Reverse Banding), C-Banding
(Constitutive Heterochromatin Banding), T-Banding (Telomere Banding), NOR Staining (Silver Staining for Nucleolar Organizer Regions), DAPI/DA Staining
dan Fluorescence In Situ Hybridization (FISH) (Gersen dan Keagle 2005). Teknik kariotipe G-banding merupakan teknik yang lebih banyak dan lebih sering digunakan untuk mempelajari susunan kromosom mamalia termasuk tikus dan kelelawar. Koopman (1982) melaporkan data kariotipe setidaknya 190 spesies kelelawar Amerika Selatan dengan 133 spesies menggunakan teknik G-banding
dan 52 spesies dengan C-banding.
Rodentia dan kelelawar telah diperkirakan memiliki laju evolusi kariotipe yang tinggi (Wilson et al. 1975). Jumlah informasi kariotipe baru dan kaitannya dengan filogenetik antar takson Rodentia (Muridae) terus bertambah secara cepat membuat penelitian kariotipe menjadi penting. Kelelawar menempati posisi yang sangat penting dalam evolusi mamalia, karena mereka terkait erat dengan Insektivora yang pada akhirnya berhubungan dengan Primata (Makino 1948). Oleh karena itu, studi kromosom kelelawar telah banyak dilakukan untuk mempelajari kajian tersebut. Wilson et al. (1975) menggunakan data kariotipe kelelawar dan spesies mamalia lain untuk mengembangkan teori evolusi mamalia. Lebih lanjut, Baker dan Bickham (1980) menggunakan teknik G-banding dan C-banding pada 78 spesies kelelawar dari 4 famili (Phyllostomatidae, Noctilionidae, Mormoopidae dan Vespertilionidae) untuk menjelaskan fenomena Megaevolusi Kariotipe.
Analisis kariotipe tikus (Rodentia, Muridae) dan kelelawar pemakan buah (Megachiroptera, Pteropodidae) di kawasan Asia Tenggara telah dilakukan pada beberapa spesies. Harada dan Kobayashi (1980) melakukan studi kromosom
Rattus rattus, Mus musculus (Rodentia, Muridae) dan Pteropus vampyrus,
3
Penelitian Li et al. (2008) pada tiga spesies Muridae pulau Hainan Cina yaitu Niviventer fulvescens, N. lotipes dan Rattus nitidus menunjukkan N. fulvescens (2n=46, FN=64) memiliki kesamaan kariotipe dengan N. fulvescens
Asia Tenggara sementara N. lotipes (2n=52, FN=66) yang sebelumnya diduga satu spesies dengan N. tenaster (2n=46, FN=54) dari Burma dan Vietnam ternyata memiliki kariotipe yang berbeda Hasil penelitian kariotipe tersebut digunakan untuk menentukan status taksonomi yang jelas dari N. Lotipes.
Hood et al. (1988) telah melakukan studi pada Rousettus amplexicaudatus,
P. lylei, C. sphinx, Megaerops niphanae, Eonycteris spelaea dan Macroglossus sobrinus di Thailand. Hasil studi tersebut menunjukkan kariotipe P. lylei (2n = 40; FN = 72) merupakan informasi baru untuk genus Pteropus. Lebih lanjut, kariotipe
M. niphanae (2n = 26; FN = 42) memiliki jumlah yang berbeda dengan M. niphanae dari semenanjung Malaysia (2n = 24) dan identik dengan spesies terdekatnya M. ecaudatus. Hal tersebut menunjukkan terdapat variasi kromosom antar spesies Megaerops dikarenakan terjadinya translokasi Robertsonian. Translokasi Robertsonian (Robertsonian Translocation) adalah perubahan susunan kromosom yang dibentuk oleh penggabungan (fusion) atau pembelahan (fission) lengan panjang dari dua kromosom akrosentrik atau telosentrik (Capanna dan Castiglia 2004).
Studi kromosom maupun data kariotipe untuk spesies tikus (Rodentia, Muridae) dan kelalawar pemakan buah (Pteropodidae) di Indonesia masih sangat kurang, termasuk untuk spesies baru maupun spesies endemik di Sulawesi. Beberapa data kariotipe tikus di Indonesia yang telah diteliti yaitu Bunomys chrysocomus, Maxomys hellwaldi, Rattus argentiventer, Rattus hoffmanni linduensis, Rattus marmosurus facetus; Margaretamys beccarii dan
Margaretamys elegans (Muridae) (Duncan 1976; Musser 1981); sedangkan kelelawar pemakan buah meliputi Cynopterus brachyotis javanicus, Cynopterus sphinx titthaecheilus, Eonycteris spelaea spelaea, Macroglossus minimus minimus
(Ando et al. 1980). Data kariotipe untuk genus tikus dan kelelawar lain seperti
Taeromys, Paruromys, Boneia, Dobsonia, Nyctimene, Styloctenium, Thoopterus, belum dipelajari. Penelitian ini diharapkan memberikan data kariotipe untuk spesies tikus dan kelelawar pemakan buah Sulawesi serta teknik pembuatannya.
4
dengan kolkisin akan memperlihatkan pengaruh negatif yaitu banyak sel yang mati atau terdegradasi (Brues dan Cohen 1936).
Levan (1938) telah melakukan penelitian efek kolkisin pada mitosis ujung akar bawang bombay (Allium fistulosum)dan bawang merah (A. cepa). Penelitian tersebut menggunakan berbagai konsentrasi dan waktu perendaman kolkisin. Perendaman kolkisin selama 7 menit sampai satu jam menghasilkan pembelahan kromosom yang baik. Sementara itu, perendaman kolkisin 12 sampai 24 jam menyebabkan benang-benang pembelahan (spindel) beregenerasi dan banyak menghasilkan kromosom yang abnormal. Perendaman 36 sampai 48 jam menyebabkan mitosis kembali ke keadaan normal. Penggunaan kolkisin pada hewan dilakukan penyuntikan. Waktu yang dibutuhkan setelah penyuntikan (injeksi) kolkisin untuk spesimen hewan rata-rata berkisar antara dua sampai tiga jam (Baker et al. 1982; Dobigny dan Xuereb 2011). Penelitian ini menganalisis waktu inhibitasi mitosis dengan kolkisin yang tepat untuk hasil kromosom yang optimal.
Preservasi sumber kromosom telah dilakukan oleh Pennock et al. (1968). Sumber kromosom yang diperservasi meliputi tulang tungkai, tulang belakang (minus spinal cord) dan gonad kadal Genus Uta (Family Iguanidae) dengan menggunakan larutan Phosphate-Buffered Saline (PBS). Namun, penelitian tersebut tidak menjelaskan berapa waktu preservasinya. Penelitian tersebut dilakukan dalam kondisi lapangan dan menghasilkan kualitas preparat kromosom yang baik. Penelitian ini mengadopsi teknik tersebut dan melakukan serangkaian pengembangan teknik sehingga didapatkan perbandingan teknik antara kondisi laboratorium dan lapang.
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) menganalisis kariotipe tikus dan kelelawar pemakan buah Sulawesi menggunakan kromosom sumsum tulang dengan teknik G-banding (Giemsa); (2) menganalisis perbedaan teknik kariotipe laboratorium dan lapang.
2 BAHAN DAN METODE
2.1 Lokasi dan Waktu Penelitian
5
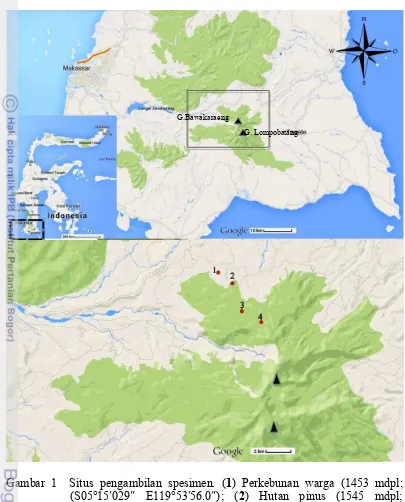
Gambar 1 Situs pengambilan spesimen. (1) Perkebunan warga (1453 mdpl; (S05°15 029 E119°53 56.0 ); (2) Hutan pinus (1545 mdpl; S05°15 29.3 E119°54 31.8 ); (3) Hutan peralihan sekunder ke primer (1835 mdpl; S05°16 42.5 E119°54 58.5 ); (4) Hutan primer (2165 mdpl; S05°17 11.4 E119°55 47.6 ) (Sumber: GoogleMap 2014)
G.Bawakaraeng
6
2.2 Koleksi Spesimen
2.2.1 Spesimen Tikus
Pengambilan spesimen menggunakan perangkap dengan teknik garis transek menurut Maryanto et al. (2009). Sepuluh garis transek dengan panjang 100 m diletakkan di setiap habitat (interval 20 m) dengan 20 perangkap (10
Kasmin cage trap 28x12x12 cm dan 10 snap trap 8x15cm) di setiap garis secara bergantian pada interval 5 m. Jumlah perangkap pada keseluruhan transek yaitu 200 perangkap. Umpan yang digunakan yaitu kelapa bakar dan ikan kering. Perangkap diletakkan selama empat malam sehingga memberikan standar penangkapan 800 perangkap per habitat (Maryanto et al. 2009).
Spesimen yang masuk perangkap cage trap diberi label dan diaklimatisasi untuk pembuatan kariotipe. Spesimen yang tertangkap pada snap trap
diidentifikasi lebih lanjut. Keseluruhan spesimen disimpan di divisi Zoologi, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
7
2.2.2 Spesimen Kelelawar
Kelelawar ditangkap dengan menggunakan 6 jaring kabut (Mist Net) dengan panjang 12 x 3 m dan 9 x 2.5 m pada masing-masing situs pengambilan. Jaring ditempatkan pada koridor terbang kelelawar seperti di sekitar pohon buah atau aliran sungai. Ketinggian jaring 2 sanpai 3 m di atas permukaan tanah (Gambar 3). Pengambilan spesimen dilakukan selama empat malam penangkapan, dimulai pada pukul 17.00 sampai 21.00. Faktor abiotik dan biotik seperti suhu, kelembaban udara, kecepatan angin dan komposisi vegetasi diukur sebagai data pendukung. Spesimen yang tertangkap diaklimatisasi sebelum dilakukan perlakuan analisis kariotipe.
8
2.3 Identifikasi Spesimen
Identifikasi spesimen dilakukan berdasarkan Corbet dan Hill (1992), Suyanto (2001), Musser (1981) dan spesimen dari Museum Zoologicum Bogoriense (MZB), Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Identifikasi sampai tingkat spesies, termasuk penentuan jenis kelamin, umur, status reproduksi, serta pengukuran morfologi luar dan tengkorak. Spesimen dikatalog dan disimpan di Museum Zoologicum Bogoriense (MZB).
2.3.1 Jenis Kelamin, Umur dan Status Reproduksi
Spesimen Tikus
Individu jantan dan betina dibedakan dengan melihat organ reproduksi luar yaitu keberadaan skrotum yang menutupi testis (jantan dewasa) dan vagina (betina). Identifikasi jenis kelamin dilakukan dengan melihat jarak antara anus dan organ reproduksi luar (Herbreteau et al. 2011). Betina memiliki jarak antara anus dan organ reproduksi luar yang lebih dekat dibandingkan dengan jantan. Kematangan seksual dan tahap perkembangan remaja (juvenile), sub dewasa ( sub-adult) atau dewasa (adult) ditentukan melalui pengamatan organ reproduksi luar dan atau reproduksi dalam serta perkembangan gigi geraham ketiga (M3) pada rahang bawah.
Spesimen Kelelawar
Kelelawar jantan dan betina dapat dibedakan dengan melihat alat reproduksi luarnya yaitu penis dan testis pada jantan, vagina dan kelenjar susu pada betina (Racey 1988). Penis yang ereksi dan ukuran testis yang besar menunjukkan jantan yang sudah mampu bereproduksi (dewasa). Abdomen yang penuh dan menonjol pada betina menunjukkan kebuntingan. Betina yang menyusui dilihat dari kelenjar susu yang membesar dan apabila ditekan akan mengeluarkan air susu (Racey 1988). Kelelawar remaja dapat dibedakan dari dewasa dengan melihat adanya tulang rawan lempeng epifisis (cartilaginous epiphyseal plates) pada tulang jari. Hal tersebut membuat persendian jari lebih menonjol (Anthony 1988).
2.3.2 Pengukuran Morfologi Luar
Pengukuran dilakukan dengan menggunakan jangka sorong digital dengan tingkat ketelitian 0.001 mm. Data pengukuran hanya digunakan untuk keperluan identifikasi spesies.
Spesimen Tikus
Pengukuran morfologi luar dilakukan berdasarkan Herbreteau et al.
9
Spesimen Kelalawar
Pengukuran dilakukan sebagai acuan identifikasi berdasarkan Rahman dan Abdullah (2010). Pengukuran morfologi luar meliputi 16 karakter pengukuran yang disajikan Tabel 2 dan Gambar 5.
Tabel 1 Karakter pengukuran morfologi luar (mm) dan singkatan pengukuran spesimen tikus
Karakter pengukuran Singkatan
Panjang kepala dan tubuh (Head and Body Length) Panjang ekor (Tail)
Panjang telapak tangan kaki belakang (Hind Foot) Tinggi telinga (Ear)
HBL T HF E
Tabel 2 Karakter pengukuran morfologi luar (mm) dan singkatan pengukuran spesimen kelelawar
Karakter pengukuran Singkatan
Panjang kepala dan badan (Head and Body Length) Panjang ekor sampai ventral (Tail to Ventral) Panjang lengan atas (Forearm)
Panjang tibia Tinggi telinga
Panjang telapak kaki belakang (Hind Foot) Panjang digit metacarpal kedua
Panjang digit metacarpal ketiga Panjang digit phalange pertama Panjang digit phalange kedua Panjang digit metacarpal keempat Panjang digit pertama phalange keempat Panjang phalange kedua
Panjang digit metacarpal kelima Panjang digit pertama phalange kelima Panjang phalange kedua
10
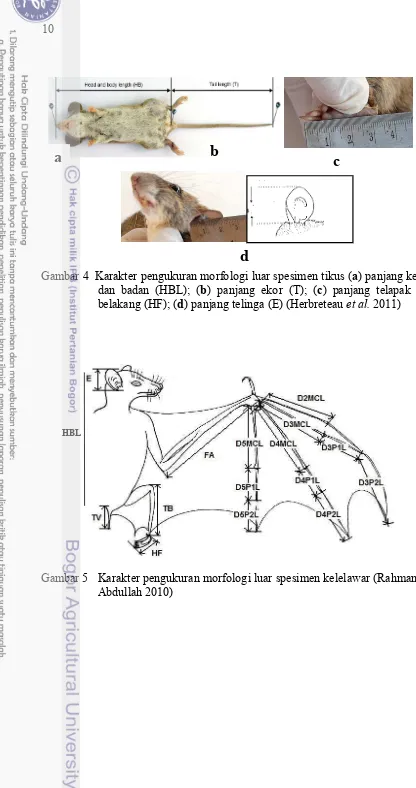
Gambar 4 Karakter pengukuran morfologi luar spesimen tikus (a) panjang kepala dan badan (HBL); (b) panjang ekor (T); (c) panjang telapak kaki belakang (HF); (d) panjang telinga (E) (Herbreteau et al. 2011)
Gambar 5 Karakter pengukuran morfologi luar spesimen kelelawar (Rahman dan Abdullah 2010)
HBL
a
b
c
11
2.3.3 Pengukuran Tengkorak
Pengukuran tengkorak dilakukan menggunakan jangka sorong digital dengan tingkat ketelitian 0.001 mm. Data pengukuran hanya digunakan untuk keperluan identifikasi. Sebelum diukur tengkorak dibersihkan menggunakan metode Hot Water Maceration (Chaval et al. 2011). Tengkorak yang sudah dipisahkan dari kulit direbus dalam air mendidih selama 15 sampai 30 menit. Jaringan otot dan mata pada tengkorak yang telah lunak selanjutnya dibersihkan.
Spesimen Tikus
Pengukuran tengkorak spesimen tikus dilakukan berdasarkan Musser dan Durden (2002). Pengukuran mencakup 15 karakter pengukuran yang disajikan Tabel 3 dan Gambar 6.
Tabel 3 Karakter pengukuran tengkorak (mm) dan singkatan pengukuran spesimen tikus
Karakter pengukuran Singkatan
Panjang tengkorak terbesar (Occipitonasal Length) Panjang rostrum (Length of Rostrum)
Lebar rostrum (Breadth of Rostrum) Lebar interorbital (Interorbital Breadth) Lebar tempurung otak (Breadth of Braincase) Lebar zigomatik (Zygomatic Breadth)
Panjang diastema (Length of Diastema)
Panjang tulang palatal (Length of Bony Palate)
Lebar gigi geraham atas pertama (Breadth of First Upper Molar) Panjang incisive foramina (Length of Incisive Foramina)
Panjang postpalatal (Postpalatal Length)
Lebar mesopterygoid fossa (Breadth ofMesopterygoid Fossa) Tinggi tempurung otak (Height of Braincase)
Panjang baris geraham rahang atas (Crown Length of Maxillary Molar Row)
Lebar lempeng zigomatik (Breadth of Zygomatic Plate)
12
Spesimen Kelalawar
Pengukuran tengkorak spesimen kelelawar dilakukan menurut Maharadatunkamsi dan Maryanto (2002). Pengukuran tengkorak meliputi 16 karakter pengukuran yang disajikan Tabel 4 dan Gambar 7.
Tabel 4 Karakter pengukuran tengkorak (mm) dan singkatan pengukuran spesimen kelelawar
Karakter pengukuran Singkatan
Panjang tengkorak terbesar (Greatest Skull Length) Lebar interorbital (Least Interorbital Width)
Lebar postorbital (Postorbital Width) Lebar zigomatik (Zygomatic Breadth) Lebar tempurung otak (Braincase Width)
Lebar mesopterygoid fossa (Mesopterygoid FossaWidth) Panjang bulla (Bullae Length)
Panjang palatal (Palatal Length) Panjang ramus angular process (Ramus Angular Process Length) Panjang gigi (Dentary Length)
Lebar antar gigi taring pertama rahang atas (Width between Upper Canine)
Lebar antar gigi taring pertama rahang bawah (Width between Lower Canine)
Lebar antar gigi geraham ketiga rahang atas (Width between Upper Third Molar)
Lebar antar gigi geraham ketiga rahang bawah (Width between Lower Third Molar)
Panjang gigi taring pertama sampai molar ketiga rahang atas (Upper First Canine to Third Upper Molar Length)
Panjang gigi taring pertama sampai molar ketiga rahang bawah(Lower First Canine to Third Lower Molar Length)
13
Gambar 6 Karakter pengukuran tengkorak tikus (Musser dan Durden 2002)
14
2.4 Analisis Kariotipe
Dua jenis analisis kariotipe dilakukan pada penelitian ini yaitu analisis kariotipe laboratorium dan lapang. Analisis laboratorium digunakan sebagai penelitian uji coba sebelum ke lapang. Analisis laboratorium menggunakan spesimen mencit (M. musculus) dengan berbagai perlakuan yang mencakup (1) perbedaan pengaruh pemberian kolkisin 0.005% dengan waktu 2 dan 3 jam; (2) preservasi sumsum tulang pada larutan Phosphate-Buffered Saline (PBS) dan (3) preservasi suspensi sel sumsum tulang pada larutan Carnoy. Analisis kariotipe lapang dilakukan pada spesimen yang tertangkap di kawasan Gunung Bawakaraeng.
2.4.1 Analisis Kariotipe Laboratorium dan Lapang
Analisis kariotipe laboratorium dan lapang dilakukan menurut Baker et al. (1982) dan Dobigny dan Xuereb (2011) yang dikombinasikan dan dimodifikasi yang mencakup aklimatisasi spesimen, peningkatan kualitas mitosis, inhibitasi mitosis (penangkapan mitosis), pengambilan sumsum, perlakuan pada larutan hipotonik, fiksasi sel, persiapan preparat dan pewarnaan.
Aklimatisasi Spesimen
Spesimen yang akan digunakan diaklimatisasi terlebih dahulu. Aklimatisasi dilakukan dengan cara meletakkan spesimen pada kandang yang telah diberi pakan dan air minum. Spesimen yang digunakan pada analisis kariotipe laboratorium yaitu dua mencit betina dewasa. Analisis kariotipe lapang menggunakan spesimen kelelawar dan tikus yang didapatkan dari perangkap cage trap.
Peningkatan Kualitas Mitosis
Spesimen ditimbang terlebih dahulu. Larutan ragi (yeast solution) dibuat dari 3 g ragi ditambahkan 2 g glukosa dan 12 ml akuades (modifikasi Baker et al. 1982). Larutan ragi diinjeksikan ke spesimen secara subkutan pada bagian punggung untuk menghindari kerusakan internal. Dosis yang dipakai yaitu 0.1 ml/ 10 g berat badan. Spesimen dibiarkan 12 sampai 24 jam sebelum dilakukan tahap selanjutnya.
Inhibitasi Mitosis (Penangkapan Mitosis)
Mitosis tahap metafase diperoleh dengan menginjeksi spesimen dengan inhibitor mitosis kolkisin 0.005% secara intraperitoneal dengan dosis 0.1 ml/ 10 g berat badan dan dibiarkan 2 sampai 3 jam sebelum dilakukan dislokasi leher (Baker et al. 1982).
Pengambilan Sumsum Tulang
Spesimen didislokasi leher, dibedah dan diambil tulang femur (pada mencit dan tikus) atau humerus (pada kelelawar). Tulang dibersihkan dari otot yang menempel. Sumsum tulang diambil dengan cara memasukkan Syringe
15
Perlakuan Menggunakan Larutan Hipotonik
Sumsum yang didapatkan selanjutnya direndam dalam larutan hipotonik KCl 0.075 M yang dibuat dari 0.56 g KCl yang ditambah 100 ml akuades selama 30 sampai 45 menit. Sumsum digerus dan dimasukkan ke dalam tabung reaksi, selanjutnya disentrifugasi dengan kecepatan 1200 rpm selama 10 menit (Dobigny dan Xuereb 2011).
Fiksasi Sel
Supernatan hasil sentrifugasi dibuang dan pelet sel direndam dalam larutan fiksatif Carnoy selama 15 menit. Larutan fiksatif Carnoy dibuat dari metanol yang dicampurkan dengan asam asetat glasial dengan perbandingan 3:1 (Dobigny dan Xuereb 2011). Campuran pelet sel dengan larutan fiksatif Carnoy disentrifugasi kembali dengan kecepatan 1200 rpm selama 10 menit. Larutan Carnoy dibuang dan diganti dengan yang baru sebanyak 0.5 ml, selanjutnya dikocok perlahan sehingga terbentuk suspensi sel (Baker et al. 1982).
Persiapan Preparat
Suspensi sel yang terbentuk pada langkah sebelumnya dihisap dengan pipet Pasteur dan diteteskan pada gelas objek yang telah dibersihkan dengan alkohol 70%. Jarak penetesan antara pipet dengan gelas objek yaitu sekitar 10 cm, dilakukan dengan cara satu kali tetes dan dibiarkan menyebar merata (Baker et al. 1982). Selanjutnya preparat dikeringkan di atas api bunsen hingga kering.
Pewarnaan
Pewarnaan preparat dengan menggunakan Giemsa 4% selama 30 menit (Baker et al. 1982; Dobigny dan Xuereb 2011). Preparat dibilas dengan air mengalir dan dikeringkan pada suhu ruangan.
2.4.2 Analisis Kariotipe Laboratorium: Perbedaan Inhibitasi Mitosis Mencit dengan Kolkisin 0.005% selama 2 Jam dan 3 Jam
Spesimen yang digunakan yaitu dua mencit betina dewasa. Spesimen diinjeksi dengan inhibitor mitosis kolkisin 0.005% secara intraperitoneal dengan dosis 0.1 ml/ 10 g berat badan selama 2 jam dan 3 jam. dilihat kualitas kromosomnya dan dibandingkan waktu terbaik untuk pemberian kolkisin.
2.4.3 Analisis Kariotipe Laboratorium: Pembuatan Larutan Phosphate-Buffered Saline (PBS)
Pembuatan larutan PBS dilakukan menurut metode modifikasi Pennock et al. (1968) berdasarkan Dulbecco dan Vogt's (1954). Larutan garam (saline solution) dibuat dengan melarutkan 8 g NaCl, 0.2 g KCl, 1.15 g Na2HPO4 dan0.2
g KH2PO4 dengan 800 ml H2O. Larutan tersebut ditambahkan 0.01 μg/ml
16
2.4.4 Analisis Kariotipe Laboratorium: Preservasi Sumsum Tulang Mencit pada Larutan PBS
Spesimen yang digunakan yaitu empat mencit jantan dan empat mencit betina dewasa. Keseluruhan sampel diambil dari kandang pemuliaan hewan, Fakultas Peternakan IPB. Tulang femur yang telah diambil dan dibersihkan, disimpan dalam larutan PBS sampai terendam seluruhnya. Kedua ujung tulang dipotong sehingga larutan PBS dapat masuk sampai sumsum tulang. Preservasi dilakukan selama 2, 4, 6, 8, 12 dan 15 hari. Preparat kromosom dibuat dengan terlebih dahulu mensentrifugasi sumsum tulang yang dipreservasi dengan kecepatan 1200 rpm selama 10 menit.
2.4.5 Analisis Kariotipe Laboratorium: Preservasi Suspensi Sel Sumsum Tulang Mencit pada Larutan Carnoy
Suspensi sel yang telah dibuat pada tahap fiksasi sel analisis kariotipe laboratorium disimpan selama 2 hari (48 jam) sampai 4 hari (96 jam). Tahapan yang sama seperti tahap fiksasi sel juga dilakukan dan selanjutnya suspensi terlebih dulu disentrifugasi dengan kecepatan 1200 rpm selama 10 menit sebelum dibuat preparatnya.
2.4.6 Pengamatan Kromosom
Preparat yang telah kering diamati di mikroskop dengan perbesaran 400 sampai 1000 kali. Kromosom yang berada pada metafase terbaik selanjutnya dipotret dengan menggunakan kamera OptiLab Profesional.
2.5 Analisis Data
Kromosom yang dibuat kariotipe diambil dari lima tahap metafase yang paling baik per spesimen seperti yang dilakukan oleh Daele et al. (2004). Kromosom disusun berdasarkan lokasi sentromer menurut Levan et al. (1964). Lokasi sentromer meliputi median, sub median, sub terminal, dan terminal. Lokasi sentromer didapatkan dengan menghitung rasio lengan (AR) dan panjang total kromosom (pq) sesuai morfologi kromosom.
panjang lengan panjang (q) (%)
AR (%) = pq (%) = p + q
panjang lengan pendek (p) (%)
Hasil pemotretan kromosom diolah menggunakan Adobe Photoshop CS3 dengan 35 kali perbesaran (35%). Panjang lengan panjang (q), lengan pendek (p), panjang total (pq) dan rasio lengan (AR) kromosom diukur menggunakan ImageJ
software (Abramoff et al. 2004; Software dapat diunduh secara gratis pada situs
http://rsbweb.nih.gov/ij/download.html). Tipe kromosom juga dapat diketahui
17
(2n), indeks sentromer (CI), fundamental number (FN) dan fundamental number
autosom (FNa) juga dihitung.
Indeks sentromer (CI) merupakan rasio panjang lengan pendek dan panjang total lengan kromosom (Loganathan et al. 2012). Lebih lanjut indeks sentromer sangat penting dalam bidang geometri klasifikasi kromosom, selain tipe
banding. Indeks sentromer dihitung dengan perhitungan sebagai berikut:
Fundamental number (FN) kromosom juga dihitung. FN merupakan jumlah total keseluruhan lengan kromosom baik autosom maupun kromosom kelamin. FNa adalah jumlah total lengan kromosom tubuh (autosom) tanpa kromosom kelamin (Baker dan Patton 1967). Kriteria penentuan morfologi tipe kromosom yang ditentukan berdasarkan Levan Plugin berbeda dengan kriteria yang dijelaskan oleh Levan et al. (1964) serta Green dan Sessions (1991). Perbedaan tersebut disajikan pada Tabel 5.
Tabel 5 Kriteria tipe kromosom dengan menggunakan Levan Plugin (Sakamoto dan Zacaro 2009)
Rasio Lengan (AR)
Levan et al. (1964)
Green dan Sessions
(1991) LevanPlugin 1.0 M
M M 1.0 ≤ x < 1.7 m
1.7 ≤ x < 3.0 SM SM SM
3.0 ≤ x < 7.0 ST ST ST
7.0 ≤ x < α A
T T
α T
M, m: Metasentrik; SM: Sub Metasentrik; ST: Sub Telosentrik; A: Akrosentrik; T: Telosentrik Panjang lengan pendek (p)
CI = x 100 %
18
3 HASIL
3.1 Identifikasi dan Pengukuran Morfologi Luar Tikus (Muridae) dan Kelelawar(Pteropodidae)
Delapan spesies (24 individu) tikus dan lima spesies (15 individu) kelelawar didapatkan untuk analisis kariotipe lapang. Spesies tikus yang didapat meliputi Rattus hoffmanni (Matschie, 1897), Bunomys andrewsi (Allen JA, 1911),
Bunomys chrysocomus (Hoffman, 1887), Paruromys sp., Bunomys heinrichi (Tate & Archbold, 1935), Taeromys celebensis (Gray, 1867), Rattus dommermani
(Thomas, 1921) dan Rattus exulans (Peale, 1848). Spesies kelelawar yang didapat meliputi Boneia bidens (Jentink, 1879), Thoopterus suhaniahae Maryanto et al. 2012, Thoopterus nigrescens (Gray, 1870), Styloctenium wallacei (Gray, 1866) dan Dobsonia viridis (Heude, 1897) (Tabel 6).
Kebanyakan spesies yang didapat merupakan spesies endemik Sulawesi, termasuk spesies yang baru ditemukan seperti T. suhaniahae. Keseluruhan spesimen tikus dan kelelawar untuk analisis kariotipe lebih banyak didapat di perkebunan warga kecuali R. hoffmanni dan T. suhaniahae yang juga didapat di hutan pinus. Selanjutnya, Bunomys chrysocomus dan Paruromys sp. hanya didapat di hutan primer. Spesimen kelelawar tidak didapat di hutan peralihan dan hutan primer.
Tabel 6 Jumlah spesies, individu dan jenis kelamin tikus dan kelelawar yang tertangkap dan digunakan dalam analisis kariotipe di Gunung Bawakaraeng
Spesies Jumlah Individu Jantan Betina Lokasi
Famili Muridae
Perkebunan Warga; (2) Hutan Pinus; (3) Hutan Transisi (sekunder ke primer);(4) Hutan Primer
19
37122; MZB 37354; MZB 37355; MZB 37297; MZB 37356; MZB 37357; MZB 37358; MZB 37359; MZB 37360; MZB 37315; MZB 37318; MZB 37311; MZB 37312.
Pengukuran Morfologi Luar
Spesimen Tikus (Muridae)
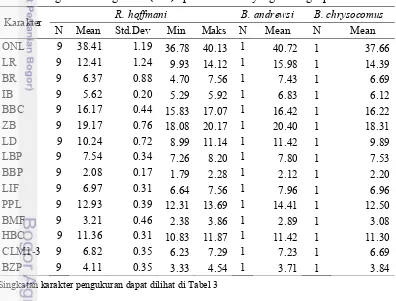
Paruromys sp. memiliki ukuran tubuh yang lebih besar diantara spesimen yang tertangkap. R. dommermani memiliki rata-rata ukuran tubuh yang lebih besar dan ekor yang lebih panjang diantara spesimen Rattus (R. hoffmanni dan R. exulans). B. andrewsi memiliki ukuran morfologi luar yang lebih besar dari B. chrysocomus dan B. heinrichi kecuali pada karakter panjang ekor (T). T. celebensis cenderung memiliki ekor yang panjangnya dua kali lipat panjang tubuhnya (Tabel 7). Beberapa spesimen tikus ditunjukkan Gambar 8.
Tabel 7 Pengukuran morfologi luar (mm) spesimen tikus yang tertangkap
Karakter R. hoffmanni
B.
Singkatan karakter pengukuran dapat dilihat di Tabel 1
Tabel 7 Pengukuran morfologi luar (mm) spesimen tikus yang tertangkap (lanjutan)
Karakter Paruromys sp. B.heinrichi T. celebensis
N Mean N Mean N Mean St.dev Min Maks
HBL 1 187.20 1 129.30 2 135.05 5.02 131.50 138.60
T 1 235.10 1 131.80 2 201.65 15.77 190.50 212.80
HF 1 45.20 1 33.30 2 40.90 2.55 39.10 42.70
E 1 27.40 1 22.30 2 21.65 2.76 19.70 23.60
Singkatan karakter pengukuran dapat dilihat di Tabel 1
Tabel 7 Pengukuran morfologi luar (mm) spesimen tikus yang tertangkap (lanjutan)
Karakter R. dommermani R. exulans
N Mean St.dev Min Maks N Mean
HBL 8 141.64 14.05 121.10 155.90 1 89.40
T 8 173.98 21.27 154.40 210.00 1 151.70
HF 8 34.90 1.55 33.00 36.75 1 32.30
E 8 20.48 2.86 16.13 23.10 1 22.10
20
Gambar 8 Beberapa spesimen tikus (a) R. hoffmanni, (b) B. heinrichi, (c) T. celebensis, (d) R. exulans, (e) R. dommermani. Skala bar 10 mm
a
b
c
d
21
Spesimen Kelalawar (Pteropodidae)
Hasil pengukuran 16 karakter pengukuran morfologi luar spesimen kelelawar menunjukkan spesimen yang memiliki rata-rata ukuran tubuh yang lebih besar (untuk keseluruhan jenis kelamin) yaitu S. wallacei (Tabel 8). B. bidens dan D. viridis juga memiliki ukuran tubuh yang relatif lebih besar. Beberapa spesimen kelelawar tidak memiliki ekor seperti T. suhaniahae, T. nigrescens dan S. wallacei. Perbedaan karakter morfologi luar yang menonjol antara T. suhaniahae dan T. nigrescens yaitu ukuran tubuh (HBL), lengan atas (FA), panjang digit metacarpal kedua (D2MCL) dan Panjang digit pertama
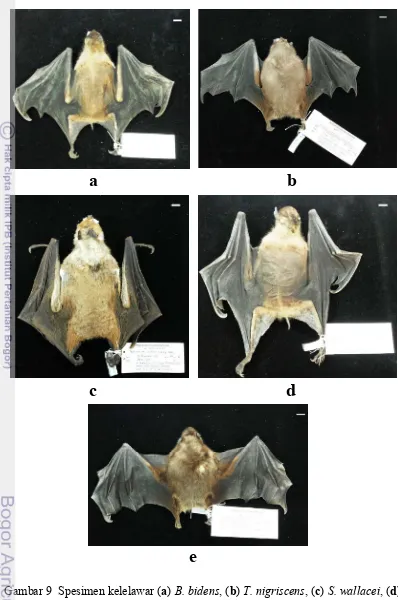
phalange keempat (D4P1L). Beberapa spesimen kelelawar penelitian ini ditunjukkan Gambar 9.
.
Tabel 8 Pengukuran morfologi luar (mm) spesimen kelelawar yang tertangkap
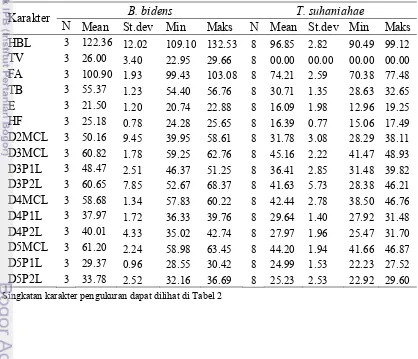
Karakter B. bidens T. suhaniahae
N Mean St.dev Min Maks N Mean St.dev Min Maks
HBL 3 122.36 12.02 109.10 132.53 8 96.85 2.82 90.49 99.12
TV 3 26.00 3.40 22.95 29.66 8 00.00 00.00 00.00 00.00
FA 3 100.90 1.93 99.43 103.08 8 74.21 2.59 70.38 77.48
TB 3 55.37 1.23 54.40 56.76 8 30.71 1.35 28.63 32.65
E 3 21.50 1.20 20.74 22.88 8 16.09 1.98 12.96 19.25
HF 3 25.18 0.78 24.28 25.65 8 16.39 0.77 15.06 17.49
22
Tabel 8 Pengukuran morfologi luar (mm) spesimen kelelawar yang tertangkap (lanjutan)
Karakter T. nigrescens S. wallacei D. viridis
N Mean N Mean N Mean St.dev Min Maks
HBL 1 98.63 1 145.22 2 139.59 1.11 138.80 140.37
TV 1 0.00 1 0.00 2 23.20 0.57 22.80 23.60
FA 1 72.32 1 94.55 2 118.04 0.04 118.01 118.07
TB 1 30.42 1 45.26 2 58.64 0.62 58.20 59.08
E 1 17.84 1 22.53 2 26.52 1.32 25.58 27.45
HF 1 16.83 1 27.20 2 22.90 0.14 22.80 23.00
23
Gambar 9 Spesimen kelelawar (a) B. bidens, (b) T. nigriscens, (c) S. wallacei, (d)
D. viridis, (e) T. suhaniahae. Skala bar 10 mm
a b
c d
24
Pengukuran Tengkorak
Spesimen Tikus (Muridae)
Spesimen yang memiliki ukuran tengkorak terbesar yaitu Paruromys sp.,
R. dommermani memiliki rata-rata ukuran tengkorak yang lebih besar dibandingkan dua spesimen Rattus lainnya, namun panjang incisive foramina
(LIF) tidak terlalu berbeda yaitu 6 sampai 7 mm. Lebar lempeng zigomatik (BZP) antara R. dommermani dengan R. hoffmanni tidak terlalu berbeda dengan selang nilai sekitar 0.6 mm. Panjang baris geraham rahang atas (CLM1-3) tidak begitu berbeda antar spesimen Rattus.
B. andrewsi memiliki ukuran tengkorak yang lebih besar dari B. chrysocomus dan B. heinrichi. Ukuran tengkorak B. chrysocomus dan B. heinrichi
tidak terlalu berbeda. B. heinrichi memiliki panjang baris geraham rahang atas (CLM1-3) yang lebih besar diantara spesimen Bunomys. T. celebensis
menunjukkan hasil pengukuran tengkorak yang mendekati ukuran Paruromys sp.
(Tabel 9). Beberapa tengkorak spesimen tikus disajikan pada Gambar 10 dan Gambar 11.
Tabel 9 Pengukuran tengkorak (mm) spesimen tikus yang tertangkap
Karakter R. hoffmani B. andrewsi B. chrysocomus
N Mean Std.Dev Min Maks N Mean N Mean
25
Tabel 9 Pengukuran tengkorak (mm) spesimen tikus yang tertangkap (lanjutan)
Karakter Paruromys sp. B. heinrichi T. celebensis
N Mean N Mean N Mean Std.Dev Min Maks
Singkatan karakter pengukuran dapat dilihat di Tabel 3
Tabel 9 Pengukuran tengkorak (mm) spesimen tikus yang tertangkap (lanjutan)
Karakter R. dommermani R. exulans
N Mean Std.Dev Min Maks N Mean
26
Spesimen Kelalawar (Pteropodidae)
D. viridis memiliki panjang tengkorak terbesar (GSL) dan beberapa karakter pengukuran seperti ZB dan DL yang lebih besar diantara spesimen yang lain. Lebar zigomatik (ZB) S. wallacei memiliki selang nilai yang tidak terlalu jauh dengan B. bidens dibandingkan dengan spesimen yang lain; namun panjang gigi taring ke geraham (C¹-M³) lebih mendekati D. viridis. T. suhaniahae
memiliki beberapa karakter pengukuran yang lebih besar dari T. nigrescens seperti GSL, POW, ZB dan PL (Tabel 10). Beberapa tengkorak spesimen kelelawar penelitian ini disajikan pada Gambar 12 dan Gambar 13.
Tabel 10 Pengukuran tengkorak (mm) spesimen kelelawar yang tertangkap
Karakter B. bidens T. suhaniahae
N Mean St.dev Min Maks N Mean St.dev Min Maks
GSL 3 46.76 1.70 45.35 48.65 8 35.19 0.39 34.75 35.91
LIW 3 8.35 0.16 8.17 8.48 8 7.96 0.45 7.45 8.84
POW 3 8.56 0.24 8.31 8.78 8 6.918 0.22 6.6 7.30
ZB 3 26.77 0.94 26.14 27.85 8 22.29 0.67 21.44 23.24
BW 3 18.53 0.40 18.10 18.89 8 14.85 0.39 14.2 15.38
MSF 3 6.48 0.11 6.37 6.58 8 4.594 0.21 4.29 4.92
BL 3 4.89 0.49 4.32 5.22 8 3.461 0.25 3.21 3.96
PL 3 23.09 0.59 22.51 23.69 8 18.58 0.79 17.35 19.67
RAP 3 12.73 1.56 11.10 14.22 8 13.91 0.26 13.52 14.19
DL 3 34.95 1.20 33.74 36.14 8 27.52 0.68 26.55 28.48
C¹-C¹ (RA) 3 9.77 0.66 9.26 10.52 8 6.853 0.34 6.26 7.20
C¹-C¹ (RB) 3 6.15 0.61 5.68 6.84 8 3.771 0.32 3.18 4.05
M³-M³ (RA) 3 11.98 0.18 11.85 12.18 8 13.33 1.01 11.06 14.19
M³-M³ (RB) 3 12.03 0.36 11.69 12.4 8 9.604 0.28 9.33 10.19
C¹-M³ (RA) 3 14.97 0.14 14.83 15.11 8 12.48 0.28 12.08 12.86
C¹-M³ (RB) 3 17.36 0.47 16.93 17.87 8 11.61 0.26 11.34 11.99
27
Tabel 10 Pengukuran tengkorak (mm) spesimen kelelawar yang tertangkap (lanjutan)
Karakter T. nigrescens S. wallacei D. viridis
N Mean N Mean N Mean St.dev Min Maks
GSL 1 34.32 1 48.91 2 51.34 1.55 50.24 52.43
LIW 1 6.64 1 6.82 2 8.33 0.09 8.26 8.39
POW 1 6.25 1 6.00 2 6.92 0.54 6.53 7.30
ZB 1 20.15 1 27.05 2 30.57 0.10 30.50 30.64
BW 1 14.22 1 19.46 2 20.08 0.16 19.96 20.19
MSF 1 4.45 1 6.08 2 6.41 0.39 6.13 6.68
BL 1 3.12 1 4.22 2 5.33 0.11 5.25 5.41
PL 1 16.57 1 25.01 2 25.09 0.58 24.68 25.50
RAP 1 14.33 1 18.26 2 21.35 0.97 20.66 22.03
DL 1 25.56 1 37.33 2 41.70 0.66 41.23 42.17
C¹-C¹ (RA) 1 6.20 1 5.15 2 9.38 0.12 9.29 9.46
C¹-C¹ (RB) 1 2.92 1 5.11 2 5.10 0.41 4.81 5.39
M³-M³ (RA) 1 10.58 1 12.78 2 13.75 2.45 12.02 15.48
M³-M³ (RB) 1 8.95 1 12.93 2 14.70 0.75 14.17 15.23
C¹-M³ (RA) 1 11.36 1 18.87 2 19.82 0.74 19.29 20.34
C¹-M³ (RB) 1 13.25 1 18.87 2 21.31 0.11 21.23 21.38
28
Gambar 10 Tengkorak spesimen tikus (a) R. hoffmanni dorsal (a1), ventral (a2); (b) B. heinrichi dorsal (b1), ventral (b2); (c) T. celebensis dorsal (c1), ventral (c2). Skala bar 10 mm
a1 a2
b1 b2
29
Gambar 11 Tengkorak spesimen tikus (a) R. dommermani dorsal (a1), ventral (a2); (b) R. exulans dorsal (b1), ventral (b2). Skala bar 10 mm
Gambar 12 Tengkorak spesimen kelelawar B. bidens dorsal (a1), ventral (a2). Skala bar 10 mm
a1
a2
b1 b2
30
Gambar 13 Tengkorak spesimen kelelawar (a) T. suhaniahae dorsal (a1), ventral (a2), (b) T. nigriscens dorsal (b1), ventral (b2), (c) S. wallacei dorsal (c1), ventral (c2). Skala bar 10 mm
a1 a2
b1
b2
31
3.2 Analisis Kariotipe Laboratorium
3.2.1 Kariotipe Mencit (Mus musculus Linnaeus, 1758)
Analisis kariotipe di laboratorium menggunakan mencit (M. musculus) menunjukkan hasil yang baik. Jumlah kromosom M. musculus yaitu 2n = 40 dengan FN = 40 dan FNa = 38. Autosom berjumlah 40 pasang dan satu pasang kromosom kelamin X. Spesies ini hanya memiliki satu tipe krosomom yaitu telosentrik (Gambar 14). Kromosom M.musculus merupakan kromosom yang didapat dari analisis kariotipe laboratorium. Kedua spesimen yang diuji menunjukkan hasil yang optimal. Kromosom menyebar dengan baik, lengan terlihat jelas dan jumlah kromosom yang dapat teridentifikasi dengan mudah. Kromosom yang muncul pada preparat bervariasi, baik bentuk maupun jumlahnya (Gambar 15).
Hasil pengukuran kromosom spesies ini menunjukkan keseluruhan kromosom merupakan tipe kromosom telosentrik dengan panjang lengan panjang (q) dan panjang total (pq) berkisar 3.48 sampai 1.20% (Tabel 11). Kromosom telosentrik tidak memiliki lengan pendek (p) sehingga rasio lengan (AR) dan indeks sentromernya (CI) tidak dapat dihitung.
Pasangan kromosom nomor 19 dan kromosom kelamin menunjukkan selang nilai panjang lengan panjang yang lebih besar dibandingkan pasangan kromosom lain, yaitu masing-masing sebesar 0.37% dan 0.22%.
32
Tabel 11 Pengukuran dan tipe kromosom M.musculus betina
Pasangan Kromosom
Panjang Relatif (%) Total
(%)
33
34
3.2.2 Perbedaan Inhibitasi Mitosis Mencit dengan Kolkisin 0.005% selama 2 Jam dan 3 Jam
Preparat mencit dengan injeksi kolkisin 0.005% dengan waktu inhibitasi mitosis 2 jam menunjukkan kromosom pada tahap metafase yang baik (optimal) (Gambar 16a). Lengan, sentromer dan pita (band) kromosom terlihat jelas. Jumlah kromosom dapat diketahui. Kromosom metafase memiliki dua warna yaitu magenta (a1) dan ungu gelap (a2). Kromosom metafase mencit dengan injeksi kolkisin 0.005% dengan waktu inhibitasi mitosis 3 jam menunjukkan hasil yang kurang optimal yaitu sedikitnya kromosom metafase yang terlihat dan kromosomnya mengalami degradasi (Gambar 16b).
3.2.3 Kualitas Kromosom Sumsum Tulang Mencit pada Preservasi PBS selama 2, 4, 6, 8, 12 dan 15 hari
Keadaan femur mencit setelah preservasi 2 sampai 15 hari yaitu femur menjadi lunak dengan sumsum merah keputihan. Perlakuan preservasi PBS selama 2 hari menunjukkan bentuk kromosom relatif jelas tetapi mulai terdegradasi (lengan terlihat jelas, tetapi sentromer sedikit terlihat dan pita (band) tidak terlihat). Kromosom sangat jarang ditemukan. Kromosom tidak menyebar dan menggerombol, tetapi apabila menyebar kromosom masih bersama sitoplasma sel. Jumlah kromosom masih belum dapat diketahui (Gambar 17a).
Berdasarkan hasil perlakuan 4 hari, pelet sel yang didapatkan pada saat sentrifugasi relatif sedang hingga sedikit. Kromosom yang didapat tidak memiliki bentuk yang jelas (lengan, sentromer dan pita (band) tidak jelas) dan terdegradasi; beberapa tidak menunjukkan adanya kromosom. Kromosom tersebut berbeda dengan kromosom pada perlakuan 2 hari yang masih menunjukkan bentuk yang relatif lebih jelas. Kromosom yang tampak cenderung tidak menyebar dan menggerombol. Preparat yang diamati menunjukkan bahwa sangat jarang ditemui adanya kromosom (Gambar 17b).
Pada perlakuan 6 sampai 15 hari, kromosom sudah tidak terlihat sama sekali atau mengalami degradasi. Preservasi kromosom dengan menggunakan PBS secara garis besar tidak menunjukkan hasil yang optimal. Kromosom yang didapat cenderung mengalami degradasi.
Gambar 16 Kromosom perbedaan inhibitasi mitosis kolkisin 0.005% (a) kromosom mencit perlakuan 2 jam (a1,a2), (b) kromosom mencit perlakuan 3 jam; Perbesaran 400 kali
a2
35
Gambar 17 Kromosom perlakuan preservasi PBS (a) kromosom mencit perlakuan 2 hari (a1,a2,a3), (b) kromosom mencit perlakuan 4 hari (b1, b2); perbesaran 400 kali; Skala bar 2,5 µm
3.2.4 Kualitas Kromosom Suspensi Sel Sumsum Tulang Mencit pada Preservasi Carnoy 2 hari (48 jam) dan 4 hari (96 jam)
Hasil pengamatan kromosom mencit sebelum perlakuan preservasi Carnoy (preparat fresh) menunjukkan bentuk kromosom yang jelas, ada yang menyebar dan ada juga yang tidak menyebar. Lengan tampak jelas, sentromer jelas, pita (band)belum terlihat jelas. Jumlah kromosom dapat teridentifikasi (Gambar 18a).
Berdasarkan perlakuan preservasi Carnoy 2 hari (48 jam), kromosom menyebar namun beberapa ada yang saling tumpang tindih. Lengan tampak jelas, sentromer jelas sedangkan pita (band) belum terlihat jelas. Jumlah kromosom relatif belum bisa teridentifikasi (Gambar 18b). Pada perlakuan ini dilakukan dua kali sentrifugasi pada saat pembuatan preparat, sehingga kromosom terlihat lebih menyebar dari kromosom sebelum preservasi Carnoy.
Hasil preservasi Carnoy 4 hari (96 jam) dengan dua kali sentrifugasi menunjukkan hasil yang optimal. Kromosom menyebar beraturan (dalam satu sel) dengan sangat baik. Bentuk kromosom jelas, tetapi dengan ukuran yang relatif lebih kecil. Lengan dan sentromer tampak jelas tetapi pita (band) masih tidak terlihat (Gambar 18c).
a1
b1 b2
36
Gambar 18 Kromosom perlakuan preservasi Carnoy (a) kromosom mencit perlakuan langsung (fresh) (a1,a2), (b) kromosom mencit perlakuan 2 hari (48 jam) (b1, b2), (c) kromosom mencit perlakuan 4 hari (96 jam); Perbesaran 400 kali; Skala bar 2,5 µm
3.3 Analisis Kariotipe Lapang
Hasil analisis kariotipe di lapang menunjukkan hanya tiga spesies (satu spesies tikus dan dua spesies kelelawar) yang menunjukkan hasil kariotipe yang paling baik yaitu R. hoffmanni dan B. bidens, T. suhaniahae. Sementara itu, D. viridis dan T. nigrescens menunjukkan hasil yang kurang baik sehingga hanya jumlah sel diploid (2n) saja yang bisa diamati (Tabel 12). Kromosom spesies lain (baik tikus dan kelelawar) tidak menunjukkan hasil yang baik yaitu kromosom masih berada di dalam sel.
Spesimen yang diaklimatisasi pada tahap peningkatan indeks mitosis seringkali mengalami kematian terutama pada kelelawar, karena kelelawar relatif rentan terhadap kondisi lingkungan. Penelitian Baker et al. (1982) menunjukkan adanya kesulitan dalam mengaklimatisasi spesies kelelawar pada tahapan tersebut. Suhu lingkungan yang rendah (mencapai 10 °C) diduga menyebabkan kelelawar gagal beradaptasi.
c a1 a2
37
Jumlah dan tipe kromosom berbeda tiap spesimen. R. hoffmanni hanya memiliki tiga tipe kromosom yaitu sub metasentrik, sub telosentrik dan telosentrik. Spesimen B. bidens dan T. suhaniahae memiliki yang keempat tipe kromosom yaitu metasentrik, sub metasentrik, sub telosentrik dan telosentrik. Jumlah tipe kromosom sub metasentrik cenderung lebih banyak dan paling banyak pada B. bidens. Tipe kromosom telosentrik lebih banyak pada R. hoffmanni dan paling sedikit pada kromosom B. bidens. M. musculus pada analisis laboratorium memiliki jumlah kromosom telosentrik lebih banyak dibandingkan
R. hoffmanni (Gambar 19). Hal tersebut mengindikasi antara tikus dan kelelawar masing-masing memiliki satu tipe kromosom yang dominan.
Gambar 19 Jumlah tipe kromosom pada spesimen tikus dan kelelawar
38
3.3.1 Spesimen Tikus (Muridae)
Rattus hoffmanni (Matschie, 1901)
Jumlah kromosom R. hoffmanni yaitu 2n = 44 dengan FN = 61 dan Fna = 59. R. hoffmanni memiliki 43 pasang autosom dan satu pasang kromosom kelamin. Spesies ini memiliki tiga tipe morfologi krosomom yaitu sub metasentrik, sub telosentrik dan telosentrik. Autosom memiliki 6 pasang kromosom sub metasentrik, 3 pasang sub telosentrik dan 12 pasang telosentrik. Kromosom kelamin X keduanya memiliki tipe kromosom telosentrik (Gambar 20). Spesimen yang menunjukkan hasil kariotipe terbaik yaitu satu individu betina dewasa yang bunting MZB 37043.
Pengukuran kromosom menunjukkan pasangan autosom sub metasentrik memiliki panjang lengan pendek (p) yang berkisar antara 1.01 sampai 0.65%. Panjang lengan panjang (q) mencapai 2.54 sampai 1.25% dan panjang total kromosom mencapai 3.55 sampai 1.90%. Indeks sentromer berkisar antara 35.33 sampai 26.97% dengan rasio lengan 2.74 sampai 1.85% (Tabel 13).
Autosom sub telosentrik memiliki panjang lengan pendek mencapai 0.72 sampai 0.48% dan panjang lengan panjang mencapai 2.20 sampai 1.61%. Panjang total kromosom berkisar 2.92 sampai 2.09%. Indeks sentromer 24.71 sampai 23.02% dan rasio lengan 3.35 sampai 3.06%. Autosom telosentrik hanya memiliki satu lengan yaitu lengan panjang dengan panjang antara 2.73 sampai 1.21%. Panjang total kromosom sama dengan panjang lengan panjang.
39
Gambar 20 Kariotipe R. hoffmanni betina MZB 37043 perbesaran 1000 kali; Skala bar 3.26 µm
40
Tabel 13 Pengukuran dan tipe kromosom R. hoffmannibetina MZB 37043
Pasangan Kromosom
Panjang Relatif (%) Total
(%)
41
3.3.2 Spesimen Kelalawar (Pteropodidae)
Boneia bidens (Jentink, 1879)
Jumlah kromosom B. bidens yaitu 2n = 30, yang terdiri dari 19 pasang kromosom tubuh (autosom) dan 1 pasang kromosom kelamin. FN = 53 dan FNa = 50. Spesimen yang menunjukkan hasil kromosom terbaik yaitu satu individu jantan dewasa MZB 37354. Kebanyakan preparat untuk individu yang lain pada spesies ini tidak menunjukkan hasil yang optimal.
Kromosom spesies ini memiliki tiga tipe kromosom, yaitu metasentrik (M), sub metasetrik (SM) dan telosentrik (T) (Gambar 22). Autosom memiliki 4 pasang kromosom metasentrik, 7 pasang sub metasetrik dan 3 pasang telosentrik. Kromosom kelamin memiliki tipe metasentrik untuk kromosom X, dan telosentrik untuk kromosom Y. Pada preparat kromosom terdapat satu kromosom tambahan yang berada di antara dua kromosom (Gambar 22).
Autosom metasentrik memiliki panjang lengan pendek (p) berkisar antara 2.426 sampai 1.152 dan panjang lengan panjang (q) berkisar 2.742 sampai 1.340%. Panjang total kromosom mencapai 5.170 sampai 2.492% dengan indeks sentromer (CI) 47.934 sampai 45.231% dan rasio lengan 1.220 sampai 1.098% (Tabel 14).
Autosom sub metasentrik memiliki panjang lengan pendek (p) sebesar 1.90 sampai 0.82%, panjang lengan panjang (q) 3.83 sampai 1.39%. Panjang total kromosom yaitu 5.73 sampai 2.21% dengan indeks sentromer 39.36 sampai 29.05% dan rasio lengan sebesar 2.41 sampai 1.60%. Autosom telosentrik tidak memiliki lengan pendek. Panjang lengan panjang (q) mencapai 3.85 sampai 1.67% dengan panjang total kromosom yaitu 3.85 sampai 1.67%.
Kromosom kelamin X memiliki panjang lengan pendek (p) sebesar 0.94% dan panjang lengan panjang (q) yaitu 2.567%. Panjang total kromosom mencapai 3.51% dengan indeks sentromer yaitu 26.77% dan rasio lengan 2.74%. Panjang total dan panjang lengan panjang kromosom kelamin Y yaitu sebesar 1.58%.
42
Gambar 22 Kariotipe B. bidens jantan MZB 37354 perbesaran 1000 kali; Skala bar 2.17 µm. Panah menunjukkan kromosom tambahan
43
Tabel 14 Pengukuran dan tipe kromosom B. bidens jantan MZB 37354
Pasangan Kromosom
Panjang Relatif (%) Total
(%)
44
Thoopterus suhaniahae Maryanto et al, 2012
Jumlah kromosom T. suhaniahae yaitu 2n = 38 terdiri dari 18 pasang autosom dan 1 pasang kromosom kelamin. FN = 64 dan FNa = 60. Spesies ini memiliki empat tipe morfologi kromosom yaitu metasentrik, sub metasentrik, sub telosentrik dan telosentik (Gambar 24). Tipe kromosom meliputi 2 pasang kromosom metasentrik, 6 pasang sub metasentrik, 4 pasang sub telosentrik dan 6 pasang telosentrik. Kromosom kelamin memiliki tipe metasentrik untuk kedua kromosom X. Spesimen yang menunjukkan hasil yang paling baik yaitu satu betina dewasa MZB 37355.
Autosom metasentrik memiliki panjang lengan pendek (p) berkisar antara 1.30 sampai 1.24% dan panjang lengan panjang (q) berkisar antara 2.18 sampai 1.56%. Panjang total kromosom yaitu 3.48 sampai 2.80% dengan indeks sentromer 44.25 sampai 37.41%. Rasio lengan berkisar antara 1.34 sampai 1.70% yang menunjukkan kromosom metasentrik (Tabel 15).
Autosom sub metasentrik memiliki panjang lengan pendek (p) berkisar antara 1.04 sampai 0.45% dan panjang lengan panjang (q) berkisar antara 2.14 sampai 1.13%. Panjang total kromosom mencapai 3.18 sampai 1.58% dengan indeks sentromer 34.45 sampai 25.84% dan rasio lengan berkisar antara 2.93 sampai 1.98%. Autosom sub metasentrik mencakup pasangan kromosom 3 sampai 8.
45
Gambar 24 Kariotipe T. suhaniahae betina MZB 37355 perbesaran 1000 kali; Skala bar 3.16 µm
46
Tabel 15 Pengukuran dan tipe kromosom T. suhaniahae betina MZB 37355
Pasangan Kromosom
Panjang Relatif (%) Total
(%)