PROFIL PROTEIN, AKTIVITAS ANTIOKSIDAN, DAN
INHIBITOR ACE DARI SUSU KUDA
DAN HIDROLISATNYA
MUHAMMAD NOVIANTO BAYU SAPUTRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Profil Protein, Aktivitas Antioksidan, dan Inhibitor ACE dari Susu Kuda dan Hidrolisatnya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
MUHAMMAD NOVIANTO BAYU SAPUTRO. Profil Protein, Aktivitas Antioksidan, dan Inhibitor ACE dari Susu Kuda dan Hidrolisatnya. Dibimbing oleh MAGGY THENAWIDJAJA SUHARTONO dan NURHENI SRI PALUPI.
Tingginya prevalensi dan mortalitas penyakit kardiovaskular seperti jantung koroner dan stroke telah mendorong eksplorasi komponen peptida bioaktif asal protein pangan. Susu kuda telah sejak lama dikonsumsi sebagai sumber nutrisi bagi bayi ataupun pangan fungsional bagi orang dewasa. Ditinjau dari segi komposisinya (protein dan laktosa), susu kuda lebih menyerupai susu ASI dibandingkan susu sapi. Susu kuda secara spesifik telah digunakan sebagai sumber nutrisi pengganti susu sapi bagi anak-anak dan bayi penderita alergi. Hal ini disebabkan oleh karakter digestibilitas dan tolerabilitas yang lebih baik dari susu sapi.
Peningkatan minat konsumen terhadap susu kuda disebabkan oleh efek pencegahan dan pengobatan terhadap beberapa penyakit, termasuk penyakit-penyakit kardiovaskular. Susu kuda secara empiris telah digunakan sebagai obat terapi untuk mengatasi penyakit-penyakit metabolik, gastrointestinal, dan hati. Selain itu, susu kuda juga telah digunakan sebagai obat untuk mengobati atau mencegah arteriosklerosis, artritis, bahkan kanker. Sifat fungsional susu kuda diduga berkaitan erat dengan pelepasan peptida-peptida bioaktif. Peptida-peptida tersebut bersifat non-aktif pada protein asalnya dan menjadi aktif ketika dilepaskan melalui proses hidrolisis. Pelepasan peptida-peptida tersebut sangat ditentukan oleh cara hidrolisisnya. Hal tersebut menjadi aspek utama dari penelitian ini.
Penelitian ini bertujuan untuk menganalisis profil protein, aktivitas antioksidan dan penghambat ACE dari kasein, whey susu kuda, dan hidrolisatnya. Protease Bacillus licheniformis F11.4 diproduksi pada media kaldu Luria Bertani dengan modifikasi (5 g L-1 tripton, 2.5 g L-1 ekstrak khamir, NaCl 5 g L-1) dan 1% (b/v) susu skim bubuk sebagai penginduksi. Bromelin diekstrak dari buah nanas segar jenis Queen tanpa kulit (Ananas comosus L.) dengan tingkat kematangan buah 50–75%. Protease F11.4 dan bromelin ekstrak kasar lalu dipresipitasi dengan amonium sulfat hingga mencapai tingkat kejenuhan 60% (b/v). Setelah disentrifugasi, presipitat –yaitu protease F11.4 dan bromelin semimurni digunakan untuk menghidrolisis protein kasein dan whey susu kuda.
Kasein susu kuda dipisahkan dari whey pada pH isoelektrik 4.2. Sebanyak 10 unit mL-1 bromelin atau protease Bacillus licheniformis galur F11.4 semimurni digunakan untuk menghidrolisis 100 mg mL-1 kasein dan whey susu kuda. Hidrolisis dilakukan pada suhu 45 oC, pH 7, selama 30, 60, 90, dan 120 menit. Analisis SDS-PAGE dilakukan untuk mengetahui pola hidrolisis masing-masing perlakuan. Komposisi gel poliakrilamida yang digunakan ialah 15 dan 18%. Elektroforesis dilakukan pada tegangan konstan 70 volt dan arus 50 mA. Gel diwarnai dengan CBB R-250 dan perak nitrat. Setelah itu, hidrolisat diuji bioaktivitasnya untuk mengetahui pengaruh hidrolisis terhadap aktivitas DPPH∙ radical scavenging, Fe reducing power, dan ACE inhibitor.
sangat efektif oleh enzim bromelin dan protease F11.4, bila dibandingkan dengan whey. Bromelin efektif menghidrolisis semua jenis kasein, protein no. 10, dan protein no. 9 (tipikal laktoferin). Di sisi lain, protease F11.4 efektif menghidrolisis -kasein, -laktoglobulin I, lisozim, protein no. 10, dan 9 (tipikal laktoferin). Dua pita protein baru dihasilkan dari hidrolisis kasein dan whey oleh bromelin. Sebaliknya, hidrolisis kasein ataupun whey oleh protease F11.4 tidak menunjukkan pembentukan pita protein baru. Hal ini mengindikasikan terbentuknya peptida-peptida yang berukuran kecil.
Proses hidrolisis meningkatkan bioaktivitas kasein susu kuda. Aktivitas DPPH∙radical scavenging dan Fe reducing power tertinggi diperoleh dari kasein susu kuda yang dihidrolisis oleh bromelin dan F11.4 pada kisaran menit ke-60 dan 90. Aktivitas spesifik DPPH∙radical scavenging nya setara dengan 124–150 ppm asam askorbat per 25 mg protein terlarut, sedangkan pada Fe reducing power-nya 3–4 kali lebih tinggi dari asam askorbat standar 100 M per 10 mg protein terlarut. Hasil penelitian ini menunjukkan bahwa susu kuda menunjukkan aktivitas penghambatan ACE yang tinggi, hampir setara dengan 1 mg mL-1 Captopril. Kasein ialah bagian yang paling kaya dengan ACE inhibitor. Ketika dihidrolisis, terjadi peningkatan signifikan aktivitas spesifik penghambatan ACE dari hidrolisat kasein. Aktivitas penghambatan tertinggi ditemukan pada hidrolisat kasein-bromelin, yaitu 84.75±0.71% per 50 µg protein. Hasil penelitian ini menunjukkan bahwa hidrolisis kasein kuda oleh bromelin dan protease F11.4 telah menghasilkan peptida-peptida antioksidan dan inhibitor ACE.
SUMMARY
MUHAMMAD NOVIANTO BAYU SAPUTRO. Protein Profile, Antioxidant, and ACE-Inhibitory Activity of Equine Milk and Its Hydrolysates. Supervised by MAGGY THENAWIDJAJA SUHARTONO dan NURHENI SRI PALUPI.
High prevalent and mortality of Cardiovascular Disease (CVD‘s) such as
coronary heart disease and stroke activate exploration of bioactive peptides from
many food protein sources. Equine‘s milk has been used not only as nutritious
food for the infant but also as functional foods for adults. From the compositional point of view, equine milk is more similar to human milk than bovine milk. It has been used as a substitute for bovine milk, especially for children and the young infant who severe from the alergenic reaction. There have been increasing
interests on equine‘s milk consumption due to their good effect on human health
and disease therapy, including CDV‘s. Equine milk has been used as a curative agent for some disease, e.g. for treating metabolic, gastrointestinal, and liver problems, for curing or preventing atherosclerosis, arthritis, and cancer. In addition, in Indonesia, fermented equine milk has been marketed and claimed for its functional properties. The functional properties of equine milk may relate to the release of bioactive peptides which non-active at their parent protein and become active after hydrolysis. The release of these peptides mainly depends on the hydrolysis step, which becomes the main aspects of this research.
The aim of this research was to study the protein profiles and to explore the antioxidant and ACE inhibitory potentials of equine casein, whey, and its hydrolysates, hydrolyzed by bromelain and Bacillus licheniformis F11.4 protease. Bacillus licheniformis F11.4 protease was produced using modified Luria-Bertani Broth (5 g L-1 tryptone, 2.5 g L-1 yeast extract, NaCl 5 g L-1) and 1% (b/v) skimmed milk powder as an inducer. The bromelain was extracted from fleshy ripe Queen pineapple fruits (Ananas comosus L.) which have 50–75% maturation point. Both crude F11.4 protease and bromelain was precipitated using ammonium sulfate until it reaches 60% (b/v) saturation point. After centrifuging, the precipitate i.e. semipurified protease was used to hydrolyze equine milk protein. The equine casein was separated at its isoelectric point (pH 4.2). As much as 10 Unit mL-1 of semipurified bromelain and Bacillus licheniformis F11.4 protease were used to hydrolyze 100 mg mL-1 both casein and whey at 45 oC, pH 7, during 30–120 minutes. The SDS-PAGE analysis was performed by using 15 and 18% polyacrylamide gel. The electrophoresis was conducted under constant voltage 70 volts and 50 mA electrical currents. The gels were stained using Coomassie Blue and silver staining technique. After electrophoresis, the bioactivity tests including DPPH∙ radical scavenging, Fe reducing power, and ACE-inhibitory activity were conducted in order to know the influence of hydrolysis to the antioxidant and antihypertensive activity.
The SDS-PAGE shows high similarity of equine milk protein profile from Indonesia with European breeding equine milk. The SDS-PAGE also shows that equine casein is more susceptible to both enzymes than the whey. Bromelain was effective in hydrolyzing all type of casein, protein no. 10, and lactoferrin-like
protein band with rather high molecular weight (MW) were produced by bromelain. Meanwhile, F11.4 proteases did not generate new protein/peptide bands, which indicated a much smaller peptides product.
Hydrolysis enhanced the bioactivity of equine casein. The highest radical scavenging and reducing power activity were obtained using bromelain and F11.4 protease after 60–90 min incubation times. The highest radical scavenging activity was equal to 124–150 ppm ascorbic acid‘s activity at β5 mg solubilized protein. Meanwhile, the highest reducing power was 3–4 times higher than 100 M
ascorbic acid‘s activity, at 10 mg solubilized protein. The highest ACE inhibitory
specific activity was obtained using bromelain on casein after 90 min incubation times. The ACE inhibitory activity was 84.75±0.71% at 50 µg protein content, which is close to the 1 mg mL-1 Captopril‘s activity (λ7.γκ%). The enhanced bioactivities might be related to the release of small peptides from equine casein by both bromelain and F11.4 protease activity.
©Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
PROFIL PROTEIN, AKTIVITAS ANTIOKSIDAN, DAN
INHIBITOR ACE DARI SUSU KUDA
DAN HIDROLISATNYA
MUHAMMAD NOVIANTO BAYU SAPUTRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Profil Protein, Aktivitas Antioksidan, dan Inhibitor ACE dari Susu Kuda dan Hidrolisatnya
Nama : Muhammad Novianto Bayu Saputro NIM : F251120021
Komisi Pembimbing
Prof Dr Ir Maggy T. Suhartono Ketua
Dr Ir Nurheni Sri Palupi, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Dr Ir Harsi D. Kusumaningrum
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 27 Juli 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala ridho dan karunia-Nya sehingga Tesis yang berjudul ―Profil Protein, Aktivitas Antioksidan, dan Inhibitor ACE dari Susu Kuda dan Hidrolisatnya‖ berhasil diselesaikan. Penulis mengucapkan terima kasih kepada proyek Penelitian Unggulan, DIPA IPB (kode MAK 2013.089.521219) yang telah mendanai penelitian ini.
Penulis juga mengucapkan terima kasih dan memberikan penghargaan yang tak terhingga kepada:
1 Ibu Prof Dr Ir Maggy Thenawidjaja Suhartono dan Ibu Dr Ir Nurheni Sri Palupi, MSi selaku komisi pembimbing atas semua waktu, ilmu, bimbingan, arahan, dan motivasi selama masa studi, perencanan dan pelaksanaan penelitian, penulisan laporan, penulisan jurnal, dan laporan akhir sehingga tesis ini dapat terselesaikan dengan baik.
2 Ibu Prof Dr Ir Sedarnawati Yasni, MAgr selaku Penguji di luar komisi atas semua waktu, saran dan kritik demi kesempurnaan karya tulis ini.
3 Ibu Dr Ir Endang Prangdimurti, MSi selaku perwakilan departemen Ilmu Pangan dan juga para dosen atas semua ilmu yang telah diberikan selama masa perkuliahan.
4 Bapak Prof Dr Ir Sony Suharsono, DEA selaku Kepala Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB) IPB atas ijin penggunaan fasilitas laboratorium Mikrobiologi dan Biokimia di gedung Pusat Antar Universitas IPB.
5 Ibu Ika Malikah dan teknisi lainnya atas semua ilmu, teknik, dan semangat kerja sehingga kegiatan penelitian ini dapat berjalan dengan lancar.
6 Bapak, Ibu, dan adinda Awalia Indahsaputri atas semua doa, dukungan moral dan finansial sehingga penulis dapat menyelesaikan studinya dengan baik. 7 Rekan-rekan seperjuangan peptida bioaktif, antara lain: Diana, Mba Ino,
Silvie atas kebersamaannya selama masa pelaksanaan penelitian.
8 Para sahabat, yaitu Fajri, Kamil, Danang, Edo, Reno atas semua doa, semangat, dukungan, dan bantuan sehingga tesis ini dapat terselesaikan dengan baik.
9 Rekan-rekan Ilmu Pangan atas semua kebersamaan dan kerjasamanya selama menempuh studi di program studi Ilmu Pangan.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
Karakter Komponen Nutrisi Susu Kuda 3
Sifat Fungsional Beberapa Protein Susu Kuda 5
Protease 5
Aplikasi Protease dalam Pembuatan Peptida Bioaktif 7
Bromelin 8
Bacillus licheniformis Galur F11.4 Sebagai Bakteri Proteolitik 9
Peptida Bioaktif 9
Peptida Antioksidan 10
Peptida Inhibitor Angiotensin-I-Converting Enzyme (ACE) 12
3 METODE 14
Waktu dan Lokasi Penelitian 14
Bahan Penelitian 14
Peralatan Penelitian 15
Metode Penelitian 15
4 HASIL DAN PEMBAHASAN 22
Profil Protein Susu Kuda 22
Profil Hidrolisat Kasein dan Whey Susu Kuda 24
Aktivitas Antioksidan Susu Kuda dan Hidrolisatnya 27 Aktivitas Penghambatan ACE oleh Susu Kuda dan Hidrolisatnya 30
5 SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 34
LAMPIRAN 40
DAFTAR TABEL
1 Komposisi total zat gizi pada berbagai jenis susu 6 2 Konsentrasi kasein dan whey protein (g kg-1) pada susu kuda, ASI,
5 Metode Bergmeyer dan Grassel (1983) dengan modifikasi. 18 6 Perbandingan jumlah pereaksi yang digunakan untuk membuat gel
pemisah dan penahan 19
7 Prosedur uji Fe reducing power 20
8 Prosedur uji penghambatan ACE 21
DAFTAR GAMBAR
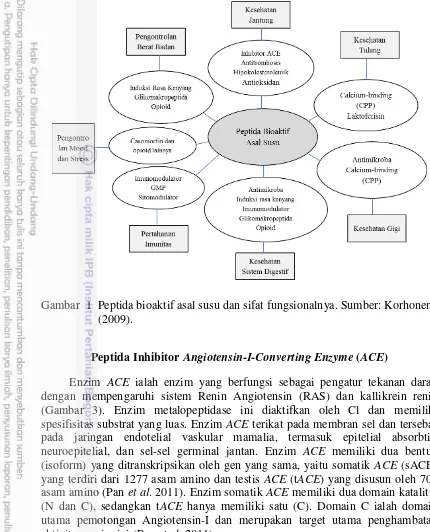
1 Peptida bioaktif asal susu dan sifat fungsionalnya. Sumber: Korhonen
(2009). 12
5 Tiga tahap utama rancangan penelitian. 16
6 Perbandingan antara profil SDS-PAGE susu kuda dari Indonesia dan beberapa studi terdahulu, serta susu sapi dan ASI. Gambar A, protein susu skim dari kuda poni pada gel 12% (Miranda et al. 2004); B, susu terhidrolisis ditunjukkan oleh tanda panah. Pita protein baru ditunjukkan oleh tanda panah dan abjad. M1 dan M2 ialah penanda protein ber-BM tinggi dan rendah. Gel diwarnai dengan perak nitrat. 25 8 Hidrolisis kasein oleh kimosin pada gel poliakrilamida 15%.
Keterangan: eCN, kasein kuda; bGMP, glikomakropeptida sapi. Fragmen a, b dan e ialah hasil hidrolisis kasein kuda. Sumber: Egito
et al. 2001. 25
10 Supramolekul kasein distabilkan oleh -kasein dan nanokluster Ca-P. Gambar A, model McMahon dan Oommen (2008) berdasarkan hasil TEM; dan B, model Walstra (1999) di dalam Phadungath (2005) 27 11 Aktivitas antioksidan DPPH∙ radical scavenging (A) dan Fe reducing
power (B) dari kasein dan whey susu kuda. 29
12 Pengaruh hidrolisis terhadap aktivitas spesifik DPPH∙ radical scavenging (A) dan Fe reducing power (B) dari kasein dan whey susu kuda. Keterangan: CB, kasein + bromelin; CF, kasein + protease F11.4; WB, whey + bromelin; dan WF, whey + protease F11.4. 30 13 Aktivitas penghambatan ACE dari kasein dan whey susu kuda. 31 14 Pengaruh hidrolisis terhadap aktivitas spesifik penghambatan ACE
dari kasein dan whey susu kuda. Keterangan: CB, kasein + bromelin; CF, kasein + protease F11.4; WB, whey + bromelin; dan WF, whey +
protease F11.4. 32
15 Mekanisme absorbsi peptida bioaktif. Sumber: Wada dan Lönnerdal
(2014). 33
DAFTAR LAMPIRAN
1 Prosedur pembuatan pereaksi metode Bradford 41
2 Kurva standar protein 41
3 Prosedur pembuatan pereaksi metode Bergmeyer dan Grassel (1983) 42 4 Prosedur pembuatan pereaksi metode SDS-PAGE 43 5 Pereaksi untuk prosedur pewarnaan Coomassie Blue 44 6 Pereaksi untuk prosedur pewarnaan Silver Staining 44
7 Prosedur pewarnaan Silver Staining 44
8 Korelasi antara konsentrasi asam askorbat dan aktivitas DPPH∙
radical scavenging 45
9 Prosedur pembuatan pereaksi metode Fe reducing power 45 10 Prosedur pembuatan pereaksi metode inhibitor ACE 46 11 Kadar protein terlarut susu kuda dan hidrolisatnya 47 12 Uji statistika aktivitas DPPH∙ radical scavenging spesifik dari
hidrolisat kasein- bromelin (CB) 48
13 Uji statistika aktivitas DPPH∙ radical scavenging spesifik dari
hidrolisat kasein-F11.4 (CF) 49
14 Uji statistika aktivitas reducing power spesifik dari hidrolisat kasein 50 15 Uji statistika aktivitas penghambatan ACE spesifik dari hidrolisat
1 PENDAHULUAN
Latar Belakang
Susu kuda (Equus caballus) telah dikonsumsi secara tradisional pada masyarakat di beberapa wilayah dunia, khususnya Asia Tengah, Mongolia, dan Rusia, seperti Kazakhstan, Kyrgyzstan, and Tajikistan. Selain memberikan nutrisi yang baik, susu kuda dipercaya dan telah digunakan untuk mencegah dan mengobati berbagai macam penyakit, seperti: kelainan metabolik, gastrointestinal, liver, arteriosklerosis, artritis, bahkan kanker (Claeys et al. 2014). Di Indonesia, minuman fermentasi susu kuda telah dipasarkan dan diklaim sifat fungsionalnya. Meskipun demikian studi mekanisme fungsionalnya masih sangat terbatas. Beberapa sifat fungsional yang telah diteliti antara lain: karakter antimikroba susu kuda autofermentasi asal Sumba dan Sumbawa, Indonesia Timur (Hermawati 2005; Detha, et al. 2013); dan inhibitor angiotensin-I-converting enzyme (ACE) dari Koumiss, yaitu minuman fermentasi susu kuda yang terkenal di Mongolia dan Rusia (Chen et al. 2010). Sebagai jenis susu yang memiliki rasio kasein/whey yang rendah, susu kuda lebih mudah dicerna dan lebih tidak berpotensi menimbulkan alergi dibandingkan susu sapi. Oleh sebab itu, susu kuda lebih cocok untuk digunakan sebagai pangan ataupun ingredien fungsional pengganti susu sapi (Salimei dan Fantuz 2012; Uniacke-Lowe et al. 2010). Aktivitas penghambatan ACE berkaitan dengan karakter antihipertensi komponen pangan, dan merupakan mekanisme utama obat-obatan antihipertensi komersial, seperti Captopril, Enalapril, Lisinopril. Penelitian Chen et al. (2010) mengindikasikan bahwa susu kuda merupakan sumber peptida-peptida inhibitor ACE yang potensial. Meskipun demikian, pelepasan peptida-peptida ini sangat dipengaruhi oleh cara hidrolisisnya.
Bromelin (EC.3.4.22.4) merupakan enzim sistein protease asal tumbuhan Bromeliaceae, khususnya nanas (Ananas comosus L.) (González-Rábade et al. 2011). Selain bersifat food grade, enzim ini juga dilaporkan memiliki aktivitas fibrinolitik, antitumor, antiedematus, antineoplastik, antitrombosis, dan antiinflamasi (González-Rábade et al. 2011). Di sisi lain, protease F11.4 dari Bacillus licheniformis galur F11.4 telah digunakan untuk memproduksi peptida kolagen bioaktif penghambat ACE dan antiproliferasi pada sel kanker serviks dan kolon (Baehaki et al. 2016). Bakteri ini merupakan hasil modifikasi genetik
dengan mendelesi gen ∆pga dan ∆chiBA sehingga produksi proteasenya meningkat (Hoffmann et al. 2010). Pada penelitian ini, kedua enzim yang sama akan diaplikasikan terhadap sumber protein yang berbeda –yaitu kasein dan whey susu kuda, untuk menghasilkan peptida bioaktif yang dapat bertindak sebagai antioksidan dan penghambat ACE.
hidrolisisnya, ataupun perubahan profil protein susu kuda selama masa simpan (Egito et al. 2003; Inglingstad et al. 2010; Miranda et al. 2004). Pada penelitian ini, SDS-PAGE digunakan untuk mengamati perubahan profil protein setelah dihidrolisis.
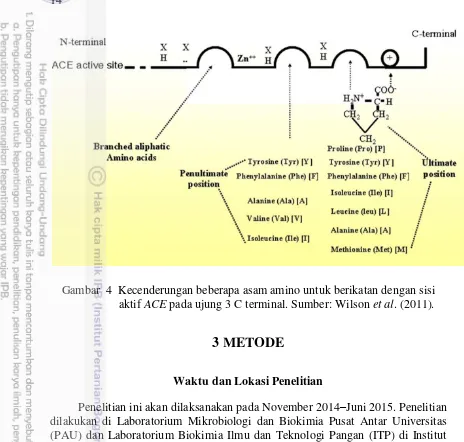
Tekanan pembuluh darah diatur oleh aktivitas angiotensin-I-converting enzyme (ACE) (EC.3.4.15.1) atau enzim pengonversi angiotensin-I. Enzim ini merupakan bagian dari sistem renin angiotensin. Enzim ACE ialah enzim metalopeptidase yang menghidrolisis 2 asam amino (His, Leu) dari ujung karboksil protein non aktif angiotensin I, sehingga dihasilkan protein aktif angiotensin II. Angiotensin II merupakan vasokonstriktor kuat dan memicu sekresi hormon aldosteron yang akan meningkatkan retensi air dan garam mineral, sehingga tekanan darah akan meningkat. Selain itu, enzim ACE juga mendegradasi bradikinin, yaitu protein vasodilator kuat yang dihasilkan dari sistem kallikrein kinin (Li et al. 2004; Wilson et al. 2011). Hipertensi dan stres oksidatif merupakan pemicu arteriosklerosis yaitu proses penyumbatan pembuluh darah yang menyebabkan penyakit jantung koroner dan stroke (Fearon dan Faux 2009; WHO 2013).
Efek samping jangka panjang dari obat-obatan antihipertensi sintetik telah diteliti dan dilaporkan (Flather et al. 2000; Hall dan Israili 1992). Hal tersebut telah mendorong eksplorasi komponen bioaktif asal pangan yang dinilai lebih alami dan aman. Peptida-peptida bioaktif tidak hanya menghambat ACE secara in vitro, tetapi juga menurunkan tekanan darah secara in vivo dan uji klinis. (Hernandez-Ledesma et al. 2011; Nongonierma dan FitzGerald 2015). Keunggulan lain dari peptida bioaktif ialah karakter multifungsionalnya. Peptida ini tidak hanya memiliki karakter antihipertensi, tetapi juga antioksidan, antihiperkolesterolemik, antiinflamasi sehingga berperan untuk mencegah dan mengatasi penyakit kardiovaskular secara sistematik (Hernandez-Ledesma et al. 2011; Nongonierma dan FitzGerald 2015).
Perumusan Masalah
Pertumbuhan faktor resiko penyakit kardiovaskular dapat dicegah melalui sifat fungsional peptida bioaktif sebagai antioksidan dan antihipertensi. Di Indonesia, susu kuda telah diketahui secara empiris dapat mengobati berbagai macam penyakit, termasuk kardiovaskular. Meskipun demikian, data penelitian yang mendukung efikasi tersebut masih sangat terbatas.
3 Tujuan Penelitian
Peptida-peptida bioaktif bersifat inaktif pada protein asalnya dan menjadi aktif setelah dilepaskan, baik melalui proses pencernaan, fermentasi mikroba, proteolisis enzim, ataupun proses pengolahan pangan. Studi peptida bioaktif susu kuda masih sangat terbatas, sehingga menjadi peluang untuk diteliti dan dikembangkan. Penelitian ini bertujuan untuk menganalisis profil protein, aktivitas antioksidan dan penghambatan ACE dari kasein, whey susu kuda, dan hidrolisatnya.
Hipotesis Penelitian
Hipotesis yang ingin dibuktikan pada penelitian ini, yaitu (1) hidrolisis protein (kasein dan whey) susu kuda oleh enzim protease B. licheniformis F11.4 dan bromelin akan menghasilkan profil protein (SDS-PAGE) hidrolisat yang berbeda, (2) dari hidrolisis tersebut akan dihasilkan peptida-peptida antioksidan dan ACE inhibitor. Profil SDS-PAGE hidrolisat yang berbeda menunjukkan perbedaan titik potong kedua enzim terhadap substrat yang spesifik.
Manfaat Penelitian
Penelitian ini memberikan informasi tentang: (1) profil protein susu skim, kasein, dan whey dari kuda asal Indonesia; (2) perubahan profil protein ( SDS-PAGE) selama hidrolisis; dan (3) korelasinya dengan aktivitas antioksidan dan penghambatan ACE kasein dan whey susu kuda. Informasi ini diperlukan sebagai dasar untuk memproduksi peptida-peptida bioaktif asal susu kuda.
Ruang Lingkup Penelitian
Penelitian ini dibatasi pada aspek profil protein, yaitu profil SDS-PAGE dari susu skim, kasein, whey, dan hidrolisatnya serta korelasinya dengan aktivitas DPPH∙radical scavenging, Fe reducing power, dan penghambatan ACE secara in vitro. Produksi peptida bioaktif dibatasi pada peptida-peptida hidrolisat kasar kasein dan whey susu kuda.
2 TINJAUAN PUSTAKA
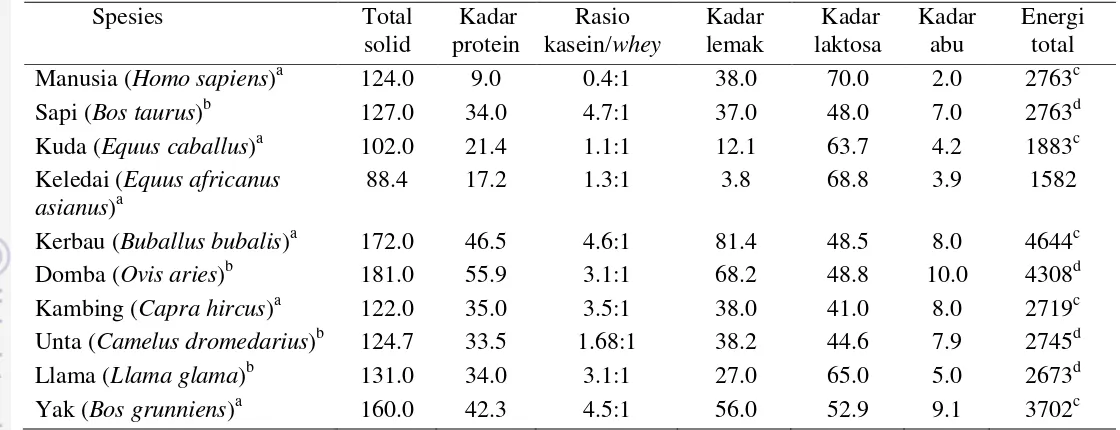
Karakter Komponen Nutrisi Susu Kuda
spesies penghasil susu lainnya, seperti sapi, kambing, domba, dan kerbau. Kadar protein, lemak, garam anorganik susu kuda lebih rendah, sedangkan kadar laktosanya lebih tinggi bila dibandingkan dengan susu sapi. Kadar laktosa susu kuda mendekati kadar laktosa Air Susu Ibu (ASI) (Tabel 1). Oleh sebab itu, bila dibandingkan dengan susu dari spesies lainnya, karakter nutrisi susu kuda lebih mendekati ASI.
Susu kuda memiliki karakter tolerabilitas dan digestibilitas yang jauh lebih baik dibandingkan dengan susu sapi (Salimei dan Fantuz 2012). Percobaan Inglingstad et al. (2010) menunjukkan bahwa protein susu kuda lebih mudah dicerna oleh enzim-enzim protease gastrointestinal. Uniacke-Lowe et al. (2010) menyatakan bahwa karakter digestibilitas protein susu sangat ditentukan oleh rasio kasein/whey nya. Data ekplorasi menunjukkan bahwa rasio kasein terhadap whey pada susu kuda, jauh lebih mendekati karakter rasio kasein/whey ASI (Tabel 1). Hal ini menunjukkan potensi susu kuda sebagai pengganti susu sapi, khususnya bagi orang yang memiliki masalah alergi. Hal ini disebabkan karena karakter digestibilitas protein susu kuda yang lebih tinggi bila dibandingkan dengan susu sapi dan kambing. Potensi ini juga didukung oleh kajian Roncada et al. (2012) yang menunjukkan bahwa sekuen -kasein susu famili Equidae (kuda dan keledai) sangat berkerabat dekat dengan sekuen kasein susu manusia (ASI).
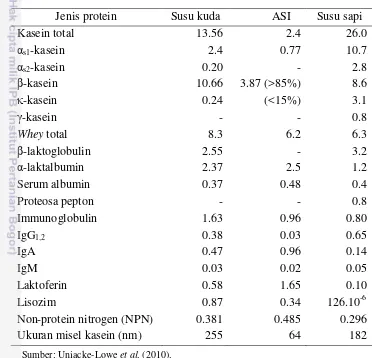
Profil komposisi protein susu kuda hampir mirip dengan ASI, bila dibandingkan dengan susu sapi. Susu kuda mengandung lebih sedikit kasein (<40% total protein) dan lebih banyak whey sehingga rasio kasein/whey nya lebih rendah dibandingkan dengan susu sapi. Sama halnya dengan susu sapi, fraksi
kasein susu kuda terdiri atas αs1-, αs2-, - dan -kasein. Sedangkan komposisi
utama fraksi whey-nya terdiri atas -laktoglobulin ( -lg), α-laktalbumin (α-la), serum albumin (SA), immunoglobulin, laktoferin (LF) and lisozim (LZ). Berbeda
pada susu sapi dan kuda, protein αs2-kasein dan -laktoglobulin tidak ditemukan
pada ASI (Tabel 2).
Susu famili Equidae (kuda dan keledai) dilaporkan memiliki kadar lipida yang relatif rendah (Tabel 1) bila dibandingkan dengan susu dari spesies lainnya. Profil komponen lipida susu kuda terdiri atas: 80% trigliserida, 5% fosfolipida, 5% sterol, dan 10% asam lemak bebas. Kadar kolesterol berada di kisaran 50–88 mg L-1 (relatif rendah). Globula lemak susu kuda berukuran 2–3 µm. Analisis profil asam lemak menunjukkan bahwa komponen lipida susu kuda banyak disusun oleh asam lemak rantai medium (Salimei dan Fantuz 2012). Pada susu sapi, komponen lipida banyak disusun oleh asam lemak rantai pendek, sedangkan asam lemak rantai panjang banyak ditemukan pada ASI. Selain itu, susu kuda juga
mengandung asam lemak jenuk jamak rantai panjang ω-3 dan 6, serta sedikit (<0.5 g 100 g-1 asam lemak) asam eikosapentanoat (EPA, C20:5 n3), dan dokosaenoat (DHA, C22:6 n3) (Salimei dan Fantuz 2012).
5 kuda dibandingkan dengan susu lain ialah kandungan vitamin C nya yang relatif tinggi, berkisar antara 1287–8100 µg 100 mL-1. Nilai tersebut hampir 4× lipat dibandingkan dengan susu sapi (Claeys et al. 2014).
Sifat Fungsional Beberapa Protein Susu Kuda
Selain berfungsi sebagai zat nutrisi, beberapa komponen susu kuda dapat memiliki sifat fungsional dan bioaktif tertentu. Diantara komponen protein lainnya, lisozim (BM 17 kDa) dan laktoferin (BM 75 kDa) ialah protein indigenus yang berfungsi sebagai senyawa antimikroba. Salah satu ciri khas susu kuda ialah kandungan lisozimnya yang tinggi (Tabel 2). Selain itu, lisozim susu kuda dilaporkan sangat termostabil, resisten terhadap asam dan protease (Uniacke-Lowe et al. 2010). Kadar laktoferin susu kuda memang lebih sedikit bila dibandingkan dengan ASI (Tabel 2), tetapi memiliki kapasitas pengkelat Fe yang sebanding. Lisozim dan laktoferin bekerja secara sinergis sebagai antimikroba. Susu kuda juga mengandung berbagai macam imunoglobulin, yang berperan untuk mendukung sistem imun. Imunoglobulin IgA ialah jenis imunoglobulin yang paling dominan pada susu kuda (Tabel 2).
Sifat fungsional tidak hanya dimiliki oleh protein utuh, tetapi juga peptida bioaktif yang dihasilkan dari proses hidrolisis oleh enzim. Peptida bioaktif, baik yang berasal dari kasein atau whey, telah dilaporkan memiliki aktivitas antibakteri, opioid, pengkelat mineral, antihipertensi, dan imunomodulator (Park 2009). Penelitian Chen et al. (2010) melaporkan bahwa koumiss mengandung banyak peptida inhibitor ACE, yang dapat menunjang kesehatan sistem kardiovaskular.
Protease
Tabel 1 Komposisi total zat gizi pada berbagai jenis susu
Spesies Total
solid
Kadar protein
Rasio kasein/whey
Kadar lemak
Kadar laktosa
Kadar abu
Energi total
Manusia (Homo sapiens)a 124.0 9.0 0.4:1 38.0 70.0 2.0 2763c
Sapi (Bos taurus)b 127.0 34.0 4.7:1 37.0 48.0 7.0 2763d
Kuda (Equus caballus)a 102.0 21.4 1.1:1 12.1 63.7 4.2 1883c
Keledai (Equus africanus asianus)a
88.4 17.2 1.3:1 3.8 68.8 3.9 1582
Kerbau (Buballus bubalis)a 172.0 46.5 4.6:1 81.4 48.5 8.0 4644c
Domba (Ovis aries)b 181.0 55.9 3.1:1 68.2 48.8 10.0 4308d
Kambing (Capra hircus)a 122.0 35.0 3.5:1 38.0 41.0 8.0 2719c
Unta (Camelus dromedarius)b 124.7 33.5 1.68:1 38.2 44.6 7.9 2745d
Llama (Llama glama)b 131.0 34.0 3.1:1 27.0 65.0 5.0 2673d
Yak (Bos grunniens)a 160.0 42.3 4.5:1 56.0 52.9 9.1 3702c
a
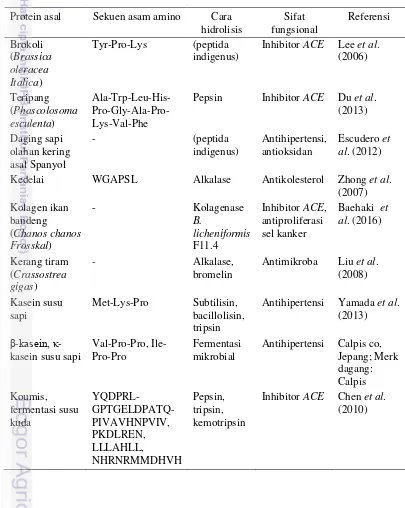
7 Protease memiliki peran penting di bidang industri pengolahan pangan dan detergen. Selain itu, protease juga berperan penting di industri farmasetikal. Beberapa protease asal tumbuhan telah secara empiris digunakan sebagai obat. Protease tersebut telah digunakan sebagai obat terapi penyakit kanker, sebagai antitumor, dan juga untuk pasien dengan penyakit-penyakit pencernaan dan imun (González-Rábade et al. 2011). Selain memiliki efek farmokologis, protease juga berperan secara tidak langsung dengan menghasilkan peptida-peptida bioaktif yang dapat meningkatkan status kesehatan manusia (Tabel 3).
Tabel 2 Konsentrasi kasein dan whey protein (g kg-1) pada susu kuda, ASI, dan susu sapi
Jenis protein Susu kuda ASI Susu sapi
Kasein total 13.56 2.4 26.0
αs1-kasein 2.4 0.77 10.7
αs2-kasein 0.20 - 2.8
-kasein 10.66 3.87 (>85%) 8.6
-kasein 0.24 (<15%) 3.1
-kasein - - 0.8
Whey total 8.3 6.2 6.3
-laktoglobulin 2.55 - 3.2
α-laktalbumin 2.37 2.5 1.2
Serum albumin 0.37 0.48 0.4
Proteosa pepton - - 0.8
Immunoglobulin 1.63 0.96 0.80
IgG1,2 0.38 0.03 0.65
IgA 0.47 0.96 0.14
IgM 0.03 0.02 0.05
Laktoferin 0.58 1.65 0.10
Lisozim 0.87 0.34 126.10-6
Non-protein nitrogen (NPN) 0.381 0.485 0.296
Ukuran misel kasein (nm) 255 64 182
Sumber: Uniacke-Lowe et al. (2010).
Aplikasi Protease dalam Pembuatan Peptida Bioaktif
Tabel 3 Kondisi hidrolisis dan protease yang digunakan untuk menghasilkan berbagai peptida bioaktif
Sumber protein
Enzim Kondisi hidrolisis Sifat fungsional Referensi Teripang
9 Bromelin memiliki peranan luas di industri pangan, kosmetik, farmasi, dan bioteknologi. Bromelin telah digunakan sebagai pengempuk daging di industri pangan, dan sebagai pembersih di industri kosmetik. Di bidang farmasi, khasiat ektrak bromelin telah diteliti dan dilaporkan. Bromelin dapat mencegah edema, agregasi platelet, dan metastasis (Gonzales-Rabade et al. 2011; Soares et al. 2012). Bromelin telah digunakan secara empiris untuk membantu penyembuhan luka, sebagai antiinflamasi dan antibiotik (Chaurasiya dan Hebbar 2013; Gonzales-Rabade et al. 2011). Kombinasi alkalase dan bromelin telah menghasilkan CgPep33, yaitu peptida bioaktif baru dari protein kerang tiram sebagai penghambat pertumbuhan bakteri gram negatif (Escherichia coli, Pseudomonas aeruginos), gram positif (Bacillus subtilis, Staphylococcus aureus), dan beberapa fungi (Botrytis cinerea, Penicillium expansum) (Liu et al. 2008). Hal ini merupakan salah satu contoh aplikasi bromelin di bidang bioteknologi pangan.
Bacillus licheniformis Galur F11.4 Sebagai Bakteri Proteolitik
Bacillus licheniformis F11 asal Palembang ialah bakteri termofil penghasil protease ekstraselular yang baik. Selain itu, secara alamiah, bakteri tersebut tidak memiliki gen chiA yang menyandikan kitinase. Oleh sebab itu, bakteri tersebut sangat berpotensi digunakan sebagai mesin biologis dalam proses deproteinisasi ekstrak kitin. Untuk meningkatkan produksi proteasenya, maka gen pga dihilangkan. Gen pga ialah gen penyandi asam poliglutamat yang merupakan bagian dari kapsul seluler. Dengan menghilangkan gen tersebut maka bakteri B. licheniformis F11 tidak dapat membentuk kapsul sehingga difusi oksigen dan sekresi protease menjadi lebih baik. Mutan ini dinamai dengan galur F11.1 (Hoffmann et al. 2010).
Meskipun demikian, proses deproteinisasi ekstrak kitin dengan protease B. licheniformis F11.1 (Δpga) rupanya masih menghasilkan kitin dengan BM yang rendah. Hal ini disebabkan oleh adanya gen penyandi kitinase lain pada lokus yang berbeda, yaitu chiB. Untuk mendapatkan kitin dengan kualitas baik (BM tinggi), maka gen chiB dihilangkan sehingga diperoleh mutan baru yang dinamai dengan galur F11.4 (Hoffmann et al. 2010). Hasil penelitian menunjukkan bahwa B. licheniformis F11.4 (Δpga ΔchiBA) menghasilkan protease ekstraseluler dengan aktivitas yang lebih tinggi dari galur F11.1 (Δpga) (Hoffmann et al. 2010). Selain menghasilkan protease, B. licheniformis F11.4 juga penghasil kolagenase yang baik. Kolagenase F11.4 telah digunakan untuk memproduksi peptida bioaktif asal kolagen kulit ikan bandeng (Chanos chanos Frosskal) yang dapat menghambat ACE dan proliferasi sel kanker (HeLa dan HCT-66) (Baehaki et al. 2016). Kolagenase B. licheniformis F11.4 memiliki pH dan suhu optimum yaitu 7 dan 50 oC. Selain itu, aktivitas enzim ini meningkat dengan adanya Ca+2 dan Cu+2 (Baehaki et al. 2012).
Peptida Bioaktif
mempengaruhi status kesehatan secara keseluruhan (Korhonen 2009). Selama proses pencernaan, protein dihidrolisis menjadi berbagai macam fragmen-fragmen peptida dan asam amino. Fragmen-fragmen tersebut terkadang memiliki kecocokan struktural dengan beberapa senyawa-senyawa sinyal atau metabolit indigenus tertentu. Kecocokan struktural menyebabkan peptida-peptida homolog dapat berinteraksi dengan beberapa reseptor atau enzim, sehingga dapat mempengaruhi jalur metabolisme tertentu. Interaksi ini dapat bersifat agonis atau antagonis (Korhonen 2009).
Peptida bioaktif dapat memberikan manfaat kesehatan dengan cara mengurangi faktor resiko penyakit kronis atau meningkatkan sistem imun tubuh manusia (Korhonen 2009). Beberapa sistem utama tubuh yang telah diketahui dapat dipengaruhi oleh peptida bioaktif antara lain: sistem kardiovaskular, digestif, endokrin, imun, dan saraf (Gambar 1). Sistem kardiovaskular dapat dipengaruhi oleh peptida yang berperan sebagai antihipertensi, antitrombosis, antioksidan, dan hipokolesterolemik (Gambar 1).
Aktivitas bioaktif dari peptida sangat beragam dan ditentukan oleh sekuen asam amino yang menyusunnya. Peptida bioaktif dapat berasal dari berbagai sumber protein, rata-rata memiliki panjang 3–20 asam amino, dan dapat bersifat multifungsi (Tabel 4). Peptida bioaktif dapat diperoleh melalui hidrolisis gastrointestinal, enzim eksogenus, fermentasi bakteri proteolitik, atau kombinasi diantara ketiganya. Diantara sumber protein lainnya, susu merupakan salah satu sumber penting peptida bioaktif. Berbagai macam peptida bioaktif asal susu dan produk turunannya (misal: keju, yoghurt) telah banyak dilaporkan dan diteliti (Tabel 4).
Peptida Antioksidan
Antioksidan memiliki peranan penting untuk melindungi tubuh dari kondisi stres oksidatif. Stres oksidatif merupakan salah satu faktor resiko penting penyakit-penyakit degeneratif seperti kardiovaskular, diabetes, dan kanker (Lakhsmi et al. 2009). Reactive Oxygen Species (ROS) ialah spesies oksigen reaktif yang dihasilkan dari proses oksidasi dan detoksifikasi pada tubuh manusia. Beberapa senyawa yang tergolong ROS yaitu yaitu anion superoksida, hidrogen peroksida, singlet oksigen, nitrit oksida (NOS), dan radikal hidroksida (Fearon dan Faux 2009; Lakhsmi et al. 2009). Kerusakan sel akibat ROS dapat dicegah melalui aktivitas antioksidan. Tubuh manusia pada dasarnya dilengkapi oleh sistem antioksidan indigenus, seperti enzim superoksida dismutase (SOD), peroksidase, dan glutation sintetase (GSH) (Lakhsmi et al. 2009). Kesehatan tubuh manusia merupakan keseimbangan antara senyawa-senyawa pro dan antioksidan. Oleh sebab itu, antioksidan eksogenus juga memiliki peranan yang sangat penting.
lipid-11 peroksil radikal, dan pengkelat logam (Phelan et al. 2009). Aktivitas antioksidan peptida bioaktif sangat dipengaruhi oleh sifat alami dan komposisi fragmen peptida yang bersangkutan (Phelan et al. 2009). Hal ini sangat ditentukan oleh spesifisitas enzim protease yang digunakan (Pihlanto 2006). Peptida antioksidan dapat bekerja secara sinergis ataupun antagonis dengan antioksidan lainnya (Phelan et al. 2009). Potensi peptida sebagai antioksidan tidak hanya terbatas pada pencegahan faktor resiko penyakit degeneratif, tetapi juga untuk pengawetan makanan, dan kosmetik (Samaranayaka dan Li-Chan 2011).
Tabel 4 Sumber, jenis, cara hidrolisis, dan sifat fungsional beberapa contoh peptida bioaktif
Protein asal Sekuen asam amino Cara
hidrolisis
Kedelai WGAPSL Alkalase Antikolesterol Zhong et al.
(2007)
Antihipertensi Yamada et al.
Gambar 1 Peptida bioaktif asal susu dan sifat fungsionalnya. Sumber: Korhonen (2009).
Peptida Inhibitor Angiotensin-I-Converting Enzyme (ACE)
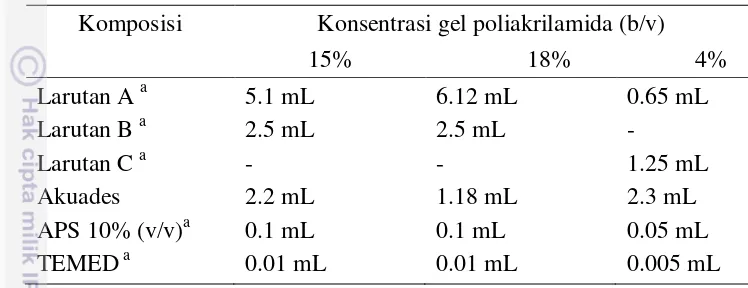
Enzim ACE ialah enzim yang berfungsi sebagai pengatur tekanan darah dengan mempengaruhi sistem Renin Angiotensin (RAS) dan kallikrein renin (Gambar 3). Enzim metalopeptidase ini diaktifkan oleh Cl dan memiliki spesifisitas substrat yang luas. Enzim ACE terikat pada membran sel dan tersebar pada jaringan endotelial vaskular mamalia, termasuk epitelial absorbtif, neuroepitelial, dan sel-sel germinal jantan. Enzim ACE memiliki dua bentuk (isoform) yang ditranskripsikan oleh gen yang sama, yaitu somatik ACE (sACE) yang terdiri dari 1277 asam amino dan testis ACE (tACE) yang disusun oleh 701 asam amino (Pan et al. 2011). Enzim somatik ACE memiliki dua domain katalitik (N dan C), sedangkan tACE hanya memiliki satu (C). Domain C ialah domain utama pemotongan Angiotensin-I dan merupakan target utama penghambatan aktivitas enzim ini (Pan et al. 2011).
13
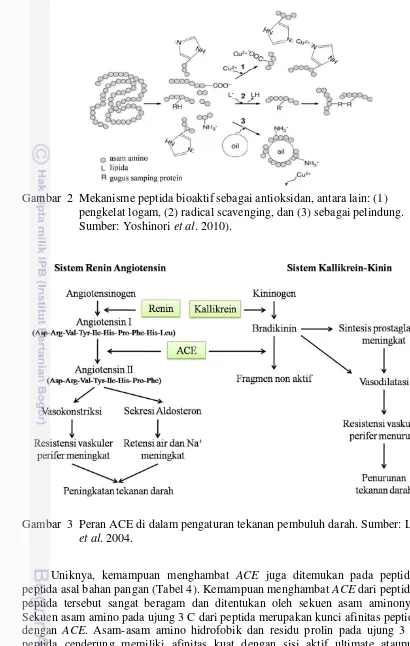
Gambar 2 Mekanisme peptida bioaktif sebagai antioksidan, antara lain: (1) pengkelat logam, (2) radical scavenging, dan (3) sebagai pelindung. Sumber: Yoshinori et al. 2010).
Gambar 3 Peran ACE di dalam pengaturan tekanan pembuluh darah. Sumber: Li et al. 2004.
Gambar 4 Kecenderungan beberapa asam amino untuk berikatan dengan sisi aktif ACE pada ujung 3 C terminal. Sumber: Wilson et al. (2011).
3 METODE
Waktu dan Lokasi Penelitian
Penelitian ini akan dilaksanakan pada November 2014–Juni 2015. Penelitian dilakukan di Laboratorium Mikrobiologi dan Biokimia Pusat Antar Universitas (PAU) dan Laboratorium Biokimia Ilmu dan Teknologi Pangan (ITP) di Institut Pertanian Bogor (IPB).
Bahan Penelitian
Bahan biologis utama yang digunakan dalam penelitian ini antara lain: susu kuda segar, buah nanas (Ananas comosus L.), dan Bacillus licheniformis galur F11.4. Susu kuda segar dibeli dari peternakan Primafit yang terletak di Desa Cibuntu, Kec. Ciampea, Bogor, Jawa Barat. Buah nanas (Ananas comosus L.) jenis Queen asal Bogor dengan tingkat kematangan 50–75% dibeli dari pasar tradisional Dramaga, Bogor, Jawa Barat. Biakan B. licheniformis galur F11.4 merupakan koleksi Laboratorium Mikrobiologi dan Biokimia PAU IPB.
15 dibeli dari Sigma (St. Louis, USA). Protein ladder SpectraTM ber-BM tinggi (40– 300 kDA) dan rendah (1.7–40 kDa) dibeli dari Thermo Fisher Scientific (USA). Bahan-bahan lain dengan spesifikasi analytical dan reagent grade dibeli dari Merck (Indonesia) dan Sigma-Aldrich (USA).
Peralatan Penelitian
Instrumen analitik yang digunakan dalam penelitian ini ialah spektrofotometer VIS (Novaspec II, Pharmacia), spektrofotometer UV-VIS (Shimadzu, model UV 2100, Jepang), Mini-Protean Kit (BioRad, USA), dan pH meter. Peralatan preparatik yang digunakan meliputi: food processor, autoklaf, laminar air flow cabinet, inkubator model Certomat WR, waterbath shaker, sentrifugator dingin (Tomy Seiko, model MRX-152, Jepang), ependorf, pipet mikro FinpipetteTM (Thermo Fisher Scientific, USA), kulkas, lemari pendingin ultra (-20 oC), dan peralatan gelas yang umum digunakan di laboratorium.
Metode Penelitian
Secara garis besar, penelitian ini terbagi menjadi tiga tahap utama, yaitu: persiapan substrat dan enzim, tahap hidrolisis, dan pengujian aktivitas biologis (Gambar 5).
Ekstraksi Kasein dan Whey Susu Kuda
Susu kuda skim dibuat menurut Marchand et al. (2009), dengan modifikasi. Susu kuda disentrifugasi dingin (4 oC) pada 1280 × g selama 30 menit, untuk dipisahkan lemaknya. Fraksi kasein dan whey dari susu kuda skim lalu dipisahkan berdasarkan metode Detha et al. (2013), dengan modifikasi. Susu kuda skim diasamkan perlahan dengan HCl 2 N hingga pH 4.2. Susu asam disentrifugasi dingin (4 oC) pada 10,000 × g selama 30 menit sehingga akan terpisah antara fraksi padatan (kasein dan komponen tak larut) dan supernatannya (whey dan fraksi larut air). Fraksi padatan (kasein) dibilas dua kali dengan larutan penyangga fosfat 0.05 M pH 7, kemudian disimpan pada suhu -20 oC hingga saat akan digunakan. Whey asam dinetralkan (pH 7) menggunakan NaOH 1 N, lalu disentrifugasi kembali dengan kondisi yang sama sehingga diperoleh whey netral. Untuk mendapatkan whey dengan kadar protein tinggi, maka whey harus dikonsentratkan. Whey dikonsentratkan menggunakan freeze dryer pada kondisi suhu -50 oC, tekanan vakum ±22.4 Pa, selama 24 jam. Konsentrat whey kemudian disimpan pada suhu -20 oC hingga saat akan digunakan. Larutan penyangga fosfat 0.05 M pH 7 digunakan sebagai pelarut kasein dan pengencer konsentrat whey. Pengukuran Kadar Protein Terlarut (Bradford 1976)
Pharmacia) pada 5λ5 nm. Kurva standar protein dibuat dengan menggunakan larutan Bovine Serum Albumin (BSA) berkonsentrasi 0–800 (µg mL-1) dengan selang konsentrasi 100 µg mL-1 (Lampiran 2).
Gambar 5 Tiga tahap utama rancangan penelitian.
Produksi Protease dari B. licheniformis F11.4
-17
1
NaCl) yang mengandung susu skim 1% (b/v) pada pH 7, suhu 37 oC dan diagitasi 110 rpm selama 40 jam. Enzim ekstrak kasar dipanen melalui sentrifugasi dingin (4 oC) pada 1600 × g selama 20 menit, sehingga diperoleh supernatan (enzim ekstrak kasar). Enzim ekstrak kasar kemudian dipresipitasi dengan amonium sulfat hingga konsentrasinya mencapai 60% (b/v) (Bollag et al. 1996, dengan modifikasi).
Amonium sulfat yang telah dihaluskan, ditambahkan sedikit demi sedikit kedalam 1.5 L enzim protease ekstrak kasar sambil diaduk perlahan dalam kondisi dingin (±10–12 oC) untuk menjaga aktivitas protease. Setelah amonium sulfat larut sempurna, campuran disimpan pada lemari pendingin bersuhu 8 oC selama semalam. Setelah itu diaduk kembali dan disentrifuse selama 30 menit (10,000 × g, suhu 4 oC) sehingga diperoleh pelet –yaitu endapan protein dan enzim. Pelet kemudian disimpan pada suhu -20 oC hingga saat akan digunakan. Sebelum digunakan, pelet harus dilarutkan kembali dengan larutan penyangga fosfat 0.05 M pH 7 dengan perbandingan 1:1, yaitu satu mL larutan penyangga untuk satu g pelet.
Ekstraksi Bromelin
Bromelin dari daging buah A. comosus diekstraksi menurut Devakate et al. (2009), dengan modifikasi. Buah nanas tanpa kulit dihancurkan dengan menggunakan food processor sehingga diperoleh sarinya. Setelah itu, sari nanas kasar disaring dua kali melalui kain perca dan hasil saringannya disaring kembali menggunakan kertas Whatman no. 41. Hasil saringan akhir berupa ekstrak bromelin kasar berwarna kuning agak keruh. Untuk menghilangkan sisa-sisa pengotor tak larut, maka ekstrak bromelin kasar disentrifugasi dingin (4 oC) pada kondisi 10,000 × g selama 30 menit. Bromelin kasar lalu dipekatkan dengan amonium sulfat, seperti yang telah dijelaskan sebelumnya. Aktivitas protease bromelain dan protease F11.4 semimurni diukur berdasarkan metode Bergmeyer dan Grassel (1983).
Pengukuran Aktivitas Protease (Bergmeyer dan Grassel 1983)
Aktivitas protease diukur secara kuantitatif dengan menggunakan metode Bergmeyer dan Grassel (1983) dengan sedikit modifikasi (Tabel 5). Produk reaksi, yaitu asam amino tirosin akan berikatan dengan reagen Folin-Ciocalteu, yang dapat diukur secara spektrofotometri menggunakan spektrofotometer VIS
(Novaspec II, Pharmacia) pada 57κ nm.
Aktivitas protease dihitung berdasarkan persamaan: [(A – B)/(C – B)] × [Fp/t]
Dimana A ialah absorbansi sampel, B: absorbansi blanko, C: absorbansi standar tirosin, Fp: faktor pengenceran, dan t: waktu inkubasi. Satu unit (U) aktivitas protease didefinisikan sebagai jumlah enzim yang dapat menghasilkan satu µmol tirosin per menit pada kondisi pengujian. Aktivitas spesifik protease (U mg-1 protein) merupakan rasio antara aktivitas protease (U mL-1) dengan kadar protein (mg mL-1).
Hidrolisis Kasein dan Whey Susu Kuda
dengan satu mililiter enzim bromelin dan protease F11.4 semimurni (10 U mL-1). Campuran diinkubasi pada suhu 45 oC selama 120 menit dan diagitasi pada 100 rpm. Sampel diambil menit ke-0 (sebagai kontrol), 30, 60, 90, dan 120. Reaksi hidrolisis dihentikan dengan merebus larutan sampel pada air mendidih selama 5 menit. Hidrolisat lalu disentrifugasi dingin (4 oC) pada 2000 × g selama 5 menit sehingga diperoleh supernatan. Supernatan atau filtrat dipindahkan kedalam tabung mikro dan disimpan pada suhu -20 oC hingga saat akan dianalisis. Masing-masing filtrat akan dianalisis: (1) kadar protein, (2) SDS-PAGE, dan (3) uji bioaktivitas. Kadar protein diukur berdasarkan metode mikroasai Bradford (1976).
Tabel 5 Metode Bergmeyer dan Grassel (1983) dengan modifikasi. Komposisi Blanko (µL) Standar (µL) Sampel (µL)
Inkubasi suhu 45 oC (atau suhu optimum enzim) selama 10 menit
TCA (0.1 M) a 500 500 500
Akuades - - 50
Enzim protease 50 50 -
Inkubasi suhu 45 oC (atau suhu optimum enzim) selama 10 menit Sentrifugasi 10,000 rpm pada suhu 4 oC, selama 10 menit
Filtrat 375 375 375
Na2CO3a 1250 1250 1250
Folin ciocalteua 250 250 250
Inkubasi suhu 37 oC selama 20 menit
Baca absorbansi pada 57κ nm
a
Cara pembuatan reagen terlampir (Lampiran 3).
SDS-PAGE (Bollag et al. 1996)
Profil protein dari kasein, whey, susu kuda dan hidrolisatnya divisualisasi dengan teknik Sodium Dodecylsulfate–Polyacrilamide Gel Electrophoresis ( SDS-PAGE) (Bollag et al. 1996, dengan modifikasi). Konsentrasi gel penahan yang digunakan ialah 4% (v/v), sedangkan untuk gel pemisah yaitu 15 dan 18% (v/v) (Tabel 6), masing-masing untuk whey dan kasein.
19 dibiarkan dingin sebelum diinjeksi. Sebanyak 15 µL sampel siap pakai diinjeksikan kedalam sumur elektroforesis menggunakan micro syringe, yang didalamnya telah berisi larutan penyangga elektroforesis (3 g L-1 tris, 14.4 g L-1 glisina, 1 g L-1 SDS, di dalam air akuades).
Tabel 6 Perbandingan jumlah pereaksi yang digunakan untuk membuat gel pemisah dan penahan
Komposisi Konsentrasi gel poliakrilamida (b/v)
15% 18% 4%
Cara pembuatan terlampir (Lampiran 4).
Elektroforesis dilakukan menggunakan instrumen Mini-Protean Kit (BioRad, USA, Model 1000/500). SDS-PAGE dilakukan pada tegangan 70 volt dan 50 A, selama 2-3 jam dalam kondisi dingin (10–12 oC). Setelah running selesai, gel dikeluarkan dan dibilas dua kali dengan air akuadeion lalu diwarnai. Teknik pewarnaan Coomassie Blue dan Silver Staining dilakukan berdasarkan metode standar Bollag et al. (1996). Teknik pewarnaan Coomassie Blue menggunakan campuran 0.1% (b/v) CBB R-250, asam asetat glasial 10% (v/v), metanol 40% (v/v) sebagai larutan pewarna. Campuran asam asetat glasial 10% (v/v) dan metanol 40% (v/v) digunakan sebagai larutan pemucat (Lampiran 5). Teknik pewarnaan silver staining menggunakan larutan enhancer (0.1% b/b Na2S2O3∙5H2O), perak nitrat (0.2% b/v AgNO3), dan Na2CO3 6% (b/v) sebagai
pewarna gel. Reaksi pewarnaan dihentikan dengan larutan fiksasi (metanol 25% v/v, asam asetat 12% v/v) (Lampiran 6 dan 7). Penanda protein berbobot molekul rendah (1.7–40 kDa) dan tinggi (40–300 kDa) digunakan sebagai standar (SpectraTM, ThermoScientific, USA).
DPPH∙Radical Scavenging (Escudero et al. 2012, dengan modifikasi)
Lima ratus µL sampel dicampur dengan 500 µL etanol 99.5% (v/v), kemudian ditambahkan 125 µL larutan DPPH∙· 0.02% (b/v). Campuran divortex lalu diinkubasikan pada suhu 25 oC, selama 60 menit, dan dalam kondisi gelap. Radikal DPPH tereduksi diukur secara spektrofotometri pada panjang gelombang 517 nm. Aktivitas antiradikal (% scavenging) ditunjukkan oleh penurunan nilai absorbansi, dan dihitung melalui persamaan:
[(B – A)/B)] × 100
pembanding. Kapasitas antioksidan dinyatakan sebagai nilai Vitamin C Equivalent Antioxidant Capacity ( M VCEAC) berdasarkan Almeida et al. (2011). Kurva standar konsentrasi asam askorbat (10 – κ0 M) linear dengan variabel respon % scavenging) (y) (y = 0.831x – 7.583, r2 = 0.985) (Lampiran 8). Aktivitas spesifik radical scavenging dinyatakan sebagai ppm asam askorbat per 25 mg protein terlarut.
Fe Reducing Power (Najafian dan Babji 2014, dengan modifikasi)
Uji ini berdasarkan reduksi Fe3+ yang akan bereaksi membentuk kompleks dengan ferisianida, TCA, dan FeCl3. Kompleks ini berwarna biru Perls Prussian
yang diserap kuat pada 700 nm. Sebanyak 250 L sampel ditambahkan kedalam
500 L larutan penyangga fosfat 0.β M (pH 6.6) dan 250 L larutan ferisianida, lalu diinkubasi pada 50 oC selama 20 menit. Setelah itu, β50 L TCA 10% (b/v) ditambahkan kedalam campuran, kemudian disentrifuse pada 3500 × g selama 10 menit. Satu mL supernatan diambil dan dipindahkan kedalam tabung yang telah terisi 1 mL akuades dan 200 µl FeCl3. Setelah diinkubasi selama 10 menit,
absorbansi diukur pada panjang gelombang 700 nm (Tabel 7). Aktivitas spesifik reducing power dinyatakan sebagai nilai absorbansi terkoreksi × 10-2 per 10 mg protein terlarut. Akuades digunakan sebagai blanko, sedangkan asam askorbat
(100 M) digunakan sebagai kontrol positif.
Tabel 7 Prosedur uji Fe reducing power
Komposisi Blanko
Cara pembuatan terlampir (Lampiran 9).
Uji Penghambatan ACE (Mirdhayati et al. 2016, dengan modifikasi)
21 larutan substrat dan 15 µL larutan BSA 10 mg mL-1. Larutan substrat terdiri atas 7.6 mM Hip-His-Leu dan 608 mM NaCl, di dalam larutan penyangga Na-borat 100 mM pH 8.3. Campuran sampel dan substrat di preinkubasi pada suhu 37 oC selama 10 menit. Sebanyak 50 µL enzim ACE (50 mU mL-1) ditambahkan untuk menjalankan reaksi enzimatik. Setelah diinkubasi pada suhu 37 oC selama 30 menit, reaksi dihentikan dengan menambahkan 200 µL larutan HCl 1 N. Asam hipurat diekstrak dengan etil asetat dan diukur absorbansinya pada panjang gelombang 228 nm (Shimadzu, model UV 2100, Jepang) (Tabel 9). Aktivitas penghambatan (%) ditunjukkan oleh penurunan nilai absorbansi dan dihitung melalui persamaan:
{[(C – Bc) – (A – Bs)]/(C – Bc)} × 100
Dimana C: asam hipurat dari reaksi kontrol (tanpa inhibitor); A: asam hipurat dari reaksi dengan inhibitor; Bc: blanko kontrol; dan Bs: blanko sampel. Obat antihipertensi komersial, yaitu Captopril (1 mg mL-1; Farmoten®; Fahrenheit, ID) digunakan sebagai kontrol positif. Aktivitas spesifik penghambatan ACE dinyatakan sebagai % penghambatan per 50 g protein terlarut.
Tabel 8 Prosedur uji penghambatan ACE
Komposisi
Pre-inkubasi selama 10 menit (37 oC)
ACE (50 mU mL-1) a 50 - 50 -
Akuabides - 50 - 50
Vortex 5 detik, lalu inkubasi selama 30 menit (37 oC)
HCl 1 N 200 200 200 200
ACE inhibitor - - - 20
Vortex 5 detik
Etil asetat 1140 1140 1140 1140
Vortex 20 detik, lalu sentrifugasi (10,000 × g, 10 menit)
Alikuot (lapisan atas) 800 800 800 800
Keringkan selama 75 menit (80 oC)
Akuabides 2000 2000 2000 2000
Ukur absorbansi 228 nm a
Prosedur Analisis Data
Semua eksperimen dalam penelitian ini diulang dua kali (2 ulangan perlakuan). Data yang disajikan merupakan nilai mean ± standar deviasi dari 3 ulangan pengujian. Uji sidik ragam dilakukan dengan piranti lunak SPSS versi 17.0 (USA). Uji beda nilai tengah bioaktivitas antara kontrol dan hidrolisat dilakukan dengan metode Duncan pada taraf uji 5% (P < 0.05).
4 HASIL DAN PEMBAHASAN
Profil Protein Susu Kuda
Susu merupakan salah satu produk pangan hewani bernilai gizi tinggi. Sebagai produk tinggi protein, jenis dan komposisi protein susu menentukan kualitas tidak hanya sebagai zat gizi, tetapi juga sifat fungsionalnya. Beberapa protein, seperti lisozim dan laktoferin, merupakan salah satu dari sistem antimikroba alami asal susu (Uniacke-Lowe et al. 2010; Salimei dan Fantuz 2012). Protein lainnya, seperti kasein, merupakan prekursor peptida bioaktif dengan beragam sifat fungsional. Tidak hanya itu, informasi komposisi protein juga
diperlukan untuk menduga potensi alergenitasnya. Kasein dan -laktoglobulin ialah beberapa contoh protein alergen mayor yang terdapat pada susu, khususnya sapi (Uniacke-Lowe et al. 2010; Salimei dan Fantuz 2012). Oleh sebab itu, informasi profil protein susu khususnya dari susu non-ASI sangat diperlukan untuk menduga potensi dan juga sifat alergenitasnya.
Hasil SDS-PAGE susu skim, kasein ataupun whey (Gambar 6 lajur S, K, dan W) menunjukkan pola pita protein yang mirip dengan beberapa penelitian sebelumnya (Gambar 6 lajur A dan B). Secara garis besar, pola migrasi protein susu di dalam gel SDS-PAGE dapat dibagi menjadi 3, yaitu area whey ber-BM tinggi, area kasein, dan area whey ber-BM rendah (Gambar 6). Bila dibandingkan dengan penelitian lain, pita 5 merupakan area kasein (Gambar 6 lajur S).
Kasein susu kuda merupakan produk dari 4 gen utama, yaitu αs1, αs2, , dan
(Uniacke-Lowe et al. 2010). Pada penelitian ini, hasil SDS-PAGE memang
belum dapat membedakan dengan jelas antara αs1, αs2, , dan -kasein. Hal ini
mungkin disebabkan oleh BM kasein susu kuda yang sangat berdekatan. Selain itu, masing-masing tipe kasein dapat memiliki sub-sub tipe atau fragmen-fragmen yang dapat saling tumpang tindih. Hal ini didukung oleh hasil karakterisasi kasein kuda poni yang dilakukan oleh Miranda et al. (β004). Walaupun αs1, , dan
-kasein terdapat pada satu area yang berdekatan, -kasein memiliki BM berturut-turut αs1> > (Egito et al. 2003).
23 tidak ditemukan pada ASI (Claeys et al. 2014) (Gambar 6 lajur C dan D). Selain itu, ditemukan pula pita-pita polipeptida lain yang belum teridentifikasi seperti pita 9 dan 10 (Gambar 6 lajur W). Kedua pita tersebut diduga kuat merupakan hasil hidrolisis parsial oleh enzim-enzim proteolitik di dalam susu kuda.
Penelitian sebelumnya telah menunjukkan adanya aktivitas dari enzim proteolitik indigenus asal susu kuda. Dengan menggunakan teknik elektroforesis 2 dimensi (2D) –yaitu kombinasi antara metode isoelectric focusing (IEF) dan SDS-PAGE, Hinz et al. (2012) berhasil memisahkan polipeptida-polipeptida berukuran 15.4 dan 21.1 kDa. Hasil analisis sekuen asam amino terhadap polipeptida-polipeptida tersebut menunjukkan derajat kesaamaan yang tinggi terhadap sekuen
asam amino αs1 dan -kasein susu kuda. Oleh sebab itu, polipeptida-polipeptida
tersebut diduga berasal dari proteolisis αs1dan -kasein oleh plasmin (Hinz et al.
2012). Selain ditentukan oleh faktor genetik, profil protein susu kuda juga ditentukan oleh aktivitas proteolitik enzim-enzim indigenus.
Gambar 6 Perbandingan antara profil SDS-PAGE susu kuda dari Indonesia dan beberapa studi terdahulu, serta susu sapi dan ASI. Gambar A, protein susu skim dari kuda poni pada gel 12% (Miranda et al. 2004); B, susu kuda skim pada gel 15% (Inglingstad et al. 2010); S, K, dan W = susu skim, kasein 10% (b/v), dan konsentrat whey; C dan D, susu sapi dan ASI pada gel 15% (Inglingstad et al. 2010).
Selain faktor genetik, lingkungan (nutrisi), dan aktivitas enzim-enzim protease indigenus. Profil susu kuda nampaknya juga dibentuk oleh peran mikroorganisme, yaitu bakteri-bakteri asam laktat (BAL) indigenus. Enzim-enzim protease ekstraseluler yang dihasilkan oleh BAL selama fermentasi turut serta membentuk profil protein susu kuda secara keseluruhan. Perbedaan kecil (minor) yang ditemukan pada profil protein susu kuda dari berbagai penelitian, dapat disebabkan oleh komposisi mikroflora yang berbeda dan unik bagi tiap spesies atau breeding. Shi et al. (2012) berhasil mengisolasi 25 isolat Lactobacillus rhamnosus dan 2 isolat Lactobacillus fermentum asal susu kuda sumbawa autofermentasi. Keberagaman faktor-faktor di atas mungkin tidak hanya berimplikasi terhadap profil protein susu kuda, tetapi juga karakter fungsionalnya.
Profil Hidrolisat Kasein dan Whey Susu Kuda
Sebanyak 100 mg mL-1 protein terlarut kasein dan whey susu kuda dihidrolisis oleh 10 U mL-1 bromelin dan protease F11.4 sehingga diperoleh hidrolisat dengan profil SDS-PAGE yang bervariasi (Gambar 7 dan 9). Profil SDS-PAGE hidrolisat kasein menunjukkan bahwa bromelin sangat efektif menghidrolisis semua tipe kasein susu kuda. Hidrolisis ini menghasilkan pita baru (pita Y) dengan BM tidak jauh berbeda dari protein asalnya (Gambar 7A). Uniknya, pola hidrolisis ini sangat mirip dengan pola hidrolisis kasein kuda yang dilaporkan oleh Egito et al. (2001) (Gambar 8). Egito et al. (2001) menggunakan protease aspartat, yaitu kimosin (EC. 3.4.23.4) yang menghasilkan pita a, b, dan e (Gambar 8). Hasil sekuensing mengonfirmasi bahwa pita a (BM prediksi 22 kDa) merupakan fragmen N-teminal dari -kasein (f1-190). Pola migrasi pita a mirip dengan pita Y pada penelitian ini (Gambar 7A). Hasil analisis menunjukkan
kimosin memotong -kasein pada Leu190–Tyr191 (Egito et al. 2001). Oleh sebab
itu, diduga kuat bahwa bromelin memiliki titik potong yang hampir mirip dengan kimosin sehingga dihasilkan fragmen dengan BM dan pola migrasi yang hampir serupa. Meskipun demikian, dibutuhkan studi lebih lanjut untuk mengonfirmasi hal tersebut.
Dibandingkan bromelin, protease F11.4 menghidrolisis protein kasein susu kuda secara lebih spesifik (tanda panah, Gambar 7B). Hidrolisis kasein oleh protease F11.4 diduga menghasilkan peptida dengan berat molekul sangat kecil (< 4.6 kDa) sehingga tidak tampak pada gel elektroforesis. Fenomena serupa juga ditemukan pada hasil penelitian Inglingstad et al. (2010) dengan menggunakan enzim gastrointestinal.
Sama halnya terhadap kasein, enzim bromelin dan protease F11.4 memiliki efektifitas hidrolisis yang berbeda terhadap protein whey susu kuda. Profil SDS-PAGE hidrolisat whey-bromelin menunjukkan bahwa bromelin efektif menghidrolisis laktoferin, protein nomor 9 dan 10 (Gambar 9A). Hidrolisis ini menghasilkan pita baru, yaitu pita X yang ber-BM cukup tinggi (Gambar 9A).
25
Gambar 7 Pengaruh hidrolisis terhadap profil protein kasein susu kuda oleh enzim bromelin (A) dan protease F11.4 (B). Pita protein yang terhidrolisis ditunjukkan oleh tanda panah. Pita protein baru ditunjukkan oleh tanda panah dan abjad. M1 dan M2 ialah penanda protein ber-BM tinggi dan rendah. Gel diwarnai dengan perak nitrat.
Berbeda halnya dengan bromelin, protease F11.4 aktif menghidrolisis -laktoglobulin I, lisozim, pita protein no. 9 dan 10 (Gambar 9B). Sama halnya dengan kasein, pita peptida baru tidak teramati pada gel hidrolisat whey-F11.4. Peptida yang dihasilkan diduga kuat berbobot molekul sangat kecil (< 4.6 kDa).
Protein -laktoglobulin merupakan salah satu protein alergen utama pada susu. Oleh sebab itu, karakter digestibilitas protein ini menentukan potensi alergenitas-nya. Bila dibandingkan dengan sapi dan kambing, -laktoglobulin kuda dilaporkan lebih cepat terhidrolisis oleh enzim-enzim intestinal, sedangkan lisozimnya lebih resisten (Inglingstad et al. 2010). Susu kuda telah digunakan sebagai pengganti susu sapi pada anak-anak dengan hipersensitifitas (alergi) (Uniacke-Lowe et al. 2010, Salimei dan Fantuz 2012). Hasil uji klinis menunjukkan bahwa susu kuda menunjukkan persentase tolerabilitas yang tinggi, yaitu 96% dari 25 responden anak-anak dengan penyakit alergi IgE susu sapi akut (Salimei dan Fantuz 2012). Karaker hipoalergenik susu kuda tersebut mungkin dapat ditingkatkan dengan aplikasi enzim protease F11.4 asal B. licheniformis dari penelitian ini. Walau demikian, karakter alergenitas bukan merupakan ruang lingkup penelitian ini, sehingga diperlukan penelitian lebih lanjut. Disisi lain hidrolisis lisozim susu kuda oleh protease F11.4 mungkin akan berpengaruh terhadap karakter antimikrobanya.
Gambar 9 Pengaruh hidrolisis terhadap profil protein whey susu kuda oleh enzim bromelin (A) dan protease F11.4 (B). Pita protein yang terhidrolisis ditunjukkan oleh tanda panah. Pita protein baru ditunjukkan oleh tanda panah dan abjad. M1 dan M2 ialah penanda protein ber-BM tinggi dan rendah. Gel diwarnai dengan CBB R-250.
27 Inglingstad et al. (β010), hal ini berkorelasi dengan jumlah -kasein susu kuda yang lebih sedikit dibandingkan dengan sapi atau kambing (Tabel 2). Ukuran misel kasein kuda yang berukuran 1.5 kali lebih besar (255 nm) dari sapi (182 nm) menjadikan rasio luas permukaan kasein dan volume menjadi lebih kecil,
sehingga jumlah -kasein lebih sedikit (Egito et al. 2001).
Kasein memiliki bentuk supramolekul yang terdiri atas sub-sub misel αs, ,
dan -kasein (Gambar 10). Bentuk ini distabilkan oleh ikatan hidrogen, interaksi hidrofobik pada inti, nanocluster Ca-P, dan -kasein (Fox dan Brodkorb β00κ). -Kasein merupakan lapisan terluar misel kasein yang berfungsi meningkatkan kestabilan struktur misel melalui interaksi elektrostatik, meningkatkan resistensi terhadap suhu tinggi, dan enzim-enzim proteolitik (Uniacke-Lowe et al. 2010).
Ukuran misel kasein susu kuda yang besar dan rendahnya jumlah -kasein menjadikan misel kasein susu kuda lebih rentan terhadap aktivitas proteolitik enzim (Inglingstad et al. 2010). Selain itu, kerentanan kasein susu kuda juga dipengaruhi oleh faktor-faktor lain, antara lainμ tingkatan glikosilasi -kasein, kadar kalsium fosfor, dan struktur misel (Uniacke-Lowe et al. 2010). Kerentanan proteolitik kasein susu kuda berimplikasi terhadap potensi besarnya sebagai sumber peptida bioaktif.
Gambar 10 Supramolekul kasein distabilkan oleh -kasein dan nanokluster Ca-P. Gambar A, model McMahon dan Oommen (2008) berdasarkan hasil TEM; dan B, model Walstra (1999) di dalam Phadungath (2005).
Aktivitas Antioksidan Susu Kuda dan Hidrolisatnya