PROTEIN DAN PEPTIDA SUSU KAMBING SERTA
POTENSINYA SEBAGAI ANTIBAKTERI
DIANA LESTARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Protein dan Peptida Susu Kambing serta Potensinya sebagai Antibakteri adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2015
Diana Lestari
RINGKASAN
DIANA LESTARI. Protein dan Peptida Susu Kambing serta Potensinya sebagai
Antibakteri. Dibimbing oleh MAGGY THENAWIDJAJA SUHARTONO dan HARSI DEWANTARI KUSUMANINGRUM.
Peptida bioaktif adalah fragmen protein spesifik yang memiliki dampak positif pada fungsi atau kondisi tubuh. Kandungan protein yang cukup tinggi dalam susu kambing menjadikannya sangat potensial sebagai penghasil peptida susu yang memiliki sifat bioaktif. Protease merupakan enzim proteolitik yang dapat memecah protein. Fragmen protein dan peptida hasil hidrolisis dapat diketahui dengan analisis SDS PAGE yang memberikan gambaran profil protein berupa berat molekul protein.
Pada penelitian ini papain digunakan untuk memperoleh peptida bioaktif dari susu kambing. Selanjutnya peptida yang dihasilkan diuji sifat bioaktif nya sebagai antibakteri. Tujuan dari penelitian ini yaitu menganalisis profil protein dan peptida hasil hidrolisis kasein dan whey susu kambing oleh enzim papain, serta menguji sifat bioaktif peptida yang dihasilkan sebagai antibakteri terhadap bakteri patogen pangan Escherichia coli dan Staphylococcus aureus.
Proses hidrolisis susu menjadi peptida dilakukan dengan menginkubasikan kasein dan whey dengan papain pada pH 7 dan suhu 50°C selama 15, 30, dan 45menit. Penghentian hidrolisis dilakukan dengan pemanasan 80°C selama 15 menit, selanjutnya hasil hidrolisis disimpan pada suhu -20°C. Sampel peptida yang telah disterilisisasi dengan membran filter 0,45 µm dianalisis profil proteinnya dengan metode SDS PAGE (gel pemisah 15% untuk sampel kasein dan 20% untuk sampel whey, pada tegangan 70 Volt dan 50 mA), serta analisis kemampuan antibakteri dengan dua metode yaitu: metode cakram dan metode kontak.
Susu kambing memiliki sepuluh pita protein dengan berat molekul 68, 60, 55, 34, 24, 21, 19, 18, 15 dan 11 kDa. Setelah dilakukan pemisahan kasein dan
whey, kesepuluh pita protein tersebut muncul kembali pada kasein dengan disertai penambahan pita protein 12 kDa, sedangkan whey memiliki 6 pita protein yaitu pita protein 85, 69, 61, 25, 14, dan 12 kDa. Hidrolisis kasein susu kambing menggunakan enzim papain menyebabkan α- dan β- kasein terhidrolisis/ dan
menyisakan κ-kasein serta satu peptida dengan berat molekul sekitar 10 kDa. Sedangkan pada whey hidrolisis oleh papain menyebabkan protein laktoferin terhidrolisis sehingga dapat menjadi faktor yang menurunkan aktivitas antibakteri pada whey.
Baik kasein dan whey utuh maupun yang sudah terhidrolisis sama-sama menghasilkan zona hambat yang signifikan terhadap pertumbuhan E. coli, tetapi tidak pada S. aureus. Pengujian lanjut dengan metode kontak menunjukkan kasein utuh dapat menghambat pertumbuhan E. coli secara signifikan sejak jam ke 2 bahkan menunjukkan penurunan jumlah bakteri sebanyak 2,8 log yang mengindikasikan sifat baterisidal kasein susu kambing.
SUMMARY
DIANA LESTARI. Caprine Milk Protein and Peptides, and Its Potestial as
Antibacterial. Supervised by MAGGY THENAWIDJAJA SUHARTONO and HARSI DEWANTARI KUSUMANINGRUM.
Bioactive peptides are specific protein fragments derived from hydrolysis that has positive effect on human health. Caprine milk is one of animal protein sources with high nutrition and relatively easy to digest. Caprine milk has high protein content (3.4%) which is potential to produce bioactive peptides.
Protease is an enzyme capable to hydrolyze protein, and thus is used to hydrolyze protein to produce bioactive peptide. Fragments of protein and peptide hydrolysates can be determined by SDS PAGE analysis that show protein profiles in the form of protein molecular weight. In this study, papain was used to produce bioactive peptides from caprine milk. The objective of this study was to analyze the profile of peptides from caprine casein hydrolyzed with papain, and analyze their bioactivity as antibacteria toward food pathogens bacteria Escherichia coli and
Staphylococcus aureus.
The caprine casein was produced by adding HCl to defatted caprine milk until isoelectric point and coagulated by centrifugation. Hydrolysis process was performed by incubating casein and whey with papain in optimum condition (pH 7, 50°C) for 15, 30, and 45 min. Hydrolysis was terminated by heating at 80°C, 15 minutes and then stored at -20°C. Culture of pathogenic bacteria that used in this study was Escherichia coli ATCC 25 922 and Staphylococcus aureus ATCC 25923. Protein and peptides samples that have been sterilized with membrane filter (0.45
μm) were analyzed the protein profile by SDS-PAGE (consisted of 15% running gel for casein samples, 20% running gel for whey samples, 4% stacking gel and subjected to electrophoresis at constant voltage and current of 70 volt and 50 mA) and the antibacterial activity by disc diffusion method and contact method.
Caprine milk has ten protein bands with molecular weight of 68, 60, 55, 34, 24, 21, 19, 18, 15 and 11 kDa. After separation, all protein bands were maintained in casein with addition of 12 kDa protein bands, whereas whey has six protein bands with molecular weight of 85, 69, 61, 25, 14, and 12 kDa. Caprine casein hydrolysis by papain enzyme, hydrolyzed α-casein (MW 32 kDa), β-casein (MW 24 kDa) and other caprine milk protein after 15 minutes incubation leaving κ-casein (MW 21 kDa) and one new peptide band (MW 10 kDa). Papain hydrolyzed lactoferrin protein in whey that can be a factor which reduce the antibacterial activity in whey. Both casein, whey and their peptide hydrolysates inhibited E. coli but not S. aureus. Further analysis showed that casein (unhydrolyzed) reduced E. coli growth significantly by 2.8 log after 2 hours exposure and the inhibition increased by exposure time.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PROTEIN DAN PEPTIDA SUSU KAMBING SERTA
POTENSINYA SEBAGAI ANTIBAKTERI
DIANA LESTARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Protein dan Peptida Susu Kambing serta Potensinya sebagai Antibakteri
Nama : Diana Lestari NIM : F251120251
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Maggy T. Suhartono Dr Ir Harsi Dewantari Kusumaningrum
Ketua Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc
Dekan Sekolah Pascasarjana IPB
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas karunia-Nya sehingga Tesis yang berjudul ” Protein dan Peptida Susu Kambing serta Potensinya sebagai Antibakteri” ini berhasil diselesaikan. Terima kasih penulis ucapkan kepada Proyek Penelitian Unggulan Perguruan Tinggi, DIPA IPB, tahun anggaran 2013, Kode MAK: 2013.089.521219 yang telah mendanai penelitian ini.
Dalam kesempatan ini, penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada Prof. Dr. Ir. Maggy Thenawidjaja Suhartono selaku ketua komisi pembimbing dan Dr. Ir. Harsi Dewantari Kusumaningrum selaku anggota komisi pembimbing atas waktu dan kesempatan yang telah diluangkan dalam memberikan bimbingan, ilmu, arahan, motivasi, dan masukkan selama penulis mengikuti pendidikan, penyusunan proposal, pelaksanaan penelitian, pembuatan artikel jurnal hingga penyusunan tesis. Ucapan terima kasih juga penulis sampaikan kepada Dr. Puspo Edi Giriwono, S.TP, M.Agr selaku penguji luar komisi pembimbing atas saran dan masukannya demi kesempurnaan Tesis ini.
Terima kasih kepada keluarga terutama orangtua penulis Bapak Inkanta dan Ibu Wachyuni Devi, kedua adik penulis Evianthy Dwi Kanta dan Andi Utomo Inkanta, serta Penfen Fealty atas doa, bantuan, dan dukungannya hingga penulis berhasil menyelesaikan Tesis ini. Serta kepada teknisi, dan staf di Program Studi IPN, Departemen ITP dan SEAFAST, terutama Ibu Ika, Mbak Ari, Pak Taufik, dan Teh Yayam, kepada rekan-rekan penelitian di laboratorium, Mba Ino, Mas Novan, Silvie, Pak Rinto, Mba Eni, Ibu Retnani, Mba Nur, Rina, Anis, dan Wulan, Laras, Tuti, Puri, Ka Tiwi serta teman-teman IPN lainnya yang tidak dapat disebutkan satu per satu. Terima kasih atas bantuan, masukkan, dukungan, dan kerjasama selama melakukan penelitian ini, serta kepada semua pihak yang turut mendukung penyelesaian tesis ini.
Akhir kata penulis berharap semoga penelitian dan tesis ini dapat bermanfaat bagi pembaca serta mampu memberikan sumbangan yang berarti bagi ilmu pengetahuan.
Bogor, Juni 2015
DAFTAR ISI
Profil Protein dan Peptida Kasein serta Whey Susu Kambing 15
Protein kasein dan peptida turunannya 15
Protein whey dan peptida turunannya 16
Profil Situs Pemotongan Peptida 18
Sifat Antibakteri Protein Susu Kambing 22
Aktivitas antibakteri dengan metode cakram 22
Aktivitas antibakteri dengan metode kontak 25
DAFTAR TABEL
1. Perbandingan komposisi susu kambing, susu sapi dan ASI 4
2. Komponen bioaktif utama pada susu dan sifat fungsionalnya 7
3. Fragmen peptida, asal, sifat antibakteri dan sifat bioaktif lainnya dari
peptida antibakteri 8
4. Hasil hidrolisis protein kasein oleh enzim papain 19
5. Hasil hidrolisis laktoferin oleh enzim papain 21
6. Diameter zona hambat kasein utuh dan peptida kasein 23
7. Diameter zona hambat peptida whey 24
8. Pertumbuhan E. coli dalam media dengan penambahan kasein utuh dan
peptida kasein 25
9. Pertumbuhan E. coli dalam media dengan penambahan whey utuh dan
peptida whey 26
10. Jenis dan spesifisitas enzim 28
DAFTAR GAMBAR
1. Skema senyawa fungsional bioaktif utama yang berasal dari susu
(Park 2009) 6
2. Mekanisme perusakan membran oleh peptida antibakteri (Fjell et al.
2012) 9
3. Diagram Alir Penelitian 11
4. Pengukuran zona penghambatan 14
5. Pola SDS-PAGE kasein pada gel pemisah 15%. 15
6. Pola SDS-PAGE hasil hidrolisis kasein oleh papain (Luo et al. 2014) 16
7. Pola SDS-PAGE whey pada gel pemisah 20% 17
8. Pola SDS-PAGE hasil hidrolisis whey (bovine)oleh papain (Kim et al.
2007) 17
9. Perbandingan sekuen asam amino α-S1 kasein susu kambing dan sapi 18
10. Perbandingan sekuen asam amino α-S2 kasein susu kambing dan sapi 19
11. Perbandingan sekuen asam amino α-S2 kasein susu kambing dan sapi 19
12. Perbandingan sekuen asam amino κ- kasein susu kambing dan sapi 19
13. Perbandingan sekuen asam laktoferin susu kambing dan sapi 21
14. Zona hambat kasein dan peptida kasein terhadap E. coli 22
15. Zona hambat whey dan peptida whey terhadap E. coli 23
16. Perbedaan struktur dinding sel bakteri gram positif dan gram negatif
(Madigan et al. 2012) 24
17. Penghambatan kasein utuh dan peptida kasein terhadap pertumbuhan
18. Penghambatan whey utuh dan peptida whey terhadap pertumbuhan
E. coli 27
19.Perbandingan hasil SDS PAGE hidrolisis whey oleh enzim A. Papain
B. Enzim pencernaan 28
DAFTAR LAMPIRAN
1. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida kasein
terhadap E. coli 34
2. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida kasein
terhadap S. aureus 34
3. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida whey
terhadap E. coli 35
4. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida whey
terhadap S. aureus 35
5. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan
peptida kasein pada jam ke-0 36
6. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan
peptida kasein pada jam ke-2 36
7. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan
peptida kasein pada jam ke-4 37
8. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan
peptida kasein pada jam ke-6 37
9. Hasil uji ANOVA dan Duncan metode kontak terhadap whey volume
2ml pada jam ke-0 38
10. Hasil uji ANOVA dan Duncan metode kontak terhadap whey volume
2ml pada jam ke-2 38
11. Hasil uji ANOVA dan Duncan metode kontak terhadap whey volume
2ml pada jam ke-4 39
12.Hasil uji ANOVA dan Duncan metode kontak terhadap whey volume
1
1.
PENDAHULUAN
Latar Belakang
Susu telah dikenal sebagai bahan pangan dengan kandungan gizi lengkap. Selain nilai zat gizi (karbohidrat, protein, lemak, vitamin, dan mineral) komponen bioaktif yang terkandung dalam susu menjadikan susu memiliki fungsi fisiologis dan biokimia penting yang memberikan dampak positif terhadap kesehatan, misalnya sebagai antihipertensi, antioksidan, antitrombotik, hipokolesterolemik, immunomodulator, antibakteri, dan lain sebagainya (Schanbacher et al. 1998; Korhonen dan Pihlanto–Leppaala 2004; Gobbetti et al. 2007). Komponen bioaktif susu dapat berasal dari berbagai sumber diantaranya protein, lemak, vitamin dan mineral.
Salah satu sumber komponen bioaktif susu adalah kasein dan whey. Kasein merupakan sumber protein susu utama, kandungannya mencapai 80% dari total protein susu, sedangkan whey adalah protein larut air yang terkandung dalam cairan sisa pengendapan susu dengan presentase protein 20% dari total protein susu. Selama dua puluh tahun terakhir, berbagai penelitian menunjukkan bahwa protein dapat berperan sebagai prekursor peptida antibakteri yang dapat meningkatkan sistem kekebalan tubuh dalam melawan mikroorganisme patogen. Oleh karena itu protein dapat dipertimbangkan sebagai sumber pangan yang berperan sebagai antibakteri.
Susu kambing merupakan salah satu sumber protein hewani yang memiliki nilai gizi tinggi dan relatif mudah dicerna. Susu kambing memiliki kandungan gizi yang tidak kalah dengan susu sapi, bahkan kandungan protein susu kambing relatif lebih tinggi yaitu mencapai 3,4% dibandingkan susu sapi yang hanya 3,2% (Park et al. 2007). Sumber lain menyebutkan kandungan protein susu kambing berkisar 2,6
– 4,1% (Raynal-Ljutovac et al. 2008) bergantung pada jenis kambing dan lingkungannya. Kandungan protein yang cukup tinggi ini sangat potensial untuk menghasilkan peptida susu yang memiliki sifat bioaktif misalnya sebagai antibakteri.
Peptida bioaktif adalah fragmen protein spesifik yang memiliki dampak positif pada fungsi atau kondisi tubuh. Peptida bioaktif susu dapat diperoleh dengan beberapa cara hidrolisis, yaitu: hidrolisis dengan enzim pencernaan, hidrolisis oleh mikroorganisme proteolitik, dan hidrolisis oleh enzim proteolitik yang dihasilkan oleh mikroorganisme atau tumbuhan.
2
2006; Baehaki 2012). Jenis enzim protease yang berbeda memiliki titik potong substrat yang berbeda, sehingga menghasilkan fragmen-fragmen peptida yang berbeda pula. Perbedaan fragmen tersebut dapat diketahui dengan analisis SDS PAGE yang memberikan gambaran profil peptida dan protein berupa ukuran atau berat molekul protein.
Protein dari berbagai sumber telah diidentifikasi sebagi prekursor peptida antibakteri. Salah satu diantaranya adalah protein susu baik yang berasal dari susu sapi, domba, kambing maupun ASI (Hernández-Ledesma et al. 2014). Hidrolisis protein whey susu kambing oleh enzim proteolitik manusia (asam lambung dan enzim duodenum) menghasilkan peptida antibakteri yang dapat menghambat pertumbuhan Listeria monocytogenes (Almaas et al. 2008). Hal ini menunjukkan terdapat fragmen peptida spesifik dalam susu kambing yang berpotensi sebagai antibakteri.
Perumusan Masalah
Kandungan protein yang tinggi dalam susu kambing merupakan potensi yang sangat besar untuk menghasilkan protein dan peptida bioaktif sebagai antibakteri. Senyawa antibakteri dari bahan pangan bersifat lebih natural dan relatif aman bagi tubuh. Saat ini penelitian serta pemanfaatan susu kambing terutama sebagai peptida bioaktif masih belum banyak dilakukan. Sehingga pemanfaatkan susu kambing sebagai pangan fungsional khususnya sumber peptida yang potensial sebagai antibakteri masih sangat terbuka.
Tujuan
Tujuan dari penelitian yang berjudul protein dan peptida susu kambing serta potensinya sebagai antibakteri ini adalah sebagai berikut:
1. Menganalisis profil protein dan peptida hasil hidrolisis kasein dan whey
susu kambing Peranakan Etawa (asal Bogor) oleh enzim papain (EC 3.4.22.2)
2. Menguji potensi sifat bioaktif protein utuh dan peptida yang dihasilkan sebagai antibakteri terhadap bakteri patogen pangan Escherichia coli dan
Staphylococcus aureus.
Hipotesis
Hipotesis dari penelitian ini yaitu:
1. Terdapat protein spesifik dalam susu kambing yang dapat berperan sebagai antibakteri
3
3. Protein atau peptida susu kambing berpotensi sebagai penghambat E. coli
dan S. aureus.
Manfaat Penelitian
4
2.
TINJAUAN PUSTAKA
Susu Kambing
Susu yang popular beredar dipasaran adalah susu sapi. Namun susu kambing kini telah mulai dikenal dan diminati oleh masyarakat. Kambing Peranakan Etawa merupakan kambing hasil persilangan antara kambing lokal Indonesia dengan kambing lokal dari India, yaitu antara kambing Kacang dan kambing Etawa, sehingga memiliki sifat diantara keduanya (Atabany 2001). Kambing Peranakan Etawa dapat menghasilkan susu 0,45 – 2,2 liter/ekor/hari (Sodiq & Abidin 2008). Rusman (2011) menunjukkan produksi susu kambing Peranakan Etawa berkisar antara 0,5 – 1,8 liter/ekor/hari bergantung pada ketinggian tempat dan cara pemeliharaan.
Susu kambing memiliki beberapa perbedaan karakteristik dari susu sapi, yaitu warnanya lebih putih, globula lemak susunya lebih kecil sehingga lemak susu kambing lebih mudah dicerna, dan dapat diminum oleh orang yang alergi terhadap susu sapi, intoleransi laktosa, atau untuk orang-orang yang mengalami berbagai gangguan pencernaan (Blakely & Blade 1991). Beberapa kelebihan susu kambing diantaranya adalah:
1) susu kambing memiliki partikel lemak yang lebih kecil dari rantai asam lemak yang lebih pendek dibandingkan susu sapi sehingga mudah dicerna oleh tubuh;
2) susu kambing mengandung 13% kadar laktosa yang lebih rendah dibandingkan susu sapi dan 41% lebih rendah dibanding ASI;
3) susu kambing memiliki daya cerna dan sifat buffer yang tinggi, menjadikannya sebagai diet yang baik bagi orang yang mengalami gangguan pencernaan seperti maag.
Perbandingan komposisi susu segar antara susu kambing, susu sapi, dan ASI dapat dilihat pada Tabel 1.
Tabel 1. Perbandingan komposisi susu kambing, susu sapi dan ASI
5
Protease
Protease merupakan enzim proteolitik yang dapat menghidrolisis/ memutuskan ikatan peptida pada protein. Protease sering kali dibedakan menjadi proteinase dan peptidase. Proteinase mengkatalis hidrolisis molekul protein menjadi fragmen-fragmen besar, sedangkan peptidase mengkatalisis hidrolisis fragmen polipeptida menjadi asam amino. Berdasarkan asalnya terdapat tiga jenis protease yaitu protease tanaman, hewan dan mikroorganisme (Salleh et al. 2006).
Protease yang dihasilkan dari tanaman diantaranya papain, bromelin dan ficin. Protease dari hewan yaitu tripsin, kimotripsin, pepsin, dan renin. Sedangkan protease dari mikroorganisme contohnya adalah protease intraseluler dari
Clostridium perfringens dan protease ekstraseluler Bacillus lichenisformis F11.4 (Salleh et al. 2006; Baehaki 2012).
Dilihat dari letak hidrolisis ikatan peptida, protease dibedakan menjadi eksopeptidase dan endopeptidase. Eksopeptidase memecahkan protein dari ujung rantai sehingga dihasilkan satu asam amino dan sisa peptida, yang terbagi lagi menjadi karboksi (ekso) peptidase yaitu protease yang memotong peptida dari arah gugus karboksil terminal dan amino (ekso) peptidase yaitu protease yang memotong peptida dari arah gugus amino terminal. Sedangkan Endopeptidase memecahkan protein pada bagian “dalam” rantai protein, sehingga dihasilkan peptida-peptida (Salleh et al. 2006).
Berdasarkan sifat kimia dan sisi aktifnya, protease digolongkan kedalam empat jenis protease yaitu protease serin, protease sulfhidril, protease metal dan protease asam. Pertama adalah protease serin, enzim golongan ini memiliki residu serin pada sisi aktifnya. Contohnya adalah enzim-enzim tripsin, kimotripsin, elastase dan subtilisin. Kedua, protease sulfhidril atau sering juga disebut protease thiol adalah enzim yang aktivitasnya bergantung pada adanya satu atau lebih residu sulfhidril pada sisi aktifnya. Contoh dari enzim golongan ini adalah papain, fisin dan bromelin. Ketiga, protease metal, yaitu protease yang aktivitasnya tergantung pada adanya logam. Logam-logam yang dapat mengaktifkan enzim ini adalah magnesium (Mg), seng (Zn), kobalt (Co), besi (Fe), merkuri (Hg), Kadmium (Cd), Tembaga (Cu), dan nikel (Ni). Enzim yang termasuk jenis ini adalah karboksipeptidase A, beberapa aminopeptidase dan beberapa protease bakteri. Terakhir adalah protease asam, enzim golongan ini keaktifannya disebabkan adanya gugus karboksil pada sisi aktifnya. Protease yang termasuk golongan ini adalah pepsin, renin, dan banyak protease lain yang aktif pada pH rendah, yaitu pH 2 sampai 4 (Salleh et al. 2006).
Papain
6
golongan enzim jenis hydrolase, EC 3.4.-.- beraksi pada ikatan peptida, EC 3.4.22.- merupakan golongan sistein endopeptidase, EC 3.4.22.2 berarti papain. Kondisi optimum enzim papain (pepaya burung varietas jawa) dalam menghidrolisis kasein yaitu pada pH 6 dan suhu 50ºC (Kusumadjaja & Dewi 2005).
Peptida Bioaktif
Peptida bioaktif didefinisikan sebagai fragmen protein spesifik yang memberikan dampak positif bagi fungsi atau kondisi tubuh dan dapat mempengaruhi kesehatan (Kitts & Wiler 2003). Peptida bioaktif dapat diperoleh dengan mengonsumsi pangan konvensional, suplemen, pangan fungsional, atau melalui obat. Peptida bioaktif belum aktif dalam bentuk parent protein sehingga protein harus dipecahkan terlebih dahulu. Peptida bioaktif dapat diperoleh melalui tiga cara, yaitu: hidrolisis dengan enzim pencernaan, hidrolisis protein oleh mikroorganisme proteolitik, hidrolisis oleh enzim proteolitik yang dihasilkan oleh mikroorganisme atau tumbuhan (Korhonen & Pihlanto 2007).
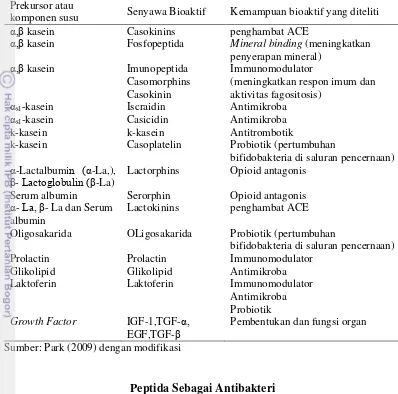
Penelitian pada dekade terakhir ini menunjukkan peptida bioaktif memiliki fungsi biologi yang luas dan sangat penting meliputi antimikroba, antihipertensi, antioksidan, antisitotoksik, immunomodulator, opioid, dan aktivitas pengangkutan mineral. Skema sederhana yang mempresentasikan sumber komponen bioaktif utama yang berasal dari susu dapat dilihat pada Gambar 1 dan Tabel 2. Beberapa peptida susu bahkan menunjukkan sifat fungsional ganda, yaitu pada satu sekuen peptida spesifik memiliki dua atau lebih aktivitas fisiologis yang berbeda.
7
Tabel 2. Komponen bioaktif utama pada susu dan sifat fungsionalnya
Prekursor atau
komponen susu Senyawa Bioaktif Kemampuan bioaktif yang diteliti
α,β kasein Casokinins penghambat ACE
α,β kasein Fosfopeptida Mineral binding (meningkatkan
penyerapan mineral)
αs1-kasein Iscraidin Antimikroba
αs1-kasein Casicidin Antimikroba
k-kasein k-kasein Antitrombotik
k-kasein Casoplatelin Probiotik (pertumbuhan
bifidobakteria di saluran pencernaan)
α-Lactalbumin (α-La,),
β- Lactoglobulin (β-La)
Lactorphins Opioid antagonis
Serum albumin Serorphin Opioid antagonis
α- La, β- La dan Serum albumin
Lactokinins penghambat ACE
Oligosakarida OLigosakarida Probiotik (pertumbuhan
bifidobakteria di saluran pencernaan)
Prolactin Prolactin Immunomodulator
Glikolipid Glikolipid Antimikroba
Laktoferin Laktoferin Immunomodulator
Antimikroba
Aktivitas antimikroba protein susu yang diturunkan sebagai peptida sangat beragam, mulai dari memiliki efek prebiotik, peptida dengan kemampuan untuk mencegah invasi mikroorganisme patogen, dan peptida yang menghambat pertumbuhanmikroorganisme (Hernandez-Ledesma et al. 2014). Menurut Gobbetti
8
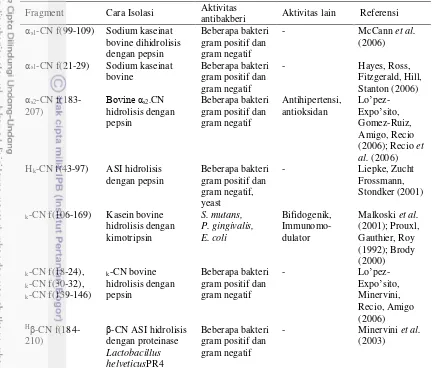
Tabel 3. Fragmen peptida, asal, sifat antibakteri dan sifat bioaktif lainnya dari peptida antibakteri
Fragment Cara Isolasi Aktivitas
antibakberi Aktivitas lain Referensi
αs1-CN f(99-109) Sodium kaseinat
bovine dihidrolisis
k-CN f(106-169) Kasein bovine
hidrolisis dengan
Sumber: Hernandez-Ledesma et al. (2014) dengan modifikasi
9
10
3.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2014 sampai Februari 2015. Penelitian dilaksanakan di Laboratorium Mikrobiologi dan Biokimia Pusat Antar Universitas (PAU) IPB, Laboratorium Mutu dan Keamanan Pangan PAU IPB, dan Laboratorium Mutu dan Keamanan Pangan SEAFAST Center IPB.
Bahan
Bahan yang digunakan dalam penelitian ini adalah susu kambing segar (jenis kambing peranakan etawa) yang diperoleh dari unit pengolahan susu, Eco-Farm, Fakultas Peternakan IPB. Isolat bakteri patogen Escherichia coli ATCC 25922 dan Staphylococcus aureus ATCC 25923. Enzim papain (Merck, Darmstadt, Germany). Media pertumbuhan bakteri Triptic Soy Broth (TSB, Oxoid, Hampshire, UK), Luria Bertani (LB, Himedia), Muller Hinton (MH, Himedia), Agar Powder Bacteriological (Himedia). Bahan kimia Hydrochloric acid, Natrium klorida, Etanol
absolute, Methanol, β-Merchaptoetanol, Akrilamida, Bis-akrilamida, Na2HPO4, NaH2PO4, Gliserol, Glycine (Merck, Darmstadt, Germany). Coomassie brilliant blue R-250 (CBB), Sodium dodecyl sulfate (SDS) (Sigma Aldrich). Standar protein berat molekul rendah (LMW) Multicolor Low Range Protein Ladder Thermo Scientific.
Alat
Alat-alat yang digunakan antara lain: spektofotometer UV-VIS (Pharmacia Novaspec II), sentrifugasi dingin (Tomy MRX-125 dan Himag CR 21G), peralatan elektroforesis SDS-PAGE (Bio-rad, Mini Protean 3), inkubator shaker (Rosi 1000), waterbath (Certomat), laminar air flow (Gelaire BSB 4A), membran filter 0,45µm (Minisart, Sartorius, Germany), pipet mikro 10-100µL, pipet mikro 100-1.000 µL, (finnpipette, Thermo Fisher Scientific, USA), serta berbagai jenis alat-alat gelas.
Metode
11
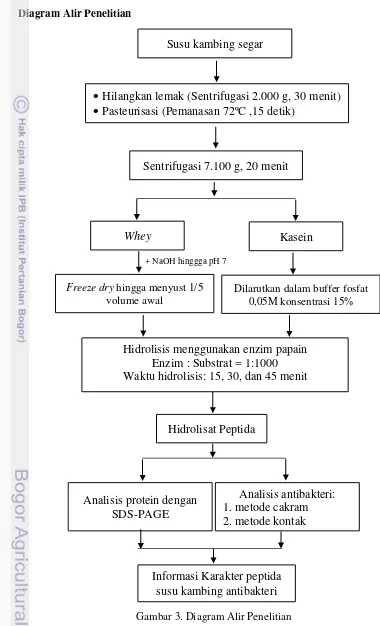
Diagram Alir Penelitian
+ NaOH hinggga pH 7
Hilangkan lemak (Sentrifugasi 2.000 g, 30 menit) Pasteurisasi (Pemanasan 72ºC ,15 detik)
Informasi Karakter peptida susu kambing antibakteri Analisis protein dengan
SDS-PAGE
Hidrolisis menggunakan enzim papain Enzim : Substrat = 1:1000 Waktu hidrolisis: 15, 30, dan 45 menit
Hidrolisat Peptida
Analisis antibakteri: 1. metode cakram 2. metode kontak
Kasein
Whey
Freeze dry hingga menyust 1/5 volume awal
Dilarutkan dalam buffer fosfat 0,05M konsentrasi 15% Sentrifugasi 7.100 g, 20 menit
Susu kambing segar
12
Preparasi susu kambing
Susu kambing segar disentrifugasi 2.000 g, 4ºC selama 30 menit untuk memisahkan komponen lemak, kemudian dilakukan pasteurisasi selama 15 detik dengan suhu 72ºC untuk menghilangkan kontaminasi mikroorganisme yang terbawa pada susu (Almaas et al. 2008). Isolasi kasein dilakukan dengan cara susu yang sudah dipasteurisasi ditambahkan HCl 2N pada suhu 40ºC hingga mencapai titik isoelektrik ( pH 4,6), kemudian dilakukan setrifugasi 7.100 g selama 30 menit. Hal ini bertujuan untuk memisahkan antara kasein dan whey. Setelah terpisah, kasein dibilas dengan akuades sebanyak 1x (Behera et al. 2013).
Hidrolisis susu kambing
Persiapan kondisi hidrolisis dalam penelitian ini yaitu: untuk substrat kasein dilakukan dengan cara melarutkan kasein padat dalam buffer fosfat 0,05 M pH 7 dengan konsentrasi kasein 15% (b/v), sedangkan untuk substrat whey, whey yang diperoleh dinetralkan dengan NaOH 1N kemudian dipekatkan dengan cara freeze drying hingga volume menyusut menjadi 1/5 volume awal. Masing-masing substrat tersebut dihidrolisis menggunakan enzim papain Merck dengan perbandingan enzim dan substrat 1:1000 (w/w, 4.000-6.000 unit/g) pada pH 7 dan suhu 50°C (Kusumadjaja & Dewi 2005), dengan interval waktu 15, 30, dan 45 menit. Penghentian hidrolisis dilakukan dengan cara pemanasan pada suhu 80°C selama 15 menit (Lo’pez-Expo’sito 2007). Protein dan peptida disentrifugasi 1.600 g selama 5 menit pada suhu ruang, dan disaring dengan membran filter (0,45 µm). Penyaringan juga dilakukan terhadap kasein dan whey utuh.
Analisis peptida hasil hidrolisis
1) Analisis profil protein dan peptida dengan SDS PAGE
Penentuan profil dan estimasi berat molekul peptida dilakukan menggunakan Sodium Dodecyl Sulphate Polyacrilamide Gel Electrophoresis (SDS-PAGE, Laemmli 1970). Beberapa modifikasi dilakukan berdasarkan Singh et al. (2001). Sampel dilarutkan dalam larutan SDS 5% dengan perbandingan sampel : larutan SDS adalah 1:5. Campuran tersebut kemudian diinkubasi dalam
13
asam asetat, 40% methanol, 0,1% Coomassie Brilliant Blue-R 250, 49,9% akuades), kemudian dilanjutkan pembilasan dengan larutan destaining (10% asam asetat, 40% methanol, 50% akuades). Standar protein yang digunakan adalah standar berat molekul rendah (LMW) dengan ukuran 2–40 kDa.
2) Analisis situs pemotongan peptida
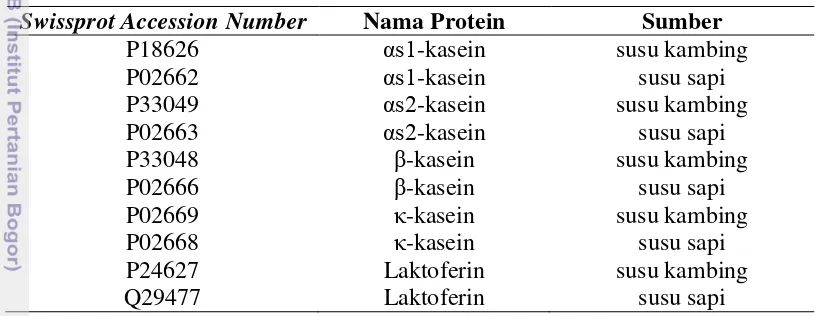
Data sekuen asam amino protein αs1-, αs2-, β-, dan κ-kasein serta laktoferin diperoleh dari http://www.uniprot.org dengan memasukan swissprot accession number (Tabel 4). Kemudian dengan informasi spesifitas enzim papain yang telah diperoleh dilakukan analisis posisi pemotongan yang terjadi terhadap protein-protein tersebut. Hasil pemotongan berupa asam amino, dipeptida, tripeptida, dan polipeptida dilaporkan dalam bentuk tabel.
Tabel 4. Swissprot accession number protein terpilih
Swissprot Accession Number Nama Protein Sumber
P18626 αs1-kasein susu kambing
P02662 αs1-kasein susu sapi
P33049 αs2-kasein susu kambing
P02663 αs2-kasein susu sapi
P33048 β-kasein susu kambing
P02666 β-kasein susu sapi
P02669 κ-kasein susu kambing
P02668 κ-kasein susu sapi
P24627 Laktoferin susu kambing
Q29477 Laktoferin susu sapi
3) Analisis antibakteri protein dan peptida
Kultur mikroorganisme patogen yang digunakan pada penelitian ini yaitu
Escherichia coli ATCC 25922 dan Staphylococcus aureus ATCC 25923. Sampel peptida yang telah disterilisasi menggunakan membran filter 0,45 µm dianalisis kemampuan antibakteri nya dengan metode cakram dan metode kontak.
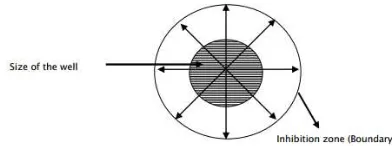
a) Metode cakram (Jorgensen & Ferraro 2009)
14
Gambar 4. Pengukuran zona penghambatan
b) Metode kontak (Zuhud et al. 2001)
Metode kontak merupakan metode evaluasi aktivitas antibakteri berdasarkan perkembangan atau kematian bakteri dengan menghitung jumlah bakteri setelah ditambahkan zat antibakteri (kontak langsung) dan diinkubasi dalam waktu tertentu. Disiapkan media Tryptic Soy Broth masing-masing 1 ml dalam tabung reaksi, kemudian ditambahkan 1 ml sampel peptida antibakteri yang akan di uji dan 100 µl bakteri uji dengan konsentrasi 105 cfu/ml. Inkubasi dilakukan dalam inkubator dengan suhu 37°C, pada waktu kontak 0, 2, 4, dan 6 jam dilakukan pemupukan pada cawan dan jumlah bakteri diukur dengan metode hitung cawan berdasarkan BAM (2001) dalam media Luria Bertani Agar.
Pengujian statistik
Pengambilan sampel dilakukan dua kali dengan dua ulangan dan dirata-ratakan. Uji Anova dengan uji lanjut Duncan dilakukan untuk membandingkan perbedaan diameter zona hambat dan kurva tumbuh bakteri setiap 2 jam. Perbedaan dinyatakan signifikan jika p< 0,05. Hasil dilaporkan dengan nilai rata-rata±SD.
15
4.
HASIL DAN PEMBAHASAN
Profil Protein dan Peptida Kasein serta Whey Susu Kambing Protein kasein dan peptida turunannya
Susu kambing mengandung 3,4% protein (Park et al. 2007). Kasein merupakan 80% dari total protein yang terkandung dalam susu. Sama halnya dengan susu sapi dan susu domba, kasein susu kambing terdiri dari dari α-,β-, dan
κ-kasein. Pemisahan kasein dapat dilakukan dengan menurunkan pH susu hingga mencapai 4,6 baik dengan penambahan asam maupun dengan cara fermentasi menggunakan starter bakteri.
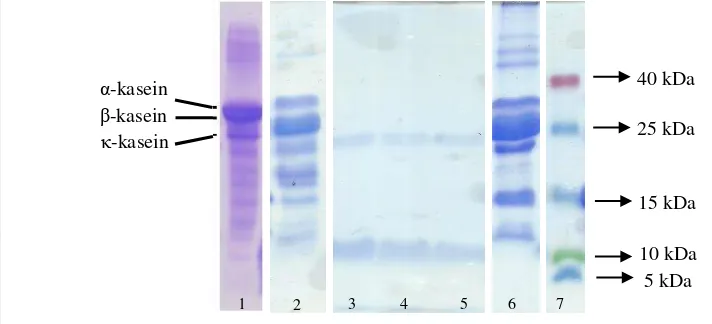
Estimasi berat molekul protein pada penelitian ini dilakukan dengan metode SDS-PAGE menggunakan marker dengan berat molekul rendah. Perhitungan berat molekul protein dilakukan dengan menghitung Rf dari masing-masing pita protein marker yang sudah diketahui berat molekulnya. Berdasarkan nilai-nilai tersebut dapat dibuat kurva standar untuk melakukan estimasi berat molekul sampel. Analisis SDS-PAGE terhadap susu kambing menunjukkan 10 pita protein dengan berat molekul dari yang tertinggi adalah 68, 60, 55, 34, 24, 21, 19, 18, 15 dan 11 kDa. Setelah dilakukan pemisahan kasein dan whey menggunakan HCl 2N, terjadi pemisahan protein dimana ke 10 pita protein tersebut muncul pada kasein dengan pita protein 69, 61, 52, 15 dan 11 kDa menjadi lebih tipis, pita protein 21 dan 19 kDa menjadi lebih tebal, serta penambahan pita protein 12 kDa (Gambar 5).
Gambar 5. Pola SDS-PAGE kasein pada gel pemisah 15%. 1. Natrium kaseinat (Luo et al. 2014), 2. Protein kasein utuh susu kambing, 3-5. Peptida kasein hidrolisis:
15 menit (3), 30 menit (4), 45 menit (5), 6. Protein susu kambing, 7. Marker.
Gambar 5 menunjukkan perbandingan hasil SDS PAGE natrium kaseinat yang telah dilakukan oleh Luo et al. (2014) dengan kasein utuh, peptida kasein hasil hidrolisis enzim papain, dan susu kambing yang diperoleh dari penelitian ini. Dapat
16
dilihat bahwa pola hasil SDS-PAGE kasein yang diperoleh dalam penelitian ini memiliki pola protein yang mirip dengan Luo et al. (2014) yaitu memiliki 11 pita protein. dengan tiga pita utama merupakan α-kasein, β-kasein, dan κ-kasein dengan BM masing-masing adalah 34 kDa, 24 kDa dan 21 kDa.
Hidrolisis kasein oleh enzim papain sejak 15 menit pertama sudah
mengakibatkan α-kasein dan β-kasein terhidrolisis dan hanya menyisakan pita κ -kasein (21 kDa) dengan penambahan satu pita peptida baru dengan BM sekitar 10 kDa, sehingga pada waktu hidrolisis 30 dan 45 menit sudah tidak menunjukkan perubahan. Hal ini mungkin disebakan oleh kemampuan enzim papain yang sangat kuat dalam menghidrolisis substrat kasein sehingga perlu penggunaan range waktu hidrolisis yang lebih sempit.
Gambar 6. Pola SDS-PAGE hasil hidrolisis kasein oleh papain (Luo et al. 2014). 0. sodium kaseinat, 1-5. hidrolisis 10, 30 menit, 1, 4, 24 jam. 6. marker
Hidrolisis sodium kaseinat oleh enzim papain yang dilakukan oleh Luo et al. (2014) dengan suhu hidrolisis yang lebih rendah (37°C) menunjukkan terjadi pemecahan substrat yang lebih lambat, sehingga degradasi protein yang terjadi lebih terlihat (Gambar 6). Namun pada penelitian tersebut enzim papain tetap menunjukkan aktivitas yang lebih kuat dibandingkan enzim lainnya dengan derajat hidrolisis 13-22%.
Perbedaan hasil SDS-PAGE antara kasein susu kambing yang dihidrolisis menggunakan papain dalam penelitian ini dengan natrium kaseinat yang dihidrolisis menggunakan papain dalam Luo et al. (2014) disebabkan oleh perbedaan jenis kasein dan suhu hidrolisis yang digunakan. Pada penelitian ini menggunakan kasein susu kambing dan suhu 50°C yang merupakan suhu optimum bagi enzim papain sedangkan Luo et al. (2014) menggunakan kasein komersial (susu sapi) dengan suhu 37°C.
Protein whey dan peptida turunannya
Selain bagian protein susu yang mengendap dalam fase padat berupa kasein, terdapat pula bagian protein susu yang larut pada fase cair yang dikenal sebagai
17
susu kambing yang diperoleh dari penelitian ini dan whey susu kambing (Eriksen
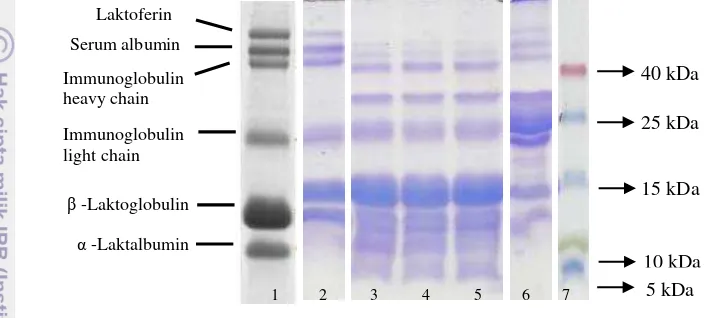
et al. 2010), serta peptida whey hasil hidrolisis enzim papain dan juga susu kambing sebelum dilakukan pemisahan kasein dan whey. Hasil analisis SDS PAGE menunjukkan whey susu kambing memiliki 6 pita protein yaitu pita protein 85, 69, 61, 25, 14, dan 12 kDa.
Gambar 7. Pola SDS-PAGE whey pada gel pemisah 20%. 1. Protein whey utuh susu kambing (Eriksen et al. 2010), 2. Protein whey utuh susu kambing, 3-5. Peptida whey hidrolisis: 15 menit (3), 30 menit (4), 45 menit (5), 6. Protein susu kambing, 7. Marker.
Dapat dilihat pada Gambar 7 bahwa pola protein hasil SDS-PAGE whey
yang diperoleh dalam penelitian ini memiliki pola yang mirip dengan penelitian yang dilakukan oleh Eriksen et al. (2010) yaitu memiliki pita laktoferin (85 kDa), serum albumin (69 kDa), immunoglobulin heavy chain (61 kDa), immunoglobulin light chain (25 kDa), β-Laktoglobulin (14 kDa), dan α-Laktalbumin (12 kDa). Hidrolisis whey menggunakan enzim papain menyebabkan pita laktoferin terhidrolisis, hal ini ditunjukkan dengan menipisnya pita laktoferin tersebut pada menit ke 15 dan hilang sempurna pada menit ke 30 dan 45. Selain itu hidrolisis
whey oleh papain juga menyebabkan muncul pita-pita protein dengan BM 54, 38, 11 dan 8 kDa.
Gambar 8. Pola SDS-PAGE hasil hidrolisis whey (bovine)oleh papain (Kim et al. 2007) (A). Standar protein, (B). WPC (Whey Protein Concentrate), (C). WPC dengan pemanasan, (1-7) Inkubasi 50°C selama 30, 60, 90 ,120, 150, 180, 240 menit
18
Hidrolisis whey protein concentrate (WPC) dari bovine oleh enzim papain juga dilakukan oleh Kim et al. (2007) dengan suhu hidrolisis 50°C (Gambar 8). Pemecahan substrat yang ditunjukkan oleh Kim et al. (2007) sedikit berbeda dibandingkan dengan hasil penelitian ini, dimana protein dengan berat molekul besar seperti laktoferin, serum albumin dan immunoglobulin telah terhidrolisis secara keseluruhan dan menghasilkan peptida dengan berat molekul kurang dari
atau sama dengan β-Lg (15 kDa). Sedangkan pada peneltian ini protein whey dengan berat molekul besar masih dapat terdeteksi (Gambar 7). Perbedaan hasil ini mungkin disebabkan oleh perbedaan jenis substrat whey dan konsemtrasi enzim papain yang digunakan.
Profil Situs Pemotongan Peptida
Protein kasein
Seperti yang sudah disebutkan sebelumnya, hidrolisis protein salah satunya dapat dilakukan menggunakkan enzim. Papain merupakan enzim hidrolase yang memotong ikatan peptida pada posisi N dari asam amino arginin, lisin, glutamin, histidin, glisin, dan tirosin, yang dikenal dengan spesifitas enzim.
Sekuen protein atau sekuen peptida adalah urutan asam amino pada suatu protein atau peptida (oligopeptida maupun polipeptida). Dengan mengetahui sekuen asam amino protein yang dihidrolisis dan spesifisitas enzim yang digunakan, maka dapat dilakukan analisis titik potong yang terjadi serta asam amino dan sekuen peptida yang dihasilkan. Perbandingan data sekuen asam amino dari protein αs1-, αs2-, β-, dan κ -kasein antara susu kambing dan susu sapi ditunjukkan pada Gambar 9, 10, 11 dan 12.
19
Gambar 10. Perbandingan sekuen asam amino α-S2 kasein susu kambing dan sapi
10 20 30 40 50
Gambar 11. Perbandingan sekuen asam amino α-S2 kasein susu kambing dan sapi
10 20 30 40 50
B: PTSTPTTEAV ESTVATLEDS PEVIESPPEI NTV↓QVTSTAV
Keterarangan:
C : caprine (susu kambing) B : bovine (susu sapi) ↓ : posisi titik potong
20
Hasil pemotongan protein αs1-, αs2-, β-, dan κ-kasein berupa asam amino, dipeptida, tripeptida, dan polipeptida dari pemotongan diatas dilaporkan dalam Tabel 5 sebagai berikut.
Tabel 5. Hasil hidrolisis protein kasein oleh enzim papain
Jumlah
amino Dipeptida Tripeptida Polipeptida Total
α-S1
Tabel 5 merupakan perbandingan hasil pemotongan oleh enzim papain pada substrat kasein susu kambing dan kasein susu sapi. Dapat dilihat pada tabel bahwa jumlah titik potong dan hasil pemotongan pada susu kambing lebih banyak daripada susu sapi. Hal ini terutama dapat dilihat pada α-S2 kasein dengan 66 titik potong dan 67 total hasil pemotongan. Titik potong dan hasil pemotongan yang lebih banyak akan menghasilkan ukuran peptida yang lebih kecil, sehingga pada analisis SDS-PAGE akan berada dibagian bawah atau sampai tidak dapat terdeteksi. Hal ini mendukung hasil penelitian yang menunjukkan bahwa pada profil SDS-PAGE peptida kasein susu kambing menghasilkan pita protein yang lebih tipis dibandingkan susu sapi yang dilaporkan oleh Luo et al. (2014) (selain karena perbedaan suhu hidrolisis).
Protein Whey
21
22
Hasil pemotongan protein laktoferin berupa asam amino, dipeptida, tripeptida, dan polipeptida dari pemotongan diatas dilaporkan dalam Tabel 6.
Tabel 6. Hasil hidrolisis laktoferin oleh enzim papain
Jumlah
amino Dipeptida Tripeptida Polipeptida Total
Laktoferin susu
kambing 708 195 56 37 33 70 196
susu
sapi 708 193 55 41 31 67 194
Perbandingan hasil pemotongan substrat laktoferin susu kambing dan susu sapi oleh enzim papain menunjukkan jumlah titik potong dan hasil pemotongan pada susu kambing hampir sama dengan susu sapi (Tabel 6). Hal ini juga ditunjukan pada profil SDS-PAGE, baik pita laktoferin susu kambing maupun susu sapi keduanya hilang secara sempurna dan pita dengan berat molekul rendah menjadi lebih tebal setelah waktu hidrolisis 30 menit yang menunjukkan protein laktoferin terdegradasi menjadi peptida dan asam amino dengan ukuran lebih kecil (Gambar 7).
Sifat Antibakteri Protein Susu Kambing
Aktivitas antibakteri dengan metode cakram
Screening aktivitas antibakteri protein kasein dan whey serta peptida hasil hidrolisisnya dilalukan dengan metode cakram terhadap bakteri uji Escherichia coli
ATCC 25922 dan Staphylococcus aureus ATCC 25923. Kontrol positif yang digunakan adalah Amoxilin 1mg/ml dan kontrol negatif buffer fosfat. Zona hambat dihitung berdasarkan besarnya diameter zona bening termasuk diameter cakram
disk (6 mm). Konsentrasi bakteri uji yang digunakan adalah 107 cfu/ml dengan volume sampel dalam cakram disk masing-masing sekitar 40 μL.
Gambar 14. Zona hambat kasein dan peptida kasein terhadap E. coli. (A) kasein utuh, (B-D) kasein hidrolisis: 15 menit (B), 30 menit (C), 45 menit (D).
Gambar 14 merupakan hasil penghambatan kasein utuh dan peptida kasein hasil hidrolisis terhadap E. coli. Dapat dilihat pada gambar bahwa terdapat zona
23
bening yang cukup jelas yang menunjukkan pertumbuhan E. coli disekitar cakram
disk terhambat, dengan ukuran diameter ditampilkan pada Tabel 7.
Tabel 7. Diameter zona hambat kasein utuh dan peptida kasein
Protein dan peptida kasein Diameter zona hambat
E.coli (mm) S.aureus (mm)
*) uji beda Duncan pada selang kepercayaan 95% terhadap kontrol negatif
Tabel 7 menunjukkan bahwa kasein utuh dan peptida hasil hidrolisis kasein memiliki penghambatan yang lebih besar terhadap E. coli dibandingkan terhadap
S. aureus. Penghambatan yang signifikan (p=0,007) terjadi terhadap bakteri uji E. coli. Hal ini ditunjunkan baik oleh protein kasein utuh maupun kasein hidrolisis 15, 30, dan 45 menit dengan nilai rata-rata diameter 7,60 – 7,77 mm. Sedangkan zona hambat protein kasein dan peptida hasil hidrolisis terhadap bakteri uji S. aureus
menunjukkan nilai yang sangat kecil, bahkan tidak menunjukkan perbedaan yang signifikan (p>0,05) terhadap kontrol negatif.
Whey dan peptida hasil hidrolisisnya juga menunjukkan adanya zona hambat terhadap bakteri uji E. coli dan S. aureus, namun zona hambat yang dihasilkan lebih kecil jika dibandingkan dengan protein kasein dan peptida hasil hidrolisisnya. Hal tersebut dapat dilihat pada Gambar 15 dan Tabel 8.
Gambar 15. Zona hambat whey dan peptida whey terhadap E. coli. (A) whey utuh, (B-D) whey hidrolisis: 15 menit (B), 30 menit (C), 45 menit (D).
Berdasarkan Gambar 15 dan Tabel 8 dapat dilihat bahwa hambatan terbesar terhadap bakteri uji E. coli dihasilkan oleh whey hidrolisis 15 menit dengan diameter 6,78±0,46, namun nilai ini tidak jauh berbeda dengan whey utuh dan peptida whey lainnya (whey hidrolisis 30 dan 45 menit). Meskipun nilai diameter zona hambat yang lebih kecil dibandingkan dengan protein kasein dan peptida hasil hidrolisisnya, secara statistik protein whey dan peptida hasil hidrolisis memiliki diameter zona hambat yang signifikan (p=0,013) dibandingkan dengan kontrol negatif. Sedangkan pengujian terhadap bakteri uji S. aureus menunjukan protein
whey dan peptidanya memiliki nilai rata-rata diameter zona hambat yang sangat
24
kecil dan secara statistik diameter zona hambat tersebut tidak menunjukkan perbedaan yang signifikan (p>0,05) terhadap kontrol negatif.
Tabel 8. Diameter zona hambat peptida whey
Protein dan peptida whey Diameter zona hambat
E.coli (mm) S.aureus (mm)
whey utuh 6,45 ± 0,29* 6,39 ± 0,37
whey hidrolisis 15 menit 6,78 ± 0,46* 6,41 ± 0,38
whey hidrolisis 30 menit 6,61 ± 0,39* 6,55 ± 0,12
whey hidrolisis 45 menit 6,51 ± 0,37* 6,54 ± 0,32
Kontrol negatif 6,00 ± 0,00 6,00 ± 0,00
p-value 0,013 0,398
*) berbeda nyata terhadap kontrol pada selang kepercayaan 95%
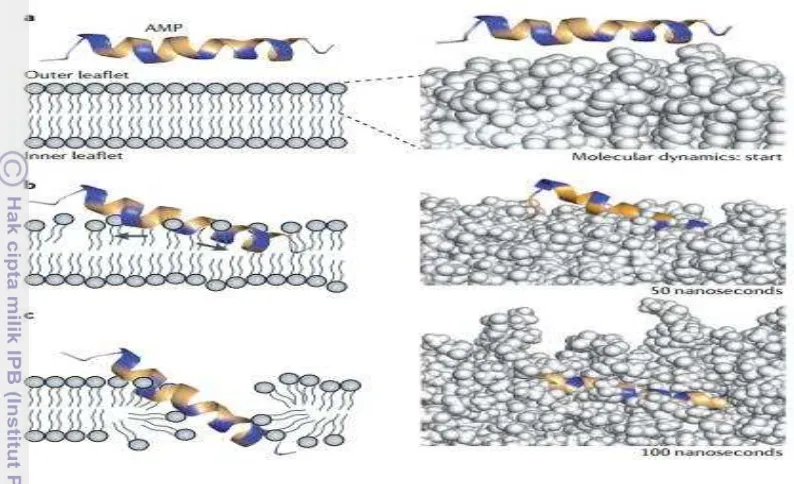
Peptida antibakteri bekerja dengan cara berinteraksi pada membran bakteri yang kemudian diikuti dengan kerusakan membran (Fjell et al. 2012). Perbedaan efek penghambatan yang dihasilkan oleh protein kasein dan whey terhadap bakteri uji E. coli dan S. aureus dapat disebabkan oleh perbedaan struktur dinding sel kedua bakteri tersebut. Dimana E. coli termasuk kedalam kelompok bakteri gram negatif yang memiliki dua lapis membran sel namun memiliki lapisan peptidoglikan yang tipis sedangkan S. aureus merupakan kelompok bakteri gram positif yang hanya memiliki satu lapis membran sel namun memiliki lapisan peptidoglikan yang tebal (Gambar 16). Efek perusakan dinding sel oleh sampel protein yang diujikan dalam penelitian ini kemungkinan besar dapat diredam oleh lapisan peptidoglikan sehingga jenis bakteri gram posititf bersifat lebih tahan dibandingkan bakteri gram negatif.
25
Aktivitas antibakteri dengan metode kontak
Pengujian lebih lanjut terhadap kemampuan antibakteri dilakukan dengan metode kontak. Berdasarkan hasil yang telah diperoleh dari metode cakram, metode kontak hanya dilakukan terhadap bakteri uji E. coli. Prinsip dari metode ini adalah menumbuhkan bakteri uji dalam media pertumbuhan dengan penambahan senyawa antibakteri (kasein dan whey serta peptida hasil hidrolisisnya). Dengan metode ini diharapkan penghambatan senyawa antibakteri terhadap bakteri uji dapat diamati berdasarkan waktu kontak. Berikut ini merupakan data pertumbuhan E. coli dalam media dengan penambahan kasein utuh dan peptida hasil hidrolisisnya.
Tabel 9. Pertumbuhan E. coli dalam media dengan penambahan kasein utuh dan peptida kasein
Jam ke 0
*) berbeda nyata terhadap kontrol pada selang kepercayaan 95%
26
Gambar 17.Penghambatan kasein utuh dan peptida kasein terhadap pertumbuhan E. coli
Meskipun tidak berbeda signifikan secara statistik, namun dapat dilihat pada jam ke-4, peptida kasein 15, 30, dan 45 menit mengalami pertumbuhan yang lebih lambat dibandingkan dengan kontrol dengan nilai 0,5 – 1,3 log cfu/ml lebih rendah dibanding kontrol. Hal ini menunjukkan adanya sifat penghambatan yang dihasilkan oleh peptida-peptida kasein tersebut meskipun dalam batas tertentu. Hal ini mungkin disebabkan enzim papain tidak memotong ikatan peptida pada posisi yang tepat untuk menghasilkan peptida bioaktif sehingga dengan dilakukan hidrolisis menggunakan enzim papain sifat antibakteri dari kasein utuh yang diperoleh dari proses prehidroisis cendurung berkurang.
Hasil hidrolisis kasein susu domba (dengan enzim porcine pepsin A) kemudian dilakukan pemurnian menunjukkan (s2-ovine f(165-181)) memberikan penghambatan terhadap pertumbuhan Escherichia coli, Listeria innocua,
Staphylococcus epidermidis, Enterococcus faecalis, Serratia marcescens, dan St. Carnosus (Lo´pez-Expo´sito et al. 2006).
Tabel 10. Pertumbuhan E. coli dalam media dengan penambahan whey utuh dan peptida whey
*) uji beda Duncan pada selang kepercayaan 95% terhadap kontrol negatif
-2
jam ke-0 jam ke-2 jam ke-4 jam ke-6
log cf
u
/m
l
kontrol hidrolisis 15 menit hidrolisis 30 menit
27
Pertumbuhan E. coli dalam media dengan penambahan Whey ditunjukkan pada Tabel 10 dan Gambar 18. Baik whey utuh maupun whey hasil hidrolisis tidak menunjukkan perbedaan pertumbuhan E. coli yang signifikan dibandingkan dengan kontrol. Meskipun tidak menunjukkan perbedaan yang signifikan secara statistik, namun pada jam ke-2 baik whey utuh maupun yang sudah dihidrolisis menunjukan pertumbuhan yang lebih lambat dibandingkan dengan kontrol dengan nilai 0,4 - 1,4 log cfu/ml. Penghambatan tertinggi ditunjukkan oleh whey hidrolisis 30 dan 45 menit pada jam ke-2 dengan nilai 1,4 log cfu/ml lebih lambat, dan pada jam ke-4 dengan nilai 0,8 - 1 log cfu/ml lebih rendah daripada kontrol. Hal ini mengindikasikan adanya sifat penghambatan yang dihasilkan oleh whey utuh dan peptida whey dalam batas tertentu.
Penghambatan yang tidak signifikan oleh whey utuh dan peptida hasil hidrolisisnya selain karena terhidrolisisnya protein laktoferin oleh enzim papain, faktor lainnya juga dapat dikarenakan oleh belum murninya peptida hasil hidrolisis yang diujikan, sehingga konsentrasi senyawa antibakteri yang terkandung didalamnya masih rendah sehingga tidak cukup untuk menghasilkan penghambatan yang signifikan.
Gambar 18. Penghambatan whey utuh dan peptida whey terhadap pertumbuhan E. coli
Penelitian lain menunjukkan hidrolisis protein whey susu kambing oleh enzim proteolitik manusia (asam lambung dan enzim duodenum) menghasilkan peptida antibakteri yang dapat menghambat pertumbuhan Listeria monocytogenes,
sedangkan hidrolisis menggunakan enzim pencernaan hewan (pepsin dan enzim corolase PP dari porcin pankreas) tidak menunjukkan adanya penghambatan (Almaas et al. 2008). Hal ini menunjukkan terdapat fragmen peptida spesifik dalam susu kambing yang berpotensi sebagai antibakteri.
0
jam ke-0 jam ke-2 jam ke-4 jam ke-6
Lo
g cf
u
/m
l
kontrol hidrolisis 15 menit hidrolisis 30 menit
28
A B
Gambar 19. Perbandingan hasil SDS PAGE hidrolisis whey oleh enzim A. Papain (1-2. whey utuh, 3-5. hidrolisis 15, 30, 45 menit) B. Enzim pencernaan (1. whey utuh, 2. whey+asam lambung, 3. whey+asam lambung+enzim duodenum, 4. Whey+porcin pepsin 5. Whey+porcin pepsin+porcin pankreas)
Baik kasein susu domba maupun whey susu kambing telah dilaporkan sebagai prekursor peptida yang memiliki aktivitas sebagai antibakteri (Lo´pez-Expo’sitoet al. 2006; Almaas et al. 2008), namun pada penelitian ini peptida yang dihasilkan baik dari kasein maupun whey belum menunjukkan adanya aktivitas antibakteri yang signifikan. Hal ini dapat disebabkan oleh perbedaan enzim protease yang digunakan. Walaupun sama-sama memiliki aktivitas proteolitik, enzim protease yang berbeda akan memutus ikatan peptida pada posisis asam amino yang berbeda yang dikenal dengan spesifisitas enzim. Dapat dilihat pada Gambar 12, perbedaan enzim yang digunakan yaitu Papain (Gambar 19A) dan enzim pencernaan (Gambar 19B) menghasilkan pola SDS PAGE yang berbeda sehingga memungkinkan menghasilkan sifat bioaktif yang berbeda.
Tabel 11. Jenis dan spesifisitas enzim
Enzim Jenis Enzim Spesifisitas
Asam Amino Sumber
Pepsin Endoprotease asam alanin, glisin dan valin Adjonu et al. (2013) Tripsin Endoprotease Basa arginin dan lisin Adjonu et al. (2013)
Kimotripsin Endoprotease Basa triptofan, tirosin, dan fenilalanin
Adjonu et al. (2013)
29
dihidrolisis, dimana enzim papain memutuskan ikatan peptida pada asam amino pada spektrum yang cukup luas seperti yang telah disebutkan sebelumya sedangkan enzim pencernaan memotong pada asam amino yang lebih spesifik seperti tripsin memotong pada asam amino arginin dan lisin, serta pepsin pada asam amino alanin, glisin dan valin.
30
5.
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan analisis SDS PAGE, susu kambing memiliki 10 pita protein. Setelah dilakukan pemisahan kasein dan whey terjadi pemisahan protein dimana ke 10 pita protein tersebut muncul pada kasein dengan penambahan satu pita protein dengan BM 12 kDa, sedangkan whey hanya memiliki 6 pita protein.
Hidrolisis kasein susu kambing menggunakan enzim papain (4.000-6.000 unit/g) menyebabkan α-kasein dan β-kasein terhidrolisis dan menyisakan κ-kasein dan satu peptida dengan berat molekul sekitar 10 kDa. Hidrolisis pada whey
menyebabkan protein laktoferin terhidrolisis sehingga dapat menjadi faktor yang menurunkan aktivitas antibakteri pada whey. Baik kasein dan whey utuh maupun yang sudah terhidrolisis sama-sama menghasilkan zona hambat yang signifikan terhadap E. coli, namun tidak menunjukkan penghambatan yang signifikan terhadap S. aureus. Pengujian lanjut dengan metode kontak menunjukkan kasein utuh dapat menghambat pertumbuhan E. coli secara signifikan sejak jam ke 2 bahkan menunjukkan penurunan jumlah bakteri sebanyak 2,8 log dibandingkan dengan kontrol yang mengindikasikan sifat baterisidal kasein susu kambing. Sedangkan peptida hasil hidrolisis baik dari kasein maupun whey memiliki sifat antibakteri yang tidak signifikan.
Saran
Enzim papain cukup kuat dalam menghidrolisis substrat kasein dan whey
31
DAFTAR PUSTAKA
[BAM] Bacterial Analytical Manuals. 2001. Chapter 3 Aerobic plate count. [FDA] Food and Drug Administration. [diunduh 30 Januari 2014]. Tersedia pada www.fda.gov
Adjonu R, Doran G, Torley P, Agboola S. 2013. Screening of whey protein isolate hydrolysates for their dual functionality: Influence of heat pre-treatment and enzyme specificity. Food Chem. 136: 1435–1443. doi:10.1016/j.foodchem.2012.09.053
Almaas H, Berner V, Holm H, Langsrud T, Vegarud GE. 2008. Degradation of whey from caprine milk by human proteolytic enzymes, and the resulting antibacterial effect against Listeria monocytogenes. Small Ruminant Res.
(79):11–15. doi:10.1016/j.smallrumres.2008.07.013.
Atabany A. 2001. Studi kasus produksi kambing Peranakan Etawah dan kambing Saanen pada Peternakan Kambing Perah Barokah dan PT. Taurus Dairy Farm. [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Baehaki A. 2012. Kolagenase Bacillus licheniformis F11 Asal Palembang dan Aplikasinya pada Pembuatan Peptida Kolagen Bioaktif. [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Behera P, Kumar R, Sandeep IVR, Kapila R, Dang AK, Kapila S. 2013. Casein hydrolysates enhance osteoblast proliferation and differentiation in mouse bone marrow culture. Fbio. 2:24 –30.
Blakely J, Bade DH. 1991. Ilmu Peternakan. Terjemahan: B. Srigandono.
Bregmeyer HU, Bergmeyer J, Grassel M. 1983. Methods of enzymatic analysis. Vol 2. Weinheim: Verlag Chemie.
Eriksen EK, Holm H, Jensen E, Aaboe R, Devold TG, Jacobsen M, Vegarud GE. 2010. Different digestion of caprine whey proteins by human and porcine gastrointestinal enzymes. British Journal of Nutrition. (104): 374–381. doi:10.1017/S0007114510000577.
Fjell C, Hiss JA. Hancock REW, Schneider G. 2012. Designing antimicrobial peptides: form follows function. Nat Rev Drug Discov. (11):37-5.
Gobbetti M, Minervini F, Rizzello CG. 2004. Angiotensin I - converting enzyme inhibi-tory and antimicrobial bioactive peptides. Int J Dairy Technol. 57:173–188.
32
Haa M, Bekhit AEDA, Carnea A, Hopkins DL. 2012. Characterisation of commercial papain, bromelain, actinidin and zingibain protease preparations and their activities toward meat proteins. Food Chem. 134: 95– 105. doi:10.1016/j.foodchem.2012.02.071.
Hernández-Ledesma B, García-Nebot MJ, Fernández-Tomé S, Amigo L, Recio I. 2014. Dairy protein hydrolysates: Peptides for health benefits. l Dairy J.
38(2): 82-100.
Jorgensen JH, Ferraro MJ. 2009. Antimicrobial susceptibility Testing: a review of general principle and contemporary practices. CID. (49): 1749-1755. doi:10/1086/647952.
Kim SB, Seo IS, Khan MA, Ki KS, Lee WS, Lee HJ, Shin HS, Kim HS. 2007. Enzymatic Hydrolysis of Heated Whey: Iron-Binding Ability of Peptides and Antigenic Protein Fractions. J. Dairy Sci. (90): 4033–4042. doi:10.3168/jds.2007-0228.
Kitts DD, Weiler K. 2003. Bioactive proteins, and peptides from food source. Applications of bioprocesses used in isolation and recovery. Curr Pharm Des. (9):1309-1323.
Korhonen H, Pihlanto A. 2007. Bioactive peptide from food protein. In: Handbook of Food Product Manufacturing. Y.H. Hui, eds. John Wiley & Sons, Inc., Hoboken, NJ. Pp: 5-37.
Korhonen H, pihlanto-Leppälä A. 2004. Milk-derived bioactive peptides: Formation and pros-pects for health promotion. In: Handbook of Functional Dairy Products. C. Shortt and J. O’ Brien (eds). RC Press, Boca Raton, FL:
109–124.
Kusumadjaja AP, Dewi RP. 2005. Penentuan Kondisi Optimum Enzim Papain Dari Pepaya Burung Varietas Jawa (Carica papaya). Indo. J. Chem. 5(2):147-151.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature. (227):680-685. doi: 10.1038/227680a0
Leung AY. 1996. Encyclopedia of Common Natural Ingridients Used in Food, Drugs, and Cosmetics. Ed 2nd. New York: Interscience.
Lo´pez-Expo´sito I, Go´mez-Ruiz JA, Amigo L, Recio I. 2006. Identification of antibacterial peptides from ovineαs2-casein. I Dairy J (16): 1072–1080.
Lo´pez-Expo´sito I, Quir´os A, Amigo L, Recio I. 2007. Casein hydrolysates as a source of antimicrobial, antioxidant and antihypertensive peptides. Lait. (87): 241–249. doi: 10.1051/lait:2007019.
Luo Y, Pan K, Zhong Q. 2014. Physical, chemical and biochemical properties of casein hydrolyzed by three proteases: partial characterizations. Foodchem.
33
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2012. Brock Biology of Microorganisms, 13th ed. San Francisco: Pearson Education.
Muchtadi D, Palupi NS, Astawan M. 1992. Enzym dalam Industri Pangan. Bogor: PAU-IPB.
Park YW, Ju´arez M, Ramos M, Haenlein GFW. 2007. Physico-chemical characteristics of goat and sheep milk. Small Ruminant Res. (68): 88–113. doi:10.1016/j.smallrumres.2006.09.013
Park YW. 2009. Bioactive component in milk and dairy product. Wiley-Blackwell: USA.
Raynal-Ljutovac K, Lagriffoul G, Paccard P, Guillet I, Chilliard Y. 2008. Composition of goat and sheep milk products: An update. Small Ruminant Res. (79): 57–72. doi:10.1016/j.smallrumres.2008.07.009.
Rusman. 2011. Produksi Susu Kambing Peranakan Etawa (PE) Berdasarkan Ketinggian Tempat Pemeliharaan. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Salleh AB, Rahman RNZRA, Basri M. 2006. New Lipases and Proteases. New York: Nova Science Publishers, Inc.
Schanbacher FL, Talhouk RS, Murray FA, Gherman LI, Willet, L.B. 1998. Milk - born bioactive peptides. Int. Dairy J. (8):393 – 403.
Singh P, Benjakul S, Maqsood S, Kishimura H. 2011. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus). Food Chem. (124): 97–105. doi:10.1016/j.foodchem.2010.05.111.
Sodiq A, Abidin Z. 2008. Meningkatkan Produksi Susu Kambing Peranakan Etawa. Jakarta: Agromedia Pustaka.
34
LAMPIRAN
Lampiran 1. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida kasein terhadap E. coli
Tests of Between-Subjects Effects
Dependent Variable: E.coli
Source
Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 5,143a 5 1,029 5,122 0,010
Intercept 599,405 1 599,405 2,985E3 0,000
kasein 4,850 4 1,213 6,038 0,007
blok 0,015 1 0,015 0,074 0,790
Error 2,410 12 0,201
Total 1021,103 18
Corrected Total 7,553 17
a. R Squared = 0,681 (Adjusted R Squared = 0,548)
Lampiran 2. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida kasein terhadap S. aureus
Tests of Between-Subjects Effects
Dependent Variable: S.aureus
Source
Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 0,720a 5 0,144 2,368 0,103
Intercept 419,458 1 419,458 6,902E3 0,000
Kasim 0,676 4 0,169 2,781 0,076
blok 0,123 1 0,123 2,024 0,180
Error 0,729 12 0,061
Total 698,836 18
Corrected Total 1,449 17
35
Lampiran 3. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida whey terhadap E. coli
Tests of Between-Subjects Effects
Dependent Variable: E.coli_whey
Source
Type III Sum
of Squares Dr Mean Square F Sig.
Corrected Model 1,681a 5 0,336 5,829 0,006
Intercept 439,154 1 439,154 7,613E3 0,000
Way 1,160 4 0,290 5,027 0,013
blok 0,904 1 0,904 15,677 0,002
Error 0,692 12 0,058
Total 762,483 18
Corrected Total 2,373 17
a. R Squared = 0,708 (Adjusted R Squared = 0,587)
Lampiran 4. Hasil uji ANOVA dan Duncan zona hambat protein dan peptida whey terhadap S. aureus
Tests of Between-Subjects Effects
Dependent Variable: S.aureus_whey
Source
Type III Sum
of Squares Dr Mean Square F Sig.
Corrected Model 0,480a 5 0,096 0,900 0,512
Intercept 447,993 1 447,993 4,198E3 0,000
Way 0,472 4 0,118 1,106 0,398
blok 0,001 1 0,001 0,010 0,921
Error 1,281 12 0,107
Total 743,592 18
Corrected Total 1,761 17
36
Lampiran 5. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan peptida kasein pada jam ke-0
Tests of Between-Subjects Effects
Dependent Variable: kasein_jam0
Source
Type III Sum
of Squares Dr Mean Square F Sig.
Corrected Model 0,738a 6 0,123 1,931 0,273
Intercept 69,852 1 69,852 1,096E3 0,000
Perlakuan 0,576 4 0,144 2,258 0,225
blok 0,289 2 0,144 2,266 0,220
Error 0,255 4 0,064
Total 142,768 11
Corrected Total 0,993 10
a. R Squared = 0,743 (Adjusted R Squared = 0,358)
Lampiran 6. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan peptida kasein pada jam ke-2
Tests of Between-Subjects Effects
Dependent Variable: kasein_Jam2
Source
Type III Sum of
Squares Dr Mean Square F Sig.
Corrected Model 35,609a 6 5,935 11,673 0,016
Intercept 72,571 1 72,571 142,734 0,000
Perlakuan 15,350 4 3,838 7,548 0,038
blok 4,830 2 2,415 4,750 0,088
Error 2,034 4 0,508
Total 233,836 11
Corrected Total 37,642 10
37
Lampiran 7. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan peptida kasein pada jam ke-4
Tests of Between-Subjects Effects
Dependent Variable: kasein_jam4
Source
Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 86,947a 6 14,491 8,926 0,026
Intercept 155,434 1 155,434 95,746 0,001
Perlakuan 52,504 4 13,126 8,085 0,034
blok 2,229 2 1,115 0,687 0,554
Error 6,494 4 1,623
Total 432,586 11
Corrected Total 93,441 10
a. R Squared = 0,931 (Adjusted R Squared = 0,826)
Lampiran 8. Hasil uji ANOVA dan Duncan metode kontak terhadap protein dan peptida kasein pada jam ke-6
Tests of Between-Subjects Effects
Dependent Variable: kasein_jam6
Source
Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 129,419a 6 21,570 31,783 0,002
Intercept 221,719 1 221,719 326,701 0,000
Perlakuan 81,644 4 20,411 30,076 0,003
blok 2,866 2 1,433 2,112 0,237
Error 2,715 4 0,679
Total 594,714 11
Corrected Total 132,134 10
38
Lampiran 9. Hasil uji ANOVA dan Duncan metode kontak terhadap whey volume 2ml pada jam ke-0
Tests of Between-Subjects Effects
Dependent Variable: whey2ml_jam0
Source
Type III Sum
of Squares Dr Mean Square F Sig.
Corrected Model 13,405a 5 2,681 31,294 0,003
Intercept 248,203 1 248,203 2,897E3 0,000
Perlakuan 0,180 4 0,045 0,527 0,725
blok 13,225 1 13,225 154,362 0,000
Error 0,343 4 0,086
Total 261,951 10
Corrected Total 13,748 9
a. R Squared = 0,975 (Adjusted R Squared = 0,944)
Lampiran 10. Hasil uji ANOVA dan Duncan metode kontak terhadap whey volume 2ml pada jam ke-2
Tests of Between-Subjects Effects
Dependent Variable:whey2ml_jam2
Source
Type III Sum
of Squares Dr Mean Square F Sig.
Corrected Model 7,592a 5 1,518 1,411 0,380
Intercept 205,390 1 205,390 190,815 0,000
Perlakuan 3,023 4 0,756 0,702 0,630
blok 4,570 1 4,570 4,245 0,108
Error 4,306 4 1,076
Total 217,288 10
Corrected Total 11,898 9