OPTIMASI DETEKSI PENYAKIT HUANGLONGBING
PADA TANAMAN JERUK MENGGUNAKAN TEKNIK
POLYMERASE CHAIN REACTION
NURISNA ULIA ULFAH
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Optimasi Deteksi Penyakit Huanglongbing pada Tanaman Jeruk menggunakan Teknik Polymerase Chain Reaction adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
ABSTRAK
NURISNA ULIA ULFAH. Optimasi Deteksi Penyakit Huanglongbing pada Tanaman Jeruk Menggunakan Teknik Polymerase Chain Reaction. Dibimbing oleh KIKIN HAMZAH MUTAQIN.
Jeruk merupakan salah satu komoditas hortikultura yang memiliki nilai ekonomi tinggi. Penyakit Huanglongbing, atau di Indonesia dikenal sebagai citrus vein phloem degeneration (CVPD), yang disebabkan oleh bakteri Liberobacter asiaticus, menyebabkan kerugian yang besar pada produksi jeruk terutama di beberapa negara Asia. Deteksi dan diagnosis penyakit tersebut berdasarkan gejala seringkali kurang akurat karena memiliki kemiripan dengan gejala kekurangan hara. Deteksi menggunakan teknik polymerase chain reaction (PCR) telah banyak dilaporkan memiliki akurasi dan sensitivitas tinggi untuk menentukan penyebab penyakit. Tujuan penelitian ini adalah untuk mengonfirmasi penyakit huanglongbing berdasarkan gejala eksternal dan internal pada tanaman dan menggunakan teknik PCR. Hasil identifikasi dan deteksi berdasarkan gejala menunjukkan bahwa tanaman dengan daun bergejala klorosis tidak selalu disertai dengan keberadaan patogen huanglongbing. Tanaman bergejala klorosis yang positif terserang huanglongbing mengalami perubahan ukuran dan bentuk daun. Ukuran daun menjadi lebih kecil dan lanset dibandingkan daun yang tidak menunjukkan gejala klorosis. Hasil deteksi berdasarkan gejala internal melalui uji akumulasi pati dalam jaringan floem menunjukkan konsistensi dengan hasil PCR. Hasil optimasi deteksi menunjukkan bahwa metode yang paling efektif dan efisien untuk menyediakan DNA templat PCR adalah modifikasi dari metode Dellaporta et al. (1986) dengan konsentrasi bufer ekstraksi 2 kali. Setelah lama penyimpanan 2 minggu pada suhu 4 oC, daun jeruk yang berpenyakit huanglongbing masih dapat dideteksi menggunakan PCR, walaupun intensitas pita DNA yang diperoleh kurang konsisten pada ketiga ulangan. Cara penyimpanan contoh tanaman jeruk yang paling optimal adalah penyimpanan pada suhu 4 oC, sedangkan penyimpanan dalam bufer CTAB masih cukup memadai dalam mempertahankan kualitas DNA untuk PCR.
ABSTRACT
NURISNA ULIA ULFAH. Optimization of Detection for Huanglongbing Disease on Citrus Using Polymerase Chain Reaction Technique. Supervised by KIKIN HAMZAH MUTAQIN.
Citrus is an important horticultural commodity with high economic value in many countries. Huanglongbing disease, or in Indonesia known as citrus vein phloem degeneration caused by Liberobacter asiaticus bacterium, is a major factor limiting citrus production in many Asian countries. The disease detection and diagnosis solely based on its symptom is sometimes not reliable since it resembles to those caused by nutrient deficiencies. Detection using polymerase chain reaction is an accurate technique for many plant pathogens including the huanglongbing causal agent. The research objectives are to observe huanglongbing disease of citrus, based on external and internal symptoms, in Bogor and to optimize PCR technique for detection of the pathogen. The disease identification and detection based on the external symptom showed that there was less specific character which correlated with pathogen presence in the sample. Symptom of the infected plants is leaf discoloration and deformation. The leaves showing symptoms of chlorosis, are smaller and more lancet than leaves without chlorosis symptoms. The results of detection based on internal symptom showed as starch accumulation in phloem are consistent with that of PCR. The optimization of detection using PCR showed that the most effective and efficient extraction method to obtain DNA template was a modification of Dellaporta et al. (1986) with extraction buffer concentration at 2 times. After 2 weeks period of storage treatment at 4 oC, Huanglongbing disease can still be detected by PCR, but its DNA bands showed inconsistency among three replications. The most optimum two weeks sample preservation is at 4 oC, whereas preservation with CTAB buffer still maintain the sample to yield DNA template adequately for PCR
©Hak Cipta milik IPB, tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
OPTIMASI DETEKSI PENYAKIT HUANGLONGBING
PADA TANAMAN JERUK MENGGUNAKAN TEKNIK
POLYMERASE CHAIN REACTION
NURISNA ULIA ULFAH
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Optimasi Deteksi Penyakit Huanglongbing pada Tanaman Jeruk Menggunakan Teknik Polymerase Chain Reaction
Nama : Nurisna Ulia Ulfah NIM : A34100032
Disetujui oleh
Dr. Ir. Kikin Hamzah Mutaqin, MSi Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini dapat diselesaikan. Penelitian dengan judul Optimasi Deteksi Penyakit Huanglongbing pada Tanaman Jeruk Menggunakan Teknik Polymerase Chain Reaction ini dilaksanakan dari bulan September hingga Desember 2013.
Terima kasih penulis ucapkan kepada Dr. Ir. Kikin Hamzah Mutaqin, MSi selaku dosen pembimbing skripsi yang telah memberikan pengarahan, saran, dan motivasi selama penelitian dan penulisan skripsi. Ucapan terimakasih juga diberikan kepada Dr. Ir. Yayi M. Kusumah, MSi selaku dosen pembimbing akademik yang telah memberikan bimbingan dan saran selama proses penentuan tugas akhir dan kegiatan belajar mengajar di Departemen Proteksi Tanaman. Penulis juga menyampaikan terima kasih kepada Dr. Ir Sugeng Santoso, MAgr selaku dosen penguji tamu yang telah memberikan banyak saran dalam proses penulisan skripsi. Di samping itu, penghargaan penulis sampaikan kepada Bapak Yunus pemilik pertanaman jeruk di Desa Situ Gede tempat penelitian dilaksanakan. Ucapan teruma kasih juga penulis ucapkan kepada teman-teman anggota laboratorium bakteriologi tumbuhan yaitu Kak Tatit S, Kak Mahardika, Kak Nadzir, Ibu Indri, Imam Solikhin, dan Suci AK yang telah memberikan bantuan dan saran selama pelaksanaan penelitian dan penulisan skripsi.Ungkapan terima kasih juga disampaikan kepada teman-teman Departemen Proteksi Tanaman angkatan 47, Almira PS, Esi Adliyah, Egi Puspitasari, Dayang Diani P, Rian Andini, Endah Wahyuni, Bunga Aprillia, Nur Islamiah, dan Eniza Rukisti atas dukungan dan bantuan yang telah diberikan.
Kepada ayah, ibu, serta seluruh keluarga yang telah mencurahkan kasih sayang, doa, dan dukungan tiada henti selama ini, karya ini semoga menjadi persembahan kecil dari ananda.
Semoga penelitian ini bermanfaat.
DAFTAR ISI
Pengamatan gejala eksternal penyakit huanglongbing 4
Pengambilan contoh tanaman 4
Pengamatan gejala internal melalui uji akumulasi pati 5
Perlakuan lama penyimpanan contoh tanaman 5
Perlakuan cara penyimpanan contoh tanaman 5
Ekstraksi DNA total menggunakan kit komersial untuk deteksi
awal dengan PCR 5
Metode ekstraksi untuk optimasi PCR 6
Amplifikasi DNA dengan PCR 7
Elektroforesis gel agarosa 7
HASIL DAN PEMBAHASAN 9
Gejala eksternal penyakit huanglongbing 9
Gejala internal akumulasi pati 12
Deteksi huanglongbing pada jeruk dengan tekhnik PCR melalui ekstraksi
DNA menggunakan kit komersial 13
Metode ekstraksi untuk optimasi PCR 18
DAFTAR GAMBAR
1 Tanaman jeruk bergejala klorosis (SGI-1 sampai 8) dan tanaman yang
tidak bergejala (SGI K) 9
2 Daun jeruk bergejala klorosis dari setiap tanaman contoh di lahan SGI (SGI-1 sampai 8) dan dari tanaman yang tidak bergejala (SGI-K) 10 3 Daun jeruk bergejala dari beberapa lokasi di Indonesia 11 4 Penampang melintang tulang daun bergejala klorosis dari setiap
tanaman contoh di lahan SGI (SGI-1 sampai 8) dan dari tanaman yang
tidak bergejala (SGI-K) 13
5 DNA total hasil ekstraksi menggunakan kit Qiagen DNeasy 14 6 Hasil amplifikasi PCR terhadap DNA contoh daun jeruk sakit
huanglongbing 14
7 Hasil amplifikasi PCR terhadap pengenceran DNA contoh daun jeruk
sakit huanglongbing 15
8 DNA total hasil ekstraksi menggunakan kit Qiagen DNeasy 16 9 Hasil amplifikasi PCR terhadap DNA contoh daun jeruk sakit
huanglongbing 16
10 Hasil amplifikasi PCR terhadap pengenceran DNA contoh daun jeruk
sakit huanglongbing 17
11 DNA total hasil perlakuan optimasi metode ekstraksi 18 12 Hasil amplifikasi PCR terhadap DNA perlakuan optimasi metode
ekstraksi 18
13 Perkembangan daun jeruk yang tidak disimpan selama 2 minggu 20
14 DNA total hasil perlakuan lama penyimpanan 21
15 Hasil amplifikasi PCR terhadap DNA perlakuan lama penyimpanan 21 16 DNA total hasil perlakuan cara penyimpanan contoh tanaman 22 17 Hasil amplifikasi PCR terhadap DNA perlakuan cara penyimpanan
DAFTAR LAMPIRAN
1 Larutan Iodin Kalium Iodida 27
2 Larutan-larutan penyangga 27
3 Rasio panjang dan lebar daun pada tanaman yang menunjukkan gejala
klorosis dan kontrol (tanaman tidak menunjukkan gejala klorosis) 27 4 Analisis ragam rasio daun pada tanaman yang menunjukkan gejala klorosis
dan kontrol (tanaman tidak menunjukkan gejala klorosis) 28 5 Analisis ragam panjang daun pada tanaman yang menunjukkan gejala
klorosis dan kontrol (tanaman tidak menunjukkan gejala klorosis) 28 6 Analisis ragam lebar daun pada tanaman yang menunjukkan gejala klorosis
1
PENDAHULUAN
Latar Belakang
Jeruk merupakan salah satu komoditas hortikultura penting yang dibudidayakan di Indonesia dan memiliki nilai ekonomi yang cukup tinggi. Tahun 1998 sampai 2004 luas panen dan produksi buah jeruk di Indonesia mengalami peningkatan yang cukup pesat yaitu masing-masing 17.9% dan 22.4%. Pada tahun 2004, luas panen jeruk telah mencapai 70 000 ha dengan total produksi sebesar 1.6 juta ton, sekaligus menempatkan posisi Indonesia sebagai negara ke-13 penghasil utama jeruk dunia. Produktivitas usaha tani jeruk cukup tinggi, yaitu berkisar 17 sampai 25 ton/ha dari potensi 25 sampai 40 ton/ha (Balitpang 2007).
Penyakit huanglongbing, atau dikenal sebagai citrus vein phloem degeneration di Indonesia, merupakan faktor utama penyebab menurunnya produksi jeruk di Asia (Bové 2006, Koizumi et al. 1996). Penyakit huanglongbing telah dilaporkan di Cina pada tahun 1894, Afrika Selatan pada tahun 1965, India pada tahun 1967, Filipina pada tahun 1967, dan Perancis pada tahun 1970. Huanglongbing disepakati sebagai nama resmi penyakit tersebut pada tahun 1995 (Bové 2006). Nama lain untuk penyakit ini seperti citrus greening, yellow shoot, leaf motle (Filipina), likubin atau decline (Taiwan), citrus dieback (India), blotchy-mottle atau mottle disease (Afrika) (Bové 2006), dan citrus vein phloem degeneration (CVPD, Indonesia) (Tirtawijaya 1964).
2
tanaman yang pertama kali terinfeksi ke bagian tanaman lainnya (Tatineni et al. 2008).
Gejala penyakit huanglongbing secara umum sangat mirip seperti gejala kekurangan hara (Timmer et al. 2003). Hal ini mengakibatkan sering terjadi kekeliruan diagnosis penyakit, sehingga penanganan gangguan kesehatan tanaman mengalami kesulitan. Penyakit ini sulit untuk didiagnosis secara akurat bila hanya menggunakan cara konvensional. Amplifikasi menggunakan PCR merupakan metode yang akurat dan sensitif untuk mendeteksi penyakit tersebut (Hung et al. 1999). Reaksi berantai polimerase atau Polymerase Chain Reaction (PCR) adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in vitro. Metode ini pertama kali dikembangkan tahun 1985 oleh Kary B. Mullis, seorang peneliti di perusahaan CETUS Corporation. Penelitian ini perlu dilakukan untuk mengonfirmasi penyakit huanglongbing berdasarkan gejala pada daun tanaman jeruk dan deteksi yang efisien menggunakan teknik molekuler.
Berbagai metode untuk mengekstrak DNA dari tanaman dalam upaya deteksi penyakit tanaman menggunakan teknik PCR telah banyak dikembangkan, termasuk untuk penyakit huanglongbing pada jeruk. Metode tersebut cukup beragam dari yang rumit hingga sederhana, dengan penggunaan bahan dari yang sedikit hingga banyak, baik yang konvensional maupun dalam bentuk kit komersial. Kit komersial untuk ekstraksi DNA sangat praktis dan hasilnya memuaskan namun masih terlalu mahal harganya, sehingga metode konvensional masih tetap layak untuk digunakan. Metode ekstraksi konvensional umumnya menggunakan alat, bahan dan tahap yang relatif banyak sehingga seringkali hasilnya kurang konsisten dari kuantitas maupun kualitas. Metode ekstraksi yang lebih praktis namun hasilnya baik sehingga tetap efektif untuk PCR diperlukan untuk deteksi dan diagnosis patogen. Oleh karena itu perlu dilakukan evaluasi dengan membandingkan dan modifikasi beberapa metode ekstraksi DNA tanaman untuk mendapatkan metode yang paling efektif dan efisien dalam deteksi menggunakan teknik PCR, namun tidak mengurangi kualitas DNA.
Contoh tanaman seringkali perlu dibawa atau dikirim ke laboratorium pengujian yang jaraknya jauh atau memakan banyak waktu, padahal deteriorasi jaringan tanaman seringkali terjadi secara cepat (Shivas & Beasley 1968). Penanganan contoh tanaman yang akan diekstraksi DNA-nya untuk deteksi menggunakan teknik PCR sering menghadapi kesulitan. Contoh tanaman dapat busuk maupun rusak karena pengaruh mikroorganisme maupun pengaruh fisik lainnya seperti suhu dan lama penyimpanan. Kerusakan atau deteriorasi contoh tanaman sangat berpengaruh pada kualitas DNA contoh tersebut, sehingga deteksi patogen yang berasosiasi pada jaringan tanaman menjadi sulit. Oleh karena itu diperlukan penelitian untuk menentukan cara penyimpanan dan lama penyimpanan contoh tanaman yang efektif dan efisien yang masih menghasilkan DNA yang layak untuk deteksi menggunakan teknik PCR.
Tujuan Penelitian
3
penyimpanan contoh tanaman yang dapat mempertahankan kualitas DNA yang diekstraksi dari contoh tanaman.
Manfaat Penelitian
4
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman. Fakultas Pertanian, Institut Pertanian Bogor dan lahan jeruk milik petani di Desa Situ Gede, Bogor. Penelitian ini dilaksanakan dari bulan September sampai Desember 2013.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah contoh daun jeruk bergejala klorosis dari pertanaman jeruk milik petani di Desa Situ Gede, Qiagen DNeasy Plant Mini Kit (Qiagen, Hilden), tabung ependorf ukuran 1.5 ml dan 2 ml, nitrogen cair, asam laktat, iodin, kalium iodida, gelas preparat, bufer ekstraksi, bufer CTAB 2%, bufer NaCl 5 M, bufer CTAB 10% dalam 0.7 M NaCl, kloroform/isoamil alkohol (24:1 v/v), isopropanol, alkohol 70%, akuades, puReTaq Ready-To-Go PCR beads (GE Health, Inggris), Primer forward OI, Primer reverse OI2c, ddH2O, gel agarosa, bufer TAE 2X, etidium bromida, bufer TAE 1X, marker 1 kbp, loading dye, dan parafilm.
Pengamatan gejala penyakit huanglongbing dilakukan terhadap tanaman dengan daun yang menunjukkan gejala klorosis di lahan milik petani di Desa Situ Gede. Daun yang bergejala klorosis diukur panjang dan lebarnya untuk mengetahui pengaruh keberadaan patogen terhadap bentuk daun, dan dibandingkan dengan daun yang tidak menunjukkan gejala klorosis (kontrol). Pengukuran dilakukan terhadap lima daun bergejala dari pucuk pada ranting yang sama, dan diulang pada tiga ranting. Dari tanaman tersebut kemudian diambil sejumlah contoh daun untuk diidentifikasi gejalanya dan dipotret dengan kamera digital pada white box lighting system.
Pengambilan Contoh Tanaman
5
Pengamatan Gejala Internal melalui Pengujian Akumulasi Pati
Uji akumulasi pati yang dilakukan sesuai dengan metode Nordam (1973). Daun muda dari tiap tanaman yang bergejala klorosis dan tanaman yang tidak bergejala diambil dan digelapkan selama semalam pada suhu 4 oC. Daun kemudian direbus dalam alkohol 70% pada suhu 80 oC hingga transparan. Daun yang sudah transparan direndam dengan larutan Iodin-Kalium Iodida dalam asam laktat selama 15 menit. Kemudian dibuat sayatan melintang dan diamati di bawah mikroskop.
Perlakuan Lama Penyimpanan Contoh Tanaman
Perlakuan lama penyimpanan dilakukan dengan menyimpan contoh daun jeruk yang terdeteksi positif terserang huanglongbing. Perlakuan lama penyimpanan yang diberikan yaitu lama penyimpanan pada suhu 4 oC selama 1 hari, 1 minggu, dan 2 minggu. Perlakuan penyimpanan bertingkat dilakukan sebagai indikator, misalnya lama pengiriman contoh tanaman dari satu lokasi ke lokasi lain. Selanjutnya contoh diekstraksi menggunakan metode yang paling efektif dan efisien yang diperoleh dari hasil perlakuan metode ekstraksi. Dari ketiga perlakuan lama penyimpan tersebut dapat diperoleh waktu penyimpanan yang masih baik untuk mempertahankan kualitas DNA. Selanjutnya contoh tanaman yang telah melalui lama penyimpanan berbeda ini diekstraksi DNA-nya secara total untuk memperoleh templat DNA untuk PCR.
Perlakuan Cara Penyimpanan Contoh Tanaman
Perlakuan cara penyimpanan dilakukan dengan merendam contoh daun jeruk yang sudah terdeteksi positif terserang huanglongbing. Perlakuan cara penyimpanan yang diberikan yaitu perendaman menggunakan alkohol 70%, perendaman menggunakan bufer CTAB 2%, dan penyimpanan pada suhu 4 oC. Perlakuan cara penyimpanan dilakukan selama 2 minggu sebagai indikator lama penyimpanan atau pengiriman contoh tanaman maksimal dari satu lokasi ke lokasi lain. Selanjutnya contoh diekstraksi menggunakan metode terbaik yang diperoleh dari hasil evaluasi metode ekstraksi. Dari ketiga perlakuan penyimpanan tersebut dapat diperoleh cara penyimpanan contoh yang paling baik untuk mempertahankan kualitas DNA. Alkohol 70% adalah bahan yang umum diperoleh dan digunakan di laboratorium, bufer CTAB 2% sebagai salah satu bufer yang umum digunakan dalam tahap ekstraksi DNA, sedangkan suhu 4 oC adalah suhu refrigerator yang umum digunakan. Selanjutnya contoh tanaman setelah melalui cara penyimpanan berbeda ini diekstraksi DNA-nya secara total untuk memperoleh templat DNA untuk PCR.
Ekstraksi DNA Total menggunakan Kit Komersial untuk Deteksi Awal dengan PCR
Ekstraksi DNA total dilakukan terhadap contoh segar dari lapangan yang sudah dipisah berdasarkan lokasi dan asal tanaman, kemudian dilakukan menggunakan Qiagen DNeasy Plant Mini Kit (Qiagen, Hilden), dengan prosedur yang sudah ditentukan sesuai petunjuk.
6
selama 30 detik dalam mortar. Cairan nitrogen dibiarkan menguap, kemudian ditambahkan 400 µl bufer AP1 dan 4 µl RNase A ke dalam potongan daun yang membeku. Campuran digerus menggunakan pistil sampai berbentuk halus. Hasil gerusan dipindahkan ke dalam tabung ependorf 1.5 ml. Suspensi diinkubasi pada suhu 65 oC selama 10 menit. Selama proses inkubasi tabung dibolak-balik 2-3 disentrifus 8 000 rpm selama 1 menit. Lisat pada colection tube dibuang. Proses tersebut diulangi kembali dengan sisa contoh yang masih tersedia. DNeasy Mini Spin column dipindahkan ke dalam collection tube yang baru, ditambahkan 500 µl bufer AW dan disentrifus 8 000 rpm selama 1 menit. Lisat yang terkumpul di collection tube dibuang. Collection tube digunakan kembali, 500 µl bufer AW ditambahkan ke DNeasy Mini Spin column dan disentrifus 14 000 rpm selama 2 menit. DNeasy Mini Spin column dipindahkan ke tabung ependorf 1.5 ml, dan 100 µl bufer AE ditambahkan ke bagian membran DNeasy dengan pipet secara tegak lurus. Campuran diinkubasi pada suhu ruangan (15 sampai 25 oC) selama 5 menit. Kemudian disentrifus 8.000 rpm selama 1 menit. Isolat DNA dapat langsung digunakan pada proses PCR, atau disimpan dalam freezer.
Metode Ekstraksi untuk Optimasi PCR
Metode yang dilakukan untuk ekstraksi DNA total dalam optimasi PCR terdiri atas empat metode berikut dan modifikasinya. Modifikasi terutama ditujukan agar ekstraksi dapat dilakukan dalam skala kecil, yaitu untuk contoh tanaman sebanyak 250 mg.
(1) Metode Hung et al. (1999): Tulang daun sebanyak 0.25 g dipotong kecil dan digerus dengan ditambahkan 1.5 ml bufer ekstraksi. Suspensi diinkubasi pada suhu 55 oC selama 1 jam, dan disentrifus pada 6 000 rpm selama 5 menit. Supernatan dipindahkan ke tabung baru, kemudian ditambahkan 0.125 volume dari 5 M NaCl dan CTAB 10% dalam 0.7 M NaCl. Campuran diinkubasi pada 65 oC selama 10 menit dan diekstrak dua kali menggunakan kloroform/isoamil alkohol (24:1). Suspensi dicampurkan selama 15 menit. Kemudian disentrifus pada 13 000 rpm selama 5 menit. Suspensi DNA pada lapisan epifase dipindahkan ke tabung baru dan ditambahkan 0.6 volume isopropanol dingin. Suspensi diinkubasi pada suhu 4 oC selama minimal 3 jam, kemudian sentrifus pada 12 000 rpm selama 10 menit. Pelet dicuci mengunakan alkohol 70% sebanyak 200 µl, dikeringkan semalaman, dan diresuspensi menggunakan 25 µl air steril.
7
hati-hati selama 15 menit. Sentrifus pada 12 000 rpm selama 5 menit. Suspensi DNA pada lapisan epifase dipindahkan pada tabung baru, dan diendapkan dengan menambahkan isopropanol dingin sebanyak 0.7 volume. Suspensi diinkubasi pada suhu 4 oC selama minimal 3 jam. Sentrifus pada 12 000 rpm selama 5 menit, pelet dikeringkan semalaman dan diresuspensi dengan 25 µl air steril.
(3) Metode Dellaporta et al. (1983) BE 1X: Tulang daun sebanyak 0.25 g dipotong-potong, kemudian direndam dengan 1.5 ml bufer ekstraksi dingin konsentrasi 1X dalam mortar selama 15 menit agar terjadi plasmolisis. Selanjutnya digerus dengan pistil. Hasil gerusan disentrifus 3 000 rpm selama 5 menit, 4 oC. Supernatan dipindahkan ke tabung baru dan disentrifus 12 000 rpm pada 4 oC selama 25 menit. Supernatan dibuang dan endapan diresuspensi dengan 1 ml bufer CTAB 60 oC. Suspensi dipindahkan ke tabung ependorf dan diinkubasi pada 60 oC selama 30 menit. Selama inkubasi, tabung digoyang hati-hati beberapa kali. Suspensi ditambah 0.8 ml kloroform/isoamil alkohol (24:1 v/v). Suspensi dicampurkan hati-hati dan disentrifus 13 000 rpm selama 5 menit. Suspensi DNA pada lapisan epifase dipindahkan ke tabung ependorf baru dan dipresipitasi dengan isopropanol dingin (-20 oC) dengan volume yang setara dan diinkubasi selama minimum 3 jam. Suspensi disentrifus 13 000 rpm selama 5 menit. Supernatan dibuang dan endapan DNA dicuci dua kali dengan 200 µl alkohol 70% dingin (-20 oC) dan disentrifus 13 000 rpm selama 2 menit. Alkohol dibuang dan endapan DNA dikeringkan selama 24 jam. DNA diresuspensikan dengan akuades steril 50 l. Pemilihan ketiga metode tersebut berdasarkan tiga metode ekstraksi yang paling optimal menurut pengujian yang dilakukan oleh Ruangwong dan Akarampisan (2006).
(4) Dellaporta et al. (1983) BE 2X: Cara ekstraksi yang digunakan sama dengan modifikasi Dellaporta et al. (1983) tersebut di atas (Metode 3), hanya saja menggunakan bufer ekstraksi dengan konsentrasi 2 kali.
Amplifikasi DNA dengan PCR
Untuk melakukan amplifikasi satu contoh menggunakan teknik PCR dibutuhkan PCR beads, primer forward OI 1 µl (5’-GCG CGT ATG CAA TAC GAG CGG CA-3’), primer reverse OI2c 1 µl (5’-GCC TCG CGA CTT CGC AAC CCA T.-3’) (Jagoeuix et al. 1994), ddH2O 9.5 µl, dan template (DNA hasil diekstraksi) 1 µl. Amplifikasi dilakukan dengan menggunakan mesin PCR Gene AMP PCR System 9700. Kondisi PCR yang digunakan adalah: denaturasi awal 92 o
C selama 2 menit, denaturasi pada 94 oC selama 1 menit, annealing pada 55 oC selama 30 detik, ekstensi pada 72 oC selama 1 menit, ekstensi akhir pada 72 oC selama 10 menit, dan diakhiridengan suhu 4 oC. Tahap berurutan denaturasi, annealing dan ekstensi diulang sebanyak 40 kali.
Elektroforesis Gel Agarosa
8
9
HASIL DAN PEMBAHASAN
Gejala Eksternal Penyakit Huanglongbing
Pengamatan tanaman bergejala dilakukan di pertanaman jeruk milik petani di Desa Situ Gede, Bogor. Sebanyak delapan tanaman bergejala klorosis yang diduga terserang huanglongbing diamati daun dan tajuk tanamannya, kemudian dibandingkan dengan tanaman yang tidak menunjukkan gejala klorosis (Gambar 1).
Gambar 1 Tanaman jeruk bergejala klorosis (SGI-1 sampai 8) dan tanaman yang tidak bergejala (SGI K)
SGI K SGI-1 SGI-2
SGI-3 SGI-4 SGI-5
SGI-8 SGI-7
10
Tanaman bergejala dengan dugaan penyakit huanglongbing di lapangan memiliki tajuk yang kurang rimbun dan cenderung menyempit secara vetikal, dengan daun berwarna kekuningan kusam dan berukuran lebih kecil secara nyata dibandingkan dengan tanaman yang tidak bergejala. Gejala tersebut menyerupai gejala kekurangan hara. Gejala kekurangan hara seperti Fe dan Zn akan mempengaruhi tajuk tanaman jeruk. Gejala kekurangan unsur mikro Fe pada tanaman jeruk berupa pengurangan ukuran tajuk, karena daun menjadi kecil dan lebih cepat gugur. Gejala kekurangan Zn dapat juga menyebabkan tajuk tanaman menjadi lebih kecil karena daun yang menjadi menjadi kecil, runcing, dan tegak (Zekri & Obreza 2002).
Gambar 2 Daun jeruk bergejala klorosis dari setiap tanaman contoh di lahan SGI (SGI-1 sampai 8) dan dari tanaman yang tidak bergejala (SGI-K)
SGI K SGI-1
SGI-2 SGI-3
SGI-4 SGI-5
SGI-6 SGI-7
11
Gambar 3 Daun jeruk bergejala dari beberapa lokasi di Indonesia
Keterangan: PPB= Pakpak Bharat, Sumatera Utara; SGA= Situ Gede lokasi 1, Bogor, Jawa Barat; SGI= Situ Gede lokasi 2, Bogor; MLG= Malang, Jawa Timur
Hasil pengamatan pada daun menunjukkan bahwa tanaman yang diduga terserang huanglongbing memiliki daun berwarna kekuningan (klorosis), dengan bagian tulang daun berwarna hijau dan mengalami penebalan. Daun juga mengalami deformasi bila dibandingkan dengan daun dari tanaman yang tidak bergejala (Gambar 2).
Pengamatan gejala pada daun juga dilakukan terhadap beberapa contoh daun bergejala dari beberapa lokasi yang berbeda. Gambar 3 menunjukkan bahwa gejala klorosis dengan penebalan tulang daun juga terdapat pada contoh-contoh daun, kecuali daun dengan kode SGI-b yang tidak mengalami penebalan pada tulang daun, dan MLG-a dengan gejala klorosis dari ujung daun. Gejala klorosis pada daun menyerupai gejala kekurangan hara. Kekurangan unsur Fe, Zn, dan Mn pada tanaman jeruk akan mengakibatkan gejala klorosis. Kekurangan unsur Fe ditandai dengan warna daun kuning keputihan, dengan pertulangan daun yang lebih hijau dari bagian lainnya. Kekurangan unsur Zn ditandai dengan klorosis
PPB-a
SGA-a PPB-c
PPB-b
SGI-b
SGI-a SGA-b
12
diantara pertulangan daun, sedangkan bagian pertulangan daun dan sekitarnya berwarna hijau. Kekurangan unsur Mn juga ditandai dengan klorosis di sekitar pertulangan daun yang hijau tua (Zekri & Obreza 2002). Menurut Smith et al. (1950) tanaman jeruk yang kekurangan hara memiliki gejala klorosis pada daun. Daun jeruk yang mengalami klorosis memiliki kandungan N, P, K, dan Na yang tinggi, sedangkan kandungan Ca, Mg, Fe, Cu, Mn, dan B yang lebih rendah
Huruf berbeda yang mengikuti angka pada lajur yang sama menunjukkan perbedaan nyata dengan Uji Berganda Duncan pada taraf 5%.
Hasil pengukuran daun (Tabel 1) pada tanaman bergejala di lahan petani di Desa Situ Gede menunjukkan bahwa kedelapan contoh tanaman bergejala memiliki ukuran panjang dan lebar daun yang secara nyata lebih kecil daripada tanaman yang tidak bergejala (kontrol). Rasio panjang dan lebar daun menunjukkan tingkat kelansetan daun. Semakin tinggi nilai rasio panjang dan lebar menunjukkan bahwa daun semakin lanset. Hasil pengamatan menunjukkan bahwa rasio ukuran daun pada kedelapan tanaman bergejala lebih besar secara nyata dari tanaman kontrol, meskipun hasil analisis statistik menunjukkan antara kontrol, SGI-1, SGI-3, SGI-4, SGI-5 dan SGI-8 tidak berbeda nyata. Hal ini menunjukkan selain klorosis dan penebalan tulang daun terdapat gejala berupa perubahan bentuk daun menjadi lebih lanset.
Gejala Internal Akumulasi Pati
13
Gambar 4 Penampang melintang tulang daun jeruk bergejala klorosis dari setiap tanaman contoh di lahan SGI (SGI-1 sampai 8) dan dari tanaman yang tidak bergejala (SGI-K)
Contoh daun yang menunjukkan akumulasi pati berupa butiran-butiran berwarna biru gelap pada jaringan floem dari bagian tulang daun yaitu contoh daun dengan kode SGI-1, SGI-2, SGI-4, SGI-5, SGI-6, SGI-7, dan SGI-8. Contoh daun dengan kode SGI-K dan SGI-3 tidak menunjukkan akumulasi pati. Akumulasi pati terutama terjadi pada bagian floem tulang daun, dan menyebar pada bagian lainnya seperti pada jaringan parenkim bunga karang.
Deteksi Huanglongbing pada Jeruk dengan PCR melalui Ekstraksi DNA menggunakan Kit Komersial
Contoh tanaman bergejala klorosis yang diperoleh dari lapang kemudian dilakukan deteksi menggunakan kit komersial. Metode deteksi menggunakan kit komersial dianggap sebagai cara yang praktis dengan hasil yang akurat. Hasil ekstraksi DNA total menggunakan kit komersial selanjutnya digunakan sebagai kontrol positif untuk optimasi. Hasil ekstraksi DNA total kemudian dielektroforesis dan divisualisasi menggunakan transluminator UV.
SGI K SGI-1 SGI-2
SGI-3 SGI-4 SGI-5
14
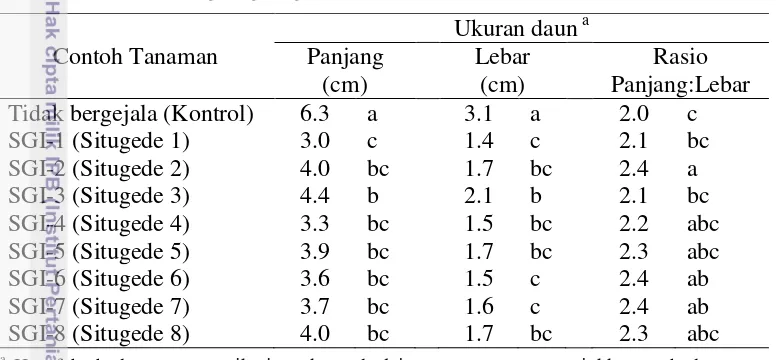
Gambar 5 DNA total hasil ekstraksi menggunakan kit Qiagen DNeasy Keterangan: M = marker 1 kbp, SGI-1 sampai SGI-8 = contoh tanaman dari Situ Gede nomor 1 sampai 8
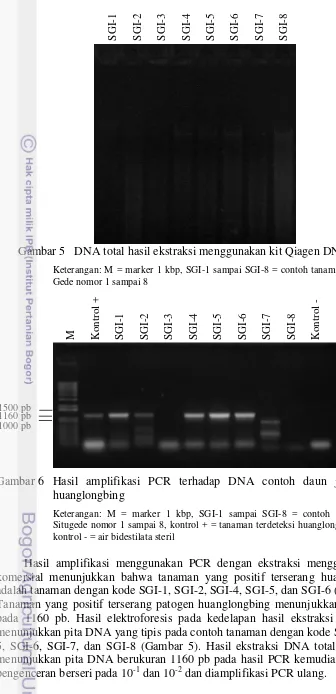
Gambar 6 Hasil amplifikasi PCR terhadap DNA contoh daun jeruk sakit huanglongbing
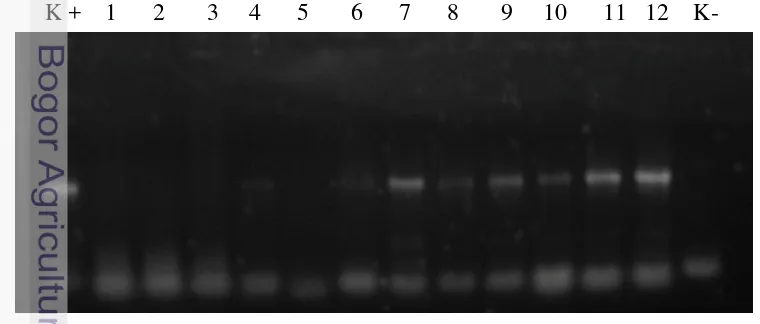
Keterangan: M = marker 1 kbp, SGI-1 sampai SGI-8 = contoh tanaman dari Situgede nomor 1 sampai 8, kontrol + = tanaman terdeteksi huanglongbing (HLB), kontrol - = air bidestilata steril
Hasil amplifikasi menggunakan PCR dengan ekstraksi menggunakan kit komersial menunjukkan bahwa tanaman yang positif terserang huanglongbing adalah tanaman dengan kode SGI-1, SGI-2, SGI-4, SGI-5, dan SGI-6 (Gambar 6). Tanaman yang positif terserang patogen huanglongbing menunjukkan pita DNA pada 1160 pb. Hasil elektroforesis pada kedelapan hasil ekstraksi DNA total menunjukkan pita DNA yang tipis pada contoh tanaman dengan kode 4, SGI-5, SGI-6, SGI-7, dan SGI-8 (Gambar 5). Hasil ekstraksi DNA total yang tidak menunjukkan pita DNA berukuran 1160 pb pada hasil PCR kemudian dilakukan pengenceran berseri pada 10-1 dan 10-2 dan diamplifikasi PCR ulang.
15
Gambar 7 Hasil amplifikasi PCR terhadap pengenceran DNA contoh daun jeruk sakit huanglongbing
Keterangan: M = marker 1 kbp, SGI-3, SGI-7, SGI-8 = contoh tanaman dari Situ Gede yang sebelumnya terdeteksi negatif dengan perlakuan pengenceran 10-1 dan 10-2, kontrol + = tanaman terdeteksi HLB, kontrol - = air bidestilata steril
16 Gede lokasi 2, Bogor kode a dan b; MLG-a= contoh tanaman dari Malang kode a
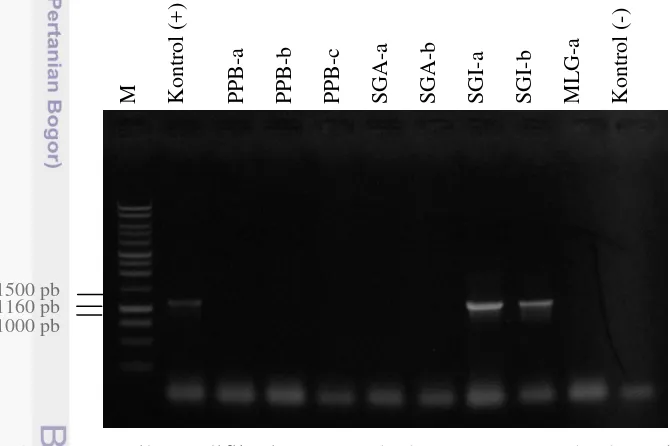
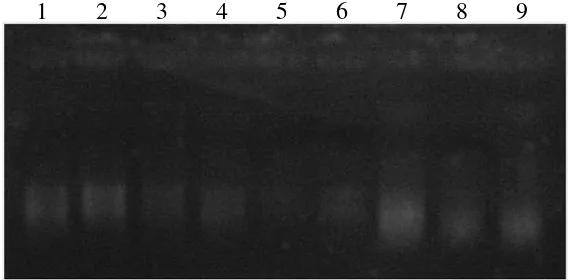
Gambar 9 Hasil amplifikasi PCR terhadap DNA contoh daun jeruk sakit huanglongbing
Keterangan: M = marker 1 kbp;PPB-a, PPB-b, PPb-c= contoh tanaman dari Pakpak Bharat kode a, b, dan c; SGA-a dan SGA-b= contoh tanaman dari Situ Gede lokasi 1, Bogor kode a dan b; SGI-a dan SGI-b=contoh tanaman dari Situ Gede lokasi 2, Bogor kode a dan b; MLG-a= contoh tanaman dari Malang kode a; kontrol + = tanaman terdeteksi HLB; kontrol - = air bidestilata steril
17
DNA. Untuk mengonfirmasi deteksi, dilakukan pengenceran pada hasil ekstraksi DNA total yang menunjukkan hasil negatif.
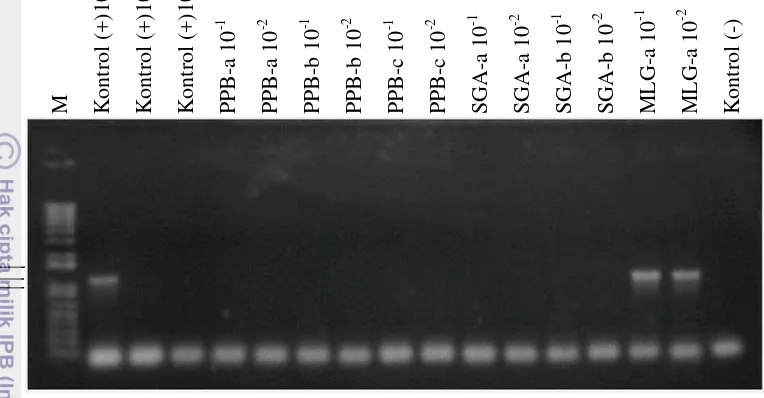
Gambar 10 Hasil amplifikasi PCR terhadap pengenceran DNA contoh daun jeruk sakit huanglongbing
Keterangan: M = marker 1 kbp;PPB-a, PPB-b, PPb-c= contoh tanaman dari Phak-Phak, Medan kode a, b, dan c; SGA-a dan SGA-b= contoh tanaman dari Situ Gede lokasi 1, Bogor kode a dan b; MLG-a= contoh tanaman dari Malang kode a, yang sebelumnya terdeteksi negatif dengan perlakuan pengenceran 10-1 dan 10-2; kontrol + = tanaman terdeteksi HLB; kontrol - = air bidestilata steril
Hasil amplifikasi pengenceran DNA contoh dengan kode MLG-a pada kedua pengenceran menghasilkan pita DNA pada 1160 pb (Gambar 10). Sehingga dari delapan contoh daun yang diperoleh dari beberapa lokasi, tanaman yang terserang huanglongbing adalah tanaman yang diperoleh dari lahan di Desa Situ Gede, Bogor lokasi 2 dan Malang.
Hasil deteksi PCR kemudian dikorelasikan dengan gejala penyakit huanglongbing pada daun maupun keseluruhan tajuk tanaman. Pada deteksi pertama, daun yang mengalami klorosis dengan tulang daun yang menebal dan berwarna hijau pada Gambar 2 hampir seluruhnya positif terserang huanglongbing (Gambar 6 dan Gambar 7). Tajuk tanaman tidak rimbun dengan gejala menyerupai kekurangan hara (Gambar 1). Sedangkan berdasarkan pengamatan ukuran daun pada Tabel 1, semua tanaman yang menunjukkan gejala huanglongbing mengalami perubahan ukuran daun. Hanya tanaman dengan kode SGI-3 yang mengalami deformasi daun, namun terdeteksi negatif.
Hasil deteksi contoh daun dari beberapa lokasi menunjukkan bahwa tidak semua daun dengan gejala klorosis dan penebalan tulang daun terdeteksi positif huanglongbing (Gambar 3, Gambar 9, dan Gambar 10). Contoh daun dengan klorosis merata hingga ke tulang daun (SGI-b) dan klorosis yang dimulai dari ujung daun (MLG-a) terdeteksi positif, sedangkan contoh daun lain tidak. Hal ini membuktikan bahwa bentuk gejala eksternal tidak selalu berkorelasi dengan keberadaan patogen penyebab penyakit huanglongbing di tanaman jeruk.
18
Hasil pengujian gejala internal menunjukkan konsistensi antara keberadaan akumulasi pati di jaringan floem tanaman dengan hasil deteksi menggunakan PCR. Tanaman yang terdeteksi positif terserang huanglongbing dengan deteksi PCR menunjukkan akumulasi pati pada jaringan floem tulang daun (Gambar 4, Gambar 6, dan Gambar 7). Daun dari tanaman yang terserang huanglongbing akan menunjukkan akumulasi pati (Tirtawijaya 1964). Menurut Carmi dan Shomer (1979) akumulasi pati berkaitan dengan kerusakan, perubahan bentuk, dan disorientasi pada grana dan tilakoid di kloroplas. Dari 8 tanaman yang menunjukkan gejala klorosis, 7 tanaman positif terdeteksi huanglongbing sedangkan 1 tanaman negatif. Dengan kata lain 87.5% tanaman bergejala klorosis di lahan Situ Gede, positif terdeteksi huanglongbing menggunakan teknik PCR.
Metode Ekstraksi untuk Optimasi PCR
Perlakuan metode ekstraksi dilakukan terhadap contoh tanaman yang sudah terdeteksi positif huanglongbing. Contoh tanaman yang digunakan yaitu SGI-1.
Gambar 11 DNA total hasil perlakuan optimasi metode ekstraksi
Keterangan: perlakuan metode ekstraksi modifikasi metode Hung et al. (1999) dengan tulang daun (1, 2) dan ranting (3), modifikasi metode Nakashima et al. (1995) dengan tulang daun (4, 5) dan ranting (6), modifikasi metode Dellaporta et al. (1983) bufer ekstraksi 1 X dengan tulang daun (7, 8) dan ranting (9), modifikasi metode Dellaporta et al. (1983) bufer ekstraksi 2 X dengan tulang daun (10, 11) dan ranting (12)
Gambar 12 Hasil amplifikasi PCR terhadap DNA perlakuan optimasi metode ekstraksi
19
Keterangan: hasil ekstraksi menggunakan kit Qiagen DNeasy (K+), modifikasi metode Hung et al. (1999) tulang daun (1,2) dan ranting (3), modifikasi metode Nakashima et al. (1995) tulang daun (4,5) dan ranting (6), modifikasi metode Dellaporta et al. (1983) bufer ekstraksi 1X tulang daun (7,8) dan ranting (9), modifikasi metode Dellaporta et al. (1983) bufer ekstraksi 2X tulang daun (10,11) dan ranting (12), air bidestilata steril (K-)
20
Lama Penyimpanan Contoh Tanaman
Daun jeruk dari lahan yang sama disimpan pada suhu ruang selama 2 minggu untuk melihat perkembangan morfologinya.
Gambar 13 Perkembangan daun jeruk yang disimpan pada suhu ruang selama 2 minggu
Keterangan: Nomor 1 sampai 14= perkembangan dari hari ke-1 sampai ke-14
Daun yang dibiarkan dalam suhu ruang selama 14 hari akan rusak dan kering seperti yang ditunjukkan pada Gambar 13. Daun mulai mengalami layu dan menggulung pada hari pertama, kemudian mengering pada hari kesembilan.
0 1 2
3 4 5
9 10 11
12 13 14
21
Gambar 14 DNA total hasil perlakuan lama penyimpanan
Keterangan: Perlakuan lama simpan 1 hari dengan tulang daun (1, 2) dan ranting (3), 1 minggu dengan tulang daun (4, 5) dan ranting (6), 2 minggu dengan tulang daun (7, 8) dan ranting (9)
Gambar 15 Hasil amplifikasi PCR terhadap contoh tanaman dengan perlakuan berbagai lama penyimpanan pada suhu 4 C
Keterangan: Hasil ekstraksi menggunakan kit Qiagen DNeasy (K+), perlakuan lama simpan 1 hari dengan tulang daun (1, 2) dan ranting (3), 1 minggu dengan tulang daun (4, 5) dan ranting (6), 2 minggu dengan tulang daun (7, 8) dan ranting (9), air bidestilata steril (K-)
Contoh tanaman yang mendapat perlakuan lama penyimpanan pada suhu 4 C selama 1 hari, 1 minggu, dan 2 minggu kemudian diekstraksi menggunakan modifikasi dari metode Dellaporta et al. (1986) dengan konsentrasi bufer ekstraksi 2 kali. Elektroforesis hasil ekstraksi DNA total menunjukkan smear pada ketiga perlakuan, namun tidak terdapat pita DNA (Gambar 14). Hasil amplifikasi perlakuan lama penyimpanan contoh tanaman terdeteksi huanglongbing menunjukkan bahwa pita DNA muncul pada ketiga perlakuan lama penyimpanan (Gambar 15). Meskipun ketiga perlakuan masih menunjukkan hasil positif, pada perlakuan penyimpanan 1 minggu dan 2 minggu pita DNA yang muncul menjadi tidak terlalu konsisten ketebalannya pada ketiga ulangan.
22
Cara Penyimpanan Contoh Tanaman
Daun jeruk dari lahan yang sama disimpan selama 2 minggu dengan perlakuan penyimpanan pada suhu 4 oC, alkohol 70%, dan bufer CTAB.
Gambar 16 DNA total hasil perlakuan cara penyimpanan contoh tanaman
Keterangan: Perlakuan cara penyimpanan pada suhu 4 oC dengan tulang daun (1, 2)
dan ranting (3), alkohol 70% dengan tulang daun (4, 5) dan ranting (6), bufer CTAB dengan tulang daun (7, 8) dan ranting (9)
Gambar 17 Hasil amplifikasi PCR terhadap DNA perlakuan cara penyimpanan contoh tanaman
Keterangan: Hasil ekstraksi menggunakan kit Qiagen DNeasy (K+), perlakuan cara penyimpanan suhu 4 oC dengan tulang daun (1, 2) dan ranting (3), alkohol 70% dengan tulang daun (4, 5) dan ranting (6), bufer CTAB dengan tulang daun (7, 8) dan ranting (9), air bidestilata steril (K-)
Contoh tanaman yang mendapat perlakuan cara penyimpanan selama 2 minggu menggunakan suhu 4 oC, alkohol 70%, dan bufer CTAB 2% kemudian diekstraksi menggunakan modifikasi dari metode Dellaporta et al. (1986) dengan konsentrasi bufer ekstraksi 2 kali. Elektroforesis hasil ekstraksi DNA total pada perlakuan cara penyimpanan menunjukkan bahwa smear hanya terdapat pada ketiga ulangan perlakuan cara penyimpanan suhu 4 oC, dan perlakuan penyimpanan menggunakan bufer CTAB 2% dengan contoh bahan ekstraksi ranting tanaman jeruk (Gambar 16). Hasil amplifikasi perlakuan cara penyimpanan juga menunjukkan pita DNA pada ketiga ulangan perlakuan penyimpanan suhu 4 oC, dan perlakuan penyimpanan menggunakan bufer CTAB 2%. Pada perlakuan penyimpanan menggunakan bufer CTAB 2% pita DNA terlihat jelas pada ulangan dengan contoh bahan ekstraksi ranting tanaman jeruk, namun terlihat tipis untuk ulangan mengunakan bahan tanaman daun jeruk (Gambar 17).
1 2 3 4 5 6 7 8 9
23
SIMPULAN DAN SARAN
Simpulan
Deteksi penyakit huanglongbing berdasarkan gejala eksternal pada tanaman jeruk kip (Citrus nobilis) dan daun dapat tertukar dengan gejala akibat kekurangan hara, seperti Zn dan Mn. Daun yang berasal dari tanaman sakit huanglongbing memiliki ukuran lebih kecil dan lanset dibandingkan daun yang tidak bergejala. Metode ekstraksi yang menghasilkan kualitas DNA terbaik untuk amplifikasi dengan PCR adalah modifikasi metode Dellaporta et al. (1986) dengan konsentrasi bufer ekstraksi 2 kali. DNA hasil ekstraksi perlu diencerkan terlebih dahulu sebagai templat DNA pada PCR untuk menghindari hasil deteksi negatif palsu akibat konsentrasi inhibitor bawaan. Hasil pengamatan gejala internal melalui uji akumulasi pati dalam floem menunjukkan konsistensi dengan hasil PCR, sehingga dapat digunakan sebagai cara deteksi yang lebih sederhana daripada deteksi dengan PCR. Penyimpanan contoh tanaman jeruk selama 2 minggu pada suhu 4 oC lebih baik daripada peyimpanan dalam bufer CTAB atau dalam alkohol 70%, karena masih menunjukkan hasil positif yang nyata. Penyimpanan contoh tanaman dalam bufer CTAB 2% masih cukup baik untuk menjaga kualitas DNA yang diekstraksi.
Saran
24
DAFTAR PUSTAKA
[Balitbangtan] Badan Penelitian dan Pengembangan Pertanian. 2007. Prospek dan Arah Pengembangan Agribisnis Jeruk. Ed ke-2. Jakarta (ID): Badan Penelitian dan Pengembangan Pertanian, Dinas Pertanian.
Bessetti J. 2007. An introduction to PCR inhibitors [internet]. [diunduh pada 2014 Februari 12]. Tersedia pada: http://www.promega.com.
Bové JM. 2006. Huanglongbing: a destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology.88 (1): 7-37
Carmi A dan Shomer I. 1979. Starch accumulation & photosynthetic activity in primary leaves of bean [abstrak]. Tersedia pada: aob.oxfordjournal.org. Dellaporta SL, Wood J, Hicks JB. 1983. A Plant DNA minipreparation : version
II. Plant Molecular Reporter.4(1): 19-20.
Dube S. 2014. Troubleshooting DNA agarose gel electrophoresis [internet]. [diunduh pada 2014 Februari 1]. Tersedia pada: http://www.bio.davidson.edu/molecular/tips/trblDNAgel.html.
Graca JV. 2005. Huanglongbing: biology and overview. Di dalam: Tim R, Wayne N, James H, Philip B, editor. Proceedings of the Second International Citrus Cancer and Huanglongbing Research Workshop; 2005 November 7-11; Orlando. Orlando (US): United States Department of Agriculture, Agricultural Research Service.hlm: 49.
Hung TH, Wu ML, Hong JS. 1999. Development of a rapid method for the diagnosis of Citrus greening disease using the polymerase chain reaction. J Phytopathology. 147(10): 599-604.
Jagoueix S, Bove JM, Garnier M. 1994. The phloem-limited bacterium of greening disease ofcitrus is a member of the a subdivision of the Proteobacteria.Int J of Systematic Bacteriology. 44(3):379-386.
Koizumi M, Prommintara M, Ohtsu Y. 1996. Wood Apple, Limonia acidissima: a new host for huanglongbing (greening) vector, Diaphorina citri. Prokaryotes and blight. Thirteen IOCV conference;1995 November 16-23;Cina. Cina: Painter Printing Company. hlm: 271-275
Kreader CA. 1995. Relief of amplification inhibition in PCR with bovine serum albumin or T4 gene 32 protein. Applied and Environmental Microbiology. 62(3): 1102–1106.
Li W, Teixeira DC, Hartung JS, Levy L. 2005. Development of multiplex real-time PCR for detection and identificati Candidatus Liberibacter species associated with citrus huanglongbing. Di dalam: Tim R, Wayne N, James H, Philip B, editor. Proceedings of the Second International Citrus Cancer and Huanglongbing Research Workshop; 2005 November 7-11; Orlando. Orlando (US): United States Department of Agriculture, Agricultural Research Service.hlm: 59.
Nakashima K, Promintara M, Ohtsu Y, Kano T. 1996. Detection of 16S rDNA of Thai isolates of bacterium-like organisms associated with greening disease of citrus. JIRCAS Journal. 3: 1-8.
25
Ruangwong O, Akarapisan A. 2006. Detection of Candidatus Liberibacter asiaticus causing Citrus Huanglongbing disease. Journal of Agricultural Technology. 2(1): 111-120.
Shivas R, Beasley D. 1968. Pengelolaan Koleksi Patogen Tanaman. Kramadibrata K, Soetjipto NW, Machmud M, penerjemah. Australia (AUS): Queensland Department of Primary Industries and Fisheries. Terjemahan dari: Plant Pathology Herbarium.
Smith PF, Reuthee W, Specht AW. 1950. Mineral composition of chlorotic orange leaves and some observation on the relation of sample preparation technique to the interpretation of result. Plant Physiology. 25(3): 496-506. Tatineni S, Sagaram US, Gowda S, Robertson CJ, Dawson WO, Iwanami T,
Wang N. 2008. In planta distribution of Candidatus Liberibacter asiaticus as revealed by Polymerase Chain Reaction (PCR) and Real-Time PCR. Phytopathology. 98(5): 592-599.
Timmer LW, Garnsey SM. Broadbent P. 2003. Diseases of Citrus. Di dalam: Ploetz RC, editor. Disease of Tropical Fruit Crops. St. Paul (US) : APS Press. Hlm: 163-195.
Tirtawijaya S. 1964. Citrus Vein-Phloem Degeneration virus penyebab dari citrus chlorosis di Jawa [disertasi]. Bogor (ID): Institut Pertanian Bogor.
26
27
Lampiran 1 Larutan Iodin Kalium Iodida
Nama bahan Jumlah untuk 10 ml
Iodin 0.2 g
Kalium Iodida 0.6 g
Larutan I-KI kemudian diencerkan dengan asam laktat dengan perbandingan 1:20. Lampiran 2 Larutan-larutan penyangga
A. Bufer Penyangga Ekstraksi
Nama bahan Jumlah untuk 1 liter
K2HPO4-3H2O 21.7 g
KH2PO4 4.1 g
Sukrosa 100 g
Polyvinylpyrrolidone (PVP-10) 20 g
Akuades steril Ditambahkan sampai 1 l
Menjelang digunakan, ke dalam bufer ekstraksi ditambahkan larutan asam askorbat (0.0176g/ml) sebanyak 500 l/50 ml bufer dan bovin serum albumin (BSA) fraksi V sebanyak 0.075 g/50 ml buffer, dan pH bufer diatur menjadi 7.6 dengan NaOH 5 M.
B. Larutan Penyangga CTAB (CTAB buffer)
Nama bahan Konsentrasi Jumlah untuk 100 ml
CTAB 2% 2 g
NaCl 1.4 M 8.1816 g
Tris 100 mM 1.211 g
EDTA 20 mM 0.7444 g
Polyvinylpyrrolidone (PVP-40) 1 % 1.0 g
Akuades steril - Ditambahkan sampai 100 ml
Menjelang digunakan, Mercaptoethanol ditambahkan ke dalam bufer CTAB sebanyak 2 l/ml larutan (0.2%). Selanjutnya pH larutan diatur menjadi 8.0.
Lampiran 3 Rasio panjang dan lebar daun pada tanaman yang menunjukkan gejala klorosis dan kontrol (tanaman tidak menunjukkan gejala klorosis)
28
Lampiran 4 Analisis ragam rasio daun pada tanaman yang menunjukkan gejala klorosis dan kontrol (tanaman tidak menunjukkan gejala klorosis)
Sumber db JK KT F Pr > F
Model 8 0.49851852 0.06231481 2.21 0.0770
Galat 18 0.50666667 0.02814815
Total 0.495947 7.487439 0.167774 2.240741
Lampiran 5 Analisis ragam panjang daun pada tanaman yang menunjukkan gejala klorosis dan kontrol (tanaman tidak menunjukkan gejala klorosis)
Sumber db JK KT F Pr > F
Model 8 21.96000000 2.74500000 7.56 0.0002
Galat 18 6.54000000 0.36333333
Total 0.770526 14.94474 0.602771 4.033333
Lampiran 6 Analisis ragam lebar daun pada tanaman yang menunjukkan gejala klorosis dan kontrol (tanaman tidak menunjukkan gejala klorosis)
Sumber db JK KT F Pr > F
Model 8 6.49185185 0.81148148 7.69 0.0002
Galat 18 1.90000000 0.10555556
29
RIWAYAT HIDUP
Penulis dilahirkan di Kendal pada tanggal 8 Juni 1992, sebagai anak kedua dari empat bersaudara keluarga Sinwan dan Pasrah Sri Lestari, S.Pd.
Penulis menyelesaikan pendidikan Sekolah Menengah Atas Negeri 1 Kendal, Jawa Tengah pada tahun 2010, dan pada tahun yang sama diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB. Pendidikan mayor penulis adalah Proteksi Tanaman, sedangkan minor yang dipilih yaitu Ekonomi Pertanian.