PEMBUATAN PEPTON DARI BUNGKU, KEDELAI DAN
LIMBAH BIR DENGAN ENZIM PAPAIN
UNTUK
MEDIA PERTUMBUHAN BAKTERI
OLEH
:FACHRANIAH
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
FACHRANIAH. Pembuatan Pepton dari Bungkil Kedelai dan Limbah bir dengan Enzim Papain Untuk Media Pertumbuhan Bakteri.. Di bawah bimbingan DEDI FARDIAZ dan TAM1 IDIYANTI.
Penelitian ini dilakukan dalam rangka memanfaatkan bungkil kedelai dan limbah pengolahan bir menjadi produk pepton untuk media pertumbuhan bakteri. Proses pembuatan pepton dilakukan dengan reaksi hidrolisis menggunakan papain kasar hasil produksi lokal.
Kondisi proses hidrolisis untuk masing-masing bahan
baku
ditenhlkanseana
bertahap at& h t a n , dimulai dengan konsentiasi substrat, konsentrasi enzim, suhu, pH awal, dan waktu reaksi. Parameter penentu kondisi proses adalah jumlah kenaikan protein terlmt optimum yang ditentukan dengan metode spektrofotometri. Aktivitas enzim papain kasar yang digunakan sebesar 1164 unit. Unit didefinisikan sebagai jumlah pg tirosin yang tdentuk dari substrat kasein 1% pada suhu 40 OC, pH6.5, dan inkubasi selama 5 menit. Karakteristik enzim memiliki nilai Vrn sebesar
2000unit dan nilai
Km
sebesar 0.8%. Kondisi proses hidrolisis untuk bungkil kedelai adalah : [S] = 3.7-[El
= 0.4% suhu 60 OC, pH 6.2-6.3, dan waktu 5 jam. Kondisiproses untuk limbah
bi
adalah: [S] = 4.76%, [El = 0.2%, suhu 60 OC, pH 5.8-5.9, danwaktu 5 jam.
Rendemen hasil pepton bungkil kedelai didapatkan sebanyak 12.1% sedangkan pepton limbah bir sebesar 18.9%. Karakteristik pepton bungkil kedelai memiliki kelarutan 97.6%, N total 7.33, N amino 1.94, dan rasio ANlTN sebesar 26.47%,
sedangkan pepton limbah bir memiliki kelarutan 98.5%,
N
total 10.21, N amino 2.82dan rasio A N m sebesar 27.62%. Pola kromatografi pada kolom kromatograti filtrasi gel
dari
kedua pepton yang dihasilkan, menunjukkan dalam waktu 5 jam sudah dihasilkan campuran peptida dengan berat molekul kecil lebih banyak sehingga dapat dimanfmtkan sebagai campuran media perhmbuhan bakteri. Karakteristik pepton yang dihasilkan dibandingkan dengan pepton standar yaitu Bacto peptone Difco dan Soy peptone Scharlau.Efektivitas pepton terhadap pertumbuhan bakteri Escherichia coli, Streptococcus aureus, dan Bacillus subtilis diamati melalui kurva pertumbuhan bakteri selama 24
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
PEMBUATAN PEPTON DARI BUNGKIL KEDELAI DAN
LIMBAH BIR DENGAN ENZIM PAPAIN UNTUK MEDIA
PERTUMBUHAN BAKTERI
Adalah benar hasil karya saya sendiri dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Mei 2002
FACHRANIAH
PEMBUATAN PEPTON DARI BUNGKIL KEDELAI DAN
LIMBAH BIR DENGAN ENZIM PAPAIN UNTUK
MEDIA PERTUMBUHAN BAKTERI
FACHRANIAH
Tesis
sebagai salah satu syarat untuk memperoleb gelar Magister Sains pada
Program Studi Ilmu Pangan
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pembuatan pepton dari bungkil kedelai dan limbah bir
dengan enzim papain untuk media pertumbuhan bakteri
Nama : Fachraniah
NBP
: 99211Program Studi : Ilmu pangan
Menyetujui,
- - 1. Komisi Pembimbing
Ketua
Meneetahui. "
2. Ketua Program Studi Ilmu Pangan
Prof. Dr. Ir. B. ri Laksmi Jenie. MS.
RIWAYAT HIDUP
Penulis dilahirkan di Banda Aceh pada tanggal 26 Juli 1961 sebagai putri ke tujuh
dari bapak Tgk. H. Ahmad Abdullah (alm) dan ibu Hj. Hamdiah. Pendidiian sajana
ditempuh di j w s a n Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Teknologi Bandung, lulus pada tahun 1987. Kesempatan untuk melanjutkan
ke Program Magister Sains pada program studi Ilmu Pangan Institut Pertanian Bogor
diperoleh dengan beaskwa dari BPPS pada tahun 1999.
Penulis bekexja sebagai staf pengajar pada jurusan Teknik Kimia, Politeknik
Negeri Lhokseumawe, Aceh Utara sejak tahun 1987 sampai sekarang.
Penulis menikah dengan Ariefin pada tahun 1988 dan saat ini sudah memiliki dua
orang putra (Arifan Adha, 13 tahun dan Anizal Fachri, 10 tahun) dan seorang putri
PRAKATA
Puji dan syukur dipersembahkan kepada Allah SWT atas segala kekuatan dan
kemampuan yang diberikan kepada penulis sehingga tesis ini dapat diselesaikan.
Penelitian dilaksanakan sejak bulan Mei 2001 sampai Februari 2002 dengan biaya dari DIP P2K, LIPI- PUSPIPTEK- SERPONG, berjudul Pembuatan Pepton dari
Bungkil kedelai dan Limbah bir dengan Enzim Papain Untuk Media Pertumbuhan
Bakteri.
Untuk hasil karya ini penulis ingin mengucapkan terima kasih kepada
Prof
Dr. Ir.Dedi Fardiaz, MSc. dan Dra. Tami Idiyanti, MSc. yang telah memberikan bimbingan,
dorongan semangat, arahan, dan saran yang bermanfaat sejak awal penelitian sampai
pada tahap penyempurnaan tesis ini. Demikian juga kepada lembaga yang
memberikan beasiswa selama studi di S2 (BPPS), P2K LIPI atas semua bahan Eimia
dan fasilitas penelitian, serta Pemda NAD dan Yayasan Supersemar yang telah
membantu menambah dana penelitian. Terima kasih disampaikan juga kepada suami
tercinta, Ariefin dan anak-anakku tersayang Ifan, Aris, dan Rifa, atas ketulusan hati,
kesabaran dan pengorbanan waktu untuk tidak bersama dengan penulis, serta kasih
sayangnya yang menjadikan semangat bagi penulis dalam menyelesaikan studi di S2
IPB. Untuk ayabanda dan bunda serta kakak-kakak tercinta, atas doa dan
perhatiannya yang menyadarkan penulis untuk selalu menjadi orang yang berguna
dan berhdsil karya. Teman-teman di IPN angkatan '99 dan '00 khususnya Farid dan
Mira serta Siti dan Dedin yang dapat menjadi teman dalam segala kondisi. Yuyus,
selama penelitian berlangsung. Tidak lupa, terima kasih disampaikan kepada pihak
lainnya yang telah membantu penulis dalam menyelesaikan tugas akhir.
Penulis menyadari masih banyak kekurangan dalam penulisan karya ilmiah ini sehingga kritik dan saran akan diterima dengan tangan terbuka, akhir kata penulis
berharap tesis ini dapat bermanfaat dalam mengembangkan alternatif produk pangan.
Bogor, Mei 2002
DAFTAR IS1
Halaman
DAFTAR TABEL ... vii
...
DAFI'AR GAMBAR ... Vlll DAFTAR LAMPIRAN ... XTINJAUAN PUSTAKA
.
A Hidrolisis Protein ... 3 B
.
Protein Kedelai ... 8.
C Pepton ... 12
.
D Protease Papain ... 13
.
E Khamir ... 17
METODOLOGI ... 21
HASIL DAN PEMBAHASAN
A . Aktivitas Enzim Papain
...
31 B.
Komposisi Bahan Baku...
32C
.
Pemilihan Kondisi Hidrolisis...
33 D . Produksi Pepton...
42E . Karakterisasi Produk
...
44...
F . Pola Kromatografi Pepton Pada Kolom Filtrasi Gel 47
...
G
.
Efektivitas Pepton Terhadap Pertumbuhan Bakteri 49KESIMPULAN DAN SARAN
...
52DAFTAR TABEL
Halaman
1 Profil berat molekul hidrolisat protein pada penggolongan yang
berbeda ... 6
2 Komponen protein globulin kedelai ... 9
3 Komposisi rata-rata ekstrak khamir bir ... 18
...
4 Analisis proksimat beberapa autolisat khamir komersial 20
5 Komposisi kimia bungkil kedelai ... 32
6 Komposisi kimia limbah bir ... 32
DAFTAR GAMBAR
Skema hidrolisis enzimatis protein terdenaturasi ... Mekanisme reaksi hidrolisis yang dikatalisis oleh enzim papain
.
Diagram tahapan penelitian
...
Diagram pembuatan pepton
...
Aktivitas enzim papain pada substrat kasein
...
Hubungan laju reaksi enzim terhadap substrat kasein ...
Kenaikan protein terlarut pada substrat bungkil kedelai ...
... Kenaikan protein terlarut pada substrat limbah bir
Hubungan laju reaksi enzim papain dan substrat bungkil kedelai
..
Hubungan laju reaksi enzim papain dan substrat limbah biu ... Kenaikan protein terlarut terhadap konsentrui enzim untuk
...
substrat bungkil kedelaiKenaikan protein terlarut terhadap konsentrasi enzim untuk ... substrat limbah bir
Rasio substrat dan enzim untuk bungkil kedelai ... Rasio substrat dan enzim untuk limbah bir ...
Kenaikan protein terlarut terhadap suhu hidrolisis bungkil ... kedelai
Kenaikan protein terlarut terhadap suhu hidrolisis limbah bir
...
Kenaikan protein terlarut terhadap pH bungkil kedelai
...
Kenaikan protein terlarut terhadap pH limbah bii
...
Kenaikan protein terlarut terhadap waktu hidrolisis bungkil kedelai ...
20 Kenaikan protein terlarut terhadap waktu hidrolisis limbah bir
....
21 Pola kromatografi filtrasi gel pepton bungkil kedelai dan limbah bir
...
...
22 Pertumbuhan E
.
coli pada beberapa media pepton23 Pertumbuhan S
.
aureus pada beberapa media pepton ...24 Pertumbuhan B
.
subtilis pa& beberapa media pepton...
...
DAFTAR LAMPIRAN
... 1 Spesifikasi papain kasar produk lokal
2 Penentuan aktivitas papain dengan metode Bergmeyer (1983) ...
3 Kuwa smdar protein ...
4 Hasil uji kenaikan protein terlarut pada
. .
penentuan kondisi proses hidrol~s~s ...5 Data perturnbuhan bakteri pada beberapa media pepton ...
PENDAHULUAN
Latar belakang
Nitrogen adalah salah satu unsur utarna yang diperlukan untuk pertumbuhan
mikroorganisme. Sumber nitrogen tersebut dapat diperoleh dari senyawa organik dan
anorganik. Protein, pepton, dan asam amino seringkali digunakan dalam media
mikrobiologi. Banyak media kompleks yaitu media yang komposisi kimianya tidak
semua diketahui
serarn
spesifik mengandung pepton sebagai s " m k nitrogen. Peptonadalah hidrdisat protein yang dibentuk dengan penghancuran enzimatis atau asam.
Kasein sangat sering digunakan sebagai substrat protein membentuk pepton, namun
substansi lainnya sejmti tepung kedelai juga seringkali digunakan.
Di Indonesia saat ini pepton masih diimpor dengan harga
ti&.
Laporan Biro Pusat Statist* (1998) menunjukkan bahwa impor pepton dan tunmamya untuk tahun1997 mencapai 1.602.415 kg dengan nilai $ 3.362.761 US. Dilaporkan pula impor pepton dari bulan Juni hingga Agustus 1998 mencapai 862.123 kg dengan nilai $
3.759.272 US, dengan demikian dirasa periu untuk mengembangkan kemampuan
penelitian pembuatan pepton dengan memanfaatkan bahan, terutama limbah
berprotein tinggi.
Bungkil kedelai dan limbah pengolahan bir yang sebagian besctr adalah khamir
mengandung protein tinggi. Bungkil kedelai adalah sisa dari proses ekstraksi minyak
kedelai, kadar proteinnya sekitar 40% (Fardiaz & Yasni, 1998), sedangkan limbah
bi
dimanfaatkan sebagai sumber bahan baku pembuatan pepton yang nilai ekonominya
jauh lebih tinggi.
Papain adalah enzim kelompok hidrolase yang dapat mengkatalisis reaksi-reaksi
hidrolisis suatu substrat protein. Enzim protease ini pemakaiannya semakin luas
mulai dari industri makanan, kulit, deterjen, kosmetik, sampai farmasi. Papain dapat
diperoleh dari getah tanaman pepaya (Carica papaya LINN). Di Indonesia pepaya
tumbuh subur di seluruh wilayah nusantara.
Getah
dari buah pepaya sangat potensial sebagai penghasil enzim papain karena daya proteolitiknya yang tinggi dibandingkandari getah batang dan daunnya (Muhidin, 2000). Pusat Penelitian Kimia PUSPIPTEK
Serpong saat ini sudah dapat mengisolasi enzim papain kasar dengan aktivitas
proteolitik lebih tinggi dari standar produk Sigma. Atas dasar pemanfaatan limbah
dan enzim yang tnrsedia maka penelitian ini dilaksanakan.
Tujuan penelitian
Tujuan penelitian ini adalah :
1. Mendapatkan teknologi proses pembuatan pepton dari bungkil kedelai dan limbah
bir oleh enzim papain,
2. Mempelajari pengaruh konsentrasi substrat, konsentrasi enzim, suhu, pH, dan
waktu terhadap proses hidrolisis protein bungkil kedelai dan limbah bir dengan
papain,
3. Membandingkan kualitas pepton yang dihasilkan terhadap pepton standar atau
TINJAUAN PUSTAKA
A. Hidroliiis proteinHidrolisis protein pangan dilakukan untuk berbagai tujuan, yaitu memperbaiki
karakteristik nutrisi, menghambat kerusakan, memberi tekstur, meningkatkan atau
menurunkan kelmtan, menambah sifat pembusaan dan koagulasi, menambah
kapasitas emulsi, mencegah interaksi yang tidak diinginkan, menghilangkan of-
flavor d m bau, dan menghilangkan r a m atau bahan-bahan penghambat (Lahl &
Brauq 1994). Menurutnya hidrolisat prdein sebagai bahan pangan dibagi ke dalam
tiga generasi. Generasi pertama, hidrolisat kasein formula hipoalergenik yang sudah
dipasarkan selama lebih dari 40 tahun, dengan karakteristik 70% mol komposisi asam
amino bebas dan peptidanya tersusun oleh lebih dari 8 asam amino. Generasi kedua,
hidrolisat protein whey dengan 4040% mol asam amino dan peptidanya tersusun
-
oleh lebih dari '12 asarn amino, sudah dipasarkan lebih dari 10 tahun. Generasi ketiga,
hidrolisat protein whey yang didapat beberapa tahun yang laly dengan karakteristik
kurang dari 20% asam amino bebas dan peptidanya tersusun lebih dari IS asam
amino
Menurut Fennema (1996), hidrolisis protein pangan menggunakan protease dapat
mengubah sifat-sifat fbngsional protein asalnya. Sifat fungsional protein didefinisikan
sebagai sifat fisik dan kimia yang mempengmhi perilah protein dalam sistem
pangaxi selama proses pengolahan, penyimpanan, persiapan, dan pemakaian.
Hidrolisis secara luas oleh protease non spesifik seperti papain menyebabkan
mengandung peptida dengan berat molekul rendah, terdiri dari lebih h a n g 2 atau 4
sekuen asam amino. Giese (1994) menyebutkan protease mengkatalisis pemutusan
ikatan peptida dan menghasilkan unit molekul lebih kecil atau peptida-peptida, dan
unit-unit yang lebih kecil akan lebih mudah larut. Kelarutan suatu peptida dianggap
sebagai proporsi nitrogen yang terkandung dalam produk protein yang terlarut dalam
kondisi spesifik. Kelaiutan protein adalah sifat fingsional pertama yang biasanya
ditentukan selama pengembangan dan uji bahan pangan protein baru (Zayas, 1997).
Kilara et al. (1996) menyatakan, kelarutan merupakan indikasi perubahan struktur
protein dan penggunaan istilah "kelarutan" digunakan dalam literatur protein pangan
sebagai kriteria untuk menentukan perubahan konformasi protein. Secara umum
diakui bahwa protein dengan nilai kelarutan tinggi mengindikasikan protein yang
serbaguna dan potensial dalam sistem pangan.
Ada 3 perubahan yang terjadi pada hidrolisis ikatan peptida yaitu kenaikan jumlah
gugus terionisasi COO-) sehingga produk lebih bersifat hidrofilik, penurunan
ukuran molekul rantai polipeptida sehingga sifat antigenisitas menurun tajam, dan
perubahan struktur molekul membentuk stmktur hidrofobik yang terbuka terhadap
lingkurlgan berair (Mahmoud, 1994). Zayas (1 997) menyatakan ha1 yang sarna yaitu,
hidrolisis ikatan peptida dalam protein dapat meningkatkan jumlah gugus bermuatan
dan sisi hidrofilik karena membukanya molekul protein, umumnya meningkatkan
kelarutan dan menurunkan viskositas dan diamati dengan meningkatnya derajat
hidrolisis. Dasar proses hidrolisis enzimatis adalah pemutusan ikatan peptida oleh
enzim dengan bantuan air, secara kimiawi digambarkan sebagai berikut (Peterson,
Konsep modifikasi protein secara enzimat is bukanlah ha1 yang baru, perolehan
kembali (recovery) protein dari bahan sisa atau limbah protein hewan sudah
mengalami perkembangan yang tinggi (Cowan, 1983).
Berlangsungnya proses hidrolisis diukur dengan rasio ANITN, jumlah amino
nitrogen yang ada dalam hidrolisat relatif terhadap jumlah nitrogen total dalam
substrat (Lahl & Braun, 1994). AN ditentukan dengan titrasi formaldehid dan
TN
ditentukan dengan kjeldahl. Pernyataan yang sama dinyatakan oleh Mahmoud (1994)
bahwa derajat hidrolisis atau pemutusan ikatan peptida yang terjadi pada protein
dapat digambarkan oleh rasio amino nitrogen dan total nitrogen atau persen ikatan
peptida yang terputus. Derajat hidrolisis digunakan dalam mengontrol proses
sehingga dapat menentukan dengan jelas sifat-sifat hidrolisat seperti kelmtan, sifat
kngsional dan rasa (j'hvor). Sifat fbngsional intrinsik seperti viskositas, pembusaan
dan emulsifikasi protein dapat dioptimasi dengan mengontrol proses (Peterson,
1981). Ukuran rantai polipeptida yang dihasilkan dapat divariasikan dengan mengatur
rasio enzim terhadap substrat dan mengubah-ubah waktu hidrolisis.
Mahmoud (1994) melaporkan sifat-sifat fisikokimia dan sifat fbngsional hidrolisat
protein pada produk-produk nutrisi. Hidrolisat protein yang digunakan dalam
formulasi nutrisi umumnya dibagi atas dua kategori, yaitu hidrolisis sebagian
dpartiaZ) dan hidrolisis secara keseluruhan (extensive). Masing-masing produk
memiliki sifat-sifat yang berbeda, yang mempengaruhi penggunaannya pada produk
akhir. Penggolongan hidrolisat protein berdasarkan berat molekul fraksi yang
Tabel 1. Profil berat molekul hidrolisat protein pada penggolongan yang berbeda*
Seleksi enzim atau campuran enzim seringkali menjadi dasar kemampuan
hidrolisis substrat menjadi produk yang diinginkan &ah1 & Braun, 1994). Untuk
formula terhidrolisis tinggi, rasio ANtTN umumnya 50 atau lebih besar, bahkan
untuk formula tertentu membutuhkan nilai AN/TN lebih besar dari 60. Larutan enzim
murni terbatas kapasitas hidrolisisnya, contohnya larutan enzim tanaman memiliki
batasan derajat hidrolisis dengan nilai rasio AN/TN maksimum sekitar 35. Daerah
yang lebar dari hidrolisat terhidrolisis sebagian didefinisikan dengan rasio ANITN yang bervariasi antara 2-67%.
Sifat fbngsional hidrolisat protein dipengaruhi oleh spesifisitas enzim proteolitik
yang digunakan, sifat fisik dan kimia protein bahan baku, dan kondisi hidrolisis.
Protease digolongkan menurut spesifisitas ikatan peptida yang diserangnya dan
mekanisme aksinya. Protease adalah enzim yang memiliki aktivitas endo-peptidolitik
yaitu memutuskan ikatan peptida di dalam rantai polipeptida protein. Stauffer (1989)
menyebutkan bahwa protease tidak akan menghidrolisis ikatan peptida jika gugus R
memiliki gugus amino bebas (gugus N terminal) atau jika R memiliki gugus karboksil (dalton)
< 500
>5000
bebas (gugus C terminal). Papain adalah protease sistein yang memiliki range pH dan
spesifisitas yang lebar.
Pada protein yang terdiri atas 20 asam amino yang berbeda, ada 380 ikatan peptida
yang berbeda yang dapat dibuat oleh protein dan dapat menjadi sasaran aksi enzim.
Enzim tertentu hanya memutuskan ikatan tertentu yang secara fisik cocok dengan
enzim. Pada protein alami (native), ikatan seringkali dilindungi dalam struktur tiga
dimensi dan hal ini dapat menghambat proses hidrolisis (Peterson 1981). Interaksi
kompleks antara sifat substrat dan sifat enzim dalarn hubungannya dengan pH,
temperatur, dan tujuan produk akhir menunjukkan bahwa kondisi proses hidrolisis
adalah spesifik untuk substrat dan enzim tertentu (Peppler, 1982).
Proses hidrolisis protein secara enzimatis dilakukan dengan melarutkan sejurnlah
tertentu bahan berprotein ke dalarn air dan selanjutnya ditambahkan sejumlah tertentu
enzim protease. Kondisi lingkungan hidrolisis seperti pH clan suhu diatur sekai
dengan lingkungan yang cocok bagi aktivitas enzim tersebut agar aktivitas enzim
optimum. Hidrolisis dilakukan dalam waktu tertentu untuk mendapatkan produk
sesuai dengan karakteristik yang diinginkan. Untuk menghentikan proses dapat
dilakukan dengan mengatur pH dan secara bersamaan mengatur temperatur karena
sebagian enzim sensitif atau rusak terhadap panas (Cowan, 1983). Cara lain untuk
menghentikan proses hidrolisis adalah memisahkan enzim dengan membran
ultrafiltrasi. Pembuatan hidrolisat protein dengan bantuan membran ultrafiltrasi tidak
hanya untuk menghentikan proses atau memisahkan enzim, tetapi juga memberikan
distribusi normal asam amino dan peptida pendek tanpa memerlukan derajat
produk komersial adalah temperatur, waktu, pH, dan rasio ANITN. Kondisi hidrolisis
dikontrol untuk mendapatkan karakteristik produk yang spesifik seperti distribusi
asam amino, distribusi berat molekul, dan jurnlah protein residu utuh. Waktu
hidrolisis berhubungan langsung dengan rasio AN/TN, sernakin panjang waktu
hidrolisis semakin tinggi nilai AN/TN. Penentuan berat molekul menggunakan
kromatografi dengan kolom filtrasi gel memberikan korelasi positif antara ukuran
molekul dan berat molekul.
B. Protein kedelai
Protein adalah komponen yang membentuk
+
40% total padatan kedelai. Sekitar90% protein tersebut dapat diekstraksi dengan air dan mengendap pada pH 4.5
-
4.8,disebut: globulin kedelai (Fukushima, '1991). Berdasarkan laju sedimentasi
ultrasentrifhgasi, -globulin kedelai disusun oleh 4 komponen yaitu 2S, 7S, 1 1 S, dan
15s dan yang paling utarna adalah 7 s dan 1 1 S. Kadar nitrogen, karbohidrat, dan
komposisi asam amino globulin 7 s dan 1 1 s berbeda, hal ini mempengaruhi struktur
dan sifat fbngsionalnya, terutama karena pengaruh radikal -SH dan ikatan S-S.
Globulin 7 s tidak memiliki radikal -SH dan memiliki 2 ikatan S-S, sebaliknya
globulin 11s memiliki 2 radikal -SH dan 20 ikatan S-S. Tabel 2 menunjukkan
komponen protein globulin kedelai.
Kilara et al. (1996) menyatakan kira-kira 80% protein kedelai memiliki bobot
molekul lebih besar dari 10.000, menunjukkan struktur berorde tinggi, atau ada
interaksi antar protein. Protein 7 s dan 11s dapat membentuk ikatan disulfida
viskositas meningkat. Kedua fraksi 7 s dan 1 1 S memiliki struktur kompleks kuartener
dan kecendenlngan yang tinggi ke arah reaksi asosiasi-disosiasi. Fraksi-fraksi
tersebut memiliki kandungan a-helik rendah dan struktur utarna adalah f! antiparalel
[image:110.579.75.505.240.433.2]dan daerah tidak teratur.
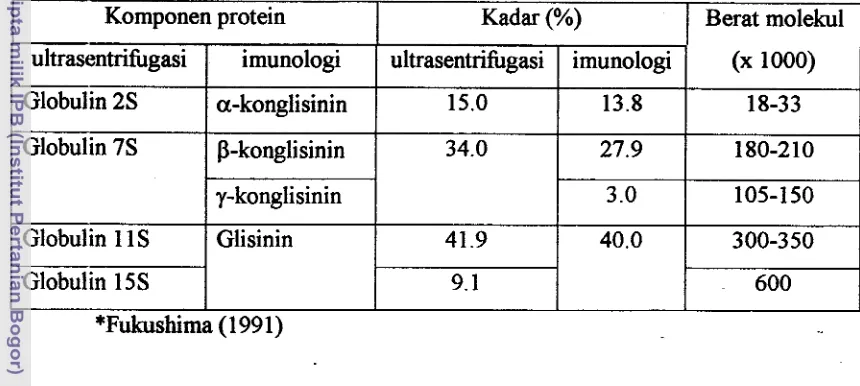
Tabel 2. Komponen protein globulin kedelai
*
1 I I
ultrasentrifbgasi
I
imunologiI
ultrasentrifbgasiI
imunologiI
(x 1000)1
Komponen protein Kadar (%)
1
Berat molekulI
I I I I
Globulin 2s
I I I I
Faktor-faktor yang mempengaruhi laju dan terjadinya hidrolisis protein secara Globulin 7s
Globulin 1 1 S
enzimatis adalah spesifisitas substrat terhadap enzim, modifikasi rantai samping asam a-konglisinin
amino substrat protein, dan struktur tiga dimensi substrat protein (Fukushima, 1991). P-konglisinin
Glisinin
Produk. yang mengandung protein kedelai umumnya diberi perlakuan panas untuk 15.0
menginaktifkan berbagai faktor antinutrisi (Kilara et al., 1996). Daya cerna protein 34.0
41.9
kedelai oleh enzim dipengaruhi oleh kondisi selarna perlakuan panas kedelai. Protein 13.8
asalnya lebih tahan terhadap proteolisis tergantung pada derajat pembukaan struktur 18-33
27.9
40.0
(unfolding) molekul substrat protein. Gambar l a dan 1 b masing-masing menu~jukkan 180-210
300-350
a. hidrolisis enzimatis protein terikat (protein native)
Catalytic s i t e
'
a Active
a
6.'Bindinc rite
center -.
b. hidrolisis enzimatis pada molekul protein terbuka (protein terdenaturasi)
Gdmbar 1. Skema hidrolisis enzimatis protein terdenaturasi (Fukushima, 1991)
Romagnolo et al. (1990) melaporkan analisis dengan SDS-PAGE, ada dua
komponen besar dalarn protein kedelai yaitu P-konglisinin dan konglisinin.
P-
konglisinin terpisah dalam 3 spot yang diperkirakm memiliki berat molekul masing-
masing 83.2, 72.4, dm 48.4 kDa. Glisinin memiliki 2 pita polipeptida yang
diidentifikasi sebagai sub unit asarn dan basa dengan perkiraan berat molekul 38.9
dan 20.7 m a . Dilaporkan pula bahwa P-konglisinin lebih mudah terdegradasi pada
rumen sapi dari glisinin. Resistensi glisinin terhadap degradasi ruminal diduga ada
dihubungkan dengan ikatan disulfida intermolekuler dan sebagian besar bagian dalam
molekul glisinin dilindungi oleh ikatan S-S. Dijelaskan pula gabungan gaya
elektrcrstatik dan hidrofobik terlibat dalam mempertahankan struktur tersier glisinin.
De
Rm
et al. (1995) menyatakan ha1 yang sama bahwa P-konglisinin dihidrolisislebih cepat dari glisinin pada fermentasi Tempe dengan Rhizopus oligo~porus. Lei et
al. (1983) melaporkan hasil analisis dengan elektroforetik dua dimensi, didapatkan
protein kedelai terdiri dari glisinin (13 komponen asam, 11 komponen basa), j3-
konglisinin (6 komponen), lektin (4 komponen), clan inhibitor tripsin Kunitz.
Muchtadi (1986) menyatakan bahwa perlakuan panas pada kedelai seperti
perebusan, dapat meningkatkan daya cerna protein kedelai disebabkan oleh hilangnya
antitripsin dalarn protein kedelai. Dengan kata lain inhibitor tripsin yang terdapat
pada protein kedelai labil terhadap panas. Bungkil kedelai adalah sisa dari proses
ekstraksi minyak kedelai. Proses ekstraksi minyak kedelai yang melibatkan panas
memberi nilai positif pada protein bungkil kedelai karena bahan penghambat tripsin
rusak oleh pemanasan sehingga protein bungkil kedelai diperkirakan akan lebih
mudah terhidrolisis dibandingkan protein kedelai utuh. Santosa et al. (1998)
melaporkan komposisi kimiawi bungkil kedelai yaitu kadar air, kadar abu, kadar
lemak, kadar protein, karbohidrat, asam fitat, antitripsin masing-masing sebesar (9.3;
4.0; 1.2; 45.1; 40.4; 1.8)0/0 dan 17.7unitImg. Dilaporkan pula pH suspensi cairan
C.
PeptonPepton dan proteosa dijelaskan dalam terminologi sebagai bahan antara peptida
dan protein. Proteosa didefinisikan sebagai kelompok turunan protein antara protein
asal dan pepton sedangkan pepton adalah campuran larut air dari proteosa dan asam
amino tuninan albumin, daging atau susu. Sifat-sifatnya antara lain larut dalam air,
tidak terkoagulasi atau tahan terhadap panas, tetapi dapat diendapkan dengan
amonium sulfa. dm seng sulfat Pepton digunakan sebagai nutrisi media dalarn
bakteriologi (Peterson & Johnson, 1978).
Pepton dapat dibuat dari bahan yang mengandung protein melalui hidrolisis asam
atau enzimatis. Pepton memiliki kemampuan yang berbeda dalam menunjang
pertumbuhan bakteri tergantung pada jenis protein yang digunakan dan proses
pembuatannya. Bridson & Brecker (1970) menyebutkan kandungan protein bahan
b a h pembuatan pepton untuk media perhunbuhan bakteri dapat bervariasi, dari
protein hewan dengan kadar 50-90% berat kering sampai pada protein beberapa
seralia yang mengandung protein h a n g dari 1%. Dijelaskan pula pepton adalah
hidrolisat protein yang dapat dibuat dari bahan-bahan berprotein seperti daging, ikan,
kasein, gelatin, keratin, tepung kedelai, khamir, biji kapas, biji bunga matahari, dan
lain-lain. Hidrolisis enzimatis protein tersebut dapat dilakukan dengan berbagai
enzim proteolitik atau protease. Protease mengkatalisis proses hidrolisis protein
kompleks menjadi larutan campuran polipeptida, dipeptida, dan asam amino yang
secara keseluruhan disebut pepton. Komposisi kimia pepton tidak diketahui secara
tepat. Produksi pepton dalam skala besar umumnya menggunakan papain, tripsin,
dengan ketat untuk memperoleh hasil maksimal dan kualitas hidrolisat standar. Ciri
yang paling penting dari pepton bakteri adalah penarnpakannya sebagai sumber
nitrogen untuk mendukung pertumbuhan bakteri. Analisis kimia hanya dapat
digunakan sebagai penunjuk yang tepat dalam mengevaluasi karakteristik pepton.
Analisis tipikal untuk identifikasi pepton adalah total nitrogen, total nitrogen
proteosa, nitrogen proteosa primer, nitrogen asam amino bebas, dan nitrogen amino.
Bailey (1992) menyatakan bahwa protein adalah molekul besar yang biasanya
mengaadung paling sedikit 50 residu asam amino d m kadang-kadang lebih dari 100.
Ciri paling penting dari protein adalah memiliki struktur tiga dimensi yang kompleks.
Dijelaskan bahwa protein memiliki struktur primer yaitu merupakan sekuen residu
asam amino, struktur sekunder yaitu bentuk yang dihubungkan dengan struktur
spesifik dalarn molekul, d m struktur tersier yaitu keseluruhan bentuk molekul tiga
dimensi. Peptida adalah molekul yang lebih kecil, biasanya mengandung h a n g dari
50 asam amino, wnurnnya tidak memiliki
stnrktur
3 dimensi yang kompleks.Perbedaan antara peptida dan protein kadang-kadang tidak jelas khususnya pada
ukuran molekul 15 sampai 50 residu, komponen ini disebut sebagai polipeptida.
D. Pratease Papain
Secara umum protease dapat dibagi ke dalam dua golongan yaitu proteinase dan
peptidase. Proteinase mengkatalisis hidrolisis molekul protein menjadi fiagrnen-
fiagmen besar, sedangkan peptidase mengkatalisis fragmen polipeptida menjadi asam
amino (Suhartono, 1992). Dilihat dari letak pemutusan ikatan peptida, protease
ikatan peptida yang berada di dalam rantai protein sehingga dihasilkan peptida dan
polipeptida, sedangkan eksopeptidase menguraikan protein dari ujung rantai sehingga
dihasilkan satu asam amino dan sisa peptida. Ditinjau dari lingkungan daya kerjanya,
protease dapat digolongkan menjadi protease asam (bekerja pada pH asam), protease
netral (bekerja pada pH netral), dan protease alkalis (bekerja pa& pH basa).
Berdasarkan sifat kimia dan sisi aktifnya diienal empat golongan protease, yaitu
protease serin, protease sulfhidril, protease metal, dan protease asam
(Suhartono, 1992). Protease serin adalah enzim yang mempunyai residu serin pada sisi
aktifnya dan merupakan endopeptidase, protease sulfhidril adalah enzim yang
aktivitasnya bergantung pada adanya satu atau lebih residu sulfhidril pada sisi
aktifhya dan disebut juga sebagai protease ti04 protease metal adalah protease yang
aktivitasnya tergantung pada adanya logam, dan protease asam adalah enzim yang
-
keaktivannya disebabkan oleh adanya dua gugus karboksil pada sisi aktifhya.
Berdasarkan perjanjian internasional, semua protease termasuk ke dalam golongan
enzim yang diberi nomor 3.4.
Berdasarkan sifat-sifat kimianya, papain digolongkan sebagai protease sulfhidril
(Muchtadi et al., 1992). Papain adalah protein sederhana berupa sebuah rantai tunggal
polipeptida yang terdiri dari 212 residu asam amino dengan sistein-25 tempat gugus
aktif ti01 (-SH) esensial. Papain mempunyai titik isoelektrik pada pH 8.75 dan berat
molekul 21.000
-
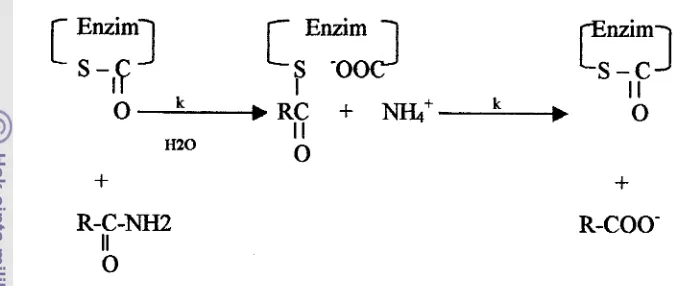
23.700 dalton, mengandung unsur sulfur 1.2% (Leung, 1996).Aktivitas papain dipengaruhi banyak faktor seperti suhy pH, kelcuatan ion, dan
tekanan, juga dipengaruhi oleh sisi aktifnya yang mengandung gugus sulfhidril.
tioester terbentuk sebagai produk intermediet. Mekanisme pembentukan tioester
antara gugus karboksil d m sulfhidril protein papain ditunjukkan pada Gambar 2,
[image:116.579.84.425.137.280.2]R-COO-
Gambar 2. Mekanisme reaksi hidrolisis yang dikatalisis oleh enzim papain (Cunningham, 1965 dalam Muchtadi et al., 1992)
Spesifisitas papain diketahui luas, tidak spesifik, dapat menghidrolisis protein,
peptida berukuran kecil, amida pada residu asam amino seperti arginin, lisin,
glutamin, histidin, glisin, dan tirosin. Papain aktif rnenghidrolisis golongan ester dan
amida dan dihambat oleh oligopeptida yang memiliki fenilalanin pada asarn amino
kedua di sisi karboksil. Kemampuan hidrolisis papain pada sebagian besar substrat
protein lebih ektensif dari protease lainnya seperti tripsin dan pepsin (Leung, 1996).
Belitz & Grosch (1999) menyatakan papain tennasuk protease sistein. Aktivitas
enzim ini berada pada daerah pH yang luas dan tergantung pada substrat (4.5-10)
dengan aktivitas maksimum pada pH 6-7.5. Residu sistein berada pada sisi aktif
Enzim papain sangat sensitif terhadap zat pengoksidasi seperti ion logam atau zat
pengemulsi, dapat diaktifkan oleh zat pereduksi seperti sistein dan zat pengkelat
seperti EDTA (etilen diamin tetra asetat). Papain merupakan enzim hidrolase yaitu
3.4.22 2. Analisis difraksi sinar-X menunjukkan bahwa molekul papain berbentuk
seperti telur dengan ukuran 36x36~48 Angstrom (Suhartono, 1992).
Papain kasar dapat diisolasi dari buah pepaya mentah dengan cara mengiris
permukaan buah, mengumpullcan getahnya dan dilanjutkan dengan pengeringan
menggunakan sinar matahari atau alat pengering. Leung (1996) menyebutkan kualitas
dan aktivitas papain kasar sangat bervariasi tergantung pada proses pengeringan.
Pengeringan dalam waktu singkat pada temperatur di bawah 50 OC menghasilkan
produk yang lebih bersih dan lebih aktif Aktivitas proteolitik papain juga
dipengaruhi oleh jenis buah, umur buah, dan penanganan pasca panennya (Muhidin,
2000). Buah pepaya berumur tiga bulan setelah berbunga atau tepat sebelum pektin
hadir akan menghasilkan papain yang paling baik atau disebut super papain kasar.
Teknik pengendapan dengan alkohol dapat menghasilkan perolehan papain dengan
aktivitas lebih tinggi dan menurunkan kadar impuritis logam pada produk akhir.
Suhartono (1989) menyatakan pH optimum papain adalah 4.5-7, suhu optimum
60-75 OC. Winarno (1986) menyatakan kestabilan enzim papain baik sekali pada
larutan yang mempunyai pH 5.0, pH optimal untuk substrat kasein adalah 7.0 dan
substrat gelatin 5.0. Papain mempunyai daya tahan panas lebih tinggi dari enzim lain.
Keaktifan enzim papain hanya menurun 20% pada pemanasan 70 OC selama 30 menit
pada pH 7.0. Papain dalam bentuk bubuk tahan terhadap panas kering 100 OC selama
3 jam (Leung, 1996). Temperatur optimal papain secara normal berada pada 60-70
0
C.
Papain banyak digunakan di bidang obat-obatan, f m a s i , dan kosmetik. Dalam
sebagsi penjernih bii dan hidrolisat protein (Winarno, 1986; Muchtadi et al., 1992;
Suhartono, 1992; Leung, 1996).
E.
KhamirKhiamir termasuk fungi, tetapi dibedakan dari kapang karena bentuknya yang
terutarna uniseluler. Khamir dapat dibedakan atas dua kelompok berdasarkan
metabolismenya, yaitu bersifat fermentatif dan oksidatif Khamir fermentatif dapat
melakukan fermentasi alkohol, yaitu memecah glukosa melahi jalur glikolisis,
namun dapat bersifat oksidatif bila tersedia cukup oksigen (Fardiaz, 1992).
Khamir dari jenis Saccharomyces uvarum atau S. carlsbergensis adalah khamir
fermentatif kuat yang umumnya digunakan pada fermentasi bir. Khamir turnbuh
berlipat ganda lebih dari 10 fold selama fermentasi, dan dipisahkan dari bir.
Walaupun seb.agian diperlukan - untuk penarnbahan pada fermentasi berikutnya,
sekitar
YI
merupakan limbah atau berlebih. Pemanfaatan limbah ini di Inggris antaralain urltuk pakan ternak karena mengandung protein tinggi dan vitamin B, sebagian
dibuat dalam benhrk tablet untuk keperluan farmasi, namun umumnya digunakan
untuk menghasilkan ekstrak khamir, produk yang komersial sejak akhir abad 19
(Kelly, 1983). Ekstrak khamir secara sederhana didefinisikan sebagai konsentrat zat
terlarut yang diperoleh dari suatu perlakuan terhadap protein khamir, rnisalnya
hidrolisis asam atau penghancuran sel secara mekanik. Atmaka (1997) melaporkan
ekstrak khamir yang dihasilkan dari penghancuran sel secara mekanik dapat
memperbaiki sifat-sifat fbngsional proteinnya menjadi lebih baik. Jenis dan
melibatkan hidrolisis enzimatis rnaka tujuannya adalah untuk mendegradasi strulctur
makromolekul dari protein khamir menjadi zat terlarut dalarn jumlah rnaksimum pada
nilai komersial yang dapat diterima (Kelly, 1983). Komposisi ekstrak khamir dari
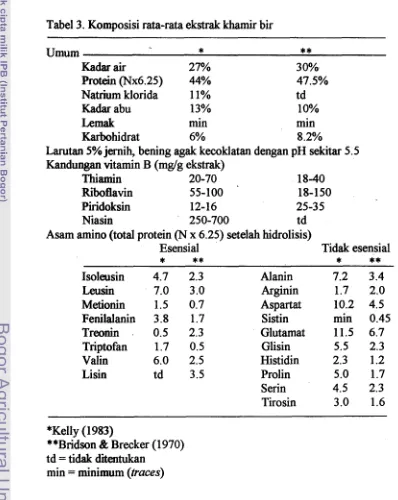
fermentasi bir ditunjukkan pada Tabel 3. Ditinjau dari nilai nutrisinya rnaka ekstrak
khamir cocok digunakan sebagai media pertumbuhan mikroba dan produk flavor.
Tabel 3. Komposisi rata-rata ekstrak khamir bir
Umum -
*
**
Kadar air 27% 30%
Protein (Nx6.25) 44% 47.5%
Natrium klorida 11% td
Kadar abu 13% 10%
Lemak min min
Karbohidrat 6% 8.2%
Larutan 5% jernih, bening agak kecoklatan dengan pH sekitar 5.5
Kandungan vitamin B (mglg ekstrak)
Thiamin 20-70 18-40
Riboflavin 55-100 18-150
Piridoksin 12-16 25-35
Niasin 250-700 td
Asam amino (total protein (N x 6.25) setelah hidrolisis)
Esensial Tidak esensial
*
-**
*
* *
Isoleusin 4.7 2.3
Leusin 7.0 3.0
Metionin 1.5 0.7
Fenilalanin 3.8 1.7
Treonin . 0.5 2.3 Triptofan 1.7 0.5
Valin 6.0 2.5
Lisin td 3.5
- AIanin Arginin Aspartat Sistin Glut amat Glisin Histidin Prolin Serin Tirosin
7.2 3.4 1.7 2.0 10.2 4.5
min 0.45 11.5 6.7 5.5 2.3 2.3 1.2
5.0 1.7 4.5 2.3 3.0 1.6
*Kelly (1 983)
**Bridson & Brecker (1970)
[image:119.584.80.478.227.727.2]Sel khamir limbah industri bir dapat dimanfaatkan sebagai autolisat dan hidrolisat
khamir yang berfbngsi sebagai sumber pepton (Peppler, 1979). Rasa pahit dari
komponen hop dapat dihilangkan dengan mencuci sel dengan larutan sedikit basa satu
atau dua kali selanjutnya disentrifbgasi dan dikeringkan. Ekstrak khamir yang
mengandung resin hop dapat menghambat pertumbuhan mikroorganisme.
Hidrolisis khamir umurnnya dilakukan dengan asam dan panas tinggi (Peppler,
1982), namun ha1 ini mendapat perhatian dewasa ini karena kandungan garam pada
produk akhir menjadi tinggi akibat penetralan
(Reed
& Nagodawithana, 1991).Hidrolisis asam dapat menyebabkan beberapa asam amino membentuk rasemisasi
sehingga menyebabkan daya cerna protein berkwang karena ikatan peptida pada
residu asam amino D kurang efisien terhidrolisis oleh protease dan juga mendukung
kehilangan asam amino esensial. D prolin dilaporkan bersifat neurotoksik (Fennema,
1996). Kandungan lisinoalanin (LAL) pada produk protein pangan yang diperlakukan
dengan panas tinggi dan asarn didapatkan tinggi. LAL selain menurunkan asarn
amino lisin juga merupakan produk yang tidak bernilai gizi. Hidrolisis asam pada
suhu tinggi juga dilaporkan dapat menghasilkan produk samping 3MCPD
(mono~oro propandiol), yang b e h g s i sebagai prekursor 1,3 DCP (dikloro
propandiol) yang bersifat karsinogenik (Anonim, 200 1).
Menurut Peppier (1982), autolisat khamir dapat diperoleh dari proses autolisis
yaitu penghancuran sel oleh enzim yang ada di dalam sel dan merupakan proses
alamiah akibat dari penuaan sel, prosesnya relatif lama sehingga jarang digunakan
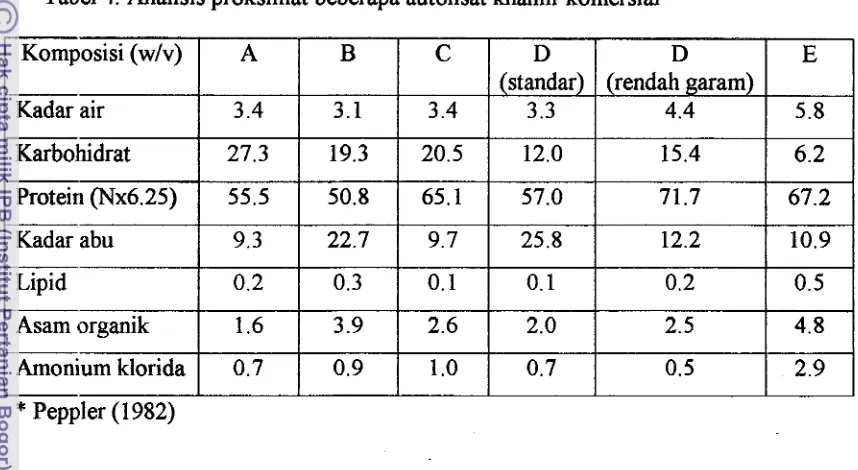
dalam industri. Pemanasan 45-65 OC dan agitasi dapat mempercepat proses autolisis.
ditunjukkan pada Tabel 4. Perbedaan dalam komposisi menunjukkan derajat
keragaman (degree of variability) dari komposisi khamir asalnya dan kondisi proses
[image:121.579.81.510.192.427.2]yang berbeda.
Tabel 4. Analisis proksimat beberapa autolisat kharnir komersial*
Kadar air
1
3.41
3.11
3.4Komposisi (wlv) A B
1 I I
Karbohidrat
1
27.31
19.31
20.5-
C
Kadar abu
1
9.31
22.71
9.7I I I
Lipid
(
0.21
0.31
0.1Protein (Nx6.25)
I I I
Arnonium klorida
1
0.71
0.91
1 .OAsam organik
I I I
*
Peppler (1982)65.1
55.5 50.8
1.6
Ekstrak khamir pada dasarnya adalah campuran asam amino dan peptida, vitamin
larut air, dan karbohidrat. Karbohidrat utarna pada khamir adalah glikogen dan
trehalosa, substansi ini diubah menjadi glukosa oleh hidrolisis enzim pada saat
ekstraksi. Poliheksosa seperti glukan dan manan tetap berada dalam dinding sel dan
dapat tlipisahkan atau terbawa bersama zat tidak terlarut (Peppler, 1982).
Penambahan protease dapat meningkatkan produk akhir, peran protease adalah
untuk meningkatkan laju kelarutan dan produk akhir. Papain mempercepat pemutusan
ikatan lisin, arginin dan fenilalanin pada protein khamir (Kelly, 1983). Papain juga
METODOLOGI
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Mikrobiologi dan Lab. Analisis Pusat
Penelitian Kimia (P2K)
LiPI
PUSPIPTEK Serpong. Penelitian berlangsung selamakurang lebih 10 bulan dimulai dari bulan Mei 2001 sampai Februari 2002.
Bahan dan Alat
Bahan utarna yang digunakan dalam penelitian ini adalah bungkil kedelai yang
diperoleh dari LIP1 Bandung, limbah bir dari pabrik bir PT Multi Bintang Indonesia
di Jakarta, serta enzim papain (Refined Papain) hasil produksi P2K LIP1 Serpong.
Untuk keperluan analisis digunakan beberapa bahan kimia dari Merck yaitu : asam
trikloro asetat (TCA), kalium natrium tartrat, natrium hidroksida, ternbaga suIfat,
peraksi Folin-Ciocalteu, tirosin, Bovin Serum Albumin (BSA), asam sulfat, kalium
sulfat, asam borat, asam klorida, natrium tiosulfat, natrium karbonat. Beberapa
indikator pendukung analisis adalah fenolftalin, larutan amilum, metil merah dan
metilen blue. Bahan untuk campwan media pertumbuhan bakteri adalah agar nutrien
(NA)
dan
beef ekstrak Difco. Sebagai pembanding produk digunakan dua peptonstandar yaitu bacto peptone Difco clan soy peptone Scharlau. Untuk paking kolom
kromatografi digunakan Superdex 75 (Pharmacia bioteh) dan bufer asetat pH 5.6.
Bakten Escherichia coli, Staphylococcus aureus, dan Bacillus subtilis diperoleh dari
Peralatan yang digunakan untuk persiapan produk dan analisis adalah : timbangan
analitik (Scaltec), erlenmeyer sebagai wadah proses hidrolisis, shaker-water incubator
(Certomat
W R
B Braun Int.), sentrihs (Beckman), Spektrofotometer UV/Vis(Hitachi U-2000), pH meter (704 Metrohm), ultrafilter stirred cell (Amicom), Freeze-
dryer (Dura Dry
MP
Pharmacia bioteh), chemistry analyzer (YSI 2700 SELECT),kromatografi Akta explorer (Pharmacia biotech), stop watch, colony counter (Leica
Quebec: Darkfield), seperangkat alat Kjeldahl, autoklaf (SIBATA SI 2301), cawan
petri, laminar air flow 185 1 SIN 19755-93 (Forma scientific), recipro shaker (I3
Braun [nt.), berbagai ukuran pipet Eppendorf dan Finnpipette, mikroburet (Duran)
dan alat-alat gelas lainnya.
Metode Penelitian
~enditian dilakukan dalam beberapa tahapan kerja secara benuutan yaitu:
penentuan aktivitas enzim papain kasar, karakteristik Vm dan Km nya.
analisis proksimat bahan baku (kadar air, kadar abu, protein dan glukosa)
penentuan kondisi optimal proses hidrolisis dengan variabel konsentrasi substrat,
konsentrasi enzim, pH, suhu dan waktu. Parameter yang digunakan adaIah
kenaikan jumlah peptida terlarut optimum.
Karakterisasi produk yaitu kelarutan dalam air, N total, N amino, dan rasio AN/
TN,
serta pola kromatografi pepton pada kolom filtrasi gel.Pengujian efektikitas produk terhadap pertumbuhan bakteri melalui pengamatan
absorbans pada panjang gelombang 660 nm selam 24 jam dan dilanjutkan dengan
Rangkaian kerja secara keseluruhan dapat dilihat pada Gambar 3.
+
*
Optimasi kondisi hidiolisis (jumlah peptida terlarut optimum)
Konsentrasi substrat Konsentrasi enzim Suhu
*
PH Waktu BungIul kedelai(Analisis proksimat)
Produksi pepton pada kondisi optimum
.
*
Karakterisasi produk Kelarutan Rasio ANITN
Pola kromatografi
I
AE Vm KmI
I
I
Papain kasar
4
Efektivitas produk sebagai media pertumbuhan bakteri Kuva pertumbuhan 24 jam
Angka lempeng total
Limbah bir
(Analisis proksimat)
[image:124.579.79.498.129.693.2]Aktivitas enzim papain
Aktivitas enzim papain diukur pada substrat kasein dengan cara membuat larutan
segar papain dan kasein masing-masing 0.1 dan I%, pH substrat diatur sampai 6.5
dengan beberapa tetes HCl 0.lM, selanjutnya 0.6 ml substrat disiapkan ddam 6
tabung reaksi (untuk sampel dan blanko dengan 3 ulangan). Ke dalam blanko
ditambahkan 0.2 rnl bufer fosfat pH 6.5 dan semua substrat diinkubasi pada water
bath suhu 40 OC seima 1 menit, kemudian 0.2 ml enzim ditambahkan pada masing-
masing tabung sampel dengan perbedaan waktu 15 detik (mengguoakan stopwatch).
Reaksi dibiarkan tepat 5 menit untuk masing-masing tabung reaksi clan dihentikan
dengan menambahkan 2 ml TCA 0.1M. Ke dalam tabung sampel ditambahkan 0.2 ml bufer fosfat pH 6.5 dan ke dalam tabung blanko ditambahkan 0.2 ml enzim,
waterbath dimatikan dan campwan diaduk (vorteks), selanjutnya disentrifbs pada
3000 rpm selama 20 menit. Filtrat diambil masing-masing sebanyak 0.6 ml dan
dimasukkan ke dalam 6 tabung reaksi yang berisi 2 ml NaOH 1h4, selanjutnya semua
tabung ditambahkan 0.4 ml larutan folin 1: 2 (pengenceran dengan akuades),
divorteks dan dibiarkan 20 menit untuk menstabilkan warna biru yang terbent.uk.
Larutan diukur absorbansinya pada panjang gelombang (h) 578 nm. Tirosin
digunakan sebagai standar dan kwva standar menghasilkan persaman garis lurus (y =
0.0667~
+ 0.0165) dimana y adalah absorbans dan x adalah konsentrasi. Aktivitas
enzim dihitung sebagai :
Keterangan : AE = aktivitas enzim (unit) Abs = absorbans
Analisis proksimat
Bungkil kedelai dikecilkan ukurannya dengan crusher sehingga 1010s 50 mesh.
Limbah bir dalam bentuk krim disentrifbgasi pada 6000 rpm selama 20 menit dan
dicuci dua kali dengan akuades, endapan dikeringkan dalam oven vakum 55 'C
selama 20 jam dan bubuk kering diseragamkan 1010s 50 mesh. Analisis kadar air
ditentukan dengan metode oven 105 OC selama 20 jam. Analisis kadar abu ditentukan dengan pengabuan (bahan hasil analisis kadar air) pada 600 'C selama 6 jam. Kadar
protein ditentukan dengan metode mikro kejldahl. Kadar glukosa ditentukan secara
langsung dengan alat Biochemistry analyzer.
Penentuan kondisi hidrolisis optimum
Untuk menentukan kondisi hidrolisis dilakukan secara bertahap dimulai dengan
variabel jumlah substrat, jumlah enzim, suhu, pH, d m waktu.
Penentuan konsentrasi substrat optimum
Sejumlah bahan ditimbang duplo (0.5; 1; 1.5; 2; 3; 4; dan 5 gram), dimasukkan ke
dalam 14 erlenrneyer (7 tabung untuk sampel dan 7 tabung untuk blanko). Masing-
masing, ditambahkan akuades sehingga volume menjadi 40 ml. Semua tabung
dimasukkan dalam shaker-waterbath 60 OC selama 5 menit. Larutan stok enzim
papain (20%) dipersiapkan segar. Ke dalam 7 tabung sampel dimasukkan 5 ml larutan
stok enzim dengan selang waktu antar tabung 15 detik, sedangkan ke dalam 7 tabung
blanko dimasukkan 5 ml air. Hidrolisis dilakukan selama 1 jam dan reaksi dihentikan
dengm menambahkan 5 ml TCA 1M ke dalam semua tabung dalam selang waktu
larutan didinginkan dan disentrifbgasi pada 3000 rpm, 4 OC selama 20 menit. Filtrat
ditentukan jumlah protein terlarutnya dengan metode Lowry. Jumlah substrat pada
112 kecepatan maksimum digunakan sebagai dasar penentuan kondisi reaksi optimum
selanjutnya.
Penentuan konsentrasi enzim optimum
Sejumlah substrat optimum yang didapat dari tahap sebelumnya dihidrolisis
dengan beberapa konsentrasi enzim yaitu 0.01, 0.05,O. 1,0.2,0.4,0.6, dan 0.8% pada
suhu 60°C selama 1 jam. Selanjutnya dilakukan sama seperti pada penentuan
konsentrasi substrat optimum.
Penentuan suhu optimum
Sejumlah substrat optimum yang diperoleh sebelumnya- dilakukan hidrolisis
dengan sejumlah enzim optimun pada beberapa suhu yaitu 40, 50,60, 70, dan 80°C.
Hidrolisis dilakukan selarna 1 jam dan perlakuan selanjutnya sama dengan pada
penentuan konsentrasi substrat dan enzim optimum.
Penentuan pH Optimum
Pada substrat, enzim, suhu optimum yang diperoleh sebelumnya dilakukan
hidrolisis selama 1 jam dengan beberapa kondisi pH awal (5; 5,5; 6; 6,5; 7; 75; 8).
Penentuan waktu Optimum
Pada konsentrasi substrat, konsentrasi enzim, suhu, dm pH optimum dilakukan
hidrolisis selama 20 jam dan selanjutnya dilakukan sama seperti diatas.
Produksi Pepton
Diagram pembuatan pepton dapat dilihat pada gambar 4 berikut ini.
Bahan baku
I
*
Disuspensikan dalam akuades
I
*
Hidrolisis pada kondisi tertentu
I
*
Inaktivasi enzim (90 OC, 5 menit)
I
+
Ultrafiltrasi dengan membran 10 kDa MWCO
I
t
Permeat dikenng bekukan
I
+
Pepton bubuk kering
Gambar 4. Diagram pembuatan pepton
Pepton dihasilkan pada kondisi hidrolisis optimum dan untuk menginaktifkan
enzim dilakukan pemanasan pada 90°C selama 5 menit. Filtrat pepton dipisahkan
[image:128.584.73.495.209.770.2]Ultrafiltrasi dilakukan untuk mendapatkan fraksi berberat molekul
<
10 kDa.Ultrafiltrasi dilakukan dengan menggunakan stirred ultraJiltration cell pada suhu 5-
10 "C dengan tekanan 1-2 bar. Tekanan tersebut dicapai dari tekanan gas nitrogen
yang dialirkan dari tabung gas.
Karakterisasi Produk
Total Nitrogen
Analisis total nitrogen dilakukan dengan metode mikro kjeldahl (AOAC, 1984).
Sejumlah contoh (0.2-0.5g) dimasukkan kedalam labu kjeldahl yang berisi beberapa
batu didih, ditambahkan O.15g &SO4 clan 15mg HgO serta 7.5ml HzS04 pekat.
Larutan dididihkan sampai berwarna jemih (f 1 jam). Setelah dingin ditambahkan
50ml akuades dan labu dipindahkan ke alat destilasi. Dalam keadaan tersarnbung, ke
dalam labu segera ditambahkan 35 ml NaOH 40%. Destilat ditampung dalam 15 ml
asam borat 3% yang telah ditetesi indikator (metil merah
+
metilen blue 2:l dalamallcohol). Kelebihan asam borat selanjutnya dititrasi dengan HCl 0.1N yang sudah
distandarisasi dengan Na2C03 (a ml). Blanko dilakukan dengan cara yang sama (b
ml). Total nitrogen dihitung sebagai :
[Total N(% ) = [{(a-b) x N HCl x 0.014)lg contoh] x 100%
1
Amino nitrogen
Analisis amino nitrogen dilakukan dengan metode titrasi Cu (Pope & Stevens,
1939). Sejumlah contoh ( 0. l g dilarutkan dalam lOml akuades kemudian disentrifbs
takar 25m1, ditambahkan 4 tetes timolftalin dan beberapa tetes NaOH 1N sampai
berwarna biru muda, selanjutnya ditambahkan 15ml suspensi Cu-fosfat (larutan
CuClz 4- N a s H n + bufer borat 1: 2: 2), selanjutnya ditambah akuades sampai tanda
batas. Endapan dipisahkan dengan cara sentrifbgasi. Filtrat dipipet sebanyak 5m1,
ditambahkan 0.25ml asam astetat dan 0.5g KI (berwarna kuning muda). Larutan
dititrasi dengan larutan Natrium tiosulfat sampai mendekati titik akhir, lalu
ditambahkan 4 tetes indikator amilum dan titrasi dilanjutkan sampai warna biru tepat
hilang.
ml tiosulfat x (N tiosulfat 1 0.0 1) x 0.28 Kadar N amino =
L
x faktor pengenceranmg contoh.
Pola kromatografi filtrasi gel
,. Pola kromatografi pepton dilakukan dengan menggunakan kolom kromatografl
filtrasi gel ukuran 1.5 x 30 cm berisi superdex 75. Eluennya adalah bufer asetat pH
5.6, laju alir 1.25mVmenit dan konsentrasi protein dibuat 10%.
Efektivitas produk pada pertumbuhan bakteri
Untuk menguji pertumbuhan bakteri, media uji dibuat dengan melarutkan 0.5%
pepton dan 0.3% beef extract dalam akuades dan sterilisasi medium dilakukan pada
suhu 121°C selama 20 menit. Ke dalam media dimasukkan 0.51111 biakan bakteri
secara aseptis, kemudian diinkubasi pada shaker reciprocal 120rpm, 30°C selama 24
jam. Pengamatan kekeruhan (Ohtransmitans) diamati setiap 1 jam. Selanjutnya
pemupukan 0. lml setiap pengenceran tertentu dari bakteri yang tumbuh 24 jam pada
media pepton uji pada media agar nutrien, dan diinkubasi 24 jam. Jumlah koloni yang
tumbuh dihitung sebagai cfidml.
[~umlah cfu/ml = (Jumlah koloni )/(faktor pengenceran x 0.1)
1
Proteixr Terlarut
Analisis protein terlarut dilakukan dengan metode spektrofotometri (Lowry, 195 1).
Sampel larutan (filtrat hasil hidrolisis) diambil sebanyak 0.25 ml dimasukkan ke
dalarn tabung reaksi dan volume ditepatkan menjadi 5 ml dengan akuades. Dari
masing-masing tabung reaksi diambil 0.25 ml dan ditambahkan 2.75m1 pereaksi
Lowry C (50 rnl Lowry A
+
1 ml Lowry B), diaduk dan selanjutnya ditambahkan0.25 ml pereaksi Lowry D, segera diaduk merata sesudah penambahan dan dibiarkan
selama 3 0 d t sampai terbentuk warm biru yang stabil. Absorbansi diukur pada h
500nrn. Persamaan kurva standar BSA adalah y = 0.0219
+
0.5855x, dimana :y = absorbans
x = konsentrasi BS A (mg/ml)
Lowry A berupa carnpuran larutan natrium karbonat 2% dalam larutan NaOH 0. IN,
Lowry B adalah larutan tembaga sulfat 0.5% dalam larutan NaK-tartrat 1%.
Perhitungan kadar protein terlarut adalah:
Abs - 0.0219
Protein terlamt (mg/ml) = x faktor pengenceran
HASIL DAN PEMBAHASAN
A. Aktivitas Enzim Papain
Enzrm yang digunakan adalah papain (reJned papain) yang diisolasi dari getah
buah pepaya dan dilakukan pengendapan dengan alkohol, selanjutnya dilakukan
pengeringan pada pengering kabinet dengan suhu 55°C. Papain yang digunakan
berbentuk bubuk putih kekuningan. Penentuan aktivitas proteolitik enzim papain
dilakukan dengan menggunakan substrat kasein 1% pada pH 6.5, suhu 40°C dan
inkubasi selama 5 menit. Nilai aktivitas yang diperoleh sebesar 1164 unit. Unit dalam
ha1 ini didefinisikan sebagai jumlah pg produk (tirosin) yang terbentuk per menit dari
substrat kasein pada kondisi uji.
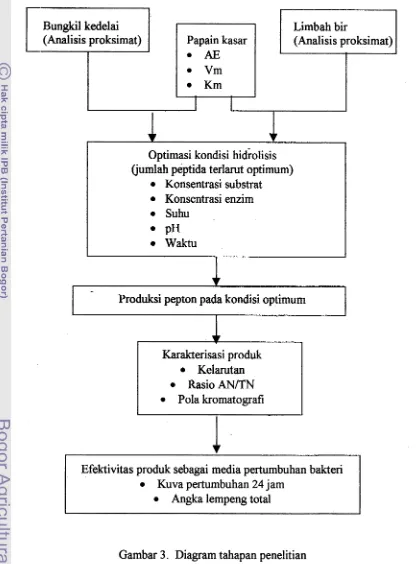
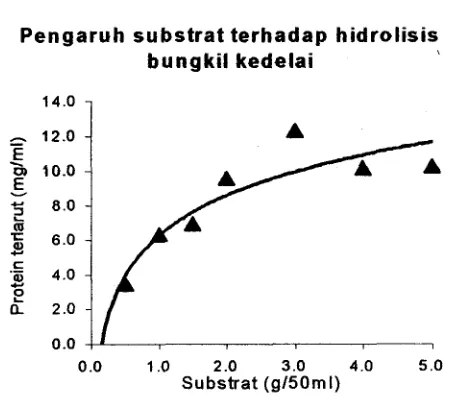
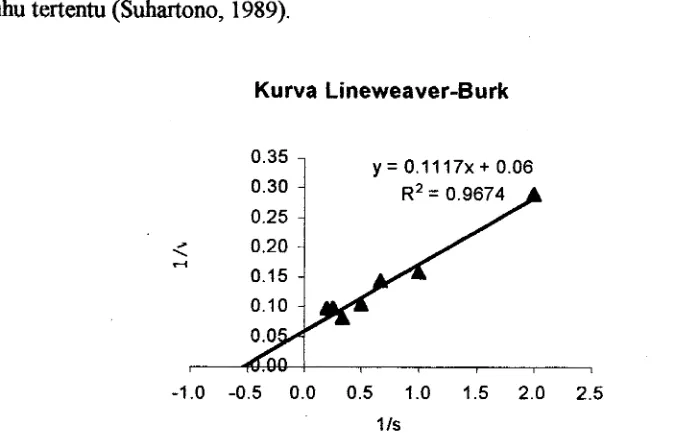
Hasil analisis melalui pendekatan kurva Lineweaver-Burk diperoleh karakteristik
dari papain yang digunakan adalah Vm sebesar 2000 unit dan Km = 0.8%. (Gambar 5 & 6). Nilai tan sudut yang dibentuk oleh garis lurus = KmNm sedangkan
perpotongan garis lurus pada sumbu tegak = 1 N m dan perpotongan garis lurus pada
sumbu datar = -1Km (Winarno, 1986).
1 5 0 0 -
1 3 0 0 -
P c
2 1 1 0 0 -
3
0 0 . 5 1 1 . 5 2 2 . 5 3
K a s e i n (%)
K u r v a Lineweaver-Burk
Gambar 6. Hubungan laju reaksi enzim terhadap substrat kasein
B. Komposisi bahan baku
Bahan baku bungkil kedelai yang digunakan berbentuk padat berwarna
kekuningan dengan butiran 1010s 50 mesh dan limbah bir dalam bentuk padatan
kering berwarna kuning kecoklatan dengan butiran 1010s 50 mesh.
Hasil analisis komposisi kimia bahan baku dapat dilihat pada Tabel 5 dan 6.
Tabel 5. Komposisi kimia bungkil kedelai
Tabel 6. Komposisi kimia limbah bir Komposisi
Protein Glukosa
Air Abu
Jumlah (g/ 1 00g) 35.4 0.24 7.6 7.3 Komposisi Protein Glukosa Air Abu
Kornposisi bungkil kedelai dan limbah bir dari hasil penelitian sedikit berbeda dari
laporan penelitian sebelumnya namun masih dalam batas dapat diterima. Hal ini
dapat disebabkan dari perbedaan bahan baku asalnya dan metode analisisnya.
el
Santosa et al. (1998) melaporkan kadar protein bungkil kedelai sebesar 45.1%,
kadar air 9.3% dan kadar abu 4.0%. Tobing (1999) melaporkan kandungan glukosa
(larut air suhu kamar) pada bungkil kedelai dari Amerika Serikat sebesar 0.13% dan
dari India sebesar 0.20%. Atmaka (1997) melaporkan kadar protein dari limbah bir
yang dipisahkan dengan penekanan hidrolik @ast press) adalah 55.66%, kadar air
sebesar 73.83% dan kadar abu 6.98%.
C. Pemilihan kondisi reaksi hidrolisis
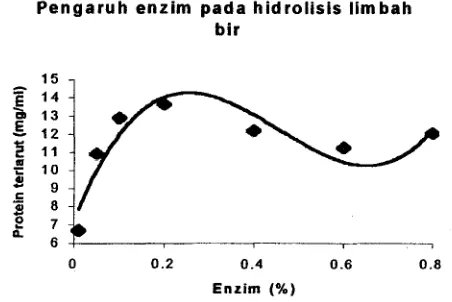
Kondisi hidrolisis umumnya dipengaruhi oleh konsentrasi substrat, konsentrasi
a i m , suhu, pH, d m waktu (Muchtadi et al., 1992) sebagaimana dijelaskan dalam
pembahasan dibawah ini.
Konsentrasi substrat
Kebutuhan banyaknya substrat bungkil kedelai dan limbah bir bagi enzim papain
ditentukan dengan menggunakan jumlah bahan yang bervariasi antara 1-10% (blv).
Hidrolisis dilakukan pada konsentrasi enzim 1% dengan waktu 1 jam dan suhu 60°C.
Pengukuran kadar protein terlar