POLA KROMATOGRAFI DAN UJI AKTIVITAS
ANTIBAKTERI DARI EKSTRAK DAN FRAKSI KULIT
BUAH PETAI (Parkia speciosa Hassk.) SEBAGAI ANTIDIARE
Niv
ers
SKRIPSI
OLEH:
SUSITA ARIANI
NIM 121524162
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
POLA KROMATOGRAFI DAN UJI AKTIVITAS
ANTIBAKTERI DARI EKSTRAK DAN FRAKSI KULIT
BUAH PETAI (Parkia speciosa Hassk.) SEBAGAI ANTIDIARE
Niv
ers
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SUSITA ARIANI
NIM 121524162
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
POLA KROMATOGRAFI DAN UJI AKTIVITAS
ANTIBAKTERI DARI EKSTRAK DAN FRAKSI KULIT
BUAH PETAI (Parkia speciosa Hassk.) SEBAGAI ANTIDIARE
umatera UtarOLEH:
SUSITA ARIANI
NIM 121524162
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 22 Mei 2015 Disetujui Oleh:
Pembimbing I
Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Pembimbing II
Dra. Erly Sitompul, M.Si., Apt. NIP 195006121980032001
Panitia Penguji,
Prof. Dr. rer. nat. E. De Lux Putra, S.U., Apt. NIP 195306191983031001
Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
NIP 195109081985031002
Medan, Juni 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
iv
KATA PENGANTAR
Bismillahirrahmanirrahiim,
Puji syukur ke hadirat Allah SWT atas segala limpahan rahmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan
skripsi ini. Shalawat serta salam semoga selalu tercurahkan kepada Rasulullah
Muhammad SAW, kiblat dalam perjalanan kita sebagai generasi penerusnya
hingga akhir zaman.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul
“Pola Kromatografi dan Uji Aktivitas Antibakteri dari Ekstrak dan Fraksi Kulit
Buah Petai (Parkia speciosa Hassk.) Sebagai Antidiare”.
Pada kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada Ibu Dr. Marline Nainggolan, M.S., Apt. dan Ibu Dra. Erly
Sitompul, M.Si., Apt., selaku pembimbing yang telah membimbing dan
memberikan petunjuk serta saran-saran selama penelitian hingga selesainya
skripsi ini. Kepada Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio
Hadisahputra, Apt. dan Ibu Wakil Dekan 1 Prof. Dr. Julia Reveny, M.Si., Apt.
yang telah memberikan fasilitas sehingga penulis dapat menyelesaikan
pendidikan. Kepada Bapak Prof. Dr. Muchlisyam, M.Si., Apt. selaku Ketua
Program Ekstensi Sarjana Farmasi USU Medan. Kepada BapakProf. Dr. rer. nat.
Effendy De Lux Putra, S.U., Apt., Bapa
selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada
v
M.Sc., Apt selaku pembimbing akademik yang telah memberikan bimbingan dan
nasehat selama masa perkuliahan hingga selesai. Kepada Bapak dan Ibu staff
pengajar Fakultas Farmasi USU Medan atas ilmu dan pendidikan yang telah
diberikan.
Penulis mengucapkan terima kasih dengan penuh kerendahan hati dan
rasa hormat serta penghargaan yang tiada terhingga kepada Ayahanda Taufik
Ansori dan Ibunda Mariana yang telah memberikan cinta, kasih sayang dan doa
tulus yang selalu tercurah dalam bilangan hari, serta pengorbanan baik materi
maupun non materi. Kedua adikku Susan Apriansyah dan Gusti Maya Sari serta
seluruh keluarga yang selalu mendoakan dan memberikan semangat.
Penulis juga mengucapkan terima kasih teramat dalam kepada Atika,
Icha, Didis, Fitri, Nola, Jesa, Roi, Sarah, Nulika, Roma, Yani, Dewi, Kiki dan
Zahara yang telah memberikan bantuan dan semangat tak terhingga. Seluruh
teman-teman ekstensi 2012 serta seluruh pihak yang telah ikut membantu penulis
terima kasih untuk dorongan, semangat dan kebersamaannya selama ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, oleh karena itu penulis menerima kritik dan saran demi
kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat
bermanfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, Mei 2015 Penulis
vi
POLA KROMATOGRAFI DAN UJI AKTIVITAS ANTIBAKTERI DARI EKSTRAK DAN FRAKSI KULIT BUAH PETAI
(Parkia speciosa Hassk.) SEBAGAI ANTIDIARE
ABSTRAK
Petai (Parkia speciosa Hassk.) merupakan salah satu tumbuhan obat yang perlu dikembangkan karena cukup bermanfaat dalam pengobatan. Kulit buah petai yang selama ini merupakan limbah organik berkhasiat sebagai hipoglikemik, antioksidan dan antibakteri. Kulit buah petai mengandung senyawa golongan saponin, flavonoid dan tanin. Penelitian ini bertujuan untuk mengetahui pola kromatografi dan aktivitas antibakteri ekstrak dan fraksi kulit buah petai terhadap bakteri Bacillus cereus, Escherichia coli dan Salmonella typhi.
Serbuk simplisia kulit buah petai dilakukan karakterisasi dan skrining fitokimia, selanjutnya diekstraksi secara maserasi dengan pelarut etanol 80%. Ekstrak etanol difraksinasi dengan pelarut n-heksana dan etilasetat menggunakan metode ekstraksi cair-cair. Analisis kandungan kimia secara kromatografi lapis tipis (KLT) dan kromatografi kertas (KKt) serta uji aktivitas antibakteri terhadap bakteri Bacillus cereus, Eschericia coli dan Salmonella typhi menggunakan metode difusi agar.
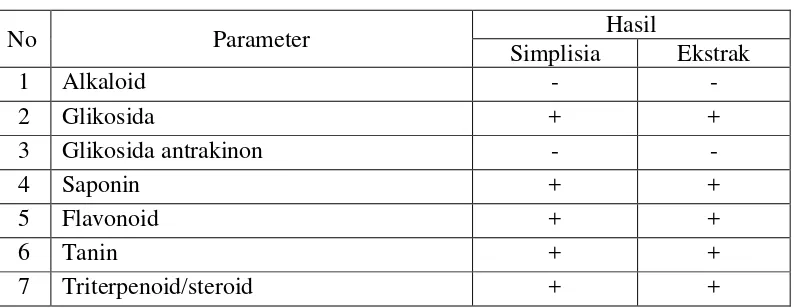
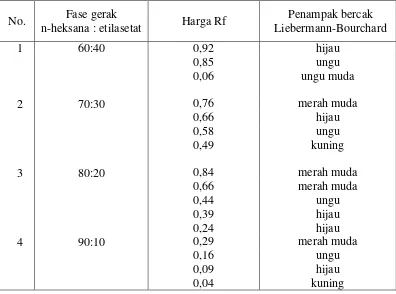
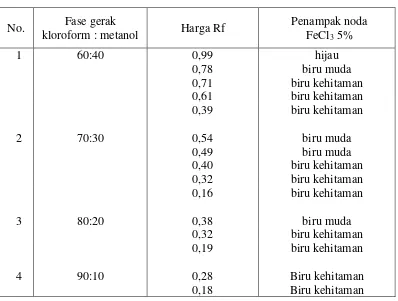
Hasil skrining fitokimia diperoleh golongan senyawa glikosida, flavonoid, triterpenoid/steroid, saponin dan tanin. Hasil KLT ekstrak etanol diperoleh 3 senyawa triterpenoid/steroid dan 3 senyawa fenol. Hasil KLT fraksi n-heksana diperoleh 7 senyawa triterpenoid/steroid dan untuk fraksi etilasetat diperoleh 4 senyawa fenol. Hasil KKt diperoleh 7 senyawa tanin dan 1 senyawa flavonoid. Hasil uji aktivitas antibakteri ekstrak etanol yang efektif adalah konsentrasi 100 mg/ml terhadap bakteri Bacillus cereus dengan diameter hambat 14,57 mm,
konsentrasi 200 mg/ml terhadap Escherichia coli dan Salmonella typhi diameter hambat 14,13 mm dan 14,73 mm. Fraksi etilasetat efektif pada konsentrasi 50 mg/ml terhadap bakteri Bacillus cereus diameter hambat 14,07 mm, konsentrasi 100 mg/ml terhadap Escherichia coli dan Salmonella typhi diameter hambat 14,33 mm dan 15,07 mm. Fraksi n-heksana kurang efektif menghambat pertumbuhan ketiga bakteri pada konsentrasi 500 mg/ml diameter hambat 12,57 mm, 12,37 mm dan 12,10 mm.
vii
CHROMATOGRAPHY PATTERN AND ANTIBACTERIAL ACTIVITY TEST OF PETAI SKIN EXTRACT AND FRACTION
(Parkia speciosa Hassk.) AS ANTIDIARRHEAL
ABSTRACT
Petai (Parkia speciosa Hassk.) is one of the medicinal herbs that needs to be developed due to its benefits in medication. Petai fruit skin which has been an organic waste, efficacious as a hypoglycemic, antioxidant and antibacterial agent. It contains saponins, flavonoids and tannins. The research aims to determine chromatographic pattern and antibacterial activity of ethanol extract and fraction petai fruit skin against bacteria Bacillus cereus, Escherichia coli and Salmonella typhi
Simplex powder of petai fruit skin was characterized and phytochemically screened then extracted by maceration with ethanol 80%. The ethanol extract was fractionated with a solvent n-hexane and ethylacetate using method of liquid-liquid extraction. The analyze of chemical compound by thin layer chromatography (TLC) and paper chromatography (KKt) and tested for antibacterial activity against Bacillus cereus, Escherichia coli and Salmonella typhi using the agar diffusion method.
The result of phytochemical screening obtained a group of chemical compounds like glycosides, flavonoids, triterpenoids/steroids, saponins, and tannins. The TLC results of ethanol extract obtained 3 triterpenoids/steroids compound and 3 phenols. The TLC results of n-hexane fraction obtained 7 triterpenoids/steroids compounds and for ethylacetate fraction obtained 4 phenol compound. The results of paper chromatography (PC) obtained 7 flavonoid compound and 1 tannin. The antibacterial activity test of ethanol extract was effective as an antibacterial agent at a concentration of 100 mg/ml against bacteria
Bacillus cereus with inhibition zone 14.57 mm, at a concentration of 200 mg/ml againts Escherichia coli and Salmonella typhi with inhibition zone 14.13 mm and 14.73 mm. Ethylacetate fractions was effective at a concentration of 50 mg/ml against bacteria Bacillus cereus with inhibition zone 14.07 mm, at a concentration of 100 mg/ml againts Escherichia coli and Salmonella typhi with inhibition zone 14.33 mm and 15.07 mm). N-hexane fraction was less effectively in inhibiting the growth of third bacteria at a concentration of 500 mg/ml with inhibition zone 12.57 mm, 12.37 mm and 12.10 mm.
viii
DAFTAR ISI
Halaman
JUDUL ... i
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Klasifikasi tumbuhan ... 5
2.1.2 Nama daerah ... 5
2.1.3 Morfologi tumbuhan ... 5
2.1.4 Kandungan kimia tumbuhan ... 6
ix
2.2 Uraian Kromatografi ... 7
2.2.1 Kromatografi kertas ... 9
2.2.2 Kromatografi lapis tipis ... 10
2.2.3 Kromatografi cair kinerja tinggi ... 11
2.2.4 Kromatografi gas ... 11
2.2.5 Kromatografi penukar ion ... 11
2.2.6 Kromatografi eksklusi ... 12
2.3 Ekstraksi ... 12
2.4 Sterilisasi ... 14
2.4.1 Sterilisasi panas kering ... 15
2.4.2 Sterilisasi panas basah ... 15
2.5 Uraian Bakteri ... 16
2.5.1 Morfologi dan struktur bakteri ... 16
2.5.2 Fase pertumbuhan bakteri ... 18
2.5.3 Pengaruh faktor lingkungan pada pertumbuhan ... 19
2.5.4 Bakteri Bacillus cereus ... 21
2.5.5 Bakteri Escherichia coli ... 23
2.5.6 Bakteri Salmonella typhi ... 26
2.6 Pengujian Aktivitas Antibakteri ... 28
2.7 Diare ... 30
BAB III METODE PENELITIAN ... 33
3.1 Alat dan Bahan ... 33
3.1.1 Alat-alat ... 33
x
3.2 Pembuatan larutan Pereaksi ... 34
3.2.1 Pereaksi Liebermann-Bouchard ... 34
3.2.2 Pereaksi Dragendorff ... 34
3.2.3 Pereaksi asam sulfat 2 N ... 34
3.2.4 Pereaksi Mayer ... 34
3.2.5 Pereaksi Bouchardat ... 35
3.2.6 Pereaksi Molish ... 35
3.2.7 Pereaksi besi (III) klorida 1% ... 35
3.2.8 Pereaksi natrium hidroksida 2 N ... 35
3.2.9 Pereaksi asam klorida 0,5 N ... 35
3.2.10 Pereaksi timbal (III) asetat 0,4 M ... 35
3.3 Penyiapan Sampel ... 35
3.3.1 Pengambilan sampel ... 35
3.3.2 Identifikasi tumbuhan ... 36
3.3.3 Pengolahan sampel ... 36
3.4 Pemeriksaan Karakterisasi Simplisia dan Ekstrak ... 36
3.4.1 Penetapan kadar air ... 36
3.4.2 Penetapan kadar abu ... 37
3.4.3 Penetapan kadar abu tidak larut dalam asam ... 37
3.4.4 Penetapan kadar sari larut dalam air ... 37
3.4.5 Penetapan kadar sari larut dalam etanol ... 38
3.5 Skrining Fitokimia Simplisia dan Ekstrak ... 38
3.5.1 Pemeriksaan alkaloid ... 38
xi
3.5.3 Pemeriksaan glikosida antrakuinon ... 39
3.5.4 Pemeriksaan saponin ... 40
3.5.5 Pemeriksaan flavonoid ... 40
3.5.6 Pemeriksaan tanin ... 40
3.5.7 Pemeriksaan triterpenoid/steroid ... 41
3.6 Pembuatan Ekstrak Kulit Buah Petai ... 41
3.6.1 Pembuatan ekstrak etanol ... 41
3.6.2 Pembuatan fraksi-fraksi dari ekstrak etanol ... 41
3.7 Pembuatan Profil Kromatografi ... 42
3.7.1 Pembuatan profil KLT ... 42
3.7.2 Pembuatan profil KKt ... 42
3.8 Sterilisasi Alat dan Bahan ... 43
3.9 Pembuatan Media Nutrien Agar ... 43
3.10 Pembuatan Media Agar Miring ... 43
3.11 Pembuatan Larutan NaCl 0,9% ... 44
3.12 Pembiakan Bakteri ... 44
3.12.1 Pembuatan stok kultur ... 44
3.12.2 Pembuatan inokulum ... 44
3.13 Pembuatan Larutan Uji Dengan Berbagai Konsentrasi 45
3.14 Pengujian Aktivitas Antibakteri ... 45
BAB IV HASIL DAN PEMBAHASAN ... 46
4.1 Hasil Identifikasi Tumbuhan ... 46
4.2 Hasil Ekstraksi ... 46
xii
4.4 Hasil Skrining Fitokimia ... 47
4.5 Hasil Analisis KLT Ekstrak Etanol Kulit Buah Petai .... 48
4.6 Hasil Analisis KLT Fraksi n-Heksana Kulit Buah Petai 49
4.7 Hasil Analisis KLT Fraksi Etilasetat Kulit Buah Petai .. 51
4.8 Hasil Analisis KKt Fraksi Etilasetat Kulit Buah Petai ... 52
4.9 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol, Fraksi n-Heksana dan Fraksi Etilasetat ... 53
BAB V KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
4.2 Saran ... 57
DAFTAR PUSTAKA ... 58
xiii
DAFTAR TABEL
Tabel Halaman
2.1 Kandungan gizi biji petai ... 6
2.2 Karakteristik penyakit akibat Bacillus cereus ... 23
4.1 Hasil karakterisasi serbuk simplisisa dan ekstrak etanol kulit buah petai ... 46
4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol kulit buah petai ... 47
4.3 Data hasil analisis KLT ekstrak etanol kulit buah petai dengan fase gerak n-heksana:etilasetat ... 48
4.4 Data hasil analisis KLT ekstrak etanol kulit buah petai dengan fase gerak kloroform:metanol ... 49
4.5 Data hasil analisis KLT fraksi n-heksana kulit buah petai dengan fase gerak n-heksana:etilasetat ... 50
4.6 Data hasil analisis KLT fraksi etilasetat kulit buah petai dengan fase gerak kloroform:metanol ... 51
4.7 Data hasil analisis KKt fraksi etilasetat kulit buah petai ... 52
4.8 Hasil uji aktivitas antibakteri ekstrak etanol ... 53
4.9 Hasil uji aktivitas antibakteri fraksi n-heksana ... 54
xiv
DAFTAR GAMBAR
Gambar Halaman
2.1 Struktur bakteri ... 16
2.2 Bentuk umum sel dan rangkaian sel bakteri ... 17
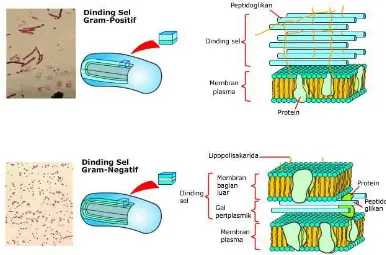
2.3 Dinding sel bakteri gram positif dan gram negatif ... 18
2.4 Grafik pertumbuhan bakteri ... 19
2.5 Koloni Bacillus cereus ... 22
2.6 Spora Bacillus cereus ... 22
2.7 Koloni Escherichia coli ... 24
2.8 Koloni Salmonella typhi ... 27
xv
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tumbuhan ... 62
2 Gambar tumbuhan dan buah petai ... 63
3 Gambar simplisia dan serbuk simplisia kulit buah petai ... 64
4 Bagan penelitian ... 65
5 Perhitungan hasil pemeriksaan karakterisasi simplisia kulit buah petai ... 68
6 Perhitungan hasil pemeriksaan karakterisasi ekstrak etanol kulit buah petai ... 71
7 Gambar hasil kromatogram ekstrak etanol secara KLT ... 74
8 Gambar hasil kromatogram fraksi n-heksana secara KLT ... 76
9 Gambar hasil kromatogram fraksi etilasetat secara KLT ... 77
10 Gambar hasil kromatogram fraksi etilasetat secara KKt ... 78
11 Hasil uji aktivitas antibakteri ekstrak etanol kulit buah petai .... 81
12 Hasil uji aktivitas antibakteri fraksi n-heksana kulit buah petai 83
13 Hasil uji aktivitas antibakteri fraksi etilasetat kulit buah petai .. 85
14 Gambar hasil uji aktivitas antibakteri ekstrak etanol kulit buah petai ... 87
15 Gambar hasil uji aktivitas antibakteri fraksi n-heksana kulit buah petai ... 90
vi
POLA KROMATOGRAFI DAN UJI AKTIVITAS ANTIBAKTERI DARI EKSTRAK DAN FRAKSI KULIT BUAH PETAI
(Parkia speciosa Hassk.) SEBAGAI ANTIDIARE
ABSTRAK
Petai (Parkia speciosa Hassk.) merupakan salah satu tumbuhan obat yang perlu dikembangkan karena cukup bermanfaat dalam pengobatan. Kulit buah petai yang selama ini merupakan limbah organik berkhasiat sebagai hipoglikemik, antioksidan dan antibakteri. Kulit buah petai mengandung senyawa golongan saponin, flavonoid dan tanin. Penelitian ini bertujuan untuk mengetahui pola kromatografi dan aktivitas antibakteri ekstrak dan fraksi kulit buah petai terhadap bakteri Bacillus cereus, Escherichia coli dan Salmonella typhi.
Serbuk simplisia kulit buah petai dilakukan karakterisasi dan skrining fitokimia, selanjutnya diekstraksi secara maserasi dengan pelarut etanol 80%. Ekstrak etanol difraksinasi dengan pelarut n-heksana dan etilasetat menggunakan metode ekstraksi cair-cair. Analisis kandungan kimia secara kromatografi lapis tipis (KLT) dan kromatografi kertas (KKt) serta uji aktivitas antibakteri terhadap bakteri Bacillus cereus, Eschericia coli dan Salmonella typhi menggunakan metode difusi agar.
Hasil skrining fitokimia diperoleh golongan senyawa glikosida, flavonoid, triterpenoid/steroid, saponin dan tanin. Hasil KLT ekstrak etanol diperoleh 3 senyawa triterpenoid/steroid dan 3 senyawa fenol. Hasil KLT fraksi n-heksana diperoleh 7 senyawa triterpenoid/steroid dan untuk fraksi etilasetat diperoleh 4 senyawa fenol. Hasil KKt diperoleh 7 senyawa tanin dan 1 senyawa flavonoid. Hasil uji aktivitas antibakteri ekstrak etanol yang efektif adalah konsentrasi 100 mg/ml terhadap bakteri Bacillus cereus dengan diameter hambat 14,57 mm,
konsentrasi 200 mg/ml terhadap Escherichia coli dan Salmonella typhi diameter hambat 14,13 mm dan 14,73 mm. Fraksi etilasetat efektif pada konsentrasi 50 mg/ml terhadap bakteri Bacillus cereus diameter hambat 14,07 mm, konsentrasi 100 mg/ml terhadap Escherichia coli dan Salmonella typhi diameter hambat 14,33 mm dan 15,07 mm. Fraksi n-heksana kurang efektif menghambat pertumbuhan ketiga bakteri pada konsentrasi 500 mg/ml diameter hambat 12,57 mm, 12,37 mm dan 12,10 mm.
vii
CHROMATOGRAPHY PATTERN AND ANTIBACTERIAL ACTIVITY TEST OF PETAI SKIN EXTRACT AND FRACTION
(Parkia speciosa Hassk.) AS ANTIDIARRHEAL
ABSTRACT
Petai (Parkia speciosa Hassk.) is one of the medicinal herbs that needs to be developed due to its benefits in medication. Petai fruit skin which has been an organic waste, efficacious as a hypoglycemic, antioxidant and antibacterial agent. It contains saponins, flavonoids and tannins. The research aims to determine chromatographic pattern and antibacterial activity of ethanol extract and fraction petai fruit skin against bacteria Bacillus cereus, Escherichia coli and Salmonella typhi
Simplex powder of petai fruit skin was characterized and phytochemically screened then extracted by maceration with ethanol 80%. The ethanol extract was fractionated with a solvent n-hexane and ethylacetate using method of liquid-liquid extraction. The analyze of chemical compound by thin layer chromatography (TLC) and paper chromatography (KKt) and tested for antibacterial activity against Bacillus cereus, Escherichia coli and Salmonella typhi using the agar diffusion method.
The result of phytochemical screening obtained a group of chemical compounds like glycosides, flavonoids, triterpenoids/steroids, saponins, and tannins. The TLC results of ethanol extract obtained 3 triterpenoids/steroids compound and 3 phenols. The TLC results of n-hexane fraction obtained 7 triterpenoids/steroids compounds and for ethylacetate fraction obtained 4 phenol compound. The results of paper chromatography (PC) obtained 7 flavonoid compound and 1 tannin. The antibacterial activity test of ethanol extract was effective as an antibacterial agent at a concentration of 100 mg/ml against bacteria
Bacillus cereus with inhibition zone 14.57 mm, at a concentration of 200 mg/ml againts Escherichia coli and Salmonella typhi with inhibition zone 14.13 mm and 14.73 mm. Ethylacetate fractions was effective at a concentration of 50 mg/ml against bacteria Bacillus cereus with inhibition zone 14.07 mm, at a concentration of 100 mg/ml againts Escherichia coli and Salmonella typhi with inhibition zone 14.33 mm and 15.07 mm). N-hexane fraction was less effectively in inhibiting the growth of third bacteria at a concentration of 500 mg/ml with inhibition zone 12.57 mm, 12.37 mm and 12.10 mm.
1
BAB I
PENDAHULUAN
1.1Latar Belakang
Indonesia memiliki iklim tropis yang menyebabkan tanahnya subur
sehingga banyak jenis tumbuhan yang dapat tumbuh. Di antara berbagai jenis
tersebut beberapa jenis tumbuhan berkhasiat sebagai obat, namun sebagian besar
tidak diketahui oleh manusia kegunaannya sehingga tidak terawat dengan baik.
Secara umum kegunaan tumbuhan obat sebenarnya disebabkan oleh kandungan
kimia yang dimilikinya (Hariana, 2008).
Petai (Parkia speciosa Hassk.) merupakan tumbuhan dari suku
polong-polongan (Fabaceae) yang tersebar luas di Nusantara bagian barat. Bijinya
dikonsumsi ketika masih muda, baik segar maupun direbus. Biji petai
mengandung zat gizi seperti, protein, lemak, karbohidrat, mineral dan vitamin
(Agoes, 2010; Susilo, 2012). Menurut Dr. Aminudin AHK dari Departement of
Physiologi Medical Faculty of University Malaysia, petai berkhasiat untuk
kesehatan seperti mengobati anemia, menurunkan tekanan darah tinggi, mengatasi
stres, sindroma pramenstruasi, liver dan sembelit (Susilo, 2012).
Kulit buah petai yang selama ini menjadi limbah organik, ternyata
bermanfaat untuk kesehatan. Hasil penelitian yang telah dilakukan terhadap kulit
buah petai menunjukkan adanya efek hipoglikemik (Jamaludin dan Mohamed,
1993), aktivitas antioksidan dan antibakteri (Wonghirundecha, dkk., 2013). Kulit
buah petai mengandung senyawa metabolit sekunder golongan saponin, flavonoid
dan tanin (Kamisah, dkk., 2013). Saponin, flavonoid dan tanin merupakan
2
merupakan zat aktif yang dapat meningkatkan permeabilitas membran sehingga
menyebabkan sel kuman akan pecah atau lisis (Poeloengan dan Praptiwi, 2010).
Flavonoid merupakan senyawa fenol yang bekerja dengan cara mendenaturasi
protein sehingga dapat menyebabkan aktivitas metabolisme sel bakteri berhenti.
Tanin bersifat antibakteri bekerja dengan membentuk ikatan yang stabil dengan
protein sehingga terjadi koagulasi protoplasma bakteri (Miranti, dkk., 2013).
Bacillus cereus, Escherichia coli dan Salmonella typhi merupakan bakteri
penyebab diare (Zein, dkk., 2014). Diare adalah suatu keadaan abnormal dari
buang air besar dengan frekuensi tiga kali atau lebih dengan melihat konsistensi
lembek, cair sampai dengan atau tanpa darah dan lendir dalam tinja (Rosidi, dkk.,
2010). Salah satu faktor penyebab terjadinya diare antara lain karena infeksi
bakteri penyebab diare (Primadani, dkk., 2012).
Bacillus cereus menyebabkan diare dengan menghasilkan enterotoksin
penyebab diare yang lebih bersifat keracunan akibat infeksi lewat makanan
(Jawetz, dkk., 2005). Escherichia coli merupakan flora normal saluran usus
sebagai penyebab diare dengan memproduksi enterotoksin dan menginvasi
dinding usus (Volk dan Wheeler, 1989). Salmonella typhi dapat menyebabkan
gastroenteritis dimana terjadi infeksi pada kolon yang ditandai dengan diare,
demam dan nyeri abdomen (Dzen, dkk., 2003). Salmonella typhi menyebabkan
gastroenteritis dengan mencemari makanan terutama daging, unggas, telur dan
produk olahan ketiganya (Arisman, 2009).
Berdasarkan uraian di atas maka pada penelitian ini dilakukan analisis
kandungan kimia dengan skrining fitokimia, karakterisasi dan pola kromatografi
3
aktivitas antibakteri ekstrak etanol, fraksi n-heksana dan fraksi etilasetat kulit
buah petai (Parkia speciosa Hassk.). Pengujian aktivitas antibakteri dilakukan
dengan metode difusi agar menggunakan bakteri Bacillus cereus, Escherichia coli
dan Salmonella typhi.
1.2Perumusan Masalah
1. Golongan senyawa kimia apakah yang terdapat di dalam kulit buah petai?
2. Bagaimana pola kromatografi ekstrak dan fraksi dari kulit buah petai
menggunakan KLT dan KKt ?
3. Apakah ekstrak etanol, fraksi n-heksana dan fraksi etilasetat kulit buah
petai memiliki aktivitas antibakteri terhadap bakteri Bacillus cereus,
Escherichia coli dan Salmonella typhi ?
1.3Hipotesis
1. Golongan senyawa kimia yang terdapat di dalam kulit buah petai adalah
glikosida, saponin, flavonoid dan tanin.
2. Pola kromatografi ekstrak dan fraksi dari kulit buah petai dengan berbagai
perbandingan pelarut memberikan pola kromatografi yang berbeda-beda.
3. Ekstrak etanol, fraksi n-heksana dan fraksi etilasetat kulit buah petai
memiliki aktivitas antibakteri terhadap bakteri Bacillus cereus,
4
1.4Tujuan Penelitian
1. Untuk mengetahui golongan senyawa kimia yang terdapat di dalam kulit
buah petai.
2. Untuk mengetahui pola kromatografi ekstrak dan fraksi kulit buah petai
dengan menggunakan KLT dan KKt.
3. Untuk mengetahui aktivitas antibakteri ekstrak etanol, fraksi n-heksana
dan fraksi etilasetat kulit buah petai terhadap bakteri Bacillus cereus,
Escherichia coli dan Salmonella typhi.
1.5Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang
kandungan senyawa kimia, pola kromatografi dan aktivitas antibakteri dari
ekstrak etanol, fraksi n-heksana dan fraksi etilasetat kulit buah petai sebagai
5
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Klasifikasi tumbuhan
Menurut Samsuhidayat dan Hutapea (1991), klasifikasi tumbuhan petai
adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Rosales
Suku : Mimosaceae
Marga : Parkia
Jenis : Parkia speciosa Hassk.
2.1.2Nama daerah
Tanaman petai di Indonesia memiliki berbagai macam nama daerah,
seperti: parira (Batak Karo); palia (Batak Toba); patai (Minangkabau); petar
(Lampung); pete, sindutan (Jawa); peteh (Madura); peteuy (Sunda); petai
(Katingan, Sampit); puti (Sumba); pode (Bima); pote (Sawu); paloh (Ceram);
pateka (Ambon) dan foopatu (Buru) (Heyne, 1987).
2.1.3 Morfologi tumbuhan
Petai (Parkia speciosa Hassk.) merupakan pohon tahunan tropis dari suku
polong-polongan. Tanaman ini berbentuk pohon dengan tinggi mencapai 5-25 m,
6
daunnya menyirip ganda. Bunganya ketika masih muda berwarna hijau, keras dan
berbentuk bongkol. Bentuk buahnya berpolong-polong, berisi biji-biji dan biji
tersebut agak lunak ketika masih muda dan agak keras setelah menjadi tua. Buah
petai mulanya berwarna hijau muda, kemudian semakin lama menjadi hijau tua
dan akhirnya setelah masak akan berwarna hitam (Susilo, 2012). Jumlah biji
dalam satu buah bisa mencapai 20 biji, yang berwarna hijau ketika masih muda
dan terbalut oleh selaput agak tebal berwarna coklat terang. Buah petai akan
mengering jika masak dan biji-bijinya akan terlepas dengan sendirinya (Agoes,
2010).
Tanaman petai tumbuh baik di daerah dataran rendah sampai daerah
pegunungan dengan ketinggian 1.500 m di atas permukaan laut dengan
lingkungan yang terbuka atau tidak terlindung oleh pohon lain, sebab tanaman
petai sangat membutuhkan sinar matahari sepanjang hari (Susilo, 2012).
2.1.4 Kandungan kimia tumbuhan
Berdasarkan penelitian yang telah dilakukan terhadap buah petai
kandungan kimia yang terdapat pada kulit buah petai yaitu tanin, flavonoid,
saponin dan bijinya mengandung alkaloid, triterpenoid/steroid dan flavonoid
(Kamisah, dkk., 2013). Selain itu biji juga mengandung zat gizi, mineral dan
vitamin sebagaimana tercantum dalam Tabel 2.1.
Tabel 2.1 Kandungan gizi biji petai
Nama Dalam 100 g biji Nama Dalam 100 g biji
Air 60,5 mg Fosfor 115 mg
Protein 10,4 mg Zat besi 1,2 mg
Lemak 2,0 mg Vitamin A 200 SI
Karbohidrat 22,0 mg Vitamin B1 0,17 mg
Kalsium 95 mg Vitamin C 36 mg
7
2.1.5. Manfaat tumbuhan
Manfaat yang dapat diperoleh dari mengkonsumsi biji petai untuk
kesehatan diantaranya adalah membantu menghilangkan depresi, mengobati
anemia, membantu mengatasi Premenstrual Syndrome (PMS), menurunkan resiko
tekanan darah tinggi, obat hati dan ginjal, mengobati luka lambung, mengatasi
sembelit dan menurunkan resiko terkena stroke (Agoes, 2010; Susilo, 2012).
Berbagai penelitian juga telah dilakukan untuk menguji manfaat biji petai
diantaranya sebagai hipoglikemik, antitumor, antimutagenik, antimikroba
(Kamisah, dkk., 2013), antioksidan dan antihipertensi (Siow dan Gan, 2013).
Kulit buah petai berkhasiat sebagai obat diantaranya berkhasiat sebagai
hipoglikemik (Jamaludin dan Mohamed, 1993), antioksidan (Gan dan Latiff,
2010; Wonghirundecha, dkk., 2013) dan antimikroba (Wonghirundecha, dkk.,
2013).
2.2 Uraian Kromatografi
Kromatografi adalah suatu nama yang diberikan untuk teknik pemisahan
tertentu. Cara yang asli telah diketengahkan pada tahun 1903 oleh Tswett, ia telah
menggunakannya untuk pemisahan senyawa-senyawa yang berwarna dan nama
kromatografi diambilkan dari senyawa yang berwarna. Elusi pertama-tama telah
digunakan oleh Tswett untuk pemisahan pigmen-pigmen daun, karena warna
tersebut maka cepat terlihat lokasinya dalam kolom. Kolom yang digunakan diisi
padatan kalsium karbonat dan dielusi dengan pelarut organik sehingga terjadi
pemisahan yang berupa pita-pita yang berwarna pada kolom. Pembatasan untuk
senyawa-senyawa yang berwarna tak lama dan hampir kebanyakan pemisahan
8
berwarna. Senyawa-senyawa tak berwarna dapat juga dilihat lokasinya, karena
flouresensi senyawa dalam sinar ultraviolet (Sastrohamidjojo, 1985).
Semua cara kromatografi pada dasarnya menggunakan dua fase yaitu fase
tetap (stationary) dan yang lainnya fase gerak (mobile), pemisahan-pemisahan
tergantung pada gerakan relatif dari dua fasa ini (Sastrohamidjojo, 1985). Fase
diam dapat berupa bahan padat atau porus dalam bentuk molekul kecil atau dalam
bentuk cairan yang dilapiskan pada pendukung padat atau dilapiskan pada dinding
kolom. Fase gerak dapat berupa gas atau cairan (Rohman, 2009).
Menurut Sastrohamidjojo (1985), cara-cara kromatografi dapat
digolongkan sesuai dengan sifat-sifat dari fase tetap yang dapat berupa zat padat
atau zat cair. Jika fase tetap berupa zat padat maka cara tersebut dikenal sebagai
kromatografi serapan (absorption chromatography), jika fase tetap cair dikenal
sebagai kromatografi partisi (partition chromatography). Karena fase gerak dapat
berupa zat cair atau gas maka ada empat macam sistem kromatografi yaitu:
1. Fase gerak zat cair – fase tetap padat :
Dikenal sebagai kromatografi serapan yang meliputi
- Kromatografi lapisan tipis
- Kromatografi penukar ion
2. Fase gerak gas – fase tetap padat :
- Kromatografi gas padat
3. Fase gerak zat cair - fase tetap zat cair
Dikenal sebagai kromatografi partisi
- Kromatografi kertas
9 - Kromatografi gas – cair
- Kromatografi kolom kapiler
Menurut Rohman (2009), berdasarkan pada mekanisme pemisahannya
kromatografi dibedakan menjadi:
a. Kromatografi adsorbsi
b. Kromatografi partisi
c. Kromatografi pasangan ion
d. Kromatografi penukar ion
e. Kromatografi eksklusi ukuran
f. Kromatografi afinitas
Menurut Rohman (2009), berdasarkan pada alat yang digunakan
kromatografi dapat dibagi atas:
a. Kromatografi kertas
b. Kromatografi lapis tipis
c. Kromatografi cair kinerja tinggi
d. Kromatografi gas
2.2.1 Kromatografi kertas
Kromatografi kertas atau KKt pada hakekatnya ialah KLT pada lapisan
tipis selulosa atau kertas. Cara ini ditemukan jauh sebelum KLT dan telah dipakai
secara efektif selama bertahun-tahun untuk pemisahan molekul biologi yang polar
seperti asam amino, gula dan nukleotida. KKt tidak memerlukan plat pendukung
dan kertas dapat dengan mudah diperoleh dalam bentuk murni sebagai kertas
saring (Gritter, dkk., 1991).
10
dengan susunan serabut dan tebal yang sesuai. Kandungan air pada kertas dapat
dianggap sebagai fase diam, maka mekanisme partisi berperan penting dalam
pemisahan. Pemisahan dapat berlangsung menggunakan fase cair tunggal dengan
proses yang sama dengan kromatografi adsorpsi dalam kolom (Depkes RI, 1995).
Keberhasilan dari pemisahan kromatografi kertas tergantung juga pada
proses deteksi. Senyawa-senyawa yang berwarna tentu saja terlihat sebagai
noda-noda berwarna yang terpisah pada akhir pengembangan. Untuk senyawa-senyawa
tak berwarna memerlukan deteksi secara kimia dan fisika. Metoda fisika
dilakukan pengamatan di bawah sinar ultra ungu sebelum dan sesudah setiap
metoda dikerjakan. Metoda kimia adalah merupakan deteksi yang paling penting,
pereaksi-pereaksi yang digunakan biasanya dinyatakan sebagai “pereaksi-pereaksi
lokasi”. Cara yang digunakan untuk mendeteksi noda yaitu dengan jalan
penyemprotan (Sastrohamidjojo, 1985).
2.2.2 Kromatografi lapis tipis
Kromatografi lapis tipis (KLT) dikembangkan oleh Izmailoff dan
Schraiber pada tahun 1938. Pada kromatografi lapis tipis, fase diamnya berupa
lapisan yang seragam pada permukaan bidang datar yang didukung oleh lempeng
kaca, plat aluminium atau plat plastik (Rohman, 2009). Fase diam dapat berupa
serbuk halus yang berfungsi sebagai permukaan penjerap (kromatografi
padat) atau berfungsi sebagai penyangga untuk lapisan zat cair (kromatografi
cair-cair). Fase diam yang umum dipakai adalah silika gel (asam silikat), alumina
(aluminium oksida), kieselgur (tanah diatom) dan selulosa (Gritter, dkk., 1991).
Fase gerak dapat berupa hampir segala macam pelarut atau campuran
11
merupakan teknik yang sensitif (Rohman, 2009). Deteksi noda senyawa tidak
berwarna pada KLT dilakukan secara fisika atau kimia. Secara fisika dilakukan
dengan fluoresensi sinar ultraviolet dan pencacahan radioaktif, sedangkan secara
kimia dilakukan dengan cara penyemprotan (Sastrohamidjojo, 1985).
2.2.3 Kromatografi cair kinerja tinggi
Kromatografi cair kinerja tinggi merupakan teknik pemisahan dengan fase
diam padat dan fase gerak cair yang umumnya dilakukan dalam suhu ruang.
Pemisahan diperoleh dari proses partisi, adsorpsi atau penukar ion tergantung dari
tipe fase diam yang digunakan. Zat yang dianalisis dilarutkan dalam pelarut yang
sesuai. Metode ini umumnya digunakan untuk analisis zat yang tidak stabil
terhadap panas. Sebagian besar analisis zat menggunakan kromatografi partisi
yang dapat selesai dalam waktu 30 menit (Kemenkes RI, 2010).
2.2.4 Kromatografi gas
Pada kromatografi gas fase geraknya berupa gas dan fase diam umumnya
suatu cairan, tetapi dapat berupa zat padat atau kombinasi zat padat dan zat cair.
Pada kromatografi gas-cair, fase diam cair sebagai lapisan tipis yang tetap pada
penyangga padat inert yang terbagi halus seperti tanah silika untuk kromatografi,
bata tahan api yang dilumatkan, butir kaca atau bagian dalam tabung berdiameter
kecil. Fase gerak atau gas pembawa umumnya dalam silinder bertekanan yang
dilengkapi dengan katup untuk mengatur tekanan, dialirkan melalui alat pengukur
aliran yang digunakan untuk pengaturan seksama laju aliran yang sesuai untuk
pemisahan suatu campuran tertentu (Ditjen POM,1995).
2.2.5 Kromatografi penukar ion
12
dan ion berdasarkan muatan. Metode ini dapat digunakan untuk hampir semua
molekul bermuatan termasuk protein, nukleotida dan asam amino. Kromatografi
penukar ion sering digunakan untuk pemurnian protein, analisis air dan quality
control. Prinsip dasar kromatografi penukar ion adalah fase diam mampu menukar
ion dan pada permukaannya mempunyai muatan listrik, muatan dinetralkan oleh
ion balik (counter ion) dari fase gerak. Fase gerak yang mengandung ion dan
molekul cuplikan ionik bersaing dengan ion-ion itu mendapat tempat pada
permukaan fase diam (Rohman, 2009).
2.2.6 Kromatografi eksklusi
Kromatografi eksklusi adalah metode pemisahan yang tergantung pada
pertukaran molekul terlarut di antara pelarut fase gerak dan pelarut yang sama
dalam pori-pori bahan pengisi kolom. Rentang ukuran pori bahan pengisi kolom
menentukan rentang ukuran molekul pada pemisahan yang terjadi. Alat terdiri
dari kolom kromatografi berisi bahan yang mampu melakukan fraksinasi pada
rentang ukuran molekul yang sesuai dan dapat dikendalikan suhunya. Fase gerak
melewati kolom pada laju aliran yang tetap, baik oleh gravitasi atau menggunakan
pompa yang sesuai (Ditjen POM, 1995).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia
yang diekstraksi mengandung senyawa aktif yang dapat larut dan senyawa yang
tidak larut seperti serat, karbohidrat, protein dan lain-lain. Senyawa aktif yang
13
atsiri, alkaloida, flavonoida dan lain-lain. Menurut Ditjen POM (2000), ada
beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
A. Cara Dingin
1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan (kamar). Maserasi kinetik berarti dilakukan pengadukan yang kontinu.
Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan
penyaringan maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri
dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi
sebenarnya (penetesan/penampungan ekstrak), terus-menerus sampai diperoleh
perkolat yang jumlahnya 1-5 kali jumlah bahan.
B. Cara Panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
14
jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi kinetik (dengan adanya pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum
dilakukan pada temperatur 40-50ºC.
4. Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur pada suhu
96-98ºC) selama waktu tertentu (15-20 menit).
5. Dekoktasi
Dekoktasi adalah infus pada waktu yang lebih lama (≥30 menit) dan
temperatur sampai titik didih air.
2.4 Sterilisasi
Sterilisasi adalah proses penghilangan atau penghancuran semua bentuk
kehidupan mikroba termasuk bakteri, virus, jamur dan spora. Sterilisasi dapat
dicapai dengan penggunaan uap air, panas kering, gas etilen oksida dan
kemosterilizer cair. Sterilitas merupakan suatu dugaan probabilistik, tidak ada
kepastian yang mutlak bahwa suatu item mengandung nol mikroorganisme. SAL
(Sterility Assurance Level) digunakan sebagai ukuran sterilitas. SAL adalah
probabilitas kelangsungan hidup mikroorganisme setelah proses sterilisasi
(Pratiwi, 2008).
Metode sterilisasi dibagi menjadi dua yaitu metode fisik dan metode
kimia. Metode sterilisasi kimia dilakukan dengan menggunakan bahan-bahan
15
panas kering maupun panas basah, radiasi dan filtrasi. Metode sterilisasi panas
merupakan metode yang relatif efisien, dapat dipercaya dan banyak digunakan.
Sterilisasi panas dibedakan menjadi sterilisasi panas kering dan sterilisasi panas
basah. Umumnya untuk bahan yang sensitif terhadap kelembapan digunakan
metode sterilisasi panas kering sedangkan untuk bahan yang resisten kelembapan
digunakan metode sterilisasi panas basah (Pratiwi, 2008) .
2.4.1 Sterilisasi panas kering
Prinsip kerja sterilisasi panas kering adalah menyebabkan denaturasi
protein dan efek toksik akibat kenaikan kadar elektrolit. Ada dua metode
sterilisasi panas kering yaitu (Waluyo, 2010):
1. Pembakaran langsung
Teknik pembakaran langsung merupakan teknik sterilisasi yang tercepat
dan 100% efektif. Caranya adalah dengan membakar peralatan sampai pijar.
2. Pemanasan dengan oven/ Sterilisasi dengan udara panas
Sterilisasi dengan cara ini memerlukan waktu lebih lama dibandingkan
dengan cara pembakaran secara langsung, caranya adalah dengan memanaskan
udara dalam oven dimana suhunya dapat mencapai 160-180ºC selama 1-2 jam.
2.4.2 Sterilisasi panas basah
Sterilisasi panas basah dapat dilakukan dengan perebusan menggunakan
air atau dengan menggunakan autoklaf (Pratiwi, 2008):
1. Perebusan menggunakan air
Teknik sterilisasi perebusan menggunakan air mendidih 100ºC selama 10
menit, efektif untuk sel-sel vegetatif dan spora eukariot.
16
Teknik sterilisasi ini menggunakan temperatur di atas 100ºC dilakukan
dengan uap, alat serupa pressure cooker dengan pengatur tekanan dan klep
pengaman. Prinsip autoklaf adalah terjadinya koagulasi yang lebih cepat dalam
keadaan basah dibandingkan keadaan kering.
2.5 Uraian Bakteri
Bakteri adalah makhluk hidup yang sangat kecil dan hanya dapat dilihat
dengan mikroskop (Irianto, 2006). Ukuran bakteri bervariasi baik penampang
maupun panjangnya, tetapi pada umumnya penampang bakteri adalah sekitar
0,7-1,5 µm dan panjangnya sekitar 1-6 µm . Walaupun bentuknya bermacam-macam,
tetapi pada dasarnya strukturnya terdiri dari atas dinding sel, membran sitoplasma,
sitoplasma, serta inti sel (Dzen, dkk., 2003).
Gambar 2.1 Struktur bakteri
2.5.1 Morfologi dan struktur bakteri
Menurut Irianto (2006), berdasarkan bentuk morfologinya bakteri
17 1. Bakteri berbentuk bulat (bola)
Bakteri berbentuk bulat atau bola dinamakan kokus (coccus), dapat
dibedakan atas monokokus (Neisseria gonorrhoeae), diplokokus (Diplococcus
pneumoniae), sarkina, streptokokus dan stafilokokus.
2. Bakteri berbentuk batang
Bakteri yang berbentuk batang dinamakan basilus (bacillus), bentuk
basillus dapat dibedakan atas basil tunggal (Salmonella typhi), diplobasil dan
streptobasil (Bacillus anthracis).
3. Bakteri berbentuk melilit
Bakteri berbentuk melilit dinamakan spirillum atau spiral, ada tiga macam
[image:34.595.115.513.409.499.2]bentuk spiral yaitu spiral (Spirillum), vibrio (Vibrio cholerae) dan spirochaeta.
Gambar 2.2 Bentuk umum sel dan rangkaian sel bakteri
Keterangan gambar: 1) monokokus; 2) diplokokus; 3) stafilokokus; 4) streptokokus; 5) sarsina; 6) bakteri batang; 7) spiral (ulir); dan 8) vibrio. (Sumber:Schlegel,1994)
Bakteri tersusun atas dinding sel dan isi sel. Dinding sel adalah struktur
bakteri yang berfungsi untuk mempertahankan bentuk bakteri, menentukan sifat
pewarnaan, antigenisitas maupun patogenisitas bakteri. Struktur dinding sel
bakteri gram positif berbeda dengan bakteri gram negatif. Bakteri gram positif
dinding selnya mengandung polisakarida yang disebut asam teikhoat yang
18
gram negatif kandungan peptidoglikan pada dinding selnya lebih sedikit, oleh
karenanya bakteri gram negatif lebih peka terhadap pengaruh mekanik. Selain
peptidoglikan, dinding sel bakteri gram negatif juga mengandung
lipopolisakarida, fosfolipid dan lipoprotein yang berperan dalam proses masuknya
[image:35.595.118.504.232.487.2]bahan-bahan dari luar sel ke dalam sel (Dzen, dkk., 2003).
Gambar. 2.3 Dinding sel bakteri gram positif dan gram negatif
2.5.2 Fase pertumbuhan bakteri
Menurut Pratiwi (2008), fase pertumbuhan bakteri meliputi empat fase,
yaitu:
1. Fase lag
Fase lag merupakan fase adaptasi, yaitu fase penyesuaian mikroorganisme
pada suatu lingkungan baru. Ciri fase ini adalah tidak adanya peningkatan jumlah
sel, yang ada hanyalah peningkatan ukuran sel. Lama fase lag tergantung pada
19 2. Fase log (fase eksponensial)
Fase ini merupakan fase dimana mikroorganisme tumbuh dan membelah
pada kecepatan maksimum, tergantung pada genetika bakteri, sifat media dan
kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang
bertambah secara eksponensial.
3. Fase stasioner
Pertumbuhan bakteri berhenti pada fase ini dan terjadi keseimbangan
antara jumlah sel yang membelah dengan jumlah sel yang mati, karena pada fase
ini terjadi akumulasi produk buangan yang toksik.
4. Fase kematian
Pada fase ini jumlah sel yang mati meningkat, faktor penyebabnya adalah
[image:36.595.145.477.416.659.2]ketidaktersediaan nutrisi dan akumulasi produk buangan yang toksik.
Gambar 2.4 Grafik pertumbuhan bakteri
2.5.3 Pengaruh faktor lingkungan pada pertumbuhan
20 bakteri meliputi:
1. Suhu (Temperatur)
Menurut Dzen, dkk. (2003), seperti halnya makhluk hidup tingkat tinggi,
untuk pertumbuhannya bakteri perlu suhu tertentu. Atas dasar suhu yang
diperlukan untuk tumbuh, bakteri dapat dibagi beberapa golongan sebagai berikut:
- Bakteri Psikofil yaitu bakteri yang dapat hidup pada temperatur 0-30ºC.
Temperatur optimal adalah 25ºC.
- Bakteri Mesofil yaitu bakteri yang dapat hidup pada temperatur 25-40ºC.
Temperatur optimal adalah 37ºC.
- Bakteri Termofil yaitu bakteri yang dapat hidup pada temperatur 50-60ºC..
2. pH
Bakteri untuk pertumbuhannya memerlukan pH tertentu, namun pada
umumnya bakteri memiliki jarak pH antara 6,5-7,5 namun beberapa spesies dapat
tumbuh dalam keadaan sangat asama tau sangat alkali (Dzen, dkk., 2003).
3. Tekanan osmosis
Medium yang baik bagi pertumbuhan bakteri ialah medium isotonis
terhadap isi sel bakteri. Jika bakteri ditempatkan dalam suatu larutan hipertonis
terhadap isi sel, maka bakteri akan mengalami plasmolisis yaitu terlepasnya
sitoplasma dalam membran sel. Sebaliknya bila bakteri ditempatkan dalam sutau
larutan hipotonis maka dapat menyebabkan pecahnya sel bakteri karena masuknya
cairan ke dalam sel (Irianto, 2006).
4. Radiasi
Sumber utama radiasi untuk mikroorganisme di bumi adalah sinar
21
sinar inframerah dan gelombang radio (Pratiwi, 2008).
5. Oksigen
Bakteri dibagi menjadi empat golongan berdasarkan kebutuhannya
terhadap oksigen yaitu: Aerobik (membutuhkan oksigen), Anaerobik (tidak
membutuhkan oksigen), Anaerobik falkutatif (tumbuh pada keadaan aerobik dan
anaerobik) dan mikroaerofilik (baik tumbuh bila sedikit oksigen) (Dzen, dkk.,
2003).
6. Nutrisi
Sumber zat makanan (nutrisi) bagi bakteri diperoleh dari senyawa karbon,
nitrogen, sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi,
seng, tembaga dan kobalt), vitamin, air untuk fungsi metabolik dan
pertumbuhannya (Pratiwi, 2008).
2.5.4 Bakteri Bacillus cereus
Menurut Dwidjoseputro (1978), klasifikasi bakteri Bacillus cereus adalah
sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Bacillaceae
Marga : Bacillus
Jenis : Bacillus cereus
Bacillus cereus adalah bakteri gram positif, berbentuk batang (basil),
bersifat anaerob fakultatif, biasanya bersifat mesofilik tumbuh pada suhu antara
22
di tanah, air, abu dan olahan makanan. Bacillus cereus juga dapat membentuk
spora (endospora), spora Bacillus cereus lebih tahan pada panas kering daripada
pada panas lembab dan dapat bertahan lama pada produk yang kering. Selnya
berbentuk batang besar (bacillus) dan sporanya tidak membengkakkan
sporangiumnya. Spora Bacillus cereus lebih tahan pada panas kering daripada
pada panas lembab dan dapat bertahan lama pada produk yang kering. Selnya
berbentuk batang besar (bacillus) dan sporanya tidak membengkakkan
sporangiumnya (Rohman, 2009).
Gambar 2.5 Koloni Bacillus cereus Gambar 2.6 Spora Bacillus cereus
Bakteri inimenghasilkan enterotoksin yang dapat menimbulkan keracunan
lewat makanan. Masa inkubasi berbeda-beda, berkisar 2-6 jam setelah menyantap
makanan yang mengandung toksin. Gejala keracunan ini timbul mendadak,
mencakup diare berat, nyeri perut, mual dan terkadang muntah (Arisman, 2009).
Selain itu juga dapat menyebabkan infeksi lokal pada mata, endokarditis,
meningitis dan pneumonia (Jawetz, dkk., 2005).
Keracunan akan timbul jika seseorang menelan makanan atau minuman
yang mengandung bakteri atau bentuk sporanya, kemudian bakteri bereproduksi
[image:39.595.114.297.319.448.2]23
yang telah mengandung toksin tersebut. Ada dua tipe toksin yang dihasilkan oleh
Bacillus cereus, yaitu toksin yang menyebabkan diare (disebabkan oleh protein
dengan berat molekul besar) dan toksin yang menyebabkan muntah atau emesis
[image:40.595.114.513.220.493.2](disebabkan oleh peptida tahan panas) (Arisman, 2009).
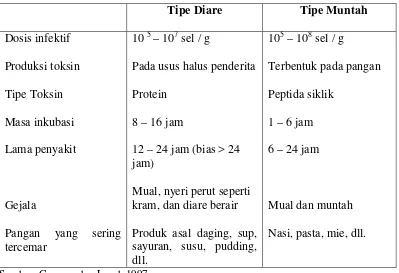
Tabel 2.2 Karakteristik penyakit akibat Bacillus cereus
Tipe Diare Tipe Muntah
Dosis infektif Produksi toksin Tipe Toksin Masa inkubasi Lama penyakit Gejala
Pangan yang sering tercemar
10 5 – 107 sel / g
Pada usus halus penderita
Protein
8 – 16 jam
12 – 24 jam (bias > 24 jam)
Mual, nyeri perut seperti kram, dan diare berair
Produk asal daging, sup, sayuran, susu, pudding, dll.
105 – 108 sel / g
Terbentuk pada pangan
Peptida siklik
1 – 6 jam
6 – 24 jam
Mual dan muntah
Nasi, pasta, mie, dll.
Sumber: Granum dan Lund, 1997.
2.5.5 Bakteri Escherichia coli
Menurut Dwidjoseputro (1978), klasifikasi bakteri Escherichia coli
sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Enterobacteriaceae
Marga : Escherichia
24
Escherichia coli yaitu bakteri berbentuk batang yang termasuk dalam
famili Enterobacteriaceae, merupakan bakteri gram negatif, tidak membentuk
spora, anaerob fakultatif, mesofilik, pH 4,4-8,5 dan merupakan penghuni normal
[image:41.595.190.436.193.355.2]usus (Arisman, 2009).
Gambar 2.7 Koloni Escherichia coli
Escherichia coli merupakan salah satu penyebab infeksi, masa inkubasi
berlangsung selama 12 jam hingga 3 hari. Gejala timbul 18-24 jam setelah
menyantap makanan yang tercemar, berupa nyeri dan diare, terkadang disertai
demam dan muntah (Arisman, 2009). Escherichia coli dapat menyebabkan diare
melalui dua mekanisme yaitu (Volk dan Wheeler, 1989):
1. Dengan memproduksi enterotoksin yang secara tidak langsung menyebabkan
kehilangan cairan.
2. Dengan invasi yang sebenarnya lapisan epitelium dinding usus, sehinnga
menyebabkan peradangan dan kehilangan cairan
Bakteri ini menjadi patogen jika jumlah bakteri ini dalam saluran
pencernaan meningkat atau berada di luar usus, yaitu menghasilkan enterotoksin
yang menyebabkan beberapa kasus diare. Escherichia coli berasosiasi dengan
25
infeksi oleh Escherichia coli bergantung pada tempat infeksi dan tidak dapat
dibedakan dengan gejala infeksi yang disebabkan oleh bakteri lain (Jawetz, dkk.,
2005).
Menurut Jawetz, dkk. (2005), beberapa penyakit yang disebabkan oleh
Escherichia coli yaitu :
1. Infeksi saluran kemih
Escherichia coli merupakan penyebab infeksi saluran kemih pada kira-kira
90 % wanita muda. Gejala dan tanda-tandanya antara lain sering kencing, disuria,
hematuria, dan piuria. Nyeri pinggang berhubungan dengan infeksi saluran kemih
bagian atas.
2. Diare
Escherichia coli yang menyebabkan diare banyak ditemukan di seluruh
dunia, diklasifikasikan oleh ciri khas sifat-sifat virulensinya, dan setiap kelompok
menimbulkan penyakit melalui mekanisme yang berbeda. Ada lima kelompok
galur Escherichia coli yang patogen, yaitu :
a. Escherichia coli Enteropatogenik (EPEC)
EPEC penyebab penting diare pada bayi, khususnya di negara
berkembang. EPEC sebelumnya dikaitkan dengan wabah diare pada anak-anak di
negara maju. EPEC melekat pada sel mukosa usus kecil.
b. Escherichia coli Enterotoksigenik (ETEC)
ETEC penyebab yang sering dari “diare wisatawan” dan penyebab diare
pada bayi di negara berkembang. Faktor kolonisasi ETEC yang spesifik untuk
manusia menimbulkan pelekatan ETEC pada sel epitel usus kecil.
26
EIEC menimbulkan penyakit yang sangat mirip dengan shigelosis.
Penyakit yang paling sering pada anak-anak di negara berkembang dan para
wisatawan yang menuju negara tersebut. Galur EIEC bersifat non-laktosa atau
melakukan fermentasi laktosa dengan lambat serta bersifat tidak dapat bergerak.
EIEC menimbulkan penyakit melalui invasinya ke sel epitel mukosa usus.
d. Escherichia coli Enterohemoragik (EHEK)
EHEK menghasilkan verotoksin, dinamai sesuai efek sitotoksisnya pada
sel vero, suatu ginjal dari monyet hijau Afrika.
e. Escherichia coli Enteroagregatif (EAEC)
EAEC menyebabkan diare akut dan kronik pada masyarakat di negara
berkembang.
3. Sepsis
Bila pertahanan inang normal tidak mencukupi, Escherichia coli dapat
memasuki aliran darah dan menyebabkan sepsis.
4. Meningitis
Escherichia coli dan Streptokokus adalah penyebab utama meningitis pada
bayi. Escherichia coli merupakan penyebab pada sekitar 40% kasus meningitis
neonatal.
2.5.6 Bakteri Salmonella typhi
Menurut Dwidjoseputro (1978), klasifikasi bakteri Salmonella typhi yaitu:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
27 Marga : Salmonella
Jenis : Salmonella typhi
Salmonella typhi merupakan bakteri berbentuk batang, tidak membentuk
spora, gram negatif, anaerob fakultatif, tumbuh pada suhu 15-41ºC (suhu optimum
[image:44.595.192.434.222.383.2]37,5 ºC) dan pH pertumbuhan 6-8 (Karsinah, dkk., 1994).
Gambar 2.8 Koloni Salmonella typhi
Salmonella typhi merupakan penyebab infeksi utama pada manusia dan
organisme ini hampir selalu masuk melalui jalan oral, biasanya dengan
mengkontaminasi makanan atau minuman. Infeksi terjadi setelah 8-48 jam setelah
menelan makanan yang telah tercemar, gejala yang timbul berupa sakit kepala,
muntah dan diare (Jawetz, dkk., 2005).
Salmonella typhi merupakan penyebab demam typoid dengan gejala
demam, rasa tidak enak badan, sakit kepala, bradycardia dan konstipasi. Demam
typoid adalah penyakit infeksi sistemik yang bisa disebabkan oleh Salmonella enteric
serotype typhi. Bakteri ini ditularkan melalui konsumsi makanan atau minuman yang
terkontaminasi atau dari feces dan urin orang yang terinfeksi. Gejala awalnya dimulai
dengan demam ringan tetapi akan progresif dan sering berkelanjutan sehingga 39ºC
28
2.6 Pengujian Aktivitas Antimikroba
Pengukuran aktivitas antimikroba dapat dilakukan dengan metode dilusi
atau metode difusi.
1. Metode Dilusi
Metode ini bertujuan untuk mengukur MIC (Minimum Inhibitory
Concentration) atau KHM (Kadar Hambat Minimum) dan MBC (Minimum
Bactericidal Concentration) atau KBM (Kadar Bunuh Minimum). Cara yang
dilakukan adalah dengan membuat seri pengenceran agen antimikroba pada
medium cair yang ditambahkan dengan mikroba uji. Larutan uji agen antimikroba
pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji
ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut
selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba uji ataupun
agen antimikroba dan diinkubasi selama 18-24 jam. Media cair yang tetap
terlihat jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
2. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar. Prinsip
metode ini adalah mengukur zona hambatan pertumbuhan bakteri yang terjadi
akibat difusi zat yang bersifat sebagai antibakteri di dalam media padat melalui
pencadang. Daerah hambatan pertumbuhan bakteri adalah daerah jernih di sekitar
cakram. Luas daerah hambatan berbanding lurus dengan aktivitas antibakteri,
semakin kuat daya aktivitas antibakterinya maka semakin luas daerah hambatnya
(Jawetz, dkk., 2005).
Menurut Pratiwi (2008), ada beberapa metoda difusi agar yaitu sebagai
29 a. Metode disc diffusion (tes Kirby& bauer)
Metode disc diffusion untuk menentukan aktivitas agen antimikroba. Pada
metode ini digunakan piringan yang berisi agen antimikroba diletakkan pada
media Agar yang telah ditanami mikroorganisme yang akan berdifusi pada media
Agar tersebut. Area jernih mengindikasikan adanya hambatan pertumbuhan
mikroorganisme oleh agen antimikroba pada permukaan media Agar.
b. Metode E-test
Metode E-test digunakan untuk mengestimasi KHM. Pada metode ini
digunakan strip plastik yang mengandung agen antimikroba dari konsentrasi
terendah hingga tertinggi dan diletakkan pada permukaan media agar yang telah
ditanami bakteri. Pengamatan dilakukan pada daerah jernih yang menunjukkan
konsentrasi antimikroba yang menghambat pertumbuhan bakteri.
c. Metode Ditch-plate
Pada metode ini agen antimikroba diletakkan pada parit yang dibuat
dengan cara memotong media agar dalam petri pada bagian tengah secara
membujur dan bakteri digoreskan ke arah parit yang berisi agen antimikroba.
d. Metode Cup-plate
Metode ini dilakukan dengan membuat sumur sedemikian rupa pada
media agar yang telah ditanami mikroorganisme dan pada sumur tersebut diberi
agen antimikroba yang akan diuji dengan berbagai konsentrasi dan diinkubasi
pada suhu 370C selama 18-24 jam, kemudian diamati diameter zona hambat
disekitar sumur.
e. Metode Gradient-plate
30
teoritis bervariasi dari 0 hingga maksimal. Media agar dicairkan dan larutan uji
ditambahkan. Campuran kemudian dituang ke dalam cawan petri dan diletakkan
dalam posisi miring. Nutrisi kedua selanjutnya dituang diatasnya, kemudian
diinkubasi selama 24 jam, selanjutnya mikroba uji digoreskan pada arah mulai
dari konsentrasi tinggi ke rendah.
2.7 Diare
Diare adalah buang air besar dengan frekuensi yang tidak normal
(meningkat) dan konsistensi tinja yang lebih lembek atau cair (Suharyono, 1986).
Diare merupakan penyakit yang disebabkan oleh infeksi mikroorganisme meliputi
bakteri, virus, parasit, protozoa dan penularan terjadi secara oral. Diare dapat
mengenai semua kelompok umur dan berbagai golongan sosial serta erat
hubungannya dengan lingkungan yang tidak higienis (Agtini, 2011).
Menurut Suharyono (2008), mikroorganisme penyebab diare yaitu:
1. Virus
Virus penyebab diare antara lain Enterovirus (virus polio, virus coxsackie,
virus ECHO), Adenovirus dan Reovirus.
2. Bakteri patogen
Bakteri patogen penyebab diare antara lain Escherichia coli, Salmonella
typhi, Shigella dysenteriae, vibrio cholerae, Clostridium perfrigens,
staphylococcus dan Bacteroides.
3. Bakteri tidak patogen
Bakteri tidak patogen yang dapat menyebabkan diare antara lain
Staphylococcus albus, Streptococcus anhaemolyticus, Streptococcus faecalis,
31 4. Parasit
Parasit penyebab diare antara lain Candida, Giardia lamblia, Entamoeba,
Trichiuris, Trichomonas dan Hymenolepis.
Kuman penyebab diare masuk lewat makanan yang biasanya disebabkan
oleh kebersihan dan kehigienisan yang tidak terjaga. Dampak yang ditimbulkan
oleh diare adalah dehidrasi, hipokalemi, hipokalsemi, hiponatremi, asidosis
bahkan kematian. Dehidrasi merupakan masalah yang sangat berat dalam diare,
karena dehidrasi dalam jumlah besar dapat mengganggu proses metabolisme dan
keterlambatan dalam pemberian pertolongan dapat menyebabkan kematian
(Yamin, dkk., 2008).
Menurut Suharyono (2008), diare dibedakan menjadi dua jenis yaitu:
1. Diare Akut
Diare akut adalah diare karena infeksi usus yang bersifat mendadak dan
berlangsung dalam waktu kurang dari 2 minggu.
2. Diare Kronik
Diare kronik adalah diare karena infeksi usus yang bersifat menahun dan
berlangsung lebih dari 2 minggu.
Diare akut diklasifikasikan secara klinis dan patofisiologis menjadi diare
non inflamasi dan diare inflamasi. Diare inflamasi disebabkan invasi bakteri dan
sitotoksin di kolon dengan menimbulkan sindroma disentri yaitu diare yang
disertai lendir dan darah. Sedangkan diare non inflamasi disebabkan oleh
enterotoksin yang mengakibatkan diare cair dengan volume besar tanpa lendir dan
darah (Zein, dkk., 2004).
32 yaitu:
a. Diare tanpa dehidrasi
Tanda diare tanpa dehidrasi yaitu keadaan secara umum baik, mata
normal, minum biasa dan turgor pada kulit kembali dengan cepat.
b. Diare dehidrasi ringan/sedang
Tanda diare dengan dehidrasi ringan/sedang yaitu keadaan gelisah, rewel,
mata cekung, rasa haus meningkat atau ingin minum banyak dan turgor pada kulit
kembali lambat.
c. Diare dehidrasi berat
Tanda diare dehidrasi berat yaitu keadaan lesu, lunglai, atau tidak sadar,
mata cekung, tidak bisa minum atau malas minum dan turgor pada kulit kembali
sangat lambat (lebih dari 2 detik).
Menurut Kemenkes RI (2011), kegiatan pencegahan penyakit diare yang
benar dan efektif dapat dilakukan dengan cara sebagai berikut:
1. Memberikan ASI ekslusif selama 6 bulan dan diteruskan sampai 2 tahun
2. Memberikan makanan pendamping ASI sesuai umur
3. Memberikan air minum yang sudah direbus dan menggunakan air yang bersih
4. Mencuci tangan dengan air dan sabun sebelum dan sesudah buang air besar
5. Buang air besar di jamban
33
BAB III
METODE PENELITIAN
Penelitian ini dilakukan dengan metode eksperimental meliputi
pengambilan dan pengolahan sampel, karakterisasi, skrining fitokimia, pembuatan
ekstrak dan fraksi-fraksinya, uji pola kromatografi dengan KLT dan KKt, uji
aktivitas antibakteri dengan menggunakan metode difusi agar. Parameter yang
diamati yaitu besarnya diameter daya hambat pertumbuhan bakteri. Penelitian
dilakukan di Laboratorium Fitokimia dan Laboratorium Mikrobiologi Fakultas
Farmasi Universitas Sumatera Utara.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas,
autoklaf (Fisons), blender (Philips), eksikator, freeze dryer (Modulio), hot plate
(Fisons), inkubator (Memmert), laminar air flow cabinet (Astec HLF 1200L),
lemari pengering, lemari pendingin (Toshiba), neraca kasar (Sun), neraca listrik
(Vibra AJ), oven (Memmert), penangas air (Yenaco), pencadang kertas, pipet
mikro (Eppendorf), rotary evaporator (Haake D), spektofotometer visibel
(Shimadzu) dan tanur (Ney M).
3.1.2 Bahan-bahan
Bahan-bahan kimia yang digunakan pada penelitian ini kecuali dinyatakan
lain adalah berkualitas pro analisis yaitu asam asetat anhidrat, asam sulfat pekat,
34
eter, etilasetat, isopropanol, kalium iodida, kloroform, metanol, n-heksana, serbuk
seng, serbuk magnesium, timbal (II) asetat, toluen, NaCl, nutrien agar (NA), plat
silika gel F254, kertas saring Whatmann No.1 dan air suling. Biakan bakteri yang
digunakan adalah Bacillus cereus KTCC 1661, Escherichia coli ATCC 8939 dan
Salmonella typhi ATCC 19943.
3.2 Pembuatan Larutan Pereaksi
3.2.1 Pereaksi Liebermann-Bourchard
Sebanyak 5 ml asam asetat anhidrida dicampurkan secara perlahan dengan
5 ml asam sulfat pekat tambahkan etanol hingga 50 ml (Wagner dkk, 1984).
3.2.2 Pereaksi Dragendorff
Sebanyak 8 gram bismut nitrat ditimbang, dilarutkan dalam 20 ml asam
nitrat pekat, lalu pada wadah lain dilarutkan 27,2 gram kalium iodida dalam 50 ml
air suling. Kemudian kedua larutan dicampurkan dan didiamkan sampai memisah
sempurna, ambil larutan jernih dan encerkan dengan air suling hingga 100 ml
(Depkes RI, 1995).
3.2.3 Pereaksi asam sulfat 2 N
Sebanyak 5,556 ml asam sulfat pekat diencerkan dengan air suling
secukupnya hingga volume 100 ml (Depkes RI, 1995).
3.2.4 Pereaksi Mayer
Sebanyak 1,359 gram raksa (II) klorida dilarutkan dalam air suling hingga
60 ml, pada wadah lain sebanyak 5 gram kalium iodida dilarutkan dalam 10 ml air
suling. Kemudian kedua larutan dicampurkan dan ditambahkan air suling hingga
35
3.2.5 Pereaksi Bouchardat
Sebanyak 4 gram kalium iodida dilarutkan dalam air suling, kemudian
sebanyak 2 gram iodium dilarutkan dalam larutan kalium iodida dan dicukupkan
dengan air suling hingga 100 ml (Depkes RI, 1995).
3.2.6 Pereaksi Molish
Sebanyak 3 gram α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.2.7 Pereaksi besi (III) klorida 1%
Sebanyak 1 gram besi (III) klorida ditimbang, dilarutkan dalam air suling
sehingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.2.8 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 gram kristal natrium hidroksida ditimbang, dilarutkan
dalam air suling sehingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.2.9 Pereaksi asam nitrat 0,5 N
Sebanyak 3,125 ml asam nitrat pekat diencerkan dengan air suling hingga
100 ml (Depkes RI, 1995).
3.2.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas CO2
hingga 100 ml (Depkes RI, 1995).
3.3 Penyiapan Sampel
3.3.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa
36
digunakan adalah buah petai berwarna hijau dan masih segar, dibeli di Pasar
Simpang Limun kelurahan Sudirejo H kecamatan Medan Kota Kotamadya
Medan.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Penelitian Biologi Lembaga Ilmu
Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Pengolahan sampel
Buah petai dikumpulkan, dicuci bersih dengan air mengalir, ditiriskan,
dipisahkan bagian kulit dan biji buah petai. Bagian kulit yang telah dipisahkan di
potong-potong kecil, ditimbang berat basah, kemudian dikeringkan di dalam
lemari pengering dengan suhu 40-50oC (sampel dianggap kering bila diremas
rapuh dan hancur), lalu ditimbang berat kering, diserbukkan dengan menggunakan
blender dan disimpan di dalam wadah kering terlindung dari cahaya matahari.