KARAKTERISASI DAN ISOLASI SENYAWA
STEROID/TRITERPENOID DARI ECENG GONDOK
(Eichhornia crassipes (Mart.) Solms)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
JESAYA AFRIYANTA
NIM 091501141
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI DAN ISOLASI SENYAWA
STEROID/TRITERPENOID DARI ECENG GONDOK
(Eichhornia crassipes (Mart.) Solms)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
JESAYA AFRIYANTA
NIM 091501141
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI DAN ISOLASI SENYAWA
STEROID/TRITERPENOID DARI ECENG GONDOK
(
Eichhornia crassipes
(Mart.) Solms)
OLEH:JESAYA AFRIYANTA NIM 091501141
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 03 Februari 2015
Disetujui Oleh :
Pembimbing I, Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. Dr. Panal Sitorus, M.Si., Apt. NIP 195709091985112001 NIP 195310301980031002
Pembimbing II, Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dra.Aswita Hafni Lubis, M.Si., Apt. Dra. Herawaty Ginting, M.Si., Apt. NIP 195304031983032001 NIP 195112231980032002
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Medan, Maret 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan
rahmat dan anugerah-Nya sehingga penulis menyelesaikan skripsi ini yang
berjudul “Karakterisasi dan Isolasi Senyawa Steroid/triterpenoid Dari Eceng
Gondok (Eichhornia crassipes (Mart.) Solm)”. Skripsi ini diajukan sebagai salah
satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara.
Penulis mengucapkan terimakasih yang sebesar-besarnya kepadaIbu Dr.
Marline Nainggolan, M.S., Apt., dan ibu Dra.Aswita Hafni Lubis, M.Si., Apt.,
selaku pembimbing yang telah memberikan waktu, bimbingan, motifasi, dan
nasehat selama penelitian dan penulisan skripsi ini berlangsung. Bapak Prof. Dr.
Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas
Sumatera Utara yang telah memberikan bantuan dan fasilitas selama masa
pendidikan.BapakDr. Panal Sitorus, M.Si., Apt., ibu Dra. Herawaty Ginting,
M.Si., Apt., dan ibuDra. Suwarti Aris, M.Si., Apt., selaku dosen penguji yang
telah memberikan masukan, kritikan, arahan, dan saran dalam penyusunan skripsi
ini.Ibu Dra. Aswita Hafni Lubis, M.Si., Apt.,selaku Kepala Laboratorium
Fitokimia Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan
fasilitas, petunjuk dan membantu selama penelitian.Ibu Dr. Marline Nainggolan,
M.S., Apt.,selaku pembimbing akademis yang selalu memberikan bimbingan dan
motifasi selama masa pendidikan, Bapak Dr. Kasmirul Ramlan Sinaga, M.S.,
Apt., serta Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera
Penulismengucapkanterimakasih yang takterhinggadanpenghargaan yang
tuluskepada Ibunda Dra. Christinawati br. Bangun, Alm Ayahanda S. Kembaren,
adik Nais Ranita Kembaren, A.md. dan Use Memorinta Kembaren, A.mf, Terima
kasih atas doa, dorongan dan pengorbanan baik moril maupun materil dalam
penyelesaian skripsi ini.
Penulis menyadari skripsi ini masih belum sempurna, oleh karena
itudiharapkan kritik dan saran yang membangun untuk penyempurnaannya.
Harapan saya semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan
kefarmasian.
.
Medan, 03Februari 2015 Penulis,
KARAKTERISASI DAN ISOLASI SENYAWA
STEROID/TRITERPENOID DARI ECENG GONDOK
(
Eichhornia crassipes
(Mart.) Solms)
AbstrakEceng gondok merupakan tumbuhan yang hidup mengapung diperairan dan digunakan masyarakat untuk mengobati bengkak, biduran, tenggorokan panas, dan pelancar air seni. Disamping itu eceng gondok dapat digunakan sebagai antibakteri, antikoagulan, antiinflamasi, antijamur, antioksidan dan antikanker serta senyawa steroid/triterpenoid mempunyai aktifitas fisiologi untuk pengobatan penyakit diabetes, ganguan mensturasi, patukan ular, ganguan kulit, kerusakan hati, malaria, antifungi, insektisida, antibakteri atau antivirus. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia dan skrining fitokimiaserta isolasi steroid/triterpenoid dari ekstrak n-heksan eceng gondoksecara spektrofotometri ultraviolet (uv) dan spektrofotometri inframerah (IR).
Terhadap serbuk simplisia daun eceng gondok dilakukan karakterisasi dan skrining fitokimia, selanjutnya dimaserasi dengan pelarut n-heksan selama 24 jam sambil sesekali diaduk dan ampas dimaserasi kembali sampai diperoleh maserat yang memberikan hasil negatif terhadap Liebermann-Bouchard (LB). Maserat digabung dan dipekatkan dengan rotary evaporator (± 40ºC). Selanjutnya dianalisa secara kromatografi lapis tipis (KLT) dengan fase gerak n-heksan-etilasetat dengan beberapa perbandingan, sebagai penampak bercak peraksi LB. Ekstrak heksan dipisahkan dengan KLT preparatif menggunakan fase gerak n-heksan-etilasetat, kemudian diuji kemurniannya secara KLT satu arah dan KLT dua arah. Isolat murni yang diperoleh diidentifikasi dengan alat spektrofotometer UV dan IR.
Hasil karakterisasi serbuk simplisia diperoleh kadar air 6,64%; kadar sari larut dalam air 12,52%; kadar sari larut dalam etanol 16,86%; kadar abu total 19,62% dan kadar abu tidak larut asam 0,68%. Hasil skrining fitokimia diperoleh golongan alkaloid, glikosida, saponin, flavonoid, dan steroid/triterpenoid. Hasil KLT ekstrak n-heksan diperoleh fase gerak n-heksan-etilasetat (75:25) yang memberikan pemisahan yang terbaik, hasil KLT preparatif diperoleh isolat murni Rf 0,79 berwarna merah ungu dengan LB. Isolat memberikan absorbansi maksimum pada panjang gelombang 206,80 nm dengan spektrofotometer UV dan hasil spektrofotometer IR menunjukkan adanyagugus –OH, –CH, –CH2,–CH3, –
C=C, –C–O.
CHARACTERIZATION AND ISOLATION OF
STEROIDS/TRITERPENOIDS FROM WATER HYACINTH
(
Eichhorniacrassipes
(Mart.) Solms)
Abstract
Water hyacinth is a plant that live floating in waters and used by society to heal swollen, suffer from rush, warm throat and urine girder. Despitefully water hyacinth can be used as antibiotic, anticoagulant, anti-inflammatory, antifungal, antioxidants and anticancer. Steroids/triterpenoids has physiology activities to treat diabetes, menstrual disorders, pecks snake, skin disorders, liver damage, malaria and many compounds that work as antifungal, insecticide, antibacterial or antiviral. The purpose of this research is to know simplex characterization, phytochemistry screening and isolation of steroids/triterpenoids from water hyacinth n-hexana extractwith ultraviolet and infra redspecthophotometric.
Characacterization and phytochemistry screening were done to simplex powder, then macerated with n-hexane solvent for 24 hours and stirred at the same time occasionally and the dregs maserated again until obtained give negative result against Liebermann-Bouchard (LB). The maserat sheafed and concentrated with rotary evaporator (± 40˚C), then analyzed with Thin Layer Chromatography (TLC) with mobile phase n-hexane-ethyl acetate using some comparisons, as the seen spotting, Liebermann-Burchard reagent was used. n-hexane extract separated with preparative TLC using mobile phase n-hexane-ethyl acetate and purity test done with one way TLC and two way TLC. The pure isolate identify using ultraviolet and infra redspechtophotometer.
The result from powder simplex characterization obtained water degree 6.64%; the essence degree of water soluble 12.52%; the essence degree of ethanol soluble 16.68%; total ash degree 19.62%; the ash degree of acid insoluble 0.68%. From the result of phytochemistry screening obtained alkaloids, glycosides, saponins, steroids/triterpenoids. The outcome of n-hexane extract TLC obtained mobile phase n-hexane-ethyl acetate (75:25) which gives the best separation, from the result of preparative TLC obtained pure isolate with Rf degree 0.79 colored purple red with LB. The isolates gives maximum absorbance in wavelength 206.80 nm with UV spechtophotometer and the result of IR spektrofotometer indicate the presence of clusters –OH, -CH, -CH2, -CH3, -C=C, -C-O groups.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 LatarBelakang ... 1
1.2 RumusanMasalah ... 2
1.3 Hipotesis ... 2
1.4 TujuanPenelitian ... 2
1.5 ManfaatPenelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Tumbuhan ... 4
2.1.1 Morfologi tumbuhan ... 4
2.1.2 Sistematika tumbuhan ... 4
2.1.3 Nama daerah ... 5
2.1.5 Khasiat ... 5
2.2 Uraian Kandungan Kimia Tumbuhan ... 5
2.2.1 Alkaloid ... 5
2.2.2 Flavonoid ... 6
2.2.3Saponin ... 6
2.2.4 Tanin ... 7
2.2.5Glikosida ... 7
2.2.6 Glikosida antrakuinon ... 9
2.2.7 Steroid/triterpenoid ... 9
2.3Metode Ekstraksi ... 12
2.4Kromatografi ... 14
2.4.1 Kromatografi lapis tipis ... 15
2.4.2 Kromatografi lapis tipis preparatif ... 17
2.4.3 Kromatografi lapis tipisdua arah ... 18
2.5 Spekrofotometri ... 18
2.5.1Spektrofotometri Ultraviolet ... 18
2.5.2Spektrofotometri Infrared ... 19
BAB III METODE PENELITIAN ... 21
3.1Alat dan Bahan ... 21
3.1.1Alat ... 21
3.1.2Bahan ... 21
3.2 PembuatanLarutanPereaksi ... 22
3.2.1 Pereaksi Liebermann-Burchard ... 22
3.2.3 PereaksiBouchardat ... 22
3.2.4 PereaksiMolish ... 22
3.2.5 PereaksiMeyer …... 22
3.2.6 Pereaksibesi (III) klorida 10% ... 22
3.2.7 Pereaksiasamsulfat 2 N ... 23
3.2.8 PereaksiDragendorff ... 23
3.2.9 Pereaksiasam nitrat 0,5 N ... 23
3.2.10 Pereaksitimbal (II) asetat 0,4 M ... 23
3.3PengambilandanPengolahan Sampel ... 23
3.3.1 Pengambilansampel ... 23
3.3.2 Identifikasitumbuhan... 23
3.3.3 Pengolahan sampel ... 24
3.4KarakterisasiSimplisia... 24
3.4.1 Penetapankadar air ... 24
3.4.2 Penetapankadar sari yang larutdalam air... 25
3.4.3 Penetapankadar sari yang larutdalametanol ... 25
3.4.4 Penetapankadarabu ... 25
3.4.5 Penetapankadarabutidaklarutdalamasam ... 26
3.5SkriningFitokimia ... 26
3.5.1 Pemeriksaan glikosida ... 26
3.5.2 Pemeriksaan alkaloida ... 27
3.5.3Pemeriksaan triterpenoid/steroid ... 27
3.5.4 Pemeriksaan saponin ... 27
3.5.6 Pemeriksaan tanin ... 28
3.5.7Pemeriksaan glikosida antrakuinon ... 28
3.6PembuatanEkstrak n-heksan ... 28
3.7Analisis Ekstrak n-heksan Secara KLT ... 29
3.8IsolasiSenyawaTriterpenoidSecara KLT Preparatif ... 30
3.9 Uji Kemurnian Isolat ... 30
3.9.1 Uji kemurnian isolat dengan KLT satu arah …... 30
3.9.2 Uji kemurnian isolat dengan KLT dua arah ... 31
3.10 Karakterisasi Isolat ... 31
3.10.1 Karakterisasi isolat denganspektrofotometer ultraviolet ... ... 31
3.10.2Karakterisasi isolat dengan spektrofotometer inframerah ... ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
BAB V KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR GAMBAR
Gambar Halaman
2.1 Gambar struktur Kuersetin ... 8
2.2 Gambar strukturSinigrin ... 8
2.3 Gambar struktur Nikleosidin ... 8
2.4 Gambar struktur Aloin ... 9
2.5 Gambar struktur kimia isopren ... 10
2.6 Gambar struktur kimia triterpenoid ... 11
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakterisasi serbuk simplisia daun
eceng gondok... 34
4.2 Hasil skrining fitokimia dari eceng gondok ... 35
4.3 Harga Rf ekstrak n-heksan daun eceng gondok denganbeberapa perbandingan fase gerak ... 36
4.4 Data hasil analisis KLT ekstrak n-heksandaun ecenggondok 37
4.5 Tabel hasil analisis spektrofotometri inframerah isolat hasilisolasi ... 38
Lampiran Halaman
1 Identifikasi tumbuhan ... 43
2 Gambar tumbuhan eceng gondok, daun dan serbuk simplisia Eichhornia crassipes (Mart.)Solms ... 44
3 Gambar mikroskopik sebuk simplisia daun eceng gondok
Eichhornia crassipes (Mart.) Solms... 46
4 Bagan kerja penelitian ... 47
5 Gambar kromatogram ekstrak n-heksan daun eceng gondok 50
6 Gambar kromatogram dari ekstrak n-heksan ... 51
7 Gambar kromatogram KLT dua arah ... 52
8 Gambar alat spektrofotometer yang digunakan analisis isolat murni ... 53
9 Gambar spektrum senyawa triterpenoid hasil isolasi dengan spektrofotometer ultraviolet ... 54
10 Gambar spektrum senyawa triterpenoid hasil isolasi dengan spektrofotometer inframerah ... 55
BAB I
PENDAHULUAN
1.1Latar Belakang
Eceng gondok (Eichhornia crassipes) merupakan salah satu jenis
tumbuhan yang hidup mengapung diperairan. Perkembangbiakannya yang begitu
cepat menyebabkan tanaman eceng gondok dapat berupa gulma dibeberapa
wilayah perairan Indonesia (Rachmawaty,dkk., 2013).Populasi yang begitu
melimpah perlu diatasi, salah satu cara pengendaliannya adalah memanfaatkan
eceng gondok (Ahmed, dkk., 2012).
Tumbuhan eceng gondok bagi masyarakat digunakan untuk mengobati
bengkak, biduran, tenggorokan panas, dan pelancar air seni (Widyaningrum,
2011). Disamping itu daun eceng gondok telah di teliti dapat digunakan sebagai
obat antibakteri (Jayanthi, 2013), antikoagulan (Rafiqua, 2012), antiinflamasi
(Jayanthi, 2013), antijamur, antioksidan, dan antikanker (Ahmed, 2011).
Penelitian sebelumnya telah mengisolasi senyawa alkaloid dan flavonoid (Lata
dan Dubey, 2010).
Metabolit sekunder dapat tersebar di seluruh organ tubuh tumbuhan seperti
daun, akar, batang, bunga, kulit, dan buah.Ada beberapa penggolongan metabolit
sekunder, yaitu alkaloid, flavonoid, steroid/triterpenoid, tanin, glikosida dan
antrakuinon. (Harbone, 1987).Senyawa steroid/triterpenoid menunjukkan berbagai
macam aktifitas fisiologi yang telah digunakan untuk antifungi, insektisida,
antibakteri atau antivirus (Robinson, 1995).
dkk., 2010), antitumor (Lage, dkk., 2010), dan aktifitas sitotoksik terhadap sel
pangkreatik (Sanchez, dkk., 2010)
Berdasarkan uraian diatas, maka dilakukan penelitian tentang karakterisasi
simplisia, skrining fitokimia dan isolasi steroid/triterpenoid dari ekstrak n-heksan
daun eceng gondok. Ekstrak n-heksan daun eceng gondok dipisahkan dengan cara
kromatografi lapis tipis (KLT) dan dipisahkan dengan KLT preparatif. Isolat yang
diperoleh diidentifikasi dengan spektrofotometer UV dan IR.
1.2Perumusan Masalah
1. Apakah simplisia eceng gondok dapat ditentukan karakteristiknya?
2. Apakah senyawa steroid/triterpenoid dari ekstrak n-heksan daun eceng
gondok dapat diisolasi dengan KLT preparatif?
3. Apakah senyawa steroid/triterpenoid hasil isolasi dapat diidentifikasi
secara spektrofotometri UV dan spektrofotometri IR?
1.3 Hipotesis
1. Karakteristik simplisia eceng gondok dapat ditentukan dengan
menggunakan prosedur karakterisasi.
2. Senyawa steroid/triterpenoid dari ekstrak n-heksan daun eceng gondok
dapat diisolasi dengan KLT preparatif.
3. Hasil isolasi senyawa steroid/triterpenoid dapat diidentifikasi secara
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk :
1. Mengetahui karakteristik simplisia eceng gondok.
2. Mengisolasi senyawa steroid/triterpenoid yang terdapat dalam ekstrak
n-heksan daun eceng gondok.
3. Mengidentifikasi senyawa steroid/triterpenoid hasil isolasi secara
spektrofotometri UV dan spektrofotometri IR.
1.5 Manfaat Penelitian
Manfaatpenelitianiniadalahuntukmenambahinformasitentang karakteristik
simplisia, golongan senyawa steroid/triterpenoid (isolat) hasil isolasidari
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Morfologi tumbuhan
Eceng gondok (Eichhornia crassipes(Mart.) Solms) merupakan tanaman
yang hidup terapung pada air yang memiliki aliran tenang, termasuk terna air
dengan tinggi 30 – 50 cm,memiliki bunga berwarna biru-lembayung muda dengan
lapisan berwarna kuning di bagian atas daun mahkota (Heyne, 1995; Putera,
2012). Daun eceng gondok berwarna hijau terang dengan permukaan daun licin,
tangkai berbentuk silinder memanjang kadang-kadanng mencapai 1 meter dengan
diameter 1-2 cm, berisi serat dan mengandung banyak air (Harahap, dkk., 2003).
Memiliki buah berbentuk kotak, beruang tiga, dan berwarna hijau. Biji berbentuk
bulat, hitam, akarnya serabut dan berwarna hitam (Widyaningrum, 2011).
2.1.2 Sistematika tumbuhan
Sistematika dari tumbuhan eceng gondok adalah sebagai berikut (Putera,
2012; Foundation, 2011) :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Monocotyledoneae
Suku :Pontederiaceae
Marga : Eichhornia
Jenis : Eichhornia crassipes (Mart.) Solms
Nama lokal : Eceng gondok.
Eceng gondok di Indonesia dikenal dengan nama yang berbeda-beda
seperti kelipuk (Palembang), ringgak (Lampung), ilung-ilung (Dayak), mampau
(Kutai), bengok (Banten), kembang bopong, weweyan (Jawa), tumpe (Manado)
(Widyaningrum, 2011).
2.1.4 Kandungan kimia
Kandungan kimia eceng gondok terdiri atas 60% selulosa, 8%
hemiselulosa dan 17% lignin (Ahmed, dkk., 2012), juga senyawa alkaloid,
antrakuinon, flavonoid, flobatanin, glikosida jantung, saponin, steroid, terpenoid,
kuinon, tanin dan polifenol (Lata dan Dubey, 2010; Widyaningrum, 2011)
2.1.5 Khasiat
Eceng gondok (Eichhornia crassipes (Mart.) Solms.) berkhasiat untuk
mengobati bengkak, biduran, tenggorokan panas dan pencahar air seni. Sebanyak
± 10 gram tangkai daun ditumbuk halus lalu ditempelkan pada bagian yang
bengkak, untuk tenggorokan yang terasa panas, biduran, bisul, dan abses
(Widyaningrum, 2011). Eceng gondok juga berguna sebagai antiinflamasi
(Jayanthi, 2013), antikoagulasi (Rafiqua, 2012), antibakteri (Jayanthi., 2013),
antijamur, antioksidan, antikanker (Ahmed, 2011).
2.2 Uraian Kandungan Kimia Tumbuhan
2.2.1 Alkaloida
Menurut Harborne (1987), alkaloid adalah senyawa bersifat basa yang
mengandung satu atau lebih atom nitrogen yang terletak dalam sistem siklik yang
mempunyai aktivitas fisiologi yang dapat digunakan dalam bidang
kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa cairan pada suhu
kamar.
Manfaat alkaloid dalam bidang kesehatan antara lain adalah memicu
sistem saraf, menaikkan atau menurunkan tekanan darah, dan melawan infeksi
mikroba (Widi dan Indriati, 2007).
2.2.2 Flavonoida
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3
-C6, artinya, kerangka karbonnya terdiri atas dua gugus C6 (cincin benzene
tersubstitusi) disambungkan oleh rantai alifatik tiga karbon. Beberapa fungsi
flavonoid bagi tumbuhan adalah sebagai pengatur tumbuh, pengatur fotosintesis
(Robinson, 1995).
Senyawa flavonoida memiliki aktifitas antioksidan, antibiotik
(Roslizawaty, dkk., 2013) antikoagulan, antimikrobadan antiinflamasi(Lata dan
Dubey, 2010). Makanan yang kaya flavonoid digunakan untuk mengobati
penyakit-penyakit seperti kanker dan penyakit jantung (Heinrich, dkk., 2005).
2.2.3 Saponin
Saponin adalah sekelompok senyawa dengan struktur triterpenoid yang
mengikat satu atau lebih gula sehingga memiliki sisi hidrofil dan lipofil dengan
penggocokan akan menimbulkan buih (Harbone, 1987).
Saponin mula-mula diberi nama demikian karena sifatnya yang
menyerupai sabun (bahasa Latin sapo berarti sabun). Saponin adalah senyawa
aktif permukaan yang kuat yang menimbulkan busa jika dikocok dalam air dan
pada konsentrasi yang rendah sering menyebabkan hemolisis sel darah merah.
saponin bekerja sebagai antimikroba. Saponin merupakan senyawa berasa
pahitdan mengakibatkan iritasi terhadap selaput lender (Robinson, 1995).
Uji saponin adalah dengan mengocok ekstrak alkohol air dari tumbuhan
dalam tabung reaksi, maka akan terbentuk busa yang bertahan lama pada
permukaan cairan (Harborne, 1987).
2.2.4 Tanin
Tanin adalah kelompok polifenol yang larut dalam air dengan berat
molekul antara 500-3000 g/mol. Berwarna putih kekuning-kuningan sampai
coklat terang tergantung sumber tanin tersebut (Ismarani, 2012). Kondisi larutan
basa, beberapa turunan tanin dapat mengabsorbsi oksigen contohnya katekin
(Fajriati, 2006).
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae
terdapat khusus dalam jaringan kayu. Senyawa tanin dapat bereaksi dengan
protein membentuk kopolimer mantap yang tak larut dalam air. Pada
kenyataannya, sebagian besar tumbuhan yang banyak bertanin dihindari oleh
hewan pemakan tumbuhan karena rasanya yang sepat. Secara kimia terdapat dua
jenis tanin yaitu tanin terkondensasi dan tanin terhidrolisis (Harborne,1987).
2.2.5 Glikosida
Glikosida adalah suatu golongan senyawa bila dihidrolisis akan terurai
menjadi gula (glikon) dan senyawa lain (aglikon atau genin). Umumnya glikosida
mudah terhidrolisis oleh asam mineral atau enzim. Hidrolisis oleh asam
memerlukan panas, sedangkan hidrolisis oleh enzim tidak memerlukan panas
Sacara kimia dan fisiologi, glikosida alam cenderung dibedakan berdasarkan
bagian aglikonnya (Robinson, 1995).
Berdasarkan ikatan antara glikon dan aglikon(Sirait, 2007), glikosida dapat
dibedakan menjadi :
a. Tipe O-glikosida, ikatan antara bagian glikon dengan aglikon melalui
jembatan O
Gambar 2.1Kuersetin
b. Tipe S-glikosida, ikatan antara bagian glikon dengan aglikon melalui jembatan
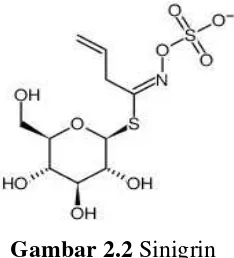
S. Contoh: sinigrin
Gambar 2.2 Sinigrin
c. Tipe N-glikosida, ikatan antara bagian dari glikon dengan aglikon melalui
jembatan N. Contoh: nikleosidin
d. Tipe C-glikosida, ikatan antara bagian glikon dengan aglikon melalui
jembatan C. Contoh: aloin.
Gambar 2.4 Aloin
2.2.6 Glikosida antrakuinon
Golongan kuinon alam terbesar terdiri dari antrakuinon. Beberapa
antrakuinon merupakan zat warna penting dan yang lainnya sebagai pencahar
(Robinson, 1995).
2.2.7 Steroid/triterpenoid
Triterpenoid adalah kelompok senyawa turunan terpenoid dengan
kerangka karbon yang dibangun oleh enam C-5 yang disebut unit isopren.
Triterpenoid yang tersebar luas adalah triterpenoid pentasiklik (Nassar, dkk.,
2010).
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualen. Senyawa tersebut mempunyai struktur siklik yang relatif kompleks,
kebanyakan merupakan suatu alkohol, aldehid atau asam karboksilat. Senyawa
triterpenoidmerupakan komponen aktif dalam tumbuhan obat yang telah
digunakan untuk penyakit termasuk diabetes, gangguan menstruasi, patukan ular,
kali bertitik leleh tinggi dan aktif optik, dapat dibagi atas 4 kelompok senyawa
yaitu triterpen sebenarnya, steroid, saponin dan glikosida jantung (Harborne,
1987). Struktur kimia isopren dapat dilihat pada Gambar 2.5.
Gambar 2.5 Struktur kimia isopren
Pembagian triterpenoid berdasarkan jumlah cincin yang terdapat pada
struktur molekulnya (Robinson, 1995), antara lain:
a. Triterpenoid asiklik, yaitu triterpenoid yang tidak mempunyai cincin tertutup
dalam cincin molekulnya, contohnya skualen.
b. Triterpenoid trisiklik, yaitu triterpenoid yang mempunyai tiga cincin tertutup
dalam cincin molekulnya, contohnya ambrein.
c. Triterpenoid tetrasiklik, yaitu triterpenoid yang mempunyai empat cincin
tertutup dalam cincin molekulnya, contohnya lanosterol.
d. Triterpenoid pentasiklik, yaitu triterpenoid yang mempunyai lima cincin
tertutup dalam cincin molekulnya, contohnya α-amirin. Contoh struktur kimia
triterpenoid dapat dilihat pada Gambar 2.6.
skualen ` ambrein
lanosterol α-amirin
Gambar 2.6 Struktur kimia triterpenoid
Senyawa triterpenoid menunjukkan aktifitas farmakologi seperti antivirus,
antibakteri, antiinflamasi, inhibisi terhadap sintesis kolesterol, antikanker (Nassar,
dkk., 2010), antitumor (Lage, dkk., 2010) dan aktifitas sitotoksik terhadap sel
pangkreatik (Sanchez, dkk., 2010)
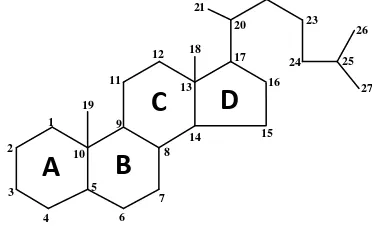
Steroid adalah senyawa yang kerangka dasarnya sistem cincin
siklopentana perhidrofenanten (Harborne, 1987). Dapat dilihat pada Gambar 2.7
berikut ini:
Gambar 2.7 Struktur dasar steroid dan sistem penomorannya
OH OH H OH H 8 9 5 6 7 10
A
B
C
D
4 1 2 3 12 11 1914 15 16 13 17 18 20 21 22 23
24 25 26
Senyawa steroid dahulu dianggap sebagai senyawa yang hanya terdapat
pada hewan tetapi sekarang ini makin banyak senyawa steroid yang ditemukan
dalam tumbuhan (fitosterol). Fitosterol merupakan senyawa steroid yang berasal
dari tumbuhan. Senyawa fitosterol yang biasa terdapat pada tumbuhan tinggi yaitu
sitosterol, stigmasterol dan kampesterol (Harborne, 1987).
Senyawa golongan steroid memiliki sifat fisiologis dan bioaktif yang
penting, misalnya berperan dalam pembentukan struktur membran, pembentukan
hormon kelamin dan hormon pertumbuhan serta pembentukan vitamin D, sebagai
penolak dan penarik serangga dan sebagai antimikroba (Robinson, 1995).
2.3 Metode Ekstraksi
Ekstraksi adalah penyarian komponen aktif dari suatu jaringan tumbuhan
atau hewan dengan menggunakan pelarut yang cocok, biasa digunakan untuk
memisahkan dua zat berdasarkan perbedaan kelarutan (Handa, dkk.,
2008).Beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
A. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengocokan atau pengadukan pada
temperatur kamar. Penyarian zat aktif dengan cara merendam serbuk simplisia
dalam cairan penyari yang sesuai pada temperatur kamar, tertutup dengan wadah
yang gelap dan terlindung dari cahaya. Maserasi dengan pengadukan secara
terus-menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan
panambahan pelarut setelahdilakukan penyaringan terhadap maserat pertama dan
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu
baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperature kamar. Proses penyarian simplisia dengan jalan melewatkan pelarut
yang sesuai secara lambat pada simplisia dalam suatu percolator. Zat berkhasiat
tertarik seluruhnya dan biasanya dilakukan untuk zat berkhasiat yang tahan
ataupun tidak tahan pemanasan (Depkes RI, 2000).
B. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik. Ekstraksi refluks digunakan untuk
mengekstraksi bahan-bahan yang tahan terhadap pemanasan.
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50°C.
3. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang
selalu baru, dilakukan dengan menggunakan alat soklet sehingga menjadi
ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit (Depkes RI, 2000).
2.4 Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan perbedaan
perpindahan dari komponen-komponen senyawa diantara dua fase yaitu fase diam
(dapat berupa gas atau zat cair) dan fase gerak (dapat berupa gas atau zat cair).
Fase gerak membawa zat terlarut melalui fase diam sehingga terpisah dari zat
terlarut lainnya yang terelusi lebih awal atau paling akhir karena perbedaan
afinitas antara masing-masing zat terlarut dengan fase diam (Sundari, 2010). Fase
diam berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan,
jika zat cair dikenal sebagai kromatografi partisi (Sastrohamidjojo, 1991).
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari
fase diam, yang berupa zat padat atau cair. Jika fase diam berupa zat padat disebut
kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Sistem
kromatografi terbagi menjadi 4 macam, yaitu:
1. Fase gerak zat cair - fase diam padat (kromatografi serapan):
- Kromatografi lapis tipis
- Kromatografikolom
2. Fase gerak gas -fase diam padat
- Kromatografi gas - padat
3. Fase gerak zat cair -fase diam zat cair (kromatografi partisi)
- Kromatografi kertas
- Kromatografi gas - cair
- Kromatografi kolom kapiler
Pemisahan dengan kromatografi tergantung pada kenyataan bahwa
senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan fase diam
dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap
senyawa yang lain (Sastrohamidjojo, 1991).
2.4.1 Kromatografi lapis tipis
Kromatografi lapis tipis merupakan metode pemisahan campuran analit
dengan mengelusi analit melalui suatu lempeng kromatografi lalu melihat
komponen/analit yang terpisah dengan penyemprotan atau pengecatan (Abdul dan
Gholib, 2007).
Fase diam dalam KLT berupa padatan penyerap yang dihasilkan pada
sebuah plat datar dari gelas, plastik, atau alumina sehingga membentuk lapisan
tipis dengan ketebalan tertentu. Fase diam atau penyerap yang bisa digunakan
sebagai pelapis plat adalah silika gel (SiO2), selulosa dan alumina (Al2O3)
kebanyakan penyerap yang digunakan adalah silika gel (Sundari, 2010).
Pendeteksian bercak hasil pemisahan dapat dilakukan dengan beberapa
cara, untuk senyawa tak berwarna cara yang paling sederhana adalah dilakukan
pengamatan dengan sinar ultraviolet (Stahl, 1985). Beberapa senyawa organik
bersinar atau berfluorosensi jika disinari dengan sinar ultraviolet gelombang
pendek (254 nm) atau gelombang panjang (366 nm), jika dengan cara itu senyawa
tidak dapat dideteksi maka harus dicoba disemprot dengan pereaksi yang
membuat bercak tersebut tampak yaitu pertama tanpa pemanasan, kemudian bila
a. Fase diam (Lapisan penyerap)
Fase diam yang digunakan dalam KLT merupakan penyerap berukuran
kecil dengan diameter partikel antara 10-30 µm. Semakin kecil ukuran rata-rata
partikel fase diam dan semakin sempit kisaran ukuran fase diam maka semakin
baik kinerja KLT dalam hal efisiensi dan resolusinya. Penyerap yang paling sering
digunakan adalah silika dan serbuk selulosa, sementara mekanisme sorpsi yang
utama pada KLT adalah partisi dan adsorpsi. Lapisan tipis yang digunakan
sebagai penyerap juga dapat dibuat dari silika yang telah dimodifikasi, resin
penukar ion, gel ekslusi dan siklodekstrin (Rohman, 2007).
b. Fase gerak (Pelarut pengembang)
Pelarut sebagai fasa gerak atau eluen merupakan faktor yang menentukan
gerakan komponen-komponen dalam campuran (Sundari, 2010). Fase gerak yang
digunakan pada KLT dapat dipilih dari pustaka-pustaka, tetapi lebih sering
dengan mencoba-coba. Biasanya fase gerak yang digunakan berisi dua campuran
pelarut organik dan pelarut yag digunakan harus memiliki tingkat kemurnian yang
tinggi sehingga dapat memberikan pemisahan yang baik. Biasanya untuk
memisahkan sterol digunakan campuran pelarut kloroform-aseton (Abdul dan
Gholib, 2012).
c. Harga Rf
Rf atau faktor retardasi didefinisikan sebagai perbandingan antara jarak
yang ditempuh solut dengan jarak yang ditempuh oleh fase gerak. Nilai Rf ini
terkait dengan faktor perlambatan dan nilai ini bukanlah suatu nilai fisika absolut
untuk suatu komponen, meskipun demikian dengan pengendalian kondisi KLT
Nilai maksimum Rf adalah 1 dan nilai minimumnya adalah 0 (Abdul dan Gholib,
2012).
�� = ����������������ℎ�����
����������������ℎ���������
2.4.2 Kromatografi lapis tipis preparatif
Kromatografi lapis tipis (KLT) preparatif merupakan salah satu metode
pemisahan dengan menggunakan peralatan sederhana. Ketebalan penyerap yang
sering dipakai adalah 0,5-2 mm, ukuran plat kromatografi biasanya 20x20 cm.
Pembatasan ketebalan lapisan dan ukuran plat sudah tentu mengurangi jumlah
bahan yang dapat dipisahkan dengan KLT preparatif. Penyerap yang paling umum
digunakan adalah silika gel (Gritter, dkk., 1991).
Penotolan cuplikan dilakukan dengan melarutkan cuplikan dalam sedikit
pelarut. Cuplikan ditotolkan berupa pita dengan jarak sesempit mungkin karena
pemisahan tergantung pada lebar pita. Pelarut yang digunakan adalah berupa
pelarut campuran dari pelarut organik dengan tujuan untuk memperoleh
pemisahan yang lebih baik. Pemisahan pelarut berdasarkan kepolaritasnya,
sehingga akan diperoleh sistem pengembang yang cocok (Gritter, dkk., 1991).
Pengembangan plat KLT preparatif dilakukan dalam bejana kaca yang
dapat menampung beberapa plat. Bejana dijaga tetapjenuh dengan pelarut
pengembang dengan bantuan kertas saring yang diletakkan berdiri disekeliling
permukaan bagian dalam bejana. Pita ditampakkan dengan cara yang tidak
merusak maka senyawa yang tidak berwarna dengan penyerap dikerok dari plat
kaca. Cara ini berguna untuk memisahkan campuran beberapa senyawa sehingga
2.4.3 Kromatografi lapis tipis dua arah
KLT dua arah atau KLT dua dimensi ini bertujuan untuk meningkatkan
resolusi sampel ketika komponen-komponen solut mempunyai karakteristik kimia
yang hampir sama, karena nilai Rf juga hampir sama, selain itu dua sistem fase
gerak yang sangat berbeda dapat digunakan secara berurutan pada suatu campuran
tertentu sehingga memungkinkan untuk melakukan pemisahan analit yang
mempunyai tingkat polaritas yang hampir sama (Rohman, 2009).
KLT dua arah dilakukan dengan melakukan penotolan sampel disalah satu
sudut lapisan lempeng tipis dan mengembangkannya sebagaimana biasa dengan
eluen pertama. Lempeng kromatografi selanjutnya dipindahkan dari chamber yang
menggunakan eluen kedua sehingga pengembangan dapat terjadi pada arah kedua
yang tegak lurus dengan arah pengembangan yang pertama. Suksesnya
pemisahantergantung pada kemampuan untuk memodifikasi selektifitas eluen
kedua dibandingkan dengan selektifitas eluen pertama (Rohman, 2009).
2.5 Spektrofotometri
2.5.1 Spektrofotometri ultraviolet
Spektrum ultraviolet adalah suatu gambaran yang menyatakan hubungan
antara panjang gelombang atau frekuensi serapan terhadap intensitas serapan
(transmitansi atau adsorbansi).Serapan cahaya oleh molekul dalam daerah
spektrum ultra violet tergantung pada struktur elektronik dari molekul yang
bersangkutan. Spektrum ulraviolet biasanya digunakan untuk molekul dan ion
anorganik atau kompleks di dalam larutan. Sinar ultraviolet berada pada panjang
gelombang 200-400 nm (Dachriyanus, 2004). Spektrofotometer UV pada
1. Menentukan jenis kromofor, ikatan rangkap terkonjugasi dan auksokrom dari
suatu senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang
maksimum suatu senyawa.
3. Mampu menganalisis senyawa organik secara kuantitatif dengan
menggunakan hukum Lambert-Beer (Sastrohamidjojo, 1991).
Ketika suatu atom atau molekul menyerap cahaya maka energi tersebut
akan menyebabkan tereksitasinya elektron pada kulit terluar ke tingkat energi
yang lebih tinggi. Tipe eksitasi tergantung panjang gelombang cahaya yang
diserap. (Dachriyanus, 2004).
2.5.2 Spektrofotometri sinar inframerah
Spektra inframerah mengandung banyak serapan yang dihubungkan
dengan sistem vibrasi yang berinteraksi dalam molekul dan karena mempunyai
karakteristik yang unik untuk setiap molekul maka dalam spektrum memberikan
pita-pita serapan yang karakteristik juga (Sastrohamidjojo, 1991).
Spektrofotometer inframerah pada umumnya digunakan untuk menentukan
gugus fungsi yang tedapat dalam suatu senyawa organik dan untuk mengetahui
informasi tentang struktur suatu senyawa organik dengan membandingkan daerah
sidik jarinya. Daerah spektra infrared dibagi dalam tiga kisaran yaitu IR dekat
(12500-4000 cm-1), IR tengah (4000-400 cm-1) dan IR jauh (400-10 cm-1)
(Gandjar dan Rohman, 2012). Daerah IR tengah merupakan daerah yang
digunakan untuk penentuan gugus fungsi (Dachriyanus, 2004).
merupakan basis dari interpretasi spektrum inframerah. Ada beberapa syarat yang
harus dipenuhi dalam menginterpretasikan spektrum, yaitu:
1. Spektrum harus tajam dan jelas serta memiliki intensitas yang tepat
2. Spektrum harus berasal dari senyawa yang murni
3. Spektrofotometer harus dikalibrasi sehingga akan menghasilkan pita atau
serapan pada bilangan gelombang yang tepat
4. Metode penyiapan sampel harus dinyatakan jika digunakan pelarut, maka jenis
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental meliputi
pengumpulan dan pengolahan sampel, karakterisasi simplisia, skrining fitokimia,
pembuatan ekstrak, analisis fraksi n-heksan yang dilanjutkan dengan isolasi
senyawa steroid/triterpenoid mengunakanKLT preparatif. Isolat yang diperoleh
diuji kemurniannya dengan KLT satu arah dan dua arah, karakterisasi isolat
dengan spektrofotometri UV dan IR.
3.1. Alat-alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas (Iwaki
Pyrex), blender (Philips),chamber, eksikator, hair dryer (Maspion), mikroskop
(Olympus), neraca analitik (Vibra AJ), neraca kasar (Homeline),oven listrik
(Memmert), penangas air (Yenaco), penguap vakum putar (Stuart), rotary
evaporator (Boeci 461), seperangkat alat kromatografi lapis tipis, seperangkat alat
penentu kadar air (Pyrex), spektrofotometer inframerah (Shimadzu),
spektrofotometer ultraviolet (Shimadzu) dan tanur (Nabertherm).
3.1.2 Bahan-bahan
Sampel yang digunakan adalah daun eceng gondok (Eichhornia
crassipes(Mart.) Solms) dan Bahan kimia yang digunakan kecuali dinyatakan lain
adalah berkualitas proanalisa yaitu: amil alkohol, ammonia pekat, asam asetat
anhidrida, asam klorida, asam nitrat, asam sulfat,benzena,besi (III)
metanol,n-heksana,plat pra lapis silika gel F254, raksa (II) klorida, serbuk
magnesium, silika gel 60 H, timbal (II) asetat, toluene dan akuades.
3.2 Pembuatan Larutan Pereaksi
3.2.1Pereaksi Liebermann-Burchard
Sebanyak 5 ml asam asetat anhidrida dicampurkan perlahan-lahan dengan
5 ml asam sulfat pekat tambahkan etanol hingga 50 ml (Wagner, dkk., 1984).
3.2.2 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g kristal natrium hidroksida ditimbang, dilarutkan dalam
air suling sehingga diperoleh larutan 100 ml(Depkes RI, 1995).
3.2.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling dan sebanyak 2 g
iodium dilarutkan dalam larutan kalium iodida dan dicukupkan dengan air suling
hingga 100 ml(Depkes RI, 1995).
3.2.4 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml(Depkes RI, 1995).
3.2.5 Pereaksi Mayer
Sebanyak 1,359 g raksa(II) klorida dilarutkan dalam air suling hingga 60
ml. Pada wadah lain sebanyak 5 gkalium iodida dilarutkan dalam 10 ml airsuling,
kemudian keduanya campur dan ditambahkan air suling hingga 100 ml(Depkes
RI, 1995).
3.2.6 Pereaksi besi (III) klorida 10%
Sebanyak 10 g besi (III) klorida ditimbang, dilarutkan dalam air suling
3.2.7 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
volume 100 ml(Depkes RI, 1995).
3.2.8 Pereaksi Dragendorff
Sebanyak20 ml larutan bismut nitrat P 40% b/v dalam asam nitrat P
dicampur dengan 50 ml kalium iodida P 54,4% b/v, didiamkan sampai memisah
sempurna. Lalu diambil lapisan jernih dan diencerkan dengan air secukupnya
hingga 100 ml (Depkes RI, 1995).
3.2.9 Pereaksi asam nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga
100 ml (Depkes RI, 1995).
3.2.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas CO2
hingga 100 ml (Depkes RI, 1995).
3.3 Pengambilan dan Pengolahan Sampel
3.3.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif tanpa membandingkan
dengan tumbuhan yang sama dari daerah lain. Sampel yang digunakan dalam
penelitian ini adalah daun eceng gondok yang masih segar, yang diambil dari
Jalan Jamin Ginting pasar 2 Padang Bulan, Kelurahan Titi rante, Kecamatan
Medan baru, Kotamadya Medan, Provinsi Sumatera Utara.
3.3.2 Identifikasi tumbuhan
3.3.3 Pengolahan sampel
Eceng gondok disortir dan dipisahkan antara tangkai dan daunnya,
dibersihkan dari pengotoran, dicuci bersih dengan air mengalir,
ditiriskan,dipotong kecil-kecil, dan dikeringkan di lemari pengering pada suhu
50˚C sampel dinyatakan kering bila diremas akan hancur,
kemudiansampeldihaluskan atau diserbukmenggunakan blender dan ditimbang,
selanjutnya disimpan dalam wadah bersih.
3.4 Karakterisasi Simplisia
Karakterisasi simplisia meliputi penetapan kadar air, penetapan kadar sari
yang larut dalam air,penetapan kadar sari yang larut dalam etanol, penetapan
kadarabu total, dan penetapan kadar abu tidak larut dalam asam.
3.4.1 Penetapan kadar air
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, lalu didestilasi selama 2 jam, kemudian toluen dibiarkan mendingin
selama 30 menit, dan dibaca volume air pada tabung penerima dengan ketelitian
0,05 ml. Sebanyak 5 g sampel serbuk simplisia yang telah ditimbang seksama
dimasukkan kedalam labu alas bulat, lalu labu dipanaskan hati-hati selama 15
menit. Kecepatan tetesan diatur lebih kurang 2 detik sampai sebagian air
terdestilasi setelah toluen mendidih, kemudian kecepatan tetesan dinaikkan hingga
4 tetes tiap detik. Saat setelah semua air terdestilasi, bagian dalam pendingin
dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung
penerima dibiarkan mendingin pada suhu kamar. Volume air dibaca dengan
air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen
(WHO, 1992).
3.4.2 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dengan 100 ml
air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) menggunakan labu
bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan
selama 18 jam dan disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam
cawan dangkal berdasarkan rata yang telah ditara. Sisa dipanaskan sampai kering
pada suhu 105oC hingga bobot tetap. Kadar sari yang larut dalam air dihitung
dalam persen terhadap bahan yang telah dikeringkan di udara(Depkes RI, 1995).
3.4.3 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dengan 100 ml
etanol (95%) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6
jam pertama, kemudian dibiarkan selama 18 jam. Saring dengan cepat untuk
menghindarkan penguapan dari etanol, sejumlah 20 ml filtrat diuapkan sampai
kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan
sampai kering pada suhu 105oC hingga bobot tetap. Kadar sari yang larut dalam
etanol dihitung dalam persen terhadap bahan yang telah dikeringkan di
udara(Depkes RI, 1995)
3.4.4 Penetapan kadar abu
Sebanyak 2 g serbuk simplisia yang telah digerus ditimbang seksama,
dimasukkan ke dalam krus porselen yang telah terlebih dahulu dipijar dan ditara,
Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara(Depkes RI,
1995).
3.4.5 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu dididihkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas.
Residu dan kertas saring dipijar sampai bobot tetap. Kadar abu yangtidak larut
dalam asam dihitung terhadap bahan yang telah dikeringkan di udara(Depkes RI,
1995).
3.5 Skrining Fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa
alkaloida,flavonoida,glikosida, antrakinonglikosida, saponin, tanin, dan
steroid/triterpenoid.
3.5.1 Pemeriksaan glikosida
Sebanyak 3g serbuk simplisia ditimbang, disari dengan 30 ml campuran
dari 7 bagian etanol 95% dan 3 bagian air suling, ditambahkan dengan asam
klorida 2 N hingga pH larutan 2, direfluks selama 10 menit, dinginkan dan
disaring. Pada 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II)
asetat 0,4 M dikocok dan didiamkam selama 5 menit, lalu disaring. Filtrat
diekstraksi dengan 20 ml campuran 3 bagian kloroform dan 2 bagian isopropanol,
ini dilakukan sebanyak tiga kali. Kumpulan sari diuapkan pada temperatur tidak
lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan ini digunakan
untuk percobaan berikut: larutan sisa dimasukkan ke dalam tabung reaksi,
Molish kemudian ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding
tabung. Jika terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya
gula(Depkes RI, 1995).
3.5.2 Pemeriksaan alkaloida
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga
percobaan di atas(Depkes RI, 1995).
3.5.3 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia ditimbang, direndam dengan 20
mln-heksana selama 2 jam kemudian disaring, lalu filtrat diuapkan dalam cawan
penguap. Pada sisanya ditambahkan
pereaksiLiebermann-Burchard(LB)(Farnsworth, 1966). Timbulnya warna merah ungu atau hijau biru
menunjukkan adanya steroid/triterpenoid(Harbone, 1987; Robinson, 1995).
3.5.4 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia ditimbang, dimasukkan dalam tabung
reaksi lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik, jika terbentuk buih yang stabil selama tidak kurang dari 10
menit setinggi 1-10 cm dan dengan penambahan 1 tetes asam klorida 2 N buih
3.5.5 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil
alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.6 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, disari dengan 10 ml air suling
selama 15 menit lalu disaring. Filtratnya diencerkan dengan air suling sampai
tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes larutan
pereaksi besi (III) klorida 10 %. Apabila terjadi warna biru atau hijau kehitaman
menunjukkan adanya tanin(Farnsworth, 1966).
3.5.7 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, ditambahkan 5 ml asam sulfat
2 N, dipanaskan sebentar, didinginkan. Ditambahkan 10 ml benzena, dikocok dan
didiamkan, lapisan benzena dipisahkan dan disaring. Lapisan benzena dikocok
dengan 2 ml natrium hidroksida 2 N dan didiamkan. Lapisan air berwarna merah
intensif dan lapisan benzena tidak berwarna menunjukkan adanya glikosida
antrakinon(Depkes RI, 1995).
3.6 Pembuatan Ekstrakn-heksan
Pembuatan ekstrak daun eceng gondok dilakukan dengan cara maserasi
menggunakan pelarut n-heksan. Sebanyak 500 g serbuk simplisia dimasukkan ke
dalam wadah gelas berwarna gelap dan ditambahkan pelarutn-heksan sampai
cahaya sambil sering diaduk. Disaring diperoleh maserat I dan ampas. Ampas
dimaserasi kembali dengan n-heksan sampai terendam sempurna dan dibiarkan
selama 2 hari. Perlakuan dilakukan sampai diperoleh filtrat yang jernih dan
negatif dengan pereaksi Liebermann-Burchard. Seluruh maserat digabungkan dan
diuapkan menggunakan rotary evaporator pada temperatur ± 40oC sampai
diperoleh ekstrak kental.
3.7 Analisis Ekstrak n-Heksan Secara KromatografiLapis Tipis (KLT)
Ekstrak n-heksan dianalisis secara KLT menggunakan plat pra lapis silika
gel F254 dan fase gerak n-heksan-etilasetat dengan perbandingan (90:10), (80:20),
(75:25), (70:30), (60:40), sebagai penampak bercak digunakan pereaksi LB.
Cara kerja:
Ekstrak n-heksana daun eceng gondok ditotolkan pada plat pra lapis
silikal gel F254yang sebelumnya telah diaktifkan, kemudian dimasukkan ke dalam
chamber yang telah jenuh dengan uap pengembang dan ditutup rapat. Sesudah
elusi selesai plat dikeluarkan dan dikeringkan di udara, plat disemprot dengan
larutan penampak bercak pereaksi Liebermann-Burchard(LB) dan dipanaskan
dioven pada suhu 110°C selama 10 menit. Warna bercak yang terjadi diamati dan
dihitung harga Rf-nya.
3.8 Isolasi Senyawa Tritepenoid Secara KLT Preparatif
Isolasi senyawa tritepenoid dilakukan secara KLT preparatif, sebagai fase
gerak digunakan n-heksan-etilasetat (75:25) perbandingan yang memberikan
pemisahan terbaik dan sebagai penampak bercak digunakan pereaksi
Cara kerja:
Ekstrak heksan daun eceng gondok diencerkan dengan pelarut
n-heksana dan ditotolkan pada jarak 1 cm dari tepi bawah plat pra lapis silika gel 60
F254 berukuran 20 x 20 cm yang telah diaktifkan, selanjutnya plat dimasukkan ke
dalam bejana kromatografi yang telah jenuh dengan uap fase gerak, pengembang
dibiarkan naik membawa komponen yang ada. Saat setelah mencapai batas
pengembang plat dikeluarkan dari bejana lalu dikeringkan. Bagian tengah plat
ditutup dengan kaca yang bersih sedangkan pada sisi kanan dan kiri plat
disemprot dengan pereaksi LB. Bercak senyawa steroid/triterpenoid pada sisi kiri
dan kanan dihubungkan, dan yang berada pada bagian tengah plat
dikerokdandikumpulkan. Silika yang mengandung senyawa steroid/triterpenoid
dielusidenganpelarutmetanol, diuapkan dan kristal yang terbentuk direkristalisasi
dengan metanol dingin.
3.9 Uji Kemurnian Isolat
3.9.1 Uji kemurnian isolat dengan KLT satu arah
Terhadap isolat dilakukan uji kemurnian dengan KLT satu arah
menggunakanfase diam plat pra lapis silika gel 60 F254dan dua fase gerak dengan
pelarut dan perbandingan yang berbeda n-heksan-etilasetat (75:25) dan
toluen-etilasetat (90:10) dan sebagai penampak bercak digunakan pereaksi LB.
Cara kerja:
Isolat ditotolkan pada plat pra lapis silika gel 60 F254 yang sebelumnya telah
diaktifkan, kemudian dimasukkan ke dalam bejana kromatografi yang telah jenuh
dengan uap pengembang dan ditutup rapat. Saat sesudah elusi selesai plat
disemprot dengan larutan penampak bercak LB. Warna bercak yang terjadi
diamati dan dihitung harga Rf-nya.
3.9.2 Uji kemurnian isolat dengan KLT dua arah
Terhadap isolat dilakukan uji kemurnian dengan KLT dua arah
menggunakan fase diam plat pra lapis silika gel 60 F254, fase gerak pertama
n-heksan-etilasetat (75:25), fase gerak kedua toluen-etilasetat (90:10), dan sebagai
penampak bercak digunakan pereaksi LB.
Cara kerja:
Isolat ditotolkan pada plat pra lapis silika gel 60 F254 yang sebelumnya telah
diaktifkan, kemudian dimasukkan ke dalam bejana kromatografi yang telah jenuh
uap pengembang pertama dan ditutup rapat.Saat sesudah elusi selesai plat
dikeluarkan dari bejana kromatografi, lalu diputar 90odimasukkan ke dalam
bejana kromatografi yang telah jenuh uap pengembangkedua dan ditutup rapat.
Saat setelah selesai elusi plat dikeluarkan dan dikeringkan di udara, kemudian plat
disemprot dengan larutan penampak bercak pereaksi LB. Warna bercak yang
terjadi diamati dan dihitung harga Rf-nya.
3.10 Karakterisasi Isolat
Karakterisasi senyawa steroid/triterpenoid hasil isolasi dilakukan dengan
spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
3.10.1 Karakterisasi isolat dengan spektrofotometri ultraviolet
Karakterisasi isolat dengan spektrofotometri ultraviolet dilakukan dengan
cara melarutkan senyawa hasil isolasi dengan metanol kemudian diukur
3.10.2 Karakterisasi isolat dengan spektrofotometri inframerah
Karakterisasi isolat dengan spektrofotometi inframerah dilakukan dengan
cara mencampur isolat dengan kalium bromida menggunakan alat mixture
vibrator, kemudian dicetak menjadi pelet dan dimasukkan kedalam alat
spektrofotometer inframerah lalu diukur spektrum inframerah pada bilangan
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Tumbuhan
Identifikasi sampel dilakukan oleh bagian Herbarium Bogoriense Bidang
Botani Pusat Penelitian Biologi LIPI Bogor terhadap tumbuhan eceng gondok
adalah Eichhornia crassipes (Mart.) Solms suku Pontederiaceae. Hasil identifikasi
sampel dapat dilihat pada Lampiran 1 halaman 43.
4.2 Hasil Ekstraksi Serbuk Simplisia
Ekstraksi serbuk simplisia dilakukan secara maserasi menggunakan pelarut
n-heksan, dari 500 g serbuk simplisia setelah diuapkan dengan alat
rotaryevaporator diperoleh ekstrak kental 45 g.
4.3Hasil Karakterisasi Simplisia
Karakterisasi serbuk simplisia daun eceng gondok tidak tercantumkan di
buku Materia Mediaka Indonesia (MMI). Hasil penelitian terhadap penetapan
karakterisasi dari simplisia daun eceng gondok dapat dilihat pada Tabel 4.1 dan
hasil perhitungannya dapat dilihat pada Lampiran 11 halaman 56 .
Kadar air simplisia memenuhi persyaratan umum pada MMI yaitu tidak
lebih dari 10%, karena kadar air yang melebihi persyaratan dapat menyebabkan
terjadinya pertumbuhan jamur. Tujuan penetapan kadar air adalah untuk
memberikan batasan minimal atau rentang tentang besarnya kandungan air dalam
bahan.Penetapan kadar sari yang larut dalam air dilakukan untuk mengetahui
zat yang tersari dalam pelarut antara lain yaitu glikosida, antrakinon glikosida,
sterois/triterpenoid, flavonoid, klorofil dalam jumlah sedikit lemak dan saponin
[image:48.595.116.507.201.339.2](Depkes RI, 1999).
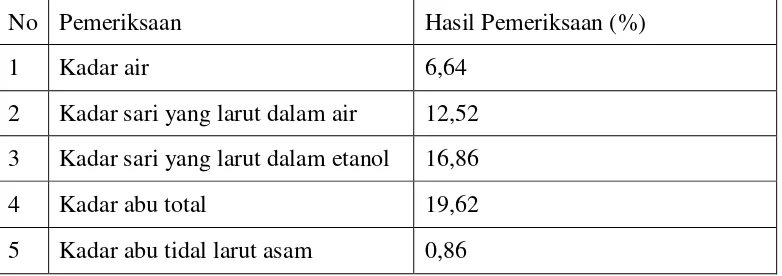
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia daun eceng gondok.
Penetapan kadar abu dilakukan untuk mendestruksi serta menguapkan
senyawa organik dan turunannya sehingga yang tersisa senyawa anorganik,
misalnya logam K, Ca, Na, Pb dan silika sedangkan kadar abu tidak larut asam
untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam misalnya
silika (Depkes RI, 2000). Tujuan penetapan kadar abu untuk memberikan
gambaran kandungan mineral internal dan eksternal yang berasal dari proses awal
sampai terbentuknya ekstrak.
4.4 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia daun eceng gondok
menunjukkan adanya senyawa golongan alkaloid, glikosida, saponin, flavonoid,
dan steroid/triterpenoid.Penentuan golongan senyawa kimia terhadap simplisia
daun eceng gondok dilakukan untuk mendapatkan informasi golongan senyawa
metabolit sekunder yang terdapat di dalamnya.Hasilnya dapat dilihat pada Tabel
4.2.
No Pemeriksaan Hasil Pemeriksaan (%)
1 Kadar air 6,64
2 Kadar sari yang larut dalam air 12,52
3 Kadar sari yang larut dalam etanol 16,86
4 Kadar abu total 19,62
Tabel 4.2 Hasil skrining fitokimia dari simplisia daun eceng gondok.
No. Golongan senyawa Simplisia
1 Alkaloid +
2 Glikosida +
3 Antrakinon glikosida -
4 Saponin +
5 Flavonoid +
6 Tanin -
7 Steroid/triterpen +
Keterangan:
+ = mengandung golongan senyawa, – = tidak mengandung golongan senyawa
Serbuk simplisia daun eceng gondok ditambah dengan pereaksi
Dragendorff memberikan endapan warna jingga kecoklatan, dengan pereaksi
Bouchardat memberikan endapan warna kuning kecoklatan dan dengan pereaksi
Mayer terbentuk endapan putih dan kekeruhan, ini menunjukkan adanya alkaloid
(Depkes RI, 1995). Flavonoid dengan penambahan serbuk Mg, HCl 2 N dan amil
alkohol memberikan warna jingga pada lapisan amil alkohol (Farnsworth, 1966).
Penambahan Liebermann-Burchard memberikan warna hijau
menunjukkan adanya senyawa steroid (Harborne, 1987). Hasil skrining pada tanin
dengan penambahan FeCl3 memberikan warna biru kehitaman yang menunjukan
adanya tanin (Farnsworth, 1966).
Hasil skrining glikosida positif yaitu ditunjukkan dengan penambahan
pereaksi Molish dan asam sulfat pekat, dimana terbentuk cincin ungu. Pereaksi
Molish merupakan pereaksi umum yang digunakan untuk identifikasi adanya gula
dengan tinggi 3 cm dan tidak hilang dengan penambahan HCl 2 N (Depkes RI,
1995).
4.5 Hasil Analisis Ekstrak n-heksan Secara KLT
Analisis senyawa steroid/triterpenoid digunakan KLT dengan fase diam
plat lapis tipis dan fase gerak n-heksan-etilasetat perbandingan (90:10), (80:20),
(75:25), (70:30), dan (60:40), sebagai penampak noda LB. Hasil KLT
n-heksan-etilasetat dengan perbandingan (75:25) memberikan bercak senyawa
steroid/triterpenoid berwarna merah ungu yang lebih dominan dan lebih terang.
Harga Rf dari masing-masing perbandingan fase gerak dapat dilihat pada Tabel
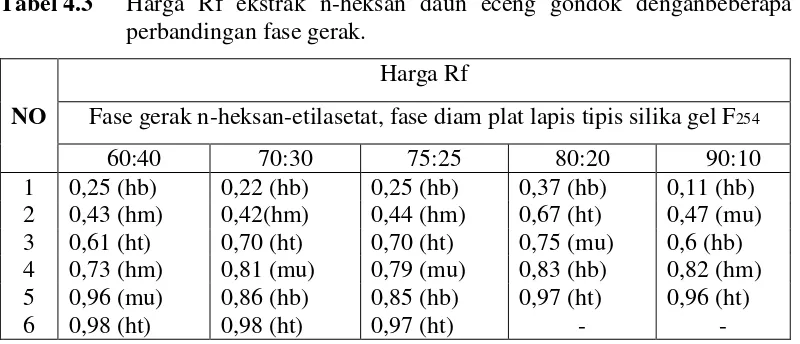
[image:50.595.114.514.384.556.2]4.3 dan pola kromatogram pada Lampiran 5 halaman 50.
Tabel 4.3 Harga Rf ekstrak n-heksan daun eceng gondok denganbeberapa perbandingan fase gerak.
Keterangan : hb = hijau biru, hm = hijau muda, ht = hijau tua, mu = merah ungu
Hasil KLT menunjukkan perbandinngan fase gerak n-heksan-etiasetat
(70:30) dan (75:25) masing-masing memiliki jumlah noda dan variasi harga Rf
yang tidak jauh berbeda,Selanjutnya dilakukan pemisahan terhadap senyawa
steroid/triterpenoid dengan KLT preparatif menggunakan fase diam silika gel 60
F254 dan penampak bercak pereksi LB untuk mendapatkan senyawa
steroid/triterpenoiddalam jumlah lebih banyak. Hasil KLT yang dikerok adalah Rf
NO
Harga Rf
Fase gerak n-heksan-etilasetat, fase diam plat lapis tipis silika gel F254
60:40 70:30 75:25 80:20 90:10
1 0,25 (hb) 0,22 (hb) 0,25 (hb) 0,37 (hb) 0,11 (hb) 2 0,43 (hm) 0,42(hm) 0,44 (hm) 0,67 (ht) 0,47 (mu) 3 0,61 (ht) 0,70 (ht) 0,70 (ht) 0,75 (mu) 0,6 (hb) 4 0,73 (hm) 0,81 (mu) 0,79 (mu) 0,83 (hb) 0,82 (hm) 5 0,96 (mu) 0,86 (hb) 0,85 (hb) 0,97 (ht) 0,96 (ht)
0,79 terlihat pada lampiran 6 halaman 51. Setelah silika hasil kerukan dielusi
dengan metanol dingin.
4.6Hasil Uji Kemurnian Isolat
Hasil uji kemurnian isolat dengan KLT menggunakan fase gerak
n-heksan-etilasetat dengan perbandingan (75:25) dan toluen : n-heksan-etilasetat (90:10) yang
disemprotkan dengan LB, memberikan bercak tunggal berwarna merah ungu
hasilnya dapat dilihat pada Lampiran 7 halaman 51 dan harga Rf dapat dilihat
pada Tabel 4.4.
Tabel 4.4 Data hasil KLT ekstrak n-heksandaun eceng gondok.
No. Perbandingan fase gerak HargaRf Penampak noda LB 1 n-heksan : etilasetat 75: 25 0,79 Merah ungu
Pemeriksaan uji kemurnian KLT dua arah dengan fase gerak pertama
n-heksan-etilasetat (75:25), dan fase gerak kedua toluen-etilasetat (90:10) dengan
penampak bercak pereaksi LB, hasilnya tetap memberikan satu bercak warna
merah ungu dengan harga Rf 0,79. Ini menunjukkan bahwa senyawa
steroid/triterpenoid yang dihasilkan dari KLT preparatif telah murni.
4.7 Hasil Karakterisasi Isolat Dengan Spektrofotometri Ultraviolet Dan Inframerah
Spektrum ultraviolet isolat memberikan panjang gelombang maksimum
pada 206,80 nm, menunjukkan adanya gugus kromofor ᴫ→ᴫ*.(Dachriyanus,
2004).Gambar spektrum ultraviolet isolat dapat dilihat pada Lampiran 9 halaman
54, sedangkan gambar spektrum inframerah isolat dapat dilihat pada Lampiran 10
halaman 55 dan hasil analisis spekrofotometer inframerah isolat dapat dilihat pada
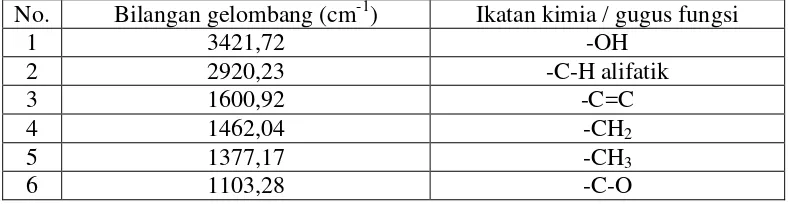
Tabel 4.5Tabel hasil analisis spektrofotometer inframerah isolat hasil isolasi.
No. Bilangan gelombang (cm-1) Ikatan kimia / gugus fungsi
1 3421,72 -OH
2 2920,23 -C-H alifatik
3 1600,92 -C=C
4 1462,04 -CH2
5 1377,17 -CH3
6 1103,28 -C-O
Hasil spektrofotometer inframerah isolat menunjukkan pita serapan yang
melebar pada bilangan gelombang 3421,72 cm-1 menunjukkan adanya gugus –
OH, bilangan gelombang 2920,23 cm-1 dan 2854,65 cm-1 menunjukkan adanya
gugus C-H alifatik. Pita serapan C=C pada bilangan gelombang 1600,92 cm-1.
bilangan gelombang gelombang 1462,04 cm-1 menunjukkan adanya gugus CH2.
Serapan pada bilangan gelombang 1377,17 cm-1 CH3dan pita serapan pada
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
a. Hasil karakterisasi simplisia daun eceng gondok diperoleh kadar air
6,64%, kadar sari yang larut dalam air 12,52%, kadar sari yang larut dalam
etanol 16,86%, kadar abu total 19,62% dan kadar abu yang tidak larut
asam 0,86%.
b. Golongan senyawa kimia simplisia daun eceng gondok adalah, alkaloid,
glikosida, saponin, flavonoid dan steroid/triterpen.
c. Hasil pengukuran spektrum secara spektrofotometri UV untuk isolat
memberikan panjang gelombang absorbsi maksimum 206,80 nm. Hasil
pengukuran spektrofotometri inframerah menunjukkan adanya gugus
C-O,-CH2,-CH3, -C=C,-C-H alifatis dan -OH.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk elusidasi struktur dari
senyawasteroid/triterpenoid yang terdapat dalam ekstrak n-heksandaun eceng
DAFTAR PUSTAKA
Abdul., dan Gholib. (2012). Kimia Farmasi Analisis. Yogyakarta: Pustaka pelajar. Hal. 353, 359.
Ahmed. (2011). Plant signaling and behavior Eichhornia crassipes (Mart) Solm
from water parasite to potential medical remedy. International journal of PharmTech Research. 6(6): 834-836.
Ahmed, A. F., Moahmed A., dan Abdel N. (2012). Pretreatment and enzymic saccharification of water hyacinth cellulose. Carbohydrate polymers 6(6): 834-836.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 3-5, 21.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Hal. 300-304, 306.
Depkes RI. (1999).Cara PengelolaanSimplisia yang Baik. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan. Departemen Kesehatan RI. Hal. 3-4.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Hal. 1-11.
Fajrianti. (2006). Optimasi metode penelitian farmasi. Kalinda, 11(2).
Farnsworth, N. R. (1966). Biological and Phytochemical Screening of Plant.Journal of Pharmaceutical Sciences. 55(3): 262-263.
Fondation, A., F. (2011). Eichhornia crassipes. From http://aquaplant. tamu.edu/image/ plantphotos? Floatingplants/ drawing/ water hyancinth.html.
Gandjar,I.G., dan Rohman, A. (2007). Kimia FarmasiAnalisis. Yogyakarta: PustakaPelajar. Hal. 323, 353-361.
Gritter, R.J., Bobbit, J., dan Schwarting, A. E. (1991).Pengantar Kromatografi.
Penerjemah: Kokasih Padmawinata. Edisi 2. Bandung: ITB. Hal. 107-146.
Handa, S., Suman, P.S.K., Gennaro, L., dan Dev, D.R. (2008). Extraction Technologies For Medicinal And Aromatic Plants. Italy: International Centre For Science and High Technology. Hal 22.
Harahap, A.S., Suhariyuwanto, dan Bambang, S. (2003). Kerajinan Tangan
Eceng Gondok. Jawa Tengah: Balai Pengembangan Pendidikan Luar
Harborne, J. B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerjemah: Kokasih Padmawinata, dan Iwang Sooediro. Edisi 2. Bandung: ITB. Hal. 102-103, 147-149, 234.
Heinrich, M., Barnes, J., Gibbons, S., dan Williamson, M. E. (2005).
Farmakognosi dan Fitoterapi. Penerjemah: Winny Syarief, Cucu Aisyah, Ella Elviana, dan Euis Rachmiyani Fidiasari. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 82, 85, 94-97, 101, 103, 106, 120.
Heyne, K. (1995). Medicinal Herb Index in Indonesia. Edisi Kedua. Jakarta: PT. Eisai Indonesia. Hal.279.
Ismarani. (2012). Potensi senyawa tanin dalam menunjang produksi ramah lingkungan. CEFARS Jurnal agribisnis dan pengembangan wilayah, 3(3).
Jayanthi, P. (2013). Anti-Inflammatory Activity of The Various Solvent Extracts of Eicchornia crassipes(Mart.) Solms. International journal of PharmTech Research. 5(2): 641-645.
Lage, H. N., Duarte, C., Coburger, A., Hilgeroth, dan Ferraira, M.J.U. (2010). Antitumor activity of terpenoids against classical and atypical multidrug resistant cancer cells. Phytomedicine. 17: 441-448.
Lata, N., dan Dubey, V. (2010). Preliminary Phytochemical Screening of Eichhornia crassipes: The World’s Worst Aquatic Weed. Journal of Pharmacy Research. 3(6):1240 – 1242.
Nassar, Z., Abdalrahim., dan Amin, M.S. (2010). The Pharmacological Propertis of terpenoid from Sandoricum Koetjape. Journal Medcentral. Hal 1-11.
Putera, R.D.H. (2012). Ekstraksi serat selulosa dari tanaman eceng gondok
(Eichhornia crassipes) dengan variasi pelarut. Skripsi. Fakultas Teknik. UI.
Rachmawaty, R., Meriyani, M., dan Priyanto, S. (2013). Sintesis Selulosa Diasetat Dari Eceng Gondok (Eichhornia crassipes) dan Potensinya Untuk Pembuatan Membran. Jurnal Teknologi Kimia dan Industri. 2 (3): 8-16.
Rafiqua, N. (2012). Efek Antikoagulasi Ekstrak Etanol Eceng Gondok (Eichhornia crassipes Mart.) Pada Mencit Jantan Galur Swiss Webster.
Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam UNISBA.
Robinson, T. (1995).KandunganOrganikTumbuhanTinggi. Penerjemah: KokasihPadmawinata. Bandung: ITB. Hal. 123-157, 191.
Roslizawaty., Ramadani, N.Y., Fakhrurrazi., dan Herialfian. (2013). Aktivitas antibakteri ekstrak etanol dan rebusan sarang semut (Myrenecod