UJI EFEKTIVITAS TRICHODERMIN DAN FUNGISIDA HEKSAKONAZOL DALAM MENGHAMBAT PERTUMBUHAN Ganoderma boninense Pat. PADA TANAMAN KELAPA
SAWIT DI LABORATORIUM
SKRIPSI
OLEH :
DIAN MARTHA SIHOMBING 100301162
AGROEKOTEKNOLOGI- HPT
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UJI EFEKTIVITAS TRICHODERMIN DAN FUNGISIDA HEKSAKONAZOL DALAM MENGHAMBAT PERTUMBUHAN Ganoderma boninense Pat. PADA TANAMAN KELAPA
SAWIT DI LABORATORIUM
SKRIPSI
OLEH :
DIAN MARTHA SIHOMBING 100301162
AGROEKOTEKNOLOGI - HPT
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul : Uji Efektivitas Trichodermin dan Fungisida Heksakonazol dalam Menghambat Pertumbuhan Ganoderma boninense Pat. pada Tanaman Kelapa Sawit di Laboratorium
Nama : Dian Martha Sihombing NIM : 100301162
Program Studi : Agroekoteknologi
Jurusan : Hama dan Penyakit Tumbuhan
Disetujui Oleh : Komisi Pembimbing
(Dr. Ir. Hasanuddin, MS) (Prof. Dr. Dra. Maryani CyccuTobing,MS) Ketua Anggota
Mengetahui
ABSTRAK
DIAN MARTHA SIHOMBING:Uji Efektivitas Trichodermin dan Fungisida Heksakonazol dalam Menghambat Pertumbuhan Ganoderma boninense Pat. Penyebab Penyakit busuk pangkal batang Pada Tanaman Kelapa sawit di Laboratorium, dibimbing oleh Hasanuddin dan Maryani Cyccu Tobing.
Penggunaan toksin trichodermin untuk menghambat pertumbuhan G.boninense penyebab penyakit busuk pangkal batang pada tanaman kelapa sawit belum banyak diteliti. Untuk itu suatu penelitian telah dilakukan di laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara (±25 m dpl) mulai Desember 2014 sampai Februari 2015 menggunakan rancangan acak lengkap (RAL) non faktorial dengan lima perlakuan dan empat ulangan.
Hasil penelitian menunjukkan bahwa trichodermin berpengaruh sangat nyata terhadap semua parameter yang diamati. Luas pertumbuhan koloni tertinggi 55.129 cm2 terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sedangkan luas pertumbuhan koloni terendah 33.916 cm2 terdapat pada trichodermin 10-1. Persentase percepatan tumbuh tertinggi 96.428% terdapat pada fungisida sedangkan persentase percepatan tumbuh terendah 42.587% terdapat pada trichodermin 10-2. Persentase penghambatan tertinggi 65.560% terdapat pada trichodermin 10-2 sedangkan persentase penghambatan terendah 3.573% terdapat pada fungisida. Perbandingan percepatan tumbuh tertinggi 1 cm terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sedangkan perbandingan percepatan tumbuh terendah 0,925 cm terdapat pada trichodermin 10-1.
ABSTRACT
DIAN MARTHA SIHOMBING: Efectivity Test of Trichodermin and Heksakonazol Fungicide to inhibit Ganoderma boninense Pat.growth causal stem rot disease on Plant Oil Palmin Laboratory, supervised by oleh Hasanuddin dan Maryani Cyccu Tobing.
The use of trichodermin to inhibit G. boninensegrowth causal stem rot disease on Plant Oil Palmhave not been researched. Therefore, a research had been conducted at Plant Pathology Laboratory, Faculty of Agriculture, University of Sumatera Utara (± 25 m asl) start from December 2014 until February 2015 using non- factorial completely randomized design with five treatments and four replication.
The result showed that trichodermin gave highly significantly effect for all
parameters observed. Highest fungal colony extensive 55.129 cm2 was on Control
(without toxin and without fungicide) meanwhile the lowest fungal colony extensive 33.916 cm2 was on trichodermin 10-1. Percentage of acceleration grow
extensive 96.428% was on fungicide meanwhile the lowest percentage of
acceleration grow 42.587% was on trichodermin 10-2. Highest percentage of
inhibition 65.560% was on trichodermin 10-2 meanwhile the lowest percentage of inhibition 3.573%. was on fungicide. Highest comparison of accelaration grow 1 cm was on control (without toxin and without fungicide) meanwhile the lowest comparison of accelaration grow is 0,925 cm was on trichodermin 10-1.
RIWAYAT HIDUP
Dian Martha Sihombing lahir pada tanggal 02 Juli 1992 di Sei Rumbia, Labuhan Batu Selatan, Sumatera Utara. Merupakan anak pertama
dari empat bersaudara dari pasangan Romes Sihombing dan Ida Eliya Saragi.
Tahun 2010 penulis lulus dari SMA Markus Medan dan pada tahun yang sama
masuk ke Fakultas Pertanian Universitas Sumatera Utara melalui jalur SNMPTN.
Penulis memilih minat Hama dan Penyakit Tanaman, Departemen Agroekoteknologi.
Selama mengikuti perkuliahan, penulis aktif sebagai anggota HIMAGROTEK
(Himpunan Mahasiswa Agroekoteknologi), anggota IMAPTAN (Ikatan Mahasiswa
Perlindungan Tanaman), pernah mengikuti organisasi Kegiatan Mahasiswa Kebaktian
Mahasiswa Kristen Unit Pelayanan Fakultas Pertanian (UKM KMK UP FP USU),
sebagai asisten Laboratorium Dasar Perlindungan Hama Hutan pada tahun tahun 2013,
asisten Laboratorium Pestisida dan Teknik Aplikasi pada tahun 2014. Selain itu penulis
mengikuti seminar “Optimalisasi Sistem Pertanian untuk Menekan Dampak Perubahan
Iklim Guna Terwujudnya Pertanian Berkelanjutan” di Fakultas Pertanian Universitas
Sumatera Utara pada Mei 2012, Penulis melaksanakan Praktek Kerja Lapangan
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa, karena berkat
rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi ini tepat pada waktunya.
Skripsi penelitian yang berjudul “Uji Efektivitas Trichodermin Dan Fungisida
Heksakonazol Dalam Menghambat Pertumbuhan Ganoderma boninense Pat. Pada
Tanaman Kelapa Sawit Di Laboratorium” merupakan salah satu syarat untuk dapat
melakukan penelitian di Program Studi Agroekoteknologi Fakultas Pertanian Universitas
Sumatera Utara, Medan.
Pada kesempatan ini penulis menyampaikan terimakasih kepada Komisi
Pembimbing Dr. Ir. Hasanuddin, MS., sebagai Ketua dan Prof. Dr.
Dra. Maryani Cyccu Tobing, MS sebagai Anggota, yang telah membimbing dan
memberikan kritik, saran dan berbagai masukan berharga kepada penulis mulai dari
penetapan judul hingga penyelesaian skripsi ini dan terimakasih juga disampaikan kepada
Kepala Laboratorium Penyakit Tumbuhan yang telah memberikan tempat dan fasilitas
untuk penelitian ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, oleh karena
itu, penulis mengharapkan kritik dan saran dari pembaca yang bersifat membangun demi
perbaikan skripsi ini di masa yang akan datang.
Akhir kata penulis mengucapkan terimakasih dan skripsi ini dapat digunakan
sebagai bahan bacaan yang berguna bagi semua orang.
Medan, Mei 2015
DAFTAR TABEL
No Judul Hal
1. Luas pertumbuhan koloni jamur (cm2) 19
DAFTAR GAMBAR
No Judul Hal
DAFTAR LAMPIRAN
No Judul Hal
8. BaganPenelitian ... 29
9. Luas pertumbuhan koloni jamurdata pengamatan 1 hsi ... 30
10. Luas pertumbuhan koloni jamurdata pengamatan 2hsi ... 31
11. Luas pertumbuhan koloni jamurdata pengamatan 3 hsi ... 32
12. Luas pertumbuhan koloni jamurdata pengamatan 4 hsi ... 33
13. Persentase percepatan tumbuh data pengamatan 2hsi ... 34
14. Persentase percepatan tumbuh data pengamatan 3hsi ... 35
15. Persentase percepatan tumbuh data pengamatan 4hsi ... 36
16. Persentase penghambatan data pengamatan 2hsi ... 37
17. Persentase penghambatan data pengamatan 3hsi ... 38
18. Persentase penghambatan data pengamatan 4hsi ... 39
19. Perbandingan percepatan tumbuh ... 40
DAFTAR ISI Ganoderma boninense ... 5
Peubah Amatan
... …...
...18
Luas Koloni Jamur ... 18
Persentase Percepatan Tumbuh ... 18
Persentase Penghambatan ... 18
Perbandingan Percepatan Tumbuh ... 18
HASIL DAN PEMBAHASAN Luas Permukaan Koloni G. boninense ... ….19
Persentase Percepatan Tumbuh ... ….20
Persentase Penghambatan ... ….21
Perbandingan Percepatan Tumbuhan ... ….2 2 KESIMPULAN DAN SARAN Kesimpulan ... ….25
Saran ... ….25
DAFTAR PUSTAKA
ABSTRAK
DIAN MARTHA SIHOMBING:Uji Efektivitas Trichodermin dan Fungisida Heksakonazol dalam Menghambat Pertumbuhan Ganoderma boninense Pat. Penyebab Penyakit busuk pangkal batang Pada Tanaman Kelapa sawit di Laboratorium, dibimbing oleh Hasanuddin dan Maryani Cyccu Tobing.
Penggunaan toksin trichodermin untuk menghambat pertumbuhan G.boninense penyebab penyakit busuk pangkal batang pada tanaman kelapa sawit belum banyak diteliti. Untuk itu suatu penelitian telah dilakukan di laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara (±25 m dpl) mulai Desember 2014 sampai Februari 2015 menggunakan rancangan acak lengkap (RAL) non faktorial dengan lima perlakuan dan empat ulangan.
Hasil penelitian menunjukkan bahwa trichodermin berpengaruh sangat nyata terhadap semua parameter yang diamati. Luas pertumbuhan koloni tertinggi 55.129 cm2 terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sedangkan luas pertumbuhan koloni terendah 33.916 cm2 terdapat pada trichodermin 10-1. Persentase percepatan tumbuh tertinggi 96.428% terdapat pada fungisida sedangkan persentase percepatan tumbuh terendah 42.587% terdapat pada trichodermin 10-2. Persentase penghambatan tertinggi 65.560% terdapat pada trichodermin 10-2 sedangkan persentase penghambatan terendah 3.573% terdapat pada fungisida. Perbandingan percepatan tumbuh tertinggi 1 cm terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sedangkan perbandingan percepatan tumbuh terendah 0,925 cm terdapat pada trichodermin 10-1.
ABSTRACT
DIAN MARTHA SIHOMBING: Efectivity Test of Trichodermin and Heksakonazol Fungicide to inhibit Ganoderma boninense Pat.growth causal stem rot disease on Plant Oil Palmin Laboratory, supervised by oleh Hasanuddin dan Maryani Cyccu Tobing.
The use of trichodermin to inhibit G. boninensegrowth causal stem rot disease on Plant Oil Palmhave not been researched. Therefore, a research had been conducted at Plant Pathology Laboratory, Faculty of Agriculture, University of Sumatera Utara (± 25 m asl) start from December 2014 until February 2015 using non- factorial completely randomized design with five treatments and four replication.
The result showed that trichodermin gave highly significantly effect for all
parameters observed. Highest fungal colony extensive 55.129 cm2 was on Control
(without toxin and without fungicide) meanwhile the lowest fungal colony extensive 33.916 cm2 was on trichodermin 10-1. Percentage of acceleration grow
extensive 96.428% was on fungicide meanwhile the lowest percentage of
acceleration grow 42.587% was on trichodermin 10-2. Highest percentage of
inhibition 65.560% was on trichodermin 10-2 meanwhile the lowest percentage of inhibition 3.573%. was on fungicide. Highest comparison of accelaration grow 1 cm was on control (without toxin and without fungicide) meanwhile the lowest comparison of accelaration grow is 0,925 cm was on trichodermin 10-1.
PENDAHULUAN
Latar belakang
Kelapa sawit merupakan tanaman komoditas perkebunan yang cukup penting di Indonesia dan masih memiliki prospek pengembangan yang cukup cerah. Baik berupa bahan mentah maupun hasil olahannya, komoditas ini menduduki peringkat ketiga penyumbang devisa non - migas terbesar setelah karet dan kopi. Tanaman kelapa sawit ( Elaeis guineensis Jacq.) berasal dari Nigeria, Afrika Barat. Tanaman ini merupakan tanaman perkebunan yang dominan di masyarakat Indonesia. Kelapa sawit juga merupakan tanaman yang mempunyai nilai ekonomis yang cukup tinggi karena merupakan salah satu tanaman penghasil minyak nabati (Hartono et al., 2013).
Salah satu kendala utama dalam budidaya tanaman adalah adanya organisme pengganggu tanaman (OPT) seperti serangan beberapa jenis hama, penyakit dan gulma. Jenis-jenis hama dan penyakit pada tanaman kelapa sawit yang harus mendapat perhatian lebih selama perkembangan kelapa sawit, mengingat potensinya yang besar dalam menimbulkan kerusakan maupun kerugian adalah Apogonia sp. dan kumbang Adoretus sp, Setothosea asigna V. Eecke, Setora nitens Walker, Oryctes rhinoceros L, Tiratabaha sp dan Mahasena corbetti Tams sedangkan jenis-jenis penyakit Ganoderma sp. Botryodiploidia palmarum, Glomerella cingulata, Melanconium elaeidis dan Culvularia eragrostidis (Allorerung et al., 2010).
Penyakit dominan pada tanaman kelapa sawit sebelum menghasilkan buah adalah penyakit busuk pangkal batang (BPB) yang disebabkan oleh Ganoderma boninense. G. boninense merupakan jamur tanah hutan hujan tropis yang bersifat saprofit dan akan berubah menjadi patogenik apabila bertemu dengan akar tanaman kelapa sawit yang tumbuh didekatnya. Serangan BPB dapat terjadi sejak bibit sampai tanaman tua, tetapi gejala penyakit biasanya baru terlihat setelah bibit ditanam di lapangan. Penyakit ini dijumpai pada tanaman berumur 5 tahun. Serangan penyakit ini yang paling tinggi dijumpai pada umur 10-15 tahun, tetapi hal ini bervariasi tergantung pada kebersihan kebun dan sejarah tanaman di kebun tersebut. Kehilangan hasil tanaman sampai dengan 80% telah dilaporkan pada
Pengendalikan secara kimiawi umumnya menjadi pilihan utama, karena hasilnya lebih cepat nampak. Namun ketergantungan terhadap pestisida kimiawi dan meningkatnya harga pestisida, sehingga tidak terjangkau oleh daya beli petani. Salah satu alternatif pengendalian yang murah dan mudah yaitu dengan memanfaatkan biofungisida Trichoderma sp. dan belerang sebagai hasil teknologi ramah lingkungan (Nurmawan, 2001).
Trichoderma spp. merupakan salah satu jamur antagonis yang telah banyak diteliti terhadap beberapa jamur patogen tanaman. T. pseudokoningii dapat memperlambat munculnya gejala dan dapat menekan intensitas serangan jamur G. boninense pada pembibitan kelapa sawit. Beberapa hasil penelitian melaporkan bahwa Trichoderma harzianum dapat menekan pertumbuhan Ganoderma sp. dan bersifat antagonis terhadap jamur patogen Ganoderma. Pusat Penelitian Kelapa Sawit (2005) melaporkan bahwa Trichoderma koningii mampu menghambat pertumbuhan jamur G. boninense secara in vitro (Andriani et al., 2012).
Trichoderma menghasilkan antibiotik yang termasuk kelompok furanon yang dapat menghambat pertumbuhan spora dan hifa mikroba patogen dan menghasilkan toksin trichodermin. Toksin tersebut dapat menyerang dan
menghancurkan propagul yang berisi spora-spora patogen disekitarnya. Jenis Trichoderma viridae menghasilkan antibiotik gliotoksin dan viridin yang dapat
melindungi bibit tanaman dari serangan penyakit rebah kecambah. Jamur T. harzianum dalam menekan pertumbuhan patogen mampu memproduksi
Berdasarkan uraian di atas, maka perlu dilakukan penelitian tentang uji efektifitas Trichodermin dan membandingkan dengan fungisida Heksakonazol dalam menghambat pertumbuhan G. boninense di laboratorium.
Tujuan Penelitian
Untuk mengetahui efektivitas trichodermin dan fungisida heksakonazol dalam menghambat pertumbuhan G. boninense di laboratorium.
Hipotesis Penelitian
Toksin trichodermin dan fungisida heksakonazol efektif dalam menghambat pertumbuhan G. boninense di laboratorium.
Kegunaan Penelitian
TINJAUAN PUSTAKA
Biologi Jamur Busuk Pangkal Batang (G. boninense Pat.)
Menurut Agrios (1996) taksonomi penyakit busuk pangkal batang (G. boninense ) adalah sebagai berikut:
Kingdom : Fungi
Phylum : Basidiomycota Class : Basidiomycetes Subclass : Agaricomycetidae Order : Polyporales Family : Ganodermataceae Genus : Ganoderma
Species : G. boninense
G. boninense yang menyerang tanaman kelapa sawit berdasarkan ciri-ciri fenotipik (morfologi) mempunyai morfologi basidiokarp yang beragam. Umumnya basidiokarp yang banyak ditemukan adalah sessile, yaitu basidiokarp tidak bertangkai, tubuh buah langsung menyatu dengan pangkal batang kelapa sawit (Gambar 1). Ganoderma juga memiliki tepi tubuh buah (basidiokarp) yang beragam, yaitu halus, bergelombang, dan kasar. Umumnya Ganoderma yang ditemukan memiliki tepi tubuh buah (basidiokarp) yaitu tepi tubuh buah halus,
Gambar 1. Tubuh buah G. boninense
Basidiospora Ganoderma adalah uniselular, haploid, berbentuk ellipsoid, bujur atau truncate. Pencirian Ganoderma yang menyerang pohon kelapa sawit yaitu massa spora yang dikutip kelihatan kekuningan. Panjang basidiospora adalah 7.1-13.8 μm dan lebar 4.8 – 8.3 μm (Gambar 2). Basidiospora yang haploid dihasilkan oleh basidium. Basidiospora bercambah menjadi miselium manokarion (Jing, 2007).
Gambar 2. Mikroskopis G. boninense
Daur Hidup Penyakit
Ganoderma merupakan parasit fakultatif yang hidup secara saprofitik pada pangkal dan batang pohon yang menjadi sumber makanannya. Penyebaran Ganoderma terjadi melalui persentuhan akar tanaman sakit dengan tanaman sehat. Ganoderma yang dibiarkan di ladang akan menjangkit dan tumbuh ke dalam akar sehingga jangkitan sepanjang akar sampai ke pangkal batang pohon kelapa sawit (Jing, 2007).
Penyakit menyebar ke tanaman sehat bila akar tanaman bersinggungan dengan tunggul-tunggul pohon yang sakit. Laju infeksi G. boninense akan semakin cepat ketika populasi sumber penyakit (inokulum) semakin banyak di areal perkebunan kelapa sawit. Hal ini akan mengancam kelangsungan hidup tanaman kelapa sawit muda yang baru saja ditanam (Lizarmi, 2011).
Gejala Serangan
Penyakit BPB dapat menyerang tanaman mulai dari bibit hingga tanaman
Faktor yang Mempengaruhi
Jamur G. boninense dapat tumbuh secara teratur pada suhu tanah 40oC
tetapi pertumbuhan jamur G. boninense terganggu pada suhu di atas 35 o
C
(pertumbuhan optimum pada suhu 28 o
C) dan dalam waktu dua hari ke depan suhu
tanah dapat mencapai 45 o
C (suhu maksimal). Kerugian dalam penanaman di awal biasanya masih rendah. Gejala serangan G. boninense biasanya terlihat setelah 10-12 tahun kemudian (Coopper et al., 2011).
Saat ini, pertumbuhan penyakit G. boninense di perkebunan kelapa sawit terutama dipicu oleh generasi perkebunan. Semakin tinggi generasi perkebunan, semakin parah serangan penyakit hingga menyerang tanaman belum menghasilkan. Pada perkebunan kelapa sawit di lahan gambut, perkembangan infeksi G. boninense cenderung meningkat, disebabkan oleh mekanisme pemencaran melalui basidiospora. G. boninense menyebar melalui kontak akar dari tanaman sehat dengan sumber inokulum yang dapat berupa akar atau batang sakit (Idris, 2008).
Pengendalian Penyakit
dengan cara membongkar tanah dan memusnahkan tunggul-tunggul serta akar-akar tanaman terinfeksi kemudian dibakar-akar (Lizarmi, 2011 ).
Infeksi pada tanaman muda (umur 1–6 tahun) tanaman dimatikan dengan melakukan penyuntikkan. Pada daerah bekas tanaman sakit dibuat lubang besar berukuran 1m x 1m x 60cm kemudian lubang dibiarkan minimal selama 6 bulan, baru dilakukan penanaman dan pemberian 200 gr Trichoderma atau 400 gr Marihat fungisida. Tanah untuk menimbun kembali sisipan diambil dari top soil yang baru. Perlakuan yang sama juga diberikan pada tanaman muda yang terserang berat G. boninense. Di areal konversi, bila ada tanaman yang terserang G. boninense dibuat parit keliling pohon sejarak 2,5 m dari pangkal pohon sedalam 80 cm. Kemudian ditabur belerang ke dinding parit sebelah dalam sebanyak 3-4 kg/pohon (Susanto dan Agus 2008).
Biologi Trichoderma sp.
Menurut Tindaon (2008), taksonomi Trichoderma sp. adalah sebagai berikut:
Kingdom : Plantae
Divisio : Amastigomycota
Class : Deutromycetes
Ordo : Moniliales
Genus : Trichoderma Spesies : Trichoderma sp.
Gambar 3. Trichoderma sp.
Trichoderma sp. memiliki konidiofor bercabang - cabang teratur, tidak membentuk berkas, konidium jorong, bersel satu, dalam kelompok kecil terminal, kelompok konidium berwarna hijau biru. Trichoderma sp. juga berbentuk oval, dan memiliki sterigma atau phialid tunggal dan berkelompok (Nurhaedah, 2002).
Koloni Trichoderma sp. pada media agar pada awalnya terlihat berwarna putih selanjutnya miselium akan berubah menjadi kehijau-hijauan lalu terlihat sebagian besar berwarna hijau ada ditengah koloni dikelilingi miselium yang masih berwarna putih dan pada akhirnya seluruh medium akan berwarna hijau (Gambar 3). (Nurhayati, 2001).
selanjutnya hijau redup terutama pada bagian yang menunjukkan banyak terdapat konidia. Konidifor dapat bercabang menyerupai piramida, yaitu pada bagian bawah cabang lateral yang berulang-ulang, sedangkan kearah ujung percabangan menjadi bertambah pendek. Fialid tampak langsing dan panjang terutama apeks dari cabang, dan berukuran (2,8-3,2) μm x (2,5-2,8) μm, dan berdinding halus. Klamidospora umumnya ditemukan dalam miselia dari koloni yang sudah tua, terletak interkalar kadang terminal, umumnya bulat, berwarna hialin, dan berdinding halus (Tindaon, 2008).
Mekanisme Antagonis Trichoderma sp.
Mekanisme utama pengendalian patogen tanaman yang bersifat tular tanah dengan menggunakan cendawan Trichoderma sp. dapat terjadi melalui :
a. Mikoparasit (memarasit miselium cendawan lain dengan menembus dinding sel dan masuk ke dalam sel untuk mengambil zat makanan dari dalam sel sehingga cendawan mati).
b. Menghasilkan antibiotik seperti alametichin, paracelsin, dan trichotoxin yang dapat menghancurkan sel cendawan melalui pengrusakan terhadap permeabilitas membran sel, dan enzim chitinase, laminarinase yang dapat menyebabkan lisis dinding sel.
d. Mempunyai kemampuan melakukan interfensi hifa. Hifa Trichoderma spp.
akan mengakibatkan perubahan permeabilitas dinding sel (Ismail dan Tenrirawe, 2010).
Mekanisme antagonis Trichoderma spp. terhadap patogen dapat terjadi melalui 3 cara yaitu persaingan baik ruang maupun nutrisi, antibiosis dengan menghasilkan toksin antara lain trichodermin dan asam sitrat serta menghasilkan enzim glukanase, dan kitinase yang dapat menghancurkan hifa patogen, dan sebagai mikoparasit yang hidup pada tubuh patogen dengan cara melilit hifa dari patogen. Lebih lanjut Mulat (2003) menyatakan bahwa dengan terpenuhinya berbagai macam unsur hara dan hormon tumbuh serta adanya interaksi antara mikroorganisme yang menguntungkan bagi tanaman (Suzana et al., 2001).
Trichodermin
Jamur endofit Trichoderma dapat menghasilkan suatu senyawa aktif untuk patogen. Trichodermin merupakan anggota dari famili 4β – aceoxy - 12, 13- epoxytrichothecene dan dapat menghambat Rhizoctonia solani. Untuk identifikasi morfologi biasanya ditumbuhkan pada media OA, PDA, dan SNA selama 7 – 14 hari pada suhu ruang 2930K di tempat terang. Pengamatan dan pengukuran Trichodermin secara mikroskopik di bawah mikroskop. Untuk menghasilkan metabolit, strain diinokulasi pada media PDA, dan diinkubasi selama 10 hari pada suhu 2980K di tempat gelap (Chen et al., 2008).
diarahkan oleh mRNA endogen. Trichodermin adalah inhibitor kuat dari sistem ini, meskipun tidak ampuh sebagai sparsomycin dan anisomycin. Namun, trichodermin adalah inhibitor yang berpotensi dalam transferase peptidil yang diukur dengan formasi dari fMet-puromycin, menghambat reaksi lebih kuat daripada anisomycin dan kurang kuat dari sparsomycin. Trichodermin tidak berpengaruh pada reaksi terminasi E. Coli. Fakta bahwa trichodermin menghambat transferase peptidil menunjukkan trichodermin yang mungkin menghambat pemutusan rantai dengan mengikat ke kompleks ribosom (Zhao et al., 2010).
Heksakonazol
Heksakonazol adalah fungisida spektrum luas yang menghambat biosintesis
ergosterol. Hal ini translokasi seluruh pabrik dan kontrol terutama Ascomycetes dan
Basidiomycetes (Nordkanalstr, 2009).
Heksakonazol SC digunakan sebagai bahan fungisida pada umumnya diproduksi
mengandung 2 persen (rnhn) dan 5 persen (m / m) dari heksakonazol. Dalam
penyusunan standar ini, pertimbangan telah diberikan kepada ketentuan Insektisida Act,
1968 dan Peraturan dibingkai bawahnya. Namun, standar ini tunduk pada pembatasan
yang dikenakan berdasarkan Undang-Undang dan Peraturan insektisida, dimanapun
berlaku. Untuk tujuan memutuskan apakah persyaratan tertentu standar ini dipenuhi, nilai
akhir, diamati atau dihitung, mengungkapkan tes atau analisis, harus dibulatkan sesuai
dengan IS 2: 1960 'Aturan untuk pembulatan nilai numerik (revisi)', jumlah tempat
signifikan dipertahankan dalam nilai dibulatkan harus sama dengan nilai yang ditentukan
dalam standar ini (pitroda, 2006).
Struktur Heksakonazol
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan (± 25 m dpl) mulai bulan Desember 2014 sampai dengan Februari 2015.
Bahan dan Alat
Bahan yang digunakan yaitu media PDA, clorox 1%, fungisida Heksakonazol, tanah di sekitar perakaran tanaman kelapa sawit, akar tanaman kelapa sawit yang terserang penyakit busuk pangkal batang, kertas saring whatman 041, alkohol, air steril, aluminium foil, kapas, dan cling wrap.
Alat yang digunakan yaitu Laminar Air Flow (LAF), cawan petri diameter 9 cm, inkubator, mikroskop, ice box, erlenmeyer, tabung reaksi, mikropipet, oven, bunsen, autoclaf, beaker glass, hot plate, lemari es, cork borer, jarum inokulum, pisau, batang pengaduk, dan alat tulis lainnya.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) non faktorial yaitu:
T02 : Kontrol + (200 ppm fungisida Heksakonazol 50 SC)
TX1 : Pengenceran 10-1 Toksin Trichodermin
TX2 : Pengenceran 10-2 Toksin Trichodermin
TX3 : Pengenceran 10-3 Toksin Trichodermin
Perlakuan diulang sebanyak 4 kali sehingga diperoleh 20 unit percobaan. Jumlah ulangan diperoleh dengan rumus :
t (r-1) ≥ 15
5 (r-1) ≥ 15
5 r - ≥ 15
5 r ≥ 20
r ≥ 4
Metode linear yang digunakan yaitu sebagai berikut :
Yij= µ + αi + ∑ij
Dimana :
Yij = respon atau nilai pengamatan pada perlakuan ke-i
αi = efek dari perlakuan taraf ke-i
∑ij = efek error
(Sastrosupadi, 2000).
Pelaksanaan Penelitian
Pembuatan PDA
Kentang dicuci dan dikupas bersih kemudian ditimbang 250 g, selanjutnya dipotong dadu kecil. Kentang dimasak dengan aquades steril 500 ml selama 30 menit. Kemudian disaring dengan kain muslin untuk mendapatkan ekstrak kentang sampai volume 500 ml, pada waktu yang bersamaan 20 gr agar dan 20 gr dextrose dalam 500 ml air suling di didihkan sampai semua agar-agar larut. Ekstrak kentang dan agar keduanya dicampurkan sambil diaduk hingga rata di atas hotplate, selanjutnya dituang ke dalam erlenmeyer ukuran 200 ml dan ditutup dengan kapas steril dan dibalut dengan kertas alumunium foil lalu disterilkan dengan autoklaf selama 15 menit dengan suhu 121°C pada tekanan 0,15 atm. PDA dibiarkan terlebih dahulu dalam udara terbuka hingga panasnya menjadi hangat kuku, lalu dituang ke dalam cawan petri. PDA dapat disimpan di dalam lemari pendingin dengan suhu 6-10°C.
Isolasi G. boninense
disterilisasi permukaan dengan klorox 0,1 % selama 2 - 3 menit kemudian dikering dengan kertas saring steril. Selanjutnya dibiakkan dalam media PDA dan dibiarkan sampai tumbuh miselium. Inokulum jamur yang tumbuh diisolasi kembali untuk mendapatkan biakan murninya.
Isolasi Trichoderma sp.
Ekstraksi pigmen Trichodermin
Perbanyakan Isolat Trichoderma sp.
Perbanyakan isolat Trichoderma dilakukan dengan mengkulturkan massa spora pada media PDA. Massa spora dari biakan murni dipanen menggunakan cotton bud basah dan steril, cotton bud dioleskan di atas koloni biakan murni kemudian disebarkan merata di atas medium PDA. Kultur spora diinkubasi selama 4-5 hari sampai terlihat perubahan warna PDA di dasar cawan petri yang menandakan adanya keluaran pigmen dari isolat Trichoderma.
Pigmen Trichoderma
Pigmen yang dihasilkan kultur Trichoderma dipanen dengan cara
memotong medium PDA sehingga menjadi bagian- bagian kecil ukuran ± 1 x 1 cm dan merendamnya dengan pelarut alkohol dalam beaker glass dengan
perbandingan volume pelarut dan volume medium 1 : 1. Campuran pelarut disaring dengan kertas whatman nomor 041 untuk memisahkan sisa PDA. Suspensi pelarut dan pigmen Trichodermin dikeringkan di udara terbuka sampai diperoleh endapan pigmen Trichodermin setengah murni.
Uji Aktivitas Fungistatik Trichodermin dan fungisida Heksakonazol Terhadap G. boninense secara In vitro
dicampur dengan air suling steril untuk mendapatkan pengenceran 10-1, 10-2, dan 10-3. Setelah Trichodermin diencerkan, Trichodermin dicampur dengan media PDA. Pengujian fungisida dilakukan dengan mencampurkan fungisida dengan dosis perlakuan 200 ppm dengan media PDA. Kemudian jamur pathogen diinokulasi dengan meletakkannya di bagian tengah petri yang berukuran 9 cm.
Peubah Amatan
1. Luas Koloni Jamur
Pengamatan luas pertumbuhan koloni jamur dilakukan setiap hari dengan cara menggambar bentuk koloni pada plastik transparan dan kemudian ditimbang
beratnya, selanjutnya nilai berat timbangan koloni tersebut ditransformasikan ke dalam cm, yaitu dengan menimbang plastik transparan yang lain.
2. Persentase Percepatan Tumbuh
Pengamatan persentase percepatan tumbuh dilakukan setiap hari dengan menggunakan rumus :
3. Persentase Penghambatan
Pengamatan persentase penghambatan dilakukan setiap hari dengan menggunakan rumus :
Persentase Penghambatan = 100 % - Persentase Percepatan Tumbuh Luas Koloni perlakuan
X 100%
4. Perbandingan Percepatan Tumbuh
HASIL DAN PEMBAHASAN
5. Luas Pertumbuhan Koloni G. boninense
Analisis sidik ragam menunjukkan bahwa toksin trichodermin berpengaruh sangat nyata terhadap luas pertumbuhan koloni G. boninense. Hal ini dapat dilihat pada Tabel 1 (Lampiran 3-5).
Tabel 1. Uji beda rataan luas pertumbuhan koloni pada 1 – 4hsi (cm2)
Keterangan: Angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
hsi = hari setelah inokulasi
Tabel 1 menunjukkan bahwa luas pertumbuhan koloni G. boninense tertinggi (55.129 cm2) pada 10 hsi terdapat pada perlakuan T01
(tanpa toksin dan tanpa fungisida). Sedangkan luas pertumbuhan koloni G. boninense terendah (33.916 cm2) terdapat pada TX-1 (Trichodermin 10-1).
Kemampuan trichodermin menghambat pertumbuhan G. boninense dapat dilihat dari terhambatnya luas pertumbuhan G. boninense secara in vitro, ini membuktikan bahwa trichodermin merupakan toksin atau senyawa racun (antibiotik) yang dihasilkan oleh agen antagonis yang dapat menekan atau menghambat pertumbuhan patogen. Hal ini sesuai dengan hasil penelitian Wahyudi (2011) yang menyatakan bahwa trichoderma menghasilkan antibiotik yang termasuk kelompok furanon yang dapat menghambat pertumbuhan spora
dan hifa mikroba patogen dan menghasilkan toksin trichodermin., sehingga toksin dapat menyerang dan menghancurkan propagul yang berisi spora-spora pathogen disekitarnya.
Berdasarkan hasil uji beda rataan diketahui bahwa luas pertumbuhan pada perlakuan T02 (diberi fungisida heksakonazol 200 ppm) berbeda nyata dengan luas pertumbuhan koloni pada perlakuan T01 (tanpa toksin dan tanpa fungisida). Ini menunjukkan bahwa heksakonazol dapat menghambat pertumbuhan G. boninense. Hal ini disebabkan heksakonazol sebagai fungisida sistemik menghasilkan racun yang dapat mengganggu metabolisme di dalam sel jamur G. boninense. Sesuai dengan hasil penelitian Nordkanalstr (2009) menyatakan bahwa fungisida spektrum luas yang menghambat biosintesis ergosterol.
2. Persentase Percepatan Tumbuh
Analisis sidik ragam menunjukkan bahwa trichodermin berpengaruh terhadap rataan persentase percepatan tumbuh G. boninense. Hasil selengkapnya dapat dilihat pada Tabel 2 (Lampiran 6-9).
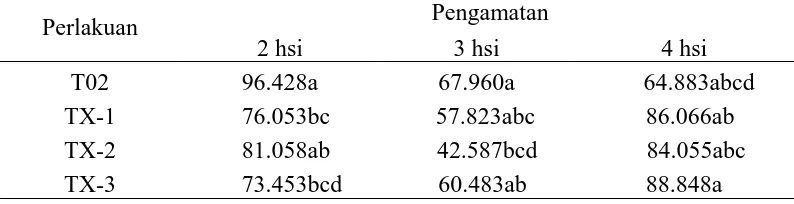
Tabel 2. Uji beda rataan persentase percepatan tumbuh pada 1 – 4 hsi (%) Perlakuan Pengamatan
Dari data pengamatan 4 hsi menunjukkan bahwa perlakuan TX-3 memperkecil percepatan tumbuh G. boninense. Hal ini disebabkan trichodermin merupakan senyawa racun terhadap jamur patogen. Sesuai dengan penelitian Chen et.al (2008) dinyatakan bahwa jamur endofit trichoderma dapat menghasilkan suatu senyawa aktif untuk.
Dari hasil pengamatan pada Tabel 2 terlihat perbedaan persentase percepatan tumbuh antara perlakuan T02 (diberi fungisida heksakonazol 200 ppm), TX-1 (Trichodermin 10-1), TX-2 (Trichodermin 10-2), dan TX-3 (Trichodermin 10-3). Tidak terlihat perbedaan nyata akibat perbedaan konsentrasi pada perlakuan TX-1 (Trichodermin 10-1), TX-2 (Trichodermin 10-2) dengan T02 (diberi fungisida heksakonazol 200 ppm), tetapi berbeda nyata pada TX-3 (Trichodermin 10-3). Hal ini disebabkan adanya perbedaan kepekatan toksin. Pemberian toksin trichodermin yang tepat yang dapat mempengaruhi percepatan tumbuh G. boninense. Semakin pekat toksin maka percepatan tumbuh jamur pathogen semakin kecil. Semakin encer toksin maka percepatan tumbuh pathogen semakin besar.
3. Persentase Penghambatan
Analisis sidik ragam dapat dilihat bahwa persentase penghambatan yang ditimbulkan oleh trichodermin terhadap G. boninense terdapat perbedaan pada tingkat konsentrasi. Hasil uji beda rataan persentase penghambatan dapat dilihat pada Tabel 3 (Lampiran 10-13).
Tabel 3. Uji beda rataan persentase penghambatan pada 1 – 4hsi (%) Perlakuan Pengamatan
T02 3.573d 35.118a 32.040abcd
TX-1 23.948a 13.945abc 42.178a
TX-2 18.943abc 15.945a 65.560a
TX-3 26.548a 11.153d 39.725a
Keterangan: Angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
hsi = hari setelah inokulasi
Hasil pengamatan diketahui bahwa terdapat perbedaan yang nyata antara perlakuan T02 (diberi fungisida heksakonazol 200 ppm) dengan perlakuan TX-3 (Trichodermin 10-3). Ini menunjukkan bahwa heksakonazol sebagai fungisida sistemik mampu menetralisasi enzim atau toksin yang terkait dalam invasi dan kolonisasi jamur. Hal ini sesuai dengan hasil penelitian Djunaedy (2008) yang menyatakan bahwa menghambat system enzim jamur, terjadinya presipitasi kimia, terjadinya antimetabolisme dan mempengaruhi sintesis asam nukleat dan protein.
4. Perbandingan Percepatan Tumbuh
Analisis sidik ragam menunjukkan bahwa toksin trichodermin berpengaruh sangat nyata terhadap perbandingan percepatan tumbuh G. boninense. Hasil selengkapnya dapat dilihat pada Tabel 4 (Lampiran 32).
Tabel 4. Uji beda rataan perbandingan percepatan tumbuh pada 4 hsi (cm) Perlakuan Pengamatan 4 hsi
T01 1a
T02 0.928e
TX-1 0.925cd
TX-2 0.967ab
TX-3 0.950bc
Keterangan: Angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
hsi = hari setelah inokulasi
Tabel 4 menunjukkan bahwa perbandingan percepatan tumbuh G. boninense tertinggi (1 cm) terdapat pada perlakuan T01 (tanpa toksin dan tanpa
fungisida). Sedangkan perbandingan percepatan tumbuh G. boninense terendah (0,925 cm) terdapat pada TX-1 (Trichodermin 10-1).
KESIMPULAN DAN SARAN
Kesimpulan
1. Luas pertumbuhan koloni G. boninense tertinggi terdapat pada perlakuan T01 (tanpa toksin dan tanpa fungisida) (55,129 cm2) dan terendah terdapat pada TX-1 (Trichodermin 10-1) (33,916 cm2).
2. Persentase percepatan tumbuh G. boninense tertinggi terdapat pada perlakuan T01 (tanpa toksin dan tanpa fungisida) (100%) dan terendah terdapat pada TX-1 (Trichodermin 10-1) (61,510%).
3. Persentase penghambatan tumbuh G. boninense tertinggi terdapat pada perlakuan TX-1 (Trichodermin 10-1) (38,491%) dan terendah (0%) pada T01 (tanpa toksin dan tanpa fungisida) .
4. Perbandingan percepatan tumbuh G. boninense tertinggi 1 cm terdapat pada perlakuan T01 (tanpa toksin dan tanpa fungisida) dan terendah pada TX-1 (Trichodermin 10-1) (0,925 cm).
Saran
1. Perlu dilakukan dengan peningkatan kepekatan Trichodermin untuk melihat tingkat efektivitas lebih lanjut.
DAFTAR PUSTAKA
Agrios GN. 1996. Ilmu Penyakit Tumbuhan. Edisi Ketiga. Penerjemah M Busnia. Gadjah Mada University Press, Yogyakarta. 467-468p.
Alfizar, Marlina, dan F Susanti. 2013. Kemampuan Antagonis Trichoderma sp. Terhadap Beberapa Jamur Patogen In vitro. J. Floratek 8: 45 – 51.
Allorerung D, M Syakir, Z Poeloengan, Syafaruddin dan W Rumini. 2010. Budidaya Kelapa Sawit. Aska Media, Bogor.
Andriani D, Y Elfina dan Y Venita. 2012. Uji Antagonis Trichoderma Pseudokoningii Rifai Dalam Formulasi Biofungisida Yang Mengandung Beberapa Bahan Organik Terhadap Jamur Ganoderma Boninense Pat. Secara In Vitro Jurusan Agroteknologi Fakultas Pertanian Universitas Riau.
Chen SY, CL Zhang, YZ Chen, dan FC Lin. 2008. Trichodermin (4 - acetoxy - 12, 13 - epoxytrichothec - 9 - ene) [10 April 2013].
Cooper RM, J Floodb dan RW Rees. 2011. Ganoderma boninense in Oil Palm Plantations Current Thinking on Epidemiology, Resistance and Pathology. The Planter, Kuala Lumpur, 87: 515-526.
Direktorat Jenderal Pendidikan. 2009. Manajemen Pemeliharaan Tanaman Kelapa sawit. Departemen Pendidikan Nasional. Jakarta.
Direktorat Perlindungan Perkebunan. 2011. Komisi Perlindungan Tanaman Bahas Strategi Pengendalian OPT Perkebunan. Direktorat Jenderal Perkebunan, Jakarta.
Dirjen Perkebunan. 2013. Kelapa Sawit. Pusat data dan informasi Pertanian, Jakarta.
Djunaedy, A. 2008. Aplikasi Fungisida Sistemik dan Pemanfaatan Mikoriza dalam Rangka Pengendalian Patogen Tular Tanah Pada Tanaman Kedelai (Glycine max L.). Embryo 5 (2).
Hartono, B, Adiwirman, dan GME, Manurung. 2013. Teknik Budidaya Tanaman Kelapa Sawit (Elaeis Guineensis Jacq) Belum Menghasilkan Di Lahan Pasang Surut Yang Dilakukan Petani Di Kecamatan Bangko Pusako Kabupaten Rokan Hilir. Jurusan Agroteknologi Fakultas Pertanian Universitas Riau.
Idris AS dan Ariffin D. 2003. Ganoderma : Penyakit Reput Pangkal Batang dan Kawalannya. Unit Pembangunan Pekebun Kecil dan Pemindahan Teknologi, Bahagian Biologi, Malaysian Palm Oil Board (MPOB), Bangi.
Ismail N dan Tenrirawe. 2010. Potensi Agens Hayati Trichoderma spp. Sebagai Agens Pengendali Hayati. Balai Pengkajian Teknologi Pertanian (BPTP), Sulawesi Utara.
Jing CJ. 2007. Kepatogenan Ganoderma boninense Pada Kelapa Sawit dan Hubungan Biologinya dengan Ganoderma spp. dari pada Perumah
Palma lain. Pusat Pengajian Sains Patologi Tumbuhan, Malaysia. 13-40p.
Lizarmi E. 2011. Ancaman Penyakit Busuk Pangkal Batang Pada Tanaman Kelapa Sawit. Komisi Perlindungan Tanaman Bahas Strategi Pengendalian OPT Perkebunan. Direktorat Jenderal Perkebunan, Jakarta. Nordkanalstr 2009. Helm AG. Hamburg. Jermany.
Nurhaedah. 2002. Pengaruh Aplikasi Trichoderma sp. dan Mulsa terhadap Persentase Serangan Penyakit Antraknosa pada Buah Tanaman Cabai Merah Besar (Capsicum annum L.). Skripsi Fakultas Pertanian UNTAD, Palu.
Nurhayati H. 2001. Pengaruh Pemberian Trichoderma sp. terhadap Daya Infeksi dan Ketahanan Hidup Sclerotium roflsii pada Akar Bibit Cabai. Skripsi Fakultas Pertanian UNTAD, Palu.
Nurmawan A. 2001. Pengkajian Pengendalian Penyakit Jamur Akar Teh Di Perkebunan Rakyat. Peneliti pada Balai Pengkajian Teknologi Pertanian Jawa Barat Lembang, Bandung.
Pitroda SG. 2006. Hexaconazole, Suspension Concentrate (SC). New Delhi. India.
Susanna, T Chamzurni dan A Pratama. 2010. Dosis dan Frekuensi Kascing Untuk
Susanto A, dan Agus EP. 2008. Menangani Penyakit Mematikan (G. boninense) Pada Perkebunan Kelapa Sawit. Pusat Penelitian Kelapa Sawit. Medan Tandion H. 2008. Pengaruh Jamur Antagonis Trichoderma harzianum dan Pupuk
Organik Untuk Mengendalikan Patogen Tular Tanah Sclerotium roflsii Sacc. Pada Tanaman Kedelai (Glycine max L.) di Rumah Kasa. http://repository.usu.ac.id.pdf [10 April 2014].
Wahyudi A. 2011. Pendampingan Pengembangan Lada di Kabupaten Belitung. Pusat Penelitian dan Pengembangan Tanaman Perkebunan, Suka Bumi.
Wicaksono WA, RF Buana dan EC Situmorang. 2011. Analisis Keragaman Genetik Ganoderma Boninense Dari Beberapa Perkebunan Berdasarkan Marka Random Amplified Polymorfic DNA (RAPD). BioTeknoSawit-Jatropha, 1(1), 25 – 31.
Lampiran 1:
Bagan Penelitian
T01
TX-1
TX-3
T02
TX-2
T01
TX-3
TX-1
TX-2
T02
T01
TX-3
TX-1
TX-2
TX-3
T02
T0-2
T01
TX-2
Lampiran 2:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 1 HSI
Perlakuan Ulangan Total Rata-rata
I II III IV
T01 4.500 4.283 3.412 1.960 14.154 3.539
T02 2.976 2.178 0.726 1.379 7.259 1.815
TX-1 0.944 0.798 1.379 0.581 3.702 0.925
TX-2 4.500 2.178 1.597 1.234 9.509 2.377
TX-3 4.500 3.847 1.379 1.669 11.396 2.849
Total 17.421 13.283 8.492 6.823 46.019
Rata-rata 3.484 2.657 1.698 1.365 2.301
Daftar Sidik Ragam
SK db JK KT F hit F 0.05 F 0.01 Ket
Perlakuan 4 15.865 3.966 2.844 3.060 4.890 tn Galat 15 20.922 1.395
Total 19 36.787
FK = 105.888 Ket: *=nyata
KK = 0,513 % **=sangat nyata
Lampiran 3:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 2 HSI
Perlakuan Ulangan Total Rata-rata
Perlakuan TX-1 TX-2 T02 TX-3 T01 Rataan 10.470 11.523 12.793 19.961 24.806
a
b
Lampiran 4:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 3 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 5:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 6:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 2 HSI
Perlakuan Ulangan Total
Rata-rata Total 393.920 270.600 292.570 350.870 1307.960
Lampiran 7:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 3 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 8:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total Rata-rata
I II III IV
T02 81.94 94.34 27.69 55.56 259.530 64.883
Lampiran 9:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 2 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 10:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 3 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 11:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 12:
PERBANDINGAN PERCEPATAN TUMBUH (cm) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 13 :
PHOTO PENGAMATAN 4 HSI
I II III IV T01 TX-1 TX-3 T02
I II III IV TX-3 TX-2 TX-1 T01
I II III IV T02 T01 TX-2 TX-3
TX-1 TX-3 T02 TX-2