SINTESIS DAN KARAKTERISASI
SENYAWA DIFENILTIMAH(IV) DIKLOROBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK
(Tesis)
Oleh
BAMBANG ISWANTORO
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
THE SYNTHESIS AND CHARACTERIZATION OF DIPHENYLTIN(IV) DICHLOROBENZOATE AS CORROSION INHIBITION FOR MILD STEEL
By
BAMBANG ISWANTORO
In this research, the synthesis and characterization of diphenyltin(IV) di-2-chlorobenzoate, diphenyltin(IV) di-3-di-2-chlorobenzoate, and diphenyltin(IV) di-4-chlorobenzoate were succesfully performed and the corrosion inhibition activity tests on mild steel for these compounds have been performed using potensiostat method. The preparation of diphenyltin(IV) dichlorobenzoate compound series was commenced by the synthesis of diphenyltin(IV) oxide from diphenyltin(IV) dichloride with NaOH in methanol. The diphenyltin(IV) oxide compound was then reacted with the ligands of 2-chlorobenzoid acid, 3-chlorobenzoid acid, and 4-chlorobenzoid acid to produce diphenyltin(IV) di-2-chlorobenzoate, diphenyltin(IV) di-3-chlorobenzoate, and diphenyltin(IV) di-4-chlorobenzoate, respectively. The percentage yields of the synthesis of diphenyltin(IV) dichlorobenzoate series at the optimum reflux time of 4 hours was 87.53, 89.69, and 90,64%, respectively. These compounds were well characterized by spectroscopy techniques of infrared (IR), ultraviolet (UV), 1H NMR, and 13C NMR as well as based on the microelemental analysis. The result of
corrosion inhibition test of the compounds synthesized toward mild steel showed that the percentage efficiency inhibition (%EI) value for the diphenyltin(IV) di-2-chlorobenzoate, diphenyltin(IV) di-3-di-2-chlorobenzoate, and diphenyltin(IV) di-4-chlorobenzoate was 55.96, 51.32, and 48.31%, respectively, at concentration of 100 mg/L.
ABSTRAK
SINTESIS DAN KARAKTERISASI
SENYAWA DIFENILTIMAH(IV) DIKLOROBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK
Oleh
BAMBANG ISWANTORO
Pada penelitian ini, telah dilakukan sintesis, karakterisasi, dan uji aktivitas inhibitor korosi pada baja lunak dari senyawa difeniltimah(IV) di-2-klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat dengan metode potensiostat. Sintesis senyawa difeniltimah(IV) diklorobenzoat dimulai dari sintesis difeniltimah(IV) oksida dengan mereaksikan difeniltimah(IV) diklorida dengan NaOH dalam metanol. Kemudian senyawa ini direaksikan dengan ligan asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam 4-klorobenzoat menghasilkan difeniltimah(IV) di-2-klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, difeniltimah(IV) di-4-klorobenzoat. Ketiga senyawa memberikan rendemen kristal masing-masing 87,53; 89,69; dan 90,64% dengan waktu refluks 4 jam. Seluruh senyawa tersebut dikarakterisasi dengan menggunakan spektrofotometer IR, UV, 1H NMR, 13C NMR, dan mikroanalisis unsur dengan menggunakan microelemental analyzer. Aktivitas inhibitor korosi senyawa-senyawa produk diujikan pada baja lunak memberikan persentase efisiensi inhibisi (%EI) untuk senyawa difeniltimah(IV) di-2-klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat sebesar 55,96; 51,32; dan 48,31% pada masing-masing konsentrasi 100 mg/L.
SINTESIS DAN KARAKTERISASI
SENYAWA DIFENILTIMAH(IV) DIKLOROBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK
Oleh
BAMBANG ISWANTORO Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Pascasarjana Magister Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Pringsewu pada tanggal 15 Desember 1971 sebagai anak keenam dari delapan bersaudara, terlahir dari pasangan Kaidi Hadi Suwarno dan Aisyah. Penulis menikah denga Siti Julaeha dan dikaruniai tiga anak, Hana Aulia Afifi, Faris Azhar Ramadhan, dan Affan Azmi Abdurrahman.
Penulis menyelesaikan pendidikan sekolah dasar di SD Negeri 1 Pringsewu pada tahun 1984, sekolah menengah pertama di SMP Negeri 1 Pringsewu pada tahun 1987, dan sekolah menengah atas di SMA Negeri 1 Pringsewu pada tahun 1990. Penulis menyelesaikan kuliah di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 1996 dan Pendidikan Akta Mengajar IV, Fakultas Keguruan dan Ilmu Pendidikan Universitas Terbuka pada tahun 2001. Penulis diterima di Program Studi Magister Kimia, Jurusan Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 2013.
…niscaya Allah akan mengangkat (derajat) orang-orang yang beriman di antaramu dan orang-orang yang diberi ilmu pengetahuan beberapa derajat. Dan Allah Maha Teliti apa yang
kamu kerjakan.
( QS. Al Mujaadilah : 11 )
“Lakukanlah kebaikan sekecil apapun, karena engkau tidak
pernah tahu kebaikan apa yang akan memasukkanmu ke syurga”
( Imam Hasan Albashri )
“Ukhuwah bukan terletak pada indahnya pertemuan tetapi
ingatan seorang sahabat kepada saudaranya didalam doa”
Dengan kerendahan hati dan rasa syukur kepada Allah SWT yang tak henti-hentinya melimpahkan berbagai kenikmatan-Nya,
Kupersembahkan sebuah karya terbaikku ini dengan semangat dan jerih payahku teruntuk :
Ayahanda Kaidi Hadi Surwarno, Ibunda Aisyah, Mertuaku Ratnasih, Istriku Siti Julaeha, anak-anakku Hana Aulia Afifi, Faris Azhar Ramadhan,
dan Affan Azmi Abdurrahman,
Orang-orang yang senantiasa mencurahkan kasih sayang, motivasi, nasehat, dan doa, kakak dan adikku tersayang, keponakanku yang aku sayangi, segenap
SANWACANA
Puji syukur Penulis ucapkan kehadirat Allah Subhanahu Wa Ta‟ala, karena atas nikmat dan hidayah-Nya sehingga tesis ini dapat diselesaikan. Shalawat dan salam kita sampaikan kepada Nabi Muhammad Shallallahu „Alaihi Wassalam, keluarga, sahabat, tabi‟in, dan orang-orang yang istiqamah di jalan-Nya.
Tesis dengan judul “Sintesis dan Karakterisasi Senyawa Difeniltimah(IV)
diklorobenzoat sebagai Inhibitor Korosi pada Baja Lunak” adalah salah satu syarat untuk memperoleh gelar Magister Sains di Universitas Lampung.
Dalam kesempatan ini Penulis mengucapkan terima kasih kepada:
1. Bapak Prof. Sutopo Hadi, Ph. D. selaku Pembimbing Utama, Pembimbing Akademik, dan Ketua Program Studi Magister Kimia yang telah meluangkan waktu, pikiran, dan tenaga untuk memberi masukan, arahan, dan bimbingan dalam proses penyelesaian tesis ini;
2. Bapak Dr. Hardoko Insan Qudus, M.S. selaku Pembimbing Kedua dan Kepala Laboratorium Instrumen/Analitik yang telah meluangkan waktu, pikiran, dan tenaga untuk memberi masukan, arahan, dan bimbingan dalam proses penyelesaian tesis ini;
4. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku Ketua Jurusan Kimia FMIPA Universitas Lampung;
5. Bapak Dr. Rudi T.M. Situmeang, M.Sc. selaku Kepala Laboratorium Kimia Anorganik-Fisik FMIPA Universitas Lampung;
6. Ibu Dra. Nuning Nurcahyani, M.Sc. selaku Ketua Jurusan Biologi dan Ibu Dra. Yulianty, M.Si. selaku Kepala Laboratorium Botani FMIPA Universitas Lampung;
7. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung; 8. Bapak dan Ibu Staf Administrasi FMIPA Universitas Lampung;
9. Adikku Hastin Kurniasih, Pak Muhamad Nurissalam, dan Hapin Afriyani atas bantuan dan kerjasamanya menyelesaikan tesis ini;
10. Rekan-rekan peer anorganik dan seluruh angkatan 2013 atas kerjasama dan kebersamaannya;
11. Ibu Dra. Sri Karmila, Ibu Dra. Hj. Zaini Yusuf, seluruh guru, dan staf Tata Usaha SMA Negeri 16 Bandar Lampung atas perhatian, motivasi, dan kebaikannya;
12. Kedua orangtuaku Kaidi Hadi Suwarno dan Aisyah, Ibu mertuaku Ratnasih serta keluarga besarku yang selalu mendukungku dengan doa dan
kesabarannya;
13. Istri tercinta Siti Julaeha dan anak-anakku Hana Aulia Afifi, Faris Azhar Ramadhan, Affan Azmi Abdurrahman yang menemaniku dengan doa-doanya dan selalu memberi semangat;
Akhir kata, Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan, akan tetapi Penulis berharap semoga tesis ini dapat bermanfaat bagi kita semua. Aamiin.
Bandar Lampung, Juli 2015
Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... i
DAFTAR GAMBAR ... iii
I. PENDAHULUAN ... 1
A. Latar Belakang dan Masalah ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 4
II. TINJAUAN PUSTAKA ... 5
A. Timah ... 5
B. Senyawa Organotimah ... 5
1. Senyawa Organotimah Halida ... 6
2. Senyawa Organotimah Oksida dan Hidroksida ... 7
3. Senyawa Organotimah Karboksilat ... 7
4. Aplikasi Senyawa Organotimah ... 8
C. Senyawa Asam Klorobenzoat ... 9
D. Analisis Spektroskopi IR ... 11
E. Analisis Spektroskopi UV-Vis ... 12
F. Analisis Spektroskopi NMR ... 14
1. 1H NMR ... 14
2. 13C NMR ... 15
G. Analisis Unsur Menggunakan Microelemental Analyzer .... 15
H. Korosi ... 16
1. Jenis-Jenis Korosi ... 17
2. Proses Korosi ... 18
3. Faktor-Faktor Penyebab Korosi ... 19
4. Inhibitor Korosi ... 20
J. Potensiostat ... 23
K. Polarisasi Potensiodinamik ... 25
III. METODOLOGI PENELITIAN ... 29
A. Waktu dan Tempat ... 29
B. Alat dan Bahan ... 29
C. Metode ... 30
1. Sintesis Senyawa Difeniltimah(IV) oksida ... 31
2. Sintesis Senyawa Difeniltimah(IV) diklorobenzoat ... ... 31
3. Preparasi Baja Lunak ... 32
4. Pembuatan Medium Korosif ... 32
5. Pembuatan Larutan Inhibitor ... 32
6. Pengaturan Pemindaian dengan Potensiostat ... 33
7. Pengujian Korosi ... 34
8. Analisis Data ... 35
9. Analisis Kualitatif Korosi ... 36
IV. HASIL DAN PEMBAHASAN ... 37
A. Sintesis Senyawa Difeniltimah(IV) oksida ... 37
B. Sintesis Senyawa Difeniltimah(IV) diklorobenzoat ... 41
C. Preparasi Baja Lunak ... 54
D. Pengujian Aktivitas Inhibitor Korosi Difeniltimah(IV) diklorida ... 55
E. Pengujian Aktivitas Inhibitor Korosi Difeniltimah(IV) oksida 57
F. Pengujian Aktivitas Inhibitor Korosi Difeniltimah(IV) diklorobenzoat ... 60
G. Analisis Kualitatif Permukaan Baja ... 64
H. Mekanisme Inhibisi Korosi Difeniltimah(IV) diklorobenzoat 66
V. SIMPULAN DAN SARAN ... 74
A. Simpulan ... 74
B. Saran ... 75
DAFTAR PUSTAKA ... 76
LAMPIRAN ... 80
Tabel 16 ... 90
DAFTAR TABEL
Tabel Halaman
1. Nilai ketahanan korosi untuk beberapa bahan inhibitor korosi ... 10
2. Harga %EI untuk beberapa senyawa ... 10
3. Harga pKa untuk beberapa asam benzoat ... 11
4. Serapan karakteristik IR untuk asam-asam karboksilat ... 12
5. Persentase rendemen sintesis difeniltimah(IV) oksida ... 37
6. Pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-2-klorobenzoat ... 44
7. Pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-3-klorobenzoat ... 44
8. Pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-4-klorobenzoat ... 44
9. Perbandingan pergeseran panjang gelombang maksimum senyawa awal dan hasil sintesis ... 49
10. Spektrum 1H dan 13C NMR pada senyawa hasil sintesis ... 53
11. Hasil mikroanalisis unsur hidrogen ... 53
12. Hasil mikroanalisis unsur karbon ... 54
13. Data efisiensi inhibisi penambahan senyawa difeniltimah(IV) diklorida dibandingkan kontrol DMSO-HCl ... 57
15. Data efisiensi inhibisi penambahan senyawa difeniltimah(IV)
diklorobenzoat dibandingkan kontrol DMSO-HCl ... 62
DAFTAR GAMBAR
Gambar Halaman
1. Pergeseran kimia 1H NMR ... 14
2. Pergeseran kimia 13C NMR ... 15
3. Hot roller plate ... 23
4. Skema potensiostat, komputer, dan elektroda ... 24
5. ER466 integrated potentiostat system eDAQ ... 24
6. Kurva polarisasi pada korosi baja ... 26
7. Kurva ekstrapolasi Tafel ... 27
8. Pengaturan pemindaian (a) anoda dan (b) katoda ... 33
9. Kristal senyawa difeniltimah(IV) oksida ... 37
10. Spektrum IR (a) difeniltimah(IV) diklorida dan (b) difeniltimah(IV) oksida ... 39
11. Spektrum UV (a) difeniltimah(IV) diklorida dan (b) difeniltimah(IV) oksida ... 40
12. Kristal senyawa (a) difeniltimah(IV) di-2-klorobenzoat, (b) difeniltimah(IV) di-3-klorobenzoat, dan (c) difeniltimah(IV) di-4-klorobenzoat ... 42
13. Spektrum IR (a) difeniltimah(IV) oksida, (b) difeniltimah(IV) di-2-klorobenzoat, (c) difeniltimah(IV) di-3-klorobenzoat, dan (d) difeniltimah(IV) di-4-klorobenzoat .. ... 46
iii
15. Spektrum 1H NMR (a) difeniltimah(IV) di-2-klorobenzoat,
(b) difeniltimah(IV) di-3-klorobenzoat, dan (c) difeniltimah(IV) di-4-klorobenzoat ... 50
16. Spektrum 13C NMR (a) difeniltimah(IV) di-2-klorobenzoat, (b) difeniltimah(IV) di-3-klorobenzoat, dan (c) difeniltimah(IV) di-4-klorobenzoat ... 51
17. Struktur (a) difeniltimah(IV) di-2-klorobenzoat, (b) difeniltimah(IV) di-3-klorobenzoat, dan (c) difeniltimah(IV) di-4-klorobenzoat ... 52
18. Potongan baja (a) sebelum diamplas dan (b) setelah diamplas .. 55
19. Grafik hasil pemindaian senyawa difeniltimah(IV) diklorida
terhadap kontrol medium korosif tanpa inhibitor ... 56
20. Grafik hasil pemindaian senyawa difeniltimah(IV) oksida terhadap kontrol medium korosif tanpa inhibitor ... 58
21. Grafik perbandingan persen efisiensi inhibisi difeniltimah(IV)
diklorida dan difeniltimah(IV) oksida ... 59
22. Grafik hasil pemindaian senyawa difeniltimah(IV) di-2- klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, dan (c) difeniltimah(IV) di-4-klorobenzoat terhadap kontrol medium korosif tanpa inhibitor ... 61
23. Grafik perbandingan persen efisiensi inhibisi difeniltimah(IV) di-2-klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat ... 63
24. Perendaman permukaan baja pada (a) medium korosif tanpa inhibitor, (b) penambahan senyawa difeniltimah(IV) di-2-klorobenzoat, (c) penambahan senyawa difeniltimah(IV) di-3-klorobenzoat, dan (d) penambahan senyawa difeniltimah(IV) di-4-klorobenzoat ... 64
25. Permukaan baja pada (a) medium korosif tanpa inhibitor dan (b) penambahan senyawa difeniltimah(IV) di-2-klorobenzoat .. 65
27. Kurva polarisasi katoda (a) difeniltimah(IV) di-2-klorobenzoat, (b) difeniltimah(IV) di-3-klorobenzoat, dan (c)difeniltimah(IV) di-4-klorobenzoat ... 69
28. Skema proses korosi baja lunak di dalam air ... 71
1
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Korosi adalah proses kerusakan atau degradasi pada material akibat berinteraksi dengan lingkungannya (Uhlig, 2000). Korosi merupakan masalah besar bagi peralatan yang menggunakan material dasar logam seperti mobil, jembatan, mesin, pipa, kapal, dan sebagainya (Rieger, 1992). Masalah yang sering terjadi adalah karat yang semakin meluas menjadi kerak pada permukaan besi dan ekspos besi ke lingkungan. Kerugian yang dapat ditimbulkan oleh korosi tidak hanya biaya langsung seperti pergantian peralatan industri, perawatan
jembatan, konstruksi, dan sebagainya, tetapi juga biaya tidak langsung seperti terganggunya proses produksi dalam industri dan kelancaran transportasi, yang umumnya lebih besar dibandingkan biaya langsung (Rahmani, 2011).
bekerja dengan membentuk lapisan pasif berupa lapisan tipis atau film di permukaan
material yang berfungsi sebagai penghalang antara logam dengan media yang korosif
(Febrianto dkk., 2010)
Senyawa turunan organotimah ditiohidrazodikarbonamida dan organotimah ditiobiurets (Rastogi et al., 2005; Rastogi et al., 2011) serta beberapa senyawa turunan organotimah baik golongan karboksilat, fosfat, ligan donor –N maupun –S diketahui memiliki aktivitas yang baik sebagai inhibitor korosi (Singh et al.,
2010; Hadi et al., 2015). Hasil uji terhadap senyawa turunan tersebut yang telah dilakukan dengan metode polarisasi potensiodinamik diketahui bahwa senyawa organotimah(IV) karboksilat mampu menahan laju korosi terhadap baja dan logam aluminium 25 - 100 kali lebih efektif bila dibandingkan tanpa
menggunakan senyawa organotimah(IV) atau dengan bahan inhibitor korosi yang lain (Singh et al., 2010). Berdasarkan hal tersebut, maka dalam penelitian ini dilakukan sintesis senyawa organotimah(IV) karboksilat untuk mencari alternatif yang lain sebagai inhibitor korosi yaitu dengan cara mereaksikan senyawa
organotimah(IV) dengan beberapa ligan asam klorobenzoat. Senyawa organotimah(IV) karboksilat yang disintesis ini dikarakterisasi dengan
3
tersebut berada kontak dengan larutan yang bersifat korosif (Rastogi et al., 2005; Rastogi et al., 2011).
Pengukuran laju korosi pada baja lunak dilakukan dengan metode elektrokimia dengan mesin eDAQ. Mesin eDAQ dilengkapi dengan potensiostat untuk mengontrol tegangan elektroda, e-corder untuk merekam data, dan Echem untuk menampilkan data dalam bentuk grafik, kemudian diolah dengan metode analisis
Tafel untuk mendapatkan arus korosi (Butarbutar dan Febrianto, 2009). Data arus korosi yang diperoleh selanjutnya dikonversi untuk mendapatkan nilai efisiensi inhibisi (EI) korosi. Tujuan pengukuran ini adalah untuk mendapatkan nilai optimum dari inhibitor yang paling efektif dalam menekan laju korosi. Parameter yang dipakai adalah variasi konsentrasi inhibitor yang ditambahkan pada suatu sistem yang statis, dimana tidak terjadi aliran serta injeksi inhibitor secara kontinyu. Keefektivitasan penambahan inhibitor ini dapat diketahui dengan bertambahnya efisiensi inhibisi korosi material baja lunak dibandingkan dengan tanpa penambahan inhibitor.
B. Tujuan Penelitian
Tujuan dari penelitian ini sebagai berikut:
2. Menentukan nilai efektivitas dan persentase efisiensi inhibisi (%EI) senyawa organotimah(IV) karboksilat hasil sintesis sebagai inhibitor dalam menekan laju korosi pada baja lunak.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Timah
Timah atau Stannum (Sn) memiliki nomor atom 50 dan massa atom relatif 118,71 sma. Pada tabel periodik, timah termasuk golongan IVA dan periode 5 bersama-sama dengan karbon, silikon, germanium, dan timbal (Daintith, 1990). Timah dalam bentuk senyawaannya memiliki tingkat oksidasi +2 dan +4, tingkat oksidasi +4 lebih stabil daripada +2. Pada tingkat oksidasi +4, timah menggunakan
seluruh elektron valensinya yaitu 5s2 5p2 dalam ikatan, sedangkan pada tingkat oksidasi +2, timah hanya menggunakan elektron valensi 5p2 saja, tetapi perbedaan energi antara kedua tingkat ini rendah (Cotton dan Wilkinson, 1989).
B. Senyawa Organotimah
Senyawa organotimah adalah senyawa organologam yang disusun oleh satu atau lebih ikatan antara atom timah dengan atom karbon (Sn─C). Atom Sn dalam senyawa organotimah umumnya berada dalam tingkat oksidasi +4. Rumus
struktur senyawa organotimah adalah RnSnX4-n (n = 1 - 4), dengan R adalah gugus
Berdasarkan sisi fisika dan kimia, senyawa organotimah merupakan monomer yang dapat membentuk makromolekul stabil, padat (metiltimah, feniltimah, dan dimetiltimah) dan cairan (butiltimah) yang sangat mudah menguap, menyublim, dan tidak berwarna serta stabil terhadap hidrolisis dan oksidasi (Grenwood and Earnshaw, 1990). Kecenderungan terhidrolisis dari senyawa organotimah lebih lemah dibandingkan senyawa Si atau Ge yang terikat dan ikatan Sn─O dapat bereaksi dengan larutan asam. Senyawa organotimah tahan terhadap hidrolisis atau oksidasi pada kondisi normal walaupun dibakar menjadi SnO2, CO2, dan
H2O. Kemudahan putusnya ikatan Sn─C oleh halogen atau reagen lainnya
bervariasi berdasarkan gugus organiknya dan urutannya meningkat dengan urutan: Bu (paling stabil) < Pr < et < me < vinil < Ph < Bz < alil < CH2CN < CH2CO2R
(paling tidak stabil) (Van der Weij, 1981).
1. Senyawa Organotimah Halida
Senyawa organotimah halida dengan rumus umum RnSnX4-n (n = 1 - 3; X = Cl,
Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif.
Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi:
2 EtI + Sn Et2Sn + I2 (2.1)
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dangan timah(IV) klorida. Caranya dengan mengubah perbandingan material awal, seperti pada persamaan reaksi berikut:
7
SnR4 + SnCl4
2 R2SnCl2 (2.3)
3 SnR4+ SnCl4 4 R3SnCl (2.4)
Ketiga persamaan reaksi merupakan reaksi redistribusi Kocheshkov. Reaksinya berlangsung dalam atmosfer bebas uap air. Rendemen yang diperoleh dengan metode tersebut cukup tinggi.
Senyawa organotimah klorida digunakan sebagai kloridanya dengan memakai logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi berikut:
R4SnCl4-n + (4-n) MX R4SnX4-n + (4-n) MCl (2.5)
(X = F, Br, I; M = K, Na, NH4) (Wilkinson, 1982).
2. Senyawa Organotimah Oksida dan Hidroksida
Produk kompleks yang diperoleh melalui hidrolisis dari trialkiltimah halida dan senyawa yang berikatan R3SnX, merupakan rute utama pada trialkiltimah oksida
dan trialkiltimah hidroksida. Prinsip tahapan intermediet ditunjukkan pada reaksi di bawah ini:
OH
R3SnX R2Sn XR2SnOSnR2X XR2SnOSnR2OH R2SnO
X atau
R3SnOH
(2.6) (Wilkinson, 1982).
3. Senyawa Organotimah Karboksilat
karboksilat dan dari organotimah halidanya dengan garam karboksilat. Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal. Organotimah halida direaksikan dengan garam karboksilat dalam pelarut yang sesuai, biasanya aseton atau karbon tetraklorida. Reaksinya adalah sebagai berikut:
R4SnCl4-n + (4-n) MOCOR R4Sn(OCOR)4-n + (4-n) MCl (2.7)
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti ditunjukkan pada reaksi berikut:
R2SnO + 2 R’COOH R2Sn(OCOR’)2 + H2O (2.8)
R3SnOH + R’COOH R3SnOCOR’ + H2O (2.9)
(Wilkinson, 1982).
4. Aplikasi Senyawa Organotimah
Senyawa organotimah memiliki aplikasi yang luas dalam kehidupan sehari-hari. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa
stabilizer polivinilklorida, pestisida nonsistematik, katalis antioksidan, antifouling agents dalam cat, stabilizer pada plastik dan karet sintetik, stabilizer untuk
9
pembuatan polisilikon, poliuretan, dan untuk sintesis poliester (Van der Weij, 1981).
Pada beberapa penelitian, telah didapat dan diisolasi senyawa organotimah(IV) karboksilat yang menunjukkan sifat sebagai antimikroorganisme sehingga dapat berfungsi sebagai antifungi dan antimikroorganisme (Bonire et al., 1998). Diketahui kompleks di- dan triorganotimah halida dengan berbagai ligan yang mengandung nitrogen, oksigen, dan sulfur memiliki aktivitas biologi dan
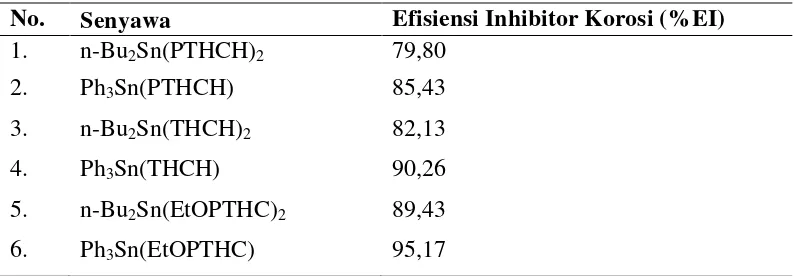
farmakologi serta digunakan sebagai fungisida dalam pertanian, bakterisida, dan agen antitumor (Jain et al., 2002). Senyawa organotimah(IV) karboksilat juga menunjukkan sifat sebagai inhibitor korosi. Nilai ketahanan korosi untuk beberapa bahan inhibitor korosi dan berbagai harga efisiensi inhibitor korosi (%EI) untuk beberapa senyawa dapat dilihat pada Tabel 1 dan 2.
C. Senyawa Asam Klorobenzoat
Asam klorobenzoat memiliki rumus molekul C7H5ClO2, berat molekul 156,57
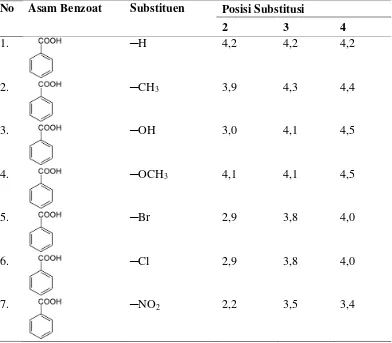
g/mol, dan berbentuk serbuk berwarna putih. Asam klorobenzoat terdiri dari 3 jenis isomer yaitu asam 2-klorobenzoat, 3-klorobenzoat, dan 4-klorobenzoat Sigma-Aldrich (2014). Harga pKa untuk asam klorobenzoat dan beberapa asam
Tabel 1. Nilai ketahanan korosi untuk beberapa bahan inhibitor korosi.
No. Bahan Inhibitor Korosi
Lama Pengujian
Observasi Ketahanan
1. Tanpa inhibitor
korosi 2 -4 hari Permukaan logam sudah berkarat dan semakin banyak dengan
bertambahnya hari
2 x
2. Pentaklorofenol 10 hari Permukaan logam berkarat
semakin bertambah dengan bertambahnya hari
5 x
3. Dirodanometana 20 hari Perkaratan permukaan
logam lebih lambat
dibandingkan bahan nomor 2 dengan bertambahnya hari
10 x
4.
Tri-n-butiltimahasetat 30 hari Perkaratan permukaan logam lebih lambat dibandingkan bahan nomor 2 dan 3 dengan
bertambahnya hari
15 x
5.
Tri-n-butiltimah-t-butoksiasetat 250 hari Perkaratan terjadi sangat lambat dan memerlukan waktu yang sangat lama dan jauh lebih baik dibandingkan inhibitor korosi pada nomor 2 dan 4
50 - 125 x
Sumber: Singh et al. ( 2010).
Tabel 2. Harga %EI untuk beberapa senyawa.
No. Senyawa Efisiensi Inhibitor Korosi (%EI) 1. n-Bu2Sn(PTHCH)2 79,80
2. Ph3Sn(PTHCH) 85,43
3. n-Bu2Sn(THCH)2 82,13
4. Ph3Sn(THCH) 90,26
5. n-Bu2Sn(EtOPTHC)2 89,43
6. Ph3Sn(EtOPTHC) 95,17
[image:30.595.114.511.538.676.2]
11
Tabel 3. Harga pKa untuk beberapa asam benzoat.
No Asam Benzoat Substituen Posisi Substitusi
2 3 4
1. ─H 4,2 4,2 4,2
2. ─CH3 3,9 4,3 4,4
3. ─OH 3,0 4,1 4,5
4. ─OCH3 4,1 4,1 4,5
5. ─Br 2,9 3,8 4,0
6. ─Cl 2,9 3,8 4,0
7. ─NO2 2,2 3,5 3,4
Sumber: Fessenden and Fessenden (1986).
D. Analisis Spektroskopi IR
Pada spektroskopi IR (infrared) atau inframerah, spektrum untuk penentuan struktur senyawa organik biasanya antara 650 - 4.000 cm-1 (15,4 – 2,5 µm). Daerah di bawah frekuensi 650 cm-1 dinamakan inframerah jauh dan daerah di atas frekuensi 4.000 cm-1 dinamakan inframerah dekat. Letak puncak serapan umumnya digunakan satuan bilangan gelombang (cm-1) dan hanya sebagian kecil
Secara umum, spektrum serapan IR dapat dibagi menjadi tiga daerah: a. Inframerah dekat, dengan bilangan gelombang antara 14.300 hingga
4.000 cm-1. Fenomena yang terjadi ialah absorpsi overtone C─H. b. Inframerah sedang, dengan bilangan gelombang antara 4.000 hingga
650 cm-1. Fenomena yang terjadi ialah vibrasi dan rotasi.
c. Inframerah jauh, dengan bilangan gelombang 650 hingga 200 cm-1. Fenomena
yang terjadi ialah penyerapan oleh ligan atau spesi lainnya yang berenergi rendah.
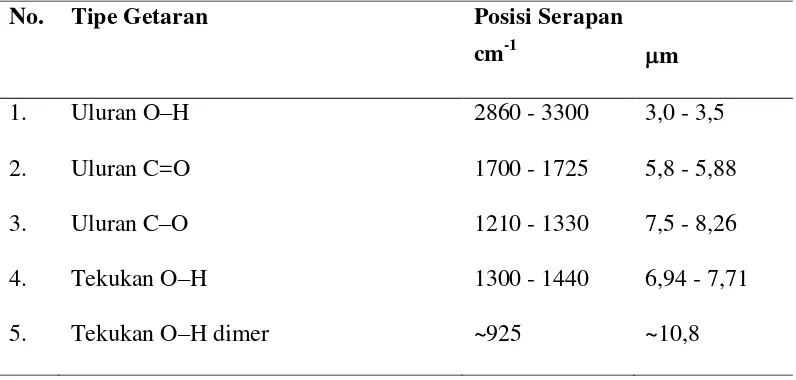
[image:32.595.114.512.378.568.2]Serapan karakteristik IR untuk asam-asam karboksilat dapat dilihat pada Tabel 4.
Tabel 4. Serapan karakteristik IR untuk asam-asam karboksilat.
No. Tipe Getaran Posisi Serapan
cm-1 m
1. Uluran O–H 2860 - 3300 3,0 - 3,5
2. Uluran C=O 1700 - 1725 5,8 - 5,88
3. Uluran C–O 1210 - 1330 7,5 - 8,26
4. Tekukan O–H 1300 - 1440 6,94 - 7,71
5. Tekukan O–H dimer ~925 ~10,8
Sumber: Fessenden dan Fessenden (1986).
E. Analisis spektroskopi UV-Vis
13
gelombang serapan merupakan ukuran perbedaan tingkat-tingkat energi dari orbital-orbital. Supaya elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi dan akan memberikan serapan pada 120 - 200 nm (1 nm = 10-7 cm = 10 Å). Daerah ini dikenal sebagai daerah ultraviolet hampa, karena pada pengukuran tidak boleh ada udara, sehingga sukar dilakukan dan relatif tidak banyak memberikan keterangan untuk penentuan struktur.
Di atas 200 nm merupakan daerah eksitasi elektron dari orbital p, d, dan π, terutama sistem π terkonjugasi yang mudah pengukurannya dan spektrumnya
memberikan banyak keterangan. Kegunaan spektrofotometer UV-Vis ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik di dalam suatu molekul. Spektrofotometer ini dapat secara umum membedakan diena terkonjugasi dari diena tak terkonjugasi, diena terkonjugasi dari triena, dan sebagainya. Letak serapan dapat dipengaruhi oleh subtituen dan terutama yang berhubungan dengan subtituen yang menimbulkan pergeseran dalam diena terkonjugasi dari senyawa karbonil (Sudjadi, 1985).
Elektron pada ikatan kovalen tunggal terikat dengan kuat dan diperlukan radiasi berenergi tinggi atau panjang gelombang yang pendek untuk eksitasinya. Hal ini berarti suatu elektron dalam orbital ikatan (bonding) dieksitasikan ke orbital antiikatan. Identifikasi kualitatif senyawa organik dalam daerah ini jauh lebih terbatas daripada dalam daerah inframerah, dikarenakan pita serapan pada daerah
karakteristik dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam molekul (Day dan Underwood, 1998).
F. Analisis Spektroskopi NMR
1. 1H NMR
Spektroskopi proton atau 1H memberikan gambaran atom-atom hidrogen dalam sebuah molekul organik. Spektroskopi ini didasarkan pada prinsip bahwa setiap kelompok proton (H) dalam molekul organik akan beresonansi pada frekuensi yang tidak identik atau beresonansi pada frekuensi spesifik (McMurry, 2008; Silverstein et al., 2005). Setiap proton dalam molekul dikelilingi elektron, sehingga menimbulkan sedikit perbedaan lingkungan elektronik dari satu proton dengan proton lainnya. Proton-proton dilindungi oleh elektron-elektron yang mengelilinginya sehingga efek dari perlindungan elektron menghasilkan medan magnet yang disebut dengan nilai pergeseran kimia (chemical shift). Pergeseran kimia memiliki simbol δ, yang dinyatakan sebagai bagian tiap juta (ppm) dari
[image:34.595.121.491.568.646.2]frekuensi radio yang digunakan (Gambar 1) (McMurry, 2008; Lambert and Mazolla, 2004).
15
2. 13C NMR
Spektroskopi karbon-13 atau 13C memberikan gambaran karbon-karbon dalam
sebuah molekul organik. Pergeseran kimia 13C antara 0 sampai dengan 220 ppm yang terbagi atas sp3 antara 0 - 60, alkohol 60 - 80 ppm, sp antara 70 - 80 ppm, sp2 antara 100 - 160 ppm, gugus karbonil dari gugus karboksilat, ester, lakton, amida, anhidrida, antara 160 - 180 ppm sedangkan aldehida antara 180 - 200 ppm, dan keton antara 190 - 220 ppm (Gambar 2) (Ramiro et al., 2012; Yu-Chia et al., 2012; Wyk et al., 2007; Silverstein et al., 2005). Bentuk sinyal dari gugus metil (CH3) berbentuk quartet (q), metilen (CH2) berbentuk triplet (t), metin (CH)
berbentuk doublet (d) sedangkan karbon quartener berbentuk singlet (s), dan rentang pergeseran 13C NMR dari 0 - 220 ppm (Ramiro et al., 2012; Yu-Chia et
al., 2012; Wyk et al., 2007; Joseph, 1999; Roe, 1996).
Gambar 2. Pergeseran kimia 13C NMR (sumber: Silverstein et al., 2008).
G. Analisis Unsur Menggunakan Microelemental analyzer
microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini selanjutnya dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costech Analytical Technologies, 2011). Prinsip dasar dari microelemental analyzer yaitu sampel dibakar pada suhu tinggi. Produk yang dihasilkan dari pembakaran tersebut merupakan gas yang telah dimurnikan
kemudian dipisahkan berdasarkan masing-masing komponen dan dianalisis dengan detektor yang sesuai. Pada dasarnya, sampel yang diketahui jenisnya dapat diperkirakan beratnya dengan menghitung setiap berat unsur yang
diperlukan untuk mencapai nilai kalibrasi terendah atau tertinggi (Caprette, 2007).
H. Korosi
17
1. Jenis-Jenis Korosi
Menurut Fontana (1986), beberapa jenis korosi yang umum terjadi pada logam sebagai berikut:
a. Korosi galvanis (bemetal corrosion)
Korosi galvanis terjadi karena perbedaan potensial antara dua logam yang tidak sama, bila kedua logam ini bersinggungan akan menghasilkan aliran elektron di antara kedua logam tersebut.
b. Korosi sumuran (pitting corrosion)
Korosi sumuran adalah bentuk penyerangan korosi setempat yang menghasilkan sumur pada logam di tempat tertentu.
c. Korosi erosi (errosion corrosion)
Korosi erosi disebabkan oleh gabungan peristiwa korosi dan korosi akibat aliran fluida sehingga proses korosi lebih cepat.
d. Korosi regangan (stress corrosion)
Gaya-gaya seperti tarikan (tensile) atau kompresi (compressive) berpengaruh sangat kecil pada proses pengkaratan.
e. Korosi celah (crevice corrosion)
Korosi ini terjadi pada suatu logam di daerah yang berhubungan langsung dengan bahan lain yang bukan logam.
f. Korosi kavitasi (cavitation corrosion)
g. Korosi lelah (fatigue corrosion)
Bila logam mendapat beban siklus yang berulang-ulang, tetapi masih di bawah batas kekuatan luluhnya.
h. Korosi antar kristal
Terjadinya korosi hanya pada batas kristal, akibat dari serangan elektrolit karena tegangan pada kristal adalah paling tinggi. Terjadinya karbida pada batas butir ini yang dapat mengakibatkan korosi.
i. Korosi batas butir
Korosi batas butir merupakan korosi yang terjadi pada batas butir logam.
2. Proses Korosi
Menurut Uhlig (2000), terkorosinya suatu logam dalam lingkungan elektrolit (air) adalah suatu proses elektrokimia. Proses ini terjadi bila ada reaksi setengah sel yang melepaskan elektron (reaksi oksidasi pada anodik) dan reaksi setengah sel yang menerima elektron (reaksi reduksi pada katodik). Kedua reaksi ini akan terus berlangsung sampai terjadi kesetimbangan dinamis dengan jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima. Suatu logam yang dicelupkan pada suatu larutan elektrolit, maka akan terbentuk dua lokasi yang disebut anoda dan katoda. Pada anoda terjadi reaksi oksidasi dan pada katoda terjadi reaksi reduksi. Pada anoda, tempat terjadinya reaksi oksidasi dan biasanya terkorosi yaitu:
19
Pada katoda, tempat terjadinya reaksi reduksi dan tidak mengalami korosi. Dua reaksi penting yang umum terjadi pada katoda tergantung pH larutan yaitu:
pH < 7 : 2 H+ + 2 e- → H2 (2.11)
pH ≥ 7 : O2 + 2 H2O + 4e- → 4 OH- (2.12)
3. Faktor-Faktor Penyebab Korosi
Faktor-faktor penyebab terjadinya korosi antara lain adalah atmosfer atau udara, air, tanah, gas-gas korosif, dan zat-zat kimia (Trethewey and Chamberlein, 1991). a. Atmosfer atau udara
Udara penyebab korosi dibedakan menjadi 2 yaitu udara kering dan udara basah (lembab). Udara kering hanya mengandung sedikit sekali uap air, sedangkan udara lembab dapat mengandung lebih banyak uap air. Pada udara yang kering dan bersih, proses korosi berjalan sangat lambat, sedangkan pada udara lembab korosi dapat terjadi dengan lebih cepat. Ini dapat disebabkan karena udara yang jenuh dengan uap air banyak mengandung garam-garam, asam, zat-zat kimia, dan gas-gas.
b. Air
reaksi reduksi-oksidasi. Biasanya zat terlarut yang membentuk asam,
misalnya belerang dioksida dan karbon dioksida yang akan mempercepat laju korosi.
c. Tanah
Korosi di dalam tanah selain terjadi pada pipa-pipa dan kabel-kabel juga terjadi pada pondasi-pondasi logam yang terpendam di dalamnya. Pada pemasangan pipa-pipa dalam tanah, tanah yang digali dan kemudian ditutup lagi memungkinkan adanya oksigen tertahan di dalam tanah sehingga dapat menyebabkan korosi. Korosi elektrokimia dapat terjadi dalam tanah akibat adanya arus listrik yang disebabkan oleh kebocoran arus listrik dari kabel-kabel jalan rel kereta api atau sumber-sumber lain. Untuk menanggulangi masalah seperti itu dibutuhkan teknik isolasi yang baik terhadap kabel yang dikubur dalam tanah.
d. Zat-zat kimia
Zat-zat kimia yang dapat menyebabkan korosi antara lain adalah asam, basa, dan garam baik dalam bentuk cair, padat maupun gas. Pada umumnya korosi oleh zat-zat kimia pada suatu material dapat terjadi bila material mengalami kontak langsung dengan zat-zat kimia tersebut.
4. Inhibitor Korosi
21
Menurut Butarbutar dan Sunaryo (2001), secara umum inhibitor korosi dibagi atas dua kategori yaitu:
a. Inhibitor anodik
Inhibitor anodik menurunkan laju korosi dengan cara memperlambat reaksi anodik. Inhibitor anodik membentuk lapisan pasif melalui reaksi ion-ion logam yang terkorosi untuk menghasilkan selaput pasif tipis yang akan menutupi anoda (permukaan logam) dan lapisan ini akan menghalangi pelarutan anoda selanjutnya. Lapisan pasif yang terbentuk mempunyai potensial korosi yang tinggi atau inhibitor anodik menaikkan polarisasi anodik. Senyawa yang biasa digunakan sebagai inhibitor anodik adalah kromat, nitrit, nitrat, molibdat, silikat, fosfat, dan borat.
b. Inhibitor katodik
Inhibitor katodik menurunkan laju korosi dengan cara memperlambat reaksi katodik. Inhibitor katodik bereaksi dengan OH- untuk mengendapkan
senyawa-senyawa tidak larut pada permukaan logam sehingga dapat menghalangi masuknya oksigen. Contoh inhibitor tipe ini antara lain Zn, CaCO3, dan polifosfat.
I. Baja Lunak
Menurut Amanto dan Daryanto ( 2006), komposisi kimia baja dibedakan menjadi dua yaitu baja karbon dan padanan. Baja karbon adalah baja yang bukan hanya tersusun atas padanan besi dan karbon, tetapi juga unsur lain yang tidak
Ada beberapa jenis baja karbon antara lain sebagai berikut:
1. Baja karbon rendah mengandung 0,022 - 0,3% C yang dibagi menjadi empat bagian menurut kandungannya yaitu:
a. Baja karbon rendah mengandung 0,04% C digunakan untuk plat-plat strip. b. Baja karbon rendah mengandung 0,05% C digunakan untuk badan
kendaraan.
c. Baja karbon rendah mengandung 0,05 - 0,25% C digunakan untuk konstruksi jembatan dan bangunan.
d. Baja karbon rendah mengandung 0,05 - 0,3% C digunakan untuk baut paku keling karena kepalanya harus dibentuk.
2. Baja karbon menengah
Baja karbon ini memiliki sifat-sifat mekanik yang lebih baik daripada baja
karbon rendah. Baja karbon menengah mengandung 0,3 - 0,6% C dan memiliki ciri khas lebih kuat dan keras daripada baja karbon rendah, tidak mudah dibentuk dengan mesin, lebih sulit dilakukan untuk pengelasan, dan dapat dikeraskan dengan baik.
3. Baja karbon tinggi
Baja karbon tinggi memiliki kandungan antara karbon antara 0,6 - 1,7% C, memiliki ciri-ciri sangat kuat yaitu getas/rapuh, sulit dibentuk mesin,
mengandung unsur sulfur dan fosfor, dan dapat dilakukan proses heat
treatment dengan baik.
23
Gambar 3. Hot roller plate (sumber: www.tokobesionline.com).
J. Potensiostat
Menurut Butarbutar dan Febrianto (2009), potensiostat merupakan peralatan yang digunakan pada penelitian elektrokimia untuk mengamati fenomena yang terjadi selama proses korosi terjadi. Potensiostat akan mengaplikasikan tegangan listrik inputan kepada benda uji sehingga nilai arus selama proses korosi dapat diperoleh. Peralatan potensiostat biasanya dilengkapi dengan tiga jenis elektroda yaitu: a. Elektroda kerja (working electrode): elektroda ini dibentuk dari logam benda uji yang akan diteliti, terkoneksi dengan sambungan listrik, dan permukaannya harus digerinda atau diamplas untuk menghilangkan oksida-oksida
yang mungkin ada.
b. Elektroda bantu (auxiliary electrode): elektroda yang khusus digunakan untuk mengalirkan arus hasil proses korosi yang terjadi dalam rangkaian sel.
c. Elektroda acuan (reference electrode): elektroda yang tegangan sirkuit
terbukanya (open-circuit potential) konstan dan digunakan untuk mengukur potensial elektroda kerja.
Chamberlin, 1991). Potensiostat dilengkapi dengan EChem sebagai perangkat lunak. EChem adalah suatu program yang biasa digunakan dalam penelitian elektrokimia. Dalam pelaksanaanya EChem dihubungkan dengan potensiostat sehingga arus yang dihasilkan pada setiap potensial yang diberikan direkam oleh komputer secara langsung (Butarbutar dan Febrianto, 2009). Skema potensiostat, komputer, dan elektroda dapat dilihat pada Gambar 4.
Gambar 4. Skema potensiostat, komputer, dan elektroda (Butarbutar dan Febrianto, 2009).
Dalam penelitian ini digunakan instrumen ER466 integrated potentiostat system eDAQ seperti pada Gambar 5.
Gambar 5. ER466 integrated potentiostat system eDAQ (sumber: www.eDAQ.com)
25
potensiostat jenis ini adalah penggunaannya yang relatif mudah, dapat memonitoring arus dari nanoampere hingga 100 mA, praktis, dan lain-lain (Anonim, 2010).
K. Polarisasi Potensiodinamik
Polarisasi potensiodinamik adalah suatu metode untuk menentukan perilaku korosi logam berdasarkan hubungan potensial dan arus anodik atau katodik. Jika logam berada kontak dengan larutan yang bersifat korosif, maka pada permukaan logam dapat terjadi reaksi reduksi dan reaksi oksidasi secara bersamaan
disebabkan pada permukaan logam terbentuk banyak mikrosel (mikroanoda dan mikrokatoda). Korosi logam terjadi jika terdapat arus anodik yang besarnya sama dengan arus katodik, walaupun tidak ada arus yang diberikan dari luar sistem. Hal ini disebabkan ada perbedaan potensial antara logam dan larutan sebagai lingkungannya. Beda potensial ini dinamakan sebagai potensial korosi, Ecorr
(Sunarya, 2008).
Pada Ecorr, laju oksidasi sama dengan laju reduksi sehingga sistem tersebut
setimbang. Arus reduksi (Ired) terjadi pada proses reduksi, arus oksidasi (Ioks)
terjadi pada proses oksidasi. Pada Ecorr, Ired = Ioks dan Itotal = Ired + Ioks = 0.
Arus yang terukur pada instrumen merupakan arus total. Bila suatu potensial yang tidak sama dengan Ecorr diberikan pada suatu sistem maka akan terjadi
polarisasi sehingga terjadi reaksi reduksi dan oksidasi. Dengan demikian Ired dan
Ioks pada Ecorr dapat ditentukan. Arus ini yang disebut arus korosi (Icorr) dan
Potensiostat dapat mengukur laju korosi berdasarkan perubahan potensial listrik terhadap perubahan arus yang dideteksi selama proses korosi pada saat
pengukuran berlangsung menggunakan bantuan kurva ekstrapolasi Tafel seperti yang ditunjukkan pada Gambar 6.
Gambar 6. Kurva polarisasi pada korosi baja.
Kurva polarisasi yang dihasilkan dapat diukur potensial korosi dan arus korosi yang terjadi dengan bantuan metode ekstrapolasi Tafel. Terjadinya korosi pada baja lunak juga dapat diketahui dari pola kurva yang dihasilkan. Penerapan potensial dari luar yang melebihi potensial ini disebut potensial lebih (over
potential). Peningkatan potensial lebih yang diterapkan tidak diikuti dengan peningkatan arus, maka pada potensial tersebut telah terjadi polarisasi seperti pada pola kurva yang terbentuk setelah zona Tafel (Fadli, 2011).
Pada awal pengujian terjadi kompetisi antara proses anodik dan katodik. Data tegangan dan arus yang langsung didapat dari pengujian yang diolah dengan
27
daerah anodik ditentukan pada daerah dimana arus turun tanpa naik lagi untuk selang over potential tertentu, sehingga Tafel slope positif. Adapun trendline daerah katodik ditentukan pada daerah dimana arus naik tanpa turun lagi untuk selang over potential tertentu, sehingga Tafel slope negatif. Oleh karena laju oksidasi dan laju reduksi sama maka persamaan garis ini adalah ekivalen. Perpotongan garis terhadap sumbu Xdinyatakan sebagai Icorr (Butarbutar dan
Febrianto, 2009).
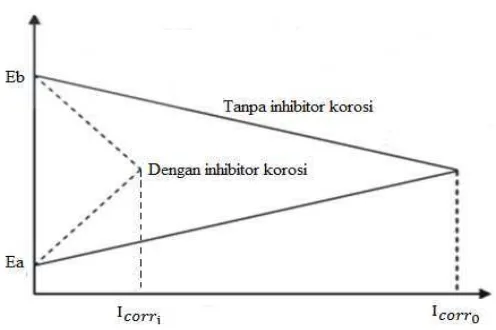
Penggunaan senyawa inhibitor korosi mampu mengubah Icorr menjadi lebih kecil
[image:47.595.189.437.355.520.2]seperti ditunjukkan pada Gambar 7.
Gambar 7. Kurva ekstrapolasi Tafel.
Pada kurva ektrapolasi menunjukkan perbandingan pola ekstrapolasi Tafel dari diagram polarisasi logam baja dalam larutan asam yang mengandung inhibitor dan tanpa inhibitor. Kurva ektrapolasi Tafel menunjukkan bahwa sebelum dan
dihasilkan menjadi lebih tinggi. Semakin tinggi arus yang dihasilkan maka laju korosi juga semakin tinggi (Butarbutar dan Febrianto, 2009).
Polarisasi atau potensial lebih adalah perubahan potensial elektroda setengah sel dari posisi kesetimbangan dengan lingkungannya pada suatu proses elektrodik. Hubungan potensial lebih dan arus dapat digunakan untuk menentukan laju korosi dan persentase efisiensi inhibisi (%EI). Untuk menghitung persentase efisiensi inhibisi pada metode ini digunakan Persamaan 2.13.
(2.13)
dengan %EI adalah persentase efektivitas penghambatan, adalah arus
sebelum ditambahkan inhibitor, adalah arus sesudah ditambahkan inhibitor
29
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai dengan April 2015. Analisis senyawa menggunakan spektrofotometer IR dilaksanakan di Laboratorium Instrumentasi FMIPA Universitas Islam Indonesia. Analisis senyawa menggunakan spektrofotometer UV-Vis dilaksanakan di Laboratorium Kimia Anorganik-Fisik, pengujian aktivitas inhibitor korosi dilaksanakan di Laboratorium Instrumen/Analitik, dan analisis kualitatif permukaan baja dilaksanakan di Laboratorium Botani FMIPA Universitas Lampung. Analisis senyawa menggunakan spektrofotometer NMR dilaksanakan di School of
Chemical Sciences, Universiti Sains Malaysia. Analisis unsur dengan
menggunakan microelemental analyzer dilaksanakan di School of Chemical and
Food Technology, Universiti Kebangsaan Malaysia.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah gelas ukur, erlenmeyer, gelas kimia, neraca analitik, satu set alat refluks, hot plate with stirrer,
Instrumentasi dalam karakterisasi senyawa dilakukan pengukuran dengan spektrofotometer IR, UV-Vis, 1H dan 13C NMR, dan secara fisika dengan
microelemental analyzer. Alat uji korosi dilakukan dengan satu set alat pengukuran potensiodinamik ER466 integrated potentiostat system eDAQ.
Bahan-bahan yang digunakan dalam penelitian ini adalah zat-zat kimia dengan kualitas GR (grade reagent) atau PA (pro analysis) yang terdiri dari:
difeniltimah(IV) diklorida [(C6H5)2SnCl2], NaOH, HCl, aseton, metanol, DMSO
(dimethyl sulfoxide), akuades, akuabides, airKCKT (Kromatografi Cair Kinerja Tinggi), amplas, asam 2-klorobenzoat, asam 3-klorobenzoat, asam
4-klorobenzoat, dan senyawa hasil sintesis [(C6H5)2Sn(o-OCOC6H4Cl)2],
[(C6H5)2Sn(m-OCOC6H4Cl)2], [(C6H5)2Sn(p-OCOC6H4Cl)2], serta pelat baja
lunak tipe HRP.
C. Metode
Prosedur untuk sintesis senyawa organotimah(IV) karboksilat dilakukan
berdasarkan prosedur yang telah digunakan sebelumnya (Hadi et al., 2009; Hadi and Rilyanti, 2010; Hadi et al., 2012) yang merupakan hasil adaptasi dari Szorcsik
31
1. Sintesis Senyawa Difeniltimah(IV) oksida
Difeniltimah(IV) diklorida [(C6H5)2SnCl2] sebanyak 15,48 gram (0,045 mol)
direaksikan dengan 3,6 gram (0,09 mol) NaOH dalam 50 mL pelarut metanol dan direfluks selama 1 jam dengan pemanas pada suhu 60°C. Endapan yang
dihasilkan disaring dengan menggunakan kertas saring Whatman No. 42, lalu dicuci dengan akuabides dan metanol, kemudian didiamkan dalam desikator sampai dihasilkan (C6H5)2SnO. Kristal (C6H5)2SnCl2 dan (C6H5)2SnO
dikarakterisasi dengan spektrofotometer IR yang diukur pada panjang gelombang 190 - 380 nm (Sudjadi, 1983), spektrofotometer UV-Vis, dan dianalisis kandungan unsur H dan C dengan alat microelemental analyzer serta diuji sifat inhibitor korosi terhadap pelat baja lunak serta diuji sifat inhibitor korosi terhadap pelat baja lunak.
2. Sintesis Senyawa Difeniltimah(IV) diklorobenzoat
Senyawa difeniltimah(IV) oksida [(C6H5)2SnO] sebanyak 0,921 gram (0,003 mol)
direaksikan dengan asam 2-klorobenzoat (2-C6H4ClCOOH) sebanyak 1,002 gram
(0,006 mol) dengan perbandingan mol 1 : 2 dalam 50 mL pelarut metanol dan direfluks dengan variasi waktu 3, 4, dan 5 jam dengan pemanas pada suhu 60°C. Setelah reaksi sempurna, metanol diuapkan dan dikeringkan di dalam desikator sampai diperoleh kristal kering. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks siap untuk dikarakterisasi dengan spektrofotometer IR yang diukur pada panjang gelombang 190 - 380 nm (Sudjadi, 1983),
spektrofotometer UV-Vis, spektrofotometer 1H dan 13C NMR, dianalisis
inhibitor korosi terhadap pelat baja lunak. Melakukan prosedur sintesis yang sama yaitu mereaksikan senyawa difeniltimah(IV) oksida dengan asam 3-klorobenzoat (3-C6H4ClCOOH) dan asam 4-klorobenzoat (4-C6H4ClCOOH).
3. Preparasi Baja Lunak
Preparasi baja lunak dilakukan dengan memotong pelat dengan ukuran 2 x 1 cm dan diamplas dengan kertas amplas mulai dari grit 240, 360, 400, 500, 600 sampai dengan grit 800. Setelah permukaan baja lunak homogen selanjutnya dicuci dengan akuades, larutan HCl encer, dan aseton secara berturut-turut untuk menghilangkan pengotor pada permukaan baja. Baja yang telah bersih selanjutnya dikeringkan.
4. Pembuatan Medium Korosif
Medium korosif dibuat dengan komposisi larutan DMSO 0,02 M dan HCl 0,2 M (Rastogi et al., 2005; Rastogi et al., 2011) dengan perbandingan 1 : 1. Sebanyak 0,14 mL DMSO p.a. dengan kadar 99% dilarutkan dengan airKCKTdalam labu 100 mL sehingga diperoleh larutan DMSO 0,02 M sedangkan larutan HCl 0,2 M dibuat dengan 1,67 mL larutan HCl p.a. (12 M) dilarutkan pada labu 100 mL dengan pelarut airKCKT. Kedua larutan tersebut kemudian dicampurkan dengan perbandingan 1 : 1 dan dihomogenkan.
5. Pembuatan Larutan Inhibitor
33
hingga volume larutan tepat 25 mL dan diperoleh larutan stok inhibitor dengan konsentrasi 400 mg/L. Pembuatan larutan dengan variasi konsentrasi inhibitor dilakukan dengan metode pengenceran menggunakan pelarut DMSO 5%. Variasi konsentrasi inhibitor 20, 40, 60, 80, dan 100 mg/L dibuat dari larutan stok
inhibitor 400 mg/L secara berturut-turut sebanyak 1,25; 2,5; 3,75; 5; dan 6,25 mL yang diencerkan dalam labu 25 mL hingga tepat pada batas tera.
6. Pengaturan Pemindaian dengan Potensiostat
Pada penelitian ini pemindaian dilakukan dengan software Echem v2 1.8 pada menu bar technique, liniear sweep, dan pengaturan pemindaian baik anoda maupun katoda seperti yang ditunjukkan pada Gambar 8.
.
(a) (b) Gambar 8. Pengaturan pemindaian (a) anoda dan (b) katoda.
dibutuhkan untuk melakukan sekali pemindaian baik anoda maupun katoda adalah 200 s.
7. Pengujian Korosi
Prosedur untuk pengujian korosi dilakukan berdasarkan prosedur yang telah digunakan sebelumnya (Hadi et al., 2015). Aktivitas inhibitor korosi senyawa difeniltimah(IV) diklorobenzoat diukur dengan metode polarisasi potensiodinamik dengan ER466 integrated potentiostat system eDAQ yang terdiri dari tiga
elektroda yaitu elektroda acuan AgCl, elektroda bantu platina (Pt), dan elektroda kerja baja lunak. Preparasinya dilakukan dengan membilas elektroda bantu dan elektroda acuan dengan akuades sebelum digunakan. Elektroda kerja juga dicuci secara berurutan dengan menggunakan akuades, HCl 0,1 M, dan aseton 1 M. Ketiga elektroda tersebut selanjutnya dirangkaikan pada sel elektrolisis yang telah diisi dengan 30 mL medium korosif tanpa inhibitor, kemudian potensiostat
dihidupkan. Setelah lampu pada potensiostat berwarna hijau, alat dihubungkan dengan komputer melalui kabel USB dan software Echem v.2 1.8 dibuka dan pemindaian anoda diatur seperti pada Gambar 8a, selanjutnya ketiga elektroda tersebut dibiarkan berinteraksi dengan medium korosif selama 10 menit.
Setelah dibiarkan selama 10 menit, pemindaian dilakukan dengan memilih start pada potensiostat dan setelah 200 s diperoleh voltammogram hasil pemindaian yang menyatakan hubungan antara nilai beda potensial dan kuat arus. Data yang didapatkan dari hasil pengujian dapat diperoleh dengan memilih seluruh
voltammogram kemudian memilih menu edit pada menu bar, copy special, as
35
software Microsoft Office Excel dengan memilih menu paste. Selanjutnya
pengukuran katoda dapat dilakukan dengan metode yang sama dengan pengaturan pemindaian seperti pada Gambar 8b. Laju korosi berbagai variasi konsentrasi inhibitor juga dapat ditentukan dengan metode pemindaian anoda dan katoda yang sama dengan perbandingan volume uji dari larutan inhibitor dan medium korosif sebesar 1 : 5.
8. Analisis Data
Setelah diperoleh data besarnya beda potensial dan arus, dilakukan analisis Tafel untuk menentukan besarnya logaritma normal dari nilai kerapatan arus (ln |J|) dengan overpotensial (ɳ) yang selanjutnya diekstrapolasi ke dalam bentuk grafik. Analisis Tafel dan pembuatan grafik dikerjakan pada Microsoft Office Excel. Pembuatan grafik dilakukan dengan memilih data ln |J| dan ɳ dari hasil
pemindaian anoda untuk masing masing pengujian, dengan memilih menu insert,
charts, scatter, kemudian memilih menu scatters with smoth lines and markes. Selanjutnya setelah data terplotkan dalam bentuk grafik, grafik dipindahkan dalam
sheet baru untuk memudahkan kerja. Untuk laju selusur anoda, dipilih nilai ln|J| sebagai nilai absis dan ɳ sebagai ordinat pada pemindaian anoda dan untuk laju selusur katoda dipilih nilai ln |J| pada pemindaian anoda sebagai absis dan ɳ sebagai ordinat pada pemindaian katoda dari masing-masing uji.
Langkah selanjutnya setelah diperoleh grafik antara laju selusur katoda dan anoda dari masing-masing pemindaian, ditentukan titik potong ln |J| kedua grafik
selanjutnya dikalikan dengan luas permukaan elektroda kerja terukur untuk menentukan besarnya arus korosi (Icorr) sesuai dengan Persamaan 3.1.
I���� = J���� × A (3.1)
dimana, Icorr adalah besaran arus korosi (µA), Jcorradalah kerapatan arus korosi
(µA/cm2), dan A adalah luas permukaan elektroda kerja terukur (cm2). Dari nilai tersebut selanjutnya dapat ditentukan besarnya persen efisiensi inhibisi dengan Persamaan 2.13.
9. Analisis Kualitatif Korosi
37
IV. HASIL DAN PEMBAHASAN
A. Sintesis Senyawa Difeniltimah(IV) oksida
Hasil sintesis senyawa difeniltimah(IV) oksida [(C6H5)2SnO] menggunakan
senyawa awal difeniltimah(IV) diklorida [(C6H5)2SnCl2] yang direaksikan dengan
NaOH dalam metanol dengan waktu refluks 1 jam pada suhu 60°C, diperoleh kristal putih dengan rendemen sebesar 12,66 gram (97,33%). Kristal dan
persentase rendemen sintesis difeniltimah(IV) oksida dapat dilihat pada Gambar 9 dan Tabel 5.
[image:57.595.252.371.443.562.2]Gambar 9. Kristal senyawa difeniltimah(IV) oksida.
Tabel 5. Persentase rendemen sintesis difeniltimah(IV) oksida.
Massa (gram) Rendemen
(%) [(C6H5)2SnCl2]
(BM = 344)
NaOH (BM = 40)
[(C6H5)2SnO] (BM = 289) (Teori)
[(C6H5)2SnO] (BM = 289) (Sintesis)
Sn Cl Cl
Sn O
Persentase rendemen sintesis difeniltimah(IV) oksida mencapai 97,33%
didapatkan dari perbandingan massa hasil sintesis terhadap teoritis. Perhitungan persentase rendemen difeniltimah(IV) oksida dapat dilihat pada Lampiran 2.
Reaksi yang terjadi pada sintesis difeniltimah(IV) oksida ini adalah sesuai Persamaan 4.1.
+ 2 NaOH + H2O + 2 NaCl (4.1)
Pemisahan NaCl pada endapan dilakukan dengan cara mencuci menggunakan akuabides dan metanol p.a. NaCl larut baik dengan akuabides sehingga senyawa difeniltimah(IV) oksida yang dihasilkan terbebas dari NaCl.
Mekanisme pembentukkan difeniltimah(IV) oksida diawali dengan penggantian ligan Cl- oleh OH-. Pengaruh delokalisasi elektron pada gugus fenil menyebabkan elektron pada ion timah(IV) menjadi lebih positif, sehingga lebih mudah
membentuk ikatan dengan ion OH-. Ligan OH- yang lebih kuat dapat
menggantikan ligan Cl- yang lebih lemah dan Cl- merupakan gugus pergi (leaving
group) yang baik, sehingga substitusi ligan Cl- oleh OH- dapat terjadi. Urutan kekuatan ligan adalah karbon > nitrogen > oksigen > halogen (Fessenden dan Fessenden, 1986).
Sifat kedua ligan ini merupakan ligan donor elektron namun ligan OH- mampu memberi desakan elektron yang lebih kuat dibandingkan ligan Cl-. Dengan desakan elektron yang lebih kuat, OH- lebih kuat terikat pada logam Sn
dibandingkan dengan ligan Cl- sehingga reaksi substitusi ligan mudah dilakukan.
39
Kemudian dua gugus hidroksi yang terikat pada atom pusat Sn yang berasal dari NaOH membentuk ikatan rangkap dua Sn═O dengan melepaskan H2O.
Hasil sintesis kemudian dilakukan karakterisasi menggunakan spektrofotometer
IR dan UV. Perubahan bilangan gelombang (ῡ) dan panjang gelombang maksimum (λmaks) digunakan untuk menentukan reaksi telah terjadi. Senyawa
difeniltimah(IV) oksida dikarakterisasi menggunakan spektrofotometer IR untuk melihat gugus fungsi yang terdapat dalam senyawa tersebut. Dan untuk
[image:59.595.125.497.364.695.2]membandingkannya, dianalisis juga senyawa awal difeniltimah(IV) diklorida. Spektrum IR kedua senyawa tersebut dapat dilihat pada Gambar 10.
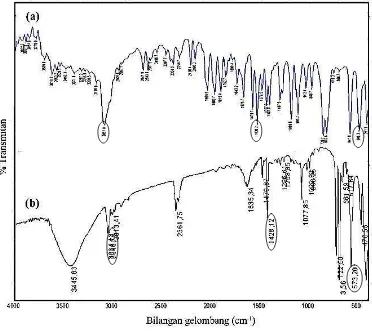
Berdasarkan Gambar 10a, terlihat serapan untuk Sn─Cl pada 346,3 cm-1, vibrasi
ulur C═C aromatik pada 1430,2 cm-1, dan serapan C─H aromatik pada 3051,0 cm-1. Pada Gambar 10b, serapan untuk Sn─O pada 573,20 cm-1 menunjukkan bahwa ligan klorida pada difeniltimah(IV) diklorida telah
digantikan oleh ligan oksida menjadi difeniltimah(IV) oksida, vibrasi ulur C═C aromatik pada 1428,12 cm-1, dan serapan C─H aromatik pada 3064,43 cm-1.
Hasil analisis Hadi and Rilyanti (2010), menunjukkan serapan Sn─Cl berada pada kisaran 390 - 310 cm-1 dan muncul pada 334,2 cm-1, serapan Sn─O pada kisaran 800 - 400 cm-1 dan muncul pada 595,3 cm-1.
Karakterisasi menggunakan spektrofotometer UV hasil sintesis ditunjukkan dari perubahan panjang gelombang maksimum setelah reaksi berlangsung. Panjang gelombang difeniltimah(IV) diklorida dan difeniltimah (IV) oksida, keduanya menghasilkan dua puncak. Spektrum UV dari difeniltimah(IV) diklorida dan difeniltimah(IV) oksida dapat dilihat pada Gambar 11.
41
Berdasarkan Gambar 11a, dapat dilihat terjadinya pergeseran panjang gelombang dari 215,00 nm menjadi 207,00 nm (Gambar 11b), hal ini disebabkan karena adanya penggantian ligan yang terikat pada atom pusat Sn. Gugus O2- pada difeniltimah(IV) oksida merupakan gugus penarik elektron yang lebih kuat dibandingkan gugus Cl- pada difeniltimah (IV) diklorida, maka transisi elektronik ππ* yang berasal dari senyawa dengan ikatan konjugasi yaitu gugus fenil pada
senyawa ini lebih sulit dan memerlukan energi yang lebih besar sehingga menghasilkan panjang gelombang yang lebih pendek yaitu 207,00 nm. Selain transisi elektronik ππ*, juga terdapat transisi nπ* pada spektrum
difeniltimah(IV) diklorida yaitu pada panjang gelombang 258,00 nm yang berasal dari pasangan elektron bebas gugus Cl- menjadi 278,00 nm yang berasal dari pasangan elektron bebas gugus O2- pada difeniltimah(IV) oksida. Senyawa yang mengandung nitrogen, oksigen, sulfur, fosforus, atau salah satu halogen,
semuanya mempunyai elektron n menyendiri (unshared). Karena elektron ini memiliki energi yang lebih tinggi daripada elektron σ atau π maka diperlukan
energi yang lebih kecil untuk mempromosikan suatu elektron n dan transisi terjadi pada panjang gelombang yang lebih panjang daripada transisi σ-σ* (Fessenden dan Fessenden, 1986).
B. Sintesis Senyawa Difeniltimah(IV) diklorobenzoat
Sintesis senyawa difeniltimah(IV) diklorobenzoat [(C6H5)2Sn(-OCOC6H4Cl)2]
adalah mereaksikan difeniltimah(IV) oksida dengan asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam 4-klorobenzoat. Hasil sintesis senyawa
sedangkan pada difeniltimah(IV) di-3-klorobenzoat dan difeniltimah(IV) di-4-klorobenzoat merupakan kristal putih, seperti ditunjukkan pada Gambar 12. Adapun persamaan reaksi yang terjadi pada sintesis ini dapat dilihat pada Persamaan 4.2, 4.3, dan 4.4.
Gambar 12. Kristal senyawa (a) difeniltimah(IV) di-2-klorobenzoat, (b) difeniltimah(IV) di-3-klorobenzoat, dan (c) difeniltimah(IV) di-4-klorobenzoat.
Reaksi yang terjadi pada sintesis ini adalah sebagai berikut:
+ 2 + H2O (4.2)
difeniltimah(IV) di-2-klorobenzoat
+ 2 + H2O (4.3)
43
+ 2 + H
2O (4.4)
difeniltimah(IV) di-4-klorobenzoat
Berdasarkan reaksi tersebut, terjadi penggantian gugus oksida oleh dua gugus karboksilat sehingga terbentuk senyawa organotimah karboksilat yaitu
difeniltimah(IV) diklorobenzoat. Dalam hal ini ketiga ligan asam klorobenzoat tidak dapat menggantikan gugus fenil karena gugus fenil cukup kuat dan meruah sehingga rintangan steriknya besar. Selain itu, ikatan Sn─C lebih kuat
dibandingkan Sn─O sehingga pada reaksi tersebut terjadi karena adanya penggantian gugus oksida oleh gugus klorobenzoat. Jadi terbentuknya reaksi adalah dengan penggantian gugus oksida oleh ligan asam klorobenzoat membentuk difeniltiltimah(IV) di-2-klorobenzoat, difeniltiltimah(IV) di-3-klorobenzoat, dan difeniltiltimah(IV) di-4-klorobenzoat.
Hasil pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-2-klorobenzoat, difeniltimah(IV) di-3-di-2-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat pada suhu 60°C dapat dilihat pada Tabel 6, 7, dan 8. Perhitungan persentase rendemen sintesis difeniltimah(IV) diklorobenzoat dapat dilihat pada Lampiran 2.
Tabel 6. Pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-2- klorobenzoat. Waktu refluks (jam) Massa teori (g)
Massa hasil sintesis (g)
Rendemen (%)
3 1,75 1,47 83,97
4 1,75 1,53 87,53
5 1,75 1,42 80,82
Tabel 7. Pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-3- klorobenzoat.
Waktu refluks (jam)
Massa teori (g)
Massa hasil sintesis (g)
Rendemen (%)
3 1,75 1,49 85,11
4 1,75 1,57 89,69
5 1,75 1,44 82,20
Tabel 8. Pengamatan waktu refluks terhadap pembentukan difeniltimah(IV) di-4- klorobenzoat.
Waktu refluks (jam)
Massa teori (g)
Massa hasil sintesis (g)
Rendemen (%)
3 1,75 1,51 86,29
4 1,75 1,59 90,64
5 1,75 1,48 84,35
kembali menurun pada waktu refluks 5 jam. Hal ini menunjukkan bahwa reaksi sempurna sintesis difeniltiltimah(IV) diklorobenzoat terjadi pada waktu refluks 4 jam dengan jumah rendemen tertinggi. Pada waktu refluks 3 jam, rendemen yang dihasilkan lebih kecil dibandingkan dengan waktu refluks 4 jam, hal ini
45
rendemen senyawa yang disintesis yang dihasilkan lebih kecil, kemungkinan disebabkan karena zat yang terbentuk mengalami penguraian atau terhidrolisis.
Sintesis dilakukan pada suhu 60oC yang merupakan suhu yang tidak terlalu tinggi namun reaksi akan lebih cepat terjadi. Penggunaan metanol sebagai pelarut diharapkan suhu reaksi tidak melebihi 60oC, dimana titik didih metanol adalah 64,7oC sehingga dapat menjaga kestabilan reaksi dan mudah diuapkan dalam proses pemisahan dengan zat hasil sintesis. Pelarut sangat vital pada suatu reaksi kimia karena bila pelarut tidak sesuai, maka produk bisa tidak diperoleh atau tidak dapat diambil.
Senyawa difeniltimah(IV) oksida, difeniltimah(IV) di-2-klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat dikarakterisasi menggunakan spektrofotometer IR untuk melihat dan
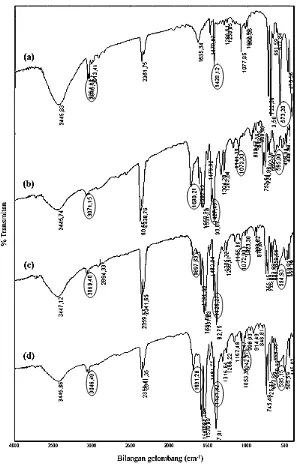
membandingkan gugus fungsi apa saja yang terdapat pada senyawa tersebut. Spektrum IR untuk keempat senyawa tersebut dapat dilihat pada Gambar 13. Berdasarkan Gambar 13, senyawa difeniltimah(IV) di-2-klorobenzoat,
difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat secara berurutan menunjukkan serapan Sn─O pada 595,00; 594,93; dan 595,59 cm-1,
vibrasi ulur C═C aromatik pada 1427,49; 1425,27; dan 1431,28 cm-1, dan serapan C─H aromatik pada 3071,15; 3069,40; dan 3046,49 cm-1. Serapan untuk
Gambar 13. Spektrum IR (a) difeniltimah(IV) oksida, (b) difeniltimah(IV) di-2-klorobenzoat, (c) difeniltimah(IV) di-3-di-2-klorobenzoat, dan (d) difeniltimah(IV) di-4-klorobenzoat.
47
Karakterisasi menggunakan spektrofotometer UV hasil sintesis ditunjukkan dari pergeseran panjang gelombang maksimum senyawa difeniltimah(IV) oksida setelah direaksikan dengan ligan asam klorobenzoat. Spektrum UV
[image:67.595.155.460.266.555.2]difeniltimah(IV) oksida, difeniltimah(IV) 2-klorobenzoat, difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat dapat dilihat pada Gambar 14.
Gambar 14. Spektrum UV (a) difeniltimah(IV) oksida, (b) difeniltimah(IV) di-2-klorobenzoat, (c) difeniltimah(IV) di-3-di-2-klorobenzoat, dan (d) difeniltimah(IV) di-4-klorobenzoat.
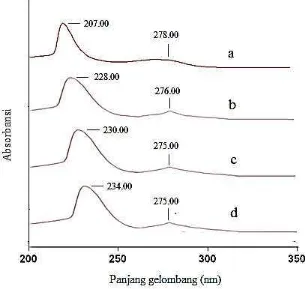
Berdasarkan Gambar 14, dapat dilihat terjadinya pergeseran panjang gelombang
difeniltimah(IV) oksida untuk transisi elektron ππ* dari 207,00 nm menjadi
228,00 ; 230,00; dan 234,00 nm pada senyawa difeniltimah(IV)
di-4-klorobenzoat yang berasal dari ikatan konjugasi gugus fenil. Untuk transisi
elektron nπ* terjadi dari panjang gelombang 278,00 nm menjadi 276,00 ;
275,00; dan 275,00 nm pada senyawa difeniltimah(IV) di-2-klorobenzoat,
difeniltimah(IV) di-3-klorobenzoat, dan difeniltimah(IV) di-4-klorobenzoat yang berasal dari pasangan elektron bebas gugus O2-. Perubahan panjang gelombang yang lebih besar menunjukkan telah terjadi penggantian ligan pada atom pusat. Hasil analisis Hadi and Rilyanti (2010), menunjukkan ada dua transisi elektron pada senyawa difeniltimah(IV) dibenzoat yaitu transisi elektron ππ* terjadi
pada panjang gelombang 201 nm dan nπ* pada panjang gelombang 297,7 nm.
Asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam 4-klorobenzoat merupakan molekul kromofor, dengan adanya gugus ─CO─ dan ikatan ─C═C─ yang menyebabkan pergeseran panjang gelombang ke arah yang lebih panjang. Selain itu adanya pengaruh auksokrom dengan adanya gugus ─Cl. Auksokrom
merupakan subtituen pada kromofor yang lebih mengintensifkan ke arah panjang gelombang yang lebih besar karena adanya efek batokromik atau pergeseran merah (Sudjadi, 1985). Selain pengaruh auksokrom, efek batokromik juga dapat dis