RESPON FISIOLOGIS JARAK PAGAR (
Jatropha curcas
)
ANDROMONOECIOUS PADA PERLAKUAN CEKAMAN
KEKERINGAN
NANDA DANISWARA AZMI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
ABSTRAK
NANDA DANISWARA AZMI. Respon Fisiologis Jarak Pagar (Jatropha curcas) Andromonoecious pada Perlakuan Cekaman Kekeringan. Dibimbing oleh TRIADIATI dan SULISTIJORINI.
Tanaman jarak pagar (Jatropha curcas) umumnya merupakan tanaman monoecious dan dapat berkembang baik di lahan kritis di wilayah Indonesia Timur, salah satunya di Kabupaten Dompu. Tanaman jarak pagar andromonoecious masih jarang ditemukan. Salah satu faktor penekan pertumbuhan dan perkembangan tanaman adalah kondisi kekeringan. Respon fisiologi jarak pagar andromonoecious dari tiga tanaman induk yang mengalami cekaman kekeringan dianalisis berdasarkan kandungan prolin dan asam askorbat. Rancangan percobaan yang digunakan ialah rancangan acak lengkap faktorial. Tanaman jarak pagar andromonoecious yang diberi perlakuan hari cekaman kekeringan memberikan respon fisiologis yang berbeda-beda. Tanaman jarak pagar andromonoecious induk 5 memiliki respon yang lebih baik dan lebih toleran terhadap kekeringan daripada tanaman jarak pagar andromonoecious induk 1 dan 6. Tanaman induk 5 dapat bertahan hidup dengan cara meningkatkan jumlah daun dan kandungan prolin hingga hari ke-15 serta kandungan asam askorbat hingga hari ke-12 cekaman kekeringan. Selain itu, tanaman induk 5 juga meningkatkan jumlah akar lateral di hari ke-3 dan panjang akar primer di hari ke-9 cekaman kekeringan.
Kata kunci: respon fisiologis, jarak pagar (Jatropha curcas), andromonoecious, cekaman kekeringan
ABSTRACT
NANDA DANISWARA AZMI. Physiological Response of Andromonoecious Physicnut (Jatropha curcas) at Drought Stress. Under supervised by TRIADIATI and SULISTIJORINI.
Physicnut (Jatropha curcas) is generally a monoecious plant and can grow well on degraded land in eastern Indonesia, for example in Dompu. While, andromonoecious physicnut still rare. One factor suppressing plant growth and development throughout is drought condition. Physiological response andromonoecious physicnut of three parent plants experiencing drought stress was analyzed based on content of proline and ascorbic acid. Experimental design was used completely randomized factorial design. Andromonoecious physicnut which given drough stress treatment has different physiological responses. Andromonoecious physicnut parent plant number 5 has better response and more tolerant of drought than those of parent plant number 1 and 6. Parent plant number 5 can survive by increasing the number of leaves and proline content until the 15th day, and ascorbic acid content until 12th day of drought stress. In addition, parent plant number 5 also increasing number of lateral roots in 3th day and extending primary root in 9th day of drought stress.
RESPON FISIOLOGIS JARAK PAGAR (
Jatropha curcas
)
ANDROMONOECIOUS PADA PERLAKUAN CEKAMAN
KEKERINGAN
NANDA DANISWARA AZMI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
iv
Judul
: Respon
Fisiologis
Jarak
Pagar
(
Jatropha
curcas
)
Andromonoecious pada Perlakuan Cekaman Kekeringan
Nama
: Nanda Daniswara Azmi
NRP
: G34070111
Disetujui
Diketahui
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP 19641002 198903 1 002
Tanggal Lulus:
Pembimbing I,
Dr. Triadiati, M. Si
NIP 19600224 198603 2 001
Pembimbing I,
PRAKATA
Puji syukur kehadirat Allah SWT atas rahmat, nikmat, dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan mulai bulan Desember 2010 sampai April 2012 dengan judul Respon Fisiologis Jarak Pagar (Jatropha curcas) Andromonoecious pada Perlakuan Cekaman Kekeringan.
Ucapan terima kasih penulis sampaikan kepada berbagai pihak yang telah membantu dalam penelitian dan penyelesaian penulisan karya ilmiah ini antara lain ibu Dr. Triadiati, M.Si dan Ibu Dr. Ir. Sulistijorini, M.Si atas bimbingan, arahan dan masukannya selama ini, ibu Dra. Taruni, M.Si selaku penguji karya ilmiah penulis atas koreksi dan saran yang telah diberikan kepada penulis. Ucapan terima kasih juga penulis tujukan kepada Ibu Dasumiyati, Kak Arif Pambudi, Kak Andik, Mbak Rina, Ibu Vio, Faisal K, Eko Prabowo, Siti Komariyah, Yuni dan Lili yang telah membantu penulis selama di Laboratorium Penelitian Fisiologi Tumbuhan. Penghargaan penulis berikan kepada Bapak dan Ibu Jajat yang telah membantu menjaga tanaman penelitian penulis di lahan penelitian Cikabayan milik University Farm, Bapak Rusna, Bapak Tisna dan Ibu Retno yang telah membantu dalam penyediaan bahan di dalam rumah kaca Departemen Biologi dan dalam peminjaman alat di Laboratorium Terpadu Biologi IPB. Tidak lupa pula kepada teman-teman Biologi angkatan 44 atas kebersamaannya selama empat tahun terakhir ini, teman-teman Cunai’s group (kokom, niswa, yuni, ifit, age, fina, risma, rodhiah) dan Serum G IPB atas nasihat, penjagaan, dan ukhuwah yang telah terjalin, dan teman-teman Kosan Marhamah (Mila, Mbak Dini, Mbak Isnia, Mbak Fitri, Istiqomah, Karimah, Mbak Dya, Kak Irma, Kak Endju, Mbak Caca, Mbak Ayes, Dina) atas kegembiraan dan persaudaraan yang telah dihadirkan selama tinggal se-atap. Terima kasih yang tak terungkapkan untuk kedua orang tua penulis, Muchson Ischak dan Ni’azah atas do’a, kasih sayang, nasihat, dukungan, dan pengorbanan yang telah di berikan. Terimakasih juga untuk kedua adikku Silmi dan Qowwam, serta Adik-adik 47 (Hana, Puji, Zurika, Mia, Debi, dan Asty) yang menjadi motivasi tersendiri bagi penulis untuk selalu menjadi contoh yang baik.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna, namun penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi ilmu pengetahuan selanjutnya.
Bogor, September 2012
vi
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 20 April 1989 di Jakarta dari pasangan Bapak Muchson Ischak dengan Ibu Ni’azah. Penulis merupakan putri pertama dari tiga bersaudara. Saat ini, penulis tinggal bersama orang tua dan kedua adiknya di Jl. Borneo II Blok N 36 no 69 RT 02/RW 32 Taman Wisma Asri, Bekasi Utara. Tahun 2007 penulis lulus dari SMA Muhammadiyah 9 Bekasi dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dengan mayor Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL ... viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE ... 2
Waktu dan Tempat ... 2
Bahan dan Alat ... 2
Metode ... 2
Penanaman dan perawatan tanaman ... 2
Perlakuan cekaman kekeringan ... 2
Analisis prolin ... 2
Analisis asam askorbat (ASA) ... 2
Rancangan percobaan ... 3
HASIL ... 3
PEMBAHASAN ... 4
SIMPULAN DAN SARAN ... 6
Simpulan ... 6
Saran ... 6
viii
DAFTAR TABEL
Halaman
1. Jumlah daun, kandungan prolin dan asam askorbat (ASA) pada perlakuan hari cekaman kekeringan dan perlakuan induk tanaman jarak pagar. ... 3
2. Jumlah akar lateral dan panjang akar primer pada perlakuan hari cekaman kekeringan dan
perlakuan induk tanaman jarak pagar. ... 4
PENDAHULUAN
Latar Belakang
Tanaman jarak pagar (Jatropha curcas) biasanya dijadikan sebagai tanaman pembatas pagar dan masih jarang dibudidayakan secara khusus. Tanaman jarak pagar dapat beradaptasi pada lahan ataupun agroklimat di Indonesia. Tanaman ini dapat tumbuh pada kisaran curah hujan 200 mm hingga kondisi basah tertinggi 2000 mm per tahun (Openshaw 2000). Ketinggian tempat tumbuh tanaman jarak pagar maksimal hingga 700 m dpl dan kelembaban relatif sekitar 75% (Behera et al. 2010). Tanaman ini tahan kering dan toleran pada lingkungan yang kritis (Parwata et al. 2010).
Wilayah Indonesia memiliki lahan kritis mencapai 2,6 juta hektar dengan kondisi tanah yang tandus dan kering (Capstick 2007), antara lain di wilayah Kabupaten Dompu, Nusa Tenggara Barat. Kabupaten ini sebagian besar berada pada ketinggian 100-500 m dpl dan memiliki iklim yang sedang hingga sangat kering (www.dompukab.go.id).
Pengembangan komoditas jarak pagar paling sesuai untuk lahan marginal atau lahan kritis di Indonesia. Wilayah yang sesuai adalah wilayah Indonesia Timur, dengan curah hujan skitar 200-1500 mm per tahun (Prawitasari et al. 2006). Jarak pagar dapat tumbuh dimana saja dengan cepat dan kuat, baik itu di dataran rendah yang beriklim basah maupun sedang dan juga pada lahan yang tandus dan berbatu. Kondisi tanah bukan menjadi faktor pembatas, tetapi jarak pagar yang hidup di daerah basah produksinya rendah karena bunganya mudah gugur. Jarak pagar dapat berproduksi sepanjang tahun, tetapi tidak dapat bertahan dalam kondisi tanah jenuh air. Iklim yang kering akan meningkatkan kadar minyak biji, akan tetapi kekeringan yang berkepanjangan menyebabkan gugur daun sehingga pertumbuhan tanaman menjadi terhambat (Mulyani et al. 2006).
Jarak pagar pada umumnya merupakan tanaman monoecious, artinya bunga jantan dan bunga betina berada pada satu tanaman yang sama. Berdasarkan alat kelamin pada bunga, terdapat dua tipe tanaman yaitu tanaman monoecious (uniseksual) dan andromonoecious. Tanaman monoecious atau uniseksual menghasilkan bunga jantan dan bunga betina yang terpisah, sedangkan tanaman andromonoecious menghasilkan bunga jantan dan bunga
hermaprodit. Bunga hermaprodit adalah bunga dengan alat kelamin jantan dan betina berada pada satu bunga (Asbani 2009). Hadirnya bunga hermaprodit ini diduga merupakan interaksi faktor genetik dengan lingkungan. Dugaan ini diperkuat dengan hasil observasi yang dilakukan selama satu tahun (2007-2008) pada sejumlah genotipe jarak pagar di Kebun Percobaan Pakuwon, Sukabumi. Di sisi lain, tanaman jarak pagar yang berbunga hermaprodit ini masih jarang ditemukan (Hartati dan Sudarsono 2010).
Kondisi kekeringan pada tanaman merupakan salah satu faktor yang dapat menekan pertumbuhan dan perkembangan tanaman (Schwanz dan Polle 2001). Kekeringan yang terjadi berkelanjutan akan menyebabkan fase generatif terganggu, terjadinya senesens dan bahkan kematian (Neumann 2008). Respon morfologi terhadap cekaman kekeringan diantaranya yaitu memperbaiki serapan air dengan cara meningkatkan kedalaman akar, mengurangi hilangnya air dengan mengurangi jerapan panas melalui permukaan daun yang semakin kecil, penggulungan daun, pelipatan atau menggugurkan daun (Fukai dan Coeper 1995). Tanaman dapat menggunakan lebih dari satu mekanisme untuk tahan cekaman kekeringan (Mitra 2001). Mekanisme tersebut diantaranya terjadi akumulasi prolin pada daun (Kandowangko et al. 2009), adanya pembentukan asam askorbat (ASA) (Sodikin 2009), serta pembentukan formasi akar yang dalam dan percabangan akar yang banyak
(Dubrovsky dan Go’mez-lomeli 2003).
Informasi tentang jarak pagar monoecious sudah banyak di masyarakat. Sedangkan informasi tentang jarak pagar andromonoecious masih sedikit dan jarang ditemukan. Informasi tentang respon fisiologis tanaman jarak pagar andromonoecious yang tumbuh pada kondisi kekeringan atau yang terkena cekaman kekeringan belum diketahui.
Tujuan
2
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan mulai dari akhir bulan Desember 2010 sampai April 2012. Penanaman, pemeliharaan dan pemberian perlakuan cekaman kekeringan bertempat di Lahan Penelitian University Farm dan rumah kaca Departemen Biologi. Analisis kandungan prolin dan asam askorbat dilakukan di Laboratorium Penelitian Fisiologi Tumbuhan Departemen Biologi, FMIPA, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan adalah benih tanaman jarak pagar andromonoecious aksesi Dompu (no. koleksi 1,5, dan 6), tanah, pupuk NPK, asam metafosforik 5%, dichlorophenol-indophenol (DCIP), larutan ASA murni, asam sulfosalisilat 3%, asam asetat glasial, asam ortofosforik, ninhidrin, larutan toluene, aquades, koran atau kertas bekas, plastik klip (besar dan kecil), alumunium foil, dan kertas saring.
Peralatan yang digunakan adalah kamera digital, meteran, jangka sorong, gunting, gelas piala, pisau, pinset, pipet, penangas air, oven, botol penyimpan larutan, erlenmeyer, gelas ukur, buret dan penyangganya, batang pengaduk, sudip.
Metode
Penanaman dan perawatan tanaman. Biji jarak yang berasal dari bunga hermaprodit tanaman induk jarak pagar andromonoecious 1, 5, dan 6 ditanam pada polibag ukuran 60 cm x 60 cm dengan 12 ulangan disetiap induk. Sehingga total seluruh tanaman yang dirawat adalah 36 tanaman. Biji-biji yang telah ditanam tersebut dirawat hingga berumur tujuh bulan di lahan penelitian University Farm. Setelah itu, dilakukan penyetekan dengan menggunakan stek batang pada setiap tanaman (satu batang) dan dipelihara sampai berumur delapan minggu di rumah kaca. Proses perawatan tanaman meliputi pemupukan, penyiangan gulma, dan penyiraman sampai tanaman siap diberi perlakuan cekaman kekeringan.
Perlakuan cekaman kekeringan.
Perlakuan cekaman kekeringan diberikan dalam jangka waktu yang berbeda yaitu 0, 3, 6, 9, 12, dan 15 hari dengan penyiraman terakhir dilakukan pada hari ke-0. Pada setiap jangka waktu tersebut, tanaman jarak pagar andromonoecious yang telah diberi cekaman kekeringan diambil sebanyak dua ulangan
tanaman pada setiap induk dan diambil data jumlah daun. Kemudian, tanaman-tanaman yang sudah diambil data jumlah daunnya dicabut dari polibag dan diambil data jumlah akar lateral dan panjang akar primernya. Salah satu ciri tanaman jarak pagar andromonoecious dapat dilihat dari percabangannya yaitu memiliki percabangan dari batang utama ≥4 cabang dengan sudut cabang ≥450. Pada stek batang juga diberikan perlakuan hari cekaman kekeringan yang sama sesuai dengan cekaman kekeringan yang diberikan pada saat batang tersebut belum distek atau masih menyatu dengan tanaman induk saat berada di lahan penelitian. Kemudian, dari stek batang ini diambil beberapa helai daun sesuai dengan jangka waktu perlakuan hari kekeringan untuk dilakukan analisis kandungan prolin dan asam askorbat (ASA). Daun yang diambil adalah daun yang sudah lebar penuh dan biasanya berada di urutan ketiga atau keempat dari pucuk batang.
Analisis prolin. Kandungan prolin dianalisis berdasarkan metode Bates (1973) dengan menggunakan spektrofotometer UV-VIS. Sampel daun jarak pagar sebanyak 0,5 gram digerus, kemudian ditambahkan 10 ml larutan asam sulfosalisilat 3% dan disaring menggunakan kertas saring. Filtrat sampel sebanyak 2 ml direaksikan dengan 2 ml asam ninhidrin dan 2 ml asam asetat glasial dalam tabung uji selama satu jam pada suhu 1000C. Setelah dipanaskan, campuran tersebut didinginkan dalam bak es. Pada ekstraksi yang sudah dingin, ditambahkan 4 ml toluene dan di kocok menggunakan stirrer selama 15-20 detik. Kandungan prolin diukur menggunakan spektrofotometer UV-VIS dengan panjang gelombang 520 nm. Asam ninhidrin dapat dibuat dengan melarutkan 1,25 g ninhidrin dalam 30 ml asam asetat glasial 100% dan 20 ml asam ortofosforik pada suhu 600-800C. Setelah larut dan dingin, asam ninhidrin disimpan selama 24 jam pada suhu 40C agar stabil
Analisis asam askorbat (ASA).
larutan NaOH 1 N sebanyak 2 ml/150 ml larutan DCIP. Larutan ini harus segera digunakan dalam jangka waktu kurang dari seminggu dan disimpan pada suhu 40C. Larutan DCIP yang digunakan untuk titrasi distandarisasi dengan larutan ASA murni dengan cara titrasi. Sebanyak 1 ml larutan ASA murni (4 mg/l) dan 9 ml asam metafosforik 5%. Titrasi dihentikan saat terjadi perubahan warna menjadi merah muda.
Rancangan percobaan. Rancangan percobaan yang digunakan adalah metode rancangan acak lengkap dua faktor. Induk tanaman (induk 1, 5, 6) sebagai faktor pertama dan hari cekaman kekeringan (0, 3, 6, 9, 12, 15 hari) sebagai faktor kedua. Analisis data menggunakan ANOVA dan uji lanjut Duncan pada taraf α=5% dengan software SAS 9.1.
HASIL
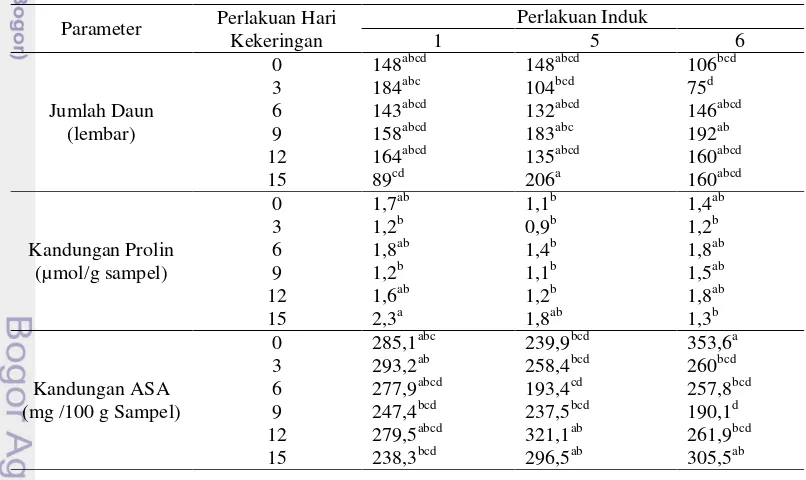
Pada pengamatan parameter jumlah daun dan kandungan prolin (Tabel 1) menunjukkan hasil yang tidak berbeda nyata
(p>0,05). Tanaman jarak pagar andromonoecious induk 1 cenderung menghasilkan jumlah daun terbanyak pada hari cekaman kekeringan ke-3 dan kandungan prolin terbanyak pada hari cekaman kekeringan ke-15. Tanaman jarak pagar andromonoecious induk 5 cenderung menghasilkan jumlah daun dan kandungan prolin terbanyak pada hari cekaman kekeringan yang sama yaitu hari ke-15. Sedangkan tanaman jarak pagar andromonoecious induk 6 cenderung menghasilkan jumlah daun terbanyak pada hari cekaman kekeringan ke-9 dan kandungan prolin terbanyak pada hari cekaman kekeringan ke-12.
Kandungan ASA (Tabel 1) menunjukkan hasil yang berbeda nyata (p≤0,05). Kandungan ASA terbanyak yang dihasilkan oleh tanaman jarak pagar andromonoecious induk 5 pada hari cekaman kekeringan ke-12. Sedangkan kandungan ASA terbanyak yang dihasilkan tanaman jarak pagar andromonoecious induk 1 pada hari ke-3 dan induk 6 pada hari ke-0.
Tabel 1 Jumlah daun, kandungan prolin dan asam askorbat (ASA) pada perlakuan hari cekaman kekeringan dan perlakuan induk tanaman jarak pagar.
Parameter Perlakuan Hari Kekeringan
Perlakuan Induk
1 5 6
Jumlah Daun (lembar)
0 148abcd 148abcd 106bcd 3 184abc 104bcd 75d 6 143abcd 132abcd 146abcd 9 158abcd 183abc 192ab 12 164abcd 135abcd 160abcd 15 89cd 206a 160abcd
Kandungan Prolin (µmol/g sampel)
0 1,7ab 1,1b 1,4ab
3 1,2b 0,9b 1,2b
6 1,8ab 1,4b 1,8ab
9 1,2b 1,1b 1,5ab
12 1,6ab 1,2b 1,8ab
15 2,3a 1,8ab 1,3b
Kandungan ASA (mg /100 g Sampel)
0 285,1abc 239,9bcd 353,6a 3 293,2ab 258,4bcd 260bcd 6 277,9abcd 193,4cd 257,8bcd 9 247,4bcd 237,5bcd 190,1d 12 279,5abcd 321,1ab 261,9bcd 15 238,3bcd 296,5ab 305,5ab
[image:11.595.108.511.423.663.2]4
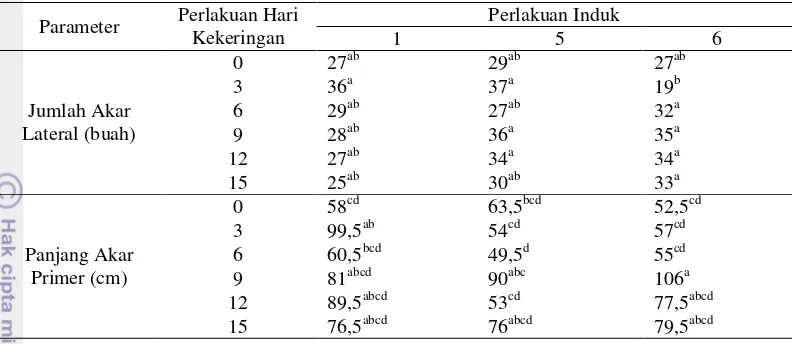
Tabel 2 Jumlah akar lateral dan panjang akar primer pada perlakuan hari cekaman kekeringan dan perlakuan induk tanaman jarak pagar.
Parameter Perlakuan Hari Kekeringan
Perlakuan Induk
1 5 6
Jumlah Akar Lateral (buah)
0 27ab 29ab 27ab
3 36a 37a 19b
6 29ab 27ab 32a
9 28ab 36a 35a
12 27ab 34a 34a
15 25ab 30ab 33a
Panjang Akar Primer (cm)
0 58cd 63,5bcd 52,5cd
3 99,5ab 54cd 57cd
6 60,5bcd 49,5d 55cd 9 81abcd 90abc 106a 12 89,5abcd 53cd 77,5abcd 15 76,5abcd 76abcd 79,5abcd
Keterangan: Angka-angka dengan diikuti huruf yang sama pada kolom yang sama memiliki arti tidak berbeda nyata berdasarkan Uji Duncan pada taraf nyata 5%.
Jumlah akar lateral (Tabel 2) menunjukkan hasil yang tidak berbeda nyata (p>0,05). Tanaman jarak pagar andromonoecious induk 1 dan induk 5 cenderung memiliki jumlah akar lateral terbanyak pada hari cekaman kekeringan ke-3. Tanaman jarak pagar andromonoecious induk 6 cenderung memiliki jumlah akar lateral terbanyak pada hari cekaman kekeringan ke-9.
Panjang akar primer (Tabel 2) menunjukkan hasil yang berbeda nyata (p≤0.05). Panjang akar primer terpanjang dihasilkan oleh tanaman jarak pagar andromonoecious induk 6 pada hari cekaman kekeringan ke-9. Sedangkan pada tanaman jarak pagar andromonoecious induk 1 panjang maksimal pada hari cekaman kekeringan ke-3 dan induk 5 panjang maksimal pada hari cekaman kekeringan ke-9.
PEMBAHASAN
Respon jumlah daun yang ditunjukkan oleh tanaman jarak pagar andromonoecious setelah diberikan perlakuan hari cekaman kekeringan berbeda-beda (Tabel 1). Tanaman jarak pagar andromonoecious ini cenderung menggugurkan daunnya saat terkena cekaman kekeringan yang berat. Walaupun demikian, tanaman induk 5 tetap memperbanyak daunnya sampai hari cekaman kekeringan ke-15.
Daun pada tanaman yang terkena cekaman kekeringan dapat mengalami kelayuan dan menggulung sehingga menghambat fotosintesis. Akibat lanjut dari
cekaman kekeringan adalah menurunnya laju fotosintesis dan seringkali mengakibatkan menurunnya akumulasi fotosintat (Savin dan Nicolas 1996). Akumulasi fotosintat yang terbatas atau terhenti mengakibatkan tanaman berada pada tingkat kekurangan karbohidrat, terpacunya degradasi lemak dan protein, akumulasi asam amino, dan mengurangi aktivitas enzim glikolisis. Pada tanaman yang peka terhadap cekaman kekeringan, perubahan metabolisme tersebut akan mempercepat kerusakan sel-sel bersifat tidak dapat balik, sehingga mengakibatkan kematian (Yu 1999). Tetapi bisa juga terjadi perbedaan respon karena adanya genetik tanaman, dimana perbedaan morfologi, anatomi dan metabolisme akan menghasilkan respon yang berbeda terhadap cekaman kekeringan (Hamim 2004).
Sel tumbuhan tertentu yang terpapar kondisi lingkungan yang kurang cocok seperti kekeringan, kadar garam, temperatur rendah, dan naungan akan menghasilkan prolin untuk menjaga keseimbangan osmotik sel. Hal ini dilakukan untuk mengatur tekanan osmotik pada kondisi cekaman
(osmotic adjustment) (Leegood 2001).
Tanaman yang mempunyai tingkat osmotikum lebih tinggi diduga lebih toleran terhadap cekaman kekeringan dibanding tanaman yang tingkat osmotikumnya lebih rendah. Apabila terjadi penurunan kandungan prolin, maka penurunan yang lebih sedikit dianggap yang toleran (Delauney dan Verma 1993). Prolin merupakan asam amino bebas yang disintesis tanaman dalam jaringan floem, akar dan biji (Simpson 2001). Prolin berperan besar sebagai osmoregulator, sehingga produksi senyawa tersebut yang berlebihan dapat menghasilkan peningkatan toleransi terhadap cekaman kekeringan tanaman (Marjorie et al. 2002). Bahan dasar pembentukan prolin adalah nitrogen dan hasil asimilat (Lakitan 2000). Hasil asimilat ini, biasanya banyak terdapat pada hari cekaman kekeringan terberat atau pada jangka waktu kekeringan yang paling lama. Namun, pada kondisi normal (tanaman tidak mengalami cekaman kekeringan) konsentrasi prolin akan selalu rendah (Khaerana et al. 2008). Oleh sebab itu adanya akumulasi prolin dapat menjadi indikator tanaman yang toleran terhadap kekeringan dan salinitas tinggi (Fitranty et al. 2003).
Respon kandungan asam askorbat (ASA) tanaman jarak pagar andromonoecious yang telah diberikan perlakuan hari cekaman kekeringan menunjukkan hasil yang berbeda-beda (Tabel 1). Cekaman kekeringan yang diberikan pada tanaman jarak pagar andromonoecious cenderung mengakibatkan terjadinya penurunan kandungan ASA hingga hari cekaman kekeringan ke-15. Hal ini berbeda dengan yang terjadi pada tanaman padi gogo, Echinochloa crusgalli. L., dan caisim dimana kandungan ASA meningkat saat terjadi cekaman kekeringan (Arifai 2009). Namun, diantara ketiga induk tanaman jarak pagar andromonoecious, tanaman induk 5 memiliki respon kandungan ASA yang lebih baik. Pada tanaman induk 5, kandungan ASA mengalami peningkatan dari hari cekaman ke-6 hingga hari cekaman ke-12, walaupun kemudian terjadi penurunan kembali di hari ke-15.
Perubahan lingkungan yang tidak menguntungkan termasuk kekeringan pada
tumbuhan, dapat menyebabkan terbentuknya senyawa oksidatif. Jika kondisi ini dibiarkan, tumbuhan akan mengalami cekaman oksidatif. Pembentukan senyawa oksidatif pada tumbuhan diawali dengan reduksi oksigen pada membran sel kloroplas membentuk superoksida (O2-). Jika hal ini terjadi akan terbentuk spesies oksigen reaktif (ROS) yang meliputi molekul-molekul seperti: superoksida (O2-), singlet oksigen ( -O2), radikal hidroksil (OH-) dan hidrogen peroksida (H2O2) (Blokhina et al. 2003). Pembentukan ROS ini akan terus meningkat ketika kondisi lingkungan tidak menguntungkan terus terjadi. Namun, tanaman memiliki suatu mekanisme penyelamatan terhadap kondisi tersebut. Salah satu mekanisme tersebut yaitu mekanisme antioksidan non-enzimatik yang menghasilkan senyawa-senyawa antioksidan seperti asam askorbat (ASA), glutasi (GSH), tokopherol, flavonoid, alkaloid dan karotenoid (Apel dan Hirt 2004).
Cekaman kekeringan pada tanaman dapat menginduksi terjadinya akumulasi ASA (Pignocchi et al. 2003). Peningkatan ASA pada tanaman ini memiliki peran untuk mereduksi radikal bebas yang terbentuk akibat cekaman oksidatif (Mc Kersie dan Leshem 1994). Antioksidan seperti ASA akan mengalami peningkatan di kloroplas pada kondisi kekeringan (Iturbe-Ormaetxe et al. 1998). Kecenderungan adanya penurunan kandungan ASA pada tanaman jarak pagar andromonoecious ini bisa saja terjadi karena adanya fungsi lain dari ASA yaitu sebagai ko-faktor untuk violaxantin deoxidase pada siklus xanthopyl. Proses ini memiliki peran dalam perlindungan pelepasan penyerapan cahaya dalam bentuk panas dan bisa diukur sebagai nonphotochemical quenching dari fluorosence klorofil (Ayhan 2000).
6
Seperti yang terjadi pada tanaman jagung, genotipe yang memiliki kandungan prolin tinggi cenderung memiliki panjang akar yang lebih panjang (Efendi 2009). Pada tanaman hotong (Setaria italica L. Beauv), perpanjangan akar berkorelasi positif dengan akumulasi prolin (Tuasamu 2009).
Menurut Wu dan Cosgrove (2000) pertumbuhan panjang akar yang intensif merupakan penentu kemampuan tanaman untuk beradaptasi pada kondisi cekaman kekeringan. Cekaman kekeringan menginduksi peningkatan akumulasi prolin yang diduga mempengaruhi peningkatan panjang akar pada aksesi tanaman hotong dengan adanya sinyal kimia yang dikendalikan oleh asam absisat (ABA) (Comstock 2002). Hal ini terjadi karena akumulasi prolin di daun akan ditranspor ke bagian ujung akar terutama zona pemanjangan akar untuk merangsang pertumbuhan akar sebagai respon awal ketika terjadi defisit air (Voetberg dan Sharp 1991). Zona pemanjangan akar terdapat dibelakang zona meristem akar (Salisbury dan Ross 1995).
SIMPULAN DAN SARAN
Simpulan
Tanaman jarak pagar andromonoecious induk 5 memiliki respon yang lebih baik dan lebih toleran terhadap kekeringan daripada tanaman jarak pagar andromonoecious induk 1 dan 6. Tanaman induk 5 dapat bertahan hidup dengan cara meningkatkan jumlah daun dan kandungan prolin hingga hari ke-15 serta kandungan asam askorbat hingga hari ke-12 cekaman kekeringan. Selain itu, tanaman induk 5 juga meningkatkan jumlah akar lateral di hari ke-3 dan panjang akar primer di hari ke-9 cekaman kekeringan.
Saran
Perlu dilakukan penelitian lebih lanjut tentang perbedaan respon yang diberikan tanaman jarak pagar hermaprodit (induk 1, 5, dan 6) terhadap cekaman kekeringan dengan waktu cekaman yang lebih panjang. Perbedaan respon yang perlu diamati yaitu antara respon yang ditunjukkan tanaman yang dirawat di lahan terbuka menggunakan naungan dengan tanaman yang dirawat di dalam rumah kaca. Hal ini perlu dilakukan agar diperoleh data yang lebih akurat berkaitan dengan perbedaan nilai respon yang dihasilkan.
DAFTAR PUSTAKA
Apel K, Hirt H. 2004. Reactive oxygen species metabolism, oxydative stress, and signal transduction. Plant Biol 143: 391-396.
Arifai M. 2009. Respon anatomi daun dan parameter fotosintesis tumbuhan padi gogo, caisim, Echinochloa crussgalli. L., dan bayam pada berbagai cekaman kekeringan [tesis]. Bogor: Sekolah Pasca Sarjana, Institut Pertanian Bogor. Asbani N. 2009. Jarak pagar
andromonoecious. Info Tek
Perkebunan 1: 23.
Ayhan C. 2000. Catalytic oxidation of p-Cres 1 by ascorbate peroxidase. Archive of Biochem Biophys 373: 175-181. Bates LS. 1973. Rapid determination of free
proline for water-stress studies. Plant and Soil 39: 205-207.
Behera SK, Srivastava P, Tripathi R, Singh JP, Singh N. 2010. Evaluation of plant performance of Jatropha curcas L under different agro-practices for optimizing biomass – a case study. Biomass and Bioenergy 34: 30-41.
Blokhina O, Virolainen E, Fagerstedt. 2003. Antioxidant, oxidative damage and oxygen deprivation stress [review]. Ann Bot 91: 179-194.
Capstick R. 2007. Jatropha curcas “Hasil
Panen Rakyat”. Prosiding
konferensi nasional Pemanfaatan Hasil Samping, Industri Biodiesel
dan etanol, Serta Peluang
Pengembangan Industri
Integratednya; Jakarta, 13 Mar 2007. Bogor: Pusat Penelitian Surfaktan dan Bioenergi. hlm 113-118.
Comstock JP. 2002. Hidraulic and chemical signaling in the control of stomatal conductance and transpiration [Short papers] . Exp Bot 537: 195-200. Delauney AJ, Verma DPS. 1993. Proline
biosinthesis and osmoregulation in plants. The Plant J 4: 215-223.
Dubrovsky JG, Go’mez-lomeli LF. 2003.
Efendi R. 2009. Tanggap genotype jagung toleran dan peka terhadap cekaman kekeringan pada fase perkecambahan. Prosiding Seminar Nasional Serealia.
Fitranty N, Nurlimala F, Santoso D, Minarsih H. 2003. Efektivitas Agrobacterium mentransfer gen P5CS ke dalam kalus tebu klon PS 851. Menara Perkebunan 71: 16-27.
Fukai S, Coeper M. 1995. Development of drought resistant cultivars using physio- morphological traits in rice. Field Crops Res 40: 67-86.
Gardner FP, Pearce RB, Mitchell RL. 1991.
Fisiologi Tanaman Budidaya.
Herawati Susilo (Penerjemah). Jakarta: Universitas Indonesia. Terjemahan dari: Physiology of Crop Plants.
Hamim. 2004. Underlying drought stress effect on plant: inhibition of photosynthesis. Hayati 11: 164-169. Hartati RS, Sudarsono. 2010. Pewarisan sifat
hermaprodit pada jarak pagar. Info Tek Perkebunan 2: 19.
Iturbe-Ormaetxe I, Escuredo PR, Arrese-Igor C, Becana M. 1998. Oxidative damage in pea plant exposed to water deficit or paraquat. Plant Physiol 132: 173-181.
Kandowangko NY, Suryatmana G, Nurlaeny N, Simanungkalit RDM. 2009. Proline and abscisic acid content in droughted corn plant inoculated with Azospirillum sp. and arbuscular mycorrhizae fungi. Hayati 16: 15-20.
Khaerana, Ghulamahdi M, Purwakusumah ED. 2008. Pengaruh cekaman kekeringan dan umur panen terhadap pertumbuhan dan kandungan xanthorizol temulawak (Curcuma xanthoriza roxb.). Bul Agron 36: 241-247.
Lakitan B. 2000. Dasar-Dasar Fisiologi Tumbuhan. Jakarta: Raja Grapindo Persada.
Leegood CPJL. 2001. Plant Biochemistry
And Molecular Biology. Second
edition. John Wileyand Sons. Marjorie J, Raymond, Smirnop N. 2002.
Proline metabolism and transport in maize seedlings at low water potential. Ann Bot 89: 813-823. Mc Kersie DB, Leshem YY. 1994. Stress and
Stress Coping in Cultivated Plants.
Netherlands: Kluwer Academic Publisher.
Mitra J. 2001. Genetics and genetic improvement of drought resistance in crop plants. Current Sci 80: 758-762.
Mulyani A, Agus F, Allelorung D. 2006. Potensi Sumber Daya Lahan untuk Pengembangan Jarak Pagar (Jatropha curcas L.) di Indonesia. Bogor: Pusat Penelitian dan Pengembangan Perkebunan.
Neumann PM. 2008. Coping mechanisms for crop plants in drought-prone environments. Ann Bot 101: 901-907.
Openshaw K. 2000. A review of Jatropha curcas: an oil plant of unfulfilled promise. Biomass Bioenerg 19: 1-15.
Parwata IGMA, Indradewa D, Yudono P, Kertonegoro BD. 2010. Pengelompokkan genotype jarak pagar berdasarkan ketahanannya terhadap kekeringan pada fase pembibitan di lahan pasir pantai. J. Agron Indones 38:156 – 162. Pignocchi C, Fletcher JM, Wilkinson JE,
Barnes JD, Foyer CH. 2003. The function of ascorbate oxidase in tobacco. Plant Physiol 132:1631– 1641.
Prawitasari T et al. 2006. Jarak Pagar Tanaman Penghasil Biodiesel. Seri Agribisnis. Bogor: PT. Penebar Swadaya.
Reiss C. 1993. Part 1; plant biochemistry, determination of ascorbic acid content of cabbage. Experiment in
Plant Physiology. New Jersey:
Benjamin Cummings.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Jilid ke-3. Lukman DR, Sumaryono, penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari: Plant Physiology. Savin R, Nicolas ME. 1996. Effect of short
periods of drought and high temperature on grain growth and starch accumulation of two malting barley cultivars. Aust J Plant Physiol 23: 201-210.
Simpson DJ. 2001. Proteolytic degradation of cereal prolamins – the problem with proline. J Plant Sci 161: 825-838. Schwanz P and Polle A. 2001. Differential
8
oak (Quercus robur) and maritime pine (Pinus pinaster) grown under high CO2 concentrations. J Exp Bot 52: 133-143.
Sodikin H. 2009. Aktivitas superoksida dismutase, askorbat peroksidase dan akumulasi asam askorbat akibat cekaman kekeringan dan herbisida paraquat pada kedelai budidaya dan kedelai liar [skripsi]. Bogor: Departemen Biologi, Institut Pertanian Bogor.
Tuasamu Y. 2009. Toleransi hotong (Setaria italica L. Beauv) pada berbagai cekaman kekeringan: pendekatan anatomi dan fisiologi [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Voetberg GS, Sharp RE. 1991. Growth of the maize primary root at low water potentials. III. Role of increase proline deposition in osmotic adjustment. PlantPhysiol 96: 1125-1130.
Wu Y, Cosgrove DJ. 2000. Adaptation of root to low water potentials by changes in cell wall extensibility and cell wall proteins. J Exp Bot 51:1543-1553.
www.dompukab.go.id [25 Agustus 2012] Yu SM. 1999. Cellular and genetic responses