ABSTRAK
DEASY ANGELA. Pemanfaatan bioflok dengan ukuran yang berbeda oleh udang vaname, ikan nila, dan kerang hijau dengan isotop 15N sebagai penanda. Dibimbing oleh WIDANARNI dan JULIE EKASARI.
Aplikasi penanda isotop stabil seperti 15N dalam menelusuri aliran nitrogen dalam rantai makanan di lingkungan perairan telah banyak digunakan. Tujuan penelitian ini untuk mengetahui pengaruh ukuran terhadap pemanfaatan bioflok pada media kultur udang vaname, ikan nila, dan kerang hijau dengan menggunakan penanda isotop 15N. Pada penelitian ini ukuran flok yang digunakan yaitu ukuran flok tanpa penyaringan, >100 µm, 48-100 µm, dan <48 µm. Pada penelitian ini jumlah nitrogen yang berasal dari bioflok yang dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau ditentukan berdasarkan akumulasi 15N pada ketiga biota tersebut. Hasil analisis isotop stabil 15N dan N total pada biota menunjukkan bahwa udang vaname, ikan nila, dan kerang hijau lebih banyak memanfaatkan nitrogen dari bioflok pada ukuran flok >100 µm.
Kata kunci: isotop 15N, ukuran flok, udang vaname, ikan nila, kerang hijau
ABSTRACT
DEASY ANGELA. Utilization of biofloc with different size in white shrimp, tilapia, and green mussel with isotope 15N tracing. Supervised by WIDANARNI and JULIE EKASARI.
Aplication of stable isotope like 15N in tracing nitrogen flow in food chain has been widely used. The study aims to evaluate the influence of biofloc size to the biofloc utilization in white shrimp, tilapia, and green mussel with isotope 15N tracing. The biofloc size used in this experiment were unshieved floc, >100 µm, 48-100 µm, and <48 µm. The accumulation of 15N in biota is a parameter indicates the amount of biofloc uptake by biota. The result of stable isotope 15N analyses and total N in biota showed white shrimp, tilapia, and green mussel utilize more nitrogen from biofloc in floc size >100 µm.
1 I. PENDAHULUAN
Teknologi bioflok merupakan alternatif baru yang digunakan dalam sistem akuakultur untuk mengatasi masalah kualitas air (Avnimelech dan Kochba, 2009; De Schryver et al, 2008). Teknologi bioflok ini didasarkan pada kemampuan bakteri heterotrof dalam memanfaatkan nitrogen organik dan anorganik menjadi biomassa bakteri (Avnimelech, 2007; De Schryver et al, 2008; Ekasari, 2008). Selain menjaga kualitas air, biomas bakteri yang terbentuk dalam sistem ini membentuk aggregat bersama dengan mikroorganisme lain dan padatan tersuspensi lain di dalam air membentuk apa yang disebut dengan bioflok. Beberapa penelitian yang telah dilakukan melaporkan bahwa bioflok memiliki kandungan nutrisi yang cukup tinggi sehingga berpotensi sebagai alternatif sumber protein untuk organisme akuakultur yang dapat dimanfaatkan secara in situ (De Schryver dan Verstraete, 2009; Ekasari, 2008; Azim et al, 2007; Kuhn et al 2008 dan 2009).
2 heterotrofik nannoflagellata (Prato et al, 2010; Arapov, 2010; Kreeger and Newell, 2001).
Bioflok dari berbagai ukuran dapat diambil oleh ikan dan udang sebagai sumber pakan (Burford et al, 2004). Namun dalam pemanfaatan bioflok sangat tergantung pada kemampuan organisme dalam memanen flok bakteri dan kemampuan untuk mencerna (Avnimelech, 1999). Selain itu, jenis ikan, ukuran ikan, kebiasaan makan, ukuran flok, dan kepadatan flok juga mempengaruhi organisme dalam memanfaatkan flok bakteri (Avnimelech, 2007). Untuk mengetahui secara kuantitatif dan prediktif bioflok yang dapat diambil oleh ikan dan udang sangat sulit (Avnimelech, 2007). Salah satu cara untuk mengetahui pemanfaatan bioflok pada biota yaitu dengan cara bioflok diberi penanda isotop 15
N.
3 II. METODOLOGI
2.1 Prosedur Penelitian
2.1.1 Tahap I: Pembuatan dan Pengayaan Bioflok dengan Isotop 15N
Penelitian tahap I dilakukan di Laboratorium Teknik Produksi dan Manajemen Akuakultur. Adapun persiapan wadah bioflok dilakukan dengan menggunakan bak fiber bulat 100 L yang dilengkapi dengan aerasi dan diisi air laut 30 g/L serta 25 ekor udang (±5 g). Jumlah pakan per hari yang diberikan ditentukan dengan tingkat pemberian pakan sebesar 8 % bobot biomassa. Pemberian pakan dilakukan 4 kali sehari yaitu pada pukul 07:00, 11:00, 15:00, dan 19:00.
Molase (44,2% C) ditambahkan setiap hari sebagai sumber karbon organik dengan estimasi rasio C/N 15 dengan perhitungan berdasarkan Avnimelech (1999). Frekuensi pemberian molase adalah 3 kali sehari setiap 2 jam setelah pemberian pakan sebanyak 14,04 g per hari (Lampiran 4) yaitu pada pukul 09:00, 13:00, dan 17:00. Persiapan bioflok ini dilakukan selama 3 minggu hingga total padatan tersuspensi (TSS) bioflok mencapai 500 mg/L. Silikat diberikan pada awal minggu ke 3 pemeliharaan sebanyak 1 g/L setiap hari selama 1 minggu untuk mempercepat pembentukan flok (Browdy, 2001).
Pemberian penanda isotop dilakukan dengan memindahkan udang terlebih dahulu dari media suspensi bioflok. Pengayaan bioflok dengan 15N dilakukan dengan menambahkan 15(NH4)2SO4 (atom excess (a.e) 20% 15N) dengan konsentrasi 0,5% dari nilai total padatan tersuspensi (TSS) bioflok. Agar N yang ditambahkan dapat dimanfaatkan oleh bakteri maka secara bersamaan molase sebagai sumber karbon diberikan dengan perbandingan C/N 20 (Avnimelech dan Kochba, 2009). Setelah itu suspensi bioflok diaerasi selama 48 jam hingga nilai total amonia nitrogen (TAN) mencapai 0 mg/L yang menunjukkan bahwa semua N yang diberikan sudah diasimilasi oleh sel bakteri.
4 penyaringan bertingkat menggunakan kain saring nilon dengan ukuran mesh 48 µm dan 100 µm.
2.1.2 Tahap II: Pemberian Bioflok 15N pada Udang Vaname, Ikan Nila, dan Kerang Hijau
Penelitian tahap II dilakukan di Laboratorium Nutrisi. Adapun persiapan wadah pemeliharaan hewan uji yang digunakan dalam penelitian ini adalah stoples plastik 2 L. Persiapan wadah dilakukan dengan cara stoples dicuci menggunakan detergen, dibilas hingga bersih dan dikeringkan. Kemudian untuk menurunkan tingkat stres pada biota, bagian luar stoples dilapisi dengan plastik berwarna hitam. Setelah itu, masing-masing wadah perlakuan diisi dengan air laut 30 g/L yang telah didisinfeksi (klorin 30 ppm dan sodium thiosulfat 15 ppm, aerasi kuat 24 jam) sebanyak 1 L.
Hewan uji yang digunakan adalah udang vaname Litopenaeus vannamei
dengan bobot 10,9±1,17 g, ikan nila Oreochromis niloticus yang telah diadaptasikan pada air laut dengan bobot 9,55±1,17 g, dan kerang hijau Perna viridis dengan bobot 10,48±1,17 g. Masing-masing hewan uji tersebut dimasukkan ke dalam stoples masing-masing 1 ekor. Proses aklimasi dan pemuasaan dilakukan selama 24 jam sebelum perlakuan.
Setelah 24 jam masa aklimatisasi, media air masing-masing hewan uji kemudian diganti dengan media suspensi bioflok yang telah diberi penanda isotop 15
N sesuai dengan perlakuannya. Untuk setiap hewan uji terdapat 4 perlakuan ukuran flok yaitu flok tanpa penyaringan, >100 µm, 48-100 µm, dan <48 µm serta 1 perlakuan kontrol tanpa penambahan suspensi bioflok masing-masing dengan 5 ulangan. Konsentrasi suspensi bioflok yang diberikan untuk masing-masing ukuran disajikan pada Tabel 1. Hewan uji kemudian dipelihara selama 4 hari. Tabel 1. Total padatan tersuspensi (TSS) awal pada suspensi bioflok dengan
penanda 15N yang telah dipisahkan berdasarkan ukuran partikel
5 2.2 Parameter Pengamatan
2.2.1 Distribusi Ukuran Flok
Distribusi ukuran flok diukur menggunakan alat Coulter LS 100 Small Volume Module. Prinsip kerja dari Coulter LS berdasarkan penghamburan sinar laser dengan partikel sebagai sumber utama untuk mendapatkan informasi ukuran partikel. Analisis distribusi ukuran flok ini dilakukan di Pusat Penelitian Kimia, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Serpong.
2.2.2 Kualitas Air
Parameter kualitas air yang diukur yaitu total amonia nitrogen (TAN) (Lampiran 1) dan total padatan tersuspensi (Lampiran 2) yang dianalisis dengan metode standar berdasarkan APHA (1989). Sedangkan pengukuran oksigen terlarut (DO) dan pH dilakukan menggunakan alat yaitu DO meter dan pH meter. Hasil pengukuran DO dan pH berada pada kisaran yang optimum bagi udang vaname, ikan nila, dan kerang hijau (Tabel 2). Sedangkan nilai TAN pada penelitian ini lebih tinggi dari nilai optimum (Tabel 2).
Tabel 2. Hasil pengukuran total amonia nitrogen (TAN), oksigen terlarut (DO), dan pH pada media pemeliharaan udang vaname, ikan nila, dan kerang hijau dengan suspensi bioflok yang telah ditandai dengan isotop stabil 15
TanpaPenyaringan 1,22 5,37 8,14
TAN
TanpaPenyaringan 0,60 6,06 8,20
DO minimum
TanpaPenyaringan 0,51 6,01 8,32
pH 7,8-8,4 >100 µm 0,55 6,02 8,19
6 2.2.3 Analisis Isotop 15N
Analisis Isotop 15N dilakukan dengan metode standar berdasarkan IAEA (1990).
2.2.3.1 Persiapan Sampel
Persiapan sampel dilakukan dengan cara sampel dipanaskan dalam oven
selama 24 jam pada suhu 70˚C. Setelah itu sampel digerus menggunakan mortar
hingga menjadi tepung.
2.2.3.2 Analisis Nitrogen Total
Analisa nitrogen total dilakukan dengan metode Kjeldahl (Eviati dan Sulaeman, 2009) terdiri dari tiga tahap yaitu tahap destruksi, destilasi, dan titrasi. Tahap Destruksi
Tahap destruksi dilakukan dengan cara sampel ditimbang sebanyak 0,5 g, selenium 1 g, dan H2SO4 pekat 5 ml dimasukkan ke dalam tabung digest.
Kemudian didestruksi pada suhu 350 ˚C selama 30 menit, hingga keluar asap
putih atau cairan di dalam tabung digest berwarna hijau bening. Setelah itu, sampel didinginkan lalu diencerkan dengan air bebas ion (akuades) hingga volume 50 mL (Larutan A). kondensasi) selama 15 menit dari tetesan Larutan B.
Tahap Titrasi
Tahap titrasi dilakukan dengan cara sampel hasil destilasi sebelumnya dititrasi dengan NaOH 0,1 N hingga terjadi perubahan warna dari ungu menjadi hijau muda.
Jumlah nitrogen total dihitung berdasarkan rumus di bawah ini: Nitrogen Total (%) = ሺ୫ୌେ୪ି୫ୟୌሻൈୌେ୪ൈଵସ
7 2.2.3.3 Analisis 15N
Pengukuran isotop 15N dianalisa menggunakan alat FAN (Fischer Analysen Instrumente) NOI-6PC. Komposisi dari isotop stabil (rasio/ perbandingan antara isotop bermassa ringan dengan berat) berbagai materi biologi dapat diukur menggunakan spektrometer massa atau spektrometer emisi optikal (IAEA, 1990). Analisis 15N dilakukan di Badan Tenaga Atom Nasional, Pusat Aplikasi Isotop dan Radiasi, Pasar Jumat, Jakarta Selatan.
Hasil analisis isotop 15N diolah menggunakan perhitungan rumus berdasarkan IAEA (1990), seperti di bawah ini.
1. Perhitungan jumlah atom % 15N excess pada bioflok dan hewan uji (Gambar 5)
2. Perhitungan nitrogen yang dapat dimanfaatkan oleh bioflok berasal dari isotop 15
N (Gambar 6)
3. Perhitungan tingkat pemanfaatan nitrogen bioflok oleh hewan uji (Gambar 7)
Nitrogen yang dapat dimanfaatkan oleh bioflok berasal dari isotop 15N
= % Ndff [3] x Total N pada bioflok [4]
8 Keterangan Rumus :
A = total % atom 15N dalam suatu sampel, disebut juga % kelimpahan 15N (% 15
N abundance). Nilai a akan sama dengan a0 untuk kelimpahan alami, tetapi a>a0 bila sampel diperkaya dengan 15N.
a0 = % 15N kelimpahan alami (natural abundance % atom 15N nitrogen di alam).
Ndff = fraksi dari nitrogen (N) dalam sampel (bioflok) yang berasal dari penanda isotop yaitu 15(NH4)2SO4 a.e 20%.
2.3Analisis Data
Data yang diperoleh diolah dengan menggunakan program Microsoft Excel
9 III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Distribusi Ukuran Flok
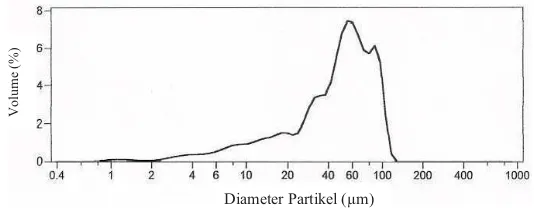
Pengukuran distribusi ukuran flok dilakukan setelah bioflok diberi penanda isotop 15N. Distribusi ukuran flok dikelompokkan menjadi 4 yaitu distribusi ukuran flok tanpa penyaringan, >100 µm, 48-100 µm, dan <48 µm. Hasil pengukuran distribusi ukuran bioflok tersebut secara berurutan disajikan pada Gambar 1, Gambar 2, Gambar 3, dan Gambar 4.
Gambar 1. Distribusi ukuran flok tanpa penyaringan
Distribusi ukuran flok sebelum dilakukan penyaringan berdasarkan ukuran disajikan pada Gambar 1. Gambar tersebut menunjukkan bahwa sebagian besar flok memiliki ukuran lebih dari 40 µm. Hasil pengukuran menunjukkan bahwa rata-rata ukuran partikel flok sebelum disaring adalah sebesar 79,24 µm.
Gambar 2. Distribusi ukuran flok > 100 µm
Distribusi ukuran flok yang tidak lolos dari saringan mesh 100 µm atau berukuran lebih dari 100 µm disajikan pada Gambar 2. Pada Gambar ini terlihat bahwa sebagian besar flok berukuran lebih dari 100 µm. Hasil pengukuran didapatkan rata-rata ukuran partikel flok pada kelompok ini adalah 118,1 µm.
10 Gambar 3. Distribusi ukuran flok 48 - 100 µm
Distribusi ukuran flok yang lolos dari saringan 100 µm namun tidak lolos dari saringan 48 µm atau flok dengan kisaran 48-100 µm dapat dilihat pada Gambar 3. Hasil pengukuran menunjukkan bahwa rata-rata ukuran partikel flok pada kelompok ini adalah sebesar 50,75 µm.
Gambar 4. Distribusi ukuran flok < 48 µm
Distribusi ukuran flok yang lolos dari saringan 48 µm atau flok berukuran kurang dari 48 µm pada Gambar 4 menunjukkan bahwa sebagian besar flok pada kelompok ini berukuran kurang dari 40 µm. Hasil pengukuran partikel menunjukkan bahwa rata-rata ukuran partikel flok yang lolos saringan 48 µm adalah 25,55 µm.
3.1.2 Jumlah Atom % 15N excess pada Bioflok, Udang Vaname, Ikan Nila,
dan Kerang Hijau
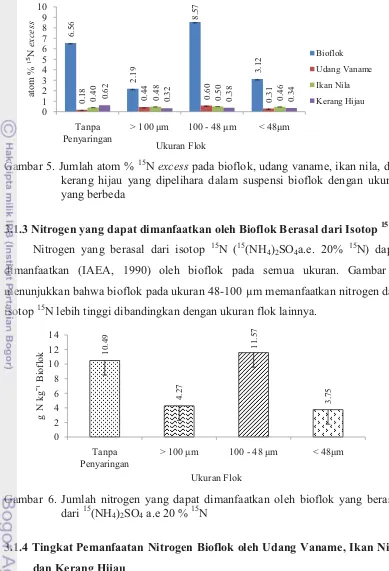
Jumlah atom % 15N pada bioflok ukuran 48-100 µm lebih tinggi dibandingkan ukuran flok lainnya. Sedangkan jumlah atom % 15N yang dapat diambil oleh udang vaname, ikan nila, dan kerang hijau lebih rendah dari jumlah atom % 15N pada bioflok (Gambar 5).
Volum
e
(%
)
Diameter Partikel (µm) Diameter Partikel (µm)
Volum
e
(%
)
11 Gambar 5. Jumlah atom % 15N excess pada bioflok, udang vaname, ikan nila, dan kerang hijau yang dipelihara dalam suspensi bioflok dengan ukuran yang berbeda
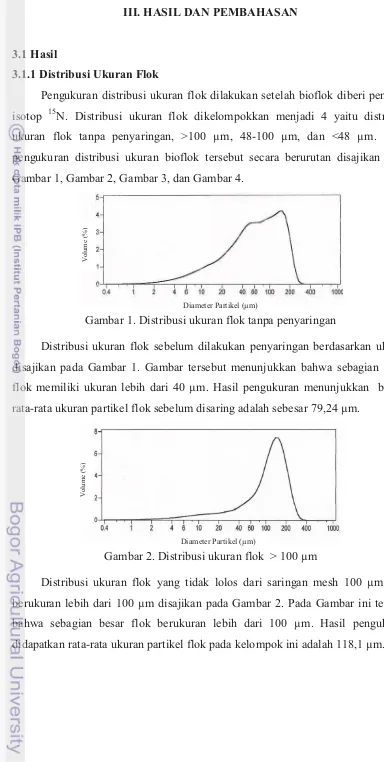
3.1.3 Nitrogen yang dapat dimanfaatkan oleh Bioflok Berasal dari Isotop 15N Nitrogen yang berasal dari isotop 15N (15(NH4)2SO4a.e. 20% 15N) dapat dimanfaatkan (IAEA, 1990) oleh bioflok pada semua ukuran. Gambar 6 menunjukkan bahwa bioflok pada ukuran 48-100 µm memanfaatkan nitrogen dari isotop 15N lebih tinggi dibandingkan dengan ukuran flok lainnya.
Gambar 6. Jumlah nitrogen yang dapat dimanfaatkan oleh bioflok yang berasal dari 15(NH4)2SO4 a.e 20 % 15N
3.1.4 Tingkat Pemanfaatan Nitrogen Bioflok oleh Udang Vaname, Ikan Nila, dan Kerang Hijau
Nitrogen bioflok dari semua ukuran flok dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau. Gambar 7 menunjukkan bahwa udang vaname, ikan nila, dan kerang hijau dapat memanfaatkan dengan baik nitrogen dari bioflok terutama pada ukuran flok >100 µm.
12 Gambar 7. Tingkat pemanfaatan N bioflok dengan ukuran yang berbeda oleh
udang vaname, ikan nila, dan kerang hijau
3.2 Pembahasan
Jumlah isotop yang bermassa lebih berat pada sampel dinyatakan dalam persen atom kelimpahan alami (excess of natural abundance) (IAEA, 1990). Jumlah atom % 15N diperoleh dari hasil pengurangan dari total atom % 15N pada biota dan kelimpahan alami dari atom % 15N di alam (0,366 atom % 15N) (IAEA, lebih tinggi dari ukuran flok lainnya yaitu sebesar 8,75 atom % 15N (Gambar 5). Hasil tersebut berbanding lurus dengan jumlah nitrogen yang dapat dimanfaatkan oleh bioflok dari isotop 15N yaitu sebesar 11,57 g N/Kg bioflok (Gambar 6). Menurut Hoch et al (1992), nitrogen yang berasal dari isotop 15N dapat dimanfaatkan oleh bakteri atau fitoplankton menjadi suatu biomassa bakteri dan bakteri heterotrof memanfaatkan nitrogen dari isotop bersamaan dengan NH4+.
Bioflok yang dapat diambil oleh biota dapat diketahui melalui akumulasi 15
N pada biota tersebut (Avnimelech, 2007). Pada udang vaname dan ikan nila jumlah atom % 15N pada ukuran flok 48-100 µm lebih tinggi daripada ukuran flok lainnya yaitu sebesar 0,60 dan 0,50 atom % 15N. Sedangkan pada kerang hijau jumlah atom % 15N pada ukuran flok tanpa penyaringan lebih tinggi daripada ukuran flok lainnya yaitu 0,62 atom % 15N. Hal ini dimungkinkan karena bioflok
13 pada ukuran tersebut memang mengandung atom 15N lebih tinggi daripada ukuran lain, sehingga walaupun jumlah flok yang dimakan sedikit namun jumlah atom 15
N bisa lebih tinggi dari perlakuan lain.
Jumlah N bioflok yang dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau diperoleh dengan mengalikan proporsi atom 15N dalam biota dari atom 15N dalam bioflok dikalikan dengan total N dalam biota. Dari hasil perhitungan tersebut didapatkan bahwa nitrogen bioflok yang paling dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau (Gambar 7) adalah bioflok dengan ukuran >100 µm. Berdasarkan Gambar 7, dapat dilihat bahwa udang vaname dapat memanfaatkan N bioflok sebesar 21,08 g N/Kg berat kering udang atau 20,04 % dari total N tubuh udang. Menurut Burford (2003) dan (2004), udang vaname mampu mengasimilasi protein dari bioflok sebesar 20-30 % atau 3,2-4,8 % N. Sedangkan pada ikan nila, jumlah nitrogen yang dapat dimanfaatkan dari bioflok sebesar 19,74 g N/Kg berat kering ikan nila atau 21,68 % dari total N tubuh ikan nila (Gambar 7). Pada kerang hijau, saat ini teknologi bioflok belum diaplikasikan. Namun organisme akuatik seperti moluska juga dapat mengasimilasi nitrogen sebesar 33% N dari limbah nitrogen yang terkandung dalam pakan (Crab et al, 2007; Kautsky, 2004). Sehingga, diduga kerang hijau dapat memanfaatkan nitrogen yang berasal dari bioflok. Berdasarkan hasil pada Gambar 7, kerang hijau mampu memanfaatkan nitrogen dari bioflok sebesar 20,39 g N/Kg berat kering kerang (tanpa cangkang) atau 14,54 % N dari tubuh kerang.
15 IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Bioflok tanpa penyaringan, ukuran >100 µm, 48-100 µm, dan <48 µm dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau. Bioflok ukuran >100 µm adalah ukuran dapat dimanfaatkan dengan baik oleh udang vaname, ikan nila, dan kerang hijau.
4.2 Saran
PEMANFAATAN BIOFLOK DENGAN UKURAN YANG
BERBEDA OLEH UDANG VANAME, IKAN NILA, DAN
KERANG HIJAU DENGAN ISOTOP
15N SEBAGAI PENANDA
DEASY ANGELA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PEMANFAATAN BIOFLOK DENGAN UKURAN YANG
BERBEDA OLEH UDANG VANAME, IKAN NILA, DAN
KERANG HIJAU DENGAN ISOTOP
15N SEBAGAI PENANDA
DEASY ANGELA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya,
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
PEMANFAATAN BIOFLOK DENGAN UKURAN YANG BERBEDA OLEH UDANG VANAME, IKAN NILA, DAN KERANG HIJAU DENGAN ISOTOP 15N SEBAGAI PENANDA
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2012
ABSTRAK
DEASY ANGELA. Pemanfaatan bioflok dengan ukuran yang berbeda oleh udang vaname, ikan nila, dan kerang hijau dengan isotop 15N sebagai penanda. Dibimbing oleh WIDANARNI dan JULIE EKASARI.
Aplikasi penanda isotop stabil seperti 15N dalam menelusuri aliran nitrogen dalam rantai makanan di lingkungan perairan telah banyak digunakan. Tujuan penelitian ini untuk mengetahui pengaruh ukuran terhadap pemanfaatan bioflok pada media kultur udang vaname, ikan nila, dan kerang hijau dengan menggunakan penanda isotop 15N. Pada penelitian ini ukuran flok yang digunakan yaitu ukuran flok tanpa penyaringan, >100 µm, 48-100 µm, dan <48 µm. Pada penelitian ini jumlah nitrogen yang berasal dari bioflok yang dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau ditentukan berdasarkan akumulasi 15N pada ketiga biota tersebut. Hasil analisis isotop stabil 15N dan N total pada biota menunjukkan bahwa udang vaname, ikan nila, dan kerang hijau lebih banyak memanfaatkan nitrogen dari bioflok pada ukuran flok >100 µm.
Kata kunci: isotop 15N, ukuran flok, udang vaname, ikan nila, kerang hijau
ABSTRACT
DEASY ANGELA. Utilization of biofloc with different size in white shrimp, tilapia, and green mussel with isotope 15N tracing. Supervised by WIDANARNI and JULIE EKASARI.
Aplication of stable isotope like 15N in tracing nitrogen flow in food chain has been widely used. The study aims to evaluate the influence of biofloc size to the biofloc utilization in white shrimp, tilapia, and green mussel with isotope 15N tracing. The biofloc size used in this experiment were unshieved floc, >100 µm, 48-100 µm, and <48 µm. The accumulation of 15N in biota is a parameter indicates the amount of biofloc uptake by biota. The result of stable isotope 15N analyses and total N in biota showed white shrimp, tilapia, and green mussel utilize more nitrogen from biofloc in floc size >100 µm.
Judul Skripsi : Pemanfaatan bioflok dengan ukuran yang berbeda oleh udang vaname, ikan nila, dan kerang hijau dengan isotop 15N sebagai penanda
Mahasiswa : Deasy Angela Nomor Pokok : C14080068
Disetujui, Pembimbing I
Dr. Widanarni NIP. 196709271994032001
Pembimbing II
Julie Ekasari, M.Sc NIP. 197707252005012002
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Sukenda
NIP. 196710131993021001
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT berkat rahmat dan karunia-Nya, penelitian dan penulisan skripsi yang berjudul “Pemanfaatan
bioflok dengan ukuran yang berbeda oleh udang vaname, ikan nila, dan kerang hijau dengan isotop 15N sebagai Penanda” dapat diselesaikan dengan baik.
Penelitian ini dilaksanakan pada bulan Mei 2012 s.d. Juli 2012 di Departemen Budidaya Perairan, FPIK, IPB. Penulis menyampaikan rasa terimakasih yang sebesar-besarnya kepada:
1. Orang tua tercinta, drh. H. Aceng Rosadas dan Hj. Popi Ropia yang selalu memberikan kasih sayang, doa dan dukungan baik moril maupun materil dan adik-adikku Dede, Opi, Odet, Oni, dan Yuda.
2. Dr. Widanarni selaku Pembimbing I dan Julie Ekasari, M.Sc selaku Pembimbing II serta Dr. M. Agus Suprayudi selaku Dosen Penguji pada pelaksanaan Ujian Akhir Skripsi atas bimbingan dan dukungannya selama pelaksanaan penelitian dan penyusunan tugas akhir.
3. Prof. Dr. Ir. Enang Harris, M.Sc selaku dosen Pembimbing Akademik. 4. Badan Tenaga Atom Nasional, Pusat Aplikasi Isotop dan Radiasi.
5. Laboran Pak Ranta, Pak Wasjan, Mba Retno, Pak Jajang, Kang Abe, Kang Dama, dan staff pegawai BDP yang telah membantu dalam menunjang penelitian dan penyelesaian tugas akhir.
6. Teman-teman tim bioflok Titi Nur Chayati, Ivan Daniel, Nora Putri Sari, dan Dian Utami Putri yang telah membantu dalam penyelesaian penelitian dan tugas akhir ini.
7. Teman-teman LKI Kak Rahman, Kak Rahmat, Nurlita, Jeanni, Retno, Wahyu, dan Dendi serta anak kosan MAHARLIKA yang telah banyak membantu dan memberi semangat.
8. Dara Restu Maharani, S.E dan Zaenal Abidin, S.Pi serta semua pihak yang telah membantu penulis baik secara langsung maupun tidak langsung.
Semoga skripsi ini bermanfaat bagi pihak yang membutuhkan.
RIWAYAT HIDUP
Penulis merupakan anak pertama dari enam bersaudara yang dilahirkan di Sumedang, 19 Oktober 1990 dari pasangan drh. H. Aceng Rosadas dan Hj. Popi Ropia. Penulis lulus dari SMAN 2 Tinggimoncong pada tahun 2008. Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah (BUD) pada jurusan Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah mengikuti magang mengenai Teknik Pembenihan Ikan Nila di Balai Besar Budidaya Air Tawar (BBBAT) Sukabumi (2010), Pembenihan Udang Vaname di PT Suri Tani Pemuka (STP) Banyuwangi (2010), Proses Produksi Pakan Udang di PT Suri Tani Pemuka (STP) Banyuwangi (2010), dan Teknik Pembenihan Ikan Botia di Balai Riset Budidaya Ikan Hias (BRBIH) Depok (2011). Penulis mengikuti praktek kerja lapangan mengenai Pembesaran Udang Vaname di Tambak Udang Sukenda Farm Lampung Selatan (2011). Penulis aktif sebagai pengurus Badan Eksekutif Mahasiswa (BEM-C) divisi Informasi dan Komunikasi (INFOKOM) periode 2010/2011. Selain itu, penulis juga aktif sebagai asisten mata kuliah Ikhtiologi S1 (2009/2010), Dasar-dasar Akuakultur S1 (2010/2011 dan 2011/2012), Fisika Kimia Perairan S1 (2010/2011), Manajemen Kualitas Air S1 (2010/2011), Manajemen Kesehatan Organisme Akuatik S1 (2011/2012), Pengelolaan Budidaya Air Payau dan Marikultur D3 (2012/2013).
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat memperoleh gelar sarjana perikanan (S.Pi) dengan judul “Pemanfaatan Bioflok dengan Ukuran yang Berbeda oleh Udang Vaname, Ikan Nila, dan
DAFTAR ISI 2.1.1 Tahap I: Pembuatan dan Pengayaan Bioflok dengan Isotop 15N ... 3 2.1.2 Tahap II: Pemberian Bioflok 15N pada Udang Vaname, Ikan Nila, 3.1.2 Jumlah Atom % 15N excess pada Bioflok, Udang Vaname, Ikan Nila,
dan Kerang Hijau ... 10 3.1.3Nitrogen yang dapat dimanfaatkan oleh Bioflok Berasal dari Isotop
15
N ... 11 3.1.4 Tingkat Pemanfaatan Nitrogen Bioflok oleh Udang Vaname, Ikan
DAFTAR TABEL
Halaman
1. Total padatan tersuspensi (TSS) awal pada suspensi bioflok dengan penanda 15N yang telah dipisahkan berdasarkan ukuran partikel ... 4
2. Hasil pengukuran total amonia nitrogen (TAN), oksigen terlarut (DO), dan pH pada media pemeliharaan udang vaname, ikan nila, dan kerang hijau dengan suspensi bioflok yang telah ditandai dengan isotop stabil 15
DAFTAR GAMBAR
Halaman
1. Distribusi ukuran flok tanpa penyaringan... 9
2. Distribusi ukuran flok > 100 µm ... 9
3. Distribusi ukuran flok 48 - 100 µm ... 10
4. Distribusi ukuran flok < 48 µm ... 10
5. Jumlah atom % 15N excess pada bioflok, udang vaname, ikan nila, dan kerang hijau yang dipelihara dalam suspensi bioflok dengan ukuran yang berbeda ... 11
6. Jumlah nitrogen yang dapat dimanfaatkan oleh bioflok yang berasal dari 15
(NH4)2SO4 a.e 20 % 15N ... 11
DAFTAR LAMPIRAN
Halaman
1. Total Amonia Nitrogen (TAN) ... 20
2. Total Padatan Tersuspensi (TSS) ... 20
1 I. PENDAHULUAN
Teknologi bioflok merupakan alternatif baru yang digunakan dalam sistem akuakultur untuk mengatasi masalah kualitas air (Avnimelech dan Kochba, 2009; De Schryver et al, 2008). Teknologi bioflok ini didasarkan pada kemampuan bakteri heterotrof dalam memanfaatkan nitrogen organik dan anorganik menjadi biomassa bakteri (Avnimelech, 2007; De Schryver et al, 2008; Ekasari, 2008). Selain menjaga kualitas air, biomas bakteri yang terbentuk dalam sistem ini membentuk aggregat bersama dengan mikroorganisme lain dan padatan tersuspensi lain di dalam air membentuk apa yang disebut dengan bioflok. Beberapa penelitian yang telah dilakukan melaporkan bahwa bioflok memiliki kandungan nutrisi yang cukup tinggi sehingga berpotensi sebagai alternatif sumber protein untuk organisme akuakultur yang dapat dimanfaatkan secara in situ (De Schryver dan Verstraete, 2009; Ekasari, 2008; Azim et al, 2007; Kuhn et al 2008 dan 2009).
2 heterotrofik nannoflagellata (Prato et al, 2010; Arapov, 2010; Kreeger and Newell, 2001).
Bioflok dari berbagai ukuran dapat diambil oleh ikan dan udang sebagai sumber pakan (Burford et al, 2004). Namun dalam pemanfaatan bioflok sangat tergantung pada kemampuan organisme dalam memanen flok bakteri dan kemampuan untuk mencerna (Avnimelech, 1999). Selain itu, jenis ikan, ukuran ikan, kebiasaan makan, ukuran flok, dan kepadatan flok juga mempengaruhi organisme dalam memanfaatkan flok bakteri (Avnimelech, 2007). Untuk mengetahui secara kuantitatif dan prediktif bioflok yang dapat diambil oleh ikan dan udang sangat sulit (Avnimelech, 2007). Salah satu cara untuk mengetahui pemanfaatan bioflok pada biota yaitu dengan cara bioflok diberi penanda isotop 15
N.
3 II. METODOLOGI
2.1 Prosedur Penelitian
2.1.1 Tahap I: Pembuatan dan Pengayaan Bioflok dengan Isotop 15N
Penelitian tahap I dilakukan di Laboratorium Teknik Produksi dan Manajemen Akuakultur. Adapun persiapan wadah bioflok dilakukan dengan menggunakan bak fiber bulat 100 L yang dilengkapi dengan aerasi dan diisi air laut 30 g/L serta 25 ekor udang (±5 g). Jumlah pakan per hari yang diberikan ditentukan dengan tingkat pemberian pakan sebesar 8 % bobot biomassa. Pemberian pakan dilakukan 4 kali sehari yaitu pada pukul 07:00, 11:00, 15:00, dan 19:00.
Molase (44,2% C) ditambahkan setiap hari sebagai sumber karbon organik dengan estimasi rasio C/N 15 dengan perhitungan berdasarkan Avnimelech (1999). Frekuensi pemberian molase adalah 3 kali sehari setiap 2 jam setelah pemberian pakan sebanyak 14,04 g per hari (Lampiran 4) yaitu pada pukul 09:00, 13:00, dan 17:00. Persiapan bioflok ini dilakukan selama 3 minggu hingga total padatan tersuspensi (TSS) bioflok mencapai 500 mg/L. Silikat diberikan pada awal minggu ke 3 pemeliharaan sebanyak 1 g/L setiap hari selama 1 minggu untuk mempercepat pembentukan flok (Browdy, 2001).
Pemberian penanda isotop dilakukan dengan memindahkan udang terlebih dahulu dari media suspensi bioflok. Pengayaan bioflok dengan 15N dilakukan dengan menambahkan 15(NH4)2SO4 (atom excess (a.e) 20% 15N) dengan konsentrasi 0,5% dari nilai total padatan tersuspensi (TSS) bioflok. Agar N yang ditambahkan dapat dimanfaatkan oleh bakteri maka secara bersamaan molase sebagai sumber karbon diberikan dengan perbandingan C/N 20 (Avnimelech dan Kochba, 2009). Setelah itu suspensi bioflok diaerasi selama 48 jam hingga nilai total amonia nitrogen (TAN) mencapai 0 mg/L yang menunjukkan bahwa semua N yang diberikan sudah diasimilasi oleh sel bakteri.
4 penyaringan bertingkat menggunakan kain saring nilon dengan ukuran mesh 48 µm dan 100 µm.
2.1.2 Tahap II: Pemberian Bioflok 15N pada Udang Vaname, Ikan Nila, dan Kerang Hijau
Penelitian tahap II dilakukan di Laboratorium Nutrisi. Adapun persiapan wadah pemeliharaan hewan uji yang digunakan dalam penelitian ini adalah stoples plastik 2 L. Persiapan wadah dilakukan dengan cara stoples dicuci menggunakan detergen, dibilas hingga bersih dan dikeringkan. Kemudian untuk menurunkan tingkat stres pada biota, bagian luar stoples dilapisi dengan plastik berwarna hitam. Setelah itu, masing-masing wadah perlakuan diisi dengan air laut 30 g/L yang telah didisinfeksi (klorin 30 ppm dan sodium thiosulfat 15 ppm, aerasi kuat 24 jam) sebanyak 1 L.
Hewan uji yang digunakan adalah udang vaname Litopenaeus vannamei
dengan bobot 10,9±1,17 g, ikan nila Oreochromis niloticus yang telah diadaptasikan pada air laut dengan bobot 9,55±1,17 g, dan kerang hijau Perna viridis dengan bobot 10,48±1,17 g. Masing-masing hewan uji tersebut dimasukkan ke dalam stoples masing-masing 1 ekor. Proses aklimasi dan pemuasaan dilakukan selama 24 jam sebelum perlakuan.
Setelah 24 jam masa aklimatisasi, media air masing-masing hewan uji kemudian diganti dengan media suspensi bioflok yang telah diberi penanda isotop 15
N sesuai dengan perlakuannya. Untuk setiap hewan uji terdapat 4 perlakuan ukuran flok yaitu flok tanpa penyaringan, >100 µm, 48-100 µm, dan <48 µm serta 1 perlakuan kontrol tanpa penambahan suspensi bioflok masing-masing dengan 5 ulangan. Konsentrasi suspensi bioflok yang diberikan untuk masing-masing ukuran disajikan pada Tabel 1. Hewan uji kemudian dipelihara selama 4 hari. Tabel 1. Total padatan tersuspensi (TSS) awal pada suspensi bioflok dengan
penanda 15N yang telah dipisahkan berdasarkan ukuran partikel
5 2.2 Parameter Pengamatan
2.2.1 Distribusi Ukuran Flok
Distribusi ukuran flok diukur menggunakan alat Coulter LS 100 Small Volume Module. Prinsip kerja dari Coulter LS berdasarkan penghamburan sinar laser dengan partikel sebagai sumber utama untuk mendapatkan informasi ukuran partikel. Analisis distribusi ukuran flok ini dilakukan di Pusat Penelitian Kimia, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Serpong.
2.2.2 Kualitas Air
Parameter kualitas air yang diukur yaitu total amonia nitrogen (TAN) (Lampiran 1) dan total padatan tersuspensi (Lampiran 2) yang dianalisis dengan metode standar berdasarkan APHA (1989). Sedangkan pengukuran oksigen terlarut (DO) dan pH dilakukan menggunakan alat yaitu DO meter dan pH meter. Hasil pengukuran DO dan pH berada pada kisaran yang optimum bagi udang vaname, ikan nila, dan kerang hijau (Tabel 2). Sedangkan nilai TAN pada penelitian ini lebih tinggi dari nilai optimum (Tabel 2).
Tabel 2. Hasil pengukuran total amonia nitrogen (TAN), oksigen terlarut (DO), dan pH pada media pemeliharaan udang vaname, ikan nila, dan kerang hijau dengan suspensi bioflok yang telah ditandai dengan isotop stabil 15
TanpaPenyaringan 1,22 5,37 8,14
TAN
TanpaPenyaringan 0,60 6,06 8,20
DO minimum
TanpaPenyaringan 0,51 6,01 8,32
pH 7,8-8,4 >100 µm 0,55 6,02 8,19
6 2.2.3 Analisis Isotop 15N
Analisis Isotop 15N dilakukan dengan metode standar berdasarkan IAEA (1990).
2.2.3.1 Persiapan Sampel
Persiapan sampel dilakukan dengan cara sampel dipanaskan dalam oven
selama 24 jam pada suhu 70˚C. Setelah itu sampel digerus menggunakan mortar
hingga menjadi tepung.
2.2.3.2 Analisis Nitrogen Total
Analisa nitrogen total dilakukan dengan metode Kjeldahl (Eviati dan Sulaeman, 2009) terdiri dari tiga tahap yaitu tahap destruksi, destilasi, dan titrasi. Tahap Destruksi
Tahap destruksi dilakukan dengan cara sampel ditimbang sebanyak 0,5 g, selenium 1 g, dan H2SO4 pekat 5 ml dimasukkan ke dalam tabung digest.
Kemudian didestruksi pada suhu 350 ˚C selama 30 menit, hingga keluar asap
putih atau cairan di dalam tabung digest berwarna hijau bening. Setelah itu, sampel didinginkan lalu diencerkan dengan air bebas ion (akuades) hingga volume 50 mL (Larutan A). kondensasi) selama 15 menit dari tetesan Larutan B.
Tahap Titrasi
Tahap titrasi dilakukan dengan cara sampel hasil destilasi sebelumnya dititrasi dengan NaOH 0,1 N hingga terjadi perubahan warna dari ungu menjadi hijau muda.
Jumlah nitrogen total dihitung berdasarkan rumus di bawah ini: Nitrogen Total (%) = ሺ୫ୌେ୪ି୫ୟୌሻൈୌେ୪ൈଵସ
7 2.2.3.3 Analisis 15N
Pengukuran isotop 15N dianalisa menggunakan alat FAN (Fischer Analysen Instrumente) NOI-6PC. Komposisi dari isotop stabil (rasio/ perbandingan antara isotop bermassa ringan dengan berat) berbagai materi biologi dapat diukur menggunakan spektrometer massa atau spektrometer emisi optikal (IAEA, 1990). Analisis 15N dilakukan di Badan Tenaga Atom Nasional, Pusat Aplikasi Isotop dan Radiasi, Pasar Jumat, Jakarta Selatan.
Hasil analisis isotop 15N diolah menggunakan perhitungan rumus berdasarkan IAEA (1990), seperti di bawah ini.
1. Perhitungan jumlah atom % 15N excess pada bioflok dan hewan uji (Gambar 5)
2. Perhitungan nitrogen yang dapat dimanfaatkan oleh bioflok berasal dari isotop 15
N (Gambar 6)
3. Perhitungan tingkat pemanfaatan nitrogen bioflok oleh hewan uji (Gambar 7)
Nitrogen yang dapat dimanfaatkan oleh bioflok berasal dari isotop 15N
= % Ndff [3] x Total N pada bioflok [4]
8 Keterangan Rumus :
A = total % atom 15N dalam suatu sampel, disebut juga % kelimpahan 15N (% 15
N abundance). Nilai a akan sama dengan a0 untuk kelimpahan alami, tetapi a>a0 bila sampel diperkaya dengan 15N.
a0 = % 15N kelimpahan alami (natural abundance % atom 15N nitrogen di alam).
Ndff = fraksi dari nitrogen (N) dalam sampel (bioflok) yang berasal dari penanda isotop yaitu 15(NH4)2SO4 a.e 20%.
2.3Analisis Data
Data yang diperoleh diolah dengan menggunakan program Microsoft Excel
9 III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Distribusi Ukuran Flok
Pengukuran distribusi ukuran flok dilakukan setelah bioflok diberi penanda isotop 15N. Distribusi ukuran flok dikelompokkan menjadi 4 yaitu distribusi ukuran flok tanpa penyaringan, >100 µm, 48-100 µm, dan <48 µm. Hasil pengukuran distribusi ukuran bioflok tersebut secara berurutan disajikan pada Gambar 1, Gambar 2, Gambar 3, dan Gambar 4.
Gambar 1. Distribusi ukuran flok tanpa penyaringan
Distribusi ukuran flok sebelum dilakukan penyaringan berdasarkan ukuran disajikan pada Gambar 1. Gambar tersebut menunjukkan bahwa sebagian besar flok memiliki ukuran lebih dari 40 µm. Hasil pengukuran menunjukkan bahwa rata-rata ukuran partikel flok sebelum disaring adalah sebesar 79,24 µm.
Gambar 2. Distribusi ukuran flok > 100 µm
Distribusi ukuran flok yang tidak lolos dari saringan mesh 100 µm atau berukuran lebih dari 100 µm disajikan pada Gambar 2. Pada Gambar ini terlihat bahwa sebagian besar flok berukuran lebih dari 100 µm. Hasil pengukuran didapatkan rata-rata ukuran partikel flok pada kelompok ini adalah 118,1 µm.
10 Gambar 3. Distribusi ukuran flok 48 - 100 µm
Distribusi ukuran flok yang lolos dari saringan 100 µm namun tidak lolos dari saringan 48 µm atau flok dengan kisaran 48-100 µm dapat dilihat pada Gambar 3. Hasil pengukuran menunjukkan bahwa rata-rata ukuran partikel flok pada kelompok ini adalah sebesar 50,75 µm.
Gambar 4. Distribusi ukuran flok < 48 µm
Distribusi ukuran flok yang lolos dari saringan 48 µm atau flok berukuran kurang dari 48 µm pada Gambar 4 menunjukkan bahwa sebagian besar flok pada kelompok ini berukuran kurang dari 40 µm. Hasil pengukuran partikel menunjukkan bahwa rata-rata ukuran partikel flok yang lolos saringan 48 µm adalah 25,55 µm.
3.1.2 Jumlah Atom % 15N excess pada Bioflok, Udang Vaname, Ikan Nila,
dan Kerang Hijau
Jumlah atom % 15N pada bioflok ukuran 48-100 µm lebih tinggi dibandingkan ukuran flok lainnya. Sedangkan jumlah atom % 15N yang dapat diambil oleh udang vaname, ikan nila, dan kerang hijau lebih rendah dari jumlah atom % 15N pada bioflok (Gambar 5).
Volum
e
(%
)
Diameter Partikel (µm) Diameter Partikel (µm)
Volum
e
(%
)
11 Gambar 5. Jumlah atom % 15N excess pada bioflok, udang vaname, ikan nila, dan kerang hijau yang dipelihara dalam suspensi bioflok dengan ukuran yang berbeda
3.1.3 Nitrogen yang dapat dimanfaatkan oleh Bioflok Berasal dari Isotop 15N Nitrogen yang berasal dari isotop 15N (15(NH4)2SO4a.e. 20% 15N) dapat dimanfaatkan (IAEA, 1990) oleh bioflok pada semua ukuran. Gambar 6 menunjukkan bahwa bioflok pada ukuran 48-100 µm memanfaatkan nitrogen dari isotop 15N lebih tinggi dibandingkan dengan ukuran flok lainnya.
Gambar 6. Jumlah nitrogen yang dapat dimanfaatkan oleh bioflok yang berasal dari 15(NH4)2SO4 a.e 20 % 15N
3.1.4 Tingkat Pemanfaatan Nitrogen Bioflok oleh Udang Vaname, Ikan Nila, dan Kerang Hijau
Nitrogen bioflok dari semua ukuran flok dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau. Gambar 7 menunjukkan bahwa udang vaname, ikan nila, dan kerang hijau dapat memanfaatkan dengan baik nitrogen dari bioflok terutama pada ukuran flok >100 µm.
12 Gambar 7. Tingkat pemanfaatan N bioflok dengan ukuran yang berbeda oleh
udang vaname, ikan nila, dan kerang hijau
3.2 Pembahasan
Jumlah isotop yang bermassa lebih berat pada sampel dinyatakan dalam persen atom kelimpahan alami (excess of natural abundance) (IAEA, 1990). Jumlah atom % 15N diperoleh dari hasil pengurangan dari total atom % 15N pada biota dan kelimpahan alami dari atom % 15N di alam (0,366 atom % 15N) (IAEA, lebih tinggi dari ukuran flok lainnya yaitu sebesar 8,75 atom % 15N (Gambar 5). Hasil tersebut berbanding lurus dengan jumlah nitrogen yang dapat dimanfaatkan oleh bioflok dari isotop 15N yaitu sebesar 11,57 g N/Kg bioflok (Gambar 6). Menurut Hoch et al (1992), nitrogen yang berasal dari isotop 15N dapat dimanfaatkan oleh bakteri atau fitoplankton menjadi suatu biomassa bakteri dan bakteri heterotrof memanfaatkan nitrogen dari isotop bersamaan dengan NH4+.
Bioflok yang dapat diambil oleh biota dapat diketahui melalui akumulasi 15
N pada biota tersebut (Avnimelech, 2007). Pada udang vaname dan ikan nila jumlah atom % 15N pada ukuran flok 48-100 µm lebih tinggi daripada ukuran flok lainnya yaitu sebesar 0,60 dan 0,50 atom % 15N. Sedangkan pada kerang hijau jumlah atom % 15N pada ukuran flok tanpa penyaringan lebih tinggi daripada ukuran flok lainnya yaitu 0,62 atom % 15N. Hal ini dimungkinkan karena bioflok
13 pada ukuran tersebut memang mengandung atom 15N lebih tinggi daripada ukuran lain, sehingga walaupun jumlah flok yang dimakan sedikit namun jumlah atom 15
N bisa lebih tinggi dari perlakuan lain.
Jumlah N bioflok yang dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau diperoleh dengan mengalikan proporsi atom 15N dalam biota dari atom 15N dalam bioflok dikalikan dengan total N dalam biota. Dari hasil perhitungan tersebut didapatkan bahwa nitrogen bioflok yang paling dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau (Gambar 7) adalah bioflok dengan ukuran >100 µm. Berdasarkan Gambar 7, dapat dilihat bahwa udang vaname dapat memanfaatkan N bioflok sebesar 21,08 g N/Kg berat kering udang atau 20,04 % dari total N tubuh udang. Menurut Burford (2003) dan (2004), udang vaname mampu mengasimilasi protein dari bioflok sebesar 20-30 % atau 3,2-4,8 % N. Sedangkan pada ikan nila, jumlah nitrogen yang dapat dimanfaatkan dari bioflok sebesar 19,74 g N/Kg berat kering ikan nila atau 21,68 % dari total N tubuh ikan nila (Gambar 7). Pada kerang hijau, saat ini teknologi bioflok belum diaplikasikan. Namun organisme akuatik seperti moluska juga dapat mengasimilasi nitrogen sebesar 33% N dari limbah nitrogen yang terkandung dalam pakan (Crab et al, 2007; Kautsky, 2004). Sehingga, diduga kerang hijau dapat memanfaatkan nitrogen yang berasal dari bioflok. Berdasarkan hasil pada Gambar 7, kerang hijau mampu memanfaatkan nitrogen dari bioflok sebesar 20,39 g N/Kg berat kering kerang (tanpa cangkang) atau 14,54 % N dari tubuh kerang.
15 IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Bioflok tanpa penyaringan, ukuran >100 µm, 48-100 µm, dan <48 µm dapat dimanfaatkan oleh udang vaname, ikan nila, dan kerang hijau. Bioflok ukuran >100 µm adalah ukuran dapat dimanfaatkan dengan baik oleh udang vaname, ikan nila, dan kerang hijau.
4.2 Saran
16 DAFTAR PUSTAKA
APHA (American Public Health Association). 1989. Standard Methods for Examination of Water and Wastewater, 14thed. APHA. Washington DC: APHA. AWWA (American Water Works Association), and WPCF (Water Pollution Control Federation).
Arapov J, Balic DE, Peharda M, Gladan ZN. 20101. Bivalve feeding-how and what they eat. Ribarstvo 68, 105-116.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture 176, 227-235.
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bioflocs technology ponds. Aquaculture 264, 140-147.
Avnimelech Y dan Kochba M. 2009. Evaluation of nitrogen uptake and excretion by tilapia in bio floc tanks, using 15N tracing. Aquaculture 287, 163-168. Azim ME, Little DC, Bron IE. 2007. Microbial protein production in activated
suspension tanks manipulating C/N ratio in feed and implications for fish culture. Bioresource Technology 99, 3590-3599.
Azim ME, Little DC. 2008. The biofloc technology (BFT) in indoor tanks: water quality, biofloc composition, and growth and welfare of nile tilapia
(Oreochromis niloticus). Aquaculture 283, 29-35.
Bayne BL. 1998. The physiology of suspension feeding by bivalve moluscs: an introduction to the Plymouth “TROPHEE” workshop. Journal of Experimental Marine Biology and Ecology 219, 1-19.
Browdy CL, Bratford D, Stokes AD, McIntoch RP. 2001. Perspective on the application of closed shrimp culture systems. In: Browdy CL, Jory DE (Eds). The New Wave, Proceedings of the special session on sustainable shrimp farming. World aqua. Soc. Baton Rough. LA. Pp. 20-34.
Brune DE, Schwartz G, Eversole AG, Collier JA, Schwedler TE. 2003. Intensification of pond aquaculture and high rate photosyntetic systems. Aquaculture Engineering 28, 65-86.
Burford MA, Thompson PJ, Mclntosh RP, Bauman RH, Pearson DC. 2003. nutrient and microbial dynamics in high-intensity, zero-exchange shrimp ponds in Belize. Aquaculture 219, 393-411.
17 Crab R, Avnimelech Y, Defoirdt T, Bossier P, Verstraete W. 2007. Nitrogen removal techniques in aquaculture for a sustainable production. Aquaculture 270, 1-14.
Craig S, Helfrich LA. 2002. Understanding fish nutrition, feed, and feeding. Virginia Cooperative Extension, Virginia Polytechnic Institute and State University, Publication. 420-256.
De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W. 2008. The basic of bio-floc technology: the added value for aquaculture. Aquaculture 277, 125-137.
De Schryver P, Verstraete W. 2009. Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reaktors. Bioresource Technology 100, 1162-1167.
Ekasari J. 2008. Bioflocs technology: the effect of different carbon source, salinity and the addition of probiotics on the primary nutritional value of the bioflocs. Thesis. Faculty of Bioscience Engineering. Ghent University. Belgium.
Epp MA, Ziemann DA, Schell DM. 2002. Carbon and nitrogen dynamics in zero-water exchange shrimp culture as indicated by stable isotope tracers. Aquac. Res. 33, 839-846.
IAEA (International Atomin Energy Agency). 1990. Use of Nuclear Technique in Studies of Soil-Plant Relationships. Training Course Series No 2. Austria: IAEA.
Jorand F, Zartaria F, Thomas F, Block JC, Bottero JY, Villemin G, Urbain V, Manem J. 1995. Chemical and structural (2d) linkage between bacteria within activated-sludge floc. Water Res 29, 1639-1647.
Jorgensen CB. 1996. Bivalve filter feeding revisited. Marine Ecology Progress Series 142, 287-302.
18 Kautsky N. 2004. Aquaculture and environment integrated aquaculture. Course.
University Ghet. Belgium.
Kreeger DA, Newell RIE. 1990. Utilization of detritus and bacteria as food source by 2 bivalve suspension-feeders the oyster Crassostrea virginica and the mussel Geukensiademissa. Mar Ecol Prog Ser 58: 299-310.
Kuhn DD, Boardman GD, Craig SR, Flick Jr GJ, McLean E. 2008. Use of microbial flocs generated from tilapia effluent as a nutritional supplement for shrimp, Litopenaeus vannamei, in recirculating aquaculture systems- Journal of the World Aquaculture Society 39, 72-82.
Kuhn D , Boardman GD, Lawrence AL, Marsh L, Flick Jr GJ. 2009. Microbial floc meal as a replacement ingredient for fish meal and soybean protein in shrimp feed. Aquaculture 296, 51-57.
Murdjani. 2007. Penerapan best management practice (BMP) pada budidaya udang windu (Penaeus monodon Fabrivius) intensif. Departemen Kelautan Perikanan. Direktorat Jendral Perikanan Budidaya. Balai Besar Pengembangan Budidaya Air Payau. Jepara.
Prato E, Danieli A, Maffi M, Biandolino F. 2010. Lipid and fatty acid compositions of Mytilus galloprovincialis cultured in the Mar Grande of Taranto (Southern Italy): feeding strategies and trophic relationships. Zoological Studies 49, 211-219.
Preston NP, Smith DM, Kellaway DM, Bunn SE. 1996. The use of enriched 15N as an indicator of the assimilation of individual protein sources from compound diets for juvenile Penaeus monodon. Aquaculture 147, 249-259. Setyobudiandi I. 2004. Beberapa aspek biologi reproduksi kerang hijau perna
19
20 Lampiran 1. Total Amonia Nitrogen (TAN)
Total amonia nitrogen (TAN) dianalisa dengan metode phenate (APHA, 1989). Sebelum pengukuran TAN, terlebih dahulu larutan phenat dan chlorox dibuat. Larutan phenat dibuat dari fenol sebanyak 2 g dan NaOH sebanyak 0,5 g yang dilarutkan ke dalam akuades sebanyak 16 ml. Sedangkan chlorox dibuat dari chlorin sebanyak 4 ml yang dilarutkan ke dalam skuades sebanyak 16 ml, kemudian pHnya disesuaikan hingga kisaran 6,5-7 dengan cara HCl 1 N diteteskan ke dalam chlorin sedikit demi sedikit.
Setelah itu, pengukuran TAN pada sampel dilakukan dengan cara sampel sebanyak 10 ml di masukkan ke dalam gelas piala dan ditambahkan reagen MnSO4 sebanyak 1 tetes, chlorox sebanyak 0,5 ml, dan phenat 0,6 ml dan diamkan selama 15 menit. Selain sampel, larutan standar amoniak perlu dibuat. Larutan amoniak dibuat dengan cara NH4Cl ditimbang sebanyak 381,9 mg dan di oven selama 2 jam pada suhu 100˚C. Setelah itu NH4Cl tersebut di larutkan ke dalam akuades sebanyak 1000 ml. Selanjutnya dari larutan tersebut dibuat larutan standar dengan konsentrasi 0, 1, 2, 5, 10, dan 25 ppm. Masing-masing larutan pada konsentrasi tersebut diberi reagen MnSO4 sebanyak 1 tetes, chlorox sebanyak 0,5 ml, dan phenat 0,6 ml dan diamkan selama 15 menit. Setelah 15 menit sampel dan larutan standar diukur menggunakan spektofotometer dengan panjang gelombang 630 nm. Hasil pengukuran spektofotometer tersebut kemudian dihitung berdasarkan rumus di bawah ini:
Keterangan: Abs : nilai absorban
Lampiran 2. Total Padatan Tersuspensi (TSS)
Pengukuran total padatan tersuspensi (TSS) dilakukan dengan metode standar berdasarkan APHA (1989). Pertama kertas saring millipore (0,48 µm) dimasukkan ke dalam oven (100˚C) selama 4 jam, setelah itu didinginkan di
dalam desikator selama 15 menit dan ditimbang (X1). Sampel air sebanyak 50 ml dimasukkan ke dalam alat vaccum pump dan sampel disaring menggunakan kertas saring millipore. Setelah itu, kertas saring tersebut di masukkan ke dalam oven
ሺିଵሻ ൌ െ
െ ሺͳ
21
(100˚C) selama 4 jam, setelah itu didinginkan di dalam desikator selama 15 menit
dan ditimbang (X2). Nilai TSS kemudian dihitung berdasarkan rumus di bawah ini:
Lampiran 3. Perhitungan Jumlah Molase
Perhitungan jumlah molase mengacu pada Avnimelech (1999).
PEMANFAATAN BIOFLOK DENGAN UKURAN YANG
BERBEDA OLEH UDANG VANAME, IKAN NILA, DAN
KERANG HIJAU DENGAN ISOTOP
15N SEBAGAI PENANDA
DEASY ANGELA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
16 DAFTAR PUSTAKA
APHA (American Public Health Association). 1989. Standard Methods for Examination of Water and Wastewater, 14thed. APHA. Washington DC: APHA. AWWA (American Water Works Association), and WPCF (Water Pollution Control Federation).
Arapov J, Balic DE, Peharda M, Gladan ZN. 20101. Bivalve feeding-how and what they eat. Ribarstvo 68, 105-116.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture 176, 227-235.
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bioflocs technology ponds. Aquaculture 264, 140-147.
Avnimelech Y dan Kochba M. 2009. Evaluation of nitrogen uptake and excretion by tilapia in bio floc tanks, using 15N tracing. Aquaculture 287, 163-168. Azim ME, Little DC, Bron IE. 2007. Microbial protein production in activated
suspension tanks manipulating C/N ratio in feed and implications for fish culture. Bioresource Technology 99, 3590-3599.
Azim ME, Little DC. 2008. The biofloc technology (BFT) in indoor tanks: water quality, biofloc composition, and growth and welfare of nile tilapia
(Oreochromis niloticus). Aquaculture 283, 29-35.
Bayne BL. 1998. The physiology of suspension feeding by bivalve moluscs: an introduction to the Plymouth “TROPHEE” workshop. Journal of Experimental Marine Biology and Ecology 219, 1-19.
Browdy CL, Bratford D, Stokes AD, McIntoch RP. 2001. Perspective on the application of closed shrimp culture systems. In: Browdy CL, Jory DE (Eds). The New Wave, Proceedings of the special session on sustainable shrimp farming. World aqua. Soc. Baton Rough. LA. Pp. 20-34.
Brune DE, Schwartz G, Eversole AG, Collier JA, Schwedler TE. 2003. Intensification of pond aquaculture and high rate photosyntetic systems. Aquaculture Engineering 28, 65-86.
Burford MA, Thompson PJ, Mclntosh RP, Bauman RH, Pearson DC. 2003. nutrient and microbial dynamics in high-intensity, zero-exchange shrimp ponds in Belize. Aquaculture 219, 393-411.
17 Crab R, Avnimelech Y, Defoirdt T, Bossier P, Verstraete W. 2007. Nitrogen removal techniques in aquaculture for a sustainable production. Aquaculture 270, 1-14.
Craig S, Helfrich LA. 2002. Understanding fish nutrition, feed, and feeding. Virginia Cooperative Extension, Virginia Polytechnic Institute and State University, Publication. 420-256.
De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W. 2008. The basic of bio-floc technology: the added value for aquaculture. Aquaculture 277, 125-137.
De Schryver P, Verstraete W. 2009. Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reaktors. Bioresource Technology 100, 1162-1167.
Ekasari J. 2008. Bioflocs technology: the effect of different carbon source, salinity and the addition of probiotics on the primary nutritional value of the bioflocs. Thesis. Faculty of Bioscience Engineering. Ghent University. Belgium.
Epp MA, Ziemann DA, Schell DM. 2002. Carbon and nitrogen dynamics in zero-water exchange shrimp culture as indicated by stable isotope tracers. Aquac. Res. 33, 839-846.
IAEA (International Atomin Energy Agency). 1990. Use of Nuclear Technique in Studies of Soil-Plant Relationships. Training Course Series No 2. Austria: IAEA.
Jorand F, Zartaria F, Thomas F, Block JC, Bottero JY, Villemin G, Urbain V, Manem J. 1995. Chemical and structural (2d) linkage between bacteria within activated-sludge floc. Water Res 29, 1639-1647.
Jorgensen CB. 1996. Bivalve filter feeding revisited. Marine Ecology Progress Series 142, 287-302.
18 Kautsky N. 2004. Aquaculture and environment integrated aquaculture. Course.
University Ghet. Belgium.
Kreeger DA, Newell RIE. 1990. Utilization of detritus and bacteria as food source by 2 bivalve suspension-feeders the oyster Crassostrea virginica and the mussel Geukensiademissa. Mar Ecol Prog Ser 58: 299-310.
Kuhn DD, Boardman GD, Craig SR, Flick Jr GJ, McLean E. 2008. Use of microbial flocs generated from tilapia effluent as a nutritional supplement for shrimp, Litopenaeus vannamei, in recirculating aquaculture systems- Journal of the World Aquaculture Society 39, 72-82.
Kuhn D , Boardman GD, Lawrence AL, Marsh L, Flick Jr GJ. 2009. Microbial floc meal as a replacement ingredient for fish meal and soybean protein in shrimp feed. Aquaculture 296, 51-57.
Murdjani. 2007. Penerapan best management practice (BMP) pada budidaya udang windu (Penaeus monodon Fabrivius) intensif. Departemen Kelautan Perikanan. Direktorat Jendral Perikanan Budidaya. Balai Besar Pengembangan Budidaya Air Payau. Jepara.
Prato E, Danieli A, Maffi M, Biandolino F. 2010. Lipid and fatty acid compositions of Mytilus galloprovincialis cultured in the Mar Grande of Taranto (Southern Italy): feeding strategies and trophic relationships. Zoological Studies 49, 211-219.
Preston NP, Smith DM, Kellaway DM, Bunn SE. 1996. The use of enriched 15N as an indicator of the assimilation of individual protein sources from compound diets for juvenile Penaeus monodon. Aquaculture 147, 249-259. Setyobudiandi I. 2004. Beberapa aspek biologi reproduksi kerang hijau perna
19
20 Lampiran 1. Total Amonia Nitrogen (TAN)
Total amonia nitrogen (TAN) dianalisa dengan metode phenate (APHA, 1989). Sebelum pengukuran TAN, terlebih dahulu larutan phenat dan chlorox dibuat. Larutan phenat dibuat dari fenol sebanyak 2 g dan NaOH sebanyak 0,5 g yang dilarutkan ke dalam akuades sebanyak 16 ml. Sedangkan chlorox dibuat dari chlorin sebanyak 4 ml yang dilarutkan ke dalam skuades sebanyak 16 ml, kemudian pHnya disesuaikan hingga kisaran 6,5-7 dengan cara HCl 1 N diteteskan ke dalam chlorin sedikit demi sedikit.
Setelah itu, pengukuran TAN pada sampel dilakukan dengan cara sampel sebanyak 10 ml di masukkan ke dalam gelas piala dan ditambahkan reagen MnSO4 sebanyak 1 tetes, chlorox sebanyak 0,5 ml, dan phenat 0,6 ml dan diamkan selama 15 menit. Selain sampel, larutan standar amoniak perlu dibuat. Larutan amoniak dibuat dengan cara NH4Cl ditimbang sebanyak 381,9 mg dan di oven selama 2 jam pada suhu 100˚C. Setelah itu NH4Cl tersebut di larutkan ke dalam akuades sebanyak 1000 ml. Selanjutnya dari larutan tersebut dibuat larutan standar dengan konsentrasi 0, 1, 2, 5, 10, dan 25 ppm. Masing-masing larutan pada konsentrasi tersebut diberi reagen MnSO4 sebanyak 1 tetes, chlorox sebanyak 0,5 ml, dan phenat 0,6 ml dan diamkan selama 15 menit. Setelah 15 menit sampel dan larutan standar diukur menggunakan spektofotometer dengan panjang gelombang 630 nm. Hasil pengukuran spektofotometer tersebut kemudian dihitung berdasarkan rumus di bawah ini:
Keterangan: Abs : nilai absorban
Lampiran 2. Total Padatan Tersuspensi (TSS)
Pengukuran total padatan tersuspensi (TSS) dilakukan dengan metode standar berdasarkan APHA (1989). Pertama kertas saring millipore (0,48 µm) dimasukkan ke dalam oven (100˚C) selama 4 jam, setelah itu didinginkan di
dalam desikator selama 15 menit dan ditimbang (X1). Sampel air sebanyak 50 ml dimasukkan ke dalam alat vaccum pump dan sampel disaring menggunakan kertas saring millipore. Setelah itu, kertas saring tersebut di masukkan ke dalam oven
ሺିଵሻ ൌ െ
െ ሺͳ
21
(100˚C) selama 4 jam, setelah itu didinginkan di dalam desikator selama 15 menit
dan ditimbang (X2). Nilai TSS kemudian dihitung berdasarkan rumus di bawah ini:
Lampiran 3. Perhitungan Jumlah Molase
Perhitungan jumlah molase mengacu pada Avnimelech (1999).