PADA TANAMAN TOMAT
NI NENGAH PUTRI ADNYANI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
NI NENGAH PUTRI ADNYANI. Uji Serologi Tomato infectious chlorosis virus
(TICV) pada Tanaman Tomat. Dibimbing oleh GEDE SUASTIKA.
Penyebaran Tomato infectious chlorosis virus (TICV) yang terbatas pada jaringan floem ini menyebabkan TICV sangat sukar dipurifikasi untuk mendapatkan virus murni dalam jumlah yang memadai sebagai antigen. Mungkin karena alasan ini maka belum ada antiserum komersial yang tersedia untuk mendeteksi TICV sehingga sampai saat ini deteksi TICV dilakukan hanya melalui
reverse transcription-polymerase chain reaction (RT-PCR). Kemajuan teknologi di bidang biologi molekuler telah menyediakan metode untuk mengekspresikan suatu gen tertentu, dengan menyisipkannya dalam vektor ekspresi (plasmid) pada
Escherichia coli. Antiserum poliklonal disiapkan untuk selubung protein (coat protein) (TICV) yang diekspresikan dalam Eschericia coli yang dievaluasi berdasarkan reaksinya terhadap keberadaan partikel virus dalam jaringan tanaman tomat. Evaluasi berdasarkan kekhususan reaksi antiserum dan tingkat titer antiserum dengan menggunakan 3 macam uji serologi yang berbeda, yaitu
agarose gel precipitation test (AGPT), dot blot immunobinding assay (DIBA), dan indirect enzyme-linked immunosorbent assay (I-ELISA). Antiserum memberikan sinyal positif yang jelas pada semua uji serologi yang menggunakan cairan perasan tanaman tomat yang terinfeksi TICV, tetapi tidak ada sinyal positif yang terdapat dalam uji reaksi antiserum dan cairan perasan tanaman tomat sehat. Hal ini yang menunjukkan kekhususan dari antiserum tersebut. Antiserum yang digunakan mempunyai titer yang cukup memadai yaitu 1/4 pada AGPT, 1/200 pada DIBA, dan 1/500 pada I-ELISA sehingga potensial digunakan sebagai alat deteksi TICV.
Kata kunci : Tomato infectious chlorosis virus (TICV), antiserum TICV, agarose gel precipitation test, dot blot immunobinding assay, indirect-enzyme linked immunosorbent assay.
PADA TANAMAN TOMAT
NI NENGAH PUTRI ADNYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Tanaman Tomat
Nama Mahasiswa : Ni Nengah Putri Adnyani NIM : A34080013
Menyetujui, Dosen Pembimbing
Dr. Ir. Gede Suastika, MSc. NIP 19620607 198703 1 003
Mengetahui, Ketua Departemen
Dr. Ir. Abjad Asih Nawangsih, MSi. NIP 19650621 198910 2 001
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Klungkung kota Semarapura, Bali pada tanggal 22 Desember 1989 dari pasangan Bapak Drs. Ketut Suyastra, MPd. dan Ibu Ni Luh Komang Darwati. Penulis merupakan anak kedua dari 2 bersaudara.
PRAKATA
Puji dan syukur penulis panjatkan ke hadapan Ida Sang Hyang Widhi Waça yang telah melimpahkan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Uji Serologi Tomato infectious chlorosis virus (TICV) pada Tanaman Tomat. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman. Penelitian ini dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari Februari 2012 sampai bulan Juni 2012.
Penulis menyampaikan ucapan terima kasih dengan rasa tulus kepada Dr. Ir. Gede Suastika, MSc. selaku dosen pembimbing yang senantiasa memberikan bimbingan, masukan, dan saran-saran kepada penulis. Ir. Djoko Prijono, MAgrSc. selaku dosen penguji tamu yang telah memberikan arahan dan saran yang bermanfaat. Dr. Ir. Wayan Winasa, MSc. selaku dosen pembimbing akademik yang senantiasa memberikan motivasi. Ketut Suyastra, Ni Luh Komang Darwati, dan I Wayan Adi Mahardika atas dukungan semangat, perhatian, dan doa yang telah diberikan kepada penulis selama kuliah di IPB. Keluarga besar di Laboratorium Virologi Tumbuhan Fitrianingrum Kurniawati, MSi., Sdri. Tuti Susanti Legiastuti, Bapak Edi Supardi, Rizki Haerunisa, Titin Rahayuningsih, Yudia N., Lestari F., Hamdayanty, Dita M., Prio S., Arif M., kakak-kakak Pascasarjana (Aceu Wulandari, Bundo Rita, Ita, Miftah, Melinda, Dwi, Dama, Nurul, Laras, Rita, Vanty, Asni, Bunda Ifa dan karantina Nurul dan Riri). Teman-teman seperjuangan Proteksi Tanaman angkatan 45 yang tidak bisa saya sebutkan satu persatu, seluruh dosen, staf dan laboran di Departemen Proteksi Tanaman yang telah banyak membantu. Terima kasih juga untuk Keluarga Mahasiswa Hindu Dharma IPB angkatan 2008, teman-teman Griya Sandat, IP, dan Puje yang selalu memberi semangat.
Penulis sangat menyadari bahwa skripsi ini masih jauh dari kesempurnaan untuk itu penulis mengharapkan kritik dan saran yang bersifat membangun agar skripsi ini bermanfaat untuk ke depannya. Akhir kata penulis serahkan skripsi ini dengan penuh rasa syukur dan bangga.
Bogor, September 2012
DAFTAR ISI
Tomato infectious chlorosis virus (TICV) ... 4
DAFTAR TABEL
Halaman
1 Titer antiserum TICV pada pengujian serologi... 16
DAFTAR GAMBAR
Halaman 1 Tanaman tomat memperlihatkan gejala klorosis... 12 Bentuk partikel TICV... 4
3 Serangga vektor Trialeurodes vaporariorum... 5
4 Reaksi antiserum TICV pada AGPT... 13
5 Reaksi antiserum TICV pada DIBA... 14
6 Reaksi antiserum TICV pada I-ELISA... 15
PENDAHULUAN
Latar Belakang
Tomato infectious chlorosis virus (TICV) adalah salah satu virus yang menyebabkan penyakit pada tanaman tomat (Tsai et al. 2004).Virus pada tanaman tomat ini pertama kali ditemukan di California pada tahun 1993 (Duffus et al. 1996). Setelah itu, TICV dilaporkan telah menyebar ke wilayah penanaman tomat dunia terutama di berbagai negara di Asia maupun Eropa (Vaira et al. 2002; Tsai
et al. 2004; Dalmon et al. 2005). Di Indonesia, virus ini telah ditemukan di beberapa sentra produksi tomat seperti di Garut, Cianjur, Bogor, Magelang, dan Yogyakarta (Hartono dan Wijonarko 2007; Fitriasari 2010).
Infeksi TICV pada tanaman tomat mengakibatkan gejala klorosis yang sangat parah pada seluruh daun sehingga tanaman tampak kuning, penyakit yang ditimbulkan ini disebut klorosis atau kuning (Vaira et al. 2002; Gambar 1). Gejala khas dari penyakit ini adalah terjadinya klorosis pada bagian antara tulang daun (interveinal chlorosis), dan jika penyakit sudah lanjut beberapa bagian daun mengalami nekrosis dan menjadi rapuh. Buah tomat yang dihasilkan dari tanaman sakit berukuran jauh lebih kecil dari normal dan proses pemasakannya terganggu sehingga hasil panen sangat menurun (Tsai et al. 2004). TICV merupakan salah satu anggota dari genus Crinivirus, famili Closteroviridae (Wisler et al. 1996), yang dapat ditularkan melalui serangga vektor kutukebul Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) secara semipersisten (Duffus et al. 1994).
Salah satu ciri dari anggota Crinivirus yang ditularkan kutukebul adalah bahwa partikel virus hanya ditemukan pada jaringan floem sehingga konsentrasi partikel virus pada keseluruhan jaringan tanaman inang sangat rendah (Wisler et al. 1998). Rendahnya konsentrasi partikel virus ini (pada jaringan tanaman inang) mempunyai implikasi pada proses deteksinya terutama yang berbasis antiserum. Penyebarannya yang terbatas pada jaringan floem ini menyebabkan TICV sangat sukar dipurifikasi untuk mendapatkan virus murni dalam jumlah yang memadai sebagai antigen (Jacquemond et al. 2008). Mungkin karena alasan ini maka belum ada antiserum komersial yang tersedia untuk mendeteksi TICV (Suastika 2012 Agustus 19, komunikasi pribadi) sehingga sampai saat ini deteksi TICV dilakukan hanya melalui reverse transcription-polymerase chain reaction (RT-PCR) (Andriani 2011; Nurulita 2011).
Kemajuan teknologi di bidang biologi molekuler telah menyediakan metode untuk mengekspresikan suatu gen tertentu, dengan menyisipkannya dalam vektor ekspresi (plasmid) pada Escherichia coli (Abouzid et al. 2002; Cotillon et al.
2005). Kurniawati (2012) telah berhasil mengekspresikan gen protein mantel (coat protein/CP) dari TICV dalam E. coli. Protein ini juga telah berhasil dipurifikasi dari biakan sel bakteri dan mencukupi untuk digunakan sebagai antigen dalam immunisasi kelinci dalam rangka memproduksi antiserum.
Reaksi antiserum (yang telah diproduksi ini) terhadap TICV yang terdapat dalam jaringan tanaman tomat belum pernah dilakukan. Untuk mengetahui terjadinya reaksi serologi tersebut, berbagai metode serologi telah tersedia saat ini seperti agarose gel precipitation test (AGPT) (Noordam 1973), dot blot immunobinding assay (DIBA) (Kubota et al. 2011), dan indirect-enzyme linked immunosorbent assay (I-ELISA) (Nickel et al. 2004), sehingga penelitian ini bertujuan menguji reaksi antiserum TICV yang telah diproduksi pada penelitian sebelumnya dan mengukur titer antiserum tersebut melalui metode serologi.
Tujuan Penelitian
Manfaat Penelitian
TINJAUAN PUSTAKA
Tomato infectious chlorosis virus
Tomato infectious chlorosis virus (TICV) diklasifikasikan dalam famili
Closteroviridae yang terdiri dari 2 genus yaitu Closterovirus dan Crinivirus
(Martelli et al. 2002). TICV merupakan spesies dari genus Crinivirus. Partikel TICV memiliki panjang rata-rata 645 nm, modal length 850 nm, dan partikel terpanjang 1600 nm (Duffus et al. 1996; Liu et al. 2000). Pengamatan Wisler et al. (1996) terhadap siapan hasil purifikasi dari tanaman tomat sakit menemukan partikel virus yang berbentuk seperti benang (threadlike) memanjang (filamentous), lentur (flexuous), berukuran panjang 850 sampai 900 nm dan lebar 12 nm. Closterovirus ini terdapat pada sitoplasma jaringan floem tanaman terinfeksi (Duffus et al. 1996).
Gambar 2 Partikel TICV berbentuk seperti benang, memanjang (filamentous) dan lentur (flexuous) (Liu et al. 2000)
sangat menurunkan bahkan meniadakan nilai ekonomi tanaman yang terinfeksi (Duffus et al. 1996); Dalmon et al. 2008). TICV ditularkan dari satu tanaman ke tanaman lainnya oleh serangga vektor Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Penularan dapat terjadi secara cepat ke seluruh areal pertanaman karena serangga vektor bersifat aktif. TICV ditularkan oleh serangga vektor secara semipersisten (Duffus et al. 1994; Wintermantel 2004). TICV tidak dapat ditularkan secara mekanis tetapi dapat ditularkan dengan serangga vektor. Memiliki periode persistensi selama 4 hari dan periode makan akuisisi di atas 48 jam. TICV dapat ditularkan dengan waktu yang terbatas yaitu antara 1-9 hari. (Wisler et al. 1998a, 1998b).
Gambar 3 Serangga vektor Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) yang mampu menularkan TICV pada tanaman tomat (Kurniawati 2011)
Antibodi Poliklonal
hari setelah imunisasi dan setelah itu konsentrasi IgM akan menurun. Setelah konsentrasi IgM menurun, IgG akan diproduksi dan mencapai puncak pada 14 hari setelah imunisasi. Apabila injeksi dilakukan lagi maka IgG akan diproduksi lebih dominan sebagai tanggap imun sekunder (Akin 2006).
Setiap hewan berdarah panas dapat dijadikan sebagai hewan percobaan untuk produksi antibodi poliklonal. Contohnya kelinci, ayam, burung puyuh, tikus, kambing, babi, dan mencit paling banyak digunakan untuk membuat antiserum. Di antara hewan tersebut, kelinci merupakan hewab yang paling banyak digunakan karena mudah memeliharanya, relatif lebih murah, mempunyai konsentrasi antibodi yang relatif tinggi, dan memerlukan sedikit antigen untuk imunisasi (Akin 2006).
Uji Serologi Virus Tumbuhan
Reaksi antara antibodi dan antigen terjadi pada reaksi pertahanan hewan apabila kemasukan antigen (patogen atau benda asing). Reaksi khas itu dapat juga terjadi secara in vitro apabila antibodi yang diproduksi hewan itu diisolasi dan direaksikan dengan antigen yang mengimbasnya. Sifat khas reaksi antibodi dan antigen dimanfaatkan sebagai alat identifikasi patogen dan diagnosis penyakit virus pada tanaman. Secara umum, reaksi serologi dapat digambarkan sebagai berikut: antibodi + antigen presipitasi (Akin 2006)
Selain untuk mendeteksi dan mengidentifikasi virus penyebab penyakit, uji serologi juga berguna dalam mengukur konsentrasi virus dalam jaringan tumbuhan, mendeteksi virus tumbuhan dalam tubuh serangga vektor dan untuk mengetahui hubungan kekerabatan antar virus (Agrios 2005). Ada beberapa metode yang digunakan dalam uji serologi antara lain Agarose gel precipitation test (AGPT), Dot blot immunobinding assay (DIBA), Tissue blot immunosorbent assay (TBIA), Enzyme linked immunosorbent assay (ELISA), dan immunoblotting
presipitasi dengan memanfaatkan reaksi difusi antara antigen dan antibodi telah berhasil dilakukan oleh Mahmood et al. (1997) untuk mendeteksi Wheat streak mosaic tritimovirus (WSMV).
Agarose Gel Precipitation Test (AGPT)
AGPT merupakan teknik imunopresipitasi dan banyak dipakai untuk mengukur titer antigen atau antibodi. Walaupun uji ini kurang peka dibanding dengan uji pengikatan primer namun relatif mudah dilakukan. Pada uji ini digunakan selapis media agar yang dilubangi. Kemudian ke dalam sumur-sumur tersebut masing-masing diisi dengan antigen dan antiserum yang telah mengandung antibodi pereaksi. Antigen dan antibodi akan berdifusi ke sekitar sumur secara radial. Apabila antigen bereaksi dengan antibodi spesifik akan terbentuk kompleks antigen-antibodi yang banyak sehingga kompleks mengendap dan terjadi presipitasi yang membentuk garis putih. Tetapi bila tidak ada kesesuaian antara antigen dan antibodi, maka garis presipitasi tidak akan terbentuk (Haryadi 2006)
Perbandingan antigen dengan antibodi merupakan faktor penting dalam reaksi presipitasi. Pembentukan presipitasi terbentuk apabila antara konsentrasi antigen dengan antibodi tercapai keseimbangan. Kondisi antigen berlebihan akan mengakibatkan melarutnya kembali komplek yang terbentuk yang disebut
postzone effect, sedangkan antibodi berlebih mengakibatkan komplek antigen-antibodi tetap ada dalam larutan prozone effect (Haryadi 2006)
Dot Blot Immunobinding Assay (DIBA)
DIBA merupakan uji serologi menggunakan membran Nitropure nitrocellulose (NPN) yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan gerusan tanaman segar dan diblot pada kertas membran (Lin et al. 1990). Metode ini mempunyai tingkat sensitivitas yang tinggi, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Dijkstra and De Jager 1998).
kemudian sap tersebut diblot menggunakan pipet mikrotiter pada kertas membran (Somowiyarjo 1997). Dalam pengerjaannya, teknik DIBA sangat mudah dan cepat dalam mendeteksi virus selain itu sampel yang sudah diblot pada kertas membran dapat disimpan dalam jangka waktu yang panjang (Chang et al. 2010).
Enzyme Linked Immunosorbent Assay (ELISA)
ELISA telah banyak mengalami modifikasi sejak pertama kali teknik ini diperkenalkan. Ciri utama ELISA adalah digunakannya enzim (alkalin fosfatase atau peroksidase) untuk reaksi imunologi. Uji ini memiliki beberapa keunggulan seperti teknik pengerjaan yang relatif sederhana, ekonomis, dan memiliki sensitivitas yang cukup tinggi. ELISA diperkenalkan pada tahun 1971 oleh Peter Perlmann dan Eva Engvall untuk menganalisis adanya interaksi antigen dengan antibodi di dalam suatu sampel dengan menggunakan enzim sebagai pelapor. Menurut Dijkstra and De Jager (1998) beberapa keunggulan ELISA sebagai tes serologi untuk virus tumbuhan yaitu konsentrasi virus yang dideteksi dapat sangat rendah. Demikian juga antibodi yang digunakan bisa sangat sedikit. Metode ini dapat digunakan untuk mendeteksi sampel virus dalam skala besar, dan hasil deteksi ELISA dapat diukur secara kuantitatif.
Umumnya ELISA dibedakan menjadi 2 jenis yaitu standard (direct) double antibody sandwich (DAS)-ELISA dan indirect ELISA (I-ELISA). Metode DAS-ELISA diperkenalkan pertama kali oleh Clark dan Adams pada tahun 1977 untuk deteksi virus tumbuhan dan uji ini pertama kali dilakukan pada pelat 96 sumur berbahan polystyrene. Tahapan DAS-ELISA yaitu sumuran pelat dicoating
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan mulai bulan Februari 2012 sampai Juni 2012.
Bahan dan Alat
Metode Serologi yang Digunakan dalam Pengujian Antiserum TICV Pengujian serologi untuk antiserum TICV ini dilakukan menggunakan 3 metode yaitu AGPT, DIBA, dan I-ELISA. AGPT merupakan teknik imunopresipitasi dan banyak dipakai untuk mengukur titer antigen atau antibodi. Walaupun uji ini kurang peka dibanding dengan uji pengikatan primer namun relatif mudah dilakukan. Pada uji ini digunakan selapis media agar yang dilubangi. Kemudian ke dalam sumur-sumur tersebut masing-masing diisi dengan antigen dan antiserum yang telah mengandung antibodi pereaksi (Haryadi 2006). Metode ini menggunakan sampel daun tomat terinfeksi TICV yang digerus dengan bufer, antiserum TICV dengan titer 1/1 sampai 1/64 serta kaca preparat dan 1% gel agarosa (Sigma, USA) sebagai media untuk mendeteksi TICV.
DIBA merupakan uji serologi menggunakan membran nitroselulosa yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan gerusan tanaman segar dan diblot pada kertas membran (Lin et al.
1990). Metode ini mempunyai tingkat sensitivitas yang tinggi, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Djiksa and De Jager 1998). DIBA dilakukan pada kertas membran nitroselulosa (Sigma, USA) yang ukurannya dapat disesuaikan dengan jumlah sampel yang ada kemudian antiserum yang digunakan yaitu titer 1/100 sampai 1/1000, plastik gerus sebagai media untuk merendam kertas membran, skim milk, enzim konjugat, dan substrat untuk setiap tahapan.
seperti teknik pengerjaan yang relatif sederhana, ekonomis, dan memiliki sensitivitas yang cukup tinggi. Metode menggunakan bufer ekstraksi untuk menggerus sampel daun yang terinfeksi TICV, pelat mikrotiter ELISA sebagai media deteksi, titer antiserum yang digunakan 1/100 sampai 1/1000, skim milk, enzim konjugat, substrat, dan ELISA reader sebagai deteksi secara kuantitatif. Agarose Gel Precipitation Test (AGPT)
Reaksi antigen-antibodi pada AGPT dilakukan pada media 1% gel agarosa (Sigma, USA). Gel dibuat dengan melarutkan 0.1 g agarosa, 0.01 g natrium azida dalam 5 ml phosphate buffer saline (PBS) pH 7.2 dan 5 ml akuabides yang dipanaskan dalam microwave selama 1 menit. Agar cair tersebut kemudian dituangkan di atas kaca preparat setebal sekitar 2 mm dan dibiarkan pada suhu ruang sampai membeku. Pada agar beku tersebut dibuat 2 lubang berdiameter 4 mm dengan jarak 4 mm untuk diisi dengan reaktan yang berbeda yaitu antigen dan antibodi masing-masing sebanyak 20 µl. Antigen adalah cairan perasan tanaman tomat yang positif terserang TICV dan yang sehat masing-masing sebanyak 0.1 g yang telah dilumatkan dalam 1x PBS dengan perbandingan 1:10 (b/v). Antibodi berupa antiserum TICV yang telah tersedia di Laboratorium Virologi Tumbuhan IPB yaitu hasil immunisasi kelinci dengan protein produk ekspresi gen CP TICV pada E. coli (Kurniawati 2012). Untuk pengukuran titer antiserum, dilakukan reaksi antara antigen tanpa pengenceran (siapan cairan perasan tanaman tomat) dan antiserum dengan seri pengenceran dupleks mulai 1/1 sampai 1/64. Pengamatan terhadap terbentuknya garis presipitasi reaksi antigen-antibodi pada media agarosa diamati setiap hari dan didokumentasikan. Metode ini dilakukan berdasarkan prosedur dari Noordam (1973).
Dot Blot Immunobinding Assay (DIBA)
Reaksi antigen-antibodi pada DIBA berdasarkan prosedur Kubota et al.
diinkubasi dalam 1x bufer kalium phosphate salin tween (KPST) [0.02 M K2HPO4, 0.15 M NaCl, pH 7.4 yang di dalamnya mengandung 0.05% Tween 20]
selama 20 menit; (3) diinkubasi dalam antiserum + konjugat (1 ml KPS 1x ditambah dengan 0.4 g skim milk, 0.2 µl enzim konjugat (Goat anti rabbit-IgG alkaline phosphatase) dan antiserum TICV) selama 90 menit; (4) dicuci 3 kali masing-masing dalam 1x tris buffer saline tween dengan 0.05% Tween 20 (TBST) [Tris-HCl 0.02 M, NaCl 0.15 M, pH 7.5 dan Tween 20] selama 10, 5 dan 5 menit; dan (6) diinkubasi dalam substrat (20 µl nitro blue tetrazolium +
bromochloroindolil phosphate) (NBT+BCIP) (Sigma, USA) dilarutkan dalam 1 ml bufer alkalin fosfatase). Untuk pengukuran titer antiserum, dilakukan reaksi antara antigen tanpa pengenceran dan antiserum dengan seri pengenceran 1/100 ,1/200, 1/300, 1/400, 1/500, 1/600, sampai 1/1000. Pengamatan dilakukan terhadap adanya perubahan warna membran menjadi ungu pada tempat antigen diteteskan dimulai beberapa menit setelah inkubasi dalam substrat.
Indirect Enzyme-Linked Immunosorbent Assay (I-ELISA)
Reaksi antigen-antibodi pada ELISA menurut prosedur dari Nickel et al.
(2004) dilakukan dalam sumuran pelat mikrotiter ELISA. Antigen dan antibodi disiapkan sama seperti pada AGPT kecuali cairan perasan tanaman dibuat dalam bufer ekstraksi pH 9.6 [Na2CO5 1.59 g, NaHCO3 0.293 g, NaN3 0.20 g yang
dilarutkan dalam 1 L akuades steril] dengan perbandingan 1:100 (b/v). Pada sumuran pelat mikrotiter ELISA dimasukkan reaktan 100 µl yang dilakukan berturut-turut sebagai berikut: (1) inkubasi cairan perasan tanaman pada suhu 4oC semalam; (2) pencucian dengan 1 x PBST) [NaCl 8 g, Na2HPO4 1.15 g, KH2PO4
HASIL DAN PEMBAHASAN
Reaksi Antiserum terhadap TICV pada Jaringan Tanaman Tomat Reaksi antiserum TICV terhadap partikel virus yang terdapat di dalam jaringan tanaman tomat telah berhasil diamati melalui 3 metode uji serologi yaitu AGPT, DIBA, dan I-ELISA.
Melalui AGPT, terjadinya reaksi (pengenalan) antibodi (antiserum) terhadap antigen (partikel TICV dalam cairan perasan tanaman tomat) ditandai dengan terbentuknya garis presipitasi berwarna putih pada gel agarosa di antara lubang yang diberi cairan antiserum dan yang diberi cairan perasan tanaman (Gambar 4).
Gambar 4 Reaksi antiserum terhadap TICV dalam jaringan tanaman tomat pada
Agarose Gel Precipitation Test (AGPT). Kiri: reaksi antiserum dengan cairan perasan tanaman tomat terinfeksi TICV. Kanan: reaksi antiserum dengan cairan perasan tanaman tomat sehat.
Terbentuknya garis presipitasi ini membutuhkan waktu 2 hari setelah dimasukkannya antiserum dan cairan perasan tanaman dalam masing-masing lubang gel. Tampaknya difusi antibodi maupun antigen (partikel TICV) dalam gel agarosa berjalan lambat sampai kedua komponen tersebut bertemu dan saling berikatan membentuk kompleks antigen-antibodi (Ag-Ab). Kompleks Ag-Ab terjadi sedikit demi sedikit dan terakumulasi dalam jumlah yang memadai sampai dapat terlihat dengan mata telanjang (Nickel et al. 2004).
partikel virus) dan tidak mengenali protein lain seperti protein komponen tanaman misalnya. Dengan demikian, dapat dikatakan bahwa antiserum yang diproduksi dari antigen CP TICV dengan spesifik dapat bereaksi dengan partikel TICV.
Pada DIBA, perubahan warna membran menjadi ungu terjadi pada tempat cairan perasan tanaman terinfeksi TICV diteteskan, sedangkan pada tempat cairan perasan tanaman sehat diteteskan tidak terlihat adanya perubahan warna menjadi ungu (Gambar 5). Perubahan warna menjadi ungu terjadi karena perubahan substrat NBT+BCIP oleh enzim yang terdapat pada konjugat (Kubota et al. 2011). Konjugat tersebut telah berikatan pada antiserum TICV yang juga telah berikatan dengan partikel TICV yang terdapat pada membran (di tempat cairan perasan tanaman terinfeksi TICV diteteskan).
Gambar 5 Reaksi antiserum terhadap TICV dalam jaringan tanaman tomat. Pada
Dot Blot Immunobinding Assay (DIBA). Kiri: reaksi antiserum dengan cairan perasan tanaman tomat terinfeksi TICV. Kanan: reaksi antiserum dengan cairan perasan tanaman tomat sehat.
Pada I-ELISA, sinyal positif ditandai dengan terjadinya perubahan warna substrat menjadi kuning. Substrat p-nitrofenil fosfat yang awalnya bening karena adanya enzim alkalin fosfatase pada konjugat, maka sedikit demi sedikit berubah warna menjadi kuning (Nickel et al. 2004) dan dalam jangka waktu 30 menit, setelah mulai terjadinya reaksi enzimatik tersebut, intensitas warna kuning sudah cukup teramati dengan mata telanjang (Gambar 6).
Gambar 6 Reaksi antiserum terhadap TICV dalam jaringan tanaman tomat pada
Indirect-Enzyme Linked Immunosorbent Assay (I-ELISA). Duplo kiri: reaksi antiserum dengan cairan perasan tanaman tomat terinfeksi TICV. Duplo kanan: reaksi antiserum dengan cairan perasan tanaman tomat sehat.
Kecepatan perubahan dan intensitas warna kuning yang terjadi pada substrat sangat bergantung pada jumlah enzim (konjugat) yang berikatan dengan antiserum TICV, sedangkan jumlah antiserum yang ada bergantung pada jumlah partikel TICV yang terdapat pada cairan perasan tanaman tomat (menempel pada dinding sumuran pelat mikrotiter ELISA). Ketiadaan enzim (konjugat) menyebabkan substrat tetap bening seperti terlihat pada sumuran pelat mikrotiter ELISA yang diberi cairan perasan tanaman sehat, dan ini merupakan sinyal negatif atau menandakan tidak terdapatnya partikel TICV yang menempel pada dinding sumuran pelat mikrotiter (cairan perasan tanaman tomat) (Gambar 6).
Titer Antiserum TICV
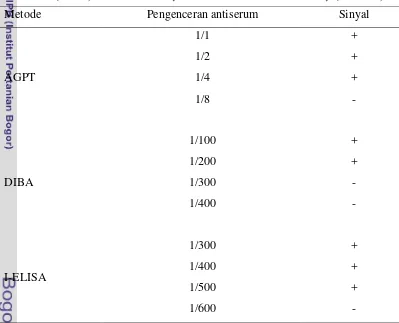
Titer antiserum adalah tingkat pengenceran tertinggi dari antiserum yang masih memberikan sinyal positif terhadap adanya kompleks Ag-Ab pada uji serologi tertentu (Noordam 1973). Oleh karena itu, titer suatu antiserum sangat ditentukan oleh kesensitifan metode serologi yang digunakan. Pada penelitian ini, untuk menentukan titer antiserum TICV digunakan 3 metode serologi yaitu AGPT, DIBA dan I-ELISA. Hasil titer antiserum TICV yang digunakan disajikan pada Tabel 1.
Tabel 1 Titer antiserum TICV pada pengujian serologi menggunakan metode
agarose gel precipitation test (AGPT), dot blot immunobinding assay
(DIBA) dan indirect-enzyme linked immunosorbent assay (I-ELISA)*
*Pengujian sejenis telah dilakukan 3-4 kali dan memberikan hasil yang konsisten.
Pada penelitian ini, antigen yang digunakan adalah partikel TICV pada tingkat konsentrasi sesuai dengan yang terdapat pada siapan cairan perasan tanaman terinfeksi TICV yang tidak diencerkan. Pereaksi antiserum terhadap antigen ini pada tingkat konsentrasi (pengenceran) yang berbeda diamati dengan
melihat intensitas sinyal yang terjadi. Seperti yang disajikan pada Tabel 1 terlihat bahwa titer antiserum berbeda untuk ketiga metode serologi yang digunakan: titer pada AGPT hanya 1/4, sedangkan pada DIBA adalah 1/200 dan I-ELISA mencapai 1/500.
Perbedaan titer antiserum pada ketiga metode ini terjadi karena beberapa hal. Pada AGPT, sinyal yang terlihat merupakan presipitasi molekul kompleks Ag-Ab yang terakumulasi. Untuk dapat teramati dengan mata telanjang diperlukan tingkat konsentrasi molekul kompleks Ag-Ab yang cukup tinggi, sedangkan tingkat akumulasi kompleks Ag-Ab tersebut ditentukan oleh jumlah antibodi yang terkandung dalam siapan antiserum. Pada pengujian ini, siapan antiserum dengan pengenceran 1/4 masih memberikan tingkat akumulasi kompleks Ag-Ab yang masih dapat teramati, namun pada pengenceran antiserum 1/8 sudah tidak terlihat walaupun mungkin akumulasi kompleks Ag-Ab masih terjadi.
Berbeda dengan AGPT, pada DIBA sinyal positif masih terjadi pada tingkat pengenceran antiserum yang jauh lebih tinggi yaitu 1/200. Tingkat sensitivitas DIBA yang jauh melebihi AGPT karena penggunaan substrat. Seperti sudah dijelaskan di atas bahwa akan terjadi perubahan warna membran menjadi ungu apabila substrat tersebut bertemu dengan enzim yang terdapat pada konjugat. Jadi dengan jumlah enzim yang tidak terlalu banyak akan menghasilkan perubahan warna yang signifikan (dapat disaksikan dengan mata telanjang) jauh melampaui batas yang diperlukan agar terlihatnya akumulasi kompleks Ag-Ab secara langsung (dalam bentuk garis presipitasi) pada AGPT. Dengan demikian, diperlukan jumlah molekul antibodi (antiserum TICV) sebagai cerminan jumlah konjugat yang terikat lebih sedikit agar sinyal positif terjadi. Atau dengan kata lain, pada pengenceran antiserum yang lebih tinggi (1/200) DIBA masih dapat memberikan sinyal positif.
yang tidak dapat diamati dengan mata telanjang masih dapat dikuantifikasi. Sinyal dikatakan positif apabila nilai absorbans(pada panjang gelombang 405 nm) sampel (cairan perasan tanaman terinfeksi TICV) mencapai 1.5 kali dari nilai absorbans kontrol negatif (cairan perasan tanaman sehat) (Dijkstra and De Jager 1998).
KESIMPULAN DAN SARAN
Kesimpulan
Antiserum hasil immunisasi kelinci dengan protein produk ekspresi gen CP TICV pada Escherichia coli (Kurniawati 2012), dapat secara spesifik bereaksi dengan partikel TICV yang terdapat pada jaringan tanaman tomat. Sinyal positif (adanya garis presipitasi pada AGPT, perubahan warna membran menjadi ungu pada DIBA dan perubahan warna substrat menjadi kuning pada ELISA) sangat jelas terlihat pada sampel tanaman terinfeksi TICV dan tidak terjadi pada sampel tanaman sehat. Antiserum ini mempunyai titer yang cukup memadai pada AGPT (1/4), DIBA (1/200) maupun I-ELISA (1/500) sehingga sangat potensial digunakan sebagai sarana deteksi TICV. I-ELISA merupakan metode yang terbaik dilihat dari sisi penggunaan antiserum TICV, pengenceran yang lebih tinggi pada I-ELISA (jumlah antiserum yang sedikit) masih mampu mendeteksi TICV yang terdapat pada cairan perasan tanaman tomat.
Saran
Perlu dilakukan penelitian lanjutan pendeteksian TICV pada sampel tanaman tomat dari berbagai daerah atau wilayah dengan antiserum yang sama sehingga semakin banyaknya data maka akan terlihat hasil yang lebih konsisten dan akurat dari antiserum tersebut.
DAFTAR PUSTAKA
Abouzid AM, Astua JF, Purcifull DE, Beckam KA, Crawford WE et al. 2002. Serological studies using polyclonal antisera prepared against the viral coat
protein of four Begomovirus expressed in Escherichia coli.Plant Dis.86(10): 1109-1114.
Agrios GN. 2005. Plant Pathology. Ed. ke-5. New York (US): Academic Press. Akin MH. 2006. Virologi Tumbuhan. Yogyakarta (ID): Penerbit Kanisisus
(Anggota IKAPI).
Andriani A. 2011. Deteksi diferensial Tomato chlorosis virus (ToCV) dan
Tomato infectious chlorosis virus (TICV) dengan reverse transcription-polymerase chain reaction (RT-PCR) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Chang PS, Mclaughlin WA, Tolin SA. 2010. Tissue blot immunoassay and direct RT-PCR of cucumoviruses and potyviruses from the same Nitro Pure nitrocellulose membrane. Journal of Virological Methods. 11(7): 345-351. Cotillon AC, Desbiez C, Bouyer S, Scheibel CW, Gros C, Delecolle B, Lecoq H.
2005. Production of a polyclonal antiserum against the coat protein of Cucurbit yellow stunting disorder crinivirus expressed in Escherichia coli. EPPO Bull.3(5): 99-103.
Dalmon A, Bouyer S, Cailly M, Girard M, Lecoq H, Desbiez C, and Jacquemond M. 2005. First report of Tomato chlorosis virus and Tomato infectious chlorosis virus in France. Plant Dis. 89 (11): 1243.
Dalmon A, Fabre F, Guilbaud L, Lecoq H, Jacquemond M. 2008. Comparative whitefly transmission of Tomato chlorosis virus and Tomato infectious chlorosis virus from single or mixed infections. Plant Pathology.58(2) : 221-227.
Dijkstra J, de Jager CP. 1998. Pratical Plant Virology. Protocol and Exercises. New York (US): Springer-Verlag Berlin Heidelberg.
Duffus JE, Liu HY, Wisler GC. 1994. A new Closterovirus of tomato in Southern California transmitted by the greenhouse whitefly (Trialeurodes vaporariorum). Phytopathology. 84(10): 1072-1073.
Duffus JE, Liu HY, Wisler GC. 1996. Tomato infectious chlorosis virus-a new closterolike transmitted by Trialeurodes vaporariorum. Eur J Plant Pathol.
10(2): 219-226.
Fitriasari ED. 2010. Keefektifan kutu kebul dalam menularkan virus penyebab penyakit kuning pada tanaman tomat [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Hartono S, Wijonarko A. 2007. Karakterisasi biologi molekuler Tomato infectious chlorosis virus penyebab penyakit kuning pada tanaman tomat di Indonesia. J Akta Agros. 2: 139-146.
Haryadi D. 2006. Produksi antibodi poliklonal Geminivirus, penyebab penyakit daun keriting kuning cabai, dan kajian serologinya [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Jacquemond M, Verdin E, Dalmon A, Guilbaud L, Gognalons P. 2008. Serological and molecular detection of Tomato chlorosis virus and Tomato infectious chlorosis virus in tomato. Plant Pathol.58(2): 210-220.
Kubota K, Usugi T, Tsuda S. 2011. Production of antiserum and immunodetection of Cucurbit chlorotic yellows virus, a novel whitefly-transmitted Crinivirus. J Gen Plant Pathol. 77(2): 116-120.
Kurniawati F. 2012. Ekspresi gen coat protein Tomato infectious chlorosis virus
pada Escherichia coli untuk antigen dalam produksi antiserum [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Lin NS, Hsu YH, Hsu HT. 1990. Immunological detection of plant viruses and a mycoplasma-like organism by direct tissue blotting on nitrocellulose membranes. Phytophatology. 80(9): 824-828.
Liu HY, Wisler GC, Duffus JE. 2000. Particle lengths of whitefly-transmitted
Criniviruses. Plant Dis. 84(7): 803-805.
Mahmood T, Hein GL, French RC. 1997. Development of serological procedures for rapid and reliable detection of Wheat streak mosaic virus in a single wheat curl mite. Plant Dis. 81(3): 250-253.
Martelli GP, Agranovsky AA, Bar-Joseph M. 2002. The family Closteroviridae
revised. Archives of Virol. 147(10): 2039-2044.
Nickel O, Targon MLPN, Fajardo TVM, Machado MA, Trivillin Ap. 2004. Polyclonal antibodies to the coat protein of Apple stem grooving virus expressed in Escherichia coli: production and use in immunodiagnosis. Fitopatol Bras. 29(5): 558-562. Noordam D. 1973. Identification of Plant Viruses Methods and Experiments.
Wageningen (NL): Center for Agricultural Publishing and Documentation. Nurulita S. 2011. Identifikasi Tomato infectious chlorosis virus (TICV) dan
Tomato chlorosis virus (ToCV) melalui reverse transcription-polymerase chain reaction (RT-PCR) dan sikuen nukleotida [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Somowiyarjo S, Sako N, Nonaka F. 1989. Dot-immunobinding assay for
Zucchini yellow mosaic virus using polyclonal and monoclonal antibodies.
Ann Phytopathol Soc. 55(1): 56-63.
Somowiyarjo S, Sumardiyono YB, Suharno. 1997. Pemanfaatan membrane nitroselulosa untuk pengiriman antigen uji dalam deteksi TMV dengan DIBA. J perlind Tan Indo. 1: 1-5.
Tsai WS, Shih SL, Green SK, Hanson P, Liu HY. 2004. First report of the occurrence of Tomato chlorosis virus and Tomato infectious chlorosis virus
Vaira AM, Accotto GP, Vecchiati M, Bracaloni M. 2002. Tomato infectious chlorosis virus causes leaf yellowing and reddening of tomato in Italy. Phytoparasitica. 30: 290-294.
Wintermantel WM. 2004. Progress on management and control of Criniviruses
in Tomato. Salinas (AS): CTC Report. hlm 1-3.
Wisler GC, Duffus JE, Liu HY, Li RH. 1998a. Ecology and epidemiology of whitefly-transmitted Closteroviruses. Plant Dis. 82(3): 270-280.
Wisler GC, Li RH, Liu HY, Lowry DS, Duffus JE. 1998b. Tomato chlorosis virus: a new whitefly-transmitted, phloem-limited, bipartite closterovirus of tomato. Phytopathology. 88(5): 402-409.
Lampiran 1 Hasil nilai absorbans I-ELISA pada ELISA reader (BIO-RAD Model 550) dengan panjang gelombang 405 nm a
Waktu Sampel Pengenceran Antiserum TICV
1/100 1/200 1/300 1/400 1/500 1/600 1/1000
0,302>0,288 0,201<0,233 0,189<0,216 0,190<0,219 0,160<0,197 0,165<0,215 0,203<0,248 Positif Negatif Negatif Negatif Negatif Negatif Negatif
0,483>0,419 0,298<0,306 0,273>0,270 0,274>0,269 0,214<0,225 0,222<0,263 0,296<0,320 Positif Negatif Positif Positif Negatif Negatif Negatif
45 menit
Bufer ekstraksi 0,383 0,276 0,213 0,219 0,195 0,187 0,196
Tanaman sehat 0,656 0,408 0,332 0,325 0,245 0,319 0,274
Antigen TICV 1,219 0,671 0,599 0,608 0,430 0,458 0,395
1,219>0,984 0,671>0,612 0,599>0,498 0,608>0,488 0,430>0,368 0,458<0,479 0,395<0,411 Positif Positif Positif Positif Positif Negatif Negatif
60 menit
Bufer ekstraksi 0,445 0,321 0,246 0,253 0,225 0,216 0,250
Tanaman sehat 0,771 0,478 0,390 0,384 0,288 0,375 0,355
Antigen TICV 1,446 0,791 0,706 0,720 0,508 0,541 0,444
1,446>1,157 0,791>0,717 0,706>0,585 0,720>0,576 0,508>0,432 0,541<0,563 0,444<0,533
Positif Positif Positif Positif Positif Negatif Negatif
a
Hasil ELISA dinyatakan positif jika rata-rata NAE antigen TICV lebih besar atau sama dengan 1.5 kali dari rata-rata NAE tanaman tomat sehat
NI NENGAH PUTRI ADNYANI. Uji Serologi Tomato infectious chlorosis virus
(TICV) pada Tanaman Tomat. Dibimbing oleh GEDE SUASTIKA.
Penyebaran Tomato infectious chlorosis virus (TICV) yang terbatas pada jaringan floem ini menyebabkan TICV sangat sukar dipurifikasi untuk mendapatkan virus murni dalam jumlah yang memadai sebagai antigen. Mungkin karena alasan ini maka belum ada antiserum komersial yang tersedia untuk mendeteksi TICV sehingga sampai saat ini deteksi TICV dilakukan hanya melalui
reverse transcription-polymerase chain reaction (RT-PCR). Kemajuan teknologi di bidang biologi molekuler telah menyediakan metode untuk mengekspresikan suatu gen tertentu, dengan menyisipkannya dalam vektor ekspresi (plasmid) pada
Escherichia coli. Antiserum poliklonal disiapkan untuk selubung protein (coat protein) (TICV) yang diekspresikan dalam Eschericia coli yang dievaluasi berdasarkan reaksinya terhadap keberadaan partikel virus dalam jaringan tanaman tomat. Evaluasi berdasarkan kekhususan reaksi antiserum dan tingkat titer antiserum dengan menggunakan 3 macam uji serologi yang berbeda, yaitu
agarose gel precipitation test (AGPT), dot blot immunobinding assay (DIBA), dan indirect enzyme-linked immunosorbent assay (I-ELISA). Antiserum memberikan sinyal positif yang jelas pada semua uji serologi yang menggunakan cairan perasan tanaman tomat yang terinfeksi TICV, tetapi tidak ada sinyal positif yang terdapat dalam uji reaksi antiserum dan cairan perasan tanaman tomat sehat. Hal ini yang menunjukkan kekhususan dari antiserum tersebut. Antiserum yang digunakan mempunyai titer yang cukup memadai yaitu 1/4 pada AGPT, 1/200 pada DIBA, dan 1/500 pada I-ELISA sehingga potensial digunakan sebagai alat deteksi TICV.
Kata kunci : Tomato infectious chlorosis virus (TICV), antiserum TICV, agarose gel precipitation test, dot blot immunobinding assay, indirect-enzyme linked immunosorbent assay.
PENDAHULUAN
Latar Belakang
Tomato infectious chlorosis virus (TICV) adalah salah satu virus yang menyebabkan penyakit pada tanaman tomat (Tsai et al. 2004).Virus pada tanaman tomat ini pertama kali ditemukan di California pada tahun 1993 (Duffus et al. 1996). Setelah itu, TICV dilaporkan telah menyebar ke wilayah penanaman tomat dunia terutama di berbagai negara di Asia maupun Eropa (Vaira et al. 2002; Tsai
et al. 2004; Dalmon et al. 2005). Di Indonesia, virus ini telah ditemukan di beberapa sentra produksi tomat seperti di Garut, Cianjur, Bogor, Magelang, dan Yogyakarta (Hartono dan Wijonarko 2007; Fitriasari 2010).
Infeksi TICV pada tanaman tomat mengakibatkan gejala klorosis yang sangat parah pada seluruh daun sehingga tanaman tampak kuning, penyakit yang ditimbulkan ini disebut klorosis atau kuning (Vaira et al. 2002; Gambar 1). Gejala khas dari penyakit ini adalah terjadinya klorosis pada bagian antara tulang daun (interveinal chlorosis), dan jika penyakit sudah lanjut beberapa bagian daun mengalami nekrosis dan menjadi rapuh. Buah tomat yang dihasilkan dari tanaman sakit berukuran jauh lebih kecil dari normal dan proses pemasakannya terganggu sehingga hasil panen sangat menurun (Tsai et al. 2004). TICV merupakan salah satu anggota dari genus Crinivirus, famili Closteroviridae (Wisler et al. 1996), yang dapat ditularkan melalui serangga vektor kutukebul Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) secara semipersisten (Duffus et al. 1994).
Salah satu ciri dari anggota Crinivirus yang ditularkan kutukebul adalah bahwa partikel virus hanya ditemukan pada jaringan floem sehingga konsentrasi partikel virus pada keseluruhan jaringan tanaman inang sangat rendah (Wisler et al. 1998). Rendahnya konsentrasi partikel virus ini (pada jaringan tanaman inang) mempunyai implikasi pada proses deteksinya terutama yang berbasis antiserum. Penyebarannya yang terbatas pada jaringan floem ini menyebabkan TICV sangat sukar dipurifikasi untuk mendapatkan virus murni dalam jumlah yang memadai sebagai antigen (Jacquemond et al. 2008). Mungkin karena alasan ini maka belum ada antiserum komersial yang tersedia untuk mendeteksi TICV (Suastika 2012 Agustus 19, komunikasi pribadi) sehingga sampai saat ini deteksi TICV dilakukan hanya melalui reverse transcription-polymerase chain reaction (RT-PCR) (Andriani 2011; Nurulita 2011).
Kemajuan teknologi di bidang biologi molekuler telah menyediakan metode untuk mengekspresikan suatu gen tertentu, dengan menyisipkannya dalam vektor ekspresi (plasmid) pada Escherichia coli (Abouzid et al. 2002; Cotillon et al.
2005). Kurniawati (2012) telah berhasil mengekspresikan gen protein mantel (coat protein/CP) dari TICV dalam E. coli. Protein ini juga telah berhasil dipurifikasi dari biakan sel bakteri dan mencukupi untuk digunakan sebagai antigen dalam immunisasi kelinci dalam rangka memproduksi antiserum.
Reaksi antiserum (yang telah diproduksi ini) terhadap TICV yang terdapat dalam jaringan tanaman tomat belum pernah dilakukan. Untuk mengetahui terjadinya reaksi serologi tersebut, berbagai metode serologi telah tersedia saat ini seperti agarose gel precipitation test (AGPT) (Noordam 1973), dot blot immunobinding assay (DIBA) (Kubota et al. 2011), dan indirect-enzyme linked immunosorbent assay (I-ELISA) (Nickel et al. 2004), sehingga penelitian ini bertujuan menguji reaksi antiserum TICV yang telah diproduksi pada penelitian sebelumnya dan mengukur titer antiserum tersebut melalui metode serologi.
Tujuan Penelitian
Manfaat Penelitian
TINJAUAN PUSTAKA
Tomato infectious chlorosis virus
Tomato infectious chlorosis virus (TICV) diklasifikasikan dalam famili
Closteroviridae yang terdiri dari 2 genus yaitu Closterovirus dan Crinivirus
(Martelli et al. 2002). TICV merupakan spesies dari genus Crinivirus. Partikel TICV memiliki panjang rata-rata 645 nm, modal length 850 nm, dan partikel terpanjang 1600 nm (Duffus et al. 1996; Liu et al. 2000). Pengamatan Wisler et al. (1996) terhadap siapan hasil purifikasi dari tanaman tomat sakit menemukan partikel virus yang berbentuk seperti benang (threadlike) memanjang (filamentous), lentur (flexuous), berukuran panjang 850 sampai 900 nm dan lebar 12 nm. Closterovirus ini terdapat pada sitoplasma jaringan floem tanaman terinfeksi (Duffus et al. 1996).
Gambar 2 Partikel TICV berbentuk seperti benang, memanjang (filamentous) dan lentur (flexuous) (Liu et al. 2000)
sangat menurunkan bahkan meniadakan nilai ekonomi tanaman yang terinfeksi (Duffus et al. 1996); Dalmon et al. 2008). TICV ditularkan dari satu tanaman ke tanaman lainnya oleh serangga vektor Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Penularan dapat terjadi secara cepat ke seluruh areal pertanaman karena serangga vektor bersifat aktif. TICV ditularkan oleh serangga vektor secara semipersisten (Duffus et al. 1994; Wintermantel 2004). TICV tidak dapat ditularkan secara mekanis tetapi dapat ditularkan dengan serangga vektor. Memiliki periode persistensi selama 4 hari dan periode makan akuisisi di atas 48 jam. TICV dapat ditularkan dengan waktu yang terbatas yaitu antara 1-9 hari. (Wisler et al. 1998a, 1998b).
Gambar 3 Serangga vektor Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) yang mampu menularkan TICV pada tanaman tomat (Kurniawati 2011)
Antibodi Poliklonal
hari setelah imunisasi dan setelah itu konsentrasi IgM akan menurun. Setelah konsentrasi IgM menurun, IgG akan diproduksi dan mencapai puncak pada 14 hari setelah imunisasi. Apabila injeksi dilakukan lagi maka IgG akan diproduksi lebih dominan sebagai tanggap imun sekunder (Akin 2006).
Setiap hewan berdarah panas dapat dijadikan sebagai hewan percobaan untuk produksi antibodi poliklonal. Contohnya kelinci, ayam, burung puyuh, tikus, kambing, babi, dan mencit paling banyak digunakan untuk membuat antiserum. Di antara hewan tersebut, kelinci merupakan hewab yang paling banyak digunakan karena mudah memeliharanya, relatif lebih murah, mempunyai konsentrasi antibodi yang relatif tinggi, dan memerlukan sedikit antigen untuk imunisasi (Akin 2006).
Uji Serologi Virus Tumbuhan
Reaksi antara antibodi dan antigen terjadi pada reaksi pertahanan hewan apabila kemasukan antigen (patogen atau benda asing). Reaksi khas itu dapat juga terjadi secara in vitro apabila antibodi yang diproduksi hewan itu diisolasi dan direaksikan dengan antigen yang mengimbasnya. Sifat khas reaksi antibodi dan antigen dimanfaatkan sebagai alat identifikasi patogen dan diagnosis penyakit virus pada tanaman. Secara umum, reaksi serologi dapat digambarkan sebagai berikut: antibodi + antigen presipitasi (Akin 2006)
Selain untuk mendeteksi dan mengidentifikasi virus penyebab penyakit, uji serologi juga berguna dalam mengukur konsentrasi virus dalam jaringan tumbuhan, mendeteksi virus tumbuhan dalam tubuh serangga vektor dan untuk mengetahui hubungan kekerabatan antar virus (Agrios 2005). Ada beberapa metode yang digunakan dalam uji serologi antara lain Agarose gel precipitation test (AGPT), Dot blot immunobinding assay (DIBA), Tissue blot immunosorbent assay (TBIA), Enzyme linked immunosorbent assay (ELISA), dan immunoblotting
presipitasi dengan memanfaatkan reaksi difusi antara antigen dan antibodi telah berhasil dilakukan oleh Mahmood et al. (1997) untuk mendeteksi Wheat streak mosaic tritimovirus (WSMV).
Agarose Gel Precipitation Test (AGPT)
AGPT merupakan teknik imunopresipitasi dan banyak dipakai untuk mengukur titer antigen atau antibodi. Walaupun uji ini kurang peka dibanding dengan uji pengikatan primer namun relatif mudah dilakukan. Pada uji ini digunakan selapis media agar yang dilubangi. Kemudian ke dalam sumur-sumur tersebut masing-masing diisi dengan antigen dan antiserum yang telah mengandung antibodi pereaksi. Antigen dan antibodi akan berdifusi ke sekitar sumur secara radial. Apabila antigen bereaksi dengan antibodi spesifik akan terbentuk kompleks antigen-antibodi yang banyak sehingga kompleks mengendap dan terjadi presipitasi yang membentuk garis putih. Tetapi bila tidak ada kesesuaian antara antigen dan antibodi, maka garis presipitasi tidak akan terbentuk (Haryadi 2006)
Perbandingan antigen dengan antibodi merupakan faktor penting dalam reaksi presipitasi. Pembentukan presipitasi terbentuk apabila antara konsentrasi antigen dengan antibodi tercapai keseimbangan. Kondisi antigen berlebihan akan mengakibatkan melarutnya kembali komplek yang terbentuk yang disebut
postzone effect, sedangkan antibodi berlebih mengakibatkan komplek antigen-antibodi tetap ada dalam larutan prozone effect (Haryadi 2006)
Dot Blot Immunobinding Assay (DIBA)
DIBA merupakan uji serologi menggunakan membran Nitropure nitrocellulose (NPN) yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan gerusan tanaman segar dan diblot pada kertas membran (Lin et al. 1990). Metode ini mempunyai tingkat sensitivitas yang tinggi, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Dijkstra and De Jager 1998).
kemudian sap tersebut diblot menggunakan pipet mikrotiter pada kertas membran (Somowiyarjo 1997). Dalam pengerjaannya, teknik DIBA sangat mudah dan cepat dalam mendeteksi virus selain itu sampel yang sudah diblot pada kertas membran dapat disimpan dalam jangka waktu yang panjang (Chang et al. 2010).
Enzyme Linked Immunosorbent Assay (ELISA)
ELISA telah banyak mengalami modifikasi sejak pertama kali teknik ini diperkenalkan. Ciri utama ELISA adalah digunakannya enzim (alkalin fosfatase atau peroksidase) untuk reaksi imunologi. Uji ini memiliki beberapa keunggulan seperti teknik pengerjaan yang relatif sederhana, ekonomis, dan memiliki sensitivitas yang cukup tinggi. ELISA diperkenalkan pada tahun 1971 oleh Peter Perlmann dan Eva Engvall untuk menganalisis adanya interaksi antigen dengan antibodi di dalam suatu sampel dengan menggunakan enzim sebagai pelapor. Menurut Dijkstra and De Jager (1998) beberapa keunggulan ELISA sebagai tes serologi untuk virus tumbuhan yaitu konsentrasi virus yang dideteksi dapat sangat rendah. Demikian juga antibodi yang digunakan bisa sangat sedikit. Metode ini dapat digunakan untuk mendeteksi sampel virus dalam skala besar, dan hasil deteksi ELISA dapat diukur secara kuantitatif.
Umumnya ELISA dibedakan menjadi 2 jenis yaitu standard (direct) double antibody sandwich (DAS)-ELISA dan indirect ELISA (I-ELISA). Metode DAS-ELISA diperkenalkan pertama kali oleh Clark dan Adams pada tahun 1977 untuk deteksi virus tumbuhan dan uji ini pertama kali dilakukan pada pelat 96 sumur berbahan polystyrene. Tahapan DAS-ELISA yaitu sumuran pelat dicoating
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan mulai bulan Februari 2012 sampai Juni 2012.
Bahan dan Alat
Metode Serologi yang Digunakan dalam Pengujian Antiserum TICV Pengujian serologi untuk antiserum TICV ini dilakukan menggunakan 3 metode yaitu AGPT, DIBA, dan I-ELISA. AGPT merupakan teknik imunopresipitasi dan banyak dipakai untuk mengukur titer antigen atau antibodi. Walaupun uji ini kurang peka dibanding dengan uji pengikatan primer namun relatif mudah dilakukan. Pada uji ini digunakan selapis media agar yang dilubangi. Kemudian ke dalam sumur-sumur tersebut masing-masing diisi dengan antigen dan antiserum yang telah mengandung antibodi pereaksi (Haryadi 2006). Metode ini menggunakan sampel daun tomat terinfeksi TICV yang digerus dengan bufer, antiserum TICV dengan titer 1/1 sampai 1/64 serta kaca preparat dan 1% gel agarosa (Sigma, USA) sebagai media untuk mendeteksi TICV.
DIBA merupakan uji serologi menggunakan membran nitroselulosa yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan gerusan tanaman segar dan diblot pada kertas membran (Lin et al.
1990). Metode ini mempunyai tingkat sensitivitas yang tinggi, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Djiksa and De Jager 1998). DIBA dilakukan pada kertas membran nitroselulosa (Sigma, USA) yang ukurannya dapat disesuaikan dengan jumlah sampel yang ada kemudian antiserum yang digunakan yaitu titer 1/100 sampai 1/1000, plastik gerus sebagai media untuk merendam kertas membran, skim milk, enzim konjugat, dan substrat untuk setiap tahapan.
seperti teknik pengerjaan yang relatif sederhana, ekonomis, dan memiliki sensitivitas yang cukup tinggi. Metode menggunakan bufer ekstraksi untuk menggerus sampel daun yang terinfeksi TICV, pelat mikrotiter ELISA sebagai media deteksi, titer antiserum yang digunakan 1/100 sampai 1/1000, skim milk, enzim konjugat, substrat, dan ELISA reader sebagai deteksi secara kuantitatif. Agarose Gel Precipitation Test (AGPT)
Reaksi antigen-antibodi pada AGPT dilakukan pada media 1% gel agarosa (Sigma, USA). Gel dibuat dengan melarutkan 0.1 g agarosa, 0.01 g natrium azida dalam 5 ml phosphate buffer saline (PBS) pH 7.2 dan 5 ml akuabides yang dipanaskan dalam microwave selama 1 menit. Agar cair tersebut kemudian dituangkan di atas kaca preparat setebal sekitar 2 mm dan dibiarkan pada suhu ruang sampai membeku. Pada agar beku tersebut dibuat 2 lubang berdiameter 4 mm dengan jarak 4 mm untuk diisi dengan reaktan yang berbeda yaitu antigen dan antibodi masing-masing sebanyak 20 µl. Antigen adalah cairan perasan tanaman tomat yang positif terserang TICV dan yang sehat masing-masing sebanyak 0.1 g yang telah dilumatkan dalam 1x PBS dengan perbandingan 1:10 (b/v). Antibodi berupa antiserum TICV yang telah tersedia di Laboratorium Virologi Tumbuhan IPB yaitu hasil immunisasi kelinci dengan protein produk ekspresi gen CP TICV pada E. coli (Kurniawati 2012). Untuk pengukuran titer antiserum, dilakukan reaksi antara antigen tanpa pengenceran (siapan cairan perasan tanaman tomat) dan antiserum dengan seri pengenceran dupleks mulai 1/1 sampai 1/64. Pengamatan terhadap terbentuknya garis presipitasi reaksi antigen-antibodi pada media agarosa diamati setiap hari dan didokumentasikan. Metode ini dilakukan berdasarkan prosedur dari Noordam (1973).
Dot Blot Immunobinding Assay (DIBA)
Reaksi antigen-antibodi pada DIBA berdasarkan prosedur Kubota et al.
diinkubasi dalam 1x bufer kalium phosphate salin tween (KPST) [0.02 M K2HPO4, 0.15 M NaCl, pH 7.4 yang di dalamnya mengandung 0.05% Tween 20]
selama 20 menit; (3) diinkubasi dalam antiserum + konjugat (1 ml KPS 1x ditambah dengan 0.4 g skim milk, 0.2 µl enzim konjugat (Goat anti rabbit-IgG alkaline phosphatase) dan antiserum TICV) selama 90 menit; (4) dicuci 3 kali masing-masing dalam 1x tris buffer saline tween dengan 0.05% Tween 20 (TBST) [Tris-HCl 0.02 M, NaCl 0.15 M, pH 7.5 dan Tween 20] selama 10, 5 dan 5 menit; dan (6) diinkubasi dalam substrat (20 µl nitro blue tetrazolium +
bromochloroindolil phosphate) (NBT+BCIP) (Sigma, USA) dilarutkan dalam 1 ml bufer alkalin fosfatase). Untuk pengukuran titer antiserum, dilakukan reaksi antara antigen tanpa pengenceran dan antiserum dengan seri pengenceran 1/100 ,1/200, 1/300, 1/400, 1/500, 1/600, sampai 1/1000. Pengamatan dilakukan terhadap adanya perubahan warna membran menjadi ungu pada tempat antigen diteteskan dimulai beberapa menit setelah inkubasi dalam substrat.
Indirect Enzyme-Linked Immunosorbent Assay (I-ELISA)
Reaksi antigen-antibodi pada ELISA menurut prosedur dari Nickel et al.
(2004) dilakukan dalam sumuran pelat mikrotiter ELISA. Antigen dan antibodi disiapkan sama seperti pada AGPT kecuali cairan perasan tanaman dibuat dalam bufer ekstraksi pH 9.6 [Na2CO5 1.59 g, NaHCO3 0.293 g, NaN3 0.20 g yang
dilarutkan dalam 1 L akuades steril] dengan perbandingan 1:100 (b/v). Pada sumuran pelat mikrotiter ELISA dimasukkan reaktan 100 µl yang dilakukan berturut-turut sebagai berikut: (1) inkubasi cairan perasan tanaman pada suhu 4oC semalam; (2) pencucian dengan 1 x PBST) [NaCl 8 g, Na2HPO4 1.15 g, KH2PO4
HASIL DAN PEMBAHASAN
Reaksi Antiserum terhadap TICV pada Jaringan Tanaman Tomat Reaksi antiserum TICV terhadap partikel virus yang terdapat di dalam jaringan tanaman tomat telah berhasil diamati melalui 3 metode uji serologi yaitu AGPT, DIBA, dan I-ELISA.
Melalui AGPT, terjadinya reaksi (pengenalan) antibodi (antiserum) terhadap antigen (partikel TICV dalam cairan perasan tanaman tomat) ditandai dengan terbentuknya garis presipitasi berwarna putih pada gel agarosa di antara lubang yang diberi cairan antiserum dan yang diberi cairan perasan tanaman (Gambar 4).
Gambar 4 Reaksi antiserum terhadap TICV dalam jaringan tanaman tomat pada
Agarose Gel Precipitation Test (AGPT). Kiri: reaksi antiserum dengan cairan perasan tanaman tomat terinfeksi TICV. Kanan: reaksi antiserum dengan cairan perasan tanaman tomat sehat.
Terbentuknya garis presipitasi ini membutuhkan waktu 2 hari setelah dimasukkannya antiserum dan cairan perasan tanaman dalam masing-masing lubang gel. Tampaknya difusi antibodi maupun antigen (partikel TICV) dalam gel agarosa berjalan lambat sampai kedua komponen tersebut bertemu dan saling berikatan membentuk kompleks antigen-antibodi (Ag-Ab). Kompleks Ag-Ab terjadi sedikit demi sedikit dan terakumulasi dalam jumlah yang memadai sampai dapat terlihat dengan mata telanjang (Nickel et al. 2004).
partikel virus) dan tidak mengenali protein lain seperti protein komponen tanaman misalnya. Dengan demikian, dapat dikatakan bahwa antiserum yang diproduksi dari antigen CP TICV dengan spesifik dapat bereaksi dengan partikel TICV.
Pada DIBA, perubahan warna membran menjadi ungu terjadi pada tempat cairan perasan tanaman terinfeksi TICV diteteskan, sedangkan pada tempat cairan perasan tanaman sehat diteteskan tidak terlihat adanya perubahan warna menjadi ungu (Gambar 5). Perubahan warna menjadi ungu terjadi karena perubahan substrat NBT+BCIP oleh enzim yang terdapat pada konjugat (Kubota et al. 2011). Konjugat tersebut telah berikatan pada antiserum TICV yang juga telah berikatan dengan partikel TICV yang terdapat pada membran (di tempat cairan perasan tanaman terinfeksi TICV diteteskan).
Gambar 5 Reaksi antiserum terhadap TICV dalam jaringan tanaman tomat. Pada
Dot Blot Immunobinding Assay (DIBA). Kiri: reaksi antiserum dengan cairan perasan tanaman tomat terinfeksi TICV. Kanan: reaksi antiserum dengan cairan perasan tanaman tomat sehat.
Pada I-ELISA, sinyal positif ditandai dengan terjadinya perubahan warna substrat menjadi kuning. Substrat p-nitrofenil fosfat yang awalnya bening karena adanya enzim alkalin fosfatase pada konjugat, maka sedikit demi sedikit berubah warna menjadi kuning (Nickel et al. 2004) dan dalam jangka waktu 30 menit, setelah mulai terjadinya reaksi enzimatik tersebut, intensitas warna kuning sudah cukup teramati dengan mata telanjang (Gambar 6).
Gambar 6 Reaksi antiserum terhadap TICV dalam jaringan tanaman tomat pada
Indirect-Enzyme Linked Immunosorbent Assay (I-ELISA). Duplo kiri: reaksi antiserum dengan cairan perasan tanaman tomat terinfeksi TICV. Duplo kanan: reaksi antiserum dengan cairan perasan tanaman tomat sehat.
Kecepatan perubahan dan intensitas warna kuning yang terjadi pada substrat sangat bergantung pada jumlah enzim (konjugat) yang berikatan dengan antiserum TICV, sedangkan jumlah antiserum yang ada bergantung pada jumlah partikel TICV yang terdapat pada cairan perasan tanaman tomat (menempel pada dinding sumuran pelat mikrotiter ELISA). Ketiadaan enzim (konjugat) menyebabkan substrat tetap bening seperti terlihat pada sumuran pelat mikrotiter ELISA yang diberi cairan perasan tanaman sehat, dan ini merupakan sinyal negatif atau menandakan tidak terdapatnya partikel TICV yang menempel pada dinding sumuran pelat mikrotiter (cairan perasan tanaman tomat) (Gambar 6).
Titer Antiserum TICV
Titer antiserum adalah tingkat pengenceran tertinggi dari antiserum yang masih memberikan sinyal positif terhadap adanya kompleks Ag-Ab pada uji serologi tertentu (Noordam 1973). Oleh karena itu, titer suatu antiserum sangat ditentukan oleh kesensitifan metode serologi yang digunakan. Pada penelitian ini, untuk menentukan titer antiserum TICV digunakan 3 metode serologi yaitu AGPT, DIBA dan I-ELISA. Hasil titer antiserum TICV yang digunakan disajikan pada Tabel 1.
Tabel 1 Titer antiserum TICV pada pengujian serologi menggunakan metode
agarose gel precipitation test (AGPT), dot blot immunobinding assay
(DIBA) dan indirect-enzyme linked immunosorbent assay (I-ELISA)*
*Pengujian sejenis telah dilakukan 3-4 kali dan memberikan hasil yang konsisten.
Pada penelitian ini, antigen yang digunakan adalah partikel TICV pada tingkat konsentrasi sesuai dengan yang terdapat pada siapan cairan perasan tanaman terinfeksi TICV yang tidak diencerkan. Pereaksi antiserum terhadap antigen ini pada tingkat konsentrasi (pengenceran) yang berbeda diamati dengan
melihat intensitas sinyal yang terjadi. Seperti yang disajikan pada Tabel 1 terlihat bahwa titer antiserum berbeda untuk ketiga metode serologi yang digunakan: titer pada AGPT hanya 1/4, sedangkan pada DIBA adalah 1/200 dan I-ELISA mencapai 1/500.
Perbedaan titer antiserum pada ketiga metode ini terjadi karena beberapa hal. Pada AGPT, sinyal yang terlihat merupakan presipitasi molekul kompleks Ag-Ab yang terakumulasi. Untuk dapat teramati dengan mata telanjang diperlukan tingkat konsentrasi molekul kompleks Ag-Ab yang cukup tinggi, sedangkan tingkat akumulasi kompleks Ag-Ab tersebut ditentukan oleh jumlah antibodi yang terkandung dalam siapan antiserum. Pada pengujian ini, siapan antiserum dengan pengenceran 1/4 masih memberikan tingkat akumulasi kompleks Ag-Ab yang masih dapat teramati, namun pada pengenceran antiserum 1/8 sudah tidak terlihat walaupun mungkin akumulasi kompleks Ag-Ab masih terjadi.
Berbeda dengan AGPT, pada DIBA sinyal positif masih terjadi pada tingkat pengenceran antiserum yang jauh lebih tinggi yaitu 1/200. Tingkat sensitivitas DIBA yang jauh melebihi AGPT karena penggunaan substrat. Seperti sudah dijelaskan di atas bahwa akan terjadi perubahan warna membran menjadi ungu apabila substrat tersebut bertemu dengan enzim yang terdapat pada konjugat. Jadi dengan jumlah enzim yang tidak terlalu banyak akan menghasilkan perubahan warna yang signifikan (dapat disaksikan dengan mata telanjang) jauh melampaui batas yang diperlukan agar terlihatnya akumulasi kompleks Ag-Ab secara langsung (dalam bentuk garis presipitasi) pada AGPT. Dengan demikian, diperlukan jumlah molekul antibodi (antiserum TICV) sebagai cerminan jumlah konjugat yang terikat lebih sedikit agar sinyal positif terjadi. Atau dengan kata lain, pada pengenceran antiserum yang lebih tinggi (1/200) DIBA masih dapat memberikan sinyal positif.
yang tidak dapat diamati dengan mata telanjang masih dapat dikuantifikasi. Sinyal dikatakan positif apabila nilai absorbans(pada panjang gelombang 405 nm) sampel (cairan perasan tanaman terinfeksi TICV) mencapai 1.5 kali dari nilai absorbans kontrol negatif (cairan perasan tanaman sehat) (Dijkstra and De Jager 1998).
KESIMPULAN DAN SARAN
Kesimpulan
Antiserum hasil immunisasi kelinci dengan protein produk ekspresi gen CP TICV pada Escherichia coli (Kurniawati 2012), dapat secara spesifik bereaksi dengan partikel TICV yang terdapat pada jaringan tanaman tomat. Sinyal positif (adanya garis presipitasi pada AGPT, perubahan warna membran menjadi ungu pada DIBA dan perubahan warna substrat menjadi kuning pada ELISA) sangat jelas terlihat pada sampel tanaman terinfeksi TICV dan tidak terjadi pada sampel tanaman sehat. Antiserum ini mempunyai titer yang cukup memadai pada AGPT (1/4), DIBA (1/200) maupun I-ELISA (1/500) sehingga sangat potensial digunakan sebagai sarana deteksi TICV. I-ELISA merupakan metode yang terbaik dilihat dari sisi penggunaan antiserum TICV, pengenceran yang lebih tinggi pada I-ELISA (jumlah antiserum yang sedikit) masih mampu mendeteksi TICV yang terdapat pada cairan perasan tanaman tomat.
Saran
Perlu dilakukan penelitian lanjutan pendeteksian TICV pada sampel tanaman tomat dari berbagai daerah atau wilayah dengan antiserum yang sama sehingga semakin banyaknya data maka akan terlihat hasil yang lebih konsisten dan akurat dari antiserum tersebut.