PENAPISAN SENYAWA AKTIF BUNGA DAN DAUN
TEMULAWAK (
Curcuma xanthorrhiza
)
SEBAGAI ANTIOKSIDAN
SRI WAHYUNI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
(Curcuma xanthorrhiza) sebagai Antioksidan. Dibimbing oleh IRMANIDA
BATUBARA dan LATIFAH K. DARUSMAN.
Penelitian ini bertujuan menapis senyawa aktif sebagai antioksidan pada
bunga dan daun C. xanthorrhiza menggunakan metode DPPH (2,2-
difenil-1-pikrilhidrasil). Bunga dan daun diekstraksi menggunakan n-heksana, etil asetat,
dan metanol. Minyak atsiri daun diperoleh menggunakan metode distilasi air. Tiap
ekstrak dan minyak atsiri diuji aktivitas antioksidannya. Ekstrak etil asetat daun
mempunyai potensi antioksidan terbaik dengan nilai IC
5041.50±7.80
μ
g/mL
namun tidak sebaik asam askorbat sebagai kontrol positif dengan nilai IC
503.36±0.29
μ
g/mL. Fraksionasi ekstrak etil asetat daun dilakukan menggunakan
kromatografi kolom silika gel metode elusi gradien menggunakan n-heksana, etil
asetat, dan metanol. Hasil fraksionasi diperoleh 13 fraksi (F1-F13) dan fraksi
teraktif adalah fraksi F11 dengan nilai IC
5024.05±2.38
μ
g/mL. Fraksi F11
dipisahkan lebih lanjut menggunakan kromatografi lapis tipis preparatif dan
diperoleh 8 fraksi (F11.1-F11.8). Fraksi F11.1 mempunyai aktivitas antioksidan
yang paling tinggi dengan nilai IC
5028.22±7.35
μ
g/mL. Uji fitokimia dan
spektroskopi inframerah terhadap F11.1 menunjukkan bahwa senyawa aktif
sebagai antioksidan adalah flavonol.
Kata kunci: Curcuma xanthorrhiza, daun, antioksidan, flavonol
ABSTRACT
SRI WAHYUNI. Active Compound Screening of Temulawak (Curcuma
xanthorrhiza) Flowers and Leaves as Antioxidant. Supervised by IRMANIDA
BATUBARA and LATIFAH K. DARUSMAN.
This study aimed to screen antioxidant compounds on leaves and flower of
C. xanthorrhiza using DPPH (2,2-diphenyl-1-picrylhydrazil) method. The flower
and leaves were extracted with n-hexane, ethyl acetate, and methanol. Essential
oil of the leaves was obtained through water distillation. Each extract and
essential oil were determined for theirs antioxidant activities. The ethyl acetate
extract of leaves had the best radical scavenging activity with IC
5041.50±7.80
μ
g/mL but not as good as ascorbic acid as the positive control with IC
503.36±0.29
μ
g/mL. Fractionation performed on ethyl aceate leaves extract using silica gel
column chromatography by step gradient elution with n-hexane, ethyl acetate, and
methanol. Fractionation resulted 13 fractions (F1-F13) and the most active
fraction was the F11 fraction (IC
5024.05±2.38
μ
g/mL). Fraction F11 was
separated further by preparative thin layer chromatography and gave 8 fractions
(F11.1-F11.8). Fractions F11.1 had the highest antioxidant activity with IC
50of
28.22±7.35
μ
g/mL. Phytochemical assay and infrared spectroscopy on F11.1
showed that the active compound as the antioxidant was flavonol.
PENAPISAN SENYAWA AKTIF BUNGA DAN DAUN
TEMULAWAK (
Curcuma xanthorrhiza
)
SEBAGAI ANTIOKSIDAN
SRI WAHYUNI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penapisan Senyawa Aktif Bunga dan Daun Temulawak (Curcuma
xanthorrhiza) sebagai Antioksidan
Nama
: Sri Wahyuni
NIM
: G44080107
Diketahui
Pembimbing
I
Pembimbing
II
Dr Irmanida Batubara, SSi, MSi
Prof Dr Ir Latifah K. Darusman, MS
NIP 19750807 200501 2 001
NIP 19530824 197603 2 003
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT dan junjungan kita
Nabi Muhammad SAW yang telah melimpahkan segala rahmat dan hidayah-Nya,
sehingga penulis dapat menyelesaikan skripsi yang berjudul Penapisan Senyawa
Aktif Bunga dan Daun Temulawak (Curcuma xanthorrhiza) sebagai Antioksidan.
Penelitian ini dilaksanakan di Laboratorium Kimia Analitik, Fakultas Matematika
dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) serta
Laboratorium Pusat Studi Biofarmaka (PSB) IPB dari bulan Januari hingga Juli
2012. Skripsi ini disusun sebagai salah satu syarat kelulusan Program Sarjana di
Departemen Kimia FMIPA IPB.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah
membantu menyelesaikan skripsi ini, terutama kepada Dr Irmanida Batubara, SSi,
MSi selaku pembimbing pertama dan Prof Dr Ir Latifah K. Darusman, MS selaku
pembimbing kedua, yang telah memberikan arahan, bimbingan, motivasi, dan doa
selama penelitian dan penyusunan skripsi. Terima kasih kepada grup riset
temulawak di bagian kimia analitik dan PSB IPB, yang telah memberikan
kesempatan untuk terlibat dalam penelitiannya. Terima kasih juga kepada staff
dan laboran di laboratorium kimia analitik dan PSB IPB yang telah membantu
dalam kelancaran selama penelitian.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada
Bapak, Mamah, kedua adik penulis (Edu dan Rama), dan Harry atas doa,
motivasi, semangat, dan dukungan moril maupun materi yang telah diberikan.
Tidak lupa penulis mengucapkan terima kasih kepada teman-teman kimia 45
terutama Septi, Erna, Amin, Mbak Dyah, dan Mbak Meysi atas bantuan dan
dukungannya. Semoga Allah SWT membalas segala bantuan dan doa dari semua
pihak yang telah membantu penulis dalam menyelesaikan skripsi ini.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 31 Maret 1990 sebagai putri
pertama dari Bapak M. Romli dan Ibu Siti Khotimah. Tahun 2008 penulis lulus
dari Sekolah Menengah Analis Kimia Bogor (SMAKBo) dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Seleksi Nasional Masuk Perguruan
Tinggi Negeri (SNMPTN).
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
METODE ... 2
Bahan dan Alat ... 2
Lingkup Kerja ... 2
Pengeringan ... 2
Kadar Air ... 2
Kadar Abu ... 2
Isolasi Minyak Atsiri Daun Temulawak ... 2
Ekstraksi ... 3
Uji Fitokimia ... 3
Penentuan Eluen Terbaik ... 3
Fraksionasi dengan Kromatografi Kolom ... 3
Uji Aktivitas Antioksidan DPPH ... 4
Identifikasi Senyawa ... 4
HASIL DAN PEMBAHASAN ... 4
Analisis Kadar Air dan Abu ... 4
Ekstraksi ... 4
Identifikasi Minyak Atsiri Daun Temulawak ... 4
Uji Fitokimia ... 5
Aktivitas Antioksidan Ekstrak Kasar dan Minyak Atsiri ... 6
Penentuan Eluen Terbaik ... 6
Fraksionasi Kromatografi Kolom ... 7
KLT Bioautografi, Uji Fitokimia Lanjutan, dan Aktivitas Antioksidan
Fraksi Hasil Kromatografi Kolom ... 8
Fraksionasi Kromatografi Lapis Tipis (KLTP) dan Aktivitas
Antioksidan Fraksi Aktif ... 9
Analisis Spektroskopi IR ... 9
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1
Rendemen ekstrak kasar daun dan bunga temulawak. ... 4
2
Komponen senyawa minyak atsiri dalam daun dan rimpang temulawak. ... 5
3
Uji fitokimia ekstrak kasar. ... 6
4
Nilai IC
50ekstrak kasar daun dan bunga temulawak. ... 6
5
Nilai IC
50pada fraksi aktif antioksidan hasil kromatografi kolom. ... 8
6
Nilai IC
50pada fraksi hasil KLTP. ... 9
7
Absorpsi inframerah gugus fungsi fraksi F11.1 . ... 9
DAFTAR GAMBAR
Halaman
1
(a) Daun dan (b) Bunga Temulawak. ... 1
2
Struktur
α
-kurkumena ... 5
3
Kromatogram lapis tipis ekstrak etil asetat daun temulawak dengan
eluen (a) n-Heksana (b) Etil asetat (c) Metanol (d) Kloroform (e)
Diklorometana (f) Aseton (g) Dietil eter (visualisasi noda 254 dan
366 nm). ... 7
4
Titik selektivitas simplex centroid ... 7
5
Kromatogram lapis tipis eluen terbaik dengan eluen n-heksana: etil
asetat: metanol (2/3:1/6:1/6) pada visualisasi noda 254 dan 366 nm ... 7
6
Kromatogram lapis tipis hasil kromatografi kolom dengan eluen
n-heksana:etil asetat:metanol perbandingan 2/3:1/6:1/6 (kondisi KLT:
plat KLT Silika gel G
60F
254, visualisasi noda 254 dan 366 nm) ... 8
7
Dugaan senyawa aktif dalam fraksi F11.1 ekstrak etil asetat daun
temulawak adalah flavonol ... 10
DAFTAR LAMPIRAN
Halaman
1
Bagan alir penelitian ... 13
2
Isolasi minyak atsiri daun temulawak ... 14
3
Contoh perhitungan kadar air daun temulawak ... 15
4
Contoh perhitungan kadar abu daun temulawak ... 15
5
Contoh perhitungan rendemen ekstrak kasar daun temulawak ... 16
6
Contoh perhitungan IC
50dengan metode penangkapan radikal bebas
DPPH untuk ekstrak teraktif (ekstrak etil asetat daun temulawak) ... 17
7
Hasil pencarian eluen terbaik dengan pelarut campuran untuk
ekstrak etil asetat daun temulawak... 18
8
Pengelompokan fraksi hasil kromatografi kolom ekstrak etil asetat
daun temulawak ... 18
9
Kromatogram lapis tipis bioautografi antioksidan fraksi hasil
kromatografi kolom ... .19
10
Hasil uji fitokimia fraksi kromatografi kolom ... 20
11
Uji Duncan terhadap nilai IC
50pada fraksi F11 dan F11.1 ... 22
12
Spektrum inframerah (IR) dari fraksi KLTP teraktif (F11.1) ... 22
PENDAHULUAN
Indonesia memiliki keanekaragaman hayati yang tinggi, banyak tumbuhan berfungsi sebagai tanaman obat. Prinsip yang berkembang dalam masyarakat dewasa ini adalah kecenderungan untuk memanfaatkan bahan alam dalam pengobatan yaitu dengan menggunakan tanaman obat tersebut. Salah satu tanaman obat yang sering digunakan adalah temulawak (Curcuma xanthorrhiza). Temulawak mempunyai karakteristik sebagai obat fitofarmaka didasarkan pada potensi tanaman tersebut sebagai antimikrob, antioksidan, antifungi, hepatoprotektor, dan antiradang (Nuratmi et al. 1996), pencegah kanker, antitumor, dan menurunkan kadar lemak darah (Sudewo 2004). Aktivitas antioksidan rimpang temulawak berasal dari komponen utama berupa kurkumin. Peran antioksidan kurkumin untuk pencegahan oksidasi hemoglobin dan lisisnya sel eritrosit disebabkan adanya struktur fenolik OH (Venkatesan et al. 2003). Komponen kimia yang berperan sebagai antioksidan adalah senyawa golongan fenol dan polifenol.
Antioksidan merupakan senyawa yang mampu menunda, memperlambat, atau menghambat reaksi oksidasi (Pokorny et al. 2001). Zat ini secara nyata mampu memperlambat atau menghambat oksidasi zat yang mudah teroksidasi meskipun dalam konsentrasi rendah. Senyawa antioksidan dapat melindungi sel dari efek berbahaya yang disebabkan radikal bebas oksigen reaktif. Radikal bebas ini dapat berasal dari metabolisme tubuh maupun faktor eksternal lainnya (Halliwel et al. 1995). Radikal bebas adalah spesies yang tidak stabil karena memiliki elektron tak berpasangan dan mencari pasangan elektron dalam makromolekul biologi. Kondisi oksidasi dapat menyebabkan kerusakan protein dan DNA, kanker, penuaan, dan penyakit lainnya (Ozyurt et al. 2007).
Aktivitas antioksidan tidak dapat diukur secara langsung, melainkan melalui efek antioksidan dalam mengontrol proses oksidasi. Banyak metode yang bisa digunakan untuk mengukur aktivitas antioksidan dan setiap metode memiliki mekanisme yang berbeda, sesuai dengan kandungan senyawa antioksidannya. Aktivitas antioksidan dapat diamati menggunakan beberapa metode, yaitu metode 2,2-difenil-1-pikrilhidrasil (DPPH), asam 2,2-azinobis(3-etilbenzatiazolin)-6-sulfonat (ABTS), ferric reducing antioxidant
power (FRAP), dan cuprac reducing
antioxidant capacity (CUPRAC) (Krishnaiah
et al. 2010). Penelitian ini akan dilakukan
pengujian aktivitas antioksidan menggunakan metode penangkapan radikal bebas DPPH karena didasarkan pada beberapa keunggulannya, diantaranya mudah, sederhana, cepat, kedapatulangan baik, baik untuk sampel dengan polaritas tertentu, sensitif, dan hanya membutuhkan sedikit sampel (Koleva et al. 2002).
Saat ini pada tanaman temulawak hanya rimpangnya saja yang digunakan. Penelitian tentang bagian tanaman lain pada temulawak seperti batang, daun, akar, dan bunganya belum ada, padahal bagian-bagian tersebut sangat berpotensi untuk bahan penelitian sehingga perlu dieksplorasi lebih dalam. Penelitian ini digunakan daun dan bunga temulawak (Gambar 1).
(a) (b)
Gambar 1 (a) Daun dan (b) Bunga Temulawak
Temulawak merupakan satu famili dengan kunyit yang berasal dari famili Zingiberaceae. Menurut penelitian Liu dan Nair (2012), ekstrak metanol dan air daun kunyit pada konsentrasi 100 µg/mL menginhibisi peroksidasi lemak (LPO) sebesar 81% dan 43%. Ekstrak dan isolat daun kunyit juga menghambat pertumbuhan sel tumor secara in
vitro dalam pankreas manusia, prostat, dan
saluran lambung. Selain itu, kandungan terpenting dalam daun kunyit adalah golongan terpenoid. Kandungan daun kunyit yang sangat bermanfaat diharapkan memiliki aktivitas yang serupa pada daun temulawak. Bunga temulawak digunakan karena merupakan satu-satunya bagian tanaman temulawak yang tumbuh tidak menyatu pada rimpang (batang semu), sehingga apabila diambil tidak akan berpengaruh pada bagian tanaman lainnya.
rimpang temulawak yang digunakan sebagai sumber antioksidan alami. Maka dalam penelitian ini dilakukan penapisan terhadap senyawa aktif dari bunga dan daun temulawak sebagai antioksidan menggunakan metode 2,2-difenil-1-pikrilhidrasil (DPPH).
METODE
Bahan dan Alat
Bahan yang digunakan adalah bunga dan daun temulawak dari kebun Pusat Studi Biofarmaka (PSB) IPB dan kebun Balai Penelitian Tanaman Rempah dan Aromatik (Balitro) Bogor, n-heksana, etil asetat, metanol, serbuk Mg, HCl(p), amil alkohol,
kloroform, NH4OH, H2SO4(p), pereaksi Mayer,
pereaksi Wagner, pereaksi Dragendorf, eter, anhidrida asetat, FeCl3 1%,
2,2-difenil-1-pikrilhidrasil (DPPH), asam askorbat, etanol, dietil eter, dikloro metana, dan silika gel G60F254.
Alat-alat yang digunakan adalah peralatan gelas, peralatan pemanasan, timbangan analitik, cawan dan pinggan porselen, eksikator, maserator, penguap putar, distilator
stahl, lempeng tetes, mikroplate, inkubator,
bejana elusi, lampu UV, kromatografi kolom, lempeng kromatografi lapis tipis analitik (KLTA) silika gel G60F254, kromatografi lapis
tipis preparatif (KLTP) silika gel G60F254,
spektrofotometer UV-Vis, spektrofotometer
Fourier Transform Infra Red (FTIR), dan
Kromatografi Gas-Spektrometri Massa.
Lingkup Kerja
Metode penelitian yang dilakukan meliputi beberapa tahap. Tahapan tersebut yaitu penyiapan sampel, isolasi minyak atsiri, ekstraksi dan fraksionasi, pemisahan, dan identifikasi komponen (Lampiran 1). Sampel diisolasi minyak atsirinya dengan distilasi air kemudian diuji aktivitas antioksidan (Lampiran 2). Kadar air dan abu dianalisis setelah sampel dikeringkan dan digiling. Simplisia kering diekstraksi bertingkat menggunakan n-heksana, etil asetat dan metanol. Tiap ekstrak dipekatkan dan diuji fitokimia serta aktivitas antioksidan. Penentuan eluen terbaik dilakukan dengan menggunakan KLT, ekstrak teraktif dipisahkan dengan kromatografi kolom silika gel. Fraksi-fraksi yang diperoleh dari pengujian kromatografi kolom diuji KLT bioautografi, fitokimia, dan aktivitas antioksidan. Fraksi yang aktif dipisahkan kembali menggunakan KLT preparatif dan fraksi teraktif yang dihasilkan diuji fitokimia
dan aktivitas antioksidan. Identifikasi menggunakan spektrofotometer FTIR (gugus fungsinya).
Pengeringan
Sampel basah bunga dan daun temulawak masing-masing diambil sebanyak 500 gram. Sampel dikeringkan dengan menggunakan oven pada suhu 40-50°C, selama 4 s.d 5 hari. Kemudian simplisia kasar dari sampel digiling, dengan ukuran 100 mesh.
Kadar Air (AOAC 2007)
Cawan porselin dikeringkan pada suhu 105°C selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g contoh serbuk bunga dan daun temulawak dimasukkan ke dalam cawan dan dipanaskan pada suhu 105°C selama 5 jam, kemudian didinginkan dalam eksikator dan ditimbang sampai diperoleh bobot konstan. Penetapan kadar air dilakukan berdasarkan penentuan jumlah bobot kering contoh. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo).
Kadarair % 100%
Keterangan:
A = Bobot contoh sebelum dikeringkan (g) B = Bobot contoh setelah dikeringkan (g)
Kadar Abu (AOAC 2007)
Cawan porselen dikeringan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel kemudian cawan didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g contoh serbuk bunga dan daun temulawak dimasukkan ke dalam cawan dan dipanaskan dengan nyala bunsen sampai tidak berasap lagi. Cawan dimasukkan ke dalam tanur dengan temperatur 600°C selama 2 jam sampai diperoleh abu, kemudian didinginkan dalam eksikator dan ditimbang. Kadar abu contoh dihitung dengan persamaan
Kadarabu % 100%
Keterangan:
A = bobot contoh awal (g) B = bobot abu (g)
Isolasi Minyak Atsiri Daun Temulawak (Muchtaridi et al. 2003) dengan modifikasi
akuades. Perbandingan sampel dan akuades sebesar 1:2. Proses distilasi air selama 6 jam dengan temperatur 100–105°C. Distilat yang diperoleh kemudian didiamkan selama 24 jam dan minyak yang terdapat dalam distilat dipisahkan dengan pelarut etil asetat menggunakan corong pisah. Minyak yang diperoleh dikumpulkan dan dipekatkan menggunakan penguap putar. Komponen senyawa minyak kasar diidentifikasi menggunakan GC-MS. Tahap selanjutnya dapat dilihat pada Lampiran 1.
Ekstraksi
Simplisia diekstraksi bertingkat dengan cara maserasi selama 24 jam dimulai dengan pelarut nonpolar (n-heksana), dan ampas yang diperoleh kemudian dimaserasi kembali dengan pelarut semipolar (etil asetat), serta yang terakhir ampas dimaserasi dengan pelarut polar (metanol). Perbandingan simplisia dan pelarut (b/v) sebesar 1:5. Tiap-tiap maserat yang diperoleh kemudian dipisahkan dan dipekatkan menggunakan penguap putar pada suhu 30°C. Rendemen tiap ekstrak dihitung, kemudian diuji fitokimia dan aktivitas antioksidannya.
Uji Fitokimia (Harborne 1987)
Uji Flavonoid. Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan kedalam tabung reaksi lalu ditambahkan 0.5 g serbuk Mg, 1 mL HCl(p),
dan 1 mL amil alkohol, kemudian dikocok kuat. Uji positif flavonoid menghasilkan warna kuning atau jingga pada lapisan amil alkohol.
Uji Alkaloid. Sebanyak 0.1 g ekstrak dilarutkan dalam 10 mL CHCl3 dan 4 tetes
NH4OH. Larutan disaring dan filtratnya
dimasukkan ke dalam tabung reaksi tertutup. Ekstrak CHCl3 dalam tabung reaksi dikocok
dengan 10 tetes H2SO4 2 M dan lapisan
asamnya dipisahkan kedalam tabung reaksi lainnya. Lapisan asam ini diteteskan pada lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf yang akan menimbulkan endapan berturut-turut berwarna putih, cokelat, dan merah jingga jika terdapat alkaloid.
Uji Saponin. Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan kedalam tabung reaksi tertutup kemudian dikocok selama 10 menit. Adanya
saponin ditunjukkan dengan terbentuknya buih yang stabil.
Uji Triterpenoid dan steroid. Sebanyak 0.1 g ekstrak dilarutkan dengan 25 mL etanol panas (50°C). Larutan disaring dalam pinggan porselin dan diuapkan sampai kering. Residu ditambahkan eter dan ekstrak eter dipindahkan kedalam lempeng tetes. Sebanyak 3 tetes anhidrida asetat dan 1 tetes H2SO4(p) (uji
Liebermann-Buchard). Warna merah atau ungu menunjukkan kandungan triterpenoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Uji Tanin. Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas, dididihkan selama 5 menit, dan disaring. Sebagian filtrat yang diperoleh ditambahkan larutan FeCl3
1%. Hasil positif ditunjukkan oleh warna hijau kehitaman.
Penentuan eluen terbaik
Pelat KLT disiapkan kemudian ekstrak pekat dari sampel ditotolkan sebanyak 10-15 kali. Setelah kering, pelat KLT tersebut dielusi dalam ruang elusi yang telah dijenuhkan oleh uap eluen pengembang (± 15 menit). Eluen tunggal yang digunakan ialah metanol, etil asetat, kloroform, dietil eter, diklorometana, aseton, dan n-heksana, lalu dilakukan perbandingan pada eluen yang menghasilkan spot yang banyak dan terpisah. Eluen akan diperbaiki lebih lanjut apabila pemisahan belum baik. Kombinasi eluen menggunakan Simplex Centroid Design
(SCD) jika terdapat 3 pelarut terbaik. Noda hasil elusi diamati dibawah lampu UV pada panjang gelombang 254 dan 366 nm.
Fraksionasi dengan kromatografi kolom (Rouessac & Rouessac 2007) dan KLT Preparatif
Fraksionasi dilakukan dengan pengemasan kolom untuk pemisahan 0.5 g ekstrak aktif dengan diameter 2 cm dan tinggi kolom 30 cm. Ekstrak dilarutkan dalam eluen terbaik yang telah diperoleh, kemudian dipisahkan komponen-komponennya dengan kolom kromatografi dengan elusi step gradient
ekstrak sampel. Fraksi dikerok, dilarutkan dengan pelarut, kemudian dipekatkan dan diuji fitokimia serta aktivitas antioksidan.
Uji Aktivitas Antioksidan DPPH (Batubara
et al. 2009)
Sampel dilarutkan dalam etanol 96%, kemudian diencerkan menggunakan etanol 96% dengan konsentrasi akhir 10.00, 13.33, 16.67, 33.33, 66.67, 100.00, 133.33, dan 166.67 μg/mL pada mikroplate. Selanjutnya, ditambahkan 11.8 mg DPPH dalam 100 mL etanol 96% sebanyak 100 μL, pada setiap lubang mikroplate. Setelah diinkubasi selama 30 menit, nilai absorban diukur pada panjang gelombang 514 nm (ungu). Kontrol positif dalam uji ini adalah asam askorbat. Aktivitas inhibisi ditentukan berdasarkan persamaan berikut:
% Inhibisi A blangko – A kontrolA sampel – A kontrol x %
A sampel adalah absorbansi sampel, A kontrol adalah absorbansi asam askorbat, dan A blangko adalah absorbansi etanol.
Identifikasi Senyawa
Sampel ditimbang sebanyak ±0.8000 mg kemudian dihaluskan bersamaan dengan 0.2004 mg KBr dalam mortar agat. Setelah dihaluskan dan bercampur, serbuk ini dimasukkan kedalam alat pencetak pelat KBr, sehingga diperoleh serbuk lempeng yang transparan. Lempeng yang diperoleh dimasukkan ke dalam FTIR.
HASIL DAN PEMBAHASAN
Kadar Air dan Abu
Penetapan kadar air berguna untuk mengetahui mutu dan daya simpan bahan sehingga terhindar dari pengaruh aktivitas jamur/mikrob yang tumbuh pada daerah yang lembap atau pada bahan yang memiliki kadar air tinggi. Rerata kadar air pada daun dan bunga temulawak berturut-turut sebesar 7.32% dan 19.45% (b/b). Kadar air pada daun temulawak yang kurang dari 10% menunjukkan ketahanan serbuk tersebut untuk disimpan dalam jangka panjang. Hal ini sesuai dengan pernyataan Winarno (1997), yaitu bila kadar air yang terkandung dalam suatu bahan kurang dari 10%, maka kestabilan optimum bahan akan tercapai dan pertumbuhan mikroba dapat dikurangi. Bunga temulawak memiliki kadar air melebihi 10% sehingga tidak tahan lama dalam penyimpanannya.
Penentuan kadar abu bertujuan menentukan kandungan mineral sisa hasil pembakaran bahan organik. Mineral sebagai senyawaan organik akan tertinggal dalam bentuk abu yang dapat digunakan untuk analisis kualitatif dan kuantitatif. Rerata kadar abu daun dan bunga temulawak berturut-turut sebesar 8.42% dan 15.34%. Kadar abu pada bunga lebih besar daripada daun temulawak yang artinya kandungan mineral pada bunga lebih besar daripada daun temulawak. Warna abu yang dihasilkan bunga berwarna hijau toska, sedangkan daun berwarna putih keabu-abuan. Warna abu yang berbeda ini dapat disebabkan adanya perbedaan bahan mineral yang terkandung dalam sampel tersebut. Data hasil perhitungan kadar air dan abu dapat dilihat pada Lampiran 3 dan 4.
Ekstraksi
Ekstraksi merupakan pengambilan bahan aktif dari suatu bahan oleh zat pengekstraksi yang sesuai dengan kepolarannya (Ansel 1989). Pemilihan pelarut juga bergantung kepada sifat kelarutan zat tersebut. Suatu senyawa akan menunjukkan kelarutan yang berbeda-beda dalam pelarut yang berbeda, mengikuti prinsip like dissolve like (Khopkar 2003). Metode ekstraksi yang dilakukan adalah maserasi karena sederhana, efektif, aman, dan menghindari rusaknya senyawa aktif pada sampel yang tidak tahan panas. Maserasi dilakukan bertingkat mengunakan pengekstraksi yang berbeda kepolarannya, yaitu menggunakan n-heksana (nonpolar), etil asetat (semipolar), dan metanol (polar). Rendemen hasil ekstraksi dapat dilihat pada Tabel 1.
Tabel 1 Rendemen ekstrak kasar daun dan bunga temulawak
Sampel Pelarut Rendemen (%) Daun n-Heksana 3.49±0.43 Etil asetat 4.32±0.57 Metanol 13.44±0.56 Bunga n-Heksana 1.73±0.02 Etil asetat 1.16±0.16 Metanol 7.70±0.43
daun, yaitu (3.49±0.43)% dan ekstrak etil asetat bunga, yaitu (1.16±0.16)%. Contoh perhitungan rendemen dapat dilihat pada Lampiran 5.
Identifikasi Minyak Atsiri Daun Temulawak
Minyak atsiri, juga dikenal dengan nama minyak eteris atau minyak terbang (essential
oil, volatile oil) merupakan salah satu hasil
metabolisme tanaman. Minyak ini bersifat mudah menguap pada suhu kamar, mempunyai rasa getir, serta berbau wangi sesuai dengan bau tanaman penghasilnya. Minyak atsiri larut dalam pelarut organik dan tidak larut dalam air (Sudaryanti dan Sugiharti 1990). Minyak atsiri daun temulawak diperoleh dari hasil distilasi air dengan rendemen sebesar 0.13%. Komponen minyak atsiri dapat diketahui dengan pemisahan menggunakan metode kromatografi gas-spektrometri massa (GC-MS). Komponen senyawa minyak atsiri daun temulawak dapat dilihat pada Tabel 2.
Tabel 2 Komponen senyawa minyak atsiri dalam daun dan rimpang temulawak Komponen Rt (min) Kadar (%) Daun Rimpang *
α-pinena - - 0.67
Kamfena - - 1.45
Isoborneol 3.76 0.06 0.67
Kamfor 3.62 0.16 5.61
α-Bergamotena - - 3.61
Trans-kariopillena
8.26 3.08 1.10
-elemena 8.44 0.72 1.48 -farnesena 8.85 0.34 3.70
α-longipinena - - 2.03 Germakrena d 8.71 0.15 1.51
α-kurkumena 9.60 14.09 19.43 Diepi- α-sedrena 18.13 0.85 29.95 Germakrena b 11.15 4.35 4.42
Furanodiena - - 4.03
-elemena 7.66 3.64 1.06 Germakrona 13.42 2.53 3.51 Xantorizol 15.31 4.35 7.10
Lain-lain hingga 100% Keterangan: (-) tidak terdeteksi
(* Sukrasno et al. 2012)
Hasil identifikasi GC-MS minyak atsiri daun temulawak menunjukkan bahwa senyawa α-kurkumena (Gambar 2) mempunyai intensitas yang paling tinggi dengan kadar 14.09%, sedangkan pada
kandungan minyak atsiri rimpang temulawak kadarnya 19.43%. Kandungan tertinggi pada rimpang temulawak ialah senyawa diepi-α -sedrena dengan kandungan sebesar 29.95%, sedangkan pada daun sebesar 0.85%.
Gambar 2 Struktur α-kurkumena
Uji Fitokimia
Pengujian fitokimia mengidentifikasi kandungan kimia dalam ekstrak kasar bunga dan daun temulawak sebagai langkah awal untuk mengetahui jenis komponen aktif yang terkandung sehingga dapat dimanfaatkan lebih lanjut. Metode uji berdasarkan perubahan warna atau terbentuknya endapan sebagai respon atas pereaksi tertentu (Harborne 1987). Kandungan fitokimia ekstrak kasar bunga dan daun temulawak dapat dilihat pada Tabel 3.
Kandungan senyawa flavonoid berdasarkan Tabel 3 terdapat pada ekstrak n -heksana, etil asetat, dan metanol daun temulawak, sedangkan pada bunga terdapat pada ekstrak etil asetat dan metanol. Kandungan alkaloid terdapat pada ekstrak etil asetat dan metanol daun sedangkan pada bunga terdapat pada ekstrak n-heksana. Kelompok senyawa saponin tidak terdapat pada bagian bunga maupun daun temulawak. Komponen senyawa tanin hanya terdapat pada ekstrak metanol daun maupun bunga. Kandungan steroid terdapat pada ekstrak n -heksana daun dan ekstrak etil asetat daun maupun bunga. Kandungan triterpenoid terdapat pada ekstrak etil asetat dan minyak atsiri daun temulawak.
Tabel 3 Uji fitokimia ekstrak kasar
Sampel Flavonoid Alkaloid Saponin Tanin Steroid Triterpenoid
n-Heksana daun + - - - + -
Etil asetat daun + + - - + +
Metanol daun + + - + - -
Minyak atsiri daun - - - +
n-Heksana bunga - + - - - -
Etil asetat bunga + - - - + -
Metanol bunga + - - + - -
Keterangan: (+) : terdeteksi; (-) tidak terdeteksi
Aktivitas Antioksidan Ekstrak Kasar dan Minyak Atsiri
Senyawa antioksidan memegang peranan penting dalam pertahanan tubuh terhadap pengaruh buruk yang disebabkan radikal bebas. Radikal bebas ini dapat berasal dari metabolisme tubuh maupun faktor eksternal lainnya (Halliwel et al. 1995). Aktivitas antioksidan dilakukan untuk mengetahui ada tidaknya daya inhibisi senyawa aktif yang terdapat pada ekstrak kasar n-heksana, etil asetat, dan metanol pada daun dan bunga temulawak. Aktifitas antioksidan diuji menggunakan metode DPPH. Metode DPPH didasarkan pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen (Apak et al. 2007). Selain itu, pada daun temulawak diisolasi minyak atsirinya. Hasil pengujian aktivitas antioksidan pada ekstrak kasar dapat dilihat pada Tabel 4.
Tabel 4 Nilai IC50 ekstrak kasar daun dan
bunga temulawak
Ekstrak IC50 (μg/mL)
n-Heksana daun >166.67 Etil asetat daun 41.50±7.80 Metanol daun >166.67 Minyak atsiri daun >166.67
n-Heksana bunga >166.67 Etil asetat bunga >166.67 Metanol bunga >166.67 Asam askorbat 3.36±0.29 Keterangan : IC50: konsentrasi ekstrak yang
mampu menghambat radikal bebas sebesar 50%.
Nilai IC50 yang terendah berdasarkan
Tabel 4 adalah ekstrak kasar etil asetat daun temulawak, yaitu 41.50±7.80 μg/mL. Nilai IC50 yang diperoleh menunjukkan bahwa
ekstrak kasar etil asetat daun temulawak dapat menangkap radikal bebas DPPH 50% pada konsentrasi 41.50±7.80 μg/mL, nilai yang diperoleh lebih tinggi dari asam askorbat yang memiliki nilai IC50 sebesar 3.36±0.29 μg/mL
sehingga asam askorbat memiliki inhibisi
yang lebih kuat daripada ekstrak kasar etil asetat.
Semakin rendah nilai IC50 suatu bahan,
maka semakin tinggi aktivitas antioksidannya. Hal tersebut disebabkan hanya dibutuhkan sejumlah kecil konsentrasi sampel untuk meredam 50% radikal bebas DPPH. Ekstrak kasar lainnya tidak ada yang mencapai inhibisi 50% hingga konsentrasi 166.67
μg/mL. Blois (1958) diacu dalam Hanani et al. (2005) mengatakan bahwa suatu bahan memiliki aktivitas antioksidan yang kuat apabila memiliki nilai IC50 kurang dari 200
ppm (setara 200 μg/mL). Contoh perhitungan IC50 antioksidan dari ekstrak kasar dengan
metode penangkapan radikal DPPH dapat dilihat pada Lampiran 6.
Penentuan Eluen Terbaik dengan KLT
KLT merupakan metode pemisahan suatu senyawa berdasarkan perbedaan distribusinya diantara dua fase, yaitu fase diam dan fase gerak. KLT analitik ini digunakan untuk mencari eluen terbaik dari beberapa eluen yang baik dalam pemisahan senyawa. Eluen yang baik adalah eluen yang bisa memisahkan senyawa dalam jumlah yang banyak ditandai dengan munculnya noda. Noda yang terbentuk tidak berekor dan jarak antara noda satu dengan yang lainnya jelas (Harborne 1987). Noda yang dihasilkan selanjutnya diamati di bawah sinar lampu UV pada panjang gelombang 254 dan 366 nm.
Gambar 3 Kromatogram lapis tipis ekstrak etil asetat daun temulawak dengan eluen (a) n-Heksana (b) Etil asetat (c) Metanol (d) Kloroform (e) Diklorometana (f) Aseton (g) Dietil eter (visualisasi noda 254 dan 366 nm)
Berdasarkan Gambar 3, ekstrak etil asetat daun temulawak dengan eluen etil asetat (semi polar) memiliki noda yang paling banyak yaitu 9 noda. Hal ini menunjukkan bahwa sampel dengan eluen etil asetat memiliki pola pemisahan yang baik. Eluen n-heksana menghasilkan noda yang paling sedikit yaitu 1 noda. Eluen terbaik juga dicari dengan eluen campuran sehingga diharapkan memiliki keterpisahan yang lebih baik. Pola pemisahan pada n-heksana yang terdapat 1 spot pada awal elusi menandakan bahwa sampel tertahan pada pelat silika gel dan eluen metanol yang pemisahannya berada pada akhir elusi menandakan bahwa sampel kurang tertahan pada pelat serta eluen etil asetat yang pemisahan nodanya lebih baik, dijadikan eluen campuran.
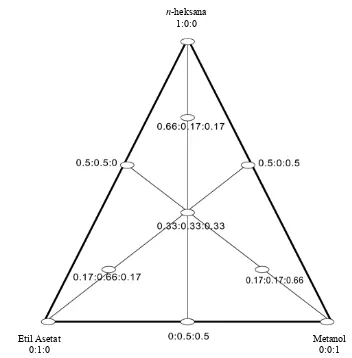
Eluen campuran menggunakan desain
Simplex Centroid Design (SCD). Ketiga
pelarut yang terpilih (n-heksana, etil asetat, dan metanol) dikombinasikan berdasarkan
simplex centroid seperti terlihat pada Gambar
4. Berdasarkan hasil elusi dengan SCD, noda yang diperoleh pada eluen n-heksana:etil asetat:metanol dengan perbandingan 2/3:1/6:1/6 memiliki noda yang paling banyak yaitu 11 noda (Gambar 5). Perbandingan ini merupakan yang terbaik dibandingkan dengan perbandingan yang lain. Hasil pencarian eluen terbaik menggunakan eluen campuran dapat dilihat pada Lampiran 7.
Gambar 4 Titik selektivitas simplex centroid
Gambar 5 Kromatogram lapis tipis eluen terbaik dengan eluen n -heksana:etil asetat:metanol (2/3:1/6:1/6) pada visualisasi noda 254 dan 366 nm
Fraksionasi Kromatografi Kolom
Fraksionasi adalah proses pemisahan komponen dalam suatu ekstrak menjadi kelompok senyawa yang memiliki kemiripan karakteristik secara kimia (Rouessac & Rouessac 2007). Fraksionasi dilakukan untuk memurnikan ekstrak kasar etil asetat daun temulawak yang memiliki potensi antioksidan menggunakan silika gel dengan metode step
gradient (peningkatan kepolaran) dimulai dari
n-heksana, etil asetat, dan metanol. Tujuan peningkatan polaritas eluen yaitu agar semua komponen yang terlarut dalam ekstrak kasar akan terbawa lebih cepat dan pemisahan dapat berlangsung dengan baik (Harvey 2000).
Elusi dimulai dengan pelarut n-heksana 100%, kemudian campuran dengan etil asetat (n-heksana: etil asetat) lalu etil asetat 100%, kemudian campuran dengan metanol (etil asetat: metanol), dan metanol 100%. Perbandingan campuran yang dipakai, yaitu
1:0:0
Etil Asetat 0:1:0
Metanol 0:0:1
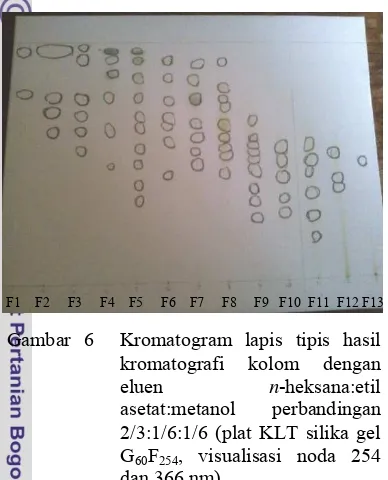
9:1; 8:2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9. Hasil pemisahan ekstrak ditampung setiap 3 ml. Hasil kolom dimonitor dengan kromatografi lapis tipis (KLT) dengan menggunakan eluen terbaik yang telah diperoleh yaitu n-heksana: etil asetat: metanol (2/3:1/6:1/6). Berdasarkan pemisahan yang dilakukan diperoleh 13 fraksi berdasarkan kesamaan Rf-nya pada KLT dengan rendemen dapat dilihat pada Lampiran 8 dan pola KLT dapat dilihat pada Gambar 6.
Gambar 6 Kromatogram lapis tipis hasil kromatografi kolom dengan eluen n-heksana:etil asetat:metanol perbandingan 2/3:1/6:1/6 (plat KLT silika gel G60F254, visualisasi noda 254
dan 366 nm)
Kromatogram lapis tipis pada Gambar 6 menunjukkan bahwa masing-masing fraksi memiliki noda lebih dari satu, fraksi yang memiliki noda terbanyak adalah fraksi 5, sedangkan fraksi yang memiliki noda paling sedikit adalah fraksi 13 sebanyak 1 noda. Fraksi lainnya memiliki jumlah noda lebih dari satu. Hal ini menandakan bahwa komponen fraksi hasil kolom belum murni, sehingga diperlukan langkah pemisahan selanjutnya dengan menggunakan KLT preparatif.
KLT Bioautografi, Uji Fitokimia Lanjutan, dan Aktivitas Antioksidan Fraksi Hasil Kromatografi Kolom
Penentuan KLT bioautografi pada aktivitas antioksidan dimaksudkan untuk melihat secara kualitatif fraksi yang teraktif. Metode yang digunakan dengan menyemprot pereaksi DPPH pada pelat KLT kemudian ditunggu selama 30 menit agar reaksi berjalan. Fraksi yang aktif akan menunjukkan perubahan warna menjadi kuning hingga tak berwarna sedangkan fraksi yang tidak aktif akan tetap
berwarna ungu yang berasal dari warna DPPH. Warna kuning ini terjadi karena senyawa bioaktif yang terkandung pada fraksi akan bereaksi dengan menyumbangkan satu atom hidrogennya, sehingga akan menghasilkan senyawa DPPH-H yang berwarna kuning. Berdasarkan hasil yang diperoleh fraksi F2-F3 dan F8-F12 terdapat noda yang berubah warna menjadi kuning. Hasil ini dapat dilihat pada Lampiran 9.
Uji fitokimia ekstrak kasar etil asetat daun temulawak ditemukan bahwa adanya kandungan golongan alkaloid, flavonoid, dan steroid/triterpenoid. Fraksi hasil kromatografi kolom (F1-F13) dilakukan uji fitokimia lanjutan terhadap ketiga kandungan kelompok senyawa tersebut. Menurut Harborne (1987), uji lanjutan golongan flavonoid dilakukan pada pelat KLT dengan diuapi uap ammonia pekat, uji steroid/triterpenoid dengan menyemprot pada pelat KLT dengan pereaksi Liebermann-Buchard (anhidrida asetat:asam sulfat pekat 3:1) yang akan menunjukkan warna hijau/biru pada steroid dan merah/ungu pada triterpenoid, sedangkan uji alkaloid dengan menyemprot pada pelat KLT dengan pereaksi Dragendorf yang akan menunjukkan noda coklat jingga berlatar kuning.
Berdasarkan uji yang dilakukan diketahui bahwa fraksi F1-F5, F7-F8, dan F11-F12 menunjukkan adanya golongan flavonoid berdasarkan warna yang ditunjukkan pada sinar tampak dan sinar UV. Uji golongan alkaloid terdapat pada fraksi F1, F3-F4, F6-F8, dan F11-F13. Uji golongan steroid/triterpenoid terdapat pada fraksi F2-F5 dan F7-F12. Hasil uji fitokimia dapat dilihat pada Lampiran 10. Noda yang paling banyak berwarna kuning adalah F11 sebanyak 4 noda. Diduga F11 ini yang akan memiliki efek inhibisi yang lebih kuat daripada fraksi yang lain. Fraksi aktif (F2-F3) dan (F8-F12) hasil KLT bioautografi ditentukan IC50-nya. Hasil
pengujian aktivitas antioksidan terhadap fraksi tersebut dapat dilihat pada Tabel 5.
Tabel 5 Nilai IC50 pada fraksi aktif
antioksidan hasil kromatografi kolom
Fraksi IC50 (μg/mL)
F2 >166.67 F3 >166.67 F8 >166.67 F9 >166.67 F10 >166.67 F11 24.05±2.38 F12 158±9.71 Asam Askorbat 3.36±0.29
Data pada Tabel 5 menunjukkan bahwa fraksi F11 dan F12 memiliki aktivitas antioksidan dengan nilai IC50 berturut-turut
24.05±2.38 dan 158±9.71 μg/mL. Fraksi yang memiliki aktivitas tertinggi adalah F11. Nilai ini lebih rendah daripada ekstrak kasar etil asetat yang memiliki IC50 sebesar 41.50±7.80
μg/mL sehingga daya inhibisi fraksi lebih kuat daripada ekstrak kasarnya. Fraksi F2-F10 tidak ada yang mencapaiinhibisi 50% hingga konsentrasi 166.67 μg/mL. Hal ini mengindikasikan bahwa komponen senyawa dalam fraksi tersebut tidak memiliki potensi sebagai antioksidan.
Fraksionasi Kromatografi Lapis Tipis Preparatif (KLTP) dan Aktivitas Antioksidan Fraksi Aktif
Fraksi F11 sebagai fraksi aktif dimurnikan lebih lanjut dengan KLTP. Berdasarkan pemisahan diperoleh 8 fraksi (F11.1-F11.8). Fraksi yang telah diperoleh kemudian masing-masing diuji aktivitas antioksidannya. Hal ini bertujuan menentukan potensi dari fraksi hasil KLTP sebagai antioksidan. Hasil pengujian aktivitas antioksidan terhadap 8 fraksi KLTP yang diperoleh dapat dilihat pada Tabel 6.
Tabel 6 Nilai IC50 pada fraksi hasil KLTP
Fraksi IC50 (μg/mL)
F11.1 28.22±7.35 F11.2 >166.67 F11.3 >166.67 F11.4 >166.67 F11.5 >166.67 F11.6 >166.67 F11.7 >166.67 F11.8 >166.67 Asam Askorbat 3.66±0.04
Fraksi hasil KLTP yang memiliki potensi paling baik dalam menghambat radikal bebas adalah fraksi F11.1 dengan nilai IC50 sebesar
28.22±7.35 μg/mL. Hasil ini apabila dibandingkan dengan data hasil uji antioksidan pada fraksi F11 ternyata mengalami penurunan aktivitas namun tidak berbeda nyata menurut uji Duncan (Lampiran 11). Hal ini dapat disebabkan karena komponen senyawa yang ada dalam fraksi tersebut telah dipisahkan sehingga efek inhibisi yang diperoleh lebih rendah sehingga fraksi F11 lebih baik dibanding dengan fraksi F11.1. Fraksi F11.2-F11.8 tidak mencapai inhibisi 50% hingga konsentrasi 166.67
μg/mL. Fraksi F11.1 yang paling aktif antioksidan diuji fitokimia. Uji fitokimia yang dilakukan bertujuan untuk mengetahui
senyawa metabolit sekundernya. Berdasarkan uji yang dilakukan F11.1 positif mengandung flavonoid (golongan flavonol glikosida) dan triterpenoid.
Analisis Spektrofotometer Infra Merah (IR)
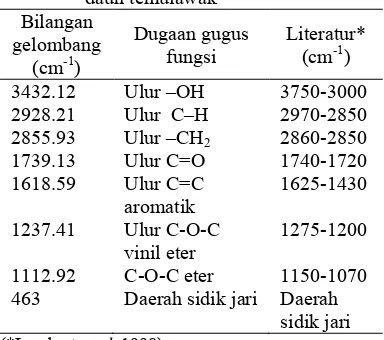
Fraksi F11.1 hasil KLTP kemudian dilakukan analisis menggunakan spektrofotometer IR. Teknik spektroskopi inframerah selain untuk mengetahui gugus fungsional suatu senyawa juga untuk mengidentifikasi senyawa, menentukan struktur molekul, mengetahui kemurnian, dan mempelajari reaksi yang sedang berjalan. Absorpsi molekul pada daerah inframerah umumnya disebabkan oleh perubahan tingkat energi vibrasi (Nur 1989). Spektrum inframerah dari fraksi F11.1 dapat dilihat pada Lampiran 12. Hasil absorpsi inframerah gugus fungsi fraksi F11.1 dapat dilihat pada Tabel 7.
Tabel 7 Absorpsi inframerah gugus fungsi fraksi F11.1 ekstrak etil asetat daun temulawak
Bilangan gelombang
(cm-1)
Dugaan gugus fungsi
Literatur* (cm-1)
3432.12 Ulur –OH 3750-3000 2928.21 Ulur C–H 2970-2850 2855.93 Ulur –CH2 2860-2850
1739.13 Ulur C=O 1740-1720 1618.59 Ulur C=C
aromatik
1625-1430
1237.41 Ulur C-O-C vinil eter
1275-1200
1112.92 C-O-C eter 1150-1070 463 Daerah sidik jari Daerah
sidik jari (*Lambert et al. 1998)
Hasil spektrum IR diperoleh gugus –OH, – CH, –CH2, C=O, C=C aromatik, C-O-C vinil
Gambar 7 Dugaan senyawa aktif dalam fraksi F11.1 ekstrak etil asetat daun temulawak adalah flavonol
SIMPULAN DAN SARAN
Simpulan
Ekstrak kasar etil asetat daun temulawak
(Curcuma xanthorrhiza) memiliki potensi
sebagai antioksidan dengan IC50 41.50±7.80
μg/mL dan asam askorbat sebagai kontrol positif dengan IC50 3.36±0.29 μg/mL. Hasil
fraksionasi kromatografi kolom dan KLTP diperoleh fraksi teraktif (F11.1) dengan IC50
28.22±7.35 μg/mL. Berdasarkan uji fitokimia dan spektroskopi inframerah terhadap F11.1 menunjukkan bahwa senyawa aktif sebagai antioksidan adalah flavonol.
Saran
Pemurnian lebih lanjut perlu dilakukan untuk mendapatkan senyawa yang berpotensi sebagai antioksidan. Karakteristik senyawa dapat diidentifikasi dengan spektroskopi NMR untuk mendapatkan senyawa penciri secara kuantitatif.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC
International. Revisi ke-2. Volume ke-1.
Maryland: AOAC International.
Amic D, Amic DD, Beslo D, Trinajstic. 2003. Structure-radical scavenging activity relationship of flavonoids. Croatia Chem Acta 76 (1): 55-61.
Ansel HC. 1989. Pengantar Bentuk Sediaan Farmasi Edisi ke-4. Jakarta: UI Pr.
Apak R, Guclu K, Ozyurek M, Celik SE, Karademir SE. 2007. Comparative
evaluation of various total antioxidant capacity assay applied to phenolic compounds with the CUPRAC assay.
Molecules 12: 1496-1547.
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J
Wood Sci 55: 230-235.
Blois MS. 1958. Antioxidant determination by the use of stable free radical. Nature 181: 1191-1200.
Halliwel B, Aeschbach R, Lolinger J, Auroma OI. 1995. Toxicology. J Food Chem 33: 601-617.
Hanani E, Munim A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam spons Callyspongia sp dari Kepulauan Seribu. Majalah Ilmu Kefarmasian 3: 127-133.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis
Tumbuhan. Ed ke-2. Kosasih P, Iwang S,
penerjemah; Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Harvey D. 2000. Modern Analytical
Chemistry 1st ed. New York:
McGraw-Hill.
Khopkar SM. 2003. Konsep Dasar Kimia
Analitik. Saptorahardjo A, penerjemah.
Terjemahan dari Basic Concepts of Analytical Chemistry. Jakarta: UI Pr.
Krishnaiah D, Sarbatly R, Nithyanandam R. 2010. A review of the antioxidant potential of medicinal plant species. J Food and
Bioproducts Processing, article in press.
DOI : 10.1016/j.fbp.2010.04.008.
Koleva I, van Beek T, Linnssen JPH, de Groot A, Evstarieva LN. 2002. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods. Phytochem Anal 13: 494-500.
Lambert JB, Shurvell HF, Lightner DA, Cooks RG. 1998. Organic Structural
Liu Y, Nair MG. 2012. Curcuma longa and
Curcuma mangga leaves exhibit functional
food property. Food Chem 135: 634-640.
Muchtaridi, Apriyantono A, Subarnas A, Budijanto S. 2003. Analysis of volatile active compounds of essential oils of some aromatic plants possessing inhibitory properties on mice locomotor activity.
Proceeding in International Symposium on
Biomedicine. Bogor: Biopharmaca Centre
IPB, 18-19 September. Tumbuhan Obat Indonesia 3: 23.
Nur MA, Adijuwana H. 1989. Teknik
Spektroskopi dalam Analisis Biologis.
Bogor: PAU IPB.
Nuratmi B, Adjirni, Paramitha DL. 1996. Penelitian farmakologis sambiloto
(Andrographis paniculata). Warta
Tumbuhan Obat Indonesia 3: 23.
Ozyurt D, Demirata B, Apak R. 2007. Determination of total antioxidant capacity by a new spectrophotometric method based on Ce (IV) reducing capacity measurement. Talanta 7: 1155–1165.
Pokorny J, Yanishlieva N, Gordon M. 2001.
Antioxidant in Food: Practical
Application. New York: CRC Pr.
Rouessac F, Rouessac A. 2007. Chemical Analysis: Modern Instrumentation
Methods and Techniques Second Edition.
England: J Wiley.
Sudewo B. 2004. Tanaman Obat Populer
Penggempur Aneka Penyakit. Jakarta:
Agro Media Pustaka.
Sudaryanti T, Sugiharti E. 1990. Budidaya
dan Penyulingan Nilam. Jakarta: Penebar
Swadaya.
Sukrasno, Kartika, Fidrianny I, Elfahmi, Anam K. 2012. Influence of Storage on the Volatile Oil Content of Curcuma
Rhizome. J Med Plant 6: 274-280.
Venkatesan P, Unnikrishnan MK, Kumar SM, Rao MNA. 2003. Effect of curcumin analogueson oxidation of haemoglobin and lysis of erythrocytes. Curr Sci 84: 74–78.
Lampiran 1 Bagan alir penelitian
Bunga temulawak Daun temulawak Distilasi air
Serbuk Bunga dan Daun Kadar air dan Kadar abu
Pengeringan 50oC, penggilingan
Ekstrak n-heksana Ampas Maserasi n-heksana
Ekstrak etil asetat Ampas
Maserasi etil asetat
Ekstrak metanol Ampas Maserasi metanol
Ekstrak pekat Dipekatkan
Ekstrak pekat Dipekatkan
Dipekatkan
Ekstrak pekat Uji Fitokimia
Uji Aktivitas Antioksidan
Ekstrak teraktif
Penentuan Eluen Terbaik Fraksionasi Kromatografi Kolom Uji Aktivitas Antioksidan
F5
Fraksi KLTP teraktif (F11.1)
Fraksionasi lanjut KLT preparatif
Uji Aktivitas Antioksidan
Uji Fitokimia
FTIR (golongan senyawa)
Senyawa aktif
Minyak atsiri
F6 F7 F8 F9 F4
F3 F2
F1 F10 F11 F12 F13
Lampiran 2 Isolasi minyak atsiri daun temulawak
Daun temulawak
Dipotong-potong
Distilasi dengan akuades (1:2)
Distilat
Waktu: 6 jam Suhu: 100-105oC
Minyak atsiri
Partisi dengan etil asetat Dipekatkan
Rendemen minyak atsiri Didiamkan 24 jam
Analisis (GC-MS)
Lampiran 3 Contoh perhitungan kadar air daun temulawak
Ulangan
Bobot
Sampel (g)
Bobot setelah
pengeringan (g)
Kadar Air
(%)
1 2.0004 1.8527
7.38
2 2.0007 1.8536
7.35
3 2.0018 1.8572
7.22
Rerata 7.32
Ulangan 1:
Kadar air %
Bobot Sampel Bobot Setelah Pengeringan
Bobot Sampel
%
.
g
.
.
g
g
%
= 7.38%
Rerata Kadar air %
.
.
.
. %
Lampiran 4 Contoh perhitungan kadar abu daun temulawak
Ulangan
Bobot
Sampel (g)
Bobot Abu (g)
Kadar Abu
(%)
1
2.0007 0.1683 8.41
2
2.0018 0.1674 8.36
3
2.0007 0.1700 8.50
Rerata 8.42
Ulangan 1:
Kadar Abu %
Bobot Sampel
Bobot Abu
%
.
.
%
= 8.41%
Lampiran 5 Contoh perhitungan rendemen ekstrak kasar daun temulawak
Sampel Pelarut
Rerata
kadar air
(%)
Bobot
sampel
(g)
Bobot
ekstrak
kasar (g)
Rendemen (%)
Basah Kering
Daun
n-Heksana
7.32 25
0.6929 2.77 2.99
0.8709 3.48 3.76
0.8610 3.44 3.72
Rerata 3.23 3.49
SD 0.40 0.43
Contoh perhitungan:
Rendemen bobot basah %
Bobot Ekstrak g
Bobot Sampel g
%
Rendemen bobot basah %
.
g
g
%
Rendemen bobot basah %
. %
Rendemen bobot kering %
Bobot Sampel g
Bobot Ekstrak g
Kadar Air
%
Rendemen bobot kering %
g
.
g
.
%
Rendemen bobot kering %
. %
Rerata Rendemen %
.
.
.
. %
Lampiran 6 Contoh perhitungan IC
50dengan metode penangkapan radikal bebas
DPPH untuk ekstrak teraktif (ekstrak etil asetat daun temulawak)
Konsentrasi (ug/mL) %inhibisi
Ulangan 1 Ulangan 2
10.00 21.88 29.12
13.33 24.74 34.57
16.67 28.01 39.89
33.33 31.25 41.62
66.67 46.11 48.14
100.00 68.92 70.88
133.33 78.22 77.79
166.67 83.83 82.71
IC50 47.01 μg/ml 35.98 μg/ml
Kurva regresi antara % inhibisi DPPH versus konsentrasi ekstrak (
μ
g/mL)
ulangan 1
Diperoleh persamaan regresi:
Y : 22.17 ln (x) – 35.36
50 : 22.17 ln (x) – 35.36
(x) : 47.01
μ
g/ml
Jadi IC
50dari ekstrak etil asetat daun temulawak ulangan 1 adalah 47.01
μ
g/ml.
Rata-rata nilai IC
50dengan metode penangkapan radikal bebas DPPH adalah:
Rerata
.
μ
g/ml
.
μ
g/ml
.
μ
g/ml
STDEV
∑
.
y = 22.17ln(x) - 35.36R² = 0.918
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 90.00
0 50 100 150 200
%
inhibisi
Lampiran 7 Hasil pencarian eluen terbaik dengan pelarut campuran untuk ekstrak
etil asetat daun temulawak
Eluen terbaik pelarut campuran
Fase
gerak
Komposisi fase gerak
n
-Heksana
Etil
asetat Metanol
1 1 0 0 2 0 1 0 3 0 0 1
4 0 1/2 1/2
5 1/2 0 1/2
6 1/2 1/2 0
7 1/3 1/3 1/3
8 2/3 1/6 1/6
9 1/6 2/3 1/6
10 1/6 1/6 2/3
Lampiran 8 Pengelompokan fraksi hasil kromatografi kolom ekstrak etil asetat
daun temulawak
Fraksi Warna Jumlah
Noda
Bobot fraksi
(g)
Rendemen (%)
1 Kuning
(+)
2
0.0058
1.16
2 Kuning
(++)
4
0.0129
2.58
3 Kuning
(+++)
6
0.0206
4.12
4 Hijau
(+++)
6
0.0165
3.3
5 Hijau
(++)
10
0.0212
4.24
6 Coklat
kehijauan(+++)
7
0.0166
3.32
7
Coklat kehijauan (++)
7
0.0214
4.28
8 Coklat
(+++)
9
0.0232
4.64
9 Coklat
(++)
9
0.0350
7.00
10 Kuning
kecoklatan
(+)
5
0.0262
5.24
11 Kuning
kecoklatan
(++) 6
0.0589
11.78
12 Hijau
(+++)
3
0.2126
42.52
13 Kuning
(+)
1
0.0339
6.78
Keterangan: (+) Kurang pekat
(++) Pekat
(+++) Sangat pekat
Lampiran 9 Kromatogram lapis tipis bioautografi antioksidan fraksi hasil
komatografi kolom
Lampiran 10 Hasil uji fitokimia fraksi kromatografi kolom
Fraksi
Noda
No
Rf Antioksidan Flavonoid
Steroid
Triterpenoid Alkaloid
1 1
0.84
+
+
2 0.94
2 1
0.59
2 0.68
+
+
3 0.74
+
4 0.94
+
+
3 1
0.53
2 0.60
3 0.66
+
+
4 0.74
5 0.90
6 0.96
+
+
+
4 1
0.45
+
+
2 0.59
3 0.74
4 0.85
+
+
5 0.91
6 0.94
+
+
5 1
0.31
+
2 0.38
3 0.46
4 0.53
+
5 0.61
+
6 0.66
+
+
7 0.74
+
+
8 0.84
+
9 0.91
+
10 0.95
+
6 1
0.41
+
2 0.56
3 0.62
4 0.65
5 0.73
6 0.83
7 0.91
7 1
0.47
+
2 0.51
3 0.58
+
4 0.64
5 0.74
+
Lanjutan Lampiran 10
Fraksi
Noda
No
Rf Antioksidan Flavonoid
Steroid
Triterpenoid Alkaloid
7 0.89
8 1
0.43
+
+
2 0.50
+
+
+
3 0.53
+
+
4 0.58
+
+
5 0.63
6 0.65
7 0.74
8 0.79
9 0.90
9 1
0.24
2 0.31
3 0.36
+
+
4 0.44
+
+
5 0.48
+
+
6 0.51
7 0.54
8 0.57
9 0.64
10 1
0.26 +
+
2 0.33
+
+
3 0.41
+
+
4 0.48
5 0.54
11 1
0.16 +
+
+
2 0.25
+
+
+
3 0.34
+
+
+
4 0.43
+
+
5 0.48
6 0.54
12 1
0.36 +
+
2 0.40
+
3 0.50
+
+
13 1
0.46
+
+
Lampiran 11 Uji Duncan terhadap nilai IC
50pada fraksi F11 dan F11.1
VAR00001
Duncan
VAR00002 N
Subset for alpha = 0.05
1 2
Ascorbic Acid 2 3.3550
F11 2 24.0450
F11.1 2 28.2200
Sig. 1.000 .419
Means for groups in homogeneous subsets are displayed.