OPTIMASI BEBERAPA METODE ELIMINASI VIRUS
PADA APEKS DAN MERISTEM TEBU
(Saccharum officinarum L.)
RARA PUSPITA DEWI LIMA WATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul "Optimasi Beberapa Metode Eliminasi Virus pada Apeks dan Meristem Tebu (Saccharum officinarum
L.)" adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Rara Puspita Dewi Lima Wati
NIM A253120111
RINGKASAN
RARA PUSPITA DEWI LIMA WATI. Optimasi Beberapa Metode Eliminasi Virus pada Apeks dan Meristem Tebu (Saccharum officinarum L.). Dibimbing oleh DARDA EFENDI dan IKA ROOSTIKA TAMBUNAN.
Tebu merupakan tanaman penghasil gula utama yang termasuk dalam family Gramineae. Umumnya, tanaman ini diperbanyak secara vegetatif dengan stek sehingga menjadi sangat mudah menyebarkan penyakit yang disebabkan oleh virus. Penyakit mosaik dapat menurunkan rendemen gula hingga 20-30%. Pada penelitian ini, dilakukan optimasi berbagai macam metode yang berpotensi diaplikasikan untuk mengeliminasi virus tanaman tebu, yaitu kultur apeks, kultur meristem, perlakuan air panas atau hot water treatment (HWT), perlakuan antiviral, dan pembekuan jaringan.
Tujuan penelitian ini adalah mengetahui pengaruh stres suhu tinggi (heat shock) dan bahan ribavirin terhadap daya hidup dan daya regenerasi apeks dan meristem tebu PS864, mengetahui pengaruh prakultur, durasi pemuatan, dan dehidrasi dalam krioprotektan PVS2 terhadap daya hidup dan daya regenerasi apeks tebu PS864 pasca-pembekuan dalam nitrogen cair. Penelitian terdiri dari lima percobaan, yaitu 1) optimasi HWT apeks pada tebu (HWT secara langsung, HWT secara tidak langsung tanpa saringan, dan HWT secara tidak langsung dengan saringan), 2) optimasi HWT (25, 30, 40, 50, dan 60 oC) dan bahan antiviral ribavirin (0, 15, 20, 25 µg l-1) pada apeks tebu, 3) optimasi HWT (25 dan 50 oC) dan bahan antiviral ribavirin (0, 15, 20, 25 µg l-1) pada meristem tebu, 4) optimasi dehidrasi jaringan dengan larutan PVS2 (0, 10, 20, 30, dan 40 menit), dan 5) optimasi pembekuan jaringan apeks dengan teknik vitrifikasi melalui perlakuan prakultur (sukrosa 0, 0.1, 0.3, dan 0.5 M selama 5 hari), lama pemuatan dalam larutan LS (0, 10, 20, dan 30 menit).
selama 5 hari dan pemuatan dalam larutan LS selama 10 menit serta dehidrasi jaringan dalam larutan PVS2 selama 30 menit merupakan metode pembekuaan jaringan yang optimal dengan daya hidup dan daya tumbuh mencapai 40%.
SUMMARY
vegetatively propagated by using its cutting node and potentially spreading viral diseases. Mosaic disease may reduce 20-30% sugar yield. These research, performed optimization methods that can be applied for virus elimination. In this study, several methods have been optimized to support virus elimination efforts through application of hot water treatment (HWT), antiviral, and freezing on apex and meristem tissues.The objectives of this study were to know the effect of temperature and antiviral agent on the survival and regeneration rate of apexes and meristems of sugarcane PS864, to know the effect of pre-culture, loading treatment and duration of dehydration in PVS2 to the survival and regeneration rate of sugarcane apexes of PS864 after freezing in liquid nitrogen. This study consisted of five experiments: 1) the optimization of HWT (direct thermotherapy, indirect thermotherapy with and without using metal sieve filter), 2) the optimization of HWT (25, 30, 40, 50, and 60 oC) and antiviral agent ribavirin (0, 15, 20, 25 µg l-1) on apexes, 3) the optimization of HWT (25 and 50 oC) and antiviral agent ribavirin (0, 15, 20, 25 µg l-1) on meristems, 4) the optimization of dehydration treatment (0, 10, 20, 30, and 40 minute), and 5) the optimization of freezing method by vitrification technique with preculture treatment (0, 0.1, 0.3, and 0.5 M sucrose for 5 days) and loading treatment with LS solution (0, 10, 20, dan 30 minutes).
The result showed that indirect HWT by using metal sieve filter was the best method. This method could decrease heat shock effect so that the apexes could grow after 50 oC treatment (25%) with regeneration rate of 4 shoots/explant. There was no interaction betwen HWT and antiviral agent. It showed that apexes could survive and grow after 50 oC (5%) or ribavirin treatment of 25 µg l-1 (57.97%) and could normally multiply on ribavirin containing media as well as their regeneration medium. However, combined treatment of HWT and antiviral agent showed no different response and interaction for survival, growth, and shoot number of meristem. Injury during isolation and high content of phenolic compound was assumed as the cause of low rate regeneration of meristem after treatment. Necrosis symptom of apexes was relatively low (< 3%) found in the ribavirin treatment of 20 and 25 µg l-1. Similar symptom did not appear on the meristem. On dehydration experiment, duration for 30 minutes was the best treatment. It was the longest periode that provide high level survival rate (74%). Post-freezing, the survival of apexes were affected by sucrose concentration on pre-culture medium. Pre-culture treatment with 0.3 M sucrose for 5 days and loading treatment for 10 minutes in LS and dehydration with PVS2 for 30 minutes was the optimal freezing method and resulted 40% survival rate.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
OPTIMASI BEBERAPA METODE ELIMINASI VIRUS
PADA APEKS DAN MERISTEM TEBU
(
Saccharum officinarum
L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Optimasi Beberapa Metode Eliminasi Virus pada Apeks dan Meristem Tebu (Saccharum officinarum L.)
Nama : Rara Puspita Dewi Lima Wati NIM : A253120111
Disetujui oleh Komisi Pembimbing
Dr Ir Darda Efendi, MSi Ketua
Dr Ika Roostika Tambunan, SP MSi Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 27 Agustus 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian ini ialah Optimasi Beberapa Metode Eliminasi Virus pada Apeks dan Meristem Tebu (Saccharum officinarum L.). Penulisan tesis ini dilakukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Pemuliaan dan Bioteknologi Tanaman, Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis tujukan kepada :
1. Bapak Dr Ir Darda Efendi, MSi dan Ibu Dr Ika Roostika Tambunan, SP MSi sebagai pembimbing yang telah memberikan fasilitas, arahan, bimbingan dan menyediakan waktunya sejak dari perencanaan dan pelaksanaan penelitian hingga penulisan tesis.
2. Dr Awang Maharijaya, SP MSi sebagai penguji luar komisi, atas kritik, saran dan masukannya yang sangat bermanfaat dalam penyusunan tesis ini.
3. Ibu Dr Ir Yudiwanti Wahyu EK, MS sebagai Ketua Program Studi Pemuliaan dan Bioteknologi Tanaman Sekolah Pascasarjana IPB dan Dr Dewi Sukma, SP MSi selaku Sekretaris Program Studi Pemuliaan dan Bioteknologi Tanaman Sekolah Pascasarjana IPB.
4. Program Hibah Kerjasama Kemitraan Penelitian dan Pengembangan Pertanian Nasional (KKP3N) yang telah mendanai penelitian ini.
5. Kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB Biogen) yang telah memberikan ijin penggunaan fasilitas pada Laboratorium Kultur Jaringan.
8. Bapak, Ibu, Kakak dan Ricki Susilo, serta Nenek Kurnia (Alm.) tercinta yang telah memberi dukungan dan doa selama menempuh studi.
9. Yosi Zendra Joni, Dea Sylva Lisnandar dan Lilis Surya Ningrum atas bantuan dan kebersamaannya dalam menyelesaikan penelitian ini baik dalam suka maupun duka.
10.Rekan–rekan sejawat PBT angkatan 2012 atas kebersamaannya selama perkuliahan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
Struktur dan Siklus Replikasi Virus 6
Virus Mosaik pada Tanaman Tebu 7
Aplikasi Kultur Apeks dan Meristem untuk Eliminasi Virus 7 Aplikasi Perlakuan Air Panas untuk Eliminasi Virus 8 Aplikasi Bahan Antiviral untuk Eliminasi Virus 8 Aplikasi Pembekuan Jaringan untuk Eliminasi Virus 9
2 OPTIMASI PERLAKUAN AIR PANAS PADA APEKS TEBU 11
Pendahuluan 11
Bahan dan Metode 11
Hasil dan Pembahasan 13
Simpulan 19
3 OPTIMASI PERLAKUAN AIR PANAS DAN BAHAN ANTIVIRAL PADA
APEKS TEBU 21
Pendahuluan 21
Bahan dan Metode 21
Hasil dan Pembahasan 22
Simpulan 23
4 OPTIMASI PERLAKUAN AIR PANAS DAN BAHAN ANTIVIRAL PADA
MERISTEM TEBU 26
Pendahuluan 26
Bahan dan Metode 26
Hasil dan Pembahasan 27
Simpulan 29
5 OPTIMASI PEMBEKUAN JARINGAN APEKS TEBU 30
Pendahuluan 30
Bahan dan Metode 30
Hasil dan Pembahasan 31
6 PEMBAHASAN UMUM 37
7 SIMPULAN DAN SARAN 39
Simpulan 39
Saran 39
DAFTAR PUSTAKA 40
LAMPIRAN 44
DAFTAR TABEL
1. Pengaruh kombinasi perlakuan HWT dan ribavirin terhadap daya hidup
dan daya tumbuh apeks tebu PS864, 5 MST 22
2. Pengaruh HWT dan ribavirin terhadap pertumbuhan meristem tebu
PS864, 8 MST 27
3. Pengaruh durasi dehidrasi jaringan dengan PVS2 terhadap pertumbuhan
apeks tebu PS864, 4 MST 32
DAFTAR GAMBAR
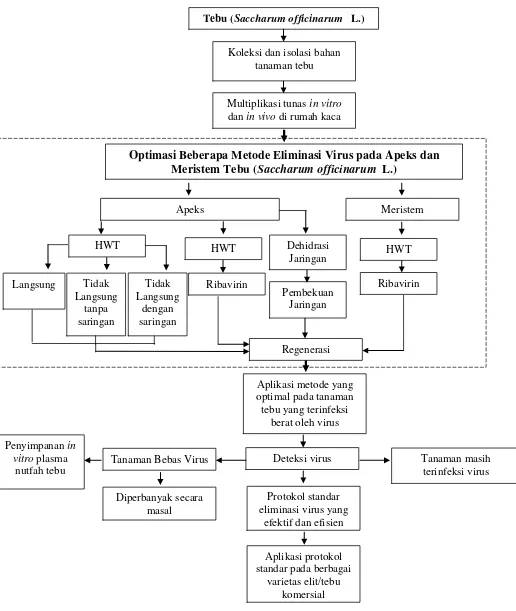
1. Diagram alir penelitian 4
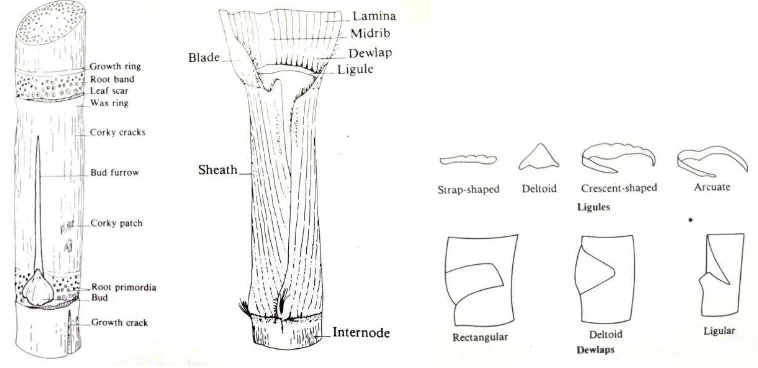
2. Struktur batang dan daun tebu 5
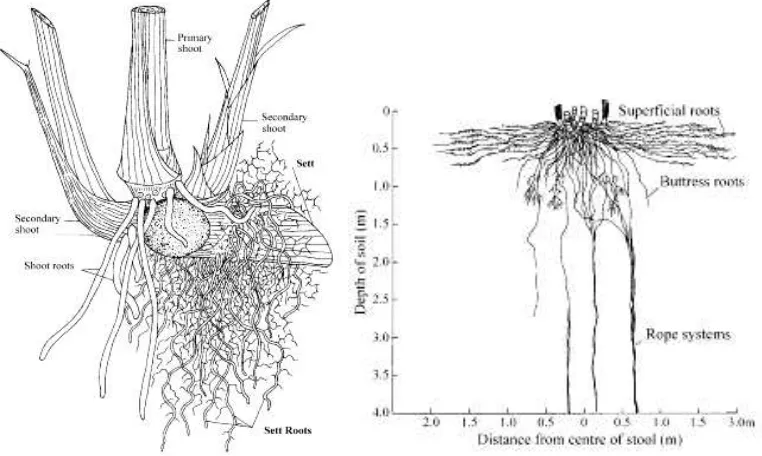
3. Struktur akar tebu 6
4. Struktur kimia ribavirin 9
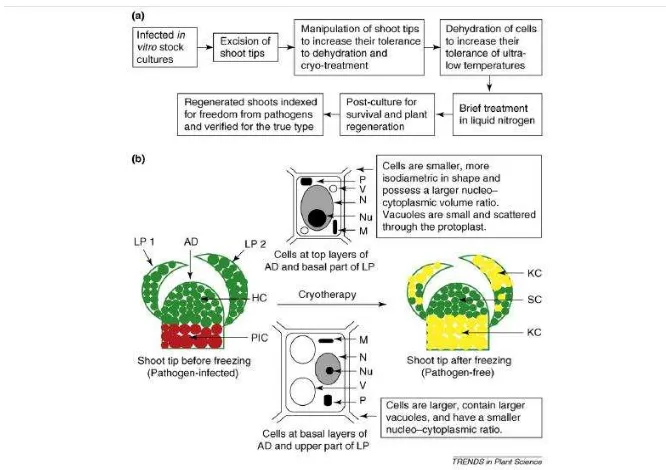
5. Mekanisme eliminasi patogen dengan teknik krioterapi 9
6. Tiga macam metode HWT apeks tebu PS864 13
7. Pengaruh HWT secara langsung terhadap daya hidup dan daya tumbuh
apeks tebu PS864, 4 MST 14
8. Pengaruh perlakuan HWT secara langsung terhadap jumlah tunas yang
terbentuk dari apeks tebu PS864 15
9. Pengaruh HWT secara tidak langsung tanpa saringan terhadap daya hidup dan daya tumbuh apeks tebu PS864, 4 MST 16 10.Pengaruh HWT secara tidak langsung tanpa saringan terhadap jumlah
tunas yang terbentuk dari apeks tebu PS864 16
11.Pengaruh HWT secara tidak langsung dengan saringan terhadap daya hidup dan daya tumbuh apeks tebu PS864, 4 MST 17 12.Pengaruh HWT secara tidak langsung dengan saringan terhadap jumlah
tunas yang terbentuk dari apeks tebu PS864 18
13.Pengaruh HWT terhadap sel-sel penyusun meristem dari apeks tebu
PS864 18
14.Pertumbuhan apeks tebu PS864 yang diberi tiga macam perlakuan
HWT 20
15.Nekrosis dari biakan tebu PS864 yang berasal dari apeks
pasca-perlakuan ribavirin dan suhu HWT 23
16.Pertumbuhan apeks tebu PS864 yang diberi perlakuan HWT dan
ribavirin, 5 MST 25
17.Pencoklatan yang berpengaruh terhadap daya tumbuh meristem tebu
PS864 28
18.Penampilan biakan tebu PS864 yang dihasilkan dari meristem yang
diberi perlakuan HWT dan ribavirin 28
19.Pengaruh lama perendaman dalam PVS2 terhadap regenerasi apeks tebu
PS864 32
20.Pengaruh molaritas sukrosa pada tahap prakultur terhadap elongasi tunas dan pencoklatan jaringan apeks tebu PS864. 33 21.Penampilan biakan tebu PS864 setelah perlakuan prakultur dengan
sukrosa 0, 0.1, 0.3, dan 0.5 M. 34
22.Penampilan biakan tebu PS864 pasca-pembekuan jaringan 36 23.Perbandingan perlakuan HWT, ribavirin, dan pembekuan jaringan
DAFTAR LAMPIRAN
1. Komposisi Media Dasar Murashige & Skoog (MS) 44
PENDAHULUAN
Latar Belakang
Tebu (Saccharum officinarum L.) merupakan tanaman penghasil gula utama di Indonesia. Tanaman yang berasal dari famili Gramineae ini merupakan tanaman asli dari daerah beriklim tropika basah, namun masih dapat tumbuh baik dan berkembang di daerah subtropika, pada berbagai jenis tanah dari daratan rendah hingga ketinggian 1 400 m di atas permukaan laut (dpl) (Ditjenbun 2013).
Produksi gula pada tahun 2013 sebesar 2.58 juta ton ((Ditjenbun 2014a) dengan perkiraan konsumsi rumah tangga 1.68 juta ton (Ditjenbun 2014b), namun kebutuhan konsumsi gula nasional diduga akan meningkat pada tahun 2014 mencapai 3.10 juta ton (http://ditjenbun.pertanian.go.id/). Untuk memenuhi kebutuhan tersebut, perlu dilakukan upaya meminimalkan faktor penyebab turunnya nilai produksi. Salah satu faktor yang mengakibatkan penurunan produksi gula adalah permasalahan hama dan penyakit tanaman.
Tebu merupakan tanaman yang diperbanyak secara vegetatif menggunakan stek batang. Perbanyakan secara vegetatif berpotensi menyebarkan penyakit tanaman. Salah satu penyakit tanaman yang menurunkan produksi tebu adalah penyakit mosaik. Efek utama dari infeksi virus mosaik adalah terhambatnya pertumbuhan batang sehingga tanaman mengalami penurunan rendemen 30─40% (Bailey 2004). Penggunaan benih tebu bebas virus dapat menjadi alternatif untuk mengatasi permasalahan tersebut. Benih yang bebas virus dapat diperoleh melalui penerapan metode eliminasi virus, antara lain metode kultur apeks, kultur meristem, perlakuan air panas/HWT, perlakuan kimia, dan pembekuan jaringan.
Kultur meristem merupakan aplikasi yang umum digunakan dalam mengeliminasi virus. Namun memiliki kendala secara teknis karena ukurannya yang sagat kecil. Oleh karena itu, dilakukan pengujian metode eliminasi virus lainnya seperti HWT, perlakuan bahan kimia, dan pembekuan jaringan. HWT berhasil mengeliminasi virus pada bawang putih (Robert et al. 1998), anggur (Maliogka et al. 2009), tebu (Maharlika 2009; Damayanti et al. 2010), dan nilam (Noveriza et al. 2012). Metode tersebut dapat mengeliminasi virus pada suhu yang optimal (55‒60 ˚C), namun daya regenerasinya rendah sehingga perlu diperoleh suhu HWT mendekati suhu optimal virus tereliminasi tetapi memiliki daya regenerasi yang tinggi. Keefektifan metode tersebut dapat ditingkatkan dengan melakukan kombinasi metode eliminasi virus lainnya seperti perlakuan kimia. Perlakuan kimia yang digunakan untuk eliminasi virus umumnya menggunakan bahan antiviral seperti ribavirin (1-β-ᴅ -ribofuranosyl-1,2,4-triazole-3-carboxamide). Ribavirin belum mampu mengoptimalkan eliminasi potato leafroll virus (PLRV), Potato virus X (PVX), Potato virus Y (PVY), dan Potato virus S
(PVS) tanaman kentang (Gunaeni dan Karjadi 2011), namun metode tersebut efektif jika dikombinasikan dengan HWT pada tanaman pir (Hu et al. 2012).
2
kondisi tersebut, sel-sel tanaman tidak melakukan aktivitas metabolik dengan viabilitas yang tetap terjaga sehingga bahan tanaman dapat disimpan dalam jangka waktu yang lama, tanpa harus dilakukan subkultur berulang-ulang (Widyastuti 2000; Roostika dan Mariska 2003). Teknik tersebut telah berhasil mengeliminasi virus pada tanaman Prunus(Brison et al. 1997) dan anggur (Wang et al. 2003).
Salah satu teknik dalam kriopreservasi adalah teknik vitrifikasi. Vitrifikasi adalah pembentukan struktur menyerupai kaca (meta-stable glass) pada suhu yang sama dengan atau di bawah titik beku larutan tertentu. Teknik ini merupakan salah satu teknik baru yang dapat mendehidrasi sebagaian air dari eksplan, yang diikuti dengan pembekuan cepat. Teknik vitrifikasi dilakukan dengan bantuan krioprotektan pada suhu 0–25 °C dan diikuti oleh pembekuan, pelelehan dan regenerasi (Roostika dan Mariska 2003; Tjokrokusumo 2004; Leunufna 2007). Beberapa jenis tanaman yang sudah disimpan dengan teknik tersebut antara lain purwoceng (Roostika et al. 2007; 2008), ubi kayu (Roostika et al. 2004a), ubi jalar (Roostika et al. 2004b), damar (Djam’an et al. 2006), dan kakao (Adu-Gyamfi 2012). Metode kultur apeks, kultur meristem, termoterapi, kemoterapi, dan krioterapi telah terbukti efektif dalam mengeliminasi virus tanaman, namun seringkali terkendala oleh faktor teknis, seperti thermo-shock, serta kerusakan mekanik dan kimia sehingga berpengaruh dalam pertumbuhan eksplan. Optimasi metode tersebut perlu dilakukan terlebih dahulu untuk memperoleh metode eliminasi virus yang optimal. Oleh karena itu, pada penelitian ini dilakukan optimasi perlakuan air panas, bahan antiviral, dan pembekuan jaringan apeks dan meristem tebu.
Tujuan Penelitian
Tujuan dari penelitian ini adalah 1) mengetahui pengaruh stres suhu tinggi terhadap daya hidup dan daya regenerasi apeks tebu PS864, 2) mengetahui pengaruh stres suhu dan bahan antiviral terhadap daya hidup dan daya regenerasi apeks dan meristem tebu PS864, 3) mengetahui pengaruh durasi dehidrasi dalam krioprotektan PVS2 terhadap daya hidup dan daya regenerasi apeks tebu PS864, 4) mengetahui pengaruh kombinasi perlakuan prakultur dan pemuatan terhadap daya hidup dan daya regenerasi apeks tebu PS864 pasca-pembekuan dalam nitrogen cair.
Hipotesis Penelitian
Hipotesis dalam penelitian ini adalah: 1) apeks tebu PS864 mampu bertahan hidup dan tumbuh pasca-perlakuan HWT pada suhu 50 oC, 2) terdapat interaksi antara perlakuan HWT dan ribavirin terhadap daya hidup dan tumbuh apeks dan meristem tebu PS864, 3) apeks tebu PS864 dapat bertahan hidup dan tumbuh hingga durasi rendaman selama 30 menit dalam larutan PVS2, 4) kombinasi pra-kultur dan pemuatan dapat meningkatkan daya hidup dan daya regenerasi apeks tebu PS864 pasca-pembekuan dalam nitrogen cair.
Manfaat Penelitian
3 pada tanaman tebu. Teknologi yang dihasilkan dari penelitian ini diharapkan dapat berkontribusi dalam upaya peningkatan produksi tebu dengan menyediakan teknologi produksi benih yang bebas virus.
Ruang Lingkup Penelitian
4
5
1
TINJAUAN PUSTAKA
Botani dan Morfologi Tebu
Tebu (Saccharum officinarum L.) merupakan tanaman monokotil dari famili Gramineae dan genus Saccharum. S. officinarum L. merupakan tanaman yang memiliki kadar gula paling tinggi di antara spesies lainnya (Ming et al.
2006). Spesies tersebut merupakan tanaman asli dari daerah beriklim tropika basah yang dapat tumbuh dan berkembang dengan baik di wilayah subtropika dari dataran rendah hingga 1 400 m di atas permukaan laut (dpl) (Ditjenbun 2013). Tanaman tersebut telah ditemukan di Papua Nugini beberapa abad silam dan tersebar di Asia Selatan hingga ke arah tenggara (James 2004).
Tebu merupakan tanaman tahunan yang memiliki tinggi sekitar 2–4 m dengan lebar batang 5 cm. Batang tebu terdiri dari dua bagian, yaitu nodus dan internodus. Nodus tersebar dengan jarak 15‒25 cm dengan satu mata tunas. Nodus terdiri dari lingkaran tumbuh (growth ring), berkas akar (root band), bekas luka daun (leaf scar), sedangkan internodus terletak di antara nodus berjumlah 20─30 ruas. Warna batang dipengaruhi banyak faktor. Batang memiliki dua pigmen dasar, yaitu antosianin (merah dan biru) pada sel epidermal dan klorofil (hijau) pada jaringan dalam (James 2004).
Daun tebu melekat dengan batang pada bagian dasar nodus. Setiap daun terdiri dari dua bagian, yaitu bagian yang melekat (sheath) dan bagian yang tidak melekat (blade atau lamina). Sheath berbentuk seperti pipa dan menyelimuti batang. Ketika memasuki masa panen, maka daun tumbuh dalam bentuk lamina.
Ligula merupakan helaian tambahan pada sheath, yang terbentuk dari perpanjangan sel parenkima. Ligula berbentuk transparan tetapi pada saat tua mengering, berubah warna dan mudah robek. Ligula terdiri dari empat tipe, yaitu berbentuk tali (strap-shaped), delta (deltoid), sabit (crescent-shaped), arkuata (arcuate). Dewlaps merupakan bentuk baji, yang tediri dari beberapa tipe seperti berbentuk persegipanjang (rectangular), delta (deltoid), dan ligular (Gambar 2) (James 2004).
6
Inisiasi akar pada tanaman tebu terjadi segera setelah batang awal (sett) ditanam dengan minimal satu mata tunas (bud). Akar pertama yang terbentuk adalah akar dari bagian sett (sett root) dan dilanjutkan dengan pertumbuhan akar tunas (shoot root) (James 2004; Smith et al. 2005). Akar sett dapat muncul 24 jam setelah penanaman. Akar ini akan tumbuh dengan baik dan bercabang selama minggu-minggu pertama perkecambahan. Akar kedua yaitu akar tunas akan muncul berasal dari dasar tunas yang baru, 5‒7 hari setelah tanam. Akar tersebut lebih tebal dan berair dibandingkan dengan akar sett yang kemudian akan berkembang menjadi akar utama (Smith et al. 2005). Akar sett akan tumbuh untuk memenuhi air dan nutrisi selama pertunasan, namun akan mati ketika fungsinya tergantikan oleh akar tunas yang baru (Gambar 3) (James 2004; Smith et al. 2005).
Tebu memiliki beberapa variasi sistem akar yaitu antara lain, akar dangkal (superficial root), akar penopang (buttress root), dan sistem tali (rope system). Akar dangkal berfungsi menyerap air dan nutrisi di dalam tanah selama pertumbuhan. Akar penopang berfungsi menjaga kestabilan tanaman, sedangkan akar dengan sistem tali merupakan akar yang dapat menembus hingga kedalaman 3‒6 m (James 2004).
Gambar 3. Struktur akar tebu (Smith et al. 2005) Struktur dan Siklus Replikasi Virus
7 untuk membuat protein sendiri sehingga mengambil alih fungsi sel inangnya untuk bereplikasi (Cambell et al. 2006).
Virus memiliki dua macam siklus replikasi, yaitu siklus litik dan siklus lisogenik. Siklus litik merupakan siklus yang menyebabkan kematian sel inangnya. Gen-gen virus dengan cepat mengubah sel inang menjadi semacam pabrik untuk memproduksi asam amino dan proteinnya. Tahap akhir dari siklus tersebut adalah lisisnya dinding sel inang dan melepaskan virus baru yang dapat menginfeksi tanaman sehat lainnya. Berbeda dengan siklus litik, siklus lisogenik mereplikasi genomnya tanpa menghancurkan inang. Molekul DNA atau RNA dimasukkan ke dalam genom inang melalui rekombinasi genetik seperti pindah silang. Ketika terjadi pembelahan sel, maka DNA inang bersamaan dengan DNA atau RNA virus bereplikasi sehingga menurunkan salinannya ke sel anaknya. Mekanisme tersebut membuat virus dapat bereplikasi tanpa membunuh inangnya. Namun pada kondisi tertentu, siklus replikasi virus dapat berubah dari siklus litik menjadi siklus lisogenik (Cambell et al. 2006).
Virus Mosaik pada Tanaman Tebu
S. Officinarum L. merupakan salah satu spesies Saccharum yang paling mudah terserang penyakit dibandingkan dengan spesies lainnya. Menurut Bailey (2004), terdapat beberapa alasan yang menyebabkan spesies tersebut sangat mudah terserang penyakit. Tanaman tersebut biasanya dibudidayakan dalam area yang sangat luas dan kontinyu sehingga penyakit sangat mudah berkembang dan menyebar. Tanaman tersebut juga diperbanyak secara vegetatif dan dibudidayakan dengan stek dan ratun. Hal ini mengakibatkan perkembangan penyakit menjadi sangat efektif dan terus berulang setiap siklus tumbuhnya.
Terdapat beberapa jenis penyakit tebu, baik yang disebabkan oleh jamur, bakteri, maupun virus. Pada beberapa tahun terakhir, penyakit yang disebabkan oleh virus merupakan salah satu masalah yang sangat serius. Salah satunya adalah penyakit mosaik yang disebabkan oleh sugarcane mosaic virus (SCMV). Penyakit mosaik dapat menurunkan rendemen tebu hingga 30─40% (Bailey 2004). Mosaik tersebar diseluruh perkebunan tebu dan dilaporkan terdapat tujuh tipe mosaik di daerah Jawa di Indonesia (Mirzawan et al.1996).
Secara visual, mosaik diidentifikasi pada pola klorosis pada helai daun. Pada awal serangan, gejala menyerupai pola mosaik pada kain perca yang kemudian berkembang pada daerah sekitarnya sepanjang lamina daun. Beberapa klon tebu menunjukkan reaksi yang lebih parah seperti kemerah-merahan dan nekrosis pada jaringan yang terinfeksi (Smith 1996).
Aplikasi Kultur Apeks dan Meristem untuk Eliminasi Virus
8
plasmodesmata, perkembangan selnya yang cepat, dan terjadinya persaingan nukleotida untuk pembelahan sel dengan replikasi virus, serta adanya zat inhibitor (Bittner et al. 1989). Apeks memiliki ukuran yang proposional sehingga memiliki kemampuan regenerasi yang baik daripada meristem, namun tingkat eliminasi virus lebih efektif dengan ukuran apeks yang lebih kecil (0.2─0.4 mm) (Wang dan Valkonen 2008). Menurut Ramgareeb et al. (2010), meristem dengan ukuran kurang dari 1 mm merupakan bahan yang optimal untuk mendapatkan tanaman yang bebas virus, namun memiliki daya tumbuh yang rendah, yaitu sekitar 46% pada tanaman tebu.
Aplikasi Perlakuan Air Panas untuk Eliminasi Virus
Perlakuan air panas atau yang juga dikenal dengan nama termoterapi, merupakan salah satu metode eliminasi virus melalui perendaman air panas. Metode tersebut pertama kali dilakukan untuk mengeliminasi virus kentang pada tahun 1949 (Kaiser 1980). Metode tersebut dapat mengurangi jumlah virus pada suhu yang tinggi. Suhu yang lebih tinggi dari suhu optimal yang digunakan untuk pertumbuhan tanaman dapat menekan multiplikasi patogen dan meningkatkan degradasi RNA virus (Wang dan Valkonen 2008). Menurut Damayanti et al.
(2010), titik inaktivasi termal sugarcane streak mosaic virus (SCSMV) adalah antara suhu 55‒60 oC, namun suhu tersebut lebih tinggi dari titik kematian termal jaringan tebu. Suhu 53 oC selama 10 menit merupakan suhu di mana tanaman mampu bertahan hidup dan tumbuh, namun tidak semua biakan bebas virus SCSMV. Ramgareeb et al. (2010) menambahkan bahwa perlakuan air panas pada meristem dengan ukuran kurang dari 2 mm merupakan metode yang efektif dalam menghasilkan tanaman tebu yang bebas virus. Metode tersebut lebih efektif meningkatkan daya tumbuh tebu daripada hanya melalui kultur meristem dengan ukuran kurang dari 1 mm.
Aplikasi Bahan Antiviral untuk Eliminasi Virus
9 (virazole) 40 dan 60 mg l-1 selama 6‒8 minggu sangat efektif dalam mengeliminasi virus pada tanaman gladiol.
Gambar 4. Struktur kimia ribavirin (Keya et al. 2003)
Aplikasi Pembekuan Jaringan untuk Eliminasi Virus
Pembekuan jaringan atau yang dikenal dengan metode kriopreservasi, merupakan metode yang digunakan dalam penyimpanan plasma nutfah pada suhu ekstrim rendah atau dengan menggunakan nitrogen cair (-196 oC) (Kartha 1985). Metode kriopreservasi juga dapat digunakan untuk mengeliminasi patogen yang ada pada jaringan tanaman sehingga disebut juga sebagai metode krioterapi. Pembekuan jaringan dilaporkan dapat mengeliminasi tujuh kelompok virus yang tidak berkerabat dan dua tipe bakteri pada mata tunas, akar dan umbi kentang (Solanum tuberosum L.; Solanaceae), ubi (Ipomoea batatas [L.] Lam.;
Convolvulaceae), anggur (Vitis vinifera L.; Vitaceae), Citrus spp. dan Prunus (Rosaceae), tanaman berry (Rubus idaeus L.; Rosaceae) dan kumpulan sel meristematik pisang (Musa spp.; Musaceae) (Wang dan Valkonen 2008).
10
Pembekuan jaringan memberikan manfaat berdasarkan perbedaan sifat fisiologi dan anatomi antara sel meristem dengan sel pada jaringan lainnya. Sel yang terinfeksi dapat hancur akibat perlakuan suhu rendah dalam nitrogen cair. Sel meristem yang bebas virus akan mampu tumbuh dan berdiferensiasi membentuk tunas baru, sehingga tanaman yang tumbuh terbebas dari virus (Gambar 5) (Wang dan Valkonen 2008).
11
2
OPTIMASI PERLAKUAN AIR PANAS PADA APEKS
TEBU
Pendahuluan
Mosaik merupakan salah satu penyakit pada tanaman tebu. Penyakit mosaik sangat mudah menyebar pada tanaman yang diperbanyak secara vegetatif. Efek utama dari infeksi virus mosaik adalah terhambatnya pertumbuhan batang sehingga tanaman mengalami penurunan rendemen 20‒30% (Bailey 2004). Pada tebu varietas PS864, penyakit mosaik dapat menurunkan potensi hasil mencapai 22% (Asnawi 2009). Oleh karena itu, diperlukan benih tebu yang bebas virus dengan menerapkan berbagai metode eliminasi virus.
Kultur meristem merupakan salah satu metode eliminasi virus yang umum digunakan, namun secara teknis sulit dilakukan dan daya regenerasi meristem rendah, mengakibatkan perlunya dilakukan metode eliminasi virus lainnya. Apeks merupakan struktur yang terdiri dari meristem (lateral atau apikal) yang mengandung primordia daun. Apeks memiliki ukuran yang proposional sehingga memiliki kemampuan regenerasi yang lebih tinggi daripada meristem (Bittner et al., 1989; Wang dan Valkonen, 2008; El Fardan Ashoub, 2009). Ukuran apeks yang lebih besar daripada meristem dapat mengurangi tingkat efektivitas dalam mengeliminasi virus sehingga akan lebih efektif jika dikombinasikan dengan metode lainnya, seperti perlakuan air panas atau dikenal dengan HWT.
Metode HWT banyak dilakukan pada bagal tebu dengan tingkat eliminasi virus dan daya hidup yang rendah pada suhu tinggi. Hal tersebut dilaporkan oleh Maharlika (2009), di mana HWT pada bagal tebu pada suhu 55 oC selama 20‒30 menit hanya dapat mengurangi intensitas serangan SCSMV 9.1‒9.9%. Oleh sebab itu, penggunaan apeks diharapkan dapat meningkatkan efektivitas eliminasi virus. Namun demikian, HWT seringkali mengakibatkan thermo-shock pada tanaman sehingga tanaman tidak dapat hidup dan beregenerasi akibat perlakuan suhu tinggi. Sebaliknya, titik inaktivasi termal virus mendekati titik termal kematian tanaman tersebut (Damayanti et al. 2010). Metode HWT yang optimal adalah metode yang mampu meningkatkan daya hidup tanaman mendekati titik termal inaktivasi virus. Oleh sebab itu, penelitian ini bertujuan untuk mengetahui pengaruh HWT terhadap pertumbuhan tanaman.
Bahan dan Metode
Penelitian dilaksanakan pada bulan April hingga Agustus 2013 di Unit Produksi Benih Unggul Pertanian, Badan Penelitian dan Pengembangan Pertanian dan Laboratorium Kultur Jaringan Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Cimanggu, Bogor. Uji Histologi dilakukan di Laboratorium Pertumbuhan dan Perkembangan Tumbuhan, Fakultas Biologi Universitas Gajah Mada (UGM).
Eksplan yang digunakan berupa apeks tebu PS864 (subkultur ke-7-9) yang terdiri atas dome dengan 5 primordia daun (LP5). Bahan kimia yang digunakan adalah media MS (Murashige dan Skoog 1962), 6-benzyl-adenine (BA), dan
12
destilata, alkohol, spritus, dan phytagel. Alat-alat yang akan digunakan meliputi
laminar air flow cabinet (LAF), otoklaf, alat tanam seperti pinset, scalpel, bunsen, dan botol tanam.
Penelitian terbagi atas tiga macam percobaan, yaitu metode HWT secara langsung, metode HWT tidak langsung tanpa saringan, dan metode HWT secara tidak langsung dengan saringan (Gambar 6). Setelah perlakuan HWT, eksplan ditanam pada media regenerasi (MS + BA 0.3 ppm). Pengamatan dilakukan selama 4 minggu. Peubah yang diamati meliputi jumlah eksplan yang hidup, jumlah eksplan membentuk tunas, dan jumlah tunas yang terbentuk.
Percobaan disusun dalam lingkungan Rancangan Acak Lengkap. Data percobaan dianalisis dengan analisis ragam (ANOVA) menggunakan program
Statistik Analysis Software (SAS versi 9). Nilai rata-rata dihitung dan dibandingkan menggunakan uji selang berganda duncan (DMRT) pada taraf 5% (P<0.05).
HWT secara langsung
Pada HWT secara langsung (Gambar 6A), tunas diisolasi hingga diperoleh apeks. Selanjutnya, apeks diberi perlakuan HWT (25 (kontrol), 30, 40, 50, dan 60 o
C) selama 30 menit dan ditanam pada media regenerasi. Perlakuan diulang sebanyak 5 kali dengan 5 eksplan per botol, sehingga jumlah total eksplan adalah 125 apeks. Eksplan diinkubasi pada suhu 20 ± 2 oC dengan pencahayaan 1000 lux dan fotoperiodisitas 16 jam.
HWT secara tidak langsung tanpa saringan
Pada metode HWT secara tidak langsung tanpa saringan (Gambar 6B), tunas pucuk tunggal yang terdiri dari 4‒5 daun diberi perlakuan HWT (25 (kontrol), 30, 40, 50, dan 60 oC) selama 30 menit. Penstabilan suhu dilakukan secara berkala melalui penambahan air panas setiap penurunan 3 oC. Setelah itu, apeks diisolasi dan ditanam pada media regenerasi. Perlakuan diulang sebanyak 5 kali dengan 3 eksplan per botol, sehingga jumlah total eksplan adalah 75 apeks. Apeks diinkubasi pada suhu 20 ± 2 oC dengan pencahayaan 1000 lux dan fotoperiodisitas 16 jam.
HWT secara tidak langsung dengan saringan
13 Analisis Histologi
Analisis histologi (Sutikno 2014) dilakukan terhadap sampel biakan yang berasal dari perlakuan HWT pada suhu 25 (kontrol) dan 60 oC. Tahapan analisis histologi ditampilkan pada Lampiran 2. Pengamatan mikroskopis dilakukan dengan perbesaran 400x. Anatomi jaringan apeks yang diperlakukan dengan HWT 60 oC beserta kontrolnya diperbandingkan. Jaringan yang bertahan hidup ditandai dengan pekatnya warna pada daerah meristem. Dehidrasi jaringan ditandai dengan mengkerutnya sel-sel penyusun jaringan meristem (Melo et al.
2010).
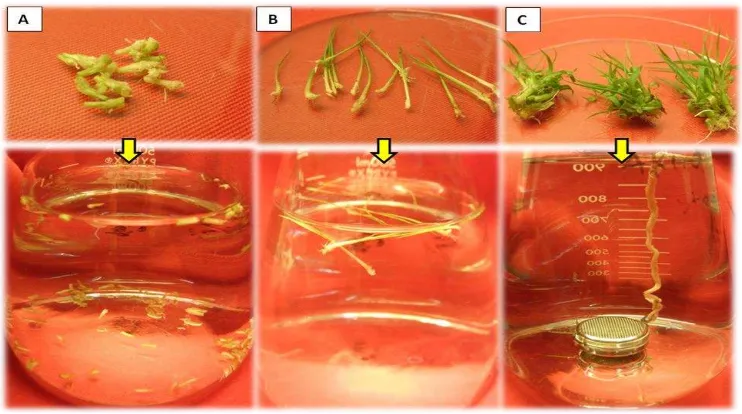
Gambar 6. Tiga macam metode HWT apeks tebu PS864: (A) HWT secara langsung, (B) HWT secara tidak langsung tanpa saringan, (C) HWT secara tidak langsung dengan saringan
Hasil dan Pembahasan
Pada tiga hari setelah perlakuan, apeks menunjukkan respon yang berbeda, yaitu jaringan memutih (menandakan mati), jaringan yang mencoklat kemudian diikuti dengan pembentukan jaringan yang berwarna hijau (menandakan hidup), dan jaringan daun yang memanjang (menandakan tumbuh). Selama 4 minggu setelah tanam (MST), apeks yang diberi perlakuan HWT mampu bermultiplikasi membentuk tunas baru tanpa diiringi pembentukan akar maupun kalus. Respon tersebut terlihat pada ketiga macam metode HWT yang diujikan.
HWT secara Langsung
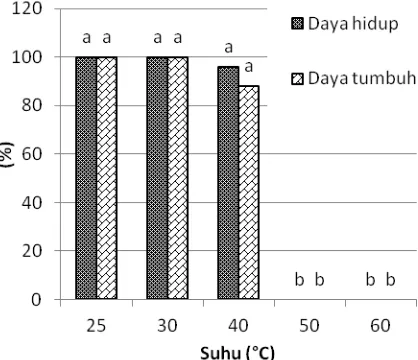
Apeks hanya mampu bertahan hidup pasca-perlakuan suhu 25, 30 dan 40 o
14
terutama membran sel dan proses fisiologis, serta kerusakan oksidatif (Ali et al.
2005; Al-Whaibi 2011; Roostika et al., 2013). Bowen et al. (2002) juga menambahkan bahwa perlakuan HWT pada kisaran suhu 39‒45 oC mengakibatkan adanya penurunan sintesis protein, peningkatan protein degradasi dan penurunan agregasi ribosom. Pada penelitiannya HWT 42 oC selama 1 jam dapat menurunkan persentase sel yang hidup pada apel hingga 50%. Pada penelitian ini suhu tinggi mengakibatkan apeks sulit tumbuh dan bermultiplikasi.
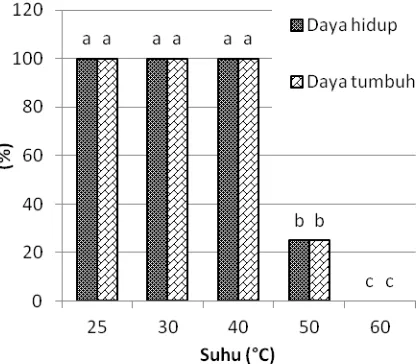
Gambar 7. Pengaruh HWT secara langsung terhadap daya hidup dan daya tumbuh apeks tebu PS864, 4 MST. Huruf di atas balok data menunjukkan perbandingan nilai tengah antar-suhu pada daya hidup dan daya tumbuhnya berdasarkan uji DMRT pada taraf 5%
Pengaruh thermo-shock juga terlihat pada daya tumbuh biakan. Tidak semua apeks yang mengalami elongasi dapat tumbuh dan bermultiplikasi. Fenomena tersebut terlihat pada apeks yang diberi perlakuan suhu 40 oC dengan daya tumbuh 88% dari total apeks yang diberi perlakuan HWT (Gambar 7).
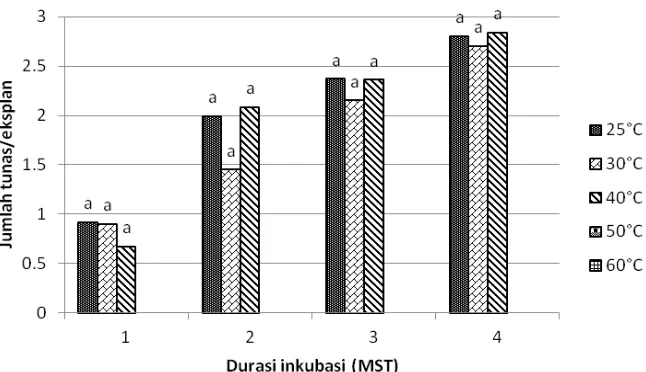
Apeks terus bermultiplikasi secara normal dan perlakuan HWT hingga suhu 40 oC tidak berpengaruh nyata terhadap jumlah tunas pada periode 1‒4 MST (Gambar 8). Hal tersebut menunjukkan bahwa jaringan apeks masih toleran terhadap suhu 40 oC. Pada suhu lebih dari suhu 40 oC, sel diduga mengalami dehidrasi berlebihan sehingga mengakibatkan lisis. Akibatnya, eksplan mengalami kematian. Menurut Damayanti et al. (2010), titik inaktivasi termal virus berkisar antara 55‒60 oC, namun suhu tersebut lebih tinggi dibandingkan dengan titik termal kematian jaringan tebu. Panattoni et al. (2013) juga menambahkan bahwa tanaman masih mampu tumbuh pada suhu 35‒54 oC tergantung pada toleransi jaringan tanaman tersebut. Hal tersebut merupakan prinsip dasar HWT untuk mengeliminasi virus tanaman, yaitu memperoleh suhu optimum tanaman tumbuh namun dapat mendegradasi virus.
15
Gambar 8. Pengaruh perlakuan HWT secara langsung terhadap jumlah tunas yang terbentuk dari apeks tebu PS864. Huruf di atas balok data menunjukkan perbandingan nilai tengah antar-suhu pada tiap durasi inkubasi berdasarkan uji DMRT pada taraf 5%
Hasil penelitian ini menunjukkan bahwa metode HWT secara langsung pada apeks kurang efektif karena hanya mampu mempertahankan daya hidup apeks setelah perlakuan suhu 40 oC. Oleh karena itu, metode HWT perlu dioptimasi lebih lanjut untuk dapat mempertahankan daya hidup apeks setelah perlakuan suhu yang lebih tinggi dari 40 oC.
HWT secara Tidak Langsung Tanpa Saringan
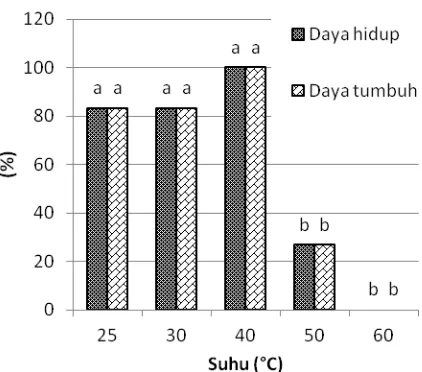
Hasil percobaan menunjukkan bahwa apeks dapat bertahan hidup pada suhu yang lebih tinggi, yaitu 50 oC menggunakan metode HWT secara tidak langsung tanpa saringan. Pada suhu tinggi tersebut, daya hidup apeks mencapai 26.7 % (Gambar 9). Noveriza et al. (2012) juga menyatakan bahwa setek batang nilam varietas Sidikalang, Lhokseumawe,dan Tapak Tuan dapat bertahan hidup setelah direndam dalam air panas pada suhu 50 oC, namun tidak mampu bertahan hidup pada suhu yang lebih tinggi.
16
Gambar 9. Pengaruh HWT secara tidak langsung tanpa saringan terhadap daya hidup dan daya tumbuh apeks tebu PS864, 4 MST. Huruf di atas balok data menunjukkan perbandingan nilai tengah antar-suhu pada daya hidup dan daya tumbuhnya berdasarkan uji DMRT pada taraf 5% Apeks yang mengalami elongasi tunas dapat tumbuh dan bermultiplikasi pasca-perlakuan HWT secara tidak langsung tanpa saringan. Tunas mampu tumbuh dan bermultiplikasi dengan jumlah kurang dari 2 tunas per eksplan setelah perlakuan suhu 50 oC (Gambar 10). Hal ini menunjukkan bahwa HWT secara tidak langsung tanpa saringan dapat mengurangi pengaruh negatif dari thermo-shock setelah terpapar suhu tinggi hingga 50 oC. Namun demikian, tingkat multiplikasi tunas masih relatif rendah. Oleh karena itu, diperlukan optimasi metode HWT agar dapat mengurangi pengaruh kerusakan fisik.
17 HWT secara Tidak Langsung dengan Saringan
Hasil percobaan menunjukkan bahwa apeks mampu bertahan hidup setelah perlakuan suhu 50 oC (25%) menggunakan metode HWT secara tidak langsung dengan saringan. Pada metode ini, daya hidup dan daya tumbuh dapat mencapai 100% setelah perlakuan suhu 25‒40 oC, bahkan sejak 1 MST (Gambar 11).
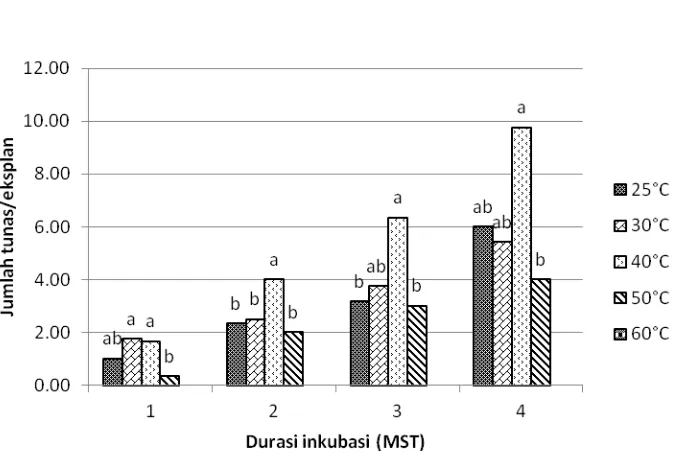
Penggunaan saringan mampu mengurangi efek thermo-shock yang ditandai dengan meningkatnya jumlah tunas yang terbentuk setelah perlakuan suhu 50 oC (4 tunas per eksplan) (Gambar 12) dibandingkan pada metode HWT secara tidak langsung tanpa saringan (2 tunas per eksplan) (Gambar 10). Pada penelitian ini, jumlah tunas terbanyak diperoleh dari perlakuan 40 oC hingga 4 MST (10 tunas per eksplan) (Gambar 12). Suhu 40 oC diduga meyebabkan terpacunya reaksi enzimatis dan suhu yang lebih tinggi (50‒60 oC) menyebabkan kerusakan oksidatif dan lisis dari sel-sel yang menyusun meristem.
Gambar 11. Pengaruh HWT secara tidak langsung dengan saringan terhadap daya hidup dan daya tumbuh apeks tebu PS864, 4 MST. Huruf di atas balok data menunjukkan perbandingan nilai tengah antar-suhu pada daya hidup dan daya tumbuhnya berdasarkan uji DMRT pada taraf 5%
Ali et al. (2005) menyatakkan bahwa enzim antioksidan memainkan peran penting dalam melindungi tanaman dari stress suhu tinggi. Dalam penelitiannya, suhu 40 oC mengakibatkan terinduksinya dehydroascorbate reductase (DHAR), glutathione peroxidase (GPX), glutathione-S-transferase (GST), glutathione reductase (GR) dan guaiacol peroxidase (G-POD) yang melindungi tanaman dari cekaman suhu tinggi. Enzim tersebut lebih aktif terinduksi pada suhu 40 oC dibandingkan pada suhu 25 oC.
Thermo-shock pada suhu HWT yang lebih tinggi dari 40 oC juga ditunjukkan pada tanaman nilam. HWT dengan suhu 50 oC juga mampu mempertahankan viabilitas stek batang 63.6‒90.9%, namun sangat tergantung pada jenis varietas dan durasi perendaman. Semakin lama durasi perendaman maka daya tumbuh stek juga semakin menurun. Suhu yang lebih tinggi, yaitu 60 oC juga mengakibatkan kematian pada berbagai varietas nilam (Noveriza et al.
18
Gambar 12. Pengaruh HWT secara tidak langsung dengan saringan terhadap jumlah tunas yang terbentuk dari apeks tebu PS864. Huruf di atas balok data menunjukkan perbandingan nilai tengah antar-suhu pada tiap durasi inkubasi berdasarkan uji DMRT pada taraf 5%
Analisis Histologi
Kerusakan fisik akibat perlakuan suhu yang ekstrim (60 oC) mengakibatkan sel pada bagian meristem mengkerut/mengkisut, sehingga terlihat ruang antar sel menjadi lebih renggang (Gambar 13B). Pada apeks yang diberi perlakuan suhu 25 oC (kontrol), jarak antar sel terlihat sangat rapat dengan sitoplasma yang pekat dan inti yang terlihat sangat jelas (menyerap zat pewarna) pada bagian meristem (Gambar 13A). Mengkerutnya sel-sel tersebut diduga terjadi sebagai akibat dari dehidrasi. Dehidrasi yang berlebihan berpeluang menyebabkan plasmolisis yang irreversible (tidak dapat balik) sehingga bersifat letal dan menyebabkan nekrosis jaringan, yang ditandai dengan menghitam/ mencoklatnya jaringan.
19 Menurut Melo et al. (2010), kerusakan sel pada tanaman tebu terjadi sebagai akibat dari sitoplasma yang tertarik keluar dari membran sel. Namun kerusakan sel yang diakibatkan oleh perlakuan desikasi tersebut masih dapat pulih melalui proses rehidrasi setelah tiga hari pada media kultur. Pada penelitian ini, perlakuan HWT pada suhu ekstrim (60 oC) diduga menyebabkan kerusakan fisik yang lebih parah, yaitu tidak hanya menyebabkan keluarnya cairan sitoplasma pada sel tetapi juga diduga terjadi kerusakan membran sel, sehingga sel-sel tidak mampu pulih dan apeks tidak dapat hidup dan tumbuh kembali.
Simpulan
20
Gambar 14. Pertumbuhan apeks tebu PS864 yang diberi tiga macam perlakuan HWT: (1) HWT secara langsung, (2) HWT secara tidak langsung tanpa saringan, dan (3) HWT secara tidak langsung dengan saringan pada suhu (A) 25, (B) 30, (C) 40, (D) 50 dan (E) 60 oC
21
3
OPTIMASI PERLAKUAN AIR PANAS DAN BAHAN
ANTIVIRAL PADA APEKS TEBU
Pendahuluan
Salah satu faktor yang mengakibatkan penurunan produksi gula adalah adanya serangan penyakit mosaik. Serangan penyakit tersebut umumnya ditemukan pada klon-klon tebu komersial dan unggul, namun infeksi terberat dijumpai pada klon PS864 yang digolongkan sebagai tanaman rentan pada penyakit tersebut. Penyakit tersebut telah menyebar di 59 kebun tebu di Jawa Tengah dan Jawa Timur dengan intensitas serangan 0‒62% (http://www.litbang.deptan.go.id/).
Salah satu metode eliminasi virus adalah dengan memanfaatkan suhu tinggi untuk menekan multiplikasi patogen dan meningkatkan degradasi RNA virus (Wang dan Valkonen 2008). Metode tersebut dikenal dengan sebutan termoterapi atau hot water treatment (HWT). Pada suhu tinggi, tanaman tidak dapat bertahan hidup, sedangkan virus belum tereliminasi secara sempurna pada suhu di mana tanaman mampu beregenerasi (Damayanti et al. 2010). Oleh sebab itu, perlu dilakukan kombinasi metode tersebut dengan metode eliminasi virus lainnya seperti kemoterapi.
Kemoterapi merupakan metode eliminasi virus menggunakan bahan antiviral seperti ribavirin pada konsentrasi tertentu. Ribavirin belum mampu mengoptimalkan eliminasi potato leafroll virus (PLRV), potato virus X (PVX),
potato virus Y (PVY), dan potato virus S (PVS) tanaman kentang, namun metode tersebut efektif jika dikombinasikan dengan metode HWT pada tanaman pir (Gunaeni dan Karjadi 2011; Hu et al. 2012). Efektivitas ribavirin sangat tergantung pada konsentrasi bahan. Pada penelitian Hu et al. (2012) dan Andriani
et al. (2013), konsentrasi ribavirin pada taraf lebih dari 50 µg l-1 mengakibatkan gejala nekrosis, klorosis dan bahkan mengakibatkan kematian. Kombinasi perlakuan HWT dan bahan antiviral diharapkan tidak memberikan efek negatif terhadap pertumbuhan tanaman. Oleh sebab itu, pada penelitian ini dilakukan dengan tujuan untuk mengetahui pengaruh suhu tinggi dan bahan antiviral ribavirin terhadap pertumbuhan apeks tebu.
Bahan dan Metode
Penelitian dilaksanakan pada bulan September hingga November 2013 di Unit Produksi Benih Unggul Pertanian, Badan Penelitian dan Pengembangan Pertanian dan Laboratorium Kultur Jaringan Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Cimanggu, Bogor.
22
Percobaan disusun secara faktorial dalam lingkungan Rancangan Acak Lengkap dengan 4 ulangan. Faktor pertama adalah taraf suhu HWT (kontrol atau 25 dan perlakuan 30, 40, 50, dan 60 oC), sedangkan faktor kedua adalah taraf ribavirin (0, 15, 20 dan 25 µg l-1). Perlakuan HWT dilakukan selama 30 menit. Setiap botol terdiri atas 3 eksplan. Penelitian ini terdiri dari 80 satuan percobaan dengan 240 satuan pengamatan. Setelah HWT, eksplan ditanam pada media regenerasi yang mengandung ribavirin selama 40 hari, kemudian diregenerasikan pada media regenerasi tanpa ribavirin. Pengamatan dilakukan selama 4 minggu. Peubah yang diamati meliputi jumlah eksplan yang hidup, jumlah eksplan membentuk tunas, dan jumlah tunas yang terbentuk. Data percobaan dianalisis dengan analisis ragam (ANOVA) menggunakan program Statistik Analysis Software (SAS versi 9). Nilai rata-rata dihitung dan dibandingkan menggunakan uji selang berganda duncan (DMRT) pada taraf 5% (P<0.05).
Hasil dan Pembahasan
Hasil analisis ragam menunjukkan tidak terdapat interaksi antara taraf suhu dan konsentrasi ribavirin. Pada penelitian ini, daya hidup dan tumbuh apeks relatif stabil hingga suhu 40 oC (>90%). Apeks masih dapat bertahan hidup pasca-perlakuan suhu 50 oC (5%), sedangkan pada suhu 60 oC apeks mengalami kematian (Tabel 1). Hidup dan tumbuhnya apeks sangat dipengaruhi oleh suhu HWT dari pada konsentrasi ribavirin. Suhu tinggi mempengaruhi integritas membran sel dan proses fisiologis sehingga apeks tidak mampu bertahan hidup (Al-Whaibi 2011). Hal serupa terjadi pada tanaman nilam di mana suhu 55-60 oC memiliki daya regenerasi yang rendah dan bahkan mengakibatkan kematian (Noveriza et al. 2012). Sebaliknya, efisiensi ribavirin tergantung pada konsentrasi bahan kimia, target virus dan tanaman inang (Hu et al. 2012).
Tabel 1. Pengaruh kombinasi perlakuan HWT dan ribavirin terhadap daya hidup dan daya tumbuh apeks tebu PS864, 5 MST
23 Penelitian ini juga menunjukkan bahwa hingga ribavirin pada taraf tertinggi (25 µg l-1), apeks dapat bermultiplikasi tanpa diiringi dengan pembentukan kalus dan akar. Daya hidup dan daya tumbuh apeks tidak berbeda dengan perlakuan kontrolnya, yaitu berkisar antara 55−58%.
Jumlah tunas juga tidak berbeda nyata pada berbagai perlakuan suhu dan konsentrasi ribavirin. Apeks dapat bermultiplikasi normal pada media yang mengandung ribavirin maupun pada media regenerasi. Hal tersebut menunjukkan bahwa HWT hingga suhu tertinggi (50 oC) atau ribavirin hingga taraf tertinggi (25µg l-1) tidak mempengaruhi multiplikasi tunas (Gambar 16). Hal tersebut berbeda pada penelitian Robert et al. (1998), perlakuan suhu tinggi tidak berpengaruh terhadap daya tumbuh, namun sangat berpengaruh terhadap multiplikasi tunas bawang merah. Mullin et al. (1974) juga menyatakan bahwa perlakuan HWT dapat meningkatkan kecepatan tumbuh meristem stroberi dibandingkan dengan kontrolnya.
Pada penelitian ini, teramati nekrosis pada biakan dari perlakuan ribavirin 20 (1.67%) dan 25 µg l-1 (2.67%), ditandai dengan mencoklat dan tidak terbentuknya daun secara sempurna, biakan menghitam dan mudah hancur seperti arang, bahkan beberapa biakan tidak mampu membentuk anakan baru (Gambar 15). Beberapa biakan lainnya masih dapat tumbuh dan membentuk anakan normal.
Gambar 15. Nekrosis dari biakan tebu PS864 yang berasal dari apeks pasca-perlakuan ribavirin (A) 20 µg l-1 dan (B) 25 µg l-1 dan suhu HWT 25 oC. Panah hitam menunjukkan biakan yang mengalami nekrosis Efek nekrosis sangat tergantung pada dosis bahan kimia yang diberikan, namun tidak mempengaruhi daya hidup dan biakan dapat kembali tumbuh normal setelah melewati masa inkubasi kemoterapi (Hu et al. 2012; Andriani et al. 2013). Hu et al. (2012) menyatakan bahwa ribavirin lebih dari 50 µg l-1 dapat mengakibatkan klorosis, nekrosis, dan bahkan kematian pada tanaman pir secara
in vitro. Pada penelitian ini, HWT pada suhu 50 oC atau ribavirin 25 µg l-1 merupakan perlakuan yang terbaik, sebab biakan mampu bertahan hidup dan bermultiplikasi dengan normal.
Simpulan
24
Gambar 16. Pertumbuhan apeks tebu PS864 yang diberi perlakuan HWT dan ribavirin, 5 MST: suhu (A) 25, (B) 30, (C) 40, (D) 50 dan (E) 60 oC dengan ribavirin (1) 0, (2) 15, (3) 20, dan (4) 25 µg l-1
26
4
OPTIMASI PERLAKUAN AIR PANAS DAN BAHAN
ANTIVIRAL PADA MERISTEM TEBU
Pendahuluan
Penyakit mosaik pada tebu mulai menyebar di sekitar Jawa Tengah dan Jawa Timur dengan intensitas serangan 0‒62%. Tebu dengan klon PS864 merupakan salah satu klon tebu yang rentan dan dominan terserang penyakit tersebut. Penularannya dapat terjadi secara mekanis atau 100% terbawa benih (http://www.litbang.deptan.go.id/).
Kultur meristem merupakan salah satu metode eliminasi virus yang umum digunakan. Meristem merupakan jaringan embrionik yang aktif membelah untuk menghasilkan sel-sel baru (Campbell et al. 2006; Levetin dan McMahon 2008). Sel meristem umumnya bebas dari virus dan parasit obligat lainnya karena sel tersebut tidak memiliki plasmodesmata, perkembangan selnya cepat, dan terjadi persaingan penggunaan nukleotida antara sel meristematik dengan virus, serta adanya zat inhibitor (Bittner et al. 1989). Namun keefektifan metode kultur meristem tersebut sangat dipengaruhi oleh ukuran meristem yang digunakan. Menurut Ramgareeb et al. (2010), meristem dengan ukuran kurang dari 1 mm merupakan ukuran yang optimal untuk mendapatkan tanaman yang bebas virus, namun memiliki daya tumbuh yang rendah. Oleh sebab itu, kultur meristem dengan ukuran lebih dari 1 mm banyak dikombinasikan dengan metode eliminasi virus lainnya seperti hot water treatment (HWT) atau menggunakan bahan antiviral (kemoterapi).
Perlakuan HWT merupakan metode eliminasi virus dengan memanfaatkan suhu tinggi untuk menekan aktivitas virus (Wang dan Valkonen 2008). Suhu yang terlalu tinggi dapat mengakibatkan thermo-shock sehingga menghambat pertumbuhan. Kemoterapi merupakan metode eliminasi virus dengan menggunakan bahan antiviral, seperti ribavirin. Menurut Hu et al. (2012), ribavirin pada taraf tertentu dapat mengakibatkan klorosis, nekrosis dan kematian jaringan. Oleh sebab itu, perlu dilakukan optimasi metode terlebih dahulu untuk mengetahui pengaruh kombinasi kedua metode tersebut terhadap pertumbuhan meristem tebu.
Bahan dan Metode
Penelitian dilaksanakan pada bulan September hingga Desember 2013 di Unit Produksi Benih Unggul Pertanian, Badan Penelitian dan Pengembangan Pertanian dan Laboratorium Kultur Jaringan Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Cimanggu, Bogor.
27 Percobaan disusun secara faktorial dalam lingkungan Rancangan Acak Lengkap dengan 4 ulangan. Setiap botol terdiri atas 3 eksplan. Penelitian ini terdiri dari 32 satuan percobaan dengan 96 satuan pengamatan. Faktor pertama adalah perlakuan HWT dan faktor kedua adalah perlakuan ribavirin. Tunas pucuk diperlakukan dengan HWT terlebih dahulu pada suhu 25 (kontrol) dan 50 oC selama 30 menit. Meristem diisolasi di bawah mikroskop dan ditanam pada media regenerasi yang mengandung ribavirin (0, 15, 20 dan 25 mg l-1) selama 40 hari. Selanjutnya, eksplan ditanam pada media regenerasi. Pengamatan dilakukan selama 8 minggu dengan peubah yang diamati meliputi jumlah eksplan yang hidup, jumlah eksplan membentuk tunas, dan jumlah tunas yang terbentuk. Data percobaan dianalisis dengan analisis ragam (ANOVA) menggunakan program
Statistik Analysis Software (SAS versi 9). Nilai rata-rata dihitung dan dibandingkan menggunakan uji selang berganda duncan (DMRT) pada taraf 5% (P<0.05).
Hasil dan Pembahasan
Meristem sudah menunjukkan tanda-tanda kehidupan satu minggu pasca-perlakuan. Meristem yang hidup ditandai dengan warna krem dan berangsur-angsur menjadi hijau, sedangkan yang mati ditandai dengan perubahan warna menjadi coklat dan mengering. Hasil analisis ragam menunjukkan bahwa daya hidup, daya tumbuh, dan jumlah tunas tidak dipengaruhi oleh taraf suhu maupun ribavirin (Tabel 2). Tidak terdapatnya perbedaan yang nyata antar perlakuan disebabkan oleh tingginya keragaman eksplan (meristem). Tingginya keragaman tersebut diduga dipengaruhi oleh adanya pelukaan mekanik pada saat isolasi dan ukuran meristem.
Tabel 2. Pengaruh HWT dan ribavirin terhadap pertumbuhan meristem tebu PS864, 8 MST
Keterangan : tidak terdapat perbedaan yang nyata antar perlakuan berdasarkan uji DMRT 5%.
Ukuran meristem tidak hanya mempengaruhi efektivitas eliminasi virus tetapi juga daya hidup eksplan. Pada ukuran kurang dari 1 mm, meristem memiliki tingkat potensi eliminasi virus yang tinggi namun memiliki daya hidup yang sangat rendah (Wang dan Valkonen 2008; Ramgareeb et al. 2010). Ali et al.
28
terbaik untuk mikropropagasi tebu. Dalam penelitian Alam et al. (2010), meristem tidak dapat hidup pada ukuran kurang dari 0.3 mm meskipun telah diberikan beberapa jenis dan kombinasi zat pengatur tumbuh.
Gambar 17. Pencoklatan yang berpengaruh terhadap daya tumbuh meristem tebu PS864: (A) kondisi meristem pada saat 4 MST, (B) media di sekitar meristem tercemari quinon sehingga meristem mati pada saat 8 MST Akumulasi senyawa fenolik berupa quinon yang terlalu tinggi juga diduga sebagai faktor penghambat pertumbuhan dan kematian pada meristem (Gambar 17). Sel yang terluka akan mengaktifkan enzim oksidase sehingga senyawa fenol teroksidasi dan mengakibatkan pencoklatan pada jaringan (Hutami 2008). Menurut Cheong et al. (2012) senyawa fenolik bersifat toksik dan menyebabkan kematian pada meristem tebu, hal tersebut dapat diatasi dengan melakukan subkultur setiap dua minggu. Selain subkultur, penggunaan arang aktif,
polyvinylpirrolidone (PVP), polyvinylpolypirrolidone (PVPP), sodium diethyl dithiocarbamate (DIECA) dan 1,4-dithio-DL-threitol (DTT) juga dapat mengatasi pencoklatan. Senyawa-senyawa tersebut dapat menyerap dan mengurangi senyawa fenol, memodifikasi potensial redoks, dan menghambat aktivitas enzim fenolase (George dan Sherrington 1984; Hutami 2008). Penampilan biakan tebu pasca-perlakuan HWT dan ribavirin secara umum dapat dilihat pada Gambar 18.
29 Keragaman eksplan (meristem) menunjukkan bahwa meode tersebut tidak aplikatif dibandingkan dengan kultur apeks. Namun demikian, metode tersebut dapat digunakan sebagai bahan pertimbangan. Pada penelitian ini, meristem masih dapat hidup, tumbuh, dan tidak terjadi nekrosis hingga perlakuan suhu 50 ˚C atau ribavirin 25 µg l-1. Oleh sebab itu, peningkatan konsentrasi ribavirin lebih dari 25 µg l-1 masih mungkin untuk diterapkan.
Simpulan
30
5
OPTIMASI PEMBEKUAN JARINGAN APEKS TEBU
Pendahuluan
Tebu merupakan bahan utama penghasil gula. Tebu memiliki beragam manfaat sehingga kebutuhannya sangat tinggi dalam kehidupan sehari-hari. Di Indonesia, perkiraan konsumsi gula di rumah tangga sebesar 1.68 juta ton (Ditjenbun 2014b), namun diduga konsumsi gula nasional akan meningkat pada tahun 2014 mencapai 3.10 juta ton (http://ditjenbun.pertanian.go.id/). Oleh sebab itu, pemerintah berupaya meningkatan produksi gula dengan berbagai cara. Namun hal tersebut mengalami beberapa kendala antara lain pengolahan tanah, bibit unggul, pemupukan, pengendalian hama dan penyakit.
Penyakit mosaik merupakan salah satu faktor yang menurunkan rendemen gula. Rendemen gula dapat turun 30‒40% akibat terhambatnya pertumbuhan batang (Bailey 2004). Penyakit tersebut tersebar di Sumatra dan Jawa dengan kejadian bervariasi antara 30‒67% tergantung pada lokasi. Penyakit tersebut dapat menginfeksi beberapa spesies tanaman dari famili Gramineae secara mekanis atau 100% terbawa benih (http://www.litbang.deptan.go.id/). Penyakit tersebut dapat diatasi dengan berbagai metode eliminasi virus. Salah satu metode eliminasi virus terbaru dan efektif adalah metode pembekuan jaringan (Wang dan Valkonen 2008).
Metode pembekuan jaringan dapat mengeliminasi patogen dengan tingkat keberhasilan yang tinggi sehingga dikenal sebagai teknik krioterapi (Wang dan Valkonen 2008). Pembekuan jaringan atau yang juga dikenal dengan nama kriopreservasi merupakan metode penyimpanan plasma nutfah pada suhu ekstrim rendah atau dengan menggunakan nitrogen cair (-196 oC) (Kartha 1985). Pada kondisi tersebut, sel, jaringan, atau organ bahan tanam yang disimpan tidak melakukan aktivitas metabolik dengan viabilitas yang tetap terjaga sehingga bahan tanaman dapat disimpan dalam jangka waktu yang lama, tanpa harus dilakukan subkultur berulang-ulang (Widyastuti 2000; Roostika dan Mariska 2003). Sel yang hidup merupakan sel yang bersifat meristematik dan telah terbukti efektif dalam mengeliminasi virus cucumber mosaic virus (CMV) dan banana streak virus (BSV) pada tanaman pisang (Helliot et al. 2002; Wang dan Valkonen 2008). Pada beberapa penelitian, metode krioterapi menyebabkan kemampuan daya hidup eksplan yang rendah seperti pada pisang (12─72%), pepaya (68%), purwoceng (40%), dan ruspberry (20─38%) (Panis et al 1996; Wang et al. 2005; Roostika et al 2007; Wang et al. 2008). Oleh sebab itu, optimasi metode pembekuan jaringan tersebut perlu dilakukan pada tebu.
Bahan dan Metode
Penelitian dilaksanakan pada bulan September─Desember 2013 di Unit Produksi Benih Unggul Pertanian, Badan Penelitian dan Pengembangan Pertanian dan Laboratorium Kultur Jaringan Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Cimanggu, Bogor.
31 sukrosa dan nitrogen cair. Bahan-bahan lain yang digunakan adalah air destilata, alkohol, spritus, dan phytagel. Alat-alat yang akan digunakan meliputi LAF, otoklaf, alat tanam seperti pinset, scalpel, bunsen, termometer, termos dan botol tanam.
Percobaan dilakukan dengan menerapkan teknik vitrifikasi. Percobaan ini terdiri dari dua tahap. Tahap pertama merupakan tahap optimasi perlakuan dehidrasi jaringan. Pada tahap ini, digunakan Rancangan Acak Lengkap dengan 5 ulangan, setiap ulangan terdiri dari 5 eksplan. Dehidrasi jaringan dilakukan dengan merendam eksplan ke dalam larutan PVS2 (gliserol 30% + etilen glikol 15% + DMSO 15% dalam media MS yang mengandung sukrosa 0.4 M) selama 0 (tanpa perendaman PVS2), 10, 20, 30, dan 40 menit.
Pada tahap kedua, percobaan merupakan optimasi perlakuan pembekuan jaringan yang terdiri dari dua faktor. Faktor pertama adalah perlakuan prakultur sedangkan faktor kedua adalah perlakuan loading. Eksplan diprakultur pada media MS padat dengan sukrosa 0, 0.1, 0.3, dan 0.5 M selama 5 hari. Selanjutnya, eksplan di-loading dengan larutan LS (gliserol 2 M dalam media MS yang mengandung sukrosa 0.4 M) selama 0, 10, 20, dan 30 menit. Setelah loading, eksplan didehidrasi pada perlakuan terbaik pada tahap sebelumnya. Eksplan kemudian dibekukan dalam nitrogen cair minimal selama 1 jam. Pelelehan dilakukan dengan menggunakan air hangat (40oC) dan dilakukan deloading dalam media MS dengan penambahan sukrosa 1.2 M selama 30 menit. Selanjutnya, eksplan ditanam pada media regenerasi yang semisolid. Peubah yang diamati meliputi jumlah eksplan yang hidup, jumlah eksplan membentuk tunas, dan jumlah tunas yang terbentuk. Data percobaan dianalisis dengan analisis ragam (ANOVA) menggunakan program Statistik Analysis Software (SAS versi 9). Nilai rata-rata dihitung dan dibandingkan menggunakan uji selang berganda duncan (DMRT) pada taraf 5% (P<0.05).
Hasil dan Pembahasan
Optimasi Perlakuan Dehidrasi Jaringan
Apeks yang berpotensi hidup akan berwarna coklat, mengalami elongasi dan berangsur-angsur berwarna hijau, sedangkan biakan yang mati diawali dengan pudarnya warna hijau dan akhirnya memutih. Pada penelitian ini, analisis ragam menunjukkan bahwa durasi dehidrasi tidak memberikan perbedaan yang nyata terhadap daya hidup, daya tumbuh, dan jumlah tunas. Walaupun semakin lama durasi dehidrasi daya hidup dan daya tumbuh apeks cenderung semakin rendah (Tabel 3).
32
Kristal es dapat mengakibatkan pelukaan pada sel (Roostika dan Mariska 2003; Roostika et al. 2007). Oleh sebab itu, durasi dehidrasi terlama dengan daya hidup dan daya tumbuh lebih dari 70% diasumsikan sebagai perlakuan optimum untuk dehidrasi jaringan.
Tabel 3. Pengaruh durasi dehidrasi jaringan dengan PVS2 terhadap pertumbuhan apeks tebu PS864, 4 MST
Keterangan : tidak terdapat perbedaan yang nyata antar perlakuan berdasarkan uji DMRT 5% Pada penelitian ini, durasi dehidrasi 30 menit merupakan perlakuan dehidrasi yang terbaik. Daya hidup dan daya tumbuh apeks masing-masing sebesar 74 dan 72% dengan jumlah tunas yang tidak berbeda nyata dengan perlakuan kontrolnya. Meskipun tinggi tanaman lebih rendah (pada perlakuan durasi 30 menit) dibandingkan dengan perlakuan kontrolnya (durasi 0 menit) pada 4 MST (data tidak ditampilkan), tunas dapat tumbuh normal dan tidak berbeda dengan kontrol pada 5 MST (Gambar 19).
Gambar 19. Pengaruh lama perendaman dalam PVS2 terhadap regenerasi apeks tebu PS864: (A) 0, (B) 10, (C) 20, (D) 30, dan (E) 40 menit pada periode inkubasi (1) 4 dan (2) 5 MST.
Optimasi Perlakuan Pembekuan Jaringan
33 struktur integritas membran sel sehingga tidak terjadi plasmolisis yang
irreversible (Panis et al. 1996; Roostika dan Mariska 2003; Roostika et al. 2007).
Gambar 20. Pengaruh molaritas sukrosa pada tahap prakultur terhadap elongasi tunas dan pencoklatan jaringan apeks tebu PS864.
Menurut Roostika et al. (2007), prakultur dapat mengakibatkan penurunan volume vakuola sel dengan cara redistribusi vakuola sentral yang lebih besar menjadi lebih kecil sehingga mencegah terjadinya injury (luka yang serius). Pada penelitian ini, peningkatan taraf sukrosa (hingga 0.5 M) menyebabkan tingginya pencoklatan dan menurunkan elongasi tunas (Gambar 21). Hal tersebut sesuai dengan penelitian Panis et al. (1996), di mana kandungan sukrosa yang terlalu tinggi dapat mengakibatkan terhambatnya pertumbuhan jaringan, menurunnya daya hidup tanaman, bahkan dapat mengakibatkan pencoklatan pada jaringan. Roostika et al. (2007) juga menambahkan bahwa tingginya molaritas sukrosa mengakibatkan sel mengalami plasmolisis. Oleh sebab itu, apeks yang di prakultur pada sukrosa 0.5 M pada penelitian ini tidak digunakan pada tahap selanjutnya.
34
Gambar 21. Penampilan biakan tebu PS864 setelah perlakuan prakultur dengan sukrosa: (A) 0, (B) 0.1, (C) 0.3, dan (D) 0.5 M.
Perlakuan pemuatan juga berperan dalam menentukan keberhasilan pembekuan jaringan, di mana sel diadaptasikan sebelum memasuki tahapan dehidrasi dalam larutan krioprotektan dengan molaritas yang lebih tinggi (Roostika et al. 2008). Montero et al. (2008) menyatakan bahwa konsentrasi gliserol dan sukrosa mempengaruhi viabilitas embrio somatik tebu pasca-pembekuan. Pada penelitiannya, viabilitas optimal diperoleh dari perlakuan perendaman LS pada konsentrasi 1.5 M gliserol dan 0.3 M sukrosa selama 30–40 menit. Pada penelitian ini, apeks mampu bertahan hidup pasca-perlakuan LS selama 0, 10, dan 30 menit (Tabel 4).
Tabel 4. Pengaruh perlakuan prakultur dan pemuatan dalam larutan LS terhadap pertumbuhan setelah pembekuan jaringan apeks tebu PS864 dalam nitrogen cair yang didehidrasi dengan PVS2 selama 30 menit, 5 MST
35 Hingga 5 MST pasca-pembekuan, jumlah tunas yang terbentuk sebesar 1–4 tunas per eksplan (Tabel 4; Gambar 22). Adanya perbedaan jumlah tunas diduga dipengaruhi oleh keragaman apeks terhadap kecepatan pemulihan (recovery) pasca-pelelehan. Menurut Roostika et al. (2008) pemulihan yang lama pasca-pembekuan jaringan dapat disebabkan oleh tingkat stres dehidrasi yang tinggi pada biakan. Meskipun jumlah tunas yang dihasilkan sedikit, metode krioterapi juga sangat efektif dalam mengeliminasi virus beberapa tanaman seperti pisang (Helliot et al. 2002) dan kentang (Wang et al. 2006). Krioterapi memanfaatkan perbedaan anatomi dan fisiologi jaringan meristematik dengan jaringan lainnya. Sel meristem memiliki ukuran yang lebih kecil dengan vakuola yang kecil, serta rasio nukleus-sitoplasma yang tinggi, sehingga memiliki daya hidup sel yang lebih tinggi ketika direndam dalam nitrogen cair (Wang dan Valkonen 2008). Sel meristem umumnya bebas dari virus dan parasit obligat lainnya karena sel tersebut tidak memiliki plasmodesmata, perkembangan selnya cepat, dan terjadi persaingan penggunaan nukleotida antara sel meristematik dengan virus, serta adanya zat inhibitor (Bittner et al. 1989).
Penelitian ini menunjukkan bahwa perlakuan prakultur 0.3 M dengan lama perendaman LS selama 10 menit memberikan persentase daya hidup dan daya tumbuh tertinggi (40%) (Tabel 4). Meskipun keberhasilannya tergolong rendah, penerapan teknik vitrifikasi pada apeks memberikan hasil yang lebih baik dibandingkan dengan embrio somatik pada penelitian Montero et al. (2008) (eksplan bertahan hidup). Menurut Roostika dan Mariska (2003), terdapat banyak faktor yang mempengaruhi keberhasilan kriopreservasi pada tanaman, antara lain kecepatan pembekuan, jenis dan konsentrasi krioprotektan, suhu akhir pembekuan, serta tipe eksplan dan keadaan fisiologis bahan yang akan disimpan.
Simpulan