KLONING GEN KITINASE Aeromonas caviae WS7b PADA
Bacillus subtilis 168
SYAIFUL KHOIRI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
SYAIFUL KHOIRI. Kloning Gen Kitinase Aeromonas caviae WS7b pada
Bacillus subtilis 168. Dibimbing oleh GIYANTO.
Hama dan penyakit merupakan salah satu masalah utama dalam budidaya tanaman. Pengendalian hayati merupakan salah satu cara dalam mengendalikan patogen tumbuhan, diantaranya dengan memanfaatkan mikroorganisme. Saat ini, bakteri kitinolitik telah dimanfaatkan secara luas sebagai agens biokontrol cendawan patogen tumbuhan. Bioteknologi dan rekayasa genetika telah berhasil mengidentifikasi gen penyandi kitinase pada Aeromonas caviae WS7b yaitu gen
chiA. Tujuan penelitian ini untuk mengkonstruksi transforman Bacillus subtilis
168 dengan fusi promotor sigB-chiA. Dalam penelitian ini, penyisipan fusi promotor sigB-chiA ke dalam kromosom B. subtilis 168 dilakukan dengan cara rekombinasi silang ganda (double crossover recombination) pada lokus amyE. Penelitian ini berhasil mengisolasi plasmid pDL2 dengan sisipan fusi promotor
sigB-chiA dari E. coli DH5α transforman stok laboratorium dan berhasil disisipkan ke dalam lokus amyE pada kromosom B. subtilis 168. Isolat transforman B. subtilis 168 mampu tumbuh pada media yang mengandung antibiotik klorampenikol, mengekspresikan kitinase pada media koloidal kitin agar, isolat ini berwarna biru dengan pewarnaan Gram untuk mengindikasikan bahwa tranforman adalah B. subtilis 168.
ABSTRACT
SYAIFUL KHOIRI. Cloning of Chitinase Gene Aeromonas caviae WS7b to
Bacillussubtilis 168. Supervised by GIYANTO.
Pests and diseases are the main problems in plant cultivation. Biological control is one of the control method of plant pathogen. Recently, chitinolytic bacteria has been used as biological control of plant pathogenic fungi widely. Biotechnology and genetic engineering have been successed determine the DNA sequences encoding chitinase (chiA) of A. caviae WS7b. This study to construct
B. subtilis 168 transformant with promotor sigB-chiA fution. In this study, insertion of sigB-chiA fution to B.subtilis 168 chromosome was conducted by double crossover recombination into amyE locus. This research success to isolated plasmids pDL2 with inserts sigB-chiA from labolatory stock E. coli DH5α
transformants and inserted to the amyE locus of B. subtilis 168 chromosome. B. subtilis 168 transformants capable to grow in medium containing chloramphenicol antibiotic, expressing chitinase on colloidal chitin agar, shown blue color with Gram staining to indicated that this transformant was B. subtilis 168.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KLONING GEN KITINASE Aeromonas caviae WS7b PADA
Bacillus subtilis 168
SYAIFUL KHOIRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi: Kloning Gen Kitinase Aeromonas caviae WS7b pada Bacillus subtilis 168
Nama : Syaiful Khoiri NIM : A34080069
Disetujui oleh
Dr. Ir. Giyanto, MSi Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi Ketua Departemen Proteksi Tanaman
PRAKATA
Puji Syukur kehadirat Allah SWT atas limpahan rahmat-Nya, sehingga skripsi tugas akhir penulis yang berjudul “Kloning Gen Kitinase Aeromonas caviae WS7b pada Bacillus subtilis168” dapat penulis selesaikan dengan baik.
Penghargaan penulis tujukan kepada ayahanda Yusuf, Ibunda Khuzaimah, Ibu Muslimah, Kakak Eny Laily, Kakak Syadiduddin, adik Khoiril Khilmy, Uswannuril Khoiri, Ibu Dyah Wiyati, Bapak Suprijanto, adik Dita dan Rani yang selalu memberikan semangat dan doa. Ungkapan terima kasih penulis sampaikan kepada Dr. Ir. Giyanto, M. Si sebagai dosen pembimbing skripsi yang telah memberikan bimbingan, arahan, dan saran yang sangat membantu dalam penulisan skripsi ini. Terima kasih juga sampaikan kepada Dr. Ir. Sugeng Santoso, M. Agr. selaku dosen penguji tamu yang telah memberikan banyak masukan dan saran untuk penyempurnaan tulisan ini. Penulis juga menyampaikan terima kasih Dr. Ir. Damayanti Buchori, M. Sc. selaku dosen pembimbing akademik yang telah memberikan bimbingan dan saran penyusunan akademik selama penulis belajar di Departemen Proteksi Tanaman. Staf labolatorium Bakteriologi Tumbuhan, Dr. Ir. Kikin Hamzah Mutaqin, M. Sc. dan Ir. Ivone O. S. M, Si. Terima kasih juga penulis sampaikan kepada Dr. Ir. Tri Asmira Damayanti, M. Agr. selaku dosen moderator seminar yang telah memberikan kritik, saran dan masukan, serta kepada semua staf pengajar Departemen Proteksi Tanaman, teman-teman di Labolatorium Bakteriologi Tumbuhan (Kak Tatit, Kak Ida, Imam Lutfi, Imam Khoiri), serta semua rekan-rekan seperjuangan yang telah membantu selama ini (Rado, Arif, Yasin, Aris P, Jack, Bush, Dhika, Titin, Yudia, dan teman-teman yang lain).
Penulis menyadari adanya kekurangan dalam penulisan skripsi ini, Namun demikian, semoga tulisan ini dapat bermanfaat sebagai informasi dalam bidang pertanian dan dapat digunakan sebagai acuan untuk penelitian selanjutnya. Terima kasih.
Bogor, Januari 2013
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
BAHAN DAN METODE 3
Tempat dan Waktu Penelitian 3
Uji Aktivitas Kitinolitik Bakteri Uji 3
Kloning Fusi Promotor sigB-chiA pada B. subtilis 168 4
HASIL DAN PEMBAHASAN 7
Aktivitas Kitinolitik Bakteri Uji 7
Kloning Fusi Promotor sigB-chiA pada B. subtilis 168 8 Isolasi Plasmid pDL2 dengan Sisipan Fusi Promotor sigB-chiA 8 Transformasi Plasmid ke dalam B. subtilis 168 10
Konfirmasi Keberhasilan Transformasi 11
SIMPULAN DAN SARAN 16
DAFTAR PUSTAKA 17
DAFTAR
GAMBAR
1 Skema pengujian aktivitas kitinolitik masing-masing isolat bakteri pada
media koloidal kitin 3
2 Zona bening yang menunjukkan aktivitas kitinolitik bakteri uji 8 3 DNA plasmid pDL2 tanpa sisipan atau dengan sisipan fusi promotor
sigB-chiA 8
4 Situs penyisipan gen dan pemotongan enzim restriksi AflII pada
plasmid pDL2 9
5 Visualisasi DNA plasmid hasil restriksi 9
6 Grafik pertumbuhan B. subtilis 168 pada suhu 37oC 10 7 Skema rekombinasi silang ganda (double crossover recombination)
antara plasmid pDL2 dan kromosom B. subtilis 168 11 8 Hasil transformasi plasmid pDL2 dengan sisipan fusi promotor sig
B-chiA yang ditumbuhkan pada media LA dengan antibiotik
klorampenikol 12
9 Isolat B. subtilis 168 transforman yang tumbuh pada media LA dengan
antibiotik klorampenikol 12
10 Hasil uji aktivitas kitinolitik transforman B. subtilis 168 12 11 Pengamatan mikroskopis bakteri dengan pewarnaan Gram 13
12 Visualisasi DNA kromosom hasil purifikasi 14
13 Visualisasi DNA hasil PCR gen pengkode 16S rRNA 14
DAFTAR LAMPIRAN
1 Sekuen promotor sigB B. subtilis 168 19
2 Sekuen gen kitinase (chiA) A. caviae WS7b 20 3 Enzim restriksi dan situs pemotongannya pada plasmid pDL2
PENDAHULUAN
Latar Belakang
Hama dan penyakit merupakan salah satu masalah utama dalam budidaya tanaman. Penggunaan agens hayati di lapangan merupakan salah satu alternatif pengendalian terhadap hama dan penyakit tanaman. Cara ini memiliki beberapa keuntungan, antara lain meningkatkan produktivitas tanaman, mencegah terjadinya resistensi patogen, aman bagi lingkungan, dan sesuai dengan konsep pertanian berkelanjutan (Cook dan Baker 1996).
Salah satu cara pengendalian hama dan penyakit tanaman adalah dengan pemanfaatan kitinase sebagai enzim pendegradasi kitin. Kitin merupakan komponen struktural dinding sel cendawan kecuali oomycetes, kerangka luar arthropoda, kerangka luar moluska, cangkang luar crustaceae dan nematoda (Cabib 1987 dalam Malik 2000). Pemanfaatan kitinase diantaranya untuk agens biokontrol cendawan patogen tanaman (Ordentlich et al. 1988), penghambatan proses ganti kulit serangga, pengendalian nyamuk, persiapan enzim mikolitik (Vyas dan Deshpande 1989). Beberapa bakteri telah dilaporkan dapat mensintesis kitinase, diantaranya: Lecanicilium psalliotae (syn. Verticillium psalliotae) yang mampu mendegradasi cangkang telur Meloidogyne incognita (Gan et al. 2007),
Serratia marcescens (Brurberg et al. 2000), dan A. caviae WS7b yang mampu menghambat perkembangan cendawan patogen tumbuhan di rumah kaca (Wenuganen 1996).
A. caviae mampu mengurangi perkembangan Rhizoctonia solani sebesar 78% dan Fusarium oxysporum f.sp. vasinfectum sebesar 57% pada tanaman kapas, sedangkan pada tanaman kacang buncis mampu mengurangi perkembangan Sclerotium rolfsii sebesar 60% (Inbar dan Chet 1991 dalam Saputra 2009). A. caviae WS7b tidak dianjurkan digunakan karena beberapa strain berpotensi menjadi patogen manusia yang menyebabkan diare akut. Oleh karena itu rekayasa genetik untuk memindahkan gen penghasil kitinase yang ada pada A. caviae WS7b ini ke bakteri lain yang aman dilepas ke lapang sangat diperlukan.
Bakteri yang dipilih sebagai target DNA rekombinan ini adalah Bacillus subtilis 168, karena bakteri ini terbukti aman bagi lingkungan dan diketahui sebagai salah satu bakteri pemacu pertumbuhan tanaman (PGPR). Selain itu, B. subtilis 168 mempunyai gen sigB (σB) yang aktif terhadap berbagai jenis cekaman lingkungan, antara lain cekaman oxidatif, suhu (Benson dan Haldenwang 1993), etanol, pH, dan cekaman nutrisi (Price 2002).
2
dengan gen chiA pada plasmid pDL2 dan mentransformasikannya dalam E. coli
DH5α sehingga isolat E. coli DH5α transforman tersebut mampu menghasilkan enzim kitinase yang lebih banyak.
Perkembangan bioteknologi saat ini memungkinkan adanya pemindahan gen kitinase (chiA) yang telah diisolasi dari genom A. caviae WS7b ke dalam B. subtilis 168. Pemilihan B. subtilis strain 168 sebagai inang kloning gen karena mampu tumbuh pada media murah, non-patogenik, mampu menangkap molekul DNA, stabil dan dapat dikulturkan, mempunyai informasi genetik yang lengkap, mempunyai genotipe spesifik untuk efektifitas hasil kloning (Madigan et al.
1997). Pemindahan gen kitinase A. caviae WS7b ke dalam lokus amyE pada kromosom B. subtilis 168 dengan cara rekombinasi ganda (double crossover recombination) (Hardwood dan Cutting 1990).
Perumusan Masalah
Bakteri Aeromonas caviae WS7B merupakan bakteri penghasil kitinase yang dapat dimanfaatkan sebagai agens hayati cendawan yang mempunyai dinding sel berupa kitin, namun beberapa strain Aeromonas caviae WS7b diketahui bersifat patogen terhadap manusia. Sebelumnya, Saputra (2009) berhasil melakukan penyisipan gen kitinase Aeromonas caviae dengan promoter sigB yang berhasil diekspresikan oleh Escherisia coli DH5α dengan vektor plasmid pDL2. Sehingga perlu adanya kloning atau rekayasa gen kitinase A. caviae WS7b pada mikroba yang non-patogenik pada manusia dan dapat diaplikasikan dilapang sebagai agens biokontrol, misalnya dengan penyisipan fusi gen sigB-chiA pada
B. subtilis 168. Hal ini diharapkan dapat diperoleh B. subtilis 168 rekombinan yang dapat di manfaatkan sebagai PGPR sekaligus agens hayati pengendali cendawan patogen tumbuhan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengintroduksi fusi promotor gen sigB dengan gen chiA (fusi promotor sigB-chiA) pada lokus amyE sehingga diperoleh isolat transforman B. subtilis 168.
Manfaat Penelitian
Manfaat penelitian ini yaitu memperoleh isolat transforman B. subtilis 168 yang dapat mengekspresikan enzim kitinase, B. subtilis 168 hasil transformasi dapat dijadikan sebagai isolat untuk pengembangan biokontrol, serta memberikan informasi salah satu penerapan rekayasa genetik dalam bidang perlindungan tanaman.
Hipotesis
Penelitian ini diharapkan dapat menyisipkan fusi promotor sigB-chiA kedalam lokus amyE di kromosom B. subtilis 168. Sehingga bakteri transforman
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini berlangsung mulai bulan Maret sampai Desember 2012.
Uji Aktivitas Kitinase Bakteri Uji
Bakteri yang gunakan dalam pengujian aktivitas kitinase adalah A. caviae
WS7b, B. subtilis 168, E. coliDH5α, dan E. coli transforman. Keempat bakteri ini merupakan isolat koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Isolat bakteri tersebut diremajakan terlebih dahulu dengan cara ditumbuhkan pada media NA (Nutrient Agar) (Bacto peptone 5 g, Beef Extract 3 g, Agar 15 g, akuades 1 L) kemudian setelah diinkubasi selama 1 hari, keempat bakteri ini diambil koloni tunggal dan ditumbuhkan pada media LB (Luria Broth) (Tryptone 10 g, NaCl 5 g, Yeast Extract 5 g, akuades 1 L) masing-masing 10 ml. Biakan diinkubasi pada suhu ruang dengan aerasi menggunakan shaker pada 100 rpm selama semalam. Isolat tersebut lalu diteteskan sebanyak 6 µl di atas media koloidal kitin agar (koloidal kitin 4 g, MgSO4.7H2O 0.5 g, K2HPO4 0.7 g, KH2PO4 0.3 g, FeSO4.7H2O 0.01 g, MnCl2 0.001 g, NaCl 0.3% (b/v), Yeast Extract 0.03% (b/v), Agar 20 g, akuades 1 L (Hackman 1962). Aktivitas kitinolitik ditunjukkan oleh adanya zona bening di sekitar koloni bakteri yang tumbuh pada media agar koloidal kitin.
4
Kloning Fusi Promotor sigB-chiA pada B. subtilis 168
Penyiapan Plasmid pDL2 dengan Sisipan Fusi Promotor sigB-chiA
Isolasi plasmid dilakukan dengan menggunakan metode lisis dengan alkali (Sambrook et al. 1989). Bakteri E. coliDH5α dengan plasmid pDL2 yang tersisipi
fusi promotor sigB-chiA, ditumbuhkan pada media NA yang mengandung antibiotik ampisilin 5 µg/ml dan diinkubasi selama 48 jam pada suhu ruang. Satu koloni diinokulasikan pada media LB 2 ml dalam tabung reaksi yang mengandung ampisilin 5 µg/ml dan diinkubasi pada suhu 37 oC dengan kecepatan 160 rpm menggunakan waterbath selama semalam. Biakan tersebut dipindahkan sebanyak 1.5 ml ke dalam tabung mikro volume 1.5 ml kemudian disentrifugasi dengan kecepatan 12,000 rpm pada suhu 4 oC selama 10 menit untuk mengendapkan sel bakteri. Supernatan dibuang hingga diperoleh pelet bakteri. Pelet diresuspensikan dengan 100 µl larutan I bersuhu 4 oC (50 mM glukosa, 25 mM Tris.Cl pH 8.0, 10 mM EDTA pH 8.0), kemudian divorteks hingga sel tersuspensi. Sebanyak 200 µl larutan II (0.2 N NaOH, 1% SDS, dicampurkan sesaat sebelum digunakan) ditambahkan dan dicampurkan dengan cara membalikkan tabung 6-8 kali. Sebangyak 150 µl larutan III (3M Sodium acetate pH 5.2, penurunan pH dilakukan dengan menambahkan Glacial acetic acid pekat) ditambahkan pada tabung mikro dan dicampur. Pencampuran dilakukan dengan cara membalikkan tabung 6-8 kali. Tabung disentrifugasi dengan kecepatan 12,000 rpm pada suhu 4 o
C selama 10 menit. Supernatan paling atas tabung dipindahkan sebanyak 400 µl ke tabung mikro baru, kemudian ditambah PCI (phenol: chloroform: isoamil alkohol, 25:24:1) sebanyak 1X volume (400 µl), kemudian divorteks dan disentrifugasi 12,000 rpm pada suhu 4 oC selama 10 menit. Setelah disentrifugasi, terbentuk dua lapisan yang dibatasi oleh lapisan warna putih, supernatan paling atas dipindahkan sebanyak 300 µl ke dalam tabung mikro baru, lalu ditambahkan RNase I 0.5 unit/µl sebanyak 10 µl dan diinkubasi pada suhu ruang selama semalam untuk menghilangkan RNA. Kemudian ditambahkan PCI 500-600 µl lalu divorteks agar tercampur merata setelah itu disentrifugasi dengan kecepatan 10,000 rpm suhu ruang selama 2 menit. Cairan bagian atas diambil dan dipindahkan kedalam tabung mikro baru. Larutan dipresipitasi dengan menambahkan 0.1X volume 3M Sodium acetat pH 5.2 dan 2X volume etanol absolut, lalu diinkubasi pada suhu -20 oC selama semalam. Larutan tersebut disentrifugasi dengan kecepatan 12,000 rpm pada suhu 4 oC selama 10 menit. Bagian supernatan dibuang, pelet dicuci dengan etanol 70% dan disentrifugasi 12,000 rpm pada suhu 4 oC selama 10 menit. Pelet dikeringkan dan ditambahkan dengan buffer TE 50 µl dan kemudian disimpan pada suhu -20 oC.
Sebelum dilakukan pemotongan DNA dilakukan pemilihan enzim restriksi dengan cara mencocokkan situs pemotongan enzim dengan gen sisipan (fusi sig
5 Transformasi Plasmid ke dalam B. subtilis 168
Penyiapan B. subtilis 168 kompeten. B. subtilis 168 kompeten dapat diperoleh menggunakan metode Anagnostopoulos dan Spizizen (1961), dengan cara ditumbuhkan terlebih dahulu isolat B. subtilis 168 pada media LA. Biakan diinkubasi pada suhu 37 oC selama satu malam. Koloni tunggal dari biakan tersebut diambil dan diinokulasi pada media CI (1x Spizizen media [10x Spizizen media per liter= 140 g K2HPO4, 60 g KH2PO4, 20 g (NH4)2SO4, 5 g Na-acetat.2H2O]) 10 ml, 50% Glukosa 0.1 ml, 2.5 mg/ml L-Tryptophan 0.2 ml, 1 M MgSO4.7H2O 0.05 ml, 5% Cassamino A acid 0.03 ml, 5% Yeast Extract 0.1 ml) dengan aerasi tinggi yaitu diinkubasi dengan shaker pada kecepatan 165 rpm suhu 37 oC. Pertumbuhan bakteri tersebut dihitung secara berkala nilai OD600 hingga pertumbuhan sel bakteri mencapai fase eksponensial akhir. Setelah mencapai akhir fase eksponensial, biakan diambil 0.5 ml lalu diendapkan dengan cara disentrifugasi dengan kecepatan 12,000 rpm selama 5 menit. Supernatan dibuang, sedangkan pelet diresuspensikan dengan 1 ml media CII (komposisi per 10 ml: 1X Spizizen media 10 ml, 50% Glukosa 0.1 ml, 2.5 mg/ml L-Tryptophan 0.05 ml, 1 M MgSO4.7H2O 0.05 ml, 5% Casein hydrolisate 0.015, 5% Yeast extract 0.01 ml), diinkubasi selama 30 menit pada suhu 37oC.
Transformasi plasmid pDL2 dengan sisipan promotor sigB-chiA pada sel kompeten B. subtilis 168. Setelah diperoleh sel kompeten, kemudian diambil sebanyak 250 µl biakan bakteri tersebut dan ditambah 2 µl plasmid lalu dinkubasi pada suhu 37 oC selama 1-1.5 jam. Biakan tersebut ditumbuhkan pada media LA yang telah ditambah antibiotik klorampenikol dengan konsentrasi 5 µg/ml dan diinkubasi pada suhu 37 oC selama semalam.
Konfirmasi Keberhasilan Transformasi
Konfirmasi keberhasilan transformasi dilakukan dengan beberapa metode, yaitu: uji resistensi antibiotik, uji kitinolitik, pewarnaan Gram, identifikasi molekuler dengan sekuensing gen 16S rRNA.
Resistensi antibiotik. B. subtilis 168 yang telah ditransformasi dengan plasmid pDL2 yang mengandung fusi promotor sigB-chiA ditumbuhkan pada media LA dengan antibiotik klorampenikol 5 µg/ml dan diinkubasi semalam. B. subtilis transforman akan tumbuh karena mempunyai sisipan gen ketahanan antibiotik klorampenikol yang terintegrasi pada plasmid PDL2.
Uji kitinolitik. Koloni yang tumbuh pada media dengan antibiotik klorampenikol kemudian diisolasi. Masing-masing isolat yang diperoleh kemudian dipindahkan pada 2 ml LB yang ditambah dengan antibiotik klorampenikol dan diinkubasi pada suhu ruang dengan aerasi menggunakan
shaker pada kecepatan 150 rpm selama semalam. Biakan tersebut diambil 6 µl dan diteteskan pada media agar koloidal kitin. Kemudian diinkubasi selama 24-48 jam dan diamati aktivitas kitinolitik. Aktivitas kitinolitik ditunjukkan adanya zona bening disekitar koloni yang tumbuh.
Pewarnaan Gram. Pewarnaan Gram dilakukan dengan modifikasi metode Hans Christian Gram (Pollack et al. 2009). Isolat ditumbuhkan pada media LA kemudian diambil satu koloni dan ditempatkan pada kaca preparat bersih. Kaca dilewatkan diatas api bunsen untuk melekatkan bakteri. Setelah itu ditetesi dengan
6
lalu dikeringanginkan. Selanjutnya ditetesi iodine dan dibiarkan satu menit. Preparat dicuci kembali menggunakan aquades mengalir dan dikeringkan. Setelah itu dicuci dengan alkohol 70% selama 5 sampai 10 detik dan dibilas menggunakan aquades lalu dikeringkan. Setelah kering ditambahkan larutan safranin selama 30 detik dan dicuci kembali dengan akuades serta dikeringanginkan. Langkah terakhir diamati menggunakan mikroskop cahaya perbesaran 1000 kali. Gram positif akan berwarna biru sedangkan gram negatif berwarna merah.
HASIL DAN PEMBAHASAN
Aktivitas Kitinase pada Bakteri Uji
Eksplorasi bakteri kitinolitik mempunyai perkembangan yang cukup pesat seiring dengan tujuan pemanfaatannya sebagai pendegradasi kitin. Beberapa bakteri yang telah dilaporkan menghasilkan kitinase, diantaranya yaitu:
Lecanicilium psalliotae (syn. Verticillium psalliotae) (Gan et al. 2007), Serratia marcescens (Brurberg et al. 2000), dan A. caviae WS7b (Wenuganen 1996), A. schubertii (Guo et al. 2004), Pseudomonas aeruginosa K-187 (Wang dan Chang 1997), Vibrio sp. 98CJ11027 (Park et al. 2000).
Aktivitas kitinase dapat diuji secara kualitatif dengan adanya zona bening yang ada di sekitar koloni pada media agar kitin koloidal. Pengujian aktivitas kitinase isolat A. caviae WS7b, B. subtilis 168, E. coliDH5α, dan Escherisia coli
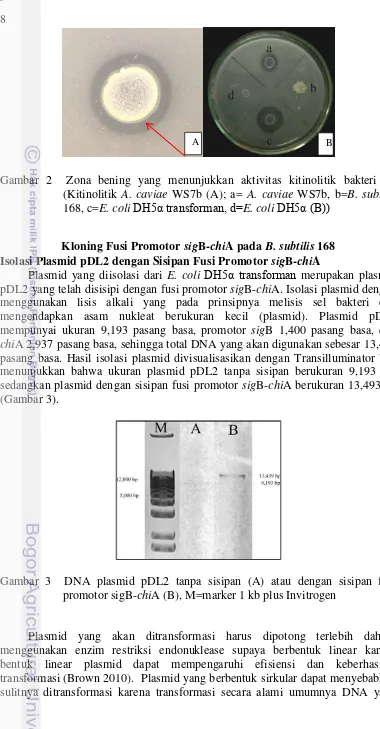
DH5α transforman (dengan sisipan fusi promotor sigB-chiA) dilakukan pada media agar koloidal kitin. Hasil pengujian kitinolitik menunjukkan bahwa A. caviae WS7b dan E. coli DH5α transforman menunjukkan aktivitas kitinolitik
positif yang ditandai adanya zona bening disekitar isolat yang tumbuh, sedangkan pada B. subtilis 168 dan E. coli DH5α non-transforman tidak menunjukan aktivitas kitinolitik (kitinolitik negatif) karena tidak adanya zona bening yang terbentuk disekitar koloni yang tumbuh. Zona bening tersebut merupakan hasil degradasi kitin oleh enzim kitinase. Menurut Wirth dan Wolf (1990), terbentuknya zona bening ini menandakan adanya aktivitas kitinase.
Bakteri A. caviae WS7b menunjukkan aktivitas kitinase yang tinggi pada saat ditumbuhkan pada media kitin (Inbar dan Chet 1991, Wenuganen 1996). Kemampuan A. caviae WS7b dalam mendegradasi kitin disandikan oleh gen penyandi kitinase. Menurut Sitrit et al. (1995), gen yang menyandikan kitinase pada Aeromonas caviae adalah gen chiA. Gen chiA menyandikan kitinase yang dapat mendegradasi kitin ketika kitin tersedia dilingkungan, sedangkan apabila kitin tidak tersedia di alam, gen chiA tidak terekspresikan sehingga tidak dihasilkan kitinase.
Perkembangan rekayasa genetik memungkinkan adanya penggantian promotor. Promotor adalah bagian dari segmen DNA yang dikenali oleh RNA polimerase (Price 2002). Salah satu gen yang bekerja berdasarkan respon lingkungan dan telah diketahui fungsinya adalah sigB (σB). Menurut Saputra (2009), penggantian promotor dapat meningkatkan aktivitas kitinase. Pada E. coli
8
Gambar 2 Zona bening yang menunjukkan aktivitas kitinolitik bakteri uji (Kitinolitik A. caviae WS7b (A); a= A. caviae WS7b, b=B. subtilis
168, c=E. coliDH5α transforman, d=E. coliDH5α (B))
Kloning Fusi Promotor sigB-chiA pada B. subtilis 168 Isolasi Plasmid pDL2 dengan Sisipan Fusi Promotor sigB-chiA
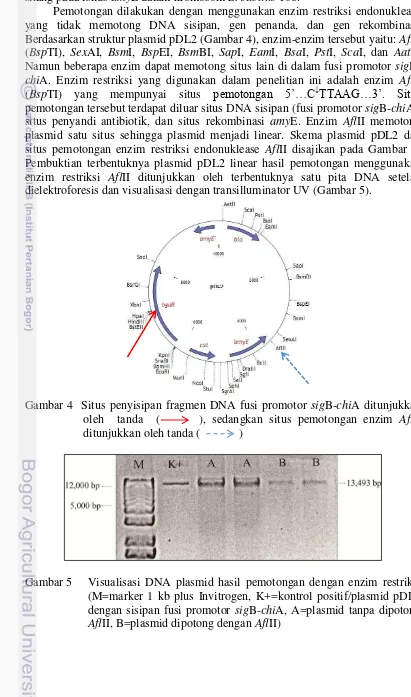
Plasmid yang diisolasi dari E. coli DH5α transforman merupakan plasmid pDL2 yang telah disisipi dengan fusi promotor sigB-chiA. Isolasi plasmid dengan menggunakan lisis alkali yang pada prinsipnya melisis sel bakteri dan mengendapkan asam nukleat berukuran kecil (plasmid). Plasmid pDL2 mempunyai ukuran 9,193 pasang basa, promotor sigB 1,400 pasang basa, dan
chiA 2,937 pasang basa, sehingga total DNA yang akan digunakan sebesar 13,493 pasang basa. Hasil isolasi plasmid divisualisasikan dengan Transilluminator UV menunjukkan bahwa ukuran plasmid pDL2 tanpa sisipan berukuran 9,193 bp, sedangkan plasmid dengan sisipan fusi promotor sigB-chiA berukuran 13,493 bp (Gambar 3).
Gambar 3 DNA plasmid pDL2 tanpa sisipan (A) atau dengan sisipan fusi promotor sigB-chiA (B), M=marker 1 kb plus Invitrogen
Plasmid yang akan ditransformasi harus dipotong terlebih dahulu menggunakan enzim restriksi endonuklease supaya berbentuk linear karena bentuk linear plasmid dapat mempengaruhi efisiensi dan keberhasilan transformasi (Brown 2010). Plasmid yang berbentuk sirkular dapat menyebabkan sulitnya ditransformasi karena transformasi secara alami umumnya DNA yang
9 berbentuk linear atau DNA kromosom (Old dan Primrose 1989). Namun dalam penelitian ini pemotongan plasmid bertujuan untuk optimalisasi rekombinasi silang pada lokus amyE dalam kromosom B. subtilis 168.
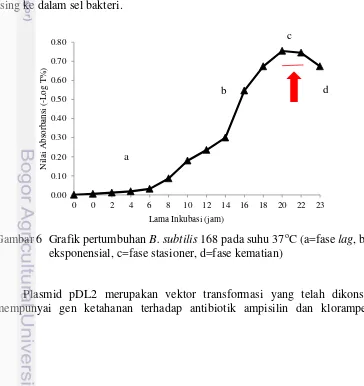
Pemotongan dilakukan dengan menggunakan enzim restriksi endonuklease yang tidak memotong DNA sisipan, gen penanda, dan gen rekombinasi. Berdasarkan struktur plasmid pDL2 (Gambar 4), enzim-enzim tersebut yaitu: AflII (BspTI), SexAI, BsmI, BspEI, BsmBI, SapI, EamI, BsaI, PstI, ScaI, dan AatII. Namun beberapa enzim dapat memotong situs lain di dalam fusi promotor sig
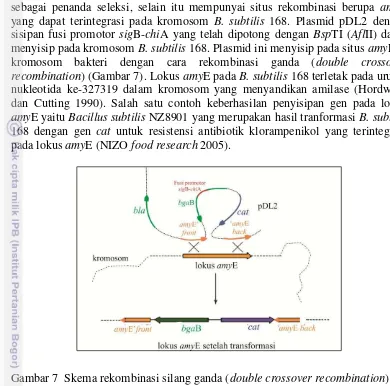
B-chiA. Enzim restriksi yang digunakan dalam penelitian ini adalah enzim AflII (BspTI) yang mempunyai situs pemotongan 5’…C↓TTAAG…3’. Situs pemotongan tersebut terdapat diluar situs DNA sisipan (fusi promotor sigB-chiA), situs penyandi antibiotik, dan situs rekombinasi amyE. Enzim AflII memotong plasmid satu situs sehingga plasmid menjadi linear. Skema plasmid pDL2 dan situs pemotongan enzim restriksi endonuklease AflII disajikan pada Gambar 4. Pembuktian terbentuknya plasmid pDL2 linear hasil pemotongan menggunakan enzim restriksi AflII ditunjukkan oleh terbentuknya satu pita DNA setelah dielektroforesis dan visualisasi dengan transilluminator UV (Gambar 5).
Gambar 4 Situs penyisipan fragmen DNA fusi promotor sigB-chiA ditunjukkan oleh tanda ( ), sedangkan situs pemotongan enzim AflII ditunjukkan oleh tanda ( )
Gambar 5 Visualisasi DNA plasmid hasil pemotongan dengan enzim restriksi (M=marker 1 kb plus Invitrogen, K+=kontrol positif/plasmid pDL2 dengan sisipan fusi promotor sigB-chiA, A=plasmid tanpa dipotong
10
Transformasi Plasmid ke dalam B. subtilis 168
Langkah awal penyiapan B. subtilis 168 kompeten yaitu mengkondisikan isolat B. subtilis pada fase awal stasioner (early stationer). Menurut Old dan Primrose (1989), Terjadinya transformasi secara alami berkaitan dengan kondisi kompeten sel selama sel tumbuh. Kondisi ini biasanya terjadi menjelang phase sel stasioner (early stationery phase) saat sel mencapai kerapatan atau populasi tertinggi sepanjang pertumbuhannya. Kompeten sel sangat memungkinkan DNA luar masuk kedalam sel bakteri. Secara alami, frekuensi terjadinya transformasi DNA sangat rendah dikarenakan adanya syarat tertentu seperti kontak antar sel, homologi dari DNA yang bersangkutan, adanya proses modifikasi dalam inang, kondisi morfologi (kemampuan membentuk phili) dan perlunya gen khusus seperti gen tra untuk proses konjugasi (Brown 2010).
Penyiapan kompeten sel bakteri dapat dilakukan dengan cara bakteri ditumbuhkan, didinginkan, dipanen dan dicuci dengan bufer dengan kandungan garam rendah untuk menurunkan tegangan ion dari suspensi sel (Sambrook et al .
1989). B. subtilis 168 yang digunakan sebagai inang transformasi merupakan bakteri yang memerlukan tambahan satu atau lebih nutrisi tambahan (auxotroph). Bahan tambahan yang ditambahkan dalam media yang digunakan adalah tryptophan (Anagnostopoulos 1961). Menurut Solomon (1999), dalam banyak organisme, perkembangan kompetensi dan ekspresi dari pengambilan DNA luar merupakan regulasi yang diatur dari respon sinyal antar sel dan kondisi nutrisi untuk pertumbuhan.
Dalam penelitian ini diperoleh data bahwa B. subtilis 168 yang ditumbuhkan pada Spizizen media 10 ml mencapai fase akhir eksponensial sekitar 20-22 jam (Gambar 6). Kondisi sel kompeten diperlukan untuk efektifitas pengambilan DNA asing ke dalam sel bakteri.
Gambar 6 Grafik pertumbuhan B. subtilis 168 pada suhu 37oC (a=fase lag, b=fase eksponensial, c=fase stasioner, d=fase kematian)
Plasmid pDL2 merupakan vektor transformasi yang telah dikonstruksi mempunyai gen ketahanan terhadap antibiotik ampisilin dan klorampenikol
11 sebagai penanda seleksi, selain itu mempunyai situs rekombinasi berupa amyE yang dapat terintegrasi pada kromosom B. subtilis 168. Plasmid pDL2 dengan sisipan fusi promotor sigB-chiA yang telah dipotong dengan BspTI (AflII) dapat menyisip pada kromosom B. subtilis 168. Plasmid ini menyisip pada situs amyE di kromosom bakteri dengan cara rekombinasi ganda (double crossover recombination) (Gambar 7). Lokus amyE pada B. subtilis 168 terletak pada urutan nukleotida ke-327319 dalam kromosom yang menyandikan amilase (Hordward dan Cutting 1990). Salah satu contoh keberhasilan penyisipan gen pada lokus
amyE yaitu Bacillus subtilis NZ8901 yang merupakan hasil tranformasi B. subtilis
168 dengan gen cat untuk resistensi antibiotik klorampenikol yang terintegrasi pada lokus amyE (NIZO food research 2005).
Gambar 7 Skema rekombinasi silang ganda (double crossover recombination) antara plasmid pDL2 dan kromosom B. subtilis 168
Konfirmasi Keberhasilan Transformasi
12
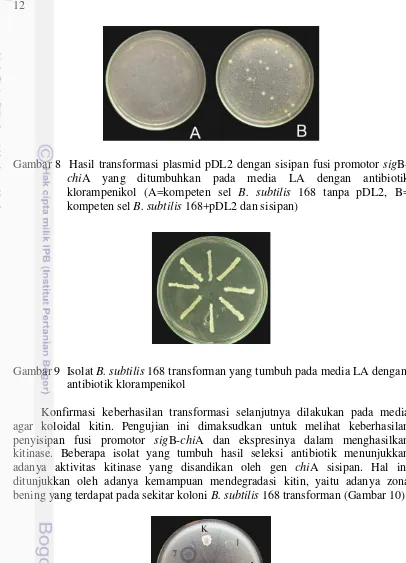
Gambar 8 Hasil transformasi plasmid pDL2 dengan sisipan fusi promotor sig
B-chiA yang ditumbuhkan pada media LA dengan antibiotik klorampenikol (A=kompeten sel B. subtilis 168 tanpa pDL2, B= kompeten sel B. subtilis 168+pDL2 dan sisipan)
Gambar 9 Isolat B. subtilis 168 transforman yang tumbuh pada media LA dengan antibiotik klorampenikol
Konfirmasi keberhasilan transformasi selanjutnya dilakukan pada media agar koloidal kitin. Pengujian ini dimaksudkan untuk melihat keberhasilan penyisipan fusi promotor sigB-chiA dan ekspresinya dalam menghasilkan kitinase. Beberapa isolat yang tumbuh hasil seleksi antibiotik menunjukkan adanya aktivitas kitinase yang disandikan oleh gen chiA sisipan. Hal ini ditunjukkan oleh adanya kemampuan mendegradasi kitin, yaitu adanya zona bening yang terdapat pada sekitar koloni B. subtilis 168 transforman (Gambar 10).
Gambar 10 Hasil uji aktivitas kitinolitik transforman B. subtilis 168 (k=B.subtilis
13 Isolat 1,2,3 tidak menunjukkan adanya aktivitas kitinolitik, sedangkan pada isolat 4, 5, 6, dan 7 menunjukkan aktivitas kitinolitik. Hal ini dapat disebabkan karena terjadi mutasi genetik yang menyebabkan sel kompeten dapat resisten terhadap antibiotik kloramfenikol. Menurut Anderson et al. (1984), B. subtilis
dapat mengalami mutasi gen dan resiten terhadap antibiotik klorampenikol hingga konsentrasi 20 µg/ml. Mutasi ini dapat terjadi spontan pada cam-2 dan telah dipetakan terjadi pada region ribosomal protein.
Menurut Glick dan Pasternak (2003) kloning dinyatakan berhasil apabila mampu mengkonstruksi DNA hingga menghasilkan protein yang diinginkan pada sel inang, dalam penelitian ini yaitu kitinase. Dari keempat isolat dipilih dua isolat transforman B. subtilis 168 yang mirip dengan B. subtilis 168 wild type secara morfologi koloni pada Gambar 10 (berwarna putih keruh dan permukaan bergelombang) yaitu transforman 4 dan 5.
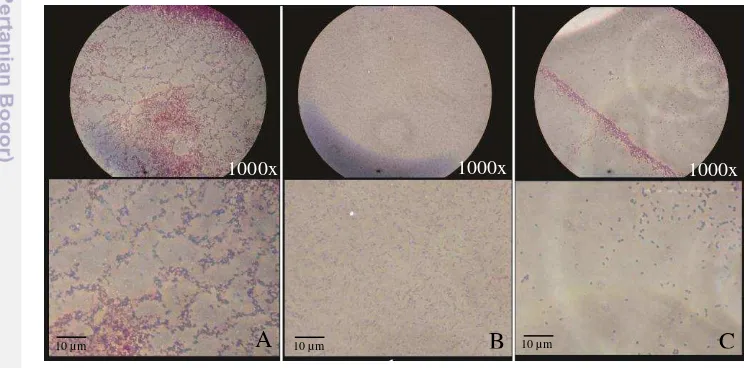
Isolat transforman 4 (selanjutnya disebut Bs168TcA4) dan 5 (selanjutnya disebut Bs168TcA5) penghasil kitinase dikonfirmasi dengan pengamatan mikroskopis melalui teknik pewarnaan gram. B. subtilis 168 merupakan bakteri gram positif. Sehingga dalam pewarnaan gram menunjukkan warna ungu atau
violet. Hasil pewarnaan menunjukkan bahwa Bs168TcA4 dan Bs168TcA5 setelah diamati dibawah mikroskop cahaya menunjukkan warna biru, bentuk basil (batang), dan berukuran sekitar 2-3 µm (Gambar 11).
Gambar 11 Pengamatan mikroskopis dengan pewarnaan Gram (A=B. subtilis 168
wild type, B=Bs168TcA4, C=Bs168TcA5)
Secara molekuler, pembuktian keberhasilan transformasi pada B. subtilis
dengan amplifikasi gen 16S rRNA dan di-sequensing. Sekuensing gen 16S rRNA bertujuan untuk memastikan bahwa klon yang diperoleh adalah bakteri B. subtilis
168. Sebelum amplifikasi gen 16S rRNA terlebih dahulu dilakukan ekstraksi DNA total. Menurut Sambrook et al. (2000), proses pendegradasian dinding sel dilakukan secara enzimatik seperti penggunaan lisozim, sedangkan untuk mendegradasi membran sel menggunakan deterjen. Pada metode, bahan yang digunakan sebagai deterjen adalah sodium dedoxyl sulfat (SDS). Penggunaan EDTA dalam proses ektraksi DNA bertujuan untuk menghindari rusaknya
A B C
1000x 1000x 1000x
14
DNA karena larutan ini mengikat Mg2+. Ion ini dibutuhkan oleh enzim DNase untuk mendegradasi DNA. Metode pemancingan DNA total menggunakan ujung tip yang bertujuan untuk meminimalkan terjadinya campuran bahan-bahan lain, sehingga dengan penggunaan metode ini diharapkan hanya DNA yang terambil.
Berdasarkan hasil ekstraksi DNA total bakteri yang telah dilakukan menunjukkan bahwa genom DNA berhasil diisolasi yang ditunjukkan adanya pita DNA yang nampak setelah dielektroforesis dan divisualisasi dengan Transilluminator UV pada bagian dekat sumur (Gambar 12). Hal ini menunjukkan bahwa DNA total mempunyai ukuran yang besar. Kunst et al. (1997) melaporkan bahwa DNA total bakteri B. subtilis yaitu 4,214,814 bp (4.2 Mbp).
Gambar 12 Visualisasi DNA kromosom hasil purifikasi (M= Marker 1 kb plus
Invitrogen, A= B. subtilis 168 wilt type, B= transforman Bs168TcA4, C= transforman Bs168TcA5, K= kontrol)
Setelah DNA total berhasil diperoleh maka dapat dilakukan amplifikasi 16S rRNA menggunakan primer universal yaitu 27F dan 1492R. Amplifikasi ini dilakukan untuk mengidentifikasi dan memastikan bahwa bakteri transforman tersebut adalah B. subtilis 168. Hasil yang diperoleh dari amplifikasi gen 16S rRNA dengan elektroforesis menunjukkan ukuran DNA sekitar 1,500 bp (Gambar 13). Identifikasi dengan sekuensing gen 16S rRNA lebih akurat dengan mengetahui susunan nukleotida dari organisme tersebut. Urutan nukleotida tersebut kemudian dapat dicocokkan lebih lanjut antara sekuen transforman dengan B. subtilis168 transforman hasil kloning yang telah dilakukan dengan menggunakan perangkat lunak Basic Local Allignment Search Tool (BLAST) (http://www.ncbi.nlm.nih.gov/BLAST/) (Zhang et al. 2000).
15 Selain kloning pada B. subtilis 168, gen chiA juga telah dilaporkan berhasil dikloning ke tanaman. Armini (2005) melaporkan gen kitinase dari A. caviae
SIMPULAN DAN SARAN
Simpulan
Tahapan kloning (konfirmasi aktivitas kitinolitik, isolasi plasmid, pemotongan dengan enzim restriksi, penyiapan kompeten sel, dan transformasi plasmid) telah berhasil dilakukan. Penyisipan fusi promotor sigB-chiA berhasil dilakukan dengan cara rekombinasi ganda (double crossover recombination) pada situs amyE penyandi amilase yang terdapat dalam kromosom B. subtilis 168. Transforman B. subtilis 168 mampu tumbuh pada media antibiotik klorampenikol, menunjukkan adanya aktivitas kitinase pada media agar koloidal kitin, dan berwarna biru pada saat pewarnaan gram. Identifikasi hasil PCR dengan sekuensing gen 16S rRNA dapat menjadi cara identifikasi lebih lanjut.
Saran
DAFTAR PUSTAKA
Anagnostopoulos C, Spizizen J. 1961. Requirements for transformation in
Bacillus subtilis. J Bacteriol. 81(5):741-746
Anderson LM, Henkin TM, Chambliss GH, Bott KF. 1984. New chloramphenicol resistance locus in Bacillus subtilis. J Bacteriol. 158 (1):386–388.
Benson AK, Haldenwang WG. 1993. The sigB-dependent promoter of the B. subtilis sigB operon is induced by heat shock. J Bacteriol. 175(7):1929– 1935.
Brown TA. 2010. Gene Cloning and DNA Analysis: An Introduction.6th ed. New York (US): Wiley-Blackwell.
Brurberg MB, Synstad B, Klemsdal SS, Van Aalten DMF, Eijsink VG. 2001. Chitinases from Serratia marcescens. Rec Res Dev Microbiol. 5 (2001):187–204.
Cook R, Baker KF. 1996. The Nature dan Practice of Biological Control of Plant Pathogens. Minnesota (US): APS Press.
Gan Z, Yang J, Tao N, Liang L, Mi Q. 2007. Cloning of the gene Lecanicillium psalliotae chitinase Lpchi1 and identification of its potential role in the biocontrol of root-knot nematode Meloidogyne incognita. Appl Microbiol Biotechnol. 76 (6):1307-1317.
Glick BR, Pasternak JJ. 2003. Molecular Biotechnology: Principles and Application of Recombinant DNA. 3th ed. Washington DC (US): ASM Press. Guo SH, Chen JK, Lee WC. 2004. Purification and characterization of extracellular chitinase from Aeromonas schubertii. Enzyme and Microb Tech. 35 (6-7):550–556. bacterium. Soil Biol Biochem. 23 (10):973-978.
Kunst F. 1997. The complete genome sequence of the Gram-positive bacterium
Bacillus subtilis. Nature. 390 (6657): 249-256.
Madigan MT, Martinko JM, Parker J. 1997. Biology of Microorganisms. 8th ed. New Jersey (US): Prentice Hall.
Malik A. 2000. Pengklonan gen kitinase bacterial menggunakan teknik mutagenesis transposon dan DNA pelacak heterologous [disertasi]. Bogor (ID): Program Pascasarjana, Institut Pertanian Bogor.
Old RW, Primrose SB. 1989. Principle of Manipulation: An Introduction to Genetic Engineering. New York (US): Blackwell Scientific Publication. Ordentlich A, Elad Y, Chet I. 1988. The role of chitinase of Serratia marcescens
in biocontrol of Sclerotium rolfsii. Phytopathology. 78 (1):84-88.
Park SH, Lee JH, Lee HK. 2000. Purification and characterization of chitinase from marine bacterium, Vibrio sp. 98CJ11027. J Microbiol. 38 (4):224–229. Pollack RA, Findlay L, Mondschein W, Modesto RR. 2009. Labolatory Exercises
18
Price CW. 2002. General stress response. Di dalam: Sonenshein AL, Hoch JA, Losick R (editor). Bacillus subtilis and Its Closest Relatives: from Genes to Cells. Washington (US): ASM Press.
Roberts PW, Selitrennikof CP. 1988. Plant and bacterial chitinase differ in antifungal activity. J Gen Microbiol. 134 (1):169-176.
Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular Cloning. New York (US): Cold Spring Harbor Laboratory Press.
Saputra A. 2009. Fusi Gen Kitinase Aeromonas caviae WS7b dengan Promotor
sigB dari Bacillus subtilis 168 dan Ekspresinya pada Escherichia coli
[skripsi]. Bogor (ID): Institut Pertanian Bogor, IPB.
Sitrit Y, Vorgias CE, Chet I, Oppenheim AB. 1995. Cloning and primary structure of the chiA gene from Aeromonas caviae. J Bacteriol. 177 (14):4187-4189. Sonenshein AL, Hoch JA, Losick R (editor). 2002. Bacillus subtilis and Its
Closest Relatives: from Genes to Cells. Washington (US): ASM Press. Vyas P, Deshpande MV. 1989. Chitinase production by Myrothecium verrucaria
and its significance for fungal mycelia degradation. J Gen Appl Microbiol.
35 (5):343-350.
Wang SL, Chang WT. 1997. Purification and characterization of two bifunctional chitinases/lysozymes extracellulary produced by Pseudomonas aeruginosa
K-187 in a shrimp and crab shell powder medium, Appl Environ Microbiol. 63 (1997):380–386.
Wenuganen S. 1996. Pengklonan gen kitinase bacterial menggunakan teknik mutagenesis transposon dan DNA pelacak heterologus [tesis]. Bogor (ID): Program Pascasarjana, Institut Pertanian Bogor.
Wirth SJ, Wolf GA. 1990. Dye-labelled substrates for the assay and detection of chitinase and lysozyme activity. J Microbiol Meth. 12 (3):197-205.
Zhang Z, Schwartz S, Wagner L, Miller W. 2000. A greedy algorithm for aligning DNA sequences. J Comput Biol. 7(1-2):203-214.
LAMPIRAN
Lampiran 1 Sekuen promotor sigB B. subtilis 168
1 AGAACGGAAAACGGTTTCTTGGAGCGTCCTGATCTGCAGAAGCTCATTGAGGAACATATG 61 TGTTCCTCTGCGCAGGAAATGGTCAAAAACATTTATGACAGCCTCCTCAAATTGCAGGAT
121 TTTCAGCTTCACGATGATTTTACGTTAATTGTTTTGCGGAGAAAGGTTTAACGTCTGTCA
181 GACGAGGGTATAAAGCAACTAGTGATTTGAAGGAAAATTTGAGGTGATACGAATGAATAT
241 AAATGTTGATGTGAAGCAAAACGAGAATGATATACAAGTAAACATTGCAGGAGAAATTGA 301 TGTATACTCAGCCCCGGTGCTTAGAGAGAAGCTCGTTCCTCTGGCAGAACAAGGAGCTGA 361 CTTAAGAATTTGCCTGAAAGATGTCAGCTACATGGACAGTACCGGATTGGGCGTTTTTGT 421 AGGGACCTTTAAAATGGTGAAAAAACAAGGTGGTTCGCTGAAACTTGAAAATCTTTCTGA 481 ACGGCTGATCCGACTGTTTGACATTACAGGCTTGAAGGACATCATTGATATTTCTGCAAA 541 GTCAGAAGGTGGAGTGCAATGAAGAATAATGCTGATTACATCGAAATGAAAGTGCCGGCC 601 CAACCTGAATATGTGGGAATTATAAGACTGACGCTGTCAGGGGTCGCAAGCAGAATGGGC 661 TATACGTACGATGAAATTGAAGACTTGAAAATCGCAGTCAGTGAGGCGTGCACAAATGCG 721 GTTCAGCACGCTTACAAAGAAGATAAAAATGGGGAAGTGTCAATACGATTCGGTGTGTTT 781 GAAGACCGTTTAGAGGTTATTGTGGCGGATGAAGGAGACAGCTTTGACTTTGATCAAAAG 841 CAGCAGGATCTAGGGCCGTACACACCTTCGCACACAGTTGATCAATTATCAGAAGGAGGG 901 CTCGGTCTATATTTAATGGAAACGCTCATGGATGAAGTCAGAGTGCAAAACCACTCCGGC 961 GTCACCGTAGCGATGACAAAGTATTTAAATGGGGAGCGAGTTGATCATGACACAACCATC 1021 AAAAACTACGAAACTAACTAAAGATGAAGTCGATCGGCTCATAAGCGATTACCAAACAAA 1081 GCAAGATGAACAAGCGCAGGAAACGCTTGTGCGGGTGTATACAAATCTGGTTGACATGCT 1141 TGCGAAAAAATACTCAAAAGGCAAAAGCTTCCACGAGGATCTCCGCCAGGTCGGCATGAT 1201 CGGGCTGCTAGGCGCGATTAAGCGATACGATCCTGTTGTCGGCAAATCGTTTGAAGCTTT 1261 TGCAATCCCGACAATCATCGGTGAAATTAAACGTTTCCTCAGAGATAAAACATGGAGCGT 1321 TCATGTGCCGAGACGAATTAAAGAACTCGGTCCAAGAATCAAAATGGCGGTTGATCAGCT 1381 GACCACTGAAACACAAAGATCGCCGAAAGTCGAAGAGATTGCCGAATTCCTCGATGTTTC 1441 TGAAGAAGAGGTTCTTGAAACGATGGAAATGGGCAAAAGCTATCAAGCCTTATCCGTTGA
Keterangan:
- Daerah yang dikenali oleh sigma faktor dalam proses transkripsi nukleotida (GGGTAT), dan (AGGTTTAA)
20
Lampiran 2 Sekuen gen kitinase (ChiA) A. Caviae WS7b
1 CCGGTCTAAGGGTCTGCGTACCTAGGATAGCGGGGCCACCACAGGTTGTATCGTCCATGG
61 GCCAAGCCATGGCTGCGATGTTGTCTGCGTTACCTGGCAGGTTGCGTTGCCTTTTTCGTT
121 GTTAATTCCAATAACGAAATAAGGAAGTTCAAATATGTTAAGTCCAAAACTTTCCCTGCT
181 GGCGCTTCTGGTCGGGGGGCTTTGCACTACCTCCGCCTTCGCCGCTGCCCCGGGCAAACC
2761 GATGAAAAATGGGGCCGAGGGGATTTTTGTCTTGCGTGGTCGGGTGTGTGTTCCCTGTCA
2821 GGGGAAAGGCGCACTCGCTTTGTCAAAAAGGCCCGTCAGGGCCTTTTTTCATGGTATGTC
2881 ACCGGTTCACAGCGGTTTTTGCCACAGGCTGAGCAGCAGATCCTG
Keterangan:
- AGGA (Shine Dalgarno) sebagai situs pengikatan ribosom - Kodon inisiasi translasi (ATG)
- Kodon terminasi translasi (TGA)
21 Lampiran 3 Enzim restriksi dan situs pemotongannya pada plasmid pDL2 di luar
lokus amyE.
No. Enzim Restriksi
Situs Pemotongana Situs Pemotongan lainb
1 BspTI (AflII) 5’…C↓TTAAG…3’ Tidak ada
2 SexAI 5’…A↓CCWGGT…3’ Tidak ada
3 BsmI 5’...GAATGCN↓...3’ Tidak ada
4 BspEI 5’…T↓CCGGA…3’ Empat situs pada gen chiA
5 SapI 5’…GCTCTTC(N)↓…3’ Tidak ada
6 EamI 5’…GACNNN↓NNGTC…3’ Terlalu umum (belum dianalisis)
7 BsaI 5’… GGTCTC(N)↓…3’ Dua situs pada gen chiA
8 PstI 5’…CTGCA↓G…3’ Satu situs pada promotor sigB,
satu situs pada gen chiA
9 ScaI 5’…AGT↓ACT…3’ satu situs pada gen chiA
10 AatII 5’…GACGT↓C…3’ Satu situs pada gen chiA
Keterangan: a kode nukleotida (C=Cytosin, G=Guanin, A=Adenin, T=Timin, W=A atau T, N=G, A, T, C)
b
Situs pemotongan yang terdapat didalam fusi promotor sigB-chiA
↓
22