iii
PERNYATAAN
POTENSI BAKTERI KITINOLITIK DALAM PENGENDALIAN Aspergillus
niger PENYEBAB PENYAKIT BUSUK PANGKAL AKAR PADA TANAMAN
KACANG TANAH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2013
vi
POTENSI BAKTERI KITINOLITIK DALAM PENGENDALIAN Aspergillus
niger PENYEBAB PENYAKIT BUSUK PANGKAL AKAR PADA TANAMAN
KACANG TANAH
ABSTRAK
Penelitian ini tentang potensi bakteri kitinolitik dalam pengendalian A. niger penyebab penyakit busuk pangkal akar pada tanaman kacang tanah telah dilakukan di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT. Balai Proteksi Tanaman Pangan dan Hortikultura 1, dan Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Penelitian ini bertujuan untuk mengetahui potensi bakteri kitinolitik yaitu Bacillus sp. BK13, Enterobacter sp. BK15, Bacillus sp. BK17, Enterobacter cloacae LK08, Bacillus sp. KR05, dan Enterobacter sp. PB17 dalam menghambat pertumbuhan jamur A. niger pada kecambah kacang tanah. Hasil penelitian menunjukkan BK15 memiliki efektivitas paling tinggi dalam menghambat pertumbuhan A. niger dengan zona hambat sebesar 2,88 cm dan BK13 dengan zona hambat sebesar 2,69 cm, sedangkan efektivitas terendah ditunjukkan oleh BK17 dengan zona hambat sebesar 2,30 cm. BK13 dan BK15 menunjukkan pengurangan busuk pangkal akar pada kacang tanah. Isolat bakteri kitinolitik yang digunakan sebagai pelapis benih kacang tanah melalui perendaman mampu mengurangi persentase busuk pangkal akar yang disebabkan oleh A. niger. BK15 memiliki kemampuan penghambatan tertinggi yaitu 58,82% dan penghambatan terendah ditunjukkan oleh BK13 dengan persentase 47,06%.
vii
CHITINOLYTIC BACTERIA ABILITY TO CONTROL Aspergillus niger
CAUSAL AGENT OF BASAL ROOT ROT OF PEANUT SEEDLINGS
ABSTRACT
A study of chitinolytic bacteria ability to control Aspergillus niger, a causal agent of basal root rot of peanut seedlings has been conducted in Laboratory of Observation Pest and Disease, Medan Johor, UPT. Protection of Crops and Horticulture 1, and Laboratory of Microbiology, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan. The purpose of the study was to evaluate the ability of chitinolytic bacteria Bacillus sp. BK13, Enterobacter sp. BK15, Bacillus sp. BK17, Enterobacter cloacae LK08, Bacillus sp. KR05, and Enterobacter sp. PB17 to inhibit the growth of A. niger on the peanut seedling. Antagonistic test showed that the most effective bacteria in inhibiting the growth of A. niger was BK15 with inhibition zone of 2,88 cm and BK13 with inhibition zone of 2,69 cm, whereas the least effective bacteria was BK17, with inhibition zone of 2,30 cm. Chitinolytic bacterial isolates used to cover peanut seed through soaking enabled to reduce seed basal root rot. BK15 had the highest inhibition to reduce the basal root rot by 58,82% while the lowest inhibition was BK13 by 47,06%.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Di Indonesia, di antara tanaman kacang-kacangan, kacang tanah merupakan komoditas utama kedua setelah kedelai. Kacang tanah merupakan sumber lemak dan protein nabati yang tinggi, yaitu masing-masing 42% dan 22% bagi penduduk Indonesia. Sebagian besar kacang tanah dikonsumsi oleh manusia, dan hanya sebagian kecil digunakan sebagai pakan maupun diproses menjadi minyak (Saleh, 2010).
Hasil kacang tanah di Indonesia pada tahun 2009 tergolong masih rendah yaitu 1,25 ton/ha polong kering (BPS, 2009), jika dibandingkan dengan hasil kacang tanah di Amerika Serikat dan Australia yang mencapai 3 ton/ha polong kering. Secara teoritis, hasil kacang tanah di Indonesia masih dapat ditingkatkan (Suryadi & Rais, 2009). Ada beberapa faktor yang menyebabkan rendahnya produktivitas kacang tanah di Indonesia adalah: (1) cara budidayanya menggunakan teknologi sederhana; (2) keterbatasan modal dan pengetahuan petani; (3) sebagian besar kacang tanah diusahakan di lahan kering dengan kesuburan tanah yang rendah dan (4) gangguan organisme pengganggu tanaman (OPT) terutama penyakit yang belum dapat diatasi (Saleh, 2010).
2
patogen sangat besar, mengingat Indonesia merupakan negara dengan biodiversitas yang tinggi (Yuliar, 2008).
Pengendalian biologis merupakan alternatif yang menarik karena banyak kekhawatiran tentang penggunaan pestisida secara umum (Haggag & Timmusk, 2007). Oleh karena itu, upaya pengendalian yang efektif dan ramah lingkungan perlu dilakukan, salah satunya adalah dengan menggunakan bakteri kitinolitik (pendegradasi kitin) yang melibatkan enzim kitinase (Muharni & Widjajanti, 2011). Pengendalian hayati jamur dengan menggunakan mikroorganisme kitinolitik didasarkan pada kemampuan mikroorganisme menghasilkan kitinase yang dapat melisis sel jamur (El-Katatny et al., 2000). Enzim kitinase yang dihasilkan oleh mikroorganisme kitinolitik mempunyai potensi tinggi untuk mendegradasi limbah yang mengandung kitin, karena dengan adanya enzim kitinase memungkinkan konversi kitin yang melimpah menjadi produk yang berguna. Bakteri kitinolitik pada bidang pertanian berfungsi sebagai agen biokontrol terhadap jamur patogen yang umumnya memiliki komponen kitin pada dinding selnya (Muharni, 2009).
Berdasarkan asumsi di atas, maka dilakukan penelitian dengan tujuan utama untuk melihat kemampuan bakteri kitinolitik dalam mengendalikan penyakit busuk pangkal akar dengan cara menghambat pertumbuhan jamur Aspergillus niger yang terdapat pada tanaman kacang tanah, melalui perendaman benih kacang tanah dengan suspensi bakteri kitinolitik yang potensial untuk meningkatkan daya tahan benih terhadap serangan jamur A. niger.
1.2Perumusan Masalah
3
1.3Tujuan Penelitian
Penelitian ini dilakukan untuk mengetahui efektivitas penggunaan bakteri kitinolitik dalam mengendalikan penyakit busuk pangkal akar pada tanaman kacang tanah yang disebabkan oleh A. niger.
1.4Hipotesis
Isolat bakteri kitinolitik mampu menghambat pertumbuhan jamur A. niger penyebab penyakit busuk pangkal akar pada tanaman kacang tanah.
1.5Manfaat
Adapun manfaat dari penelitian ini adalah:
a. Memberikan informasi pengendalian hayati patogen tanaman dengan bakteri kitinolitik
b. Menambah wawasan dan mengembangkan pengetahuan tentang teknik pengendalian penyakit tanaman yang ramah lingkungan
BAB 2
TINJAUAN PUSTAKA
2.1 Kacang Tanah
Kacang tanah berasal dari Amerika Selatan, namun saat ini telah menyebar ke seluruh dunia yang beriklim tropis atau subtropis. Cina dan India merupakan penghasil kacang tanah terbesar dunia. Kacang tanah menyukai tanah gembur dengan drainase yang baik. Pembentukan polong dapat dipermudah dan dipercepat bila ditanam di tanah gembur. Meskipun kacang tanah toleran terhadap kekeringan dan tanah asam (pH tanah 4,5), kondisi tersebut akan berpengaruh pada banyaknya polong yang terisi. Kalsium yang cukup di sekitar tanaman diperlukan untuk pembentukan polong (Sari, 2010).
Umumnya kacang tanah ditanam di lahan kering pada awal atau akhir musim kemarau, baik secara monokultur maupun tumpang sari dengan jagung atau ubi kayu. Produksi kacang tanah Indonesia sebagian besar digunakan untuk memenuhi kebutuhan domestik (Kasno, 2004).
2.2Jamur Busuk Akar
5
patogen dapat menyebabkan semakin rentannya tanaman inang terhadap serangan patogen lain, misalnya nematoda, layu fusarium, layu bakteri.
Jamur patogen merupakan salah satu mikroba yang mengganggu proses-proses fisiologis pada tanaman. Patogen tanaman menimbulkan gangguan yang terus menerus yang merugikan aktivitas tanaman. Jamur merugikan tanaman dalam hal pengangkutan zat cair dan garam mineral, mengganggu proses fotosintesis, serta mengganggu pengangkutan hasil-hasil proses fotosintesis. Jamur dapat merusak akar, batang, daun, buah dan bunga, serta hasil tanaman di tempat penyimpanan (Tjahjadi, 1989).
Kerugian yang lain dari penyakit tanaman adalah kehilangan hasil panen selama penyimpanan, pemasaran, dan transportasi karena terinfeksi patogen, banyak mikroorganisme yang mengkolonisasi hasil panen menghasilkan senyawa yang beracun dan membahayakan manusia, seperti aflatoksin. Adanya penyakit tumbuhan, sudah tentu akan menyebabkan penambahan biaya produksi karena diperlukannya dana untuk upaya pengendalian penyakit (Suradji, 2003).
Sebagian jamur yang bersifat saprofit fakultatif dan semua yang parasit obligat memproduksi miselium di antara sel dan membentuk haustorium ke dalam sel untuk mendapatkan nutrisinya. Jamur karat membentuk hifa secara intraselular dan membentuk haustorium pada sel induk yang akan menembus dinding sel tumbuhan. Kapak penetrasi yang kecil dibentuk untuk menebus dinding sel. Ujung dari kapak penetrasi membesar dan membentuk haustorium yang hampir sperikel. Patogen membentuk hifa interselular lebih banyak lagi selain haustorium, yang kemudian diikuti dengan pembentukan haustoria yang lebih banyak. Pada akhirnya, jaringan tumbuhan inang dapat dikolonisasi oleh patogen secara luas (Suradji, 2003).
8
Adanya keinginan yang cukup besar dalam menemukan alternatif untuk pestisida kimia dalam menekan patogen tular tanah pada tanaman. Pengendalian biologis merupakan alternatif yang cukup menarik untuk masa depan karena kekhawatiran pemakaian pestisida dalam skala besar. Idealnya, agen biologis yang mengendalikan patogen akar jamur harus mengerahkan aktivitas antagonis yang cukup dalam rhizosfer untuk mengurangi gejala penyakit akar secara signifikan (Haggag, 2007).
Pengendalian hayati dengan menggunakan mikroorganisme merupakan pendekatan alternatif yang perlu dikaji dan dikembangkan, karena relatif aman juga ramah lingkungan. Beberapa mikroorganisme antagonis memiliki daya antagonisme yang tinggi terhadap patogen tanaman (Soenartiningsih, 2010). Antagonis yang dapat memanfaatkan atau menguasai ekologi yang mirip dengan patogen merupakan suatu agensia pengendali hayati patogen akar yang dikenal sebagai penekan secara nyata mikroba patogen penyakit akar, baik melalui tindakan alami maupun melalui manipulasi persaingan dengan patogen di dalam lingkungannya (Soesanto, 2008).
2.5 Bakteri Kitinolitik
Mikroorganisme kitinolitik adalah mikroorganisme yang menggunakan enzim kitinase dalam mendegradasi kitin. Mikroorganisme ini dapat diperoleh dari berbagai sumber seperti rizosfer, filosfer, tanah atau dari lingkungan air seperti laut, danau, kolam atau limbah udang dan sebagainya. Selain lingkungan mesofil, mikroorganisme kitinolitik juga telah berhasil diisolasi dari lingkungan termofil seperti sumber air panas, daerah geotermal dan lain-lain (Herdyastuti et al., 2009).
9
& Widjajanti, 2011). Mikroba kitinolitik dapat ditapis dengan menggunakan medium yang mengandung kitin. Mikroba diisolasi dengan menggunakan medium garam koloidal kitin disesuaikan dengan kondisi lingkungan dari tempat isolat berasal. Hasil degradasi kitin dapat diketahui dari adanya pembentukan halo di sekitar koloni (Suryanto & Munir, 2008).
2.6 Enzim Kitinase
Kitinase merupakan suatu kebutuhan untuk memenuhi nutrisi pada bakteri. Sementara pada tanaman, kitinase dimanfaatkan untuk melawan jamur patogen maupun parasit. Degradasi kitin menjadi monomer glukosamin memerlukan enzim endokitinase dan eksokitinase yang bekerja sinergistik dalam dua tahap (Rahayu et al., 2003).
Kitinase merupakan salah satu enzim yang menarik untuk diisolasi karena kemampuannya untuk menghidrolisis kitin menjadi turunan kitin yang sangat banyak manfaatnya. Kitinase dapat dimanfaatkan dalam penanganan limbah terutama limbah yang mengandung kitin seperti pabrik pembekuan udang. Hal ini dikarenakan kitin merupakan komponen utama pembentuk dinding sel jamur yang dapat didegradasi oleh enzim kitinase yang dihasilkan oleh mikroorganisme, hewan, dan tumbuhan (Herdyastuti et al., 2009). Kerusakan dinding sel yang tersusun dari komponen kitin mengakibatkan gangguan pertumbuhan dan kelangsungan hidup organisme (Giyanto et al., 2009).
Kitinase banyak dimanfaatkan sebagai suatu agen biokontrol bagi tanaman yang terserang infeksi jamur. Hal ini dikarenakan enzim kitinase dapat mendegradasi kitin yang merupakan komponen utama dinding sel jamur menghasilkan produk yang ramah lingkungan dibandingkan penggunaan zat kimia (Herdyastuti et al., 2009).
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Januari 2012 sampai September 2012 bertempat di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT. Balai Proteksi Tanaman Pangan dan Hortikultura 1, Medan dan Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah cawan petri, tabung reaksi, rak tabung reaksi, gelas ukur, gelas beaker, pipet serologi, karet penghisap, spatula, jarum ose, autoklaf, oven, mikroskop, jangka sorong, hot plate, bunsen, timbangan, pipet tetes, gelas objektif, gelas penutup, cork borer, gunting, botol selai, magnetic stirrer, vorteks, pinset, erlenmeyer, spatula, inkubator, sprayer, dan nampan plastik berukuran 38 x 30 x 7 cm.
Bahan-bahan yang digunakan adalah 6 isolat bakteri kitinolitik (Bacillus sp. BK13, Enterobacter sp. BK15, Bacillus sp. BK17, Enterobacter cloacae LK08, Bacillus sp. KR05, dan Enterobacter sp. PB17) dari Laboratorium Mikrobiologi,
11
Aspergillus niger. Isolat ditumbuhkan dalam media PDA dan diinkubasi pada suhu
28-30°C, selanjutnya disimpan di dalam kulkas hingga saatnya digunakan.
3.3 Isolasi Jamur Patogen A. niger
Bagian tanaman yang sakit menunjukkan gejala penyakit busuk di bagian pangkal batang yang disebabkan oleh A. niger diambil, kemudian bagian tanaman didesinfeksi dengan larutan 2% NaClO selama 10 detik, dicuci dengan air steril sebanyak tiga kali dan ditumbuhkan dalam media PDA. Setelah diinkubasi selama dua hari, biakan jamur diinokulasikan kembali pada media PDA baru untuk mendapatkan biakan murni (alur lebih jelas dapat dilihat pada lampiran 1 halaman 30). Pengamatan dilakukan untuk mengidentifikasi secara makroskopis dan mikroskopis (Suryanto et al., 2010).
3.4 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap A. niger
Biakan jamur diinokulasikan di tengah media MGMK ditambah 2% yeast dengan jarak 3,5 cm dari cakram tempat inokulum bakteri. Selanjutnya suspensi bakteri kitinolitik yang telah dibuat dengan konsentrasi ≈ 108 sel/ml (standar 0,5 McFarland) diinokulasikan pada cakram dengan diameter 0,6 cm di bagian tepi media sebanyak 10 μl, dibuat 2 kali pengulangan. Biakan diinkubasi pada suhu 28-30oC. Media MGMK ditambah 2% yeast yang diinokulasi jamur patogen saja digunakan sebagai kontrol. Aktivitas penghambatan ditentukan berdasarkan zona hambat yang terbentuk di
sekitar koloni. Pengamatan dimulai dari hari ke-2 sampai hari ke-7 (Suryanto et al., 2011). (Alur lebih jelas dapat dilihat pada lampiran 2 halaman 31).
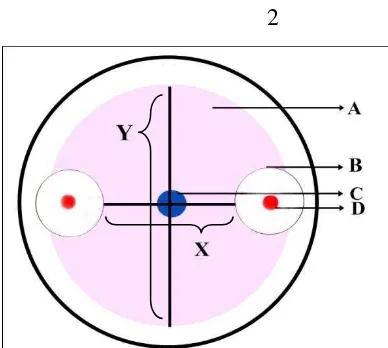
Y-12
X = hasil. 2
Gambar 3.7.1 Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur; A. koloni jamur; B. zona hambat bakteri kitinolitik terhadap koloni jamur; C. titik tengah jamur diletakkan; D. koloni bakteri kitinolitik; X. diameter koloni jamur yang terhambat pertumbuhannya; Y. diameter koloni jamur normal (Suryanto, 2001)
3.5 Pengamatan Mikroskopis
Pengamatan secara mikroskopis dilakukan dengan cara mengamati ujung miselium pada daerah zona hambat jamur patogen. Ujung miselium A. niger yang tumbuh pada permukaan media dipotong berbentuk block square, kemudian diletakkan pada gelas objektif. Selanjutnya pertumbuhan miselium jamur patogen diamati adanya abnormalitas, berupa pembengkokan ujung miselium, miselium pecah, miselium berbelah, miselium bercabang, miselium lisis dan miselium kerdil (Lorito et al., 1992). (Alur lebih jelas dapat dilihat pada lampiran 3 halaman 32).
3.6 Uji Potensi Serangan A. niger pada Benih Kacang Tanah
Uji patogenitas dilakukan dengan cara biakan A. nigeryang telah diremajakan selama 7 hari di cawan petri diinokulasikan pada 120 ml media Glucose Yeast Broth (GYB) dengan kerapatan spora ≈106
13
kompos steril (nisbah 3:1) di dalam nampan plastik berukuran 38 cm x 30 cm x 7 cm. Pada setiap nampan ditanam 30 benih kacang tanah dan ditutup dengan plastik. Benih yang ditanam ke dalam media yang tidak diinokulasikan A. niger dijadikan sebagai kontrol. Ulangan dilakukan sebanyak 3 kali tiap perlakuan. Peubah yang diamati adalah tanaman yang terserang busuk pangkal akar selama persemaian 30 hari (alur lebih jelas dapat dilihat pada lampiran 1 halaman 30). Persentase busuk pangkal akar dihitung dari jumlah kecambah yang mati karena terinfeksi dibagi jumlah seluruh kecambah yang tumbuh (Suryanto et al., 2010).
Reisolasi A. niger dilakukan dengan memotong jaringan pada pangkal akar yang terinfeksi busuk pangkal akar. Jaringan tersebut didesinfeksi dengan larutan 2% NaClO, dicuci dengan air steril sebanyak tiga kali (Suryanto et al., 2010) dan diinokulasikan pada media PDA (alur lebih jelas dapat dilihat pada lampiran 2 halaman 31). Isolat yang diperoleh dibandingkan dengan isolat sebelum jamur digunakan dalam uji patogenitas.
3.7 Penghambatan Serangan A. niger pada Benih Kacang Tanah
Inokulum A. niger dengan kerapatan spora 4x106 sebanyak 120 ml dicampur dengan 600 g campuran tanah dan kompos steril (nisbah 3:1) dalam nampan plastik berukuran 38 cm x 30 cm x 7 cm. Ke dalam tiap nampan ditanam 30 bibit tanaman yang telah direndam dengan campuran suspensi bakteri kitinolitik selama 30 menit. Benih yang direndam akuades tidak diinokulasi bakteri kitinolitik dijadikan sebagai kontrol negatif (-) dan benih yang diinokulasikan dengan A. niger dijadikan sebagai kontrol positif (+) ditanam ke dalam nampan. Ulangan dilakukan sebanyak tiga kali untuk masing-masing perlakuan (alur lebih jelas dapat dilihat pada lampiran 3 halaman 32). Parameter yang diamati adalah tanaman yang mati terserang busuk pangkal akar, tinggi tanaman dan jumlah daun kecambah selama persemaian 30 hari. Menurut Suryanto et al., (2010), pengurangan persentase kematian tanaman dihitung dari rumus :
Pengurangan kematian tanaman =
14
18
Dari hasil di atas, dapat disimpulkan bahwa enam isolat bakteri kitinolitik memiliki kemampuan yang perlu dikembangkan sebagai agen pengendali hayati jamur patogen tanaman. Adanya perubahan struktur hifa A. niger terjadi karena adanya interaksi antara isolat bakteri kitinolitik dengan jamur patogen. Dengan adanya aktivitas antagonisme bakteri kitinolitik dengan mekanisme enzimatik sehingga dapat menghambat pertumbuhan hifa A. niger dengan merusak dinding selnya. Hifa A. niger mengalami pembengkakan, pembengkokan, keriting, mengecil, dan lisis. Hifa A. niger yang mengalami pembengkokan, keriting, mengecil dan lisis dapat ditemukan pada uji antagonis dari enam isolat bakteri kitinolitik terhadap A. niger.
Uji antagonisme bakteri kitinolitik BK15 terhadap A. niger banyak memperlihatkan hifa jamur yang lisis dibandingkan dengan isolat bakteri kitinolitik lainnya. Lisis pada hifa A. niger menunjukkan bahwa isolat bakteri kitinolitik BK15 mampu menghidrolisis dinding sel A. niger. Komponen kitin pada dinding sel jamur yang mengalami kerusakan mengakibatkan adanya gangguan pertumbuhan dan kelangsungan hidup (Giyanto et al., 2009).
Kerusakan hifa berupa perubahan bentuk dari hifa jamur patogen yang membentuk spiral dan melengkung-lengkung tidak beraturan dan mengalami pemendekan, ada juga hifa yang mengalami pembengkakan dinding sel. Hifa yang mengalami kerusakan tersebut tidak ada ditemukan konidia jamur. Isolat antagonis yang digunakan ini mampu menempel kuat pada hifa jamur patogen yang menyebabkan perusakan sebagian dinding sel hifa (Indratmi, 2008). Hal ini berkaitan dengan bakteri kitinolitik yang digunakan mampu mensekresikan enzim kitinase yang mampu menghidrolisis dinding sel jamur.
19
4.4 Potensi Serangan A. niger pada Benih Kacang Tanah
Dari hasil potensi serangan A. niger terhadap benih kacang tanah diperoleh bahwa A. niger sebagai penyebab patogen, dengan persentase busuk pangkal akar yang cukup
tinggi yaitu 62,96 %. Menurut Rakholiya et al. (2012), banyak tanaman kacang tanah terserang penyakit busuk pangkal akar ini. Penyakit ini menunjukkan gejala sebelum dan sesudah berkecambah. Sebelum berkecambah, benih yang terinfeksi berwarna hitam membusuk lalu mati. Sedangkan setelah berkecambah, gejala yang ditimbulkan adanya infeksi di bagian pangkal akar kecambah, lalu kecambah akan layu dan tidak berkembang.
Menurut Agrios (2004), infeksi pada pangkal akar yang disebabkan oleh jamur patogen mampu menghambat perkembangan kecambah. Jamur patogen menghambat produksi akar rambut, sehingga mengurangi penyerapan air, dan mengubah permeabilitas sel akar. Patogen juga mengganggu penyerapan air dan nutrisi melalui akar-akarnya. Reisolasi jamur ini dilakukan pada pangkal kecambah yang terserang busuk dengan gejala serangan (Gambar 4.4.1), bagian pangkal akar rusak, dipenuhi oleh koloni A. niger, bagian daun muda menguning, kecambah layu dan akhirnya mati.
Gambar 4.4.1 Isolat A. niger dan serangannya terhadap kecambah kacang tanah (a) isolat A. niger di media PDA, (b) kecambah yang terserang busuk pangkal akar (1) bagian pangkal akar yang membusuk, dan (c) hasil reisolasi(2) koloni A. niger
20
yaitu busuk pangkal akar (Gibson, 1953). Penurunan penyerangan A. niger perlu dilakukan agar produksi kacang tanah semakin bertambah. Untuk mengantisipasinya digunakan bakteri kitinolitik sebagai agen pengendali hayati jamur patogen.
4.5 Penghambatan Serangan A. niger pada Benih Kacang Tanah
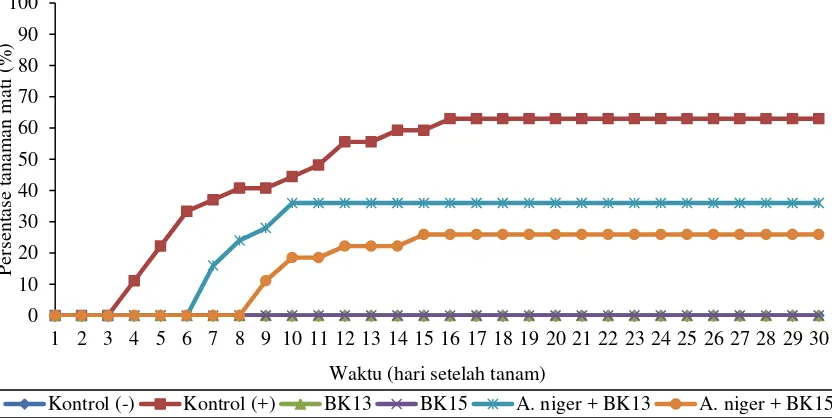
Benih kacang tanah yang telah direndam oleh suspensi bakteri kitinolitik ditumbuhkan pada media tanah yang telah dicampur oleh inokulum A. niger. Pengamatan dilakukan terhadap persentase busuk pangkal akar, tinggi kecambah, dan jumlah daun dari minggu ke-0 sampai minggu ke-4. Kecambah yang ditumbuhkan pada tanah yang telah dicampur dengan A. niger banyak mati akibat terserang busuk pangkal akar pada perlakuan kontrol (+), jika dibandingkan dengan kontrol (-), untuk lebih jelasnya dapat dilihat pada Gambar 4.5.1 berikut ini:
Gambar 4.5.1 Persentase kecambah mati yang disebabkan oleh A. niger dengan perlakuan bakteri kitinolitik
Keterangan:
Kontrol (+) = dengan pemberian inokulum A. niger dan tanpa bakteri uji Kontrol (-) = tanpa pemberian inokulum A. niger dan bakteri uji
Kecambah mulai mengalami busuk pangkal akar setelah memasuki minggu pertama pengamatan dan terus meningkat jumlahnya sampai minggu kedua. Penyerangan A. niger penyebab busuk pangkal akar pada tanaman kacang tanah
0 10 20 30 40 50 60 70 80 90 100
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Persen ta se ta nam an m at i (%)
Waktu (hari setelah tanam)
21
berhenti pada hari ke-16 karena tidak ada tanaman mati setelah terserang busuk pangkal akar pada hari selanjutnya. Kecambah kacang tanah mulai terserang busuk pangkal akar oleh A. niger dari hari ke-7 sampai hari ke-20 setelah tanam (Kishore et al., 2005). Pengamatan hari ke-30, tanaman mati akibat terserang busuk pangkal akar
pada kontrol (+) sebanyak 17 kecambah, A. niger+BK13 sebanyak 9 kecambah, dan A. niger+BK15 sebanyak 7 kecambah (data tanaman yang mati dapat dilihat pada
lampiran 4 halaman 33). Persentase tanaman mati setelah terserang busuk pangkal akar tertinggi yaitu pada kontrol (+) yang mencapai 62,96 % dari total kecambah yang tumbuh, sedangkan pada kontrol (-), BK13, dan BK15 tidak mengalami busuk pangkal akar. Dari perlakuan dengan menggunakan bakteri, persentase busuk pangkal akar menurun jika dibandingkan dengan kontrol (+). Persentase tanaman mati karena busuk pangkal akar dari A. niger+BK13 yaitu sebesar 36 % dan dari A. niger+BK15 sebesar 25,93 %.
Benih yang telah diberi perlakuan bakteri kitinolitik menunjukkan penurunan persentase tanaman mati karena terserang busuk pangkal akar oleh A. niger. Jumlah tanaman mati menurun jika dibandingkan dengan kecambah pada kontrol (+). Penurunan tanaman mati karena terserang busuk pangkal akar dengan perlakuan A. niger+BK15 mencapai nilai tertinggi yaitu 58,82 %, jika dibandingkan dengan
perlakuan A. niger+BK13 yaitu 47,06 % (gambar tanaman kacang tanah umur 4 minggu dapat dilihat pada lampiran 5 halaman 34). Isolat bakteri kitinolitik BK15 berpotensi untuk dikembangkan sebagai agen pengendali hayati jamur patogen tanaman. Hal ini disebabkan karena bakteri kitinolitik sebagai mikroorganisme antagonis mampu menghambat pertumbuhan jamur patogen.
22
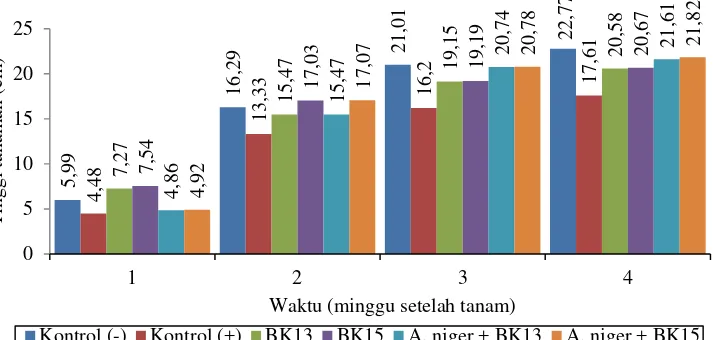
Hasil pengamatan tinggi tanaman dari minggu pertama sampai minggu keempat, dapat dilihat bahwa kecambah kacang tanah mengalami pertambahan tinggi (Gambar 4.5.2).
Gambar 4.5.2 Perbedaan tinggi kecambah kacang tanah setelah diinokulasi
A. niger dengan perlakuan bakteri kitinolitik
Pada pengamatan minggu pertama, kecambah tertinggi terlihat pada perlakuan BK15 yaitu 7,54 cm dan perlakuan BK13 yaitu 7,27 cm, sedangkan kecambah yang terendah adalah kontrol (+) yaitu 4,48 cm. Kecambah yang direndam dengan suspensi BK13 dan BK15 memiliki pertumbuhan yang lebih tinggi jika dibandingkan dengan perlakuan lainnya. Pada pengamatan minggu keempat, kecambah tertinggi terlihat pada kontrol (-) yaitu 22,77 cm, diikuti A. niger+BK15 yaitu 21,82 cm, perlakuan A. niger+BK13 yaitu 21,61 cm, lalu perlakuan BK15 yaitu 20,67 cm, perlakuan BK13
yaitu 20,58 cm, dan kecambah yang terendah adalah kontrol (+) yaitu 17,61 cm.
Pada akhir pengamatan, tinggi tanaman pada kontrol (-) lebih tinggi jika dibandingkan dengan tanaman yang diberi perlakuan. Hal ini disebabkan karena pertumbuhan tanaman pada kontrol (-) berjalan normal, tidak adanya gangguan dari jamur patogen yang menyebabkan tanaman tumbuh sehat, sedangkan tinggi tanaman pada kontrol (+) jauh lebih rendah dibandingkan tinggi tanaman pada perlakuan yang lain. Hal ini disebabkan karena adanya gangguan dari jamur patogen. Pertumbuhan jamur patogen menghambat aliran air pada pembuluh xilem yang berakibat transportasi air dan unsur hara terganggu sehingga pertumbuhan tinggi tanaman menjadi terhambat (Ambar et al. 2005).
5, 99 16 ,2 9 21 ,0 1 22 ,7 7 4, 48 13 ,3
3 16,2 17
,6 1 7, 27 15 ,4 7 19 ,1 5 20 ,5 8 7, 54 17 ,0 3 19 ,1 9 20 ,6 7 4, 86 15 ,4 7 20 ,7 4 21 ,6 1 4, 92 17 ,0
7 20
,7 8 21 ,8 2 0 5 10 15 20 25
1 2 3 4
Ting gi ta nam an (cm )
Waktu (minggu setelah tanam)
24
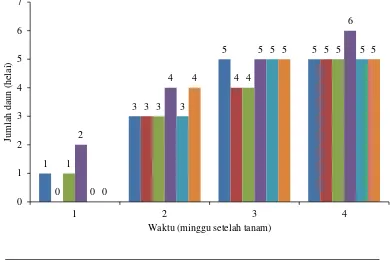
Kecambah kacang tanah yang terserang busuk pangkal akar pada perlakuan kontrol (+), A. niger+BK13 dan A.niger+BK15 akan mati, sedangkan kecambah yang tidak terserang penyakit akan terus tumbuh dan berkembang sampai hari akhir pengamatan. Dari hasil pengamatan rata-rata jumlah daun tidak terdapat perbedaan jumlah daun yang signifikan dari masing-masing perlakuan (Gambar 4.5.4). Pada pengamatan minggu keempat, perlakuan BK15 memiliki jumlah daun terbanyak yaitu 6 helai. Sementara itu, tanaman kacang tanah pada perlakuan lain memiliki jumlah daun yang sama. Hal ini dapat disimpulkan bahwa isolat BK15 meningkatkan jumlah daun pada kecambah kacang tanah. Kemungkinan isolat BK15 menghasilkan senyawa yang membantu pertumbuhan kecambah kacang tanah dengan adanya jumlah daun yang dihasilkan lebih banyak jika dibandingkan dengan kontrol (-).
Gambar 4.5.4 Perbedaan jumlah daun kecambah kacang tanah setelah diinokulasi A. niger dengan perlakuan bakteri kitinolitik
1
3
5 5
0 3 4 5 1 3 4 5 2 4 5 6 0 3
5 5
0
4
5 5
0 1 2 3 4 5 6 7
1 2 3 4
Ju m la h dau n (h el ai )
Waktu (minggu setelah tanam)
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Semua isolat bakteri kitinolitik yang digunakan mampu menghambat pertumbuhan dan perkembangan jamur A. niger penyebab busuk pangkal akar pada kecambah kacang tanah secara in vitro. Isolat bakteri yang paling besar dalam penghambatan A. niger adalah Enterobacter sp. BK15 dan Bacillus sp. BK13, sedangkan isolat dengan penghambatan terkecil adalah Bacillus sp. BK17. Persentase pengurangan kematian tanaman yang terbesar adalah isolat BK15 yaitu 58,82 %. Isolat BK15 sangat berpotensi sebagai agen pengendali hayati.
5.2 Saran
DAFTAR PUSTAKA
Agrios GN. 2004. Plant Pathology. Fifth Edition. California: Elsevier Academic Press. hlm. 106-108
Ambar AA, HT Ambarwati, P Nursamsi & W Arif. 2005. Patogenitas Isolat Fusarium oxysporum sp. Lycopersici dari Empat Lokasi pada Tanaman Tomat. Tesis. Yogyakarta: UGM
Badan Pusat Statistik. 2009. Luas Panen, Produktivitas dan Produksi Tanaman Kacang Tanah Seluruh Provinsi. http://www.bps.go.id. (17 Maret 2012). Cappucino JG & N Sherman. 1996. Microbiology: A Laboratory Manual. 4th Ed.
California: Addison-Wesley Publishing Company. hlm. 254-255.
Djafaruddin. 2000. Dasar-Dasar Pengendalian Penyakit Tanaman. Jakarta: Bumi Aksara. hlm. 42-43
El-Katatny MH, W Somitsch, KH Robra, MS El-Katatny & GM Gubitz. 2000. Production of Chitinase and ß-1,3-glucanase by Trichoderma harzianum for Control of the Phytopathogenic Fungus Sclerotium rolfsii. Food Technol. Biotechnol. 38: 173-180
Emmanuel ESC, S Rathnavel, & S Maruthamuthu. 2011. A Survey of Collar Rot Disease of Arachis hypogaea by Aspergillus niger in Certain Locations of Madurai District (Tamil Nadu), India. Plant Archives 11(2): 645-647
Gajera HP & DN Vakharia. 2012. Production of Lytic Enzymes by Trichoderma Isolates during In Vitro Antagonism with Aspergillus niger, The Causal Agent of Collar Rot of Peanut. Brazilia. Journal of Microbiol. 20(12): 43-52
Gajera HP, K Rakholiya, & DN Vakharia. 2011. Bioefficacy of Trichoderma Isolates Against Aspergillus niger van Tieghem Inciting Collar Rot in Groundnut (Arachis Hypogaea L.). Journal of Plant Protect. Research 51(3): 240-247 Gibson IAS. 1953. Crown Rot, A Seedling Disease of Groundnut Caused by
27
Giyanto, A Suhendar, & Rustam. 2009. Kajian Pembiakan Bakteri Kitinolitik Pseudomonas fluorescens dan Bacillus sp. pada Limbah Organik dan Formulasinya sebagai Pestisida Hayati (Bio-Pesticide). Prosiding Seminar Hasil-Hasil Penelitian IPB. hlm. 849-858
Haggag WM. 2007. Colonization of Exopolysaccharide-producing Paenibacillus polymyxa on Peanut Roots for Enhancing Resistance Against Crown Rot Disease. Afr. J. Biotechnol. 6(13): 1568-1577
Haggag WM & S Timmusk. 2007. Colonization of Peanut Roots by Biofilm Forming Paenibacillus polymyxa Initiates Biocontrol Against Crown Rot Disease. The Society for Applied Microbiology. Journal of Appl. Microbiol. 104: 961-969 Herdyastuti N, TJ Raharjo, Mudasir, & S Matsjeh. 2009. Kitinase dan
Mikroorganisme Kitinolitik: Isolasi, Karakterisasi dan Manfaatnya. Indo. J. Chem. 9 (1): 37-47
Indratmi D. 2008. Mekanisme Penghambatan Colletotrichum gloeosporioldes Patogen Penyakit Antraknosa pada Cabai dengan Khamir Debaryomyces sp. Draft publikasi penelitian pengembangan IPTEKS. Malang: Universitas Muhammaddiyah Malang
Kasno A. 2004. Pencegahan Infeksi Aspergillus flavus dan Kontaminasi Alfatoksin pada Kacang Tanah. Jurnal Litbang Pertanian 23(3): 75-81
Khalimi K, NA Gusti & W Susanta. 2010. Pemanfaatan Plant Growth Promoting
Rhizobacteria untuk Biostimulants dan Bioprotectans. Ecotrophic. 4(2): 131-135
Kishore GK, S Pande, & AR Podile. 2005. Biological Control of Collar Rot Disease with Broadspectrum Antifungal Bacteria Associated with Groundnut. Can. J. Microbiol. 51: 123-132
Lorito MG, E Harman, CK Hayes, RM Broadway, SL Tronsmo, Woo & A Di Pietro. 1992. Chitinolytic Enzymes Produced by Trichoderma harzianum: Antifungal
Activity or Purified Endochitinase and Chitobiosidase. Phytopathol. 83: 302-307
Muharni. 2009. Isolasi dan Identifikasi Bakteri Penghasil Kitinase dari Sumber Air Panas Danau Ranau Sumatera Selatan. Jurnal Penelitian Sains 09: 12-15 Muharni & H Widjajanti. 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap
28
Noverita. 2009. Identifikasi Kapang dan Khamir Penyebab Penyakit Manusia pada Sumber Air Minum Penduduk pada Sungai Ciliwung dan Sumber Air Sekitarnya. Fakultas Biologi Universitas Nasional. Vis Vitalis 2(2): 12-22 Pelczar MJ & ECS Chan. 2005. Dasar-dasar Mikrobiologi. Jilid 1. Jakarta: Universitas
Indonesia Press. hlm. 511
Pitt JI & AD Hocking. 2009. Fungi and Food Spoilage. Second Edition. New York: Springer. hlm. 313-315
Rahayu S, FM Suhartati, EA Rimhawauto, & N Iriyanti. 2003. Isolasi dan Identifikasi Bakteri Kitinolitik Asal Rumen. Animal Product. 5(2): 73-78
Rakholiyah KB, KB Jadeja & AM Parakhia. 2012. Management of Collar Rot of Groundnut Through Seed Treatment. Agric. Sci. 2(1): 62-66
Saleh N. 2010. Optimalisasi Pengendalian Terpadu Penyakit Bercak Daun dan Karat pada Kacang Tanah. Malang: Balai Penelitian Tanaman Kacang-Kacangan dan Umbi-Umbian. Pengembangan Inovasi Pertanian 3(4): 289-290
Sari SP. 2010. Pengoptimalan Persediaan Bahan Baku Kacang Tanah Menggunakan Metode EOQ (Economic Order Quantity) di PT. Dua Kelinci Pati. Skripsi. Fakultas Pertanian Universitas Sebelas Maret. Surakarta
Semangun H. 2008. Penyakit-Penyakit Tanaman Pangan di Indonesia. Edisi kedua. Yogyakarta: Gadjah Mada University Press. hlm. 163
Soenartiningsih. 2010. Efektivitas beberapa Cendawan Antagonis dalam Menghambat Perkembangan Cendawan Rhizoctonia solani pada Jagung Secara Invitro. Prosiding Pekan Serealia Nasional.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta: PT. Raja Grafindo Persada. hlm. 166
Subbiah G & N Indra. 2003. Management of Seed and Collar Rots caused by Aspergillus niger van Tiegham in Groundnut (Arachis hypogaea L.) by Biocontrol Method. Madras Agric. J. 90 (4-6): 292-297
29
Suradji MS. 2003. Dasar-Dasar Ilmu Penyakit Tumbuhan. Jakarta: Swadaya. hlm. 7-8, 105
Suryadi Y & SA Rais. 2009. Respon Beberapa Genotipe Kacang Tanah terhadap Penyakit Layu Bakteri (Ralstonia solanacearum) di Rumah Kaca. Buletin Plasma Nutfah 15(1): 20-26
Suryanto D & E Munir. 2006. Potensi Pemanfaatan Isolat Kitinolitik Lokal untuk Pengendalian Hayati Jamur. Prosiding Seminar Hasil-hasil Penelitian USU. hlm. 15-25
Suryanto D, N Irawati, & E Munir. 2011. Isolation and Characterization of Chitinolytic Bacteria and Their Potential to Inhibit Plant Pathogenic Fungi. Microbiol. Indones. 5(3): 144-148
Suryanto D, S Patonah, & E Munir. 2010. Control of Fusarium Wilt of Chili with Chitinolytic Bacteria. Hayati J. Biosci. 17(1): 5-8
Tahtamouni MEW, KM Hameed & IM Saadoun. 2006. Biological Control of Sclerotinia sclerotiorum using Indigenous Chitinolytic Actinomycetes in Jordan. Plant Pathol. J. 22(2): 107-114
Tjahjadi N. 1989. Hama dan Penyakit Tanaman. Yogyakarta: Kanisius. hlm. 45 Wang S, J Wu, P Rao, TB Ng, & X Ye. 2005. A Chitinase with Antifungal Activity
from The Mung Bean. Protein Expr. Purif. 40: 230-236
Yuliar. 2008. Skrining Bioantagonistik Bakteri untuk Agen Biokontrol Rhizoctonia solani dan Kemampuannya dalam Menghasilkan Surfaktin. Bidang Mikrobiologi, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI). Biodiversitas 9(2): 83-86
LAMPIRAN
Lampiran 1
Isolasi Jamur Patogen
Dipotong jaringan pada pangkal akar Didesinfeksi dengan larutan NaClO 2% Dicuci dengan air steril sebanyak 3 kali Ditumbuhkan pada media PDA
Diinkubasi selama 2 hari Dibuat biakan murni A. niger Diamati
Potensi Serangan A. niger pada Benih Kacang Tanah
Diambil sebanyak 120 ml
Dicampur dengan 600 gram campuran tanah dan kompos steril (3:1) di dalam nampan plastik
Ditanam 30 buah benih kacang tanah dalam tiap nampan (3 nampan)
Ditutup dengan plastik
Diamati tanaman yang terserang busuk pangkal akar selama 30 hari
Kecambah Kacang Tanah Terinfeksi Busuk PangkalAkar
Hasil
Suspensi biakan
31
Lampiran 2
Reisolasi A. niger
Dipotong jaringan pada pangkal akar Didesinfeksi dengan larutan NaClO 2% Dicuci dengan air steril sebanyak 3 kali Ditumbuhkan pada media PDA
Diuji dengan Postulat Koch
Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap A. niger
Diinokulasikan di tengah media MGMK + 2% yeast pada jarak 3,5 cm dari cakram tempat inokulum bakteri. Diinokulasi sebanyak 10 μl suspensi bakteri 108
sel/ ml pada kertas cakram
Diletakkan kertas cakram yang berdiameter 0,6 cm di bagian pinggir media
Dibuat 2 kali pengulangan Diinkubasi pada suhu 28-30oC
Diamati zona hambat terhadap miselia jamur patogen terbentuk mulai dari hari ke-2 sampai ke-7 Kecambah Kacang Tanah
Hasil
32
Lampiran 3
Pengamatan Mikroskopis
Diambil bagian hifa patogen yang abnormal Diamati struktur hifa di bawah mikroskop Dibandingkan dengan struktur hifa normal
Penghambatan Serangan A. niger pada Benih Kacang Tanah
Diambil sebanyak 120 ml
Dicampur dengan 600 gram campuran tanah dan kompos steril (3:1) di dalam nampan plastik
Ditanam 30 buah benih kacang tanah yang telah direndam dengan campuran suspensi bakteri kitinolitik Ditutup dengan plastik
Diamati tanaman yang terserang busuk pangkal akar selama 30 hari
Isolat Aspergillus niger
Hasil
Suspensi Biakan A. niger
33 Lampiran 4
Data Tanaman yang Mati Terserang Busuk Pangkal Akar
Perlakuan Hari ke-
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Kontrol (-) 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Kontrol (+) 0 0 3 6 9 10 11 11 12 13 15 15 16 16 17 17 17 17 17 17 17 17 17 17 17 17 17 17 17 17
A. niger+BK13 0 0 0 0 0 0 0 4 6 7 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9 9
A. niger+BK15 0 0 0 0 0 0 0 0 3 5 5 6 6 6 7 7 7 7 7 7 7 7 7 7 7 7 7 7 7 7
Data Tanaman yang Bertahan Hidup
Perlakuan Hari
ke-1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Kontrol (-) 0 0 0 18 19 21 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26 26
Kontrol (+) 0 0 0 9 9 9 9 9 9 9 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10
A. niger+BK13 0 0 0 13 13 13 13 14 14 14 15 16 16 16 16 16 16 16 16 16 16 16 16 16 16 16 16 16 16 16
34
Lampiran 5
Kecambah Kacang Tanah Umur 4 minggu. (a) Kontrol (-), (b) BK13, (c) A. niger