UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIOKSIDAN DAN UJI TOKSISITAS
EKSTRAK ETANOL 70% DAN EKSTRAK AIR KULIT
BATANG KAYU JAWA (
Lannea coromandelica
)
SKRIPSI
ERWIN PRAWIRODIHARJO
1110102000037
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIOKSIDAN DAN UJI TOKSISITAS
EKSTRAK ETANOL 70% DAN EKSTRAK AIR KULIT
BATANG KAYU JAWA (
Lannea coromandelica
)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar sarjana Farmasi
ERWIN PRAWIRODIHARJO
1110102000037
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Program Studi : Farmasi
Judul : Uji Aktivitas Antioksidan dan Uji Toksisitas Ekstrak Etanol 70% dan Ekstrak Air Kulit Batang Kayu Jawa (Lannea coromandelica)
Penelitian ini dilakukan untuk menguji aktivitas antioksidan dan toksisitas ekstrak etanol 70% dan ekstrak air kulit batang kayu jawa (Lannea coromandelica). Ekstrak etanol 70% diperoleh melalui metode maserasi, sedangkan ekstrak air diperoleh melalui metode dekokta. Pengujian aktivitas antioksidan dilakukan dengan metode DPPH (2,2 Difenil-1 Pikrihidrazil) dengan vitamin C sebagai kontrol positif. Hasil uji aktivitas antioksidan yang dilakukan menunjukkan nilai AAI (Antioxidant activity index) ekstrak etanol 70%, ekstrak air, dan vitamin C berturut-turut 5,5679 (sangat kuat); 0,0667 (lemah); dan 9,6254 (sangat kuat). Pengujian toksisitas juga dilakukan terhadap ekstrak etanol 70% dan ekstrak air menggunakan metode BSLT (Brine shrimp lethality test). Hasil uji toksisitas yang dihitung menggunakan metode probit menunjukkan ekstrak air tidak memiliki aktivitas toksik dengan nilai LC50 3.171 ppm,
sedangkan ekstrak etanol 70% menunjukkan aktivitas toksik dengan nilai LC50
23,774 ppm. Berdasarkan penelitian ini, ekstrak etanol 70% kulit batang kayu jawa (Lannea coromandelica) diduga memiliki potensi antikanker.
vii
Program Study : Pharmacy
Judul : Antioxidant Activity Test and Toxicity Test of 70% Ethanolic Extract and Aqueous Extract of kayu jawa (Lannea coromandelica) Bark
This study aimed to find out antioxidant activity and toxicity of 70% ethanolic extract and aqueous extract of kayu jawa (Lannea coromandelica) Bark. 70% ethanolic exctract was obtained by maceration method, whereas aqueous extract was obtained by decoction method. Antioxidant activity testing was tested by DPPH (2,2 Diphenyl-1 Picrylhydrazyl) method with vitamin C as a positive control. The result of antioxidant activity showed that AAI (Antioxidant activity index) value of 70% ethanolic extract, aqueous extract, and vitamin C were 3,6792 (very strong); 0,0667 (weak); dan 9,6254 (very strong) respectively. Toxicity testing also was tested to 70% ethanolic extract and aqueous extract by BSLT (Brine shrimp lethality test) method. The result of toxicity test which was computed by probit method showed that aqueous extract didn’t have toxic activity with LC50 value 3.171 ppm, whereas
70% ethanolic extract showed toxic activity with LC50 value 23,774 ppm. Based on
this study, 70% ethanolic extract of kayu jawa (Lannea coromandelica) bark was thought to have anticancer potential.
Alhamdulillahirabbil’alamin, puji syukur selalu terpanjatkan atas kehadirat Allah subhanahu wa ta’ala atas segala berkah dan kasih sayang-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat serta salam senantiasa tercurahkan kepada keharibaan junjungan Nabi Besar Muhammad SAW, beserta keluarga, sahabat, dan para pengikutnya hingga hari akhir nanti semoga kita mendapatkan syafaat dari beliau. Aamiin yaa rabbal ‘alamin.
Skripsi dengan judul “Uji Aktivitas Antioksidan dan Uji Toksisitas Ekstrak Etanol 70% dan Ekstrak Air Kulit Batang Kayu Jawa (Lannea coromandelica)” ini disusun dalam rangka memenuhi salah satu syarat menempuh ujian akhir guna mendapatkan gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Selama proses penelitian dan penyusunan skripsi ini, penulis menyadari begitu banyak bantuan dari berbagai pihak yang telah meluangkan waktunya, mendidik dan membimbing, memberikan secercah harapan, dan mendoakan yang terbaik kepada penulis. Maka pada kesempatan ini, penulis menyampaikan penghargaan setinggi-tingginya dan rasa terima kasih yang sebesar-besarnya kepada :
1. Bapak Prof. Dr. (hc) dr. M. K. Tadjudin, Sp. And selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Bapak Drs. Umar Mansur, M.Sc., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Bapak Yardi, Ph. D., Apt dan Ibu Eka Putri, M. Sc., Apt. sebagai Pembimbing I dan Pembimbing II yang dengan sabar senantiasa meluangkan waktu dan pikirannya untuk membimbing dan mendidik penulis.
ix
5. Ayahanda tercinta H. Muh. Syukri dan Ibunda tercinta Hj. Ernawati bidadari dalam hidup ini yang selalu menyelimuti kegelisahan hingga menjadi sebuah ketenangan yang begitu menenangkan, yang selalu memberikan cinta dan
kasih sayang, semangat, dukungan, do’a, dan nasihatnya yang tak akan pernah mampu penulis membalas itu semua. Maafkan penulis yang terkadang hanya bisa mengeluh tanpa pernah bisa memberikan sesuatu yang baik untuk senyumanmu. Penulis hanya bisa berdo’a kepada Allah yang maha pengasih lagi maha penyayang agar kiranya dengan segala kebesaran-Nya mengasihi dan melindungi Ayahanda dan Ibunda tercinta, melimpahkan rezeki, dan memberikan keselamatan di dunia dan di akhirat kelak. Aamiin.
6. Kakakku yang terhebat Irwan Susanto, S. HI., adik-adikku tersayang Sri Mustika dan Muh. Andika Saputra yang selalu memberikan semangat dan keceriaan pada hidup penulis.
7. Teman-teman seperjuangan Farmasi Angkatan 2010 “Andalusia” yang selalu memberikan warna baru dalam hidup penulis, kebersamaan yang begitu indah, dan ilmu tentang hidup dan kehidupan yang begitu berharga.
8. Kak Lisna, Kak Tiwi, Kak Liken, Kak Eris, Mba Rani, dan Kang Rahmadi yang telah membantu keseharian penulis selama penelitian di laboratorium. 9. Serta semua pihak yang telah membantu penulis selama ini yang tidak dapat
penulis sebutkan satu per satu.
Semoga Allah swt memberikan balasan yang berlipat ganda atas segala bantuan dan dukungannya kepada penulis. Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kelemahan dan kekurangan. Maka dari itu, dengan segala kerendahan hati penulis sangat mengharapkan kritik dan saran pembaca agar lebih sempurnanya skripsi ini.
Jakarta, 11 Juli 2014
xi
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PENYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 4
BAB 2 TINJAUAN PUSTAKA ... 5
2.1 Kayu Jawa (Lannea coromandelica) ... 5
2.2 Ekstrak dan Ekstraksi ... 6
2.3 Pelarut ... 9
2.4 Kromatografi Lapis Tipis (KLT) ... 11
2.5 Spektrofotometri UV-Vis ... 13
2.6 Antioksidan ... 16
2.7 Uji Aktivitas Antioksidan Metode DPPH ... 18
3.2 Alat dan Bahan ... 22
3.2.1 Alat ... 22
3.2.2 Bahan ... 22
3.3 Prosedur Kerja ... 22
3.3.1 Penyiapan Sampel ... 22
3.3.2 Ekstrasi Sampel Kulit Batang Kayu Jawa (Lannea coromandelica) ... 23
3.3.3 Penapisan Fitokimia ... 24
3.3.4 Parameter Ekstrak ... 25
3.3.5 Pengujian Antioksidan secara Kualitatif dengan Metode Kromatografi Lapis Tipis (KLT) ... 26
3.3.6 Pengujian Antioksidan secara Kuantitatif dengan Metode DPPH ... 26
3.3.6.1 Pembuatan larutan DPPH 0,1 mM ... 26
3.3.6.2 Penentuan Panjang Gelombang Maksimum DPPH 26 3.3.6.3 Pembuatan Larutan Blangko ... 26
3.3.6.4 Pembuatan Larutan Uji Ekstrak Kulit Batang Kayu Jawa (Lannea coromandelica) ... 27
3.3.6.5 Pembuatan Larutan Pembanding Vitamin C ... 27
3.3.6.6 Analisis Data ... 28
3.3.7 Pengujian Toksisitas dengan Metode Brine Shrimp Lethality Test (BSLT) ... 28
3.3.7.1 Persiapan Larva Artemia salina ... 28
3.3.7.2 Pembuatan Larutan Uji Ekstrak Kulit Batang Kayu Jawa (Lannea coromandelica) ... 29
3.3.7.3 Pengujian Toksisitas ... 29
3.3.7.4 Analisis Data ... 30
BAB 4 HASIL DAN PEMBAHASAN ... 31
4.1 Determinasi Tanaman ... 31
4.2 Penyiapan Sampel ... 31
xiii
4.6 Uji Aktivitas Antioksidan secara Kualitatif ... 35
4.7 Uji Aktivitas Antioksidan secara Kuantitatif ... 35
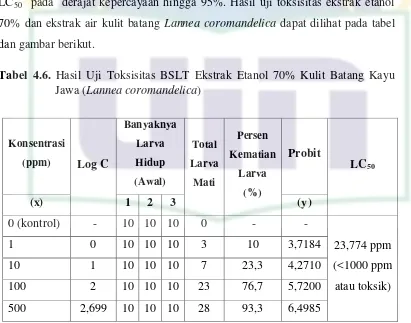
4.8 Uji Toksisitas BSLT Ekstrak Etanol 70% dan Ekstrak Air Kulit Batang Kayu Jawa (Lannea coromandelica) ... 40
BAB 5 KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan ... 45
5.2 Saran ... 45
DAFTAR PUSTAKA ... 46
Tabel 4.1. Hasil Penetapan Parameter Spesifik dan Non Spesifik Ekstrak Etanol 70% dan Ekstrak Air Kulit Batang Kayu Jawa (Lannea coromandelica) ... 33 Tabel 4.2. Hasil Penapisan Fitokimia Ekstrak Etanol 70% dan Ekstrak
Air Kulit Batang Kayu Jawa (Lannea coromandelica) ... 35 Tabel 4.3. Hasil Uji Aktivitas Antioksidan Ekstrak Etanol 70% Kulit
Batang Kayu Jawa (Lannea coromandelica) ... 37 Tabel 4.4. Hasil Uji Aktivitas Antioksidan Ekstrak Air Kulit Batang Kayu
Jawa (Lannea coromandelica) ... 37 Tabel 4.5. Hasil Uji Aktivitas Antioksidan Vitamin C ... 37 Tabel 4.6. Hasil Uji Toksisitas BSLT Ekstrak Etanol 70% Kulit Batang
Kayu Jawa (Lannea coromandelica) ... 41 Tabel 4.7. Hasil Uji Toksisitas BSLT Ekstrak Air Kulit Batang Kayu
xv
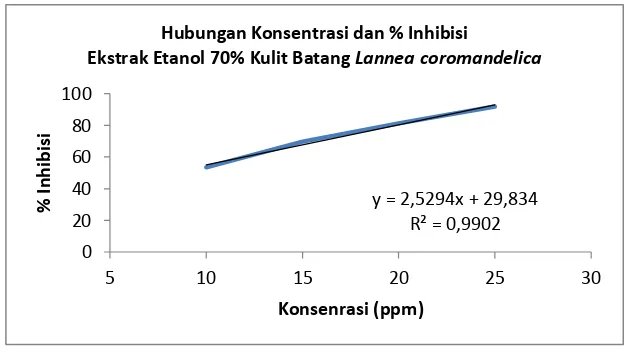
Gambar 2.1. Tanaman Lannea coromandelica ... 5 Gambar 4.1. Kurva Hubungan Konsentrasi dan % Inhibisi Ekstrak Etanol
70% Kulit Batang Lannea coromandelica ... 38 Gambar 4.2. Kurva Hubungan Konsentrasi dan % Inhibisi Ekstrak Air
Kulit Batang Lannea coromandelica ... 39 Gambar 4.3. Kurva Hubungan Konsentrasi dan % Inhibisi Vitamin C ... 39 Gambar 4.4. Kurva Hubungan Log Konsentrasi Ekstrak Etanol 70%
Lampiran 1. Alur Kerja Penelitian ... 50
Lampiran 2. Hasil Determinasi Lannea coromandelica ... 51
Lampiran 3. Penapisan Fitokimia Ekstrak Air ... 52
Lampiran 4. Penapisan Fitokimia Ekstrak Etanol 70% ... 52
Lampiran 5. Perhitungan Rendemen Ekstrak Etanol 70% ... 54
Lampiran 6. Perhitungan Residu Pelarut Etanol pada Ekstrak Etanol 70% ... 54
Lampiran 7. Perhitungan Kadar Abu TotalEkstrak Etanol 70% ... 54
Lampiran 8. Hasil KLT Uji Aktivitas Antioksidan Secara Kualitatif ... 54
Lampiran 9. Perhitungan dalam Uji Antioksidan ... 56
Lampiran 10. Perhitungan dalam Uji Toksisitas BSLT ... 59
Lampiran 11. Panjang Gelombang Maksimum DPPH ... 61
Lampiran 12. Skema Uji Aktivitas Antioksidan Ekstrak Etanol 70% menggunakan Metode DPPH ... 62
Lampiran 13. Skema Uji Aktivitas Antioksidan Ekstrak Air menggunakan Metode DPPH ... 63
Lampiran 14. Skema Uji Aktivitas Antioksidan Kontrol Positif Vitamin C menggunakan Metode DPPH ... 64
Lampiran 15. Skema Uji Toksisitas ekstrak etanol 70% menggunakan Metode BSLT ... 65
Lampiran 16. Skema Uji Toksisitas Ekstrak Air menggunakan Metode BSLT ... 66
Lampiran 17. Data Absorbansi Uji Aktivitas Antioksidan ... 67
UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN
1.1 Latar Belakang
Indonesia adalah negara yang kaya akan keanekaragaman hayati. Kekayaan alam yang melimpah ini merupakan suatu berkah dari Allah swt., yang sangat besar potensinya untuk dikembangkan dalam bidang ekonomi, kesehatan, maupun dalam pengembangan ilmu pengetahuan.
Etnis bugis adalah etnis terbesar yang ada di Sulawesi Selatan. Tradisi pengobatan etnis bugis, sebelum bahkan setelah populernya pengobatan holistik, masyarakat mengenal adanya sanro (dukun) yang dalam kesehariannya dipercayai dapat membantu mengobati berbagai penyakit. Sanro dalam pengobatannya mayoritas menggunakan tumbuh-tumbuhan, baik dalam bentuk tunggal ataupun diramu sedemikian rupa dengan tumbuhan lainnya. Selain tumbuh-tumbuhan, terkadang sanro juga menggunakan bahan obat dari hewan ataupun bahan lainnya (mineral). Kemampuan pengobatan seperti ini diwariskan secara turun menurun dan oleh masyarakat terus digunakan sampai saat ini (Asni & Dewi, 2010).
Kayu jawa atau dalam masyarakat bugis dikenal dengan sebutan aju jawa adalah salah satu tanaman obat tradisional yang masih sering digunakan oleh masyarakat bugis sampai sekarang ini karena khasiatnya yang dipercaya sangat ampuh untuk mengobati luka dalam maupun luka luar. Selain itu, masyarakat sering menggunakan tanaman ini untuk mengobati bintitan. Cara penggunaan tanaman ini berbeda-beda tergantung tujuan penggunaannya, misalnya untuk pengobatan muntah darah masyarakat meminum rebusan kulit batang tanaman ini. Sedangkan untuk mempercepat penyembuhan luka, masyarakat biasanya langsung menggunakan kulit batang ini dengan menempelkannya ke bagian luka.
Berdasarkan studi fitokimia, kulit batang tanaman kayu jawa (Lannea coromandelica) telah dilaporkan mengandung senyawa golongan karbohidrat, steroid, alkaloid, glikosida jantung, terpenoid, tanin, dan flavonoid (Manik, et al.,
2013). Venkata (2008) melaporkan kulit batang Lannea coromandelica memiliki
potensi antikanker. Studi farmakologi juga telah dilaporkan bahwa ekstrak metanol kulit batang kayu jawa memiliki aktivitas biologis seperti antioksidan dan analgesik (Alam, et al., 2013). Selain itu, fraksi n-hexan, diklorometana, dan etil asetat kulit batang dan daun tumbuhan kayu jawa memiliki aktivitas antioksidan, antimikroba, dan trombolitik. Fraksi etil asetat menunjukkan aktivitas antioksidan paling besar dengan IC50 sebesar 3,8±0,14 g/ml (Manik, et al., 2013).
Banyak proses fisiologis dan biokimia dalam tubuh manusia dapat menghasilkan radikal bebas dan senyawa oksigen reaktif lainnya. Radikal bebas tersebut dapat menyebabkan kerusakan oksidatif pada biomolekul (misalnya lipid, protein, DNA) dan akhirnya menimbulkan berbagai penyakit, seperti kanker, aterosklerosis, diabetes, dan berbagai penyakit degeneratif lainnya pada manusia
(Ivanišová, et al., 2013). Selain dari dalam tubuh, sumber radikal bebas dapat berasal dari luar tubuh meliputi asap rokok, polusi, radiasi, sinar ultraviolet, obat-obatan, pestisida, dan ozon (Langseth, 1995). Salah satu senyawa yang dapat menghambat terjadinya kerusakan oksidatif tersebut adalah antioksidan.
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat dihambat (Pratimasari, 2009). Berdasarkan sumber perolehannya ada 2 macam antioksidan, yaitu antioksidan alami dan antioksidan buatan (sintetik). Antioksidan sintetik seperti butylated hydroxyanisole (BHA) dan butylated hydroxytoluene (BHT) banyak digunakan karena efektif dan harga relatif murah. Namun, keamanan dan toksisitas antioksidan sintetik telah mendapatkan perhatian yang serius. Oleh karena itu, penggunaan antioksidan alami meningkat (Ivanišová,
et al., 2013). Sesungguhnya Allah telah mengisyaratkan dalam al-Qur’an Surah asy-Syuara ayat 7 sebagai berikut.
ي مل أ
مي ك ج لك نم ا يف انتبنأ مك ضرألا ىلإ ا
Artinyaμ “Dan apakah mereka tidak memperhatikan bumi, berapakah
UIN Syarif Hidayatullah Jakarta
Tanaman banyak mengandung berbagai molekul penghambat radikal bebas, seperti senyawa fenolik (asam fenolik, flavonoid, kuinon, kumarin, lignan, stilbenes, tanin), senyawa nitrogen (alkaloid, amina, betalain), vitamin, terpenoid (termasuk karotenoid), dan beberapa metabolit endogen lainnya yang kaya akan aktivitas antioksidan (Ivanišová, et al., 2013). Senyawa metabolit ini umumnya bersifat polar sehingga dalam penelitian ini digunakan pelarut polar yaitu etanol 70% dan air. Pelarut polar ini diharapkan dapat menyari lebih banyak senyawa yang berpotensi sebagai antioksidan tersebut.
Selain uji aktivitas antioksidan, juga dilakukan pengujian toksisitas. Metode BSLT (Brine shrimp lethality test) merupakan salah satu metode uji toksisitas untuk mengetahui keamanan penggunaan suatu bahan alam serta untuk skrining senyawa antikanker karena adanya korelasi positif antara metode BSLT dengan uji sitotoksik menggunakan kultur sel kanker (Carballo, et al., 2002). Metode ini memiliki beberapa keuntungan antara lain lebih cepat, murah, mudah, tidak memerlukan kondisi aseptis dan dapat dipercaya (Meyer, et al., 1982).
Pada penelitian ini, kulit batang kayu jawa diekstraksi menggunakan metode maserasi dan dekokta. Metode maserasi dipilih karena pengerjaan dan peralatan yang cukup mudah dan sederhana dimana kebanyakan sediaan herbal terstandar diekstraksi dengan metode ini. Sementara itu, pemilihan metode dekokta didasari oleh cara penggunaan kulit batang kayu jawa ini sebagai obat di dalam masyarakat.
1.2 Rumusan Masalah
Adapun rumusan masalah dari penelitian ini sebagai berikut.
1. Bagaimana aktivitas antioksidan ekstrak etanol 70% dan ekstrak air kulit batang tanaman kayu jawa (Lannea coromandelica) yang diperoleh menggunakan metode maserasi dan dekokta?
2. Bagaimana toksisitas ekstrak etanol 70% dan ekstrak air kulit batang tanaman kayu jawa (Lannea coromandelica) yang diperoleh menggunakan metode maserasi dan dekokta?
1.3 Tujuan Penelitian
Penelitian ini dilakukan bertujuan sebagai berikut.
1. Mengetahui aktivitas antioksidan ekstrak etanol 70% dan ekstrak air kulit batang tanaman kayu jawa (Lannea coromandelica) yang diperoleh menggunakan metode maserasi dan dekokta.
2. Mengetahui toksisitas ekstrak etanol 70% dan ekstrak air kulit batang tanaman kayu jawa (Lannea coromandelica) yang diperoleh menggunakan metode maserasi dan dekokta.
1.4 Manfaat Penelitian
1. Manfaat teoritis : menambah khazanah ilmu pengetahuan dan memberikan informasi ilmiah mengenai potensi kearifan lokal tanaman obat di Indonesia
2. Manfaat metodologis : sebagai referensi untuk penelitian selanjutnya dan sebagai acuan metodologi khususnya aktivitas antioksidan dan toksisitas dari kulit batang tanaman kayu jawa (Lannea coromandelica)
3. Manfaat aplikatif : dapat dijadikan sebagai landasan ilmiah penggunaan kulit batang kayu jawa sebagai obat dalam upaya peningkatan kesehatan dan pemanfaatannya di bidang industri farmasi.
Kayu jawa merupakan deciduous tree atau pohon gugur yang dapat tumbuh hingga mencapai 25 m (umumnya 10-15 m). Permukaan batang berwarna abu-abu sampai coklat tua, kasar, ada pengelupasan serpihan kecil yang tidak teratur, batang dalam berserat berwarna merah atau merah muda gelap, dan memiliki eksudat yang bergetah. Daun imparipinnate, meruncing, dan berjumlah 7-11. Bunga berkelamin tunggal berwarna hijau kekuningan. Buah berbiji dengan panjang 12 mm, bulat telur, kemerahan, dan agak keras. Tanaman ini berbunga dan berbuah dari bulan Januari hingga Mei (Sasidharan, 2004). Lannea coromandelica memiliki sinonim Odina wodier yang tersebar di Himalaya (Swat-Bhutan), Assam, Burma, Indo-China, Ceylon, Pulau Andaman, China, dan Malaysia (Sasidharan, 2004).
Tanaman kayu jawa (Lannea coromandelica) merupakan tanaman pekarangan yang dapat dimanfaatkan daun dan kulit batangnya dengan cara ditumbuk ataupun direbus untuk mengobati luka luar, luka dalam, dan perawatan paska persalinan (Rahayu, et al., 2006). Kulit batang dapat digunakan sebagai astringen, mengobati sakit perut, lepra, ulcer, penyakit jantung, disentri, dan sariawan. Kulit batang digunakan bersama dengan kulit batang Aegle mermelos,
Artocarpus heterophyllus dan Sygygium cumini berguna dalam penyembuhan impotensi. Kulit batang dapat dikunyah selama 2-3 hari untuk menyembuhkan glossitis. Perebusan daun juga dianjurkan untuk pembengkakan dan nyeri lokal (Wahid, 2009).
Dari kulit batang dapat ditemukan β-sitosterol, physcion, dan physcion anthranol B (Wahid, 2009). Md. Tofazzal Islam, et al., (2009) telah mengisolasi dihydroflavonols, (2R,3S)-(+)-3′,5-dihydroxy-4′,7-dimethoxydihydroflavonol and (2R,3R)-(+)-4′,5,7-trimethoxy dihydroflavonol dari kulit batang Lannea coromandelica.
2.2 Ekstrak dan Ekstraksi
UIN Syarif Hidayatullah Jakarta
tersisa diperlakukan sehingga memenuhi baku yang telah ditetapkan (Soesilo, 1995). Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang sesuai, diluar pengaruh cahaya matahari langsung (Tiwari, et al., 2011).
Parameter yang mempengaruhi kualitas dari ekstrak adalah bagian dari tumbuhan yang digunakan, pelarut yang digunakan untuk ekstrak, dan prosedur ekstraksi (Tiwari, et al., 2011).
Ekstraksi adalah pemisahan bagian aktif sebagai obat dari jaringan tumbuhan ataupun hewan menggunakan pelarut yang sesuai melalui prosedur yang telah ditetapkan (Tiwari, et al., 2011). Selama proses ekstraksi, pelarut akan berdifusi sampai ke material padat dari tumbuhan dan akan melarutkan senyawa dengan polaritas yang sesuai dengan pelarutnya (Tiwari, et al., 2011).
Beberapa metode ekstraksi dengan menggunakan pelarut dibagi menjadi dua cara, yaitu cara panas dan cara dingin (Ditjen POM, 2000). Ekstraksi cara dingin dapat dibedakan sebagai berikut.
1. Maserasi
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap perendaman, tahap perkolasi antara, tahap perkolasi sebenarnya (penampungan ekstrak) secara terus menerus sampai diperoleh ekstrak (perkolat). Untuk menentukan akhir dari pada perkolasi dapat dilakukan pemeriksaan zat secara kualitatif pada perkolat akhir. Ini adalah prosedur yang paling sering digunakan untuk mengekstrak bahan aktif dalam penyusunan tincture dan ekstrak cairan (Tiwari, et al., 2011).
Ekstraksi cara panas dapat dibedakan sebagai berikut. 1. Sokletasi
Sokletasi adalah ekstraksi mengunakan pelarut yang selalu baru, dengan menggunakan alat soklet sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Ditjen POM, 2000).
2. Refluks
Refluks adalah ekstraksi dengan menggunakan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (Ditjen POM, 2000). 3. Infusa
Infusa adalah ekstraksi dengan pelarut air pada temperatur 900C selama 15 menit. Infusa adalah ekstraksi menggunakan pelarut air pada temperatur penangas air dimana bejana infus tercelup dalam penangas air mendidih, temperatur yang digunakan (96-980C) selama waktu tertentu (15-20 menit) (Ditjen POM, (15-2000). Cara ini menghasilkan larutan encer dari komponen yang mudah larut dari simplisia (Tiwari, et al., 2011).
4. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥30o
UIN Syarif Hidayatullah Jakarta
ini digunakan untuk ekstraksi konstituen yang larut dalam air dan konstituen yang stabil terhadap panas (Tiwari, et al., 2011).
5. Digesti
Digesti adalah maserasi kinetik pada temperatur lebih tinggi dari temperatur suhu kamar, yaitu secara umum dilakukan pada temperatur 40-50oC (Ditjen POM, 2000). Digesti adalah maserasi dengan pengadukan kontinyu pada temperatur lebih tinggi dari temperatur ruang (umumnya 25-30oC). Ini adalah jenis ekstraksi maserasi di mana suhu sedang digunakan selama proses ekstraksi (Tiwari, et al., 2011).
2.3 Pelarut
Pelarut adalah zat yang digunakan sebagai media untuk melarutkan zat lain. kesuksesan penentuan senyawa biologis aktif dari bahan tumbuhan sangat tergantung pada jenis pelarut yang digunakan dalam prosedur ekstraksi (Ncube, et al., 2008). Sifat pelarut yang baik untuk ekstraksi yaitu toksisitas dari pelarut yang rendah, mudah menguap pada suhu yang rendah, dapat mengekstraksi komponen senyawa dengan cepat, dapat mengawetkan dan tidak menyebabkan ekstrak terdisosiasi (Tiwari, et al., 2011).
Pemilihan pelarut juga akan tergantung pada senyawa yang ditargetkan. Faktor-faktor yang mempengaruhi pemilihan pelarut adalah jumlah senyawa yang akan diekstraksi, laju ekstraksi, keragaman senyawa yang akan diekstraksi, kemudahan dalam penanganan ekstrak untuk perlakuan berikutnya, toksisitas pelarut dalam proses bioassay, potensial bahaya kesehatan dari pelarut (Tiwari, et al., 2011).
Berbagai pelarut yang digunakan dalam prosedur ekstraksi antara lain: 1. Air
(Tiwari, et al., 2011). Air juga melarutkan senyawa fenolik yang memiliki aktivitas penting sebagai antioksidan (Tiwari, et al., 2011).
2. Aseton
Aseton melarutkan beberapa komponen senyawa hidrofilik dan lipofilik dari tumbuhan. keuntungan pelarut aseton yaitu dapat bercampur dengan air, mudah menguap dan memiliki toksisitas rendah. Aseton digunakan terutama untuk studi antimikroba dimana banyak senyawa fenolik yang terekstraksi dengan aseton (Tiwari, et al., 2011).
3. Alkohol
Aktivitas antibakteri yang lebih tinggi dari ekstrak etanol dibandingkan dengan ekstrak air dapat dikaitkan dengan adanya jumlah polifenol yang lebih tinggi pada ekstrak etanol dibandingkan dengan ekstrak air. Konsentrasi yang lebih tinggi dari senyawa flavonoid terdeteksi dengan etanol 70% karena polaritas yang lebih tinggi daripada etanol murni (Tiwari,
et al., 2011).
Etanol lebih mudah untuk menembus membran sel untuk mengekstrak bahan intraseluler dari bahan tumbuhan. Metanol lebih polar dibanding etanol namun karena sifat yang toksik, sehingga tidak cocok digunakan untuk ekstraksi (Tiwari, et al., 2011).
4. Kloroform
Terpenoid lakton telah diperoleh dengan ekstraksi berturut-turut menggunakan heksan, kloroform dan metanol dengan konsentrasi aktivitas tertinggi terdapat dalam fraksi kloroform. Kadang-kadang tanin dan terpenoid ditemukan dalam fase air, tetapi lebih sering diperoleh dengan pelarut semipolar (Tiwari, et al., 2011).
5. Eter
Eter umumnya digunakan secara selektif untuk ekstraksi kumarin dan asam lemak (Tiwari, et al., 2011).
6. n-Heksan
UIN Syarif Hidayatullah Jakarta
didih heksana pada tekanan 760 mmHg adalah 66 sampai 71°C (Daintith, 1994). n-Heksan biasanya digunakan sebagai pelarut untuk ekstraksi minyak nabati.
7. Etil asetat
Etil asetat merupakan pelarut dengan karekateristik semipolar. Etil asetat secara selektif akan menarik senyawa yang bersifat semipolar seperti fenol dan terpenoid (Tiwari, et al., 2011).
2.4 Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) merupakan salah satu metode pilihan kromatografi secara fisikokimia (Gandjar & Rohman, 2007). KLT merupakan bentuk kromatografi planar, selain kromatografi kertas dan elektroforesis. Pada KLT fase diamnya berupa lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat alumunium atau plat plastik. Meskipun demikian, kromatografi planar ini merupakan bentuk terbuka dari kromatografi kolom (Gritter, et al., 1991).
KLT dapat dipakai dengan dua tujuan. Pertama, dipakai untuk mencapai hasil kualitatif, kuantitatif atau preparatif. Kedua dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom (Gritter, et al., 1991).
Kromatografi lapis tipis (KLT) dapat digunakan untuk tujuan analitik dan preparatif. KLT analitik digunakan untuk menganalisa senyawa-senyawa organik dalam jumlah kecil misalnya, menentukan jumlah komponen dalam campuran dan menentukan pelarut yang tepat untuk pemisahan dengan KLT preparatif. Sedangkan KLT preparatif digunakan untuk memisahkan campuran senyawa dari sampel dalam jumlah besar berdasarkan fraksinya, yang selanjutnya fraksi-fraksi tersebut dikumpulkan dan digunakan untuk analisa berikutnya (Townshend, 1995).
pengelusi akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara mekanik (ascending), atau karena pengaruh gravitasi pada pengembangan menurun (descending) (Gritter, et al., 1991).
Jumlah volume fase gerak harus mampu mengelusi lempeng sampai ketinggian lempeng yang telah ditentukan. Setelah lempeng terelusi, dilakukan deteksi bercak (Gandjar & Rohman, 2007). Laju pergerakan fase gerak terhadap fase diam dihitung sebagai retardation farctor (Rf). Nilai Rf diperoleh dengan membandingkan jarak yang ditempuh oleh zat terlarut dengan jarak yang ditempuh oleh fase gerak (Gandjar & Rohman, 2007).
Fase gerak harus memiliki kemurnian yang tinggi. Hal ini dikarenakan KLT merupakan teknik yang sensitif. Fase gerak yang digunakan adalah pelarut organik yang memiliki tingkat polaritas tersendiri, melarutkan senyawa contoh, dan tidak bereaksi dengan penjerap. Adsorben umumnya digunakan dalam KLT meliputi partikel silika gel ukuran 12 µm, alumina, mineral oksida, silika gel dengan ikatan kimia, selulosa, poliamida, polimer penukar ion, silika gel, dan fase kiral (Gritter, et al., 1991).
Ada beberapa cara untuk mendeteksi senyawa yang tidak berwarna pada kromatogram. Deteksi paling sederhana adalah jika senyawa menunjukkan penyerapan di daerah UV gelombang pendek (radiasi utama kira-kira 254 nm) atau jika senyawa itu dapat dieksitasi pada radiasi UV gelombang pendek dan gelombang panjang (365 nm). Pada senyawa yang mempuyai dua ikatan rangkap atau lebih dan senyawa aromatik seperti turunan benzena, mempunyai serapan kuat ± di daerah 230-300 nm (Stahl, 1985).
UIN Syarif Hidayatullah Jakarta
kurang sifat kepolarannya akan bergerak lebih cepat dibandingkan bahan-bahan polar (Gritter, et al., 1991).
Fase gerak harus memiliki kemurnian yang tinggi. Hal ini dikarenakan KLT merupakan teknik yang sensitif. Fase gerak yang digunakan adalah pelarut organik yang memiliki tingkat polaritas tersendiri, melarutkan senyawa contoh, dan tidak bereaksi dengan penjerap (Gritter, et al., 1991).
Pelarut yang ideal harus melarutkan linarut dan harus cukup baik sebagai pelarut yang bersaing dengan daya serap penjerap. Keadaan yang ideal tersebut mungkin terjadi jika pelarut tidak berproton seperti hidrokarbon, eter dan senyawa karbonil dipakai sebagai pelarut pengembang (Gritter, et al., 1991).
2.5 Spektrofotometer UV-Vis
Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat encer dengan pembanding blangko pelarut menggunakan spektrofotometer. Senyawa tanpa warna diukur pada panjang gelombang 200-400 nm, senyawa berwarna pada panjang gelombang 400-800 nm. Prinsip kerja spektrofotometer UV-Vis ialah interaksi sinar ultraviolet atau tampak dengan molekul sampel. Energi cahaya akan mengeksitasi elektron terluar molekul ke orbital lebih tinggi (Harborne, 1987).
Pada kondisi ini, elektron tidak stabil dan dapat melepas energi untuk kembali ke tingkat dasar, dengan disertai emisi cahaya. Besarnya penyerapan cahaya sebanding dengan molekul, sesuai dengan hukum lambert-Beer:
A= ɛ B C Keterangan: A= serapan
Sumber radiasi pada spektrofotometer UV-Vis berdasarkan panjang gelombang terbagi menjadi 2, yaitu lampu deuterium dan tungstent. Lampu deuterium menghasilkan sinar 160-500 nm. Lampu tungstent digunakan di daerah sinar tampak 350-3500 nm. Sumber radiasi dikatakan ideal jika memancarkan sperktrum radiasi yang kontinyu, intensitasnya tinggi dan stabil pada semua panjang gelombang.
Radiasi ultraviolet dan sinar tampak diabsorpsi oleh molekul organic aromatik, molekul yang mengandung elektron-π terkonyugasi dan atau atom yang mengandung elektron-n, menyebabkan transisi elektron di orbital terluarnya dari tingkat energi elektron dasar ke tingkat energi elektron tereksitasi lebih tinggi.
Besarnya serapan radiasi tersebut sebanding dengan banyaknya molekul analit yang mengabsorpsi sehingga dapat digunakan untuk analisis kuantitatif. Gugus fungsi yang menyerap radiasi di daerah ultraviolet dekat dan daerah tampak disebut kromofor dan hampir semua kromofor mempunyai ikatan tak jenuh. Pada kromofor jenis ini transisi terjadi dari π→π*, yang menyerap pada
max kecil dari 200 nm (tidak terkonyugasi), misalnya pada >C=C< dan -C≡C-.
Kromofor ini merupakan tipe transisi dari sistem yang mengandung elektron π pada orbital molekulnya. Untuk senyawa yang mempunyai sistem konjugasi, perbedaan energi antara keadaan dasar dan keadaan tereksitasi menjadi lebih kecil sehingga penyerapan terjadi pada panjang gelombang yang lebih besar. Gugus fungsi seperti –OH, -NH2, dan –Cl yang mempunyai elektron-elektron valensi
bukan ikatan disebut auksokrom yang tidak menyerap radiasi pada panjang gelombang lebih besar dari 200 nm, tetapi menyerap kuat pada daerah ultraviolet jauh. Bila suatu auksokrom terikat pada suatu kromofor, maka pita serapan kromofor bergeser ke panjang gelombang yang lebih panjang (efek batokrom) dengan intensitas yang lebih kuat. Efek hipsokrom adalah suatu pergeseran pita serapan ke panjang gelombang lebih pendek, yang sering kali terjadi bila muatan positif dimasukkan ke dalam molekul dan bila pelarut berubah dari non polar ke pelarut polar (Dachriyanus, 2004).
UIN Syarif Hidayatullah Jakarta
yang menghubungkan antara banyaknya sinar yang diserap dengan frekuensi (atau panjang gelombang) sinar merupakan spektrum absorpsi. Transisi yang dibolehkan (allowed transition) untuk suatu molekul dengan struktur kimia yang berbeda adalah tidak sama, sehingga spektrum absorpsinya juga berbeda. Dengan demikian, spektrum dapat digunakan sebagai bahan informasi yang bermanfaat untuk analisis kualitatif. Banyaknya sinar yang diabsorpsi pada panjang gelombang tertentu sebanding dengan banyaknya molekul yang menyerap radiasi, sehingga spektrum absorpsi juga dapat digunakan untuk analisis kuantitatif (Gandjar dan Rohman, 2007).
Hal–hal yang harus diperhatikan dalam analisis spektofotometri UV-Vis sebagai berikut.
1. Penentuan panjang gelombang maksimum
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang dimana terjadi serapan maksimum. Untuk memperoleh panjang gelombang serapan maksimum, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu.
2. Pembuatan kurva kalibrasi
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi. Masing–masing absorbansi larutan dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi. Bila hukum Lambert-Beer terpenuhi maka kurva kalibrasi berupa garis lurus.
3. Pembacaan absorbansi sampel atau cuplikan
2.6 Antioksidan
Radikal bebas merupakan atom, molekul atau senyawa-senyawa yang mengandung satu atau lebih elektron yang tidak berpasangan yang bersifat sangat reaktif dan tidak stabil (Surai, 2003). Agar menjadi stabil, radikal bebas memerlukan elektron yang berasal dari pasangan elektron di sekitarnya, sehingga terjadi perpindahan elektron dari molekul donor ke molekul radikal untuk menjadikan radikal tersebut stabil (Simanjuntak, et al., 2012).
Antioksidan adalah zat yang dapat melawan pengaruh bahaya dari radikal bebas atau Reactive Oxygen Species (ROS) yang terbentuk sebagai hasil dari metabolisme oksidatif yaitu hasil dari reaksi-reaksi kimia dan proses metabolik yang terjadi dalam tubuh. Senyawa antioksidan dapat berfungsi sebagai penangkap radikal bebas, membentuk kompleks dengan logam-logam peroksida dan sebagai senyawa pereduksi (Goldberd, 2003).
Banyak proses fisiologis dan biokimia dalam tubuh manusia (endogen) dapat menghasilkan radikal bebas dan senyawa oksigen reaktif (ROS) lainnya seperti proses autooksidasi, aktivitas oksidasi, dan sistem transpor electron. Selama produksi radikal bebas tersebut dapat menyebabkan kerusakan oksidatif pada biomolekul (misalnya lipid, protein, DNA) dan akhirnya menimbulkan berbagai penyakit kronis, seperti aterosklerosis, kanker, diabetes, dan penyakit
degeneratif lainnya pada manusia (Ivanišová, et al., 2013). Selain dari dalam tubuh, sumber radikal bebas dapat berasal dari luar tubuh manusia (eksogen) meliputi asap rokok, polusi lingkungan, radiasi, sinar ultraviolet obat-obatan, pestisida, anestetik, pelarut industri, dan ozon (Langseth, 1995).
UIN Syarif Hidayatullah Jakarta
kelompok ini misalnya BHA, BHT, PG, TBHQ, dan tokoferol. Antioksidan yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Antioksidan tersebut dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*,ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibandingkan radikal lipida.
Fungsi kedua merupakan mekanisme fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil. Senyawa-senyawa ini mempunyai kemampuan untuk mendekomposisi hidroperoksida menjadi produk akhir yang stabil. Tipe antioksidan ini pada umumnya digunakan untuk menstabilkan poliolefin resin. Contohnya, asam tiodipropionat dan dilauriltiopropionat (Gordon, 1990).
Fungsi ketiga adalah sebagai Oxygen scavengers, yaitu senyawa-senyawa yang berperan sebagai pengikat oksigen sehingga tidak mendukung reaksi oksidasi. Dalam hal ini, senyawa tersebut akan mengadakan reaksi dengan oksigen yang berada dalam sistem sehingga jumlah oksigen akan berkurang. Contoh dari senyawa-senyawa kelompok ini adalah vitamin C (asam askorbat), askorbilpalminat, asam eritorbat, dan sulfit (Gordon, 1990).
Antioxidative Enzime merupakan enzim yang berperan mencegah terbentuknya radikal bebas. Contohnya glukose oksidase, superoksidase dismutase (SOD), glutation peroksidase, dan kalalase. Selain itu, ada juga senyawa-senyawa yang mampu mengikat logam seperti besi dan tembaga yang mampu mengkatalis reaksi oksidasi lemak. Senyawa-senyawa ini disebut juga dengan Chelators sequestrants, yang termasuk didalamnya adalah asam sitrat, asam amino, ethylenediaminetetra acetid acid (EDTA), dan fosfolipid (Gordon, 1990).
Berdasarkan sumber perolehannya, ada 2 macam antioksidan yaitu antioksidan alami dan antioksidan buatan (sintetik). Antioksidan sintetis seperti
digunakan karena efektif dan lebih murah daripada yang alami. Namun, keamanan dan toksisitas antioksidan sintetik telah mendapatkan perhatian yang serius. Oleh karena itu, penggunaan antioksidan alami yang juga mungkin memiliki sifat gizi menyebabkan penggunaannya meningkat (Ivanišová, et al., 2013).
2.7 Uji Aktivitas Antioksidan Metode DPPH
Metode DPPH merupakan salah satu metode untuk menentukan aktivitas antioksidan yang sederhana dengan menggunakan 2,2-diphenyl-1-picrylhydrazyl (DPPH) sebagai senyawa pendeteksi (Surai, 2003). DPPH adalah senyawa radikal bebas yang dapat bereaksi dengan atom hidrogen yang berasal dari suatu antioksidan membentuk DPPH tereduksi (Surai, 2003).
Metode DPPH (2,2-diphenyl-1-picrylhydrazyl) digunakan secara luas untuk menguji kemampuan senyawa yang berperan sebagai pendonor elektron atau atom hidrogen. Metode DPPH merupakan metode yang dapat mengukur aktivitas total antioksidan baik dalam pelarut polar maupun nonpolar. Beberapa metode lain terbatas mengukur komponen yang larut dalam pelarut yang digunakan dalam analisa. Metode DPPH mengukur semua komponen antioksidan, baik yang larut dalam lemak maupun dalam air (Prakash, 2001).
Metode DPPH merupakan metode yang sederhana, mudah, cepat dan peka, serta hanya memerlukan sedikit sampel. DPPH adalah senyawa radikal bebas stabil kelompok nitrit oksida. Senyawa ini mempunyai ciri-ciri padatan berwarna ungu kehitaman, larut dalam pelarut DMF atau etanol/metanol 394,3 g/mol, rumus molekul C18H12N5O6 (Prakash, 2001).
UIN Syarif Hidayatullah Jakarta
Aktivitas antioksidan dapat dinyatakan dengan satuan % aktivitas. Nilai ini diperoleh dengan rumus sebagai berikut (Molyneux, 2003).
% Inhibisi
Absorbansi blangko yang digunakan dalam prosedur ini adalah absorbansi DPPH dengan metanol pro analisa. Berdasarkan rumus tersebut, semakin tinggi tingkat diskolorisasi (absorbansi semakin kecil) maka semakin tinggi nilai aktivitas penangkapan radikal bebas (Molyneux, 2003).
Aktivitas antioksidan pada metode DPPH dinyatakan dengan IC50
(Inhibition Concentration). IC50 adalah bilangan yang menunjukkan konsentrasi
ekstrak yang mampu menghambat aktivitas DPPH sebesar 50%. Semakin kecil nilai IC50 berarti semakin tinggi aktivitas antioksidan (Blois, 1958).
AAI (Antioxidant activity index) adalah nilai yang menunjukkan besarnya aktivitas antioksidan yang dimiliki suatu ekstrak atau bahan uji. Nilai AAI dapat ditentukan dengan cara konsentrasi DPPH yang digunakan dalam uji (ppm) dibagi dengan nilai IC50 yang diperoleh (ppm). Penggolongan nilai AAI ini
dilakukan oleh Scherer dan Godoy (2009). Nilai AAI yang <0,5 menandakan antioksidan lemah, AAI > 0,5-1 menandakan antioksidan sedang, AAI >1-2 menandakan antioksidan kuat, dan AAI >2 menandakan antioksidan yang sangat kuat (Vasic, Stefanovic, Licina, Radojevic & Comic, 2012).
2.8 Uji Toksisitas Brine Shrimp Lethality Test (BSLT)
Uji ini merupakan uji pendahuluan untuk mengamati aktivitas farmakologi suatu senyawa salah satunya adalah anti kanker. Adapun penerapan untuk sistem bioaktivitas dengan menggunakan larva udang tersebut, antara lain untuk mengetahui residu pestisida, anastetik lokal, senyawa turunan morpin, mikotoksin, karsinogenitas suatu senyawa dan polutan untuk air laut serta sebagai alternatif metode yang murah untuk uji sitotoksisitas (Hamburger & Hostettmann, 1991). Senyawa aktif yang memiliki daya bioaktivitas tinggi diketahui berdasarkan nilai Lethal Concentration 50% (LC50), yaitu suatu
nilai yang menunjukkan konsentrasi zat toksik yang dapat menyebabkan kematian hewan uji sampai 50%. Data mortalitas yang diperoleh kemudian diolah dengan analisis probit yang dirumuskan oleh Finney (1971) untuk menentukan nilai LC50 pada derajat kepercayaan 95%. Senyawa kimia
memiliki potensi bioaktif jika mempunyai nilai LC50 kurang dari 1.000 µg/ml
(Meyer, et al., 1982).
Uji BSLT dengan menggunakan larva udang Artemia salina
dilakukan dengan menetaskan telur-telur tersebut dalam air laut yang dibantu dengan aerasi. Telur Artemia salina akan menetas sempurna menjadi larva dalam waktu 24 jam. Larva A. salina yang baik digunakan untuk uji BSLT adalah yang berumur 48 jam sebab jika lebih dari 48 jam dikhawatirkan kematian Artemia salina bukan disebabkan toksisitas ekstrak melainkan oleh terbatasnya persediaan makanan (Meyer, et al., 1982).
Keunggulan penggunaan larva udang A. salina untuk uji BSLT ini ialah sifatnya yang peka terhadap bahan uji, waktu siklus hidup yang lebih cepat, mudah dibiakkan dan harganya yang murah. Sifat peka A. salina kemungkinan disebabkan oleh keadaan membran kulitnya yang sangat tipis sehingga memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi metabolisme dalam tubuhnya. A. salina ditemukan hampir pada seluruh permukaan perairan di bumi yang memiliki kisaran salinitas 10 - 20g/L, hal inilah yang menyebabkannya mudah dibiakkan. Larva yang baru saja menetas disebut nauplius berbentuk bulat lonjong dan berwarna
UIN Syarif Hidayatullah Jakarta
BAB 3
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Penelitian I, laboratorium Kimia Obat, dan laboratorium Analisis Obat dan Pangan Halal, Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta. Waktu penelitian dimulai pada bulan Maret hingga bulan Juni 2014.
3.2 Alat Dan Bahan 3.2.1 Alat
Alat serta instrumen yang digunakan dalam penelitian ini antara lain timbangan analitik (AND GH-202), blender, kertas label, penggaris, pensil, aluminium foil, plastik, kertas saring, kapas, labu erlenmeyer, becker glass, gelas ukur, corong, tabung reaksi, spatula, batang pengaduk, pipet tetes, kaca arloji, botol kaca, krus porselen, botol timbang, gelas ukur, pipa kapiler, vial, elektromantel, panci dekok, plat KLT, chamber, oven, tanur (Thermolyne), spektrofotometer UV-Vis (Hitachi U-2910), dan vacuum rotary evaporator
(EYELA N-1000).
3.2.2 Bahan
UIN Syarif Hidayatullah Jakarta 3.3 Prosedur Kerja
3.3.1 Penyiapan Sampel
Sampel kulit batang tanaman kayu jawa (Lannea coromandelica) diperoleh dari daerah Watampone, Kabupaten Bone, Sulawesi Selatan. Sampel kulit batang dikumpulkan pada bulan Februari 2014. Sebanyak 1,5 kg kulit batang segar disortasi basah, selanjutnya dicuci dengan air mengalir. Sampel kemudian dirajang dan dikeringkan dengan cara dikering-anginkan. Selanjutnya sampel yang telah kering disortasi kering dan dihaluskan menggunakan blender hingga diperoleh serbuk simplisia kering sebanyak 688 gram.
3.3.2 Ekstraksi Sampel Kulit Batang Kayu Jawa (Lannae coromandelica)
Serbuk kering kulit batang Kayu Jawa (Lannea coromandelica) diekstraksi dengan menggunakan dua metode yang berbeda yaitu sebagai berikut.
1. Metode Maserasi
Serbuk simplisia kering kulit batang kayu jawa (Lannea coromandelica) ditimbang 344 gram dan dimaserasi dengan etanol 70% selama 2 sampai 3 hari. Prosedur diulangi hingga 6 kali proses maserasi. Selanjutnya masing-masing hasil ekstraksi disaring dan filtrat yang diperoleh dipekatkan dengan vacuum rotary evaporator hingga diperoleh ekstrak kental. Selanjutnya ekstrak kental yang diperoleh, dihitung rendemennya.
2. Metode Dekokta
kukusan/dandan. Waktu 30 menit dihitung setelah suhu dalam botol telah mencapai 90°C (Tiwari, et al., 2011).
3.3.3 Penapisan Fitokimia
Penapisan fitokimia dilakukan untuk mengetahui metabolit sekunder yang terkandung di dalam ekstrak etanol 70% dan ekstrak air kulit batang kayu jawa (Lannea coromandelica). Metabolit sekunder yang diuji secara kualitatif ini antara lain alkaloid, flavonoid, saponin, glikosida, triterpenoid, fenol, dan tanin.
1. Uji Alkaloid
Sebanyak 0,5 gram ekstrak dilarutkan dalam larutan HCl encer kemudian disaring. Tes Mayer dilakukan dengan menambahkan filtrat dengan reagen mayer (Potassium Mercuric Iodide). Terjadinya endapan berwarna kuning mengindikasikan adanya senyawa alkaloid (Tiwari, et al., 2011). Tes Dragendorf juga dapat dilakukan untuk mengetahui keberadaan alkaloid.Filtrat yang diperoleh ditambahkan reagen dragendorf (solution of Potassium Bismuth Iodide). Terjadinya endapan berwarna merah mengindikasikan adanya senyawa alkaloid (Tiwari, et al., 2011).
2. Uji Flavonoid
Sebanyak 0,5 gram ekstrak dilarutkan dengan 2 mL etanol 70% dan ditambahkan 3 tetes larutan NaOH. Terjadinya perubahan intensitas warna kuning menjadi tidak berwarna pada penambahan asam sulfat mengindikasikan adanya senyawa flavonoid (Tiwari, et al., 2011).
3. Uji Saponin
Sebanyak 0,5 gram ekstrak dilarutkan dalam 20 mL aquades, kemudian larutan dikocok dalam labu ukur selama 15 menit. Terbentuknya busa setinggi 1 cm mengindikasikan adanya senyawa saponin (Tiwari, et al., 2011).
4. Uji Glikosida
UIN Syarif Hidayatullah Jakarta
5. Uji Triterpenoid
Tes Salkowski dapat digunakan untuk mengidentifikasi keberadaan senyawa triterpen. Sebanyak 0,5 gram ekstrak dilarutkan dalam kloroform dan disaring. Kemudian filtrat ditambahkan beberapa tetes asam sulfat dan dikocok. Terbentuknya warna kuning emas mengindikasikan adanya senyawa triterpen.
6. Uji Fenol
Sebanyak 0,5 gram ekstrak dilarutkan dengan 2 mL etanol 70% dan ditambahkan 3 tetes larutan FeCl3. Terbentuknya warna hitam kebiruan
mengindikasikan adanya senyawa fenol (Tiwari, et al., 2011). 7. Uji Tanin
Sebanyak 0,5 gram ekstrak dilarutkan dengan 2 mL etanol 70%, dididihkan dalam 10 mL aquades dalam tabung reaksi kemudian disaring. Ditambahkan 3 tetes larutan ferri klorida 0,1% dan diamati terbentuknya warna hijau kecoklatan atau biru kehitaman menunjukkan adanya tanin (Ayoola, et al., 2008).
3.3.4 Parameter Ekstrak
1. Identitas
Ekstrak dideskripsikan dengan tata nama yang meliputi nama ekstrak, nama latin tumbuhan, bagian tumbuhan yang digunakan, dan nama Indonesia tumbuhan (Depkes RI, 2000).
2. Organoleptik
Ekstrak dideskripsikan menggunakan panca indera untuk mengetahui bentuk, warna, bau, dan rasa (Depkes RI, 2000).
3. Residu Pelarut Etanol
4. Kadar Abu Total
Penetapan kadar abu total dilakukan sebanyak tiga kali (triplo). Sebanyak 2 gram ekstrak etanol 70% ditimbang ke dalam krus yang telah ditara dan dipijarkan perlahan. Suhu dinaikkan secara bertahap hingga 600±25°C. Didinginkan dalam desikator dan ditimbang berat abu. Kadar abu dihitung dalam persen terhadap berat sampel awal (Depkes RI, 2000).
3.3.5 Pengujian Antioksidan secara Kualitatif dengan Metode Kromatografi Lapis Tipis (KLT)
Ekstrak etanol 70% ditimbang 50 mg dilarutkan dengan etanol 50 mL (1000 ppm). Ekstrak air digunakan konsentrasi 5%. Silika gel pada lempeng aluminium digunakan sebagai fase diam. Fase gerak digunakan etanol, etil asetat, dan kloroform dengan perbandingan 2:1:1. Setelah itu chamber yang berisi eluen dijenuhkan (Ghasal & Mandal, 2012).
Ekstrak etanol 70% dan ekstrak air kulit batang kayu jawa (Lannea coromandelica), ditotolkan pada plat KLT menggunakan pipa kapiler. Proses elusi dilakukan dengan cara plat KLT dimasukkan ke dalam chamber yang berisi eluen dan telah dijenuhkan. Eluen dibiarkan merambat hingga mencapai batas plat yang telah ditandai sebelumnya. Setelah selesai, plat KLT dikeluarkan dari chamber. Plat KLT kemudian dikeringkan dan disemprot dengan larutan DPPH 0,1 mM (Ghasal & Mandal, 2012). Bercak pada plat KLT yang memiliki aktivitas antioksidan akan berubah menjadi warna putih kuning dengan latar belakang ungu (Kuntorini & Astuti, 2010).
3.3.6 Pengujian Antioksidan secara Kuantitatif dengan Metode DPPH 3.3.6.1 Pembuatan Larutan DPPH 0,1 mM
UIN Syarif Hidayatullah Jakarta 3.3.6.2 Penentuan Panjang Gelombang Maksimum DPPH
Larutan DPPH 0,1 mM sebanyak 2 mL dimasukkan ke dalam tabung reaksi lalu ditambahkan metanol p.a sebanyak 2 mL, tutup dengan aluminium foil, dihomogenkan dengan vortex lalu dituang ke dalam kuvet dan diukur pada panjang gelombang 400-800 nm menggunakan spektrofotometer UV-Vis (Musfiroh & Syarief, 2009). Panjang gelombang maksimum DPPH yang digunakan berada pada 515,5 nm.
3.3.6.3 Pembuatan Larutan Blangko
Larutan DPPH 0,1 mM sebanyak 2 mL dimasukkan ke dalam tabung reaksi dan ditambahkan metanol p.a sebanyak 2 mL. Tutup dengan aluminium foil. Campuran dihomogenkan dengan vortex dan diinkubasi dalam ruangan gelap selama 30 menit (Molyneux, 2004). Selanjutnya, serapan larutan blangko diukur pada panjang gelombang maksimum yaitu 515,5 nm.
3.3.6.4 Pembuatan Larutan Uji Ekstrak Kulit Batang Kayu Jawa (Lannea coromandelica)
1. Pembuatan Larutan uji ekstrak etanol 70% dan ekstrak air kulit batang Kayu Jawa (Lannea coromandelica)
Larutan induk ekstrak etanol 70% dibuat terlebih dahulu dengan menimbang 50 mg ekstrak dan dibasahi dengan 5 tetes etanol 70%. Etanol 70% dibiarkan menguap kemudian dilarutkan dengan metanol p.a. Larutan dimasukkan ke dalam labu ukur 50 mL. Volume dicukupkan dengan metanol p.a sampai tanda batas (1000 ppm). Kemudian dari larutan induk dibuat seri konsentrasi 5 ppm, 10 ppm, 15 ppm, 20 ppm, dan 25 ppm.
Larutan induk ekstrak air diperoleh dari hasil dekokta 5%. Kemudian dari larutan induk 5% tersebut dibuat seri konsentrasi yaitu 0,03%, 0,05%, 0,12%, dan 0,15%.
mL, dihomogenkan dengan vortex. Selanjutnya, diinkubasi dalam ruangan gelap selama 30 menit (Molyneux, 2004). Serapan diukur pada panjang gelombang maksimum yaitu 515,5 nm.
3.3.6.5 Pembuatan Larutan Pembanding Vitamin C
1. Pembuatan larutan pembanding Vitamin C
Membuat larutan induk Vitamin C 1000 ppm dengan cara menimbang 50 mg serbuk vitamin C, dilarutkan dengan metanol p.a dan dimasukkan ke dalam labu ukur 50 mL. Volume dicukupkan dengan metanol p.a sampai tanda batas. Kemudian dari larutan induk dibuat seri konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm.
2. Pengukuran serapan dengan menggunakan spektrofotometer UV-Vis Pengujian dilakukan dengan cara masing-masing konsentrasi larutan pembanding vitamin C sebanyak 2 mL dimasukkan ke dalam tabung reaksi. Ditambahkan larutan DPPH 0,1 mM sebanyak 2 mL, dihomogenkan dengan vortex. Selanjutnya, diinkubasi dalam ruangan gelap selama 30 menit (Molyneux, 2004). Serapan diukur pada panjang gelombang maksimum yaitu 515,5 nm.
3.3.6.6 Analisis Data
1. Penentuan Nilai IC50 (Inhibitory Concentration)
Parameter yang biasa digunakan untuk menginterpretasikan hasil dari uji aktivitas antioksidan dengan metode DPPH adalah dengan nilai
efficient concentration (EC50) atau sering disebut nilai IC50, yaitu
konsentrasi yang menyebabkan hilangnya 50% aktivitas DPPH (Molyneux, 2004). Untuk menghitung nilai IC50 diperlukan data persen inhibisi dari
pengujian yang dilakukan. Persen inhibisi dapat dihitung dengan menggunakan rumus sebagai berikut:
UIN Syarif Hidayatullah Jakarta
Konsentrasi sampel dan persen inhibisi yang diperoleh diplot masing-masing pada sumbu x dan y pada persamaan regresi linear. Persamaan tersebut digunakan untuk menentukan nilai IC50 dari
masing-masing sampel dinyatakan dengan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai IC50 (Nurjanah, Izzati & Abdullah, 2011).
2. Penentuan Nilai AAI (Antioxidant Activity Index)
Nilai AAI dapat ditentukan dengan cara konsentrasi DPPH yang digunakan dalam uji (ppm) dibagi dengan nilai IC50 yang diperoleh (ppm).
Nilai AAI yang <0,5 menandakan antioksidan lemah, AAI > 0,5-1 menandakan antioksidan sedang, AAI >1-2 menandakan antioksidan kuat, dan AAI >2 menandakan antioksidan yang sangat kuat (Vasic, Stefanovic, Licina, Radojevic & Comic, 2012).
3.3.7 Pengujian Toksisitas dengan Metode Brine Shrimp Lethality Test (BSLT)
3.3.7.1 Persiapan Larva Artemia salina
Penetasan telur Artemia salina dilakukan dengan cara menetaskan sebanyak 50 mg telur Artemia salina dalam wadah yang berisi air laut, disekat menjadi dua bagian yang salah satunya dibuat gelap dan diletakkan dibawah lampu (Meyer, et al., 1982). Telur Artemia salina akan menetas dan menjadi larva setelah 24 jam (Mudjiman, 1988).
3.3.7.2 Pembuatan Larutan Uji Ekstrak Kulit Batang Kayu Jawa (Lannea coromandelica)
Larutan uji ekstrak etanol 70% kulit batang kayu jawa (Lannea coromandelica) dibuat dengan cara menimbang 50 mg ekstrak etanol 70% kemudian dilarutkan dengan sedikit etanol 70% dan ditambahkan aquades hingga 50 mL sebagai larutan induk 1000 ppm. Larutan uji dibuat seri konsentrasi akhir menjadi 1 ppm, 10 ppm, 100 ppm, dan 500 ppm.
3.3.7.3 Pengujian Toksisitas
Pengujian toksisitas larutan uji ekstrak etanol 70% dan ekstrak air dilakukan dengan mengambil sebanyak 10 ekor larva udang menggunakan pipet tetes dan dimasukkan ke dalam tabung reaksi. Pada pengujian ekstrak etanol 70%, masing-masing tabung kemudian ditambahkan larutan uji ekstrak etanol 70%. Sedangkan pada pengujian ekstrak air, masing-masing tabung ditambahkan larutan uji ekstrak air. Volume digenapkan dengan aquades hingga 10 mL sehingga terjadi pengenceran. Larutan diaduk perlahan sampai homogen. Untuk setiap konsentrasi dilakukan 3 kali pengulangan (triplikat) (Anderson, 1991).
Untuk kontrol dilakukan tanpa penambahan sampel. Larutan dibiarkan selama 24 jam, kemudian dihitung jumlah larva yang mati dan masih hidup dari tiap tabung (Juniarti, et al., 2009).
3.3.7.4 Analisis Data
Pengujian efek toksik dihitung dengan menentukan nilai LC50. Nilai LC50
diperoleh dengan terlebih dahulu menghitung persentase mortalitas hewan uji setelah 24 jam dengan cara :
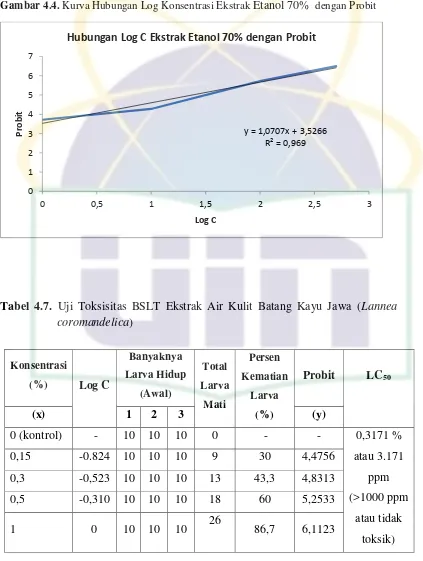
Selanjutnya dicari angka probit melalui tabel probit dan dibuat grafik dengan log konsentrasi sebagai sumbu x terhadap persentase mortalitas dalam satuan probit sebagai sumbu y. Nilai LC50 merupakan konsentrasi dimana suatu
zat menyebabkan kematian 50% hewan uji yang diperoleh dengan menggunakan persamaan regresi linier y = a + bx. Suatu zat dikatakan aktif atau toksik bila nilai LC50 kurang dari 1000 ppm untuk ekstrak dan kurang dari 30 ppm untuk suatu
UIN Syarif Hidayatullah Jakarta BAB 4
HASIL DAN PEMBAHASAN
4.1 Determinasi Tanaman
Determinasi tanaman terlebih dahulu dilakukan untuk mengetahui identitas tanaman yang digunakan. Determinasi tanaman ini dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi LIPI (Lembaga Ilmu Pengetahuan Indonesia) Cibinong, Bogor. Hasil determinasi menunjukkan bahwa sampel yang digunakan merupakan Lannea coromandelica (Houtt.) Merr. dari famili Anacardiacea (lampiran 2).
4.2 Penyiapan Sampel
Bagian tanaman yang digunakan pada penelitian ini adalah kulit batang dari tanaman kayu jawa (Lannea coromandelica). Kayu jawa yang menjadi sampel adalah kayu jawa yang tumbuh di daerah Watampone, kabupaten Bone, Sulawesi Selatan. Tanaman ini banyak tumbuh liar ataupun sengaja ditanam sebagai tanaman pagar. Kulit batang yang digunakan dari batang kayu jawa yang berdiameter 5 sampai 6 cm. Kulit batangnya biasanya berukuran 3 sampai 5 mm. Kulit batang mulai dikumpulkan pada bulan februari 2014.
Sebanyak 1,5 kg kulit batang segar disortasi basah untuk memisahkan dengan pengotor seperti tanah ataupun bagian tanaman yang tidak digunakan dalam penelitian dan terbawa pada saat proses pengumpulan kulit batang. Kulit batang selanjutnya dicuci dengan air mengalir. Kulit batang yang telah dicuci dirajang untuk memperbesar luas permukaan sampel sehingga pelarut lebih mudah berpenetrasi ke dalam sel sehingga penarikan senyawa kimia yang terkandung dalam sampel lebih maksimal. Setelah proses perajangan, dilanjutkan proses pengeringan dengan cara dikering-anginkan. Pengeringan dilakukan untuk menghentikan reaksi enzimatik yang dapat menyebabkan penguraian atau perubahan kandungan kimia yang terdapat pada kulit batang. Selain itu, pengeringan dilakukan di tempat yang terlindung dari cahaya matahari langsung. Hal ini dilakukan untuk menghindari kemungkinan terjadinya kerusakan pada
kandungan kimia kulit batang akibat pemanasan. Selanjutnya, kulit batang yang telah kering disortasi kering untuk meisahkan dari pengotor-pengotor yang masih terbawa pada saat proses pengeringan. Kulit batang yang telah disortasi dihaluskan menggunakan blender hingga dan diperoleh serbuk simplisia kering sebanyak 688 gram.
4.3 Ekstraksi
Proses ekstraksi simplisia kulit batang kayu jawa dilakukan dengan dua cara berbeda yaitu maserasi langsung dan dekokta. Maserasi langsung dilakukan dengan mengekstraksi langsung simplisia kulit batang dengan etanol 70%. Maserasi dipilih karena proses pengerjaan yang mudah dan peralatan yang cukup sederhana. Pada maserasi ini, digunakan simplisia sebanyak 344 gram. Proses maserasi dilakukan selama 2 sampai 3 hari. Prosedur diulangi hingga 6 kali proses maserasi.
Total pelarut etanol 70% yang digunakan sebanyak 6,2 L dan sebelumnya telah didestilasi terlebih dahulu. Menurut Tiwari, et al. (2011), etanol lebih efisien dalam degradasi dinding sel sehingga polifenol akan tersari lebih banyak. Selain itu, flavonoid ditemukan lebih tinggi pada penggunaan etanol 70% pada proses ekstraksi. Filtrat hasil maserasi disaring dengan kapas dan kertas saring yang kemudian dipekatkan dengan vacuum rotary evaporator pada suhu 45-50°C hingga diperoleh ekstrak kental sebanyak 41 gram. Rendemen ekstrak etanol 70% adalah 11,919 %.
UIN Syarif Hidayatullah Jakarta 4.4 Parameter Ekstrak
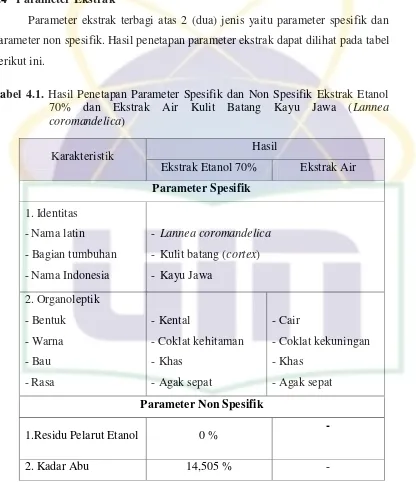
Parameter ekstrak terbagi atas 2 (dua) jenis yaitu parameter spesifik dan parameter non spesifik. Hasil penetapan parameter ekstrak dapat dilihat pada tabel berikut ini.
Tabel 4.1. Hasil Penetapan Parameter Spesifik dan Non Spesifik Ekstrak Etanol 70% dan Ekstrak Air Kulit Batang Kayu Jawa (Lannea coromandelica)
Karakteristik Hasil
Ekstrak Etanol 70% Ekstrak Air
Parameter Spesifik
Parameter spesifik yang dilakukan yaitu mengidentifikasi identitas dan organoleptik ekstrak yang digunakan. Tanaman yang digunakan merupakan kayu jawa dengan nama latin Lannea coromandelica. Ekstrak dibuat dari bagian kulit batang tanaman tersebut. Organoleptik ekstrak diidentifikasi menggunakan panca indera.
dan stabilitas ekstrak (Saifudin, Rahayu, & Teruna, 2011). Parameter residu pelarut etanol dilakukan untuk memastikan bahwa tidak ada lagi pelarut etanol yang tersisa setelah proses pemekatan ekstrak. Bila sisa pelarut berupa etanol masih tinggi dalam ekstrak, maka kemungkinan bila masuk ke dalam tubuh dapat memberikan reaksi efek samping (Saifudin, Rahayu, & Teruna, 2011). Selain itu, pelarut etanol yang tersisa di dalam ekstrak dapat mengganggu hasil uji toksisitas yang dilakukan karena memberikan intervensi atas kematian larva uji. Pada hasil penelitian ini,bobot jenis rata-rata yang diperoleh adalah 1,0072. Nilai bobot jenis tersebut dalam tabel bobot jenis dan kadar etanol pada Farmakope Indonesia edisi III menunjukkan bahwa kandungan etanol yang dimiliki sama dengan nol (lampiran 8).
Selain itu, pada penentuan parameter non spesifik dilakukan penentuan kadar abu.Penentuan kadar abu dilakukan bertujuan untuk memberikan gambarankandungan mineral internal dan eksternal yang berasal dari proses awal sampaiterbentuknya ekstrak. Pada tahap ini ekstrak dipanaskan hingga senyawa organik dan turunannya terdestruksi dan menguap sampai tinggal unsur mineral dan anorganik saja (Depkes RI, 2000). Kadar abu ekstrak etanol 70% kulit batang
Lannea coromandelica sebesar 14,5087%. Hal ini menunjukkan bahwa kadar abu ekstrak tersebut cukup tinggi. Tingginya kadar abu ini dapat dikarenakan tingginya kandungan mineral internal di dalam kulit batang Lannea coromandelica sendiri ataupun mineral yang berasal dari luar (mineral eksternal).
4.5 Penapisan Fitokimia
UIN Syarif Hidayatullah Jakarta Tabel 4.2. Hasil Penapisan Fitokimia Ekstrak Etanol 70% dan Ekstrak Air Kulit
Batang Kayu Jawa (Lannea coromandelica)
Pengujian Senyawa
Hasil
Ekstrak Etanol 70% Ekstrak Air
Alkaloid - -
Flavonoid + +
Saponin + +
Glikosida + +
Triterpenoid - -
Fenol + +
Tanin + +
Hasil penapisan fitokimia yang dilakukan pada ekstrak etanol 70% menunjukkan adanya kandungan senyawa metabolit sekunder diantaranya flavonoid, saponin, glikosida, fenol, dan tanin. Penapisan fitokimia pada ekstrak air pun menunjukkan kandungan yang sama yaitu flavonoid, saponin, glikosida, fenol, dan tanin. Umumnya metabolit sekunder yang diperoleh bersifat polar sehingga tersari di dalam pelarut polar yang digunakan yaitu etanol 70% dan air.
4.6 Uji Aktivitas Antioksidan secara Kualitatif
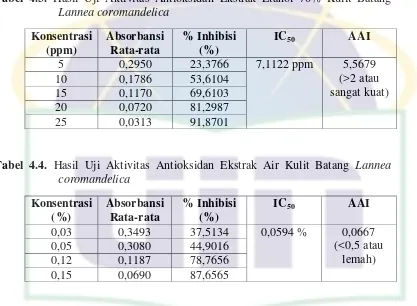
Pengujian kualitatif antioksidan terlebih dahulu dilakukan elusi dengan beberapa kombinasi eluen. Kombinasi eluen yang cukup baik untuk mengelusi ekstrak etanol 70% dan ekstrak air kulit batang Lannea coromandelica yaitu dengan pelarut etanol, etil asetat, dan kloroform dengan perbandingan 2:1:1 (Lampiran 8). Adanya perubahan warna DPPH yang disemprotkan pada bercak plat KLT dari ungu menjadi putih kekuningan menandakan bahwa ekstrak etanol 70% dan ekstrak air kulit batang Lannea coromandelica memiliki aktivitas antioksidan.
4.7 Uji Aktivitas Antioksidan secara Kuantitatif