PENGEMBANGAN METODE ORGANOGENESIS DAN
EMBRIOGENESIS SOMATIK PADA NENAS (Ananas comosus
(L.) Merr.) SERTA DETEKSI DINI UNTUK MEREDUKSI
KERAGAMAN SOMAKLONAL
IKA ROOSTIKA TAMBUNAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Pengembangan Metode Organogenesis dan Embriogenesis Somatik pada Nenas (Ananas comosus (L.) Merr.) serta Deteksi Dini untuk Mereduksi Keragaman Somaklonal adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, 26 Juli 2012
ABSTRACT
IKA ROOSTIKA TAMBUNAN. Development of Organogenesis and Somatic Embryogenesis Regeneration of Pineapple (Ananas comosus (L.) Merr.) and Early Detection to Reduce Somaclonal Variation. Supervised by NURUL KHUMAIDA, GUSTAAF ADOLF WATTIMENA, and IKA MARISKA SOEDHARMA.
Pineapple is a unique plant belongs to facultative CAM (Crassulacean Acid Metabolism) photosynthesis. It is highly potential to be planted on suboptimal land. Conventionally, it can be propagated from many propagules but their reproductive time is not uniform and this availability is commonly limited in cultivar Smooth Cayenne. Today micropropagation is being used commercially in the pineapple industry abroad but in Indonesia, the industries survive with conventional vegetative propagation because of somaclonal variation. The main goal of the study was to obtain the effective regeneration method of pineapple with high level of seedling production and low level of somaclonal variation, included the artificial seed formation method, the early detection method of somaclonal variation for eliminating undesirable traits during micropropagation, and the method to reduce the level of somaclonal variation during micropropagation. This study was devided into six chapters, included the study of morhogenetic system (with solid and liquid media); direct organogenesis induced by auxin and cytokinin (IAA, IBA, NAA, and BA); indirect organogenesis and somatic embryogenesis induced by 2,4-D, picloram, adenine sulfate, and N-organic compounds; encapsulation and minimal growth induced by paclobutrazol, mannitol, and reduced temperature; morphological and molecular characterization by using RAPD markers; and early detection to reduce of somaclonal variation. Generally, this study has some novelities in the in vitro characterization, the information of the non dead-end mechanism of rooted pineapple explants, the information of the complete events of somatic embryogenesis, the conservation method by minimal growth, and the large number of variants. The result showed that the direct and indirect organogenesis generated high shoot multiplication level. The use of mannitol (4%) was better than paclobutrazol for storing the encapsulated explants for 4 months. The morphological characterization could easily differentiate the normal and the abnormal variants (off-types). The direct organogenesis showed the lower level of variation (1.6%) compare to the indirect organogenesis (2%) and somatic embryogenesis (31.1%). The RAPD analysis strengthened the occurence of somaclonal variation. The use of the new in vitro cultures could reduce somaclonal variation. In conclusion, the direct organogenesis was the effective regeneration method for mass propagation. The morphological characterization of in vitro cultures can be applied as guidance for early detection and elimination of undesirable variants in mass propagation. The in vitro conservation method by mannitol can be applied to store pineapple cultures for medium-term period. The use of the new in vitro population could reduce the level of somaclonal variation.
RINGKASAN
IKA ROOSTIKA TAMBUNAN. Pengembangan Metode Organogenesis dan Embriogenesis Somatik pada Nenas (Ananas comosus (L.) Merr.) serta Deteksi Dini untuk Mereduksi Keragaman Somaklonal. Dibimbing oleh NURUL KHUMAIDA, GUSTAAF ADOLF WATTIMENA, dan IKA MARISKA SOEDHARMA.
selama 2 bulan dari struktur ETs (embryogenic tissues) atau 14 embrio/eksplan selama 2.5 bulan dari struktur FETs (friable embryogenic tissues). Penggunaan manitol (4%) lebih baik daripada penggunaan paklobutrazol maupun penurunan suhu dalam menyimpan eksplan nenas dalam kondisi terenkapsulasi, dengan periode simpan hingga 4 bulan. Terdapat 21 varian yang terdeteksi dari populasi biakan induk, di mana 8 varian menunjukkan fenomena epigenetik, 8 varian menunjukkan fenomena khimera, dan 7 varian menunjukkan kestabilan fenotipe di rumah kaca. Karakterisasi secara morfologi membedakan varian dan tanaman kontrol dengan koefisien kemiripan 0.49-0.91 (r=0.83). Karakterisasi molekuler memperkuat dugaan terjadinya keragaman somaklonal. Berdasarkan karakterisasi tersebut, tanaman kontrol dan varian memiliki koefisien kemiripan sebesar 0.32-0.61 (r=0.97). Ketidak-stabilan fenotipe pada karakter duri pada daun diduga kuat disebabkan oleh retrotransposon karena pola terbentuknya duri sama sekali tidak beraturan, bahkan pada bibit yang dihasilkan dari metode embriogenesis somatik yang terbukti bersifat unicellular origin. Metode embriogenesis somatik tidak langsung menghasilkan keragaman fenotipe yang tertinggi (31.1%), diikuti dengan metode organogenesis tidak langsung (2%) dan organogenesis langsung (1.6%). Populasi biakan in vitro yang baru memiliki koefisien kemiripan genetik yang lebih tinggi (0.65-0.85) daripada populasi lama, baik sebelum (0.32-0.61) maupun sesudah diekstraksi dengan menggunakan 3 macam metode regenerasi (0.34-0.63). Hal ini mengindikasikan bahwa keragaman somaklonal dapat direduksi dengan menggunakan bahan tanaman yang baru. Disimpulkan bahwa organogenesis langsung merupakan metode terbaik untuk mikropropagasi tanaman nenas. Penggunaan manitol lebih baik daripada paklobutrazol untuk penyimpanan in vitro dengan periode simpan 4 bulan. Metode karakterisasi morfologi dapat diterapkan pada biakan in vitro untuk eliminasi varian yang tidak diharapkan selama proses mikropropagasi secara dini. Teknik RAPD mengkonfirmasi dugaan terjadinya variasi somaklonal pada kultur in vitro nenas.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi oleh Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENGEMBANGAN METODE ORGANOGENESIS DAN
EMBRIOGENESIS SOMATIK PADA NENAS (Ananas comosus
(L.) Merr.) SERTA DETEKSI DINI UNTUK MEREDUKSI
KERAGAMAN SOMAKLONAL
IKA ROOSTIKA TAMBUNAN
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Pemuliaan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Pengembangan Metode Organogenesis dan Embriogenesis Somatik pada Nenas (Ananas comosus (L.) Merr.) serta
Deteksi Dini untuk Mereduksi Keragaman Somaklonal Nama : Ika Roostika Tambunan
NRP : A263090111
Disetujui, Komisi Pembimbing
Dr. Ir. Nurul Khumaida, M.S. Ketua
Prof. Dr. Ir. G.A. Wattimena, M.Sc. Prof. (R) Dr. Ika Mariska, APU
Anggota Anggota
Diketahui,
Ketua Mayor Dekan Sekolah Pascasarjana
Pemuliaan Bioteknologi Tanaman
Dr. Ir. Tri Koesoemaningtyas, M.Sc. Dr. Ir. Dahrul Syah, M.Agr.
Penguji pada Ujian Tertutup: Prof. Dr. Ir. Slamet Susanto, MAgr
Dr. Ir. Darda Efendi, MSi
Penguji pada Ujian Terbuka: Dr. Ir. Sobir, MS
PRAKATA
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT atas segala petunjuk dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Disertasi ini mengangkat topik tentang Pengembangan Metode Organogenesis dan Embriogenesis Somatik pada Nenas (Ananas comosus (L.) Merr.) serta Deteksi Dini untuk Mereduksi Keragaman Somaklonal. Penelitian tersebut dilaksanakan sejak Februari 2010 hingga April 2012.
Disertasi ini memuat enam bab yang merupakan pengembangan dari naskah artikel yang diajukan ke jurnal dan pertemuan ilmiah. Bab 2 telah diterbitkan pada Jurnal Agrobiogen Vol.8 No.1 Th. 2012 dengan judul Indirect organogenesis and somatic embryogenesis of pineapple induced by dichlorophenoxy acetic acid. Bab 3 sedang dalam proses penerbitan pada Indonesian Journal of Agricultural Science dengan judul The effect of picloram and light on somatic embryogenesis regeneration of pineapple. Bab 4 sedang diajukan ke Jurnal Hortikultura dengan judul Pembentukan Benih Sintetik Nenas dan Konservasi In Vitro secara Pertumbuhan Minimal. Bab 5 masih dalam proses pendampingan publikasi pada jurnal internasional (Plant Cell Tissue and Organ Culture) dengan judul Morphological characterization of pineapple in vitro cultures and acclimated seedlings. Bab 6 akan disampaikan pada International Seminar on Agriculture Adaptation in The Tropics dengan judul Molecular characterization of pineapple in vitro cultures for detecting plant off-types during micropropagation.
Penghargaan yang setinggi-tingginya disampaikan kepada Badan Litbang Pertanian yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi S3 dan atas dukungan dana penelitian melalui Program KKP3T 2011. Terima kasih yang tidak terhingga penulis ucapkan kepada Dr. Nurul Khumaida, Prof. Dr. G.A. Wattimena dan Prof. (R) Dr. Ika Mariska sebagai komisi pembimbing. Ucapan terima kasih juga disampaikan kepada Dr. Sutrisno, Dr. Karden Mulya (Kepala BB-Biogen), Dr. Sobir, Dr. Wicaksono, Prof. Dr. Sudarsono, Prof. Dr. Wasmen Manalu, Dr. Tri Koesoemaningtyas, Dr. Endah Retno Palupi, Prof. Dr. Bambang S. Purwoko, dan Dr. Made Tasma yang telah memberikan dukungan sebelum dan semasa penelitian serta pemahaman, saran dan masukan dalam penelitian maupun penyusunan naskah publikasi ilmiah. Kepada penguji luar komisi, Dr. Agus Purwito dan Dr. Sintho W. Ardie (pada ujian Prakualifikasi Doktor), Prof. Dr. Slamet Susanto dan Dr. Darda Efendi (pada Ujian Tertutup) serta Dr. Yusdar Hilman, APU dan Dr. Sobir (pada Ujian Terbuka), disampaikan terima kasih. Terima kasih juga ditujukan kepada teman-teman sejawat dan rekan-rekan teknisi di Kelti BSJ BB-Biogen serta rekan-rekan mahasiswa pascasarjana IPB. Rasa cinta dan terima kasih juga disampaikan kepada Ibunda dan Ayahanda (Ibu Suhaesih dan Alm. Djamian Tambunan), suami (Faleh Setia Budi, MT.), ananda (Furaida Alya Muna) serta keluarga besar dan seluruh pihak yang telah memberikan dukungan moril, dan spirituil. Besar harapan penulis akan seluas-luasnya manfaat dari hasil karya ini.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Magelang pada tanggal 12 September 1972 sebagai anak kedua dari pasangan Djamian Tambunan dan Suhaesih. Pendidikan sarjana ditempuh pada Jurusan Hama dan Penyakit Tumbuhan Program Studi Fitopatologi, Fakultas Pertanian Universitas Gadjah Mada, lulus pada tahun 1997. Pada tahun 1999, penulis diterima sebagai mahasiswa pascasarjana pada Program Studi Agronomi dengan peminatan Pemuliaan Non Konvensional Institut Pertanian Bogor, lulus pada tahun 2003. Kesempatan untuk melanjutkan studi ke program doktor pada Program Studi Pemuliaan Bioteknologi Tanaman IPB diperoleh pada tahun 2009, dengan beasiswa dari Badan Litbang Pertanian.
Sejak lulus sebagai sarjan hingga saat ini, penulis bekerja di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Bidang keahlian adalah Bioteknologi Pertanian dengan spesifikasi kultur in vitro, terutama pada aspek konservasi in vitro (pertumbuhan minimal dan kriopreservasi) serta variasi somaklonal.
DAFTAR ISI
Halaman
DAFTAR TABEL ……….. viii
DAFTAR GAMBAR ………. x
PENDAHULUAN Latar Belakang ……… 1
Tujuan Penelitian ……… 3
Manfaat Penelitian ……….. 4
Ruang Lingkup Penelitian ……….. 5
TINJAUAN PUSTAKA Taksonomi, Morfologi, Anatomi, dan Nilai Penting Nenas ……….. 6
Perbanyakan In Vitro ……….. 9
Konservasi In Vitro ………... 12
Fenomena Keragaman Somaklonal ……… 13
Deteksi Keragaman Somaklonal ………. 14
STUDI MORFOGENESIS EKSPLAN NENAS YANG DIINDUKSI OLEH AUKSIN DAN SITOKININ Abstrak ……….... 16
Abstract ………... 16
Pendahuluan ……… 17
Bahan dan Metode ……….. 19
Hasil dan Pembahasan ……… 20
Simpulan ………. 29
Daftar Pustaka ………. 30
ORGANOGENESIS DAN EMBRIOGENESIS SOMATIK TIDAK LANGSUNG PADA NENAS YANG DIINDUKSI OLEH 2,4-D Abstrak ……….... 32
Abstract ………... 32
Pendahuluan ……… 33
Bahan dan Metode ……….. 35
Hasil dan Pembahasan ……… 38
Simpulan ………. 48
Daftar Pustaka ………. 48
INDUKSI EMBRIOGENESIS SOMATIK TIDAK LANGSUNG PADA NENAS MELALUI PENGGUNAAN PIKLORAM Abstrak ……….... 51
Abstract ………... 52
Pendahuluan ……… 52
Bahan dan Metode ……….. 54
Hasil dan Pembahasan ……… 57
Simpulan ………. 70
PEMBENTUKAN BENIH SINTETIK NENAS DAN KONSERVASI IN VITRO SECARA PERTUMBUHAN MINIMAL
Abstrak ……….... 74
Abstract ………... 74
Pendahuluan ……… 75
Bahan dan Metode ……….. 76
Hasil dan Pembahasan ……… 79
Simpulan ………. 90
Daftar Pustaka ………. 90
KARAKTERISASI MORFOLOGI DAN MOLEKULER BIAKAN IN VITRO DAN BIBIT NENAS Abstrak ……….... 93
Abstract ………... 94
Pendahuluan ……… 94
Bahan dan Metode ……….. 96
Hasil dan Pembahasan ……… 99
Simpulan ………. 112
Daftar Pustaka ………. 113
EVALUASI KERAGAMAN BIBIT NENAS DARI POPULASI LAMA DAN PEMBENTUKAN POPULASI BARU SERTA DETEKSI DINI KERAGAMAN SOMAKLONAL Abstrak ……….... 116
Abstract ………... 116
Pendahuluan ……… 117
Bahan dan Metode ……….. 119
Hasil dan Pembahasan ……… 122
Simpulan ………. 133
Daftar Pustaka ………. 134
PEMBAHASAN UMUM ……….. 136
SIMPULAN DAN SARAN ……… 149
DAFTAR TABEL
Halaman 1 Status penelitian kultur in vitro nenas di mancanegara ... 10
2 Status penelitian kultur in vitro nenas di Indonesia dan peluang
risetnya ………... 11
3 Data produksi buah-buahan di Indonesia tahun 1995-2009 …………. 18
4 Penampilan kalus embriogenik nenas kultivar Smooth Cayenne pada
beberapa macam formulasi media, 2 bulan setelah subkultur ... 45
5 Pengaruh media dasar dan adenin sulfat terhadap pertumbuhan FETs
nenas kultivar Smooth Cayenne ………... 45
6 Respon kalusnenas kultivar Smooth Cayenne terhadap media induksi kalus embriogenik pada dua macam kondisi inkubasi yang berbeda,
1 bulan setelah subkultur ……….. 61
7 Perkembangan ETs nenas kultivar Smooth Cayenne pada media MS
yang mengandung Kn 1 mg l-1, 2 bulan setelah subkultur 65
8 Pengaruh pencahayaan dan formulasi media terhadap pembentukan
suspensi sel nenas kultivar Smooth Cayenne ... 68
9 Tingkat pencoklatan FETs nenas kultivar Smooth Cayenne pada media regenerasi, 1 bulan setelah subkultur ………. 69
10 Tingkat regenerasi FETs nenas kultivar Smooth Cayenne pada media
regenerasi, 1 bulan setelah subkultur ………. 69
11 Jumlah embrio somatik dewasa yang terbentuk dari FETs nenas
kultivar Smooth Cayenne, 1 bulan setelah subkultur ………... 70
12 Pengaruh suhu penyimpanan terhadap pertumbuhan biakan tunas nenas kultivar Smooth Cayenne yang terenkapsulasi dalam
13 Pengaruh suhu penyimpanan dan taraf manitol terhadap daya tembus biakan nenas kultivar Smooth Cayenne yang terenkapsulasi dengan
Na-alginat 3% ………... 88
14 Pengaruh suhu penyimpanan dan taraf manitol terhadap daya hidup biakan nenas kultivar Smooth Cayenne yang terenkapsulasi dengan
Na-alginat 3% ………... 89
15 Karakter dan sub karakter yang diamati pada fenotipe normal dan varian dari biakan in vitro nenas kultivar smooth Cayenne (umur 4
tahun) ………... 98
16 Ciri-ciri spesifik dari varian yang muncul dari populasi biakan
in vitro nenas kultivar Smooth Cayenne umur 4 tahun ... 103
17 Proporsi varian yang muncul dalam populasi biakan in vitro nenas
kultivar Smooth Cayenne umur 4 tahun ………... 104
18 Stabilitas fenotipe setiap individu varian nenas kultivar Smooth
Cayenne dan regenerannya selama subkultur dan aklimatisasi ... 107 19 Jumlah pita DNA yang teramplifikasi dan yang bersifat polimorfik
dalam analisis RAPD populasi biakan in vitro nenas kultivar Smooth
Cayenne umur 4 tahun ……….... 109
20 Proporsi variasi fenotipe dari populasi biakan in vitro nenas kultivar Smooth Cayenne yang dihasilkan dari metode organogenesis (langsung dan tidak langsung serta embriogenesis somatik tidak langsung... 125 21 Rekapitulasi tingkat variasi dari biakan in vitro yang dihasilkan dari
tiga macam metode regenerasi dibandingkan dengan populasi biakan
induk...………... 126 22 Proporsi bibit yang tidak berduri, berduri khimera, dan berduri
lengkap yang dihasilkan dari metode organogenesis langsung yang
diinduksi oleh BA dan NAA... 126 23 Proporsi bibit nenas kultivar Smooth Cayenne dengan daun tidak
berduri, berduri khimera, dan berduri lengkap yang dihasilkan dari metode organogenesis tidak langsung yang diinduksi oleh 2,4-D... 127 24 Proporsi bibit nenas kultivar Smootha Cayenne dengan daun tidak
berduri, berduri khimera, dan berduri lengkap yang dihasilkan dari
DAFTAR GAMBAR
Halaman 1 Diagram alir tahapan penelitian dalam studi pengembangan metode
organogenesis dan embriogenesis somatik pada nenas serta deteksi dini untuk mereduksi keragaman somaklonal ……….... 6
2 Berbagai macam organ vegetatif tanaman nenas……… 8
3 Keragaan kultur nenas kultivar Smooth Cayenne yang berasal dari eksplan basal daun (1 bulan setelah tanam) ………... 21 4 Pengaruh tipe eksplan dan ZPT serta pengaruh interaksi antara tipe
eksplan dan ZPT terhadap morfogenesis eksplan basal daun nenas kultivar Smooth Cayenne pada media padat...……….. 23 5 Penampilan kalus nenas pasca-perlakuan NAA dan tipe sel yang
menyusunnya ……….. 25
6 Pembelahan sel secara asimetris dari sel embriogenik yang diiduksi
oleh NAA ………... 25
7 Pengaruh kombinasi sitokinin dan auksin pada media cair terhadap pembentukan tunas, nodul, dan akar kultur in vitro nenas kultivar Smooth Cayenne yang berasal dari eksplan daun utuh dan potongan
basal daun, umur 1.5 bulan ……… 27
8 Pengaruh kombinasi sitokinin dan auksin pada media cair terhadap jumlah tunas kultur in vitro nenas kultivar Smooth Cayenne yang berasal dari eksplan daun utuh dan potongan basal daun ... ...
28
9 Tahapan morfogenesis dari eksplan daun nenas kultivar Smooth
Cayenne pada media cair ……….... 29
10 Tahapan analisis histologi kalus embriogenik nenas, modifikasi
metode Kiernan (1990) ………... 37
11 Tahapan induksi kalus dari basal daun nenas kultivar Smooth Cayenne 38 12 Pengaruh 2,4-D terhadap pembentukan kalus dan bobot basah kalus
nenas kultivar Smooth Cayenne ………. 39
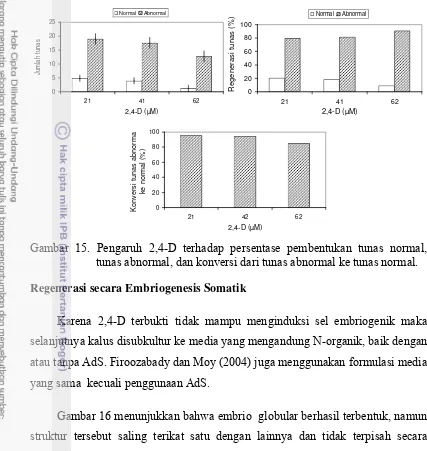
14 Penampilan tunas in vitro nenas kultivar Smooth Cayenne hasil perlakuan 2,4-D pada tahap regenerasi dan elongasi ... 41 15 Pengaruh 2,4 terhadap persentase pembentukan tunas normal, tunas
abnormal, dan konversi dari tunas abnormal ke tunas normal...………... 42 16 Penampilan jaringan embriogenik nenas kultivar Smooth Cayenne
pada berbagai macam media ……….. 43
17 Tahapan embriogenesis somatik nenas kultivar Smooth Cayenne ... 44 18 Pengaruh faktor tunggal dan pengaruh interaksi antara media induksi
kalus embriogenik dan media regenerasi terhadap regenerasi FETs
nenas kultivar Smooth Cayenne ... 46 19 Perbedaan perkembangan embrio somatik nenas kultivar Smooth
Cayenne umur 8 bulan pada media regenerasi ………... 47 20 Pengaruh pikloram terhadap pembentukan kalus dan bobot basah dari
eksplan basal daun nenas kultivar Smooth cayenne ………... 58 21 Respon basal daun nenas kultivar Smooth Cayenne terhadap
perlakuan pikloram dan pengamatan mikroskopisnya ………... 59 22 Pengamatan mikroskopis dari ECCs nenas kultivar Smooth Cayenne
setelah ditanam pada media induksi kalus embriogenik ……… 60 23 Penampilan ETs dan FETs nenas kultivar Smooth Cayenne ...……….. 62 24 Pengaruh faktor tunggal (media dan pencahayaan) terhadap tingkat
pencoklatan, persentase pembentukan nodul, persentase pembentukan embrio, dan jumlah embrio prematur (2 bulan setelah subkultur) ... 64 25 Regenerasi ETs nenas kultivar Smooth Cayenne pada media MS
dengan penambahan Kn 1 mg l-1 ……… 66
26 Pengaruh faktor pencahayaan dan media induksi kalus embriogenik serta pengaruh interaksinya terhadap pembentukan embrio somatik nenas kultivar Smooth Cayenne ………..………...… 66 27 Tahapan perkembangan embrio somatik nenas kultivar Smooth
Cayenne dari struktur FETs yang diinduksi oleh pikloram ... 67 28 Analisis histologi embrio somatik dari kultur suspensi sel nenas
29 Pengaruh BA dan NAA terhadap pertumbuhan eksplan batang semu nenas kultivar Smooth Cayenne yang dienkapsulasi dalam Na-alginat
3%, 1 bulan masa inkubasi ……… 80
30 Keragaan eksplan batang semu nenas kultivar Smooth Cayenne yang
dienkapsulasi dengan Na-alginat 3% (1 bulan masa inkubasi) ... 81 31 Proporsi pembentukan planlet, akar, dan nodul dari eksplan basal daun
nenas kultivar Smooth Cayenne yang diinduksi oleh BA 0.5 mg l-1 dan NAA 0.5 mg l-1, 2 bulan periode inkubasi ... 82 32 Pengaruh kombinasi BA dan NAA terhadap pertumbuhan eksplan
basal daun nenas kultivar Smootha Cayenne yang terenkapsulasi
dalam Na-alginat 3% ……….. 82
33 Penampilan tunas nenas kultivar Smooth Cayenne yang dienkapsulasi dengan alginat 3% yang mengandung paklobutrazol dan disimpan
pada suhu yang berbeda ………. 84
34 Daya hidup, daya regenerasi dan jumlah tunas nenas kultivar Smooth Cayenne pada tahap pemulihan pasca penyimpanan dengan paklobutrazol ... 86 35 Penampilan tunas nenas kultivar Smooth Cayenne pada tahap
pemulihan (1 bulan) pasca-penyimpanan dengan paklobutrazol ... 86 36 Penampilan kapsul embrio somatik nenas kultivar Smooth Cayenne
(4 bulan periode simpan) yang disimpan dengan menggunakan manitol pada suhu penyimpanan yang berbeda ... 89 37 Keragaan varian dari populasi biakan in vitro nenas kultivar Smooth
Cayenne umur 4 tahun ……… 100
38 Dendogram hasil karakterisasi morfologi biakan in vitro nenas
kultivar Smooth Cayenne umur 4 tahun, berdasarkan metode
(SAHN)-UPGMA (r=0.83) ………... 102 39 Kualitas DNA hasil isolasi sampel daun nenas kultivar Smooth
Cayenne dengan metode CTAB ………. 107
40 Profil DNA varian nenas kultivar Smooth Cayenne, hasil amplifikasi
PCR dengan penanda RAPD ……….. 111
42 Tingkat keragaman bibit nenas kultivar Smooth Cayenne yang dihasilkan dari tiga metode regenerasi ………... 123 43 Profil DNA biakan nenas kultivar Smooth Cayenne yang diekstraksi
dari populasi biakan induk ………... ... 129 44 Dendogram hasil evaluasi keragaman genetik (dengan penanda
RAPD, r=0.98) bibit nenas kultivar Smooth Cayenne populasi lama yang diperbanyak secara organogenesis langsung, organogenesis tak langsung, dan embriogenesis somatik ……….. 130 45 Profil DNA dari populasi baru biakan in vitro nenas kultivar Smooth
Cayenne ……….. 132
46 Dendogram hasil deteksi dini keragaman somaklonal biakan in vitro nenas kultivar Smooth Cayenne dari populasi baru dengan penanda
RAPD (r=0.96) ………... 133
47 Tahapan lengkap embriogenesis somatik nenas kultivar Smooth
Cayenne ……… 140
DAFTAR ISTILAH DAN SINGKATAN
Tanaman CAM fakultatif : tanaman yang berfotosintesis tipe CAM ketika lingkungan tumbuhnya suboptimal dan
berfotosintesis tipe C3 atau C4 ketika lingkungan tumbuhnya optimal (nenas bertipe C3-CAM) Propagul : bagian tanaman yang dapat digunakan sebagai
bahan perbanyakan
Mikropropagasi : teknik perbanyakan mikro untuk produksi bibit Aklimatisasi : proses penyesuaian fisiologi bibit tanaman dari kondisi in vitro ke kondisi ex vitro
Multiplikasi : tingkat penggandaan tunas atau bibit
Proliferasi tunas : teknik perbanyakan in vitro melalui penggandaan
tunas aksilar
Organogenesis : proses pembentukan organ yang bersifat unipolar (satu kutub) berupa tunas atau akar
Embriogenesis somatik : proses pembentukan embrio yang bersifat bipolar (dua kutub), diregenerasikan dari sel-sel somatik Suspensi sel : kultur sel yang terdispersi di dalam media cair
yang selalu digoyang
Pertumbuhan minimal : suatu teknik konservasi in vitro untuk
penyimpanan jangka menengah melalui modifikasi
unsur hara, sumber karbon, suhu penyimpanan, penggunaan zat penghambat tumbuh dan retardan Keragaman somaklonal : keragaman yang terjadi pada sel-sel somatik, disebabkan oleh mutasi atau perubahan sekuens
DNA, aktivasi atau pembungkaman gen
Syncarp : sejumlah bakal buah yang membentuk satu ruang, daun fertil pendukung makrospora berupa bakal biji (ovulum) yang secara kolektif membentuk putik Eksplan : bahan tanaman yang digunakan dalam penanaman
secara in vitro
BA : benzyl adenine, sitokinin turunan purin Kn : kinetin, sitokinin turunan purin
TDZ : thidiazuron, secara fisiologis fungsinya sama dengan sitokinin, turunan fenilurea
IAA : indole acetic acid, auksin alami
NAA : naphthalene acetic acid
Gln : glutamine, asam amino Arg : arginine, asam amino
Gly : glycine, asam amino
CH : casein hydrolysate, senyawa organik kompleks AdS : adenine sulfate, senyawa organik sumber nitrogen 2,4-D : 2,4-dichlorophenoxy acetic acid
Pikloram : 4-amino 3,5,6-trichloropicolinic acid
Sel embriogenik : sel yang akan berdiferensiasi membentuk embrio melalui pembelahan yang bersifat asimetris
Pro-embrio : calon embrio yang terbentuk dari sel embriogenik PEM : pre-embryogenic mass, kumpulan atau massa proembrio ETs : embryogenic tissues
FETs : friable embryogenic tissues
Planlet : tanaman utuh yang telah lengkap mempunyai tunas dan akar, dihasilkan dari regenerasi secara in vitro
Nekrosis : gejala matinya sel dan berasosiasi dengan degradasi klorofil yang disebabkan oleh oksidasi fenol
Paklobutrazol : senyawa sintetik golongan triazol yang berfungsi sebagai
retardan
Manitol : gula alkohol yang dapat berfungsi sebagai regulator osmotik (pengatur tekanan osmotikum) media Amplifikasi : proses penggandaan molekul DNA
EtBr : ethidium bromide
CTAB : cetyl trimethyl amonium bromide
PCR : polymerase chain reaction, proses polimerisasi DNA
secara in vitro
Denaturasi : proses pemisahan DNA dari ikatan ganda menjadi utas
tunggal
Elektroforesis : teknik pemisahan molekul berdasarkan gerakan yang berbeda pada medan listrik
RAPD : randomly amplified polymorphism DNA
Epigenetik : perubahan sifat yang tidak disebabkan oleh perubahan sekuens DNA, bersifat dapat balik
PENDAHULUAN
Latar BelakangNenas (Ananas comosus L. Merr.) merupakan tanaman penting di daerah tropis, termasuk di Indonesia. Berdasarkan data produksi buah-buahan, komoditas nenas menempati peringkat ketiga atau keempat setelah pisang, mangga, dan jeruk (BPS 2009). Tanaman ini bersifat toleran terhadap cekaman kekeringan dan kemasaman sehingga berpeluang besar dikembangkan di lahan-lahan marginal, termasuk lahan gambut (Sagiman 2007).
Menurut Ochse et al. (1961) serta Coppens d’Eeckenbrugge dan Leal (2003), tanaman nenas pada umumnya diperbanyak secara vegetatif dengan menggunakan butt atau stump, ratoon, sucker, basal slips, hapas, crown slips, dan crown atau mahkota. Sayangnya, jenis dan jumlah propagul tersebut sangat terbatas pada kultivar Smooth Cayenne (sucker dan mahkota) sehingga perbanyakan secara konvensional perlu dukungan teknologi lainnya, terutama ketika diperlukan bibit dalam jumlah yang besar. Penerapan teknologi kultur in vitro akan berguna bagi penyediaan materi genetik calon varietas unggul maupun perbanyakan varietas unggul yang baru saja dilepas, serta pembukaan lahan baru untuk pengembangan komoditas tersebut secara luas.
Di mancanegara, beberapa kultivar nenas telah dikembangkan secara komersial, antara lain Cayenne (Champaka, Giant Kew, Sarawak, Maipuri, Esmeralda, Claire, dan Typhon), Queen, Spanish (Red Spanish dan Singapore Spanish), Perola (Pernambuco atau Abacaxi), Manzana, dan Perolera (atau Motilana) (IBPGR 1991; Chan et al. 2003). Di antara beberapa kultivar tersebut, Queen dan Smooth Cayene merupakan kultivar yang banyak dikembangkan di Indonesia.
(Firoozabady dan Moy 2004; Nursandi et al. 2005). Secara praktis, mikropropagasi digunakan untuk memantapkan blok multiplikasi bagi penyediaan bahan tanaman perbanyakan konvensional dalam skala yang lebih luas. Selain itu, teknik mikropapagasi dapat diterapkan untuk skrining varian sebelum diterapkannya metode perbanyakan secara konvensional (Smith et al 2003). Dalam rangka peningkatan produksi, populasi tanaman akan ditingkatkan dari 40.000 tanaman/ha menjadi 100.000 tanaman/ha sehingga keperluan penyediaan bibit akan semakin tinggi (Suminar 2010).
Dalam teknik kultur in vitro, terjadinya keragaman genetik atau keragaman somaklonal (off-type) kadang-kadang tidak dapat dihindari. Keragaman somaklonal merupakan kejadian abnormalitas yang terjadi oleh karena mutasi atau perubahan sekuens, aktivasi gen, dan pembungkaman gen (Kaeppler et al. 2000). Keragaman tersebut dapat dideteksi melalui karakterisasi morfologi (Noor et al. 2009; Somsri et al. 2009; Zhao et al. 2005; Podwyszyńska 2005), sitologi (Al-Zahim et al. 1999), biokimia, fisiologi (Perez et al. 2011), dan molekuler (Chen et al. 1998; Al-Zahim et al. 1999; Soniya et al. 2001; Perez et al. 2011).
Wakasa (1979) telah melakukan pengamatan bibit nenas hasil kultur in vitro 1.5 tahun dalam periode in vitro, 14-22 bulan pada tahap aklimatisasi, dan 1 tahun periode pertumbuhan tanaman melalui pengamatan karakter morfologi, yaitu duri pada daun, warna daun, sekresi lilin pada permukaan daun bawah, dan corak daun. Diperlukan waktu sekitar 4 tahun untuk mendeteksi keragaman yang terjadi pada bibit hasil perbanyakan secara in vitro tersebut. Nursandi (2006) melaporkan bahwa perlakuan in vitro dapat menimbulkan keragaman tanaman nenas hingga 88% untuk karakter daun varigata, roset, dan kerdil, namun sebagian besar tanaman tersebut mampu berubah menjadi normal setelah umur tertentu (25 minggu setelah tanam), yang diduga sebagai epigenetik.
Pada tanaman nenas, deteksi penyimpangan secara molekuler banyak diterapkan dengan menggunakan penanda RAPD (Random Amplified Polymorphism DNA). Soneji et al. (2002) telah mengkarakterisasi bibit nenas kultivar Queen untuk sifat daun berduri dan tidak berduri dengan penanda RAPD. Feuser et al. (2003) juga menganalisis ketepatan genetik planlet nenas kultivar Amarelinho (grup Perola) dan Santos et al. (2008) melakukan evaluasi keragaman genetik dari biakan in vitro nenas hias (Ananas comosus var. bracteatus) dengan menggunakan penanda RAPD. Hingga saat ini, belum terdapat laporan tentang analisis keragaman somaklonal terhadap biakan dan bibit nenas hasil perbanyakan in vitro yang dikulturkan dalam periode yang panjang.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk memperoleh metode regenerasi yang efektif (tingkat multiplikasi tinggi dan tingkat keragaman rendah), termasuk metode pembentukan benih sintetik tanaman nenas, metode deteksi dini keragaman somaklonal untuk eliminasi varian yang tak diharapkan, dan metode reduksi keragaman somaklonal. Tujuan khusus penelitian ini adalah:
1. Mempelajari morfogenesis eksplan nenas kultivar Smooth Cayenne dalam merespon zat pengatur tumbuh (ZPT) dan konsistensi media
2. Memperoleh informasi tentang pengaruh kombinasi sitokinin (benzyl adenine/ BA) dan auksin (naphthalene acetic acid/NAA, indole acetic acid/IAA, indole butiric acid/IBA) terhadap regenerasi nenas kultivar Smooth Cayenne secara organogenesis langsung
3. Mempelajari pengaruh auksin non herbisida NAA dan auksin herbisida 2,4-dichlorophenoxyacetic acid (2,4-D) atau 4-amino 3,5,6-trichloropicolinic acid (pikloram) terhadap induksi organogenesis dan embriogenesis somatik tidak langsung pada nenas kultivar Smooth Cayenne
4. Mempelajari pengaruh suhu dan paklobutrazol atau manitol terhadap daya hidup, daya simpan, dan daya regenerasi eksplan nenas kultivar Smooth Cayenne yang dienkapsulasi dengan natrium alginat 3%
6. Mengetahui tingkat keragaman biakan dan bibit nenas kultivar Smooth Cayenne yang dihasilkan dari metode organogenesis langsung dan tidak langsung, serta embriogenesis somatik tidak langsung
7. Mendeteksi keragaman molekuler biakan in vitro dari populasi yang baru dibentuk untuk menentukan metode perbanyakan yang paling efektif.
Manfaat Penelitian
varian yang tidak diharapkan, sebelum bibit ditanam di lapang sehingga dapat meningkatkan efisiensi produksi bibit. Selain itu, varian-varian yang dihasilkan dalam penelitian ini juga dapat dimanfaatkan sebagai bahan pemuliaan tanaman atau bahkan sebagai kandidat klon superior. Secara umum, hasil penelitian ini akan bermanfaat bagi pengembangan komoditas nenas di Indonesia.
Ruang Lingkup Penelitian
Karakterisasi morfologi dan molekuler biakan
in vitrodan bibit nenas
Karakterisasi morfologi biakanin vitro
Evaluasi fenotipe bibit di rumah kaca
Karakterisasi molekuler dengan metode RAPD Subkultur dan evaluasi fenotipe individu varian
Studi morfogenesis eksplan
Organogenesis langsung pada media
padat
Induksi akar dan aklimatisasi di rumah
kaca
Evaluasi fenotipe dan analisis molekuler dengan metode RAPD Organogenesis
langsung pada media cair
Pemilihan metode terbaik
Studi organogenesis dan embriogenesis tidak langsung
menggunakan 2,4-D
Induksi kalus
Induksi akar dan aklimatisasi di rumah
kaca
Evaluasi fenotipe dan analisis molekuler dengan metode RAPD
Regenerasi kalus menjadi tunas melalui
jalur organogenesis Induksi kalus embriogenik Regenerasi kalus embriogenik menjadi embrio somatik
Aklimatisasi di rumah kaca
Evaluasi fenotipe dan analisis molekuler dengan metode RAPD
Studi embriogenesis somatik tidak langsung menggunakan pikloram Induksi kalus embriogenik Regenerasi kalus embriogenik menjadi embrio somatik
Aklimatisasi di rumah kaca Proliferasi kalus
embriogenik
Evaluasi fenotipe dan analisis molekuler dengan metode RAPD
Pembentukan benih sintetik dan pertumbuhan minimal
Studi enkapsulasi: pengaruh jenis eksplan
dan pra-perlakuan
Pertumbuhan minimal dengan manitol dan
modifikasi suhu
Pemulihan dan regenerasi Pertumbuhan minimal dengan paklobutrazol
dan modifikasi suhu
Induksi akar dan aklimatisasi di rumah
kaca
Evaluasi keragaman bibit dari 3 metode regenerasi dari populasi lama (induk)
Evaluasi keragaman bibit hasil organogenesis
langsung
Evaluasi keragaman bibit hasil embriogenesis somatik
tidak langsung
Evaluasi ketepatan genetik dengan metode RAPD Evaluasi keragaman bibit hasil organogenesis tidak
langsung
Sterilisasi dan inisiasi tunas in vitro
Regenerasi secara organogenesis
langsung
Evaluasi fenotipe biakanin vitro
Isolasi eksplan basal daun
Pembentukan populasi baru biakanin vitro dan deteksi dini keragaman somaklonal
Deteksi dini secara molekuler dengan metode RAPD
Populasi lama biakanin vitro (umur 4 tahun)
Gambar 1. Diagram alir tahapan penelitian dalam studi pengembangan metode organogenesis dan embriogenesis pada nenas serta deteksi dini untuk mereduksi keragaman somaklonal.
TINJAUAN PUSTAKA
Taksonomi, Morfologi, Anatomi, dan Nilai Penting NenasAnanas comosus (L.) Merr. termasuk dalam monocotyledonae, ordo Bromeliales, famili Bromeliaceae, dan subfamily Bromeliadeae. Nenas merupakan tanaman herbaseus perenial. Batangnya memiliki internodus yang sangat pendek (1-10 mm tergantung pada posisinya) sehingga tampak kompak dan roset. Jaringan pembuluh yang padat memisahkan korteks dan stele yang terutama terdiri atas xilem dengan sedikit floem. Tanaman nenas mempunyai filotaksi yang bervariasi antara 3/8 hingga 5/13 dan 8/21 ketika berbunga. Daun memiliki lapisan kutikula yang tebal dan jaringan penyimpan air pada bagian epidermis atas. Bagian abaksial daun banyak mengandung trikoma yang memberikan warna keperakan dan mampu meningkatkan pantulan cahaya. Selain itu, densitas stomata daun agak rendah, yaitu sekitar 80 stomata mm-2. Keberadaan kutikula, jaringan penyimpan air, jarangnya stomata, dan banyaknya trikoma menyebabkan tanaman nenas bersifat ekonomis dalam menggunakan air (Coppens d’Eeckenbrugge dan Leal 2003).
Nenas merupakan tanaman penting di daerah tropis. Berdasarkan data produksi buah-buahan di Indonesia, komoditas nenas menempati peringkat ketiga atau keempat setelah pisang, mangga, dan jeruk (BPS 2009). Sebagian besar buah nenas dikonsumsi sebagai buah segar (buah meja) dan buah kaleng. Buah nenas adalah sumber berbagai macam mineral dan vitamin seperti Mn, Cu, Ca, N, P, Fe, vitamin C, B1 (tiamin), B2 (riboflavin), B3 (niasin), B6 (piridoksin), asam askorbat, karoten dan serat. Nenas juga mengandung enzim bromelain yang berfungsi untuk berbagai macam pengobatan seperti detoksifikasi liver, antitumor dan antiradang. Selain itu, daun nenas juga dapat dimanfaatkan sebagai sumber untuk kertas dan tekstil (Baez et al. 2007; Department of Health and Ageing 2008; Jacques et al. 2008).
batang utama dari tanaman dewasa; (2) ratoon, yaitu tunas yang muncul pada pangkal batang; (3) sucker, yaitu tunas-tunas pada ketiak daun; (4) basal slips, yaitu cabang-cabang yang muncul dari dasar buah; (5) hapas, yaitu tunas yang muncul dari dasar tangkai buah, (6) crown slips, yaitu cabang-cabang yang muncul dari ujung buah; dan (7) crown atau mahkota, tunas yang muncul dari bagian atas buah (Gambar 2).
6
5
4
3
2 1
[image:32.595.52.467.54.611.2]Sumber: Ochse et al. (1961)
Gambar 2. Berbagai macam organ vegetatif tanaman nenas: batang pokok (1), ratoon (2), aerial sucker (3), basal slip (4), crown slip (5), dan mahkota (6).
Perbanyakan in Vitro
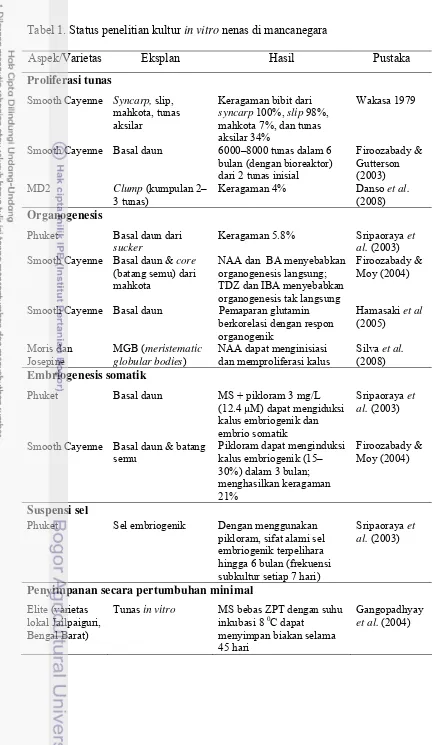
Di mancanegara, teknik kultur in vitro tanaman nenas telah berkembang (Tabel 1) mulai dari proliferasi tunas in vitro (Wakasa 1979; Firoozabady dan Gutterson 2003; Khan et al. 2004; Danso et al. 2008), organogenesis (Sripaoraya et al. 2003; Firoozabady dan Moy 2004; Hamasaki et al. 2005), embriogenesis somatik (Sripaoraya et al. 2003; Firoozabady dan Moy 2004; Silva et al. 2008), hingga kultur suspensi sel (Sripaoraya et al. 2003) dan teknologi benih sintetik untuk konservasi jangka pendek (Gangopadhyay et al. 2004). Di Indonesia, teknik perbanyakan in vitro tanaman nenas masih terbatas dalam hal teknik proliferasi tunas nenas kultivar Queen (Nursandi et al. 2003; Purnamaningsih et al 2009), teknik etiolasi nenas kultivar Smooth Cayenne (Nursandi et al. 2005), dan teknik mutagenesis nenas kultivar Smooth Cayenne (Suminar 2010), sedangkan teknik embriogenesis somatik dan benih sintetik masih belum dikaji (Tabel 2).
Tabel 1. Status penelitian kultur in vitro nenas di mancanegara
Aspek/Varietas Eksplan Hasil Pustaka
Proliferasi tunas
Smooth Cayenne Syncarp, slip, mahkota, tunas aksilar
Keragaman bibit dari
syncarp 100%, slip 98%, mahkota 7%, dan tunas aksilar 34%
Wakasa 1979
Smooth Cayenne Basal daun 6000–8000 tunas dalam 6 bulan (dengan bioreaktor) dari 2 tunas inisial
Firoozabady & Gutterson (2003) MD2 Clump (kumpulan 2–
3 tunas)
Keragaman 4% Danso et al.
(2008) Organogenesis
Phuket Basal daun dari
sucker
Keragaman 5.8% Sripaoraya et al. (2003) Smooth Cayenne Basal daun & core
(batang semu) dari mahkota
NAA dan BA menyebabkan organogenesis langsung; TDZ dan IBA menyebabkan organogenesis tak langsung
Firoozabady & Moy (2004)
Smooth Cayenne Basal daun Pemaparan glutamin berkorelasi dengan respon organogenik
Hamasaki et al
(2005)
Moris dan Josepine
MGB (meristematic globular bodies)
NAA dapat menginisiasi dan memproliferasi kalus
Silva et al.
(2008) Embriogenesis somatik
Phuket Basal daun MS + pikloram 3 mg/L (12.4 µM) dapat mengiduksi kalus embriogenik dan embrio somatik
Sripaoraya et al. (2003)
Smooth Cayenne Basal daun & batang semu
Pikloram dapat menginduksi kalus embriogenik (15– 30%) dalam 3 bulan; menghasilkan keragaman 21%
Firoozabady & Moy (2004)
Suspensi sel
Phuket Sel embriogenik Dengan menggunakan pikloram, sifat alami sel embriogenik terpelihara hingga 6 bulan (frekuensi subkultur setiap 7 hari)
Sripaoraya et al. (2003)
Penyimpanan secara pertumbuhan minimal Elite (varietas
lokal Jailpaiguri, Bengal Barat)
Tunas in vitro MS bebas ZPT dengan suhu inkubasi 8 0C dapat
menyimpan biakan selama 45 hari
Gangopadhyay
Tabel 2. Status penelitian kultur in vitro nenas di Indonesia dan peluang risetnya
Aspek/Varietas Eksplan Hasil Pustaka
Proliferasi tunas
Queen Tunas in vitro MS + BA 4.4 uM + NAA 1.6 µM menghasilkan multiplikasi tunas tertinggi (26.3
tunas/eksplan); penggunaan TDZ menghasilkan struktur noduler; tanaman roset dapat tumbuh normal setelah 30 MST
Nursandi et al. (2003 dan 2005)
Smooth Cayenne Tunas in vitro Perlakuan paklobutrazol 0.1 mg/L tidak nyata dalam menurunkan variasi
Purnama-ningsih et al. (2009) Etiolasi
Smooth Cayenne Tunas in vitro MS + BA 4 mg/L menghasilkan 2–3 planlet/eksplan dalam 10 minggu
Nursandi et al. (2005)
Mutagenesis Golden Pineapple
Kalus Iradiasi sinar gamma 15 Gy menginduksi variasi
pertumbuhan tunas, fenotipe dan karakter molekuler dengan penanda ISSR.
Suminar (2010)
Peluang riset dan kebaruan
Studi organogenesis (tahapan lengkap organogenesis tanaman nenas)
Studi embriogenesis somatik tanaman monokotil (tahapan lengkap embriogenesis somatik tanaman nenas)
Pembentukan benih sintetik untuk perbanyakan dan penyimpanan in vitro (metode enkapsulasi eksplan tanaman nenas)
Penyimpanan secara pertumbuhan minimal biakan in vitro nenas secara enkapsulasi (metode penyimpanan in vitro dengan modifikasi suhu dan paklobutrazol atau manitol)
Karakterisasi morfologi biakan in vitro nenas umur 4 tahun (metode deteksi dini untuk eliminasi varian yang tak diharapkan selama proses mikropropagasi)
Reduksi keragaman somaklonal biakan in vitro nenas
Konservasi In Vitro
Teknik konservasi in vitro dapat dibedakan menjadi tiga macam: (1) teknik penyimpanan pada media tumbuh, (2) teknik pertumbuhan minimal, dan (3) teknik kriopreservasi (Mariska et al. 1996; Leunufna 2004). Teknik pertumbuhan minimal disarankan untuk diterapkan untuk working collection atau active collection, sedangkan teknik kriopreservasi diterapkan untuk base collection (Withers 1985).
Pada teknik penyimpanan dengan media tumbuh, tidak diperlukan penambahan zat penghambat tumbuh. Penyimpanan dengan cara tersebut akan memerlukan tindakan subkultur yang frekuentif sehingga kurang menghemat tenaga, waktu, dan biaya serta beresiko terhadap kontaminasi (Mariska et al. 1996). Selain itu, subkultur yang frekuentif juga beresiko terhadap timbulnya keragaman somaklonal (Eeuwens et al. 2002).
Pada teknik pertumbuhan minimal, beberapa modifikasi media dan lingkungan dapat diterapkan, antara lain penurunan temperatur lingkungan dan intensitas cahaya (Hu dan Wang 1983; Withers 1985; Keller et al. 2006), penggunaan regulator osmotik seperti sukrosa dan manitol (Withers 1985; Bessembinder et al. 1993), penurunan taraf beberapa faktor esensial seperti pengenceran media (Desbrunais et al. 1992), serta penggunaan zat penghambat tumbuh seperti paclobutrazol, cycocel, dan ancymidol (Withers 1985). Dengan penerapan teknik pertumbuhan minimal maka biakan dapat disimpan dalam jangka menengah (bulanan hingga tahunan).
Fenomena Keragaman Somaklonal
Dalam teknik kultur in vitro, terjadinya keragaman genetik atau keragaman somaklonal kadang-kadang tidak dapat dihindari. Keragaman somaklonal merupakan kejadian abnormalitas yang terjadi secara sitologi, mutasi, perubahan sekuens, aktivasi gen, dan silencing atau pembungkaman gen (Kaeppler et al. 2000). Dari berbagai kajian pustaka, dilaporkan bahwa off types dapat disebabkan oleh variasi dari tanaman donor (pre-existing variation) (Wakasa 1979), periode in vitro yang panjang (Koornneef 1991; Masoud and Hamta 2008), zat pengatur tumbuh (Bairu et al. 2009), subkultur yang frekuentif (Eeuwens et al. 2002), dan tergantung pada genotipe tanaman (Zucchi et al. 2002). Untuk menghindari tingginya keragaman somaklonal maka diperlukan strategi untuk memproduksi bibit dengan kesamaan identitas genetik yang tinggi. Dengan demikian, metode deteksi keragaman somaklonal memegang peranan penting dalam pengujian tersebut.
Melalui pengamatan karakter morfologi, Wakasa (1979) menemukan tingkat keragaman genetik yang berbeda-beda pada tanaman nenas hasil perbanyakan secara in vitro ketika digunakan sumber eksplan yang berbeda pula. Berdasarkan penelitian tersebut, diketahui bahwa syncarp menghasilkan keragaman sebesar 100%, slip 98%, crown 7%, dan tunas aksilar 34%. Sripaoraya et al. (2001) menemukan fenomena keragaman somaklonal sebesar 5.7-7% ketika menggunakan eksplan berupa tunas aksilar dan tunas terminal sucker nenas kultivar Phuket. Soneji et al. (2002a) melaporkan terjadinya keragaman sebesar 7.6% dari bibit hasil perbanyakan in vitro dengan menggunakan mata tunas aksilar dorman yang berasal dari mahkota nenas kultivar Queen. Dengan menggunakan jenis eksplan yang sama, Santos et al. (2008) menemukan kejadian keragaman genetik sebesar 38% pada nenas hias. Melalui jalur organogensis, Firoozabady dan Moy (2004) menghasilkan keragaman sebesar 4% sedangkan melalui jalur embriogenesis somatik dihasilkan variasi sebesar 21%.
subkultur, zat pengatur tumbuh, genotipe, komposisi media, tingkat ploidi, dan khimera (Zucchi et al. (2002). Dari bebagai jenis eksplan nenas yang digunakan, mahkota menghasilkan tanaman dengan tingkat keragaman yang paling rendah dibandingkan dengan syncarp, slip, dan tunas aksilar (Wakasa 1979). Sripaoraya et al. (2003) mensinyalir bahwa keragaman somaklonal dapat ditekan dengan menggunakan jaringan somatik yang masih muda. Regenerasi secara langsung dari basal daun terbukti menghasilkan tanaman nenas yang true-to-type. Di lain pihak, Masoud dan Hamta (2008) menemukan fenomena bahwa makin panjang periode in vitro kultur cengkeh maka frekuensi keragaman makin tinggi pula. Bairu et al. (2006) melaporkan bahwa perbanyakan pisang Cavendish dengan menggunakan BA pada taraf rendah (2,5 ppm) dan jumlah subkultur yang rendah (maksimal 6 kali) menghasilkan peluang off type yang lebih rendah, yaitu 10%. Ketika taraf BA ditingkatkan menjadi 7.5 ppm dan frekuensi subkultur dinaikkan menjadi 10 kali maka peluang off type dapat melebihi 70%. Menurut Eeuwens et al. (2002), tingginya tingkat abnormalitas bibit kelapa sawit hasil kultur in vitro diduga karena intensifnya penggunaan auksin dalam konsentrasi yang tinggi, frekuensi subkultur yang tinggi (interval waktu subkultur yang singkat), dan umur embrioid.
Deteksi Keragaman Somaklonal
Perbanyakan bibit dan konservasi menghendaki stabilitas genetik bahan tanaman yang diperlakukan. Deteksi penyimpangan bibit yang dihasilkan dari teknik kultur in vitro dapat dilakukan melalui karakterisasi morfologi (Wakasa 1979; Noor et al. 2009; Somsri et al. 2009 ; Zhao et al. 2005; Podwyszyńska 2005; Suminar 2010), sitologi (Al-Zahim et al. 1999; Joachimiak dan Ilnicki 2003), biokimia (Feuser et al. 2003), fisiologi (Perez et al. 2011), dan molekuler (Chen et al. 1998; Al-Zahim et al. 1999; Soniya et al. 2001; Soneji et al. 2002; Feuser et al. 2003; Santos et al. 2008; Perez et al. 2011).
kultur in vitro melalui pengamatan karakter morfologi. Hasil penelitian tersebut menunjukkan bahwa perlakuan in vitro dapat menimbulkan keragaman tanaman hingga 88% untuk karakter daun variegata, roset, dan kerdil, namun sebagian besar tanaman tersebut mampu berubah menjadi normal setelah umur tertentu (25 MST).
Dalam analisis molekuler, Popluechai et al. (2007) menerapkan analisis RAPD (Random Amplified Polymorphism DNA) untuk mengetahui hubungan kekerabatan beberapa aksesi nenas. Penelitian tersebut telah berhasil membuktikan bahwa 17 primer, yaitu OPA2, OPA3, OPA4, OPA9, OPA13, OPC2, OPC5, OPC8, OPC9, OPC10, OPC11, OPC12, OPC14, OPC15, OPC16, OPC19, dan OPC20 (Operon Tech. Alameda, USA) bersifat polimorfik (hingga 12 pita). Soneji et al. (2002b) juga menerapkan RAPD untuk menganalisis varian nenas kultivar Queen yang berduri dan yang tidak berduri dengan menggunakan primer OPA1, OPA2, OPA3, OPA4, OPA7, OPA8, OPA9, OPA11, OPA12, OPA13, OPA15, OPA16, OPA17, OPA18, OPA19, OPF1, OPF4, OPF5, OPF6, OPF8, OPF10, OPF13, OPJ4, OPJ5, OPJ7, OPJ8, OPJ9, OPJ10, OPJ11, OPJ12, OPJ13, OPJ14, OPJ16, OPJ18, dan OPJ19. Santos et al. (2008) juga menggunakan teknik RAPD untuk mengevaluasi variabilitas regeneran nenas hias dan menghasilkan pita yang polimorfik dengan menggunakan primer OPA1, OPA20, OPB1, OPB19, OPC19, OPF13, OPL17, OPM13, OPP16, OPT7, OPV19, dan OPX3. Selain itu, marka ISSR (Inter Simple Sequence Repeat), yaitu (CAG)5, (CAA)5, dan (GACA)4 (disintesis oleh Isogen) juga pernah diterapkan pada tanaman nenas untuk mengevaluasi biakan pasca-penyimpanan in vitro (Gangopadhyay et al. 2004).
STUDI MORFOGENESIS EKSPLAN NENAS
YANG DIINDUKSI OLEH AUKSIN DAN SITOKININ
Abstrak
Morfogenesis eksplan perlu dipelajari sebelum penerapan metode regenerasi untuk perbanyakan masal, konservasi in vitro, dan transformasi genetik. Tujuan penelitian ini adalah untuk mengetahui pengaruh auksin dan sitokinin serta jenis eksplan terhadap morfogenesis eksplan nenas kultivar Smooth Cayenne pada media padat dan cair. Pada tahap pertama, digunakan media MS padat dengan penambahan zat pengatur tumbuh secara tunggal berupa BA atau NAA (0, 1, 2, dan 3 mg l-1) dengan eksplan berupa basal daun muda dan basal daun tua. Pada tahap kedua, digunakan media MS cair dengan kombinasi perlakuan sitokinin BA (0.5 atau 1.0 mg l-1) dan auksin (NAA atau IAA atau IBA pada taraf 0.5 mg l-1) dengan menggunakan eksplan berupa daun utuh dan potongan basal daun. Hasil percobaan pertama menunjukkan bahwa eksplan basal daun hanya memberikan respon ketika diberi perlakuan sitokinin ataupun auksin. Perlakuan terbaik untuk morfogenesis eksplan basal daun pada media padat adalah BA 3 mg l-1 yang menghasilkan persentase pertunasan sebasar 30% dan jumlah tunas sebesar 10 tunas/eksplan dalam waktu 2 bulan. Hal yang menarik adalah munculnya sel embriogenik dan pro-embrio dari eksplan yang diberi perlakuan NAA, namun embrio somatik gagal terbentuk. Hasil percobaan kedua menunjukkan bahwa kombinasi BA 0.5 mg l-1 dan IBA 0.5 mg l-1 dengan eksplan potongan basal daun merupakan perlakuan yang terbaik untuk morfogenesis pada media cair dengan persentase pertunasan sebesar 18% dan jumlah tunas sebesar 13 tunas/eksplan dalam waktu 2 bulan. Secara umum, disimpulkan bahwa morfogenesis eksplan basal daun nenas menggunakan media padat lebih baik daripada menggunakan media cair.
Kata kunci: Morfogenesis, nenas, kultur in vitro, media padat, media cair, embriogenesis somatik
Abstract
treated explants but they failed to form somatic embryos. The result of the second experiment showed that the basal leaves grown in MS liquid medium containing of 0.5 mg l-1 BA and 0.5 mg l-1 NAA yielded 18% shoot formation and 13 shoots/explant in 2 months. In conclusion, morphogenesis of pineapple leaf bases on solid media was beter than that in liquid media.
Keywords: Morphogenetic system, pineapple, in vitro culture, solid media, liquid media, and somatic embryogenesis
Pendahuluan
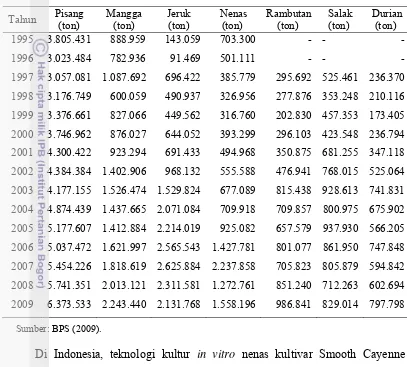
Nenas (Ananas comosus (L.) Merr.) merupakan tanaman penting di daerah tropis dan subtropis. Berdasarkan data produksi buah-buahan, nenas menempati peringkat ketiga atau keempat setelah pisang, mangga, dan jeruk (Tabel 3). Penanaman bibit nenas sebanyak 40.000 tanaman/ha akan diarahkan menjadi 100.000 tanaman/ha (Suminar 2010) karena saat ini peningkatan densitas tanaman dapat meningkatkan produksi. Konsekuensinya, keperluan penyediaan bibit nenas menjadi sangat tinggi pada masa mendatang.
Menurut Coppens d’Eckenbrugge dan Leal (2003), secara umum organ vegetatif nenas terdiri dari crown (mahkota), sucker (tunas yang berasal dari ketiak daun), butt atau stump (merupakan tanaman utuh setelah pemanenan), hapas (tunas yang diproduksi pada bagian dasar tangkai buah), ratoon (tunas yang muncul dari bagian batang yang tertimbun di dalam tanah), dan slip (tunas yang timbul dari tangkai buah pada bagian persis di bawah buah). Khusus untuk kultivar Smooth Cayenne, organ vegetatif tersebut terbatas pada mahkota dan sucker, sedangkan slip jarang sekali dihasilkan.
perbanyakan, khususnya untuk varietas nenas yang ditujukan sebagai buah meja karena mahkota harus selalu terikut bersama buahnya pada saat dijual.
Tabel 3. Data produksi buah-buahan di Indonesia sejak tahun 1995-2009
Tahun Pisang (ton)
Mangga (ton)
Jeruk (ton)
Nenas (ton)
Rambutan (ton)
Salak (ton)
Durian (ton)
1995 3.805.431 888.959 143.059 703.300 - - -
1996 3.023.484 782.936 91.469 501.111 - - -
1997 3.057.081 1.087.692 696.422 385.779 295.692 525.461 236.370 1998 3.176.749 600.059 490.937 326.956 277.876 353.248 210.116 1999 3.376.661 827.066 449.562 316.760 202.830 457.353 173.405 2000 3.746.962 876.027 644.052 393.299 296.103 423.548 236.794 2001 4.300.422 923.294 691.433 494.968 350.875 681.255 347.118 2002 4.384.384 1.402.906 968.132 555.588 476.941 768.015 525.064 2003 4.177.155 1.526.474 1.529.824 677.089 815.438 928.613 741.831 2004 4.874.439 1.437.665 2.071.084 709.918 709.857 800.975 675.902 2005 5.177.607 1.412.884 2.214.019 925.082 657.579 937.930 566.205 2006 5.037.472 1.621.997 2.565.543 1.427.781 801.077 861.950 747.848 2007 5.454.226 1.818.619 2.625.884 2.237.858 705.823 805.879 594.842 2008 5.741.351 2.013.121 2.311.581 1.272.761 851.240 712.263 602.694 2009 6.373.533 2.243.440 2.131.768 1.558.196 986.841 829.014 797.798
Sumber: BPS (2009).
Di Indonesia, teknologi kultur in vitro nenas kultivar Smooth Cayenne relatif masih terbatas pada teknik proliferasi tunas (Purnamaningsih et al. 2009), etiolasi (Nursandi et al. 2005), dan mutagenesis (Suminar 2010). Oleh karena itu, diperlukan studi yang komprehensif untuk memantapkan metode regenerasi tanaman nenas yang akan berguna bagi berbagai macam keperluan, seperti perbanyakan bibit secara masal, konservasi in vitro, dan rekayasa genetika.
sitokinin dan auksin. Kedua senyawa tersebut berperan penting dalam pembelahan dan elongasi sel (Srivastava 2002). Oleh karena itu, kedua jenis ZPT tersebut digunakan dalam penelitian ini. Tujuan penelitian ini adalah untuk mengetahui pengaruh auksin dan sitokinin serta jenis eksplan terhadap morfogenesis eksplan nenas kultivar Smooth Cayenne pada media padat dan cair.
Bahan dan Metode
Bahan tanaman yang digunakan adalah kultur in vitro tanaman nenas kultivar Smooth Cayenne yang berasal dari Subang, Jawa Barat. Biakan tanaman induk tersebut dipelihara pada media MS (Murashige dan Skoog 1962) dengan penambahan benzyl adenine (BA) 0.5 mg l-1 (2.2 µM) dan kinetin (Kn) 1 mg l-1 (4.6 µM). Inkubasi dilakukan di ruang kultur dengan suhu 25±2 0C dan pencahayaan 800–1000 lux dengan fotoperiodisitas 16 jam. Penelitian dibagi atas dua tahap percobaan, yaitu morfogenesis eksplan pada media padat dan morfogenesis eksplan pada media cair.
Morfogenesis eksplan pada media padat
biakan. Persentase pembentukan akar atau tunas atau kalus adalah jumlah eksplan yang berakar atau bertunas atau berkalus dibagi dengan jumlah total eksplan yang diamati dikalikan 100%.
Morfogenesis eksplan pada media cair
Pada tahap ini, terdapat dua percobaan. Percobaan pertama menggunakan eksplan daun utuh, sedangkan percobaan kedua menggunakan eksplan potongan basal daun. Pada kedua percobaan tersebut digunakan Rancangan Acak Lengkap. Helaian daun in vitro dilepaskan secara hati-hati dari batangnya dengan bantuan skalpel lalu basal daun diisolasi dengan mata pisau tajam. Perlakuan yang diujikan adalah media MS cair (25 ml) yang mengandung BA pada taraf 0.5 atau 1.0 mg l-1 (2.2 atau 4.4 µM) dengan atau tanpa penambahan NAA, indole butyric acid (IBA), dan indole acetic acid (IAA) pada taraf 0.5 mg l-1. Ke dalam setiap botol, dimasukkan sepuluh eksplan, dan perlakuan diulang sebanyak 4 kali. Penggoyangan atau pemutaran dilakukan pada rotary shaker dengan kecepatan 60 rpm secara periodik 16 jam selama 3 minggu kemudian kecepatan ditingkatkan menjadi 70 rpm. Fotoperiodisitas diterapkan selama 16 jam terang dengan intensitas cahaya 800–1000 lux. Inkubasi dilakukan pada suhu 25±2 0C selama 1.5 bulan. Respon yang diamati adalah persentase pembentukan akar, tunas, kalus, jumlah tunas, dan penampilan visual biakan. Persentase pembentukan akar atau tunas atau kalus adalah jumlah eksplan yang berakar atau bertunas atau berkalus dibagi dengan jumlah total eksplan yang diamati dikalikan 100%.
Hasil dan Pembahasan
Morfogenesis eksplan pada media padat
vitro. Selain itu, Suryowinoto (1996) menjelaskan bahwa tanaman dalam famili Bromeliaceae mempunyai meristem adventif di daerah basal daunnya. Fakta dari percobaan ini menunjukkan bahwa diferensiasi sel-sel basal daun sangat dipengaruhi oleh suplai ZPT.
A
C
B D
G F
E
Gambar 3. Keragaan kultur nenas kultivar Smooth Cayenne yang berasal dari eksplan basal daun (1 bulan setelah tanam): tanpa ZPT (A), BA 1 mg l-1 (B), BA 2 mg l-1 (C), BA 3 mg l-1 (D), NAA 1 mg l-1 (E), NAA 2 mg l-1 (F), dan NAA 3 mg l-1 (G).
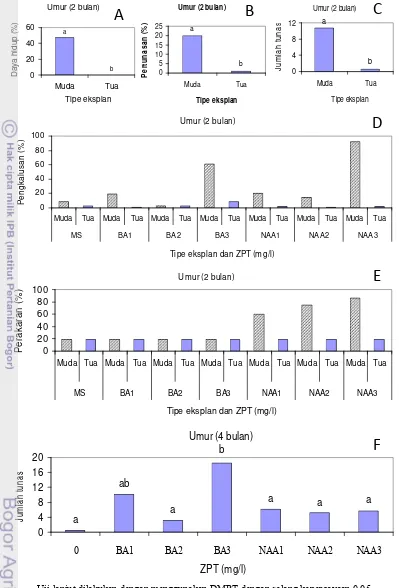
Hasil percobaan juga menunjukkan terdapatnya interaksi yang nyata antara jenis eksplan dengan ZPT terhadap peubah persentase daya hidup, persentase eksplan berkalus, dan persentase eksplan berakar pada periode 2 bulan setelah tanam (Gambar 4). Secara umum, kombinasi perlakuan NAA 3 mgl-1 dan eksplan basal daun muda memberikan hasil yang tertinggi dari ketiga peubah tersebut.
aktivitas polifenol oksidase yang menghasilkan quinon sehingga eksplan menjadi coklat.
Selain persentase pembentukan tunas, hingga periode 2 bulan, peubah jumlah tunas juga dipengaruhi oleh jenis eksplan walaupun pada periode 4 bulan, ZPT memberikan pengaruh yang nyata terhadap jumlah tunas. Pada periode 2 bulan, sebanyak 30% eksplan beregenerasi membentuk tunas (Gambar 4) dengan jumlah tunas sebanyak 10 tunas/eksplan (Gambar 4). Pada periode 4 bulan, perlakuan BA 3 mg l-1 menghasilkan jumlah tunas tertinggi (18 tunas/eksplan) dibandingkan perlakuan lainnya. Diduga bahwa sitokinin terakumulasi di dalam jaringan biakan dengan bertambahnya periode kultur in vitro sehingga pengaruhnya nyata pada 4 bulan setelah tanam.
Secara visual terdapat perbedaan respon yang mencolok antara eksplan yang diberi perlakuan BA dan NAA. Penggunaan BA pada awalnya memacu pertumbuhan ke arah pertunasan dan selanjutnya menginduksi pembentukan kalus setelah pembentukan tunas (Gambar 4). Diduga bahwa kandungan sitokinin endogen menurun seiring dengan bertambahnya periode in vitro sehingga tarafnya menjadi seimbang dengan auksin endogen yang disintesis oleh pucuk tunas dan berakibat pada terbentuknya kalus. Di lain pihak, NAA memacu pertumbuhan akar dan mampu menginduksi pertumbuhan kalus setelah pembentukan akar dan menginduksi pembentukan tunas setelah kalus terbentuk. Terbentuknya kalus oleh perlakuan NAA diduga karena akar yang terbentuk mampu segera mensintesis sitokinin lalu sitokinin tersebut ditranslokasikan secara akropetal sehingga ketika rasio antara keduanya seimbang maka terbentuk kalus dan ketika sitokinin endogen lebih tinggi tarafnya maka terbentuk tunas.
Umur (2 bulan) a b 0 4 8 12 Muda Tua Tipe eksplan J um lah t una s
Umur (2 bulan)
a b 0 20 40 60 Muda Tua Tipe eksplan D ay a hi du p ( % )
Umur (2 bulan)
0 20 40 60 80 100
Muda Tua Muda Tua Muda Tua Muda Tua Muda Tua Muda Tua Muda Tua
MS BA1 BA2 BA3 NAA1 NAA2 NAA3
Tipe eksplan dan ZPT (mg/l)
P e ngk al u s a n ( % )
Umur (2 bulan)
0 20 40 60 80 100
Muda Tua Muda Tua Muda Tua Muda Tua Muda Tua Muda Tua Muda Tua
MS BA1 BA2 BA3 NAA1 NAA2 NAA3
Tipe eksplan dan ZPT (mg/l)
Pe ra k a ra n ( %)
Umur (2 bulan)
b a 0 5 10 15 20 25 Muda Tua Tipe eksplan P e rt u n a san ( % )
Umur (4 bulan)
a a a b a ab a 0 4 8 12 16 20
0 BA1 BA2 BA3 NAA1 NAA2 NAA3
ZPT (mg/l)
Jum
la
h t
unas
A
B
C
D
E
F
[image:47.595.108.507.84.672.2]Uji lanjut dilakukan dengan menggunakan DMRT dengan selang kepercayaan 0.05
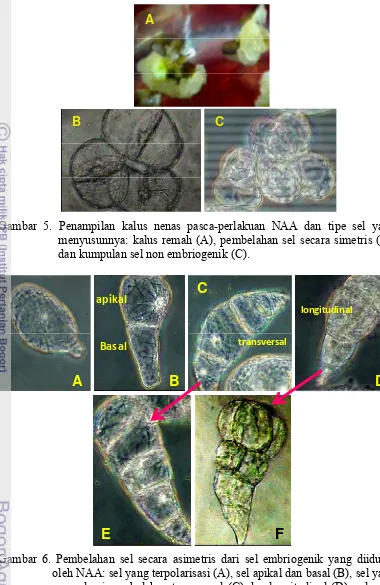
Hasil percobaan ini juga menunjukkan bahwa kalus yang terbentuk dari perlakuan BA bersifat kompak sedangkan kalus yang terbentuk dari perlakuan NAA bersifat remah. Terbentuknya kalus kompak diduga disebabkan oleh tingginya kandungan sitokinin endogen yang diinduksi oleh perlakuan sitokinin eksogen berupa BA. Terbentuknya kalus remah menimbulkan dugaan adanya sel-sel induced embryogenic determined cell (IEDC) pada daerah basal daun nenas dan berpotensi untuk induksi embriogenesis somatik. NAA merupakan salah satu jenis auksin yang mempunyai daya aktivitas kuat, mudah ditranslokasikan, dan mempunyai persistensi yang tinggi sehingga memacu pembentukan akar dan mampu menginduksi terbentuknya kalus. Dengan demikian, dapat dikatakan bahwa eksplan basal daun nenas juga berpeluang tinggi untuk diregenerasikan secara embriogenesis somatik.
A
[image:49.595.115.495.81.666.2]B C
Gambar 5. Penampilan kalus nenas pasca-perlakuan NAA dan tipe sel yang menyusunnya: kalus remah (A), pembelahan sel secara simetris (B), dan kumpulan sel non embriogenik (C).
apikal
Basal transversal
longitudinal
A
B
C
D
E
F
Morfogenesis eksplan pada media cair
Berdasarkan hasil percobaan pertama diketahui bahwa eksplan daun nenas memberikan respon yang baik pada media padat yang ditambah dengan ZPT. Diduga bahwa eksplan tersebut akan memberikan respon yang lebih baik pada media cair karena kontak eksplan dengan media cair lebih intensif dibandingkan dengan media padat. Oleh karena itu, taraf ZPT pada percobaan ini diturunkan dan digunakan kombinasi perlakuan antara sitokinin dan auksin. Selain itu, jenis eksplan (daun utuh dan potongan basal daun) juga dipelajari pengaruhnya terhadap daya morfogenesis pada media cair.
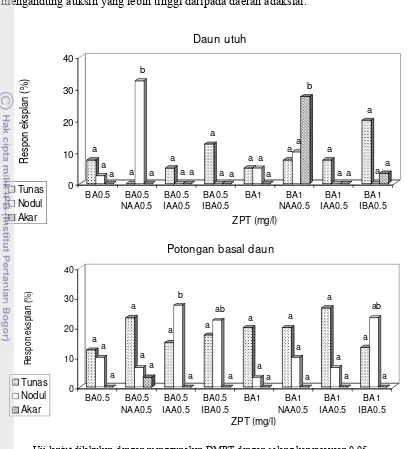
Hasil percobaan menunjukkan bahwa semua formulasi media tidak memberikan pengaruh yang nyata terhadap persentase pertunasan tetapi berpengaruh nyata terhadap persentase pembentukan nodul dan akar dari eksplan daun utuh (Gambar 7). Berbeda dengan daun utuh, eksplan basal daun mempunyai respon yang lebih baik karena beregenerasi hampir pada semua formulasi media. Persentase pembentukan tunas dan akar tidak dipengaruhi secara nyata oleh perlakuan yang diberikan. Perlakuan kombinasi antara BA 0.5 mgl-1 dan IAA 0.5 mgl-1, BA 0.5 mgl-1 dan IBA 0.5 mgl-1, serta BA 1 mgl-1 dan IBA 0.5 mgl-1 memberikan persentase pembentukan nodul yang berbeda nyata daripada perlakuan lainnya (Gambar 7). Selanjutnya, peubah jumlah tunas, tidak terdapat perbedaan yang nyata antar formulasi media yang diujikan (Gambar 8). Jumlah tunas tertinggi diperoleh dari perlakuan BA 0.5 mgl-1 dan IBA 0.5 mgl-1 serta perlakuan IBA 1 mgl-1. Dengan demikian, dapat disimpulkan bahwa perlakuan BA 0.5 mgl-1 dan IBA 0.5 mgl-1 merupakan perlakuan terbaik untuk morfogenesis eksplan nenas pada media cair.
elongasi sel diperankan oleh auksin sehingga diduga bahwa daerah abaksial mengandung auksin yang lebih tinggi daripada daerah adaksial.
a a a a b a a a a a a a a a a aa b a a a a a a 0 10 20 30 40 R espon ekspl an (% ) BA0.5 BA0.5 NAA0.5 BA0.5 IAA0.5 BA0.5 IBA0.5 BA1 BA1 NAA0.5 BA1 IAA0.5 BA1 IBA0.5 ZPT (mg/l) Daun utuh Tunas Nodul Akar a a a a a a a b a a ab a a a a a a a a a a a ab a 0 10 20 30 40 R esp on ek sp la n ( % ) BA0.5 BA0.5 NAA0.5 BA0.5 IAA0.5 BA0.5 IBA0.5 BA1 BA1 NAA0.5 BA1 IAA0.5 BA1 IBA0.5 ZPT (mg/l)
Potongan basal daun
Tunas Nodul Akar
[image:51.595.112.523.112.561.2]Uji lanjut dilakukan dengan menggunakan DMRT dengan selang kepercayaan 0.05
Gambar 7. Pengaruh kombinasi sitokinin dan auksin pada media cair terhadap pembentukan tunas, nodul, dan akar dari kultur in vitro nenas kultivar Smooth Cayenne yang berasal dari eksplan daun utuh dan potongan basal daun, umur 1.5 bulan.
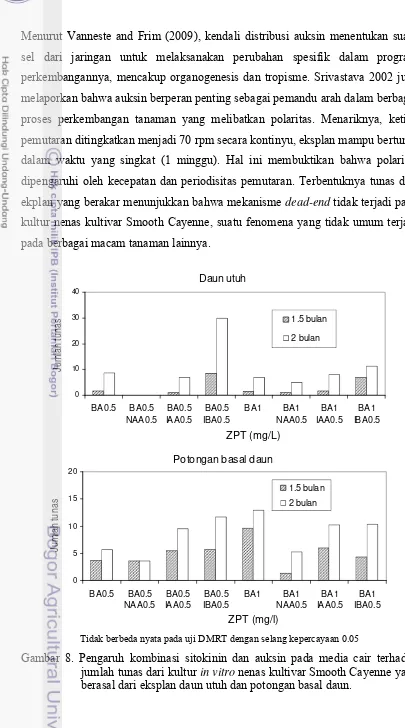
Menurut Vanneste and Frim (2009), kendali distribusi auksin menentukan suatu sel dari jaringan untuk melaksanakan perubahan spesifik dalam program perkembangannya, mencakup organogenesis dan tropisme. Srivastava 2002 juga melaporkan bahwa auksin berperan penting sebagai pemandu arah dalam berbagai proses perkembangan tanaman yang melibatkan polaritas. Menariknya, ketika pemutaran ditingkatkan menjadi 70 rpm secara kontinyu, eksplan mampu bertunas dalam waktu yang singkat (1 minggu). Hal ini membuktikan bahwa polaritas dipengaruhi oleh kecepatan dan periodisitas pemutaran. Terbentuknya tunas dari ekplan yang berakar menunjukkan bahwa mekanisme dead-end tidak terjadi pada kultur nenas kultivar Smooth Cayenne, suatu fenomena yang tidak umum terjadi pada berbagai macam tanaman lainnya.
Daun utuh 0 10 20 30 40 BA0.5 BA0.5 NAA0.5 BA0.5 IAA0.5 BA0.5 IBA0.5 BA1 BA1 NAA0.5 BA1 IAA0.5 BA1 IBA0.5 ZPT (mg/L) Jum lah tuna
s 1.5 bulan
2 bulan
Potongan basal daun
0 5 10 15 20 BA0.5 BA0.5 NAA0.5 BA0.5 IAA0.5 BA0.5 IBA0.5 BA1 BA1 NAA0.5 BA1 IAA0.5 BA1 IBA0.5 ZPT (mg/l) Ju m lah tu na s 1.5 bulan 2 bulan
[image:52.595.64.469.56.784.2]Tidak berbeda nyata pada uji DMRT dengan selang kepercayaan 0.05
Gambar 8. Pengaruh kombinasi sitokinin dan auksin pada media cair terhadap
jumlah tunas dari kultur in vitro nenas kultivar Smooth Cayenne yang
Perbedaan respon juga terlihat pada daerah abaksial dan adaksial. Daerah abaksial cenderung membentuk akar sedangkan tunas muncul dari daerah adaksial (Gambar 9). Hal ini menunjukkan bahwa distribusi dan rasio ZPT pada kedua daerah tersebut juga berbeda, di mana sitokinin lebih dominan pada daerah adaksial sehingga memacu pertumbuhan tunas, sedangkan auksin lebih dominan pada daerah abaksial sehingga memacu pertumbuhan akar.
A
C
B
D
Gambar 9. Tahapan morfogenesis dari eksplan daun nenas kultivar Smooth Cayenne pada media cair: respon awal eksplan oleh perlakuan kombinasi sitokinin dan auksin (A), pembentukan nodul, akar, dan tunas (B), elongasi tunas (C), dan pembentukan planlet (D).
Simpulan
sebesar 10 tunas/eksplan dalam waktu 2 bulan. Perlakuan terbaik untuk organogenesis langsung pada media cair adalah BA 0.5 mg l-1 dan IBA 0.5 mg l-1 dengan eksplan berupa potongan basal daun dengan dengan persentase pertunasan sebesar 18% dan tingkat multiplikasi tunas sebesar 13 tunas/eksplan dalam waktu 2 bulan. Secara umum dapat disimpulkan bahwa organogenesis langsung basal daun nenas pada media padat lebih baik daripada organogenesis langsung pada media cair.
Daftar Pustaka
Abrash, E.B. and D.C. Bergmann. 2009. Asymmetric cell divisions: A view from plant development. Developmental Cell 16: 783-796.
[BPS] Badan Pusat Statistik Republik Indonesia. 2009. Produksi buah-buahan di Indonesia. Ja