PEROKSIDASI LIPID PADA AKAR PADI (
Oryza sativa
L.)
SEBAGAI RESPON FISIOLOGIS TERHADAP CEKAMAN ALUMINIUM
Oleh:
SRI ANINDA WULANSARI
G34102013
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SRI ANINDA WULANSARI. Peroksidasi Lipid pada Akar Padi (Oryza sativa L.) sebagai Respon Fisiologis terhadap Cekaman Aluminium. Dibimbing oleh MIFTAHUDIN dan UTUT WIDYASTUTI SUHARSONO.
Aluminium (Al) merupakan faktor pembatas pertumbuhan tanaman pada tanah asam dengan pH dibawah 4.5. Penghambatan pertumbuhan akar dan terjadinya peroksidasi pada lipid membran sel merupakan salah satu respon tanaman terhadap keberadaan Al di rizhosfer. Dalam penelitian ini dipelajari pengaruh keracunan Al terhadap pertumbuhan akar dan peroksidasi lipid pada akar padi varietas IR64 dan Krowal. Akar padi varietas IR64 dan Krowal yang mendapat cekaman Al3+ (dalam bentuk AlCl3) 0, 15, 30, 45, dan 60 ppm selama 24 jam telah mengalami penghambatan
pertumbuhan akar pada konsentrasi Al 15 ppm. Akar yang mengalami penghambatan pertumbuhan juga terlihat lebih tebal dan kerdil. Penghambatan pertumbuhan juga terjadi pada akar samping.
Hasil analisis histokimia peroksidasi lipid menggunakan reagen Schiff’s untuk mendeteksi peroksidasi lipid pada membran akar menunjukkan kompleks warna merah yang tidak berbeda antara akar yang mendapat cekaman Al 0, 15, 30, dan 45 ppm pada kedua varietas. Hasil analisis histokimia ini didukung oleh hasil analisis kuantitatif peroksidasi lipid menggunakan metode uji
Thiobarbituric Acid (TBA). Konsentrasi malondyaldehyde (MDA) sebagai produk akhir peroksidasi lipid baru mengalami peningkatan secara signifikan pada konsentrasi cekaman Al 60 ppm mulai jam ke-12, dan terus meningkat sampai jam ke-48. Pada semua konsentrasi dan periode cekaman Al, konsentrasi MDA pada varietas Krowal lebih rendah dari konsentrasi MDA pada varietas IR64. Perbedaan respon tanaman terhadap Al pada penghambatan pertumbuhan akar dan pola peroksidasi lipid menunjukkan bahwa pada padi, peroksidasi lipid tidak berhubungan langsung dengan penghambatan pertumbuhan akar.
ABSTRACT
SRI ANINDA WULANSARI. Lipid Peroxidation in Rice Root (Oryza sativa L.) as Physiological Response to Aluminum Stress. Supervised by MIFTAHUDIN and UTUT WIDYASTUTI SUHARSONO.
Aluminum (Al) is a major growth-limiting factor for plants in acid soil. Inhibition of root growth and lipid peroxidation formation of cell membrane are plant responses to Al toxicity in rizhosfer. This paper reported Al toxicity effects on inhibition of root growth and lipid peroxidation in rice root (Oryza sativa L.) var. IR64 and Krowal. Root growth inhibition occurred on both varieties that were Al-stressed with 0, 15, 30, 45 and 60 ppm Al for 24 h starting at as low as 15 ppm Al stress. The inhibited root showed thicker and stunted. The root inhibition also occurred on lateral root.
PEROKSIDASI LIPID PADA AKAR PADI (
Oryza sativa
L.)
SEBAGAI RESPON FISIOLOGIS TERHADAP CEKAMAN ALUMINIUM
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
SRI ANINDA WULANSARI
G34102013
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Peroksidasi Lipid pada Akar Padi (
Oryza sativa
L.) sebagai Respon
Fisiologis terhadap Cekaman Aluminium
Nama
: Sri Aninda Wulansari
NRP : G34102013
Menyetujui,
Pembimbing I
Dr. Ir Miftahudin, M.Si
NIP 131851281
Pembimbing II
Dr. Ir. Utut Widyastuti Suharsono, M.Si
NIP131851279
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.Sc.
NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan bulan Januari 2006 sampai dengan April 2007 dengan judul Peroksidasi Lipid pada Akar Padi (Oryza sativa) sebagai Respon Fisiologis terhadap Cekaman Aluminium.
Penulis menyampaikan penghargaan dan ucapan terima kasih kepada berbagai pihak yang telah membantu dalam penyelesaian karya ilmiah ini, terutama kepada Dr.Ir. Miftahudin, M.Si. dan Dr. Ir. Utut Widayastuti Suharsono, M.Si. atas bimbingan, saran, ilmu, waktu dan curahan perhatiannya selama penelitian, serta Dr. Ir. Aris Tri Wahyudi, M.Si selaku penguji yang telah memberikan saran dan kritik. Penulis juga mengucapkan terima kasih kepada Dra. Triadiati, M.Si yang senantiasa memberikan arahan selama bekerja di laboratorium Biologi Terpadu; rekan seperjuangan selama penelitian, Ina, Ela, Bu Dewi dan Mbak Vio; teman yang tiada henti memberikan dukungan moril, Awi, Kha, Zuve, Mia, Ammay, Popi, Adit, Adel, Achie, Nearly, Gaga, serta rekan-rekan Biologi angkatan 39 atas hangatnya persahabatan. Tak lupa juga kepada Bahrelfi dan Mas Firdaus, terima kasih atas diskusi-diskusi yang menyenangkan.
Ungkapan terima kasih terbesar penulis sampaikan kepada Mama, Papa, Nenek, Adikku Selvi serta seluruh keluarga tersayang atas cinta dan doa tulus tiada henti.
Semoga karya ilmiah ini bermanfaat bagi kemajuan ilmu pengetahuan. Amin.
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis dilahirkan di Majalengka tanggal 10 Juni 1984 sebagai putri pertama dari dua bersaudara dari pasangan Ucup Suparsa, S.Pd. dan Titin Supartini.
Tahun 2002 penulis lulus dari SMU Negeri 1 Jatiwangi dan pada tahun yang sama diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR... viii
DAFTAR LAMPIRAN... viii
PENDAHULUAN... 1
Latar Belakang... 1
Tujuan ... 1
BAHAN DAN METODE ... 2
Bahan. ... 2
Kultur Hara ... 2
Analisis Root Regrowth... 2
Analisis Histokimia Peroksidasi Lipid... 2
Analisis Kuantitatif Peroksidasi Lipid ... 2
Analisis Data... 3
HASIL ... ... 3
Morfologi Akar ... 3
Analisis Root Regrowth... 3
Analisis Histokimia Peroksidasi Lipid... 3
Analisis Kuantitatif Peroksidasi Lipid ... 4
PEMBAHASAN... 5
SIMPULAN DAN SARAN... 6
DAFTAR GAMBAR
Halaman
1 Diagram proses peroksidasi lipid ... 1
2 Morfologi akar IR64 dan Krowal ... 3
3 Rata-rata pertambahan panjang akar IR64 dan Krowal selama perlakuan Aluminium ... 3
4 Rata-rata Root regrowth IR64 dan Krowal... 3
5 Pewarnaan histokimia akar IR64 dan Krowal pada perlakuan Al 0,15, 30, 45 dan 60 ppm. ... 4
6 Pewarnaan histokimia akar IR64 dan Krowal pada perlakuan Al 0 dan 60 ppm... 4
7 Pewarnaan histokimia akar IR64 dan Krowal pada perlakuan Al 0, 6, 12, 24, dan 48 jam 4 8 Pewarnaan histokimia akar IR64 dan Krowal pada perlakuan Al 0 dan 48 jam. ... 4
9 Konsentrasi Malondialdehyde (MDA) akar IR64 dan Krowal pada perlakuan Al 0,15, 30, 45 dan 60 ppm . ... 5
10 Konsentrasi Malondialdehyde (MDA) perlakuan Al 0 dan 45 ppm pada kedelai varietas Lumut dan padi varietas IR64 ... 5
PENDAHULUAN
Latar belakang
Aluminium (Al) adalah faktor pembatas utama pertumbuhan tanaman pada tanah asam (pH di bawah 4.5). Al dapat berada dalam berbagai bentuk bergantung pada pH rizhos-fer. Pada pH di bawah 4.5, bentuk Al yang dominan adalah Al(H2O)63+. Seiring dengan
meningkatnya pH, bentuk ini akan berubah menjadi Al(OH)2+ dan Al(OH)2+. Al(H2O)63+
yang biasa disebut Al3+ dipercaya sebagai bentuk yang paling beracun bagi tanaman dibandingkan Al(OH)2+ dan Al(OH)2+
(Mat-sumoto 2000).
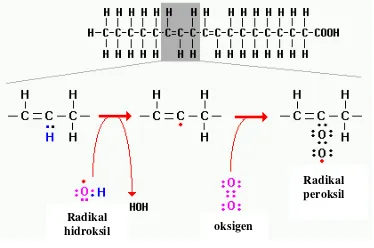
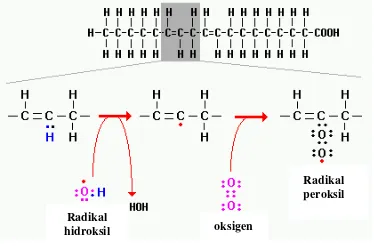
Situs utama keracunan dan akumulasi Al adalah daerah meristem akar karena daerah ini merupakan daerah perakaran yang paling sensitif terhadap perubahan lingkungan dan masih sangat aktif membelah. Targetnya adalah senyawa pektin pada dinding sel, permukaan luar membran plasma dan ligan donor oksigen (seperti gugus karboksil dan gugus fosfat dari Poly Unsaturated Fatty Acid
= PUFA) (Yamamoto et al. 2001). Interaksi aluminium dengan ketiga target di atas dapat memberikan efek yang berbeda-beda, yang semuanya berdampak terhadap metabolisme pada membran plasma. Pada dinding sel, aluminium menggantikan posisi Ca2+ dalam ikatan Ca-pektat yang menyebabkan dinding sel kaku (Blamey 1993). Sedangkan ter-ikatnya Al3+ dengan gugus fosfat pada membran menyebabkan hilangnya permea-bilitas membran sehingga membran meng-alami kekakuan. Selain itu kanal Ca2+ terhalang oleh Al3+, sehingga pertukaran kation terhambat. Hal ini akan menyebabkan terjadinya perbedaan potensial yang cukup tinggi antara di dalam dengan di luar sel. Struktur membran yang kaku dan tidak permeabel serta perbedaan potensial tersebut dapat menyebabkan terjadinya retakan pada membran sehingga sel mengalami kematian (Yamamoto et al. 2001).
Ion Al3+ berinteraksi kuat dengan kom-ponen membran plasma (Matsumoto 2000). Ikatan Al3+ dengan lipid membran menye-babkan membran menjadi kaku yang berdampak pada metabolisme yang terjadi di membran plasma. Salah satu akibat dari perubahan struktur dan fungsi membran ini adalah terjadinya peroksidasi lipid (Yama-moto et al. 2001). Peroksidasi lipid merupa-kan suatu reaksi autooksidasi, dalam hal ini
lipid membran mengalami kelebihan oksigen radikal bebas (superoksida). Interaksi aluminium dengan protein dan lipid membran dapat meningkatkan produksi Reactive Oxygen Species (ROS) seperti O2- yang
berdampak pada peroksidasi lipid. Proses peroksidasi lipid diawali dengan tahap inisiasi. Pada tahap ini terjadi pemisahan atom H oleh radikal bebas dari suatu grup metil (-CH2-) dari PUFA. Reaksi ini menghasilkan
pembentukkan suatu karbon radikal bebas (-*CH-) pada PUFA. Karbon radikal bebas ini distabilkan melalui ikatan rangkap yang menghasilkan diena terkonjugasi. Diena adalah senyawa yang mempunyai ikatan rangkap, yang bila letaknya berdekatan dapat melakukan konjugasi. Bila diena terkonjugasi bereaksi dengan O2, maka akan terbentuk
radikal peroksida lipid (ROO*). Tahap selanjutnya adalah propagasi, dimana radikal peroksida lipid dapat menghilangkan sebuah atom H dari molekul lipid lain yang berdekatan untuk membentuk radikal lipid lain. Bila radikal lipid ini bereaksi lagi dengan O2, maka reaksi peroksidasi lipid akan terus
berlanjut (Gambar 1). Peroksidasi lipid sebagai akibat cekaman Al merupakan penyebab langsung kematian sel (Yamamoto
et al. 2001).
Radikal peroksil
Radikal
hidroksil oksigen
Gambar 1 Tahapan proses terjadinya peroksidasi pada lipid membran.
Tingkat kerusakan pada sel akibat peroksidasi lipid berbeda untuk tiap spesies, bahkan tiap varietas dalam satu spesies. Sejauh ini perbedaan tingkat peroksidasi lipid antar varietas pada padi belum banyak diketahui, termasuk padi lokal Indonesia. Oleh karena itu, penelitian ini mengungkap pola peroksidasi lipid pada padi sawah dan padi gogo lokal Indonesia.
Tujuan
mendapat cekaman Al pada berbagai konsentrasi dan periode cekaman.
BAHAN DAN METODE
Bahan
Bahan tanaman yang digunakan dalam penelitian ini adalah benih padi varietas IR64 (padi sawah) dan Krowal (padi lokal Indonesia). Benih padi tersebut diperoleh dari Balai Penelitian Biologi Molekuler dan Sumber Daya Genetika (BALITBIOGEN) Cimanggu Bogor.
Metode
Kultur hara. Benih padi disterilisasi dengan natrium hipoklorit 0.5% (v/v) selama 15 menit kemudian dikecambahkan selama 48 jam. Kecambah padi yang seragam ditanam pada saringan plastik yang mengambang di atas larutan hara dengan komposisi 0.4 mM CaCl2.2H2O, 0.25 mM MgSO4.6H2O, 0.65
mM K2SO4, 0.04 mM NH4NO3, 0.01 mM
NH4Cl (Miftahudin et al. 2002), pH 4.0.
Larutan hara tersebut diganti setiap hari.
Analisis Root Regrowth. Pengaruh alumunium terhadap penghambatan panjang akar dapat diukur menggunakan metode Root Regrowth. Tanaman yang ditumbuhkan dalam kultur hara selama 24 jam diberi perlakuan Al (dalam bentuk AlCl3.6H2O) konsentrasi 0, 15,
30, 45, dan 60 ppm selama 24 jam. Kemudian akar diukur panjangnya sebagai panjang awal dan ditumbuhkan kembali pada larutan hara tanpa aluminium. Setelah 48 jam akar diukur kembali panjangnya sebagai panjang akhir.
Root Regrowth merupakan selisih panjang akhir dikurangi panjang awal. Percobaan ini dilakukan sebanyak tiga ulangan.
Analisis Histokimia Peroksidasi Lipid. Pendeteksian terjadinya peroksidasi lipid secara histokimia dilakukan mengikuti metode Pompella et al. (1987). Tanaman yang ditumbuhkan dalam kultur hara selama 48 jam diberi perlakuan Al dengan konsentrasi 0, 15, 30, 45, dan 60 ppm selama 24 jam. Selain itu pada seri percobaan lain kecambah padi mendapatkan perlakuan 60 ppm Al pada periode 0, 6, 12, 24, dan 48 jam. Kemudian akar diwarnai dengan reagen Schiff’s (basic Fuchsin 0.5% (w/v), K2S2O5 0.5% (w/v), HCl
10% (v/v)) selama 20 menit untuk mendeteksi aldehid fungsional hasil peroksidasi lipid. Kemudian akar dicuci dengan larutan sulfit (K2S2O5 0.5% (w/v)) dalam 0.05 M HCl
selama 15-30 menit. Akar yang telah diwarnai disimpan dalam larutan sulfit untuk memper-tahankan warna, kemudian diamati dan diambil gambarnya.
Analisis Kuantitatif Peroksidasi Lipid. Metode Analisis kuantitatif peroksidasi lipid merujuk pada Mihara et al. (1980) yang dimodifikasi dalam jumlah tanaman, suhu dan waktu inkubasi, serta kecepatan dan waktu sentrifugasi. Tanaman mendapat perlakuan kultur hara dan Al yang sama dengan analisis histokimia. Akar yang telah dipotong 1.5 cm dari ujungnya (masing-masing 80 tanaman untuk tiap perlakuan atau setara dengan 200 gram), digerus menggunakan mortar dalam 0.5 ml larutan Trichloroacetic Acid (TCA) 0.1% (w/v) yang mengandung 1 mM
Butylated Hydroxytoluene (BHT) pada suhu 4oC. Homogenat tersebut kemudian ditambah 3 ml larutan H3PO4 2% (v/v) dan 1 ml TBA
0.6% (w/v) dalam TCA 20% (w/v). Campuran tersebut diinkubasi pada suhu 100oC selama 30 menit, kemudian di-dinginkan sampai mencapai suhu ruang. Setelah dingin, campuran ditambah 4 ml n-butanol 100 % (v/v) kemudian dikocok dengan kuat menggunakan vortex. Fase butanol dan fase larutan dipisahkan dengan sentrifugasi 4200 rpm selama 30 menit (Labofuge 400R). Absorbansi kompleks TBA-MDA pada fase butanol diukur dengan spektrofotometer pada panjang gelombang (λ) 532 nm, sedangkan untuk nilai absorban non spesifik diukur pada
λ 520 nm. Konsentrasi MDA sebagai produk akhir peroksidasi lipid dapat dihitung dengan mengurangi nilai absorban pada λ 532 nm dengan nilai absorban pada λ 520 nm dengan akar tanaman tanpa perlakuan Al digunakan sebagai kontrol. Tingkat peroksidasi lipid dicerminkan oleh konsentrasi MDA yang terbentuk yang dapat dihitung menggunakan rumus:
[MDA] = ( A / ε . d ) v
[MDA] = Konsentrasi MDA yang bentuk ( nmol)
A = Selisih nilai absorban
ε = Nilai ekstinsi MDA (155 mM-1
cm-1)
d = Lebar kuvet (cm) v = Volume sampel (ml)
Percobaan ini dilakukan sebanyak tiga ulangan.
45 ppm selama 24 jam, dan dilakukan satu kali ulangan.
Analisis Data. Data hasil percobaan dianalisis dengan Analisis Sidik Ragam berdasarkan percobaan faktorial yang disusun berdasarkan rancangan acak kelompok (RAK) dengan varietas tanaman sebagai faktor pertama dan konsentrasi Al atau periode cekaman sebagai faktor kedua dengan model linear yang diuji adalah:
Yijk= μ + αi + βj + (αβ)ij +γk + εijk
Yijk = pengamatan pada konsentrasi Al
atau periode cekaman Al ke i, varietas j dan ulangan ke k.
μ = rataan umum
αi = pengaruh konsentrasi Al atau
periode cekaman Al ke i
βj = pengaruh varietas ke j
(αβ)ij = pengaruh konsentrasi Al atau
periode cekaman Al ke i pada varietas ke j
γk = kelompok ke k
εijk = pengaruh acak pada konsentrasi Al
atau periode cekaman Al ke i, varietas ke j, dan ulangan ke k.
HASIL
Morfologi Akar
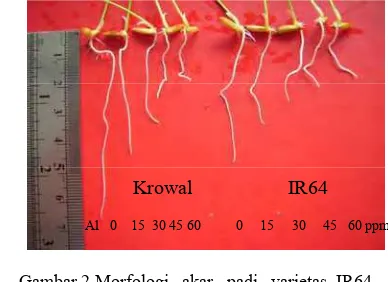
Akar yang mendapat cekaman Al, mengalami gangguan dalam beberapa proses metabolisme selnya. Hal ini berdampak pada penghambatan pembentukkan akar samping pada akar padi IR64 dan Krowal. Selain pemanjangan akar terhambat, akar juga menjadi lebih tebal. Gejala ini mulai terlihat pada konsentrasi Al 15 ppm (Gambar 2).
Gambar 2 Morfologi akar padi varietas IR64 dan Krowal setelah mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam.
Root Regrowth
Akar padi IR64 dan Krowal yang mendapat cekaman Al mengalami peng-hambatan pemanjangan akar bila di-bandingkan dengan kontrol (konsentrasi Al 0 ppm) (Gambar 2). Penghambatan ini terus meningkat seiring dengan peningkatan konsentrasi Al yang diberikan (Gambar 3).
0,0 0,5 1,0 1,5 2,0 2,5 3,0
0 15 30 45 60
Konse n trasi Aluminium (ppm)
P e r ta m ba ha n P a n ja ng A ka r (c m
) IR 64
Krowal
Gambar 3 Rata-rata pertambahan panjang akar padi varietas IR64 dan Krowal selama mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Rata-rata dari tiga ulangan.
Setelah ditumbuhkan kembali dalam kultur hara tanpa Al selama 48 jam, pemanjangan akar mengalami recovery (pemulihan) (Gambar 4). 0 1 2 3 4 5
0 15 30 45 60
Konse ntrasi Al uminium (ppm)
R oot R e gr ow th (c m ) IR64 Krowal
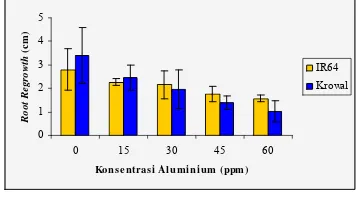
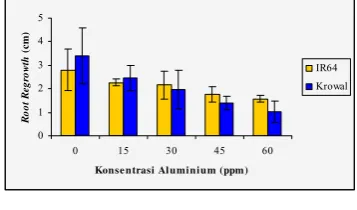
Gambar 4 Rata-rata Root Regrowth pada padi
varietas IR64 dan Krowal setelah ditumbuhkan kembali dalam kultur hara tanpa Al selama 48 jam. Rata- rata dari tiga ulangan.
Analisis Histokimia Peroksidasi Lipid Hasil analisis histokimia dari peroksidasi lipid menunjukkan intensitas warna akar yang tidak berbeda antara akar yang mendapat cekaman Al 15, 30, dan 45 ppm baik pada padi varietas IR64 maupun Krowal. Perbedaan intensitas warna baru terlihat pada akar yang mendapat cekaman Al 60 ppm (Gambar 5).
Krowal IR64
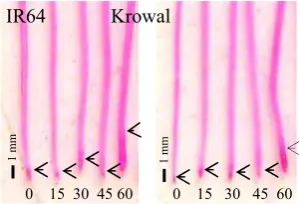
Gambar 5 Analisis histokimia peroksidasi lipid pada akar padi varietas IR64 dan Krowal setelah perlakuan Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Hal ini menunjukkan bahwa baik padi varietas IR64 maupun Krowal baru mengalami peningkatan proses peroksidasi lipid pada perlakuan cekaman Al 60 ppm. Gejalanya jelas terlihat saat akar dari tanaman kontrol dibandingkan dengan akar dari tanaman yang mendapat cekaman Al 60 ppm (Gambar 6). Ujung akar padi varietas IR64 terwarnai lebih pekat dan lebih luas daripada ujung akar padi varietas Krowal yang mendapat perlakuan yang sama. Hal ini menandakan bahwa akar padi varietas IR64 mengalami peroksidasi lipid lebih banyak daripada akar padi varietas Krowal.
Gambar 6 Perbandingan analisis histokimia peroksidasi lipid pada akar padi varietas IR64 dan Krowal setelah perlakuan Al 60 ppm selama 24 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Untuk mengetahui awal terjadinya peroksidasi lipid akibat cekaman Al 60 ppm, selanjutnya dilakukan analisis periode cekaman Al pada konsentrasi Al 60 ppm. Hasil analisis menunjukkan bahwa semakin lama periode cekaman, warna yang terbentuk sebagai ikatan antara reagen Schiff’s dengan
aldehid fungsional hasil peroksidasi lipid semakin pekat (Gambar 7).
IR64 Krowal
IR64 Krowal
1m
m
1m
m
0 15 30 45 60 0 15 30 45 60
Gambar 7 Analisis histokimia peroksidasi lipid pada akar padi IR64 dan Krowal setelah perlakuan Al 60 ppm selama 0, 6, 12, 24, dan 48 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Hasil analisis periode cekaman Al menunjukkan warna akar padi varietas IR64 lebih pekat dan lebih luas dibanding akar padi varietas Krowal. Gejala ini lebih jelas terlihat saat dibandingkan antara akar padi tanpa Al dengan akar padi yang telah mendapat cekaman Al 60 ppm selama 48 jam (Gambar 8).
Gambar 8 Perbandingan Analisis Histokimia peroksidasi lipid pada akar padi varietas IR64 dan Krowal setelah perlakuan Al 60 ppm selama 48 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Analisis Kuantitatif Peroksidasi Lipid
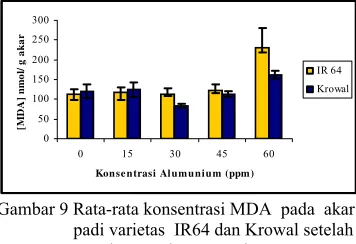
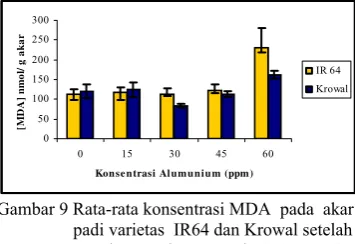
Malondyaldehyde (MDA) adalah produk akhir peroksidasi lipid, dan diakumulasi ketika tanaman mengalami cekaman oksidatif. Perlakuan cekaman Al meningkatkan konsentrasi MDA pada kedua varietas. Namun peningkatan konsentrasi MDA ini baru terlihat berbeda nyata pada perlakuan Al 60 ppm di-bandingkan dengan konsentrasi MDA pada perlakuan lainnya (Gambar 9). Al 0 60 0 60 ppm
IR64 Krowal
IR64 Krowal
0 48 0 48 0 6 12 24 48 0 6 12 24 48
1m
m
1m
m
1 mm
Gambar 9 Rata-rata konsentrasi MDA pada akar padi varietas IR64 dan Krowal setelah mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Rata-rata dari tiga ulangan.
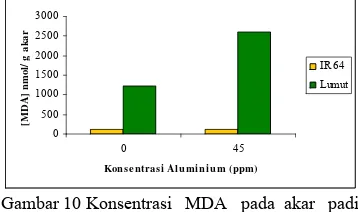
Perbandingan konsentrasi MDA sebagai produk akhir peroksidasi lipid yang dilakukan pada padi varietas IR64 dengan kedelai varietas Lumut menunjukkan bahwa kedelai varietas Lumut mempunyai nilai yang jauh lebih tinggi dibandingkan padi varietas IR64 (Gambar 10). Hal ini menunjukkan bahwa pada perlakuan yang sama, padi lebih sedikit mengalami peroksidasi lipid dibanding kedelai akibat cekaman Al.
0 500 1000 1500 2000 2500 3000 0 45
Konse ntrasi Alumini um (ppm)
[M D A ] n m ol / g ak a r IR 64 Lumut
Gambar 10 Konsentrasi MDA pada akar padi varietas IR64 dan kedelai varietas Lumut pada konsentrasi cekaman Al 0 dan 45 ppm selama 24 jam.
Akar tanaman padi yang mendapat perlakuan Al 60 ppm, menunjukkan peningkatan konsentrasi MDA mulai jam ke-12, dan terus meningkat sampai jam ke-48 (Gambar 11). 0 50 100 150 200 250 300
0 6 12 24 48
Lama Pe rl akuan Al umuni um (jam)
[M D A ] n m ol
/ g a
k
ar
IR 64 Krowal
Gambar 11 Rata-rata konsentrasi MDA pada akar padi IR64 dan Krowal setelah mendapat cekaman Al 60 ppm selama 0, 6, 12, 24, dan 48 jam. Rata- rata dari tiga ulangan.
PEMBAHASAN
0 50 100 150 200 250 3000 15 30 45 60
Konse ntrasi Al umunium (ppm)
[M D A ] n m ol / g ak ar IR 64 Krowal
Penghambatan pemanjangan akar adalah gejala awal yang terlihat akibat cekaman Al. Pada penelitian ini, perlakuan cekaman Al telah dapat menghambat pertumbuhan akar pada konsentrasi Al 15 ppm. Menurut Matsumoto (1991), pemanjangan akar berhubungan dengan pembelahan dan pemanjangan sel. Aluminium yang masuk ke dalam sel dapat berikatan dengan gugus fosfat dari DNA yang menyebabkan terhambatnya proses replikasi pada mitosis sehingga pembelahan sel terhambat. Alumunium juga menyebabkan akumulasi polisakarida dinding sel, khususnya polisakarida hemiselulosa pada daerah pertumbuhan (Tabuchi dan Matsu-moto, 2001) yang berakibat pada penebalan dinding sel. Selain itu, Al3+ berinteraksi dengan pektin yang berada pada dinding sel menggantikan posisi Ca menyebabkan dinding sel kaku dan menghambat proses pertukaran kation, sehingga sel tidak dapat membesar dan memanjang (Blamey et al.
1993).
Kollmeier et al. (2000) menemukan bahwa Al3+ juga dapat menyebabkan penghambatan transport auksin ke pangkal akar yang diduga sebagai salah satu mekanisme Al3+ dalam menginduksi penghambatan pemanjangan sel akar. Namun mekanisme penghambatannya belum diketahui dengan pasti. Selain mengalami penghambatan pertumbuhan, akar tanaman yang mendapat perlakuan Al juga terlihat lebih tebal atau gemuk, serta lebih sedikit jumlah akar sampingnya bila dibandingkan dengan akar tanaman yang tidak mendapat perlakuan Al (Gambar 2). Hal ini terjadi pada varietas IR64 dan Krowal yang menunjukkan bahwa keduanya mempunyai respon pertumbuhan akar yang sama terhadap cekaman Al.
sistem pertumbuhannya sehingga masih tetap dapat bertahan hidup walaupun telah mendapat cekaman Al.
Selain menghambat pertumbuhan akar, Al3+ dapat menyebabkan peroksidasi lipid serta kerusakan membran (Cakmak dan Horst 1991). Malondyaldehyde (MDA) adalah produk oksidasi lipid membran, dan keberadaannya bisa menunjukkan tingkat cekaman oksidatif yang dialami tanaman. Pada penelitian ini, konsentrasi MDA meningkat secara signifikan ketika tanaman mendapat perlakuan Al 60 ppm. Hal ini menunjukkan bahwa cekaman Al 60 ppm menyebabkan tanaman mengalami cekaman oksidatif dan peroksidasi lipid pada membran. Nilai MDA yang diperoleh dari penelitian ini berbeda dengan hasil penelitian-penelitian sejenis sebelumnya yang dilakukan oleh Cakmak dan Horst (1991) pada tanaman kedelai (Glycine max L.) dan Yamamoto et al.
(2001) pada tanaman kapri (Pisum sativum
L.). Menurut hasil penelitian mereka, akar tanaman yang diberi perlakuan Al mengalami peningkatan peroksidasi lipid yang meningkat seiring dengan meningkatnya konsentrasi Al yang diberikan pada media tumbuh. Sedangkan pada padi, perlakuan Al 15, 30, dan 45 ppm tidak mempengaruhi peroksidasi lipid pada kedua varietas. Pada ketiga konsentrasi cekaman Al tersebut, kedua varietas tanaman belum mengalami cekaman oksidatif yang cukup berarti.
Kenyataan ini berbeda dengan hasil analisis kuantitatif peroksidasi lipid yang dilakukan terhadap kedelai varietas Lumut. Jika dibandingkan dengan tanaman padi IR64 dengan perlakuan cekaman Al yang sama (45 ppm), pembentukan MDA pada kedelai varietas Lumut jauh lebih tinggi. Hal ini menunjukkan bahwa membran sel padi lebih toleran terhadap peroksidasi lipid yang disebabkan oleh Al dibanding membran sel kedelai.
Pembentukkan MDA pada akar Krowal yang lebih rendah daripada MDA yang terbentuk pada akar IR64 menandakan bahwa pada perlakuan cekaman yang sama varietas Krowal mengalami cekaman oksidatif yang lebih rendah dibanding IR64.
Setiap spesies mempunyai mekanisme toleransi yang berbeda-beda terhadap cekaman Al. Begitupun dengan mekanisme terjadinya peroksidasi lipid pada membran plasma sebagai respon tanaman terhadap keberadaan Al. Mekanisme awal terjadinya
peroksidasi lipid disebabkan oleh terjadinya modifikasi struktur membran. Menurut Cakmak dan Horst (1991), modifikasi struktur membran karena interaksi Al3+ dengan protein dan lipid membran dapat meningkatkan produksi spesies oksigen reaktif (ROS) seperti O2- dan H2O2 dan peroksidasi lipid. Oksigen
radikal (O2-) berasal dari beberapa proses
metabolik seperti respirasi pada membran plasma. Sedangkan H2O2 diproduksi oleh
dismutasi enzimatik dan dismutasi spontan dari O2-. Kombinasi O2- dan H2O2,
membentuk radikal hidroksi reaktif tinggi yang menginisiasi rantai reaksi radikal bebas yang menghasilkan peroksidasi lipid. Hasil penelitian ini menunjukkan bahwa pada padi pun terdapat mekanisme toleransi tersendiri terhadap cekaman Al yang dapat menghambat terjadinya peroksidasi lipid. Sehingga pada konsentrasi cekaman Al yang pada tanaman lain (seperti kedelai) telah menyebabkan peningkatan peroksidasi lipid, peningkatan peroksidasi lipid masih dapat dihambat pada padi varietas IR64 dan Krowal.
Hasil analisis peroksidasi lipid pada penelitian ini tidak sejalan dengan hasil analisis root regrowth dimana penghambatan pemanjangan akar sudah terlihat pada cekaman Al 15 ppm, sedangkan peroksidasi lipid baru terlihat secara nyata pada konsentrasi Al 60 ppm. Penelitian Yamamoto
et al. (2001) menunjukkan bahwa pada Pisum sativum, peroksidasi lipid merupakan gejala yang tampak sebagai akibat cekaman Al, tapi bukan merupakan penyebab utama terjadinya penghambatan pemanjangan akar. Hasil penelitian tersebut sejalan dengan hasil penelitian ini yang juga membuktikan bahwa peroksidasi lipid bukan merupakan faktor utama penyebab penghambatan akar pada tanaman padi.
SIMPULAN DAN SARAN
Simpulanperoksidasi lipid tidak berhubungan langsung dengan penghambatan panjang akar.
Saran
Diperlukan analisis anatomi akar untuk mengetahui tingkat kerusakan jaringan. Selain itu analisis peroksidasi lipid perlu dilakukan terhadap varietas padi toleran sehingga dapat diketahui mekanisme toksisitas Al pada padi.
DAFTAR PUSTAKA
Blamey FPC, Edwards DG, Asher CJ. 1993. Factors affecting aluminium sorption by calcium pectate. Plant and Soil. 113: 1447-1455
Cakmak I, Horst WJ. 1991. Effect of alu-minum on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycine max L.). PlantPhysiol 83: 463-468. Kollmeier M, Felle HH, Horst WJ. 2000.
Genotypical differences in aluminum resistance of maize are expressed in the distal part of the transition zone. Is reduced basipetal auxin flow involved in inhibition of root elongation by aluminium? Plant Physiol. 122: 945-956. Matsumoto H. 1991. Biochemical mechanism
of toxicity of aluminium and the sequestration of aluminium in plant cells.
Di dalam: Wright RJ, editor. Plant Soil Interaction at Low pH. Netherland: Kluwer Academic Publ. hal 825-838. Matsumoto H. 2000. Cell biology of
aluminum toxicity and tolerance in higher plants. Int Rev Cytol 200: 1-46.
Miftahudin, Scoles GJ, Gustafson JP. 2002. AFLP markers tightly linked to the aluminum tolerance gene Alt3 in rye (Secale sereale L.). Theor. Appl. Genet.
104:626-631.
Mihara M, Uchiyama M, Fukazawa K. 1980. Thiobarbituric acid value on fresh homogenate of rat as parameter of lipid peroxidation in aging, CCl4 intoxication
and vitamin edeficiency. Biochem Med
23:302-311.
Pompella LA, Maellaro E, Casini AF, Comporti M. 1987. Histochemical detec-tion of lipid peroxidadetec-tion in the liver of bromobenzene-poisoned mice. Am. J Pathol. 129:295-301.
Tabuchi A, Matsumoto H. 2001. Changes in cell wall properties of wheat (Triticum aestivum) roots during aluminum-induced growth inhibition. Physiol. Plant. 112: 353-358.
Yamamoto Y, Yukiko k, Hideaki M. 2001. Lipid peroxidation is an early symptom triggered by alumunium, but not primary cause of elongation inhibition in pea roots.
PEROKSIDASI LIPID PADA AKAR PADI (
Oryza sativa
L.)
SEBAGAI RESPON FISIOLOGIS TERHADAP CEKAMAN ALUMINIUM
Oleh:
SRI ANINDA WULANSARI
G34102013
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SRI ANINDA WULANSARI. Peroksidasi Lipid pada Akar Padi (Oryza sativa L.) sebagai Respon Fisiologis terhadap Cekaman Aluminium. Dibimbing oleh MIFTAHUDIN dan UTUT WIDYASTUTI SUHARSONO.
Aluminium (Al) merupakan faktor pembatas pertumbuhan tanaman pada tanah asam dengan pH dibawah 4.5. Penghambatan pertumbuhan akar dan terjadinya peroksidasi pada lipid membran sel merupakan salah satu respon tanaman terhadap keberadaan Al di rizhosfer. Dalam penelitian ini dipelajari pengaruh keracunan Al terhadap pertumbuhan akar dan peroksidasi lipid pada akar padi varietas IR64 dan Krowal. Akar padi varietas IR64 dan Krowal yang mendapat cekaman Al3+ (dalam bentuk AlCl3) 0, 15, 30, 45, dan 60 ppm selama 24 jam telah mengalami penghambatan
pertumbuhan akar pada konsentrasi Al 15 ppm. Akar yang mengalami penghambatan pertumbuhan juga terlihat lebih tebal dan kerdil. Penghambatan pertumbuhan juga terjadi pada akar samping.
Hasil analisis histokimia peroksidasi lipid menggunakan reagen Schiff’s untuk mendeteksi peroksidasi lipid pada membran akar menunjukkan kompleks warna merah yang tidak berbeda antara akar yang mendapat cekaman Al 0, 15, 30, dan 45 ppm pada kedua varietas. Hasil analisis histokimia ini didukung oleh hasil analisis kuantitatif peroksidasi lipid menggunakan metode uji
Thiobarbituric Acid (TBA). Konsentrasi malondyaldehyde (MDA) sebagai produk akhir peroksidasi lipid baru mengalami peningkatan secara signifikan pada konsentrasi cekaman Al 60 ppm mulai jam ke-12, dan terus meningkat sampai jam ke-48. Pada semua konsentrasi dan periode cekaman Al, konsentrasi MDA pada varietas Krowal lebih rendah dari konsentrasi MDA pada varietas IR64. Perbedaan respon tanaman terhadap Al pada penghambatan pertumbuhan akar dan pola peroksidasi lipid menunjukkan bahwa pada padi, peroksidasi lipid tidak berhubungan langsung dengan penghambatan pertumbuhan akar.
ABSTRACT
SRI ANINDA WULANSARI. Lipid Peroxidation in Rice Root (Oryza sativa L.) as Physiological Response to Aluminum Stress. Supervised by MIFTAHUDIN and UTUT WIDYASTUTI SUHARSONO.
Aluminum (Al) is a major growth-limiting factor for plants in acid soil. Inhibition of root growth and lipid peroxidation formation of cell membrane are plant responses to Al toxicity in rizhosfer. This paper reported Al toxicity effects on inhibition of root growth and lipid peroxidation in rice root (Oryza sativa L.) var. IR64 and Krowal. Root growth inhibition occurred on both varieties that were Al-stressed with 0, 15, 30, 45 and 60 ppm Al for 24 h starting at as low as 15 ppm Al stress. The inhibited root showed thicker and stunted. The root inhibition also occurred on lateral root.
PENDAHULUAN
Latar belakang
Aluminium (Al) adalah faktor pembatas utama pertumbuhan tanaman pada tanah asam (pH di bawah 4.5). Al dapat berada dalam berbagai bentuk bergantung pada pH rizhos-fer. Pada pH di bawah 4.5, bentuk Al yang dominan adalah Al(H2O)63+. Seiring dengan
meningkatnya pH, bentuk ini akan berubah menjadi Al(OH)2+ dan Al(OH)2+. Al(H2O)63+
yang biasa disebut Al3+ dipercaya sebagai bentuk yang paling beracun bagi tanaman dibandingkan Al(OH)2+ dan Al(OH)2+
(Mat-sumoto 2000).
Situs utama keracunan dan akumulasi Al adalah daerah meristem akar karena daerah ini merupakan daerah perakaran yang paling sensitif terhadap perubahan lingkungan dan masih sangat aktif membelah. Targetnya adalah senyawa pektin pada dinding sel, permukaan luar membran plasma dan ligan donor oksigen (seperti gugus karboksil dan gugus fosfat dari Poly Unsaturated Fatty Acid
= PUFA) (Yamamoto et al. 2001). Interaksi aluminium dengan ketiga target di atas dapat memberikan efek yang berbeda-beda, yang semuanya berdampak terhadap metabolisme pada membran plasma. Pada dinding sel, aluminium menggantikan posisi Ca2+ dalam ikatan Ca-pektat yang menyebabkan dinding sel kaku (Blamey 1993). Sedangkan ter-ikatnya Al3+ dengan gugus fosfat pada membran menyebabkan hilangnya permea-bilitas membran sehingga membran meng-alami kekakuan. Selain itu kanal Ca2+ terhalang oleh Al3+, sehingga pertukaran kation terhambat. Hal ini akan menyebabkan terjadinya perbedaan potensial yang cukup tinggi antara di dalam dengan di luar sel. Struktur membran yang kaku dan tidak permeabel serta perbedaan potensial tersebut dapat menyebabkan terjadinya retakan pada membran sehingga sel mengalami kematian (Yamamoto et al. 2001).
Ion Al3+ berinteraksi kuat dengan kom-ponen membran plasma (Matsumoto 2000). Ikatan Al3+ dengan lipid membran menye-babkan membran menjadi kaku yang berdampak pada metabolisme yang terjadi di membran plasma. Salah satu akibat dari perubahan struktur dan fungsi membran ini adalah terjadinya peroksidasi lipid (Yama-moto et al. 2001). Peroksidasi lipid merupa-kan suatu reaksi autooksidasi, dalam hal ini
lipid membran mengalami kelebihan oksigen radikal bebas (superoksida). Interaksi aluminium dengan protein dan lipid membran dapat meningkatkan produksi Reactive Oxygen Species (ROS) seperti O2- yang
berdampak pada peroksidasi lipid. Proses peroksidasi lipid diawali dengan tahap inisiasi. Pada tahap ini terjadi pemisahan atom H oleh radikal bebas dari suatu grup metil (-CH2-) dari PUFA. Reaksi ini menghasilkan
pembentukkan suatu karbon radikal bebas (-*CH-) pada PUFA. Karbon radikal bebas ini distabilkan melalui ikatan rangkap yang menghasilkan diena terkonjugasi. Diena adalah senyawa yang mempunyai ikatan rangkap, yang bila letaknya berdekatan dapat melakukan konjugasi. Bila diena terkonjugasi bereaksi dengan O2, maka akan terbentuk
radikal peroksida lipid (ROO*). Tahap selanjutnya adalah propagasi, dimana radikal peroksida lipid dapat menghilangkan sebuah atom H dari molekul lipid lain yang berdekatan untuk membentuk radikal lipid lain. Bila radikal lipid ini bereaksi lagi dengan O2, maka reaksi peroksidasi lipid akan terus
berlanjut (Gambar 1). Peroksidasi lipid sebagai akibat cekaman Al merupakan penyebab langsung kematian sel (Yamamoto
et al. 2001).
Radikal peroksil
Radikal
hidroksil oksigen
Gambar 1 Tahapan proses terjadinya peroksidasi pada lipid membran.
Tingkat kerusakan pada sel akibat peroksidasi lipid berbeda untuk tiap spesies, bahkan tiap varietas dalam satu spesies. Sejauh ini perbedaan tingkat peroksidasi lipid antar varietas pada padi belum banyak diketahui, termasuk padi lokal Indonesia. Oleh karena itu, penelitian ini mengungkap pola peroksidasi lipid pada padi sawah dan padi gogo lokal Indonesia.
Tujuan
mendapat cekaman Al pada berbagai konsentrasi dan periode cekaman.
BAHAN DAN METODE
Bahan
Bahan tanaman yang digunakan dalam penelitian ini adalah benih padi varietas IR64 (padi sawah) dan Krowal (padi lokal Indonesia). Benih padi tersebut diperoleh dari Balai Penelitian Biologi Molekuler dan Sumber Daya Genetika (BALITBIOGEN) Cimanggu Bogor.
Metode
Kultur hara. Benih padi disterilisasi dengan natrium hipoklorit 0.5% (v/v) selama 15 menit kemudian dikecambahkan selama 48 jam. Kecambah padi yang seragam ditanam pada saringan plastik yang mengambang di atas larutan hara dengan komposisi 0.4 mM CaCl2.2H2O, 0.25 mM MgSO4.6H2O, 0.65
mM K2SO4, 0.04 mM NH4NO3, 0.01 mM
NH4Cl (Miftahudin et al. 2002), pH 4.0.
Larutan hara tersebut diganti setiap hari.
Analisis Root Regrowth. Pengaruh alumunium terhadap penghambatan panjang akar dapat diukur menggunakan metode Root Regrowth. Tanaman yang ditumbuhkan dalam kultur hara selama 24 jam diberi perlakuan Al (dalam bentuk AlCl3.6H2O) konsentrasi 0, 15,
30, 45, dan 60 ppm selama 24 jam. Kemudian akar diukur panjangnya sebagai panjang awal dan ditumbuhkan kembali pada larutan hara tanpa aluminium. Setelah 48 jam akar diukur kembali panjangnya sebagai panjang akhir.
Root Regrowth merupakan selisih panjang akhir dikurangi panjang awal. Percobaan ini dilakukan sebanyak tiga ulangan.
Analisis Histokimia Peroksidasi Lipid. Pendeteksian terjadinya peroksidasi lipid secara histokimia dilakukan mengikuti metode Pompella et al. (1987). Tanaman yang ditumbuhkan dalam kultur hara selama 48 jam diberi perlakuan Al dengan konsentrasi 0, 15, 30, 45, dan 60 ppm selama 24 jam. Selain itu pada seri percobaan lain kecambah padi mendapatkan perlakuan 60 ppm Al pada periode 0, 6, 12, 24, dan 48 jam. Kemudian akar diwarnai dengan reagen Schiff’s (basic Fuchsin 0.5% (w/v), K2S2O5 0.5% (w/v), HCl
10% (v/v)) selama 20 menit untuk mendeteksi aldehid fungsional hasil peroksidasi lipid. Kemudian akar dicuci dengan larutan sulfit (K2S2O5 0.5% (w/v)) dalam 0.05 M HCl
selama 15-30 menit. Akar yang telah diwarnai disimpan dalam larutan sulfit untuk memper-tahankan warna, kemudian diamati dan diambil gambarnya.
Analisis Kuantitatif Peroksidasi Lipid. Metode Analisis kuantitatif peroksidasi lipid merujuk pada Mihara et al. (1980) yang dimodifikasi dalam jumlah tanaman, suhu dan waktu inkubasi, serta kecepatan dan waktu sentrifugasi. Tanaman mendapat perlakuan kultur hara dan Al yang sama dengan analisis histokimia. Akar yang telah dipotong 1.5 cm dari ujungnya (masing-masing 80 tanaman untuk tiap perlakuan atau setara dengan 200 gram), digerus menggunakan mortar dalam 0.5 ml larutan Trichloroacetic Acid (TCA) 0.1% (w/v) yang mengandung 1 mM
Butylated Hydroxytoluene (BHT) pada suhu 4oC. Homogenat tersebut kemudian ditambah 3 ml larutan H3PO4 2% (v/v) dan 1 ml TBA
0.6% (w/v) dalam TCA 20% (w/v). Campuran tersebut diinkubasi pada suhu 100oC selama 30 menit, kemudian di-dinginkan sampai mencapai suhu ruang. Setelah dingin, campuran ditambah 4 ml n-butanol 100 % (v/v) kemudian dikocok dengan kuat menggunakan vortex. Fase butanol dan fase larutan dipisahkan dengan sentrifugasi 4200 rpm selama 30 menit (Labofuge 400R). Absorbansi kompleks TBA-MDA pada fase butanol diukur dengan spektrofotometer pada panjang gelombang (λ) 532 nm, sedangkan untuk nilai absorban non spesifik diukur pada
λ 520 nm. Konsentrasi MDA sebagai produk akhir peroksidasi lipid dapat dihitung dengan mengurangi nilai absorban pada λ 532 nm dengan nilai absorban pada λ 520 nm dengan akar tanaman tanpa perlakuan Al digunakan sebagai kontrol. Tingkat peroksidasi lipid dicerminkan oleh konsentrasi MDA yang terbentuk yang dapat dihitung menggunakan rumus:
[MDA] = ( A / ε . d ) v
[MDA] = Konsentrasi MDA yang bentuk ( nmol)
A = Selisih nilai absorban
ε = Nilai ekstinsi MDA (155 mM-1
cm-1)
d = Lebar kuvet (cm) v = Volume sampel (ml)
Percobaan ini dilakukan sebanyak tiga ulangan.
mendapat cekaman Al pada berbagai konsentrasi dan periode cekaman.
BAHAN DAN METODE
Bahan
Bahan tanaman yang digunakan dalam penelitian ini adalah benih padi varietas IR64 (padi sawah) dan Krowal (padi lokal Indonesia). Benih padi tersebut diperoleh dari Balai Penelitian Biologi Molekuler dan Sumber Daya Genetika (BALITBIOGEN) Cimanggu Bogor.
Metode
Kultur hara. Benih padi disterilisasi dengan natrium hipoklorit 0.5% (v/v) selama 15 menit kemudian dikecambahkan selama 48 jam. Kecambah padi yang seragam ditanam pada saringan plastik yang mengambang di atas larutan hara dengan komposisi 0.4 mM CaCl2.2H2O, 0.25 mM MgSO4.6H2O, 0.65
mM K2SO4, 0.04 mM NH4NO3, 0.01 mM
NH4Cl (Miftahudin et al. 2002), pH 4.0.
Larutan hara tersebut diganti setiap hari.
Analisis Root Regrowth. Pengaruh alumunium terhadap penghambatan panjang akar dapat diukur menggunakan metode Root Regrowth. Tanaman yang ditumbuhkan dalam kultur hara selama 24 jam diberi perlakuan Al (dalam bentuk AlCl3.6H2O) konsentrasi 0, 15,
30, 45, dan 60 ppm selama 24 jam. Kemudian akar diukur panjangnya sebagai panjang awal dan ditumbuhkan kembali pada larutan hara tanpa aluminium. Setelah 48 jam akar diukur kembali panjangnya sebagai panjang akhir.
Root Regrowth merupakan selisih panjang akhir dikurangi panjang awal. Percobaan ini dilakukan sebanyak tiga ulangan.
Analisis Histokimia Peroksidasi Lipid. Pendeteksian terjadinya peroksidasi lipid secara histokimia dilakukan mengikuti metode Pompella et al. (1987). Tanaman yang ditumbuhkan dalam kultur hara selama 48 jam diberi perlakuan Al dengan konsentrasi 0, 15, 30, 45, dan 60 ppm selama 24 jam. Selain itu pada seri percobaan lain kecambah padi mendapatkan perlakuan 60 ppm Al pada periode 0, 6, 12, 24, dan 48 jam. Kemudian akar diwarnai dengan reagen Schiff’s (basic Fuchsin 0.5% (w/v), K2S2O5 0.5% (w/v), HCl
10% (v/v)) selama 20 menit untuk mendeteksi aldehid fungsional hasil peroksidasi lipid. Kemudian akar dicuci dengan larutan sulfit (K2S2O5 0.5% (w/v)) dalam 0.05 M HCl
selama 15-30 menit. Akar yang telah diwarnai disimpan dalam larutan sulfit untuk memper-tahankan warna, kemudian diamati dan diambil gambarnya.
Analisis Kuantitatif Peroksidasi Lipid. Metode Analisis kuantitatif peroksidasi lipid merujuk pada Mihara et al. (1980) yang dimodifikasi dalam jumlah tanaman, suhu dan waktu inkubasi, serta kecepatan dan waktu sentrifugasi. Tanaman mendapat perlakuan kultur hara dan Al yang sama dengan analisis histokimia. Akar yang telah dipotong 1.5 cm dari ujungnya (masing-masing 80 tanaman untuk tiap perlakuan atau setara dengan 200 gram), digerus menggunakan mortar dalam 0.5 ml larutan Trichloroacetic Acid (TCA) 0.1% (w/v) yang mengandung 1 mM
Butylated Hydroxytoluene (BHT) pada suhu 4oC. Homogenat tersebut kemudian ditambah 3 ml larutan H3PO4 2% (v/v) dan 1 ml TBA
0.6% (w/v) dalam TCA 20% (w/v). Campuran tersebut diinkubasi pada suhu 100oC selama 30 menit, kemudian di-dinginkan sampai mencapai suhu ruang. Setelah dingin, campuran ditambah 4 ml n-butanol 100 % (v/v) kemudian dikocok dengan kuat menggunakan vortex. Fase butanol dan fase larutan dipisahkan dengan sentrifugasi 4200 rpm selama 30 menit (Labofuge 400R). Absorbansi kompleks TBA-MDA pada fase butanol diukur dengan spektrofotometer pada panjang gelombang (λ) 532 nm, sedangkan untuk nilai absorban non spesifik diukur pada
λ 520 nm. Konsentrasi MDA sebagai produk akhir peroksidasi lipid dapat dihitung dengan mengurangi nilai absorban pada λ 532 nm dengan nilai absorban pada λ 520 nm dengan akar tanaman tanpa perlakuan Al digunakan sebagai kontrol. Tingkat peroksidasi lipid dicerminkan oleh konsentrasi MDA yang terbentuk yang dapat dihitung menggunakan rumus:
[MDA] = ( A / ε . d ) v
[MDA] = Konsentrasi MDA yang bentuk ( nmol)
A = Selisih nilai absorban
ε = Nilai ekstinsi MDA (155 mM-1
cm-1)
d = Lebar kuvet (cm) v = Volume sampel (ml)
Percobaan ini dilakukan sebanyak tiga ulangan.
45 ppm selama 24 jam, dan dilakukan satu kali ulangan.
Analisis Data. Data hasil percobaan dianalisis dengan Analisis Sidik Ragam berdasarkan percobaan faktorial yang disusun berdasarkan rancangan acak kelompok (RAK) dengan varietas tanaman sebagai faktor pertama dan konsentrasi Al atau periode cekaman sebagai faktor kedua dengan model linear yang diuji adalah:
Yijk= μ + αi + βj + (αβ)ij +γk + εijk
Yijk = pengamatan pada konsentrasi Al
atau periode cekaman Al ke i, varietas j dan ulangan ke k.
μ = rataan umum
αi = pengaruh konsentrasi Al atau
periode cekaman Al ke i
βj = pengaruh varietas ke j
(αβ)ij = pengaruh konsentrasi Al atau
periode cekaman Al ke i pada varietas ke j
γk = kelompok ke k
εijk = pengaruh acak pada konsentrasi Al
atau periode cekaman Al ke i, varietas ke j, dan ulangan ke k.
HASIL
Morfologi Akar
Akar yang mendapat cekaman Al, mengalami gangguan dalam beberapa proses metabolisme selnya. Hal ini berdampak pada penghambatan pembentukkan akar samping pada akar padi IR64 dan Krowal. Selain pemanjangan akar terhambat, akar juga menjadi lebih tebal. Gejala ini mulai terlihat pada konsentrasi Al 15 ppm (Gambar 2).
Gambar 2 Morfologi akar padi varietas IR64 dan Krowal setelah mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam.
Root Regrowth
Akar padi IR64 dan Krowal yang mendapat cekaman Al mengalami peng-hambatan pemanjangan akar bila di-bandingkan dengan kontrol (konsentrasi Al 0 ppm) (Gambar 2). Penghambatan ini terus meningkat seiring dengan peningkatan konsentrasi Al yang diberikan (Gambar 3).
0,0 0,5 1,0 1,5 2,0 2,5 3,0
0 15 30 45 60
Konse n trasi Aluminium (ppm)
P e r ta m ba ha n P a n ja ng A ka r (c m
) IR 64
Krowal
Gambar 3 Rata-rata pertambahan panjang akar padi varietas IR64 dan Krowal selama mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Rata-rata dari tiga ulangan.
Setelah ditumbuhkan kembali dalam kultur hara tanpa Al selama 48 jam, pemanjangan akar mengalami recovery (pemulihan) (Gambar 4). 0 1 2 3 4 5
0 15 30 45 60
Konse ntrasi Al uminium (ppm)
R oot R e gr ow th (c m ) IR64 Krowal
Gambar 4 Rata-rata Root Regrowth pada padi
varietas IR64 dan Krowal setelah ditumbuhkan kembali dalam kultur hara tanpa Al selama 48 jam. Rata- rata dari tiga ulangan.
Analisis Histokimia Peroksidasi Lipid Hasil analisis histokimia dari peroksidasi lipid menunjukkan intensitas warna akar yang tidak berbeda antara akar yang mendapat cekaman Al 15, 30, dan 45 ppm baik pada padi varietas IR64 maupun Krowal. Perbedaan intensitas warna baru terlihat pada akar yang mendapat cekaman Al 60 ppm (Gambar 5).
Krowal IR64
45 ppm selama 24 jam, dan dilakukan satu kali ulangan.
Analisis Data. Data hasil percobaan dianalisis dengan Analisis Sidik Ragam berdasarkan percobaan faktorial yang disusun berdasarkan rancangan acak kelompok (RAK) dengan varietas tanaman sebagai faktor pertama dan konsentrasi Al atau periode cekaman sebagai faktor kedua dengan model linear yang diuji adalah:
Yijk= μ + αi + βj + (αβ)ij +γk + εijk
Yijk = pengamatan pada konsentrasi Al
atau periode cekaman Al ke i, varietas j dan ulangan ke k.
μ = rataan umum
αi = pengaruh konsentrasi Al atau
periode cekaman Al ke i
βj = pengaruh varietas ke j
(αβ)ij = pengaruh konsentrasi Al atau
periode cekaman Al ke i pada varietas ke j
γk = kelompok ke k
εijk = pengaruh acak pada konsentrasi Al
atau periode cekaman Al ke i, varietas ke j, dan ulangan ke k.
HASIL
Morfologi Akar
Akar yang mendapat cekaman Al, mengalami gangguan dalam beberapa proses metabolisme selnya. Hal ini berdampak pada penghambatan pembentukkan akar samping pada akar padi IR64 dan Krowal. Selain pemanjangan akar terhambat, akar juga menjadi lebih tebal. Gejala ini mulai terlihat pada konsentrasi Al 15 ppm (Gambar 2).
Gambar 2 Morfologi akar padi varietas IR64 dan Krowal setelah mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam.
Root Regrowth
Akar padi IR64 dan Krowal yang mendapat cekaman Al mengalami peng-hambatan pemanjangan akar bila di-bandingkan dengan kontrol (konsentrasi Al 0 ppm) (Gambar 2). Penghambatan ini terus meningkat seiring dengan peningkatan konsentrasi Al yang diberikan (Gambar 3).
0,0 0,5 1,0 1,5 2,0 2,5 3,0
0 15 30 45 60
Konse n trasi Aluminium (ppm)
P e r ta m ba ha n P a n ja ng A ka r (c m
) IR 64
Krowal
Gambar 3 Rata-rata pertambahan panjang akar padi varietas IR64 dan Krowal selama mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Rata-rata dari tiga ulangan.
Setelah ditumbuhkan kembali dalam kultur hara tanpa Al selama 48 jam, pemanjangan akar mengalami recovery (pemulihan) (Gambar 4). 0 1 2 3 4 5
0 15 30 45 60
Konse ntrasi Al uminium (ppm)
R oot R e gr ow th (c m ) IR64 Krowal
Gambar 4 Rata-rata Root Regrowth pada padi
varietas IR64 dan Krowal setelah ditumbuhkan kembali dalam kultur hara tanpa Al selama 48 jam. Rata- rata dari tiga ulangan.
Analisis Histokimia Peroksidasi Lipid Hasil analisis histokimia dari peroksidasi lipid menunjukkan intensitas warna akar yang tidak berbeda antara akar yang mendapat cekaman Al 15, 30, dan 45 ppm baik pada padi varietas IR64 maupun Krowal. Perbedaan intensitas warna baru terlihat pada akar yang mendapat cekaman Al 60 ppm (Gambar 5).
Krowal IR64
Gambar 5 Analisis histokimia peroksidasi lipid pada akar padi varietas IR64 dan Krowal setelah perlakuan Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Hal ini menunjukkan bahwa baik padi varietas IR64 maupun Krowal baru mengalami peningkatan proses peroksidasi lipid pada perlakuan cekaman Al 60 ppm. Gejalanya jelas terlihat saat akar dari tanaman kontrol dibandingkan dengan akar dari tanaman yang mendapat cekaman Al 60 ppm (Gambar 6). Ujung akar padi varietas IR64 terwarnai lebih pekat dan lebih luas daripada ujung akar padi varietas Krowal yang mendapat perlakuan yang sama. Hal ini menandakan bahwa akar padi varietas IR64 mengalami peroksidasi lipid lebih banyak daripada akar padi varietas Krowal.
Gambar 6 Perbandingan analisis histokimia peroksidasi lipid pada akar padi varietas IR64 dan Krowal setelah perlakuan Al 60 ppm selama 24 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Untuk mengetahui awal terjadinya peroksidasi lipid akibat cekaman Al 60 ppm, selanjutnya dilakukan analisis periode cekaman Al pada konsentrasi Al 60 ppm. Hasil analisis menunjukkan bahwa semakin lama periode cekaman, warna yang terbentuk sebagai ikatan antara reagen Schiff’s dengan
aldehid fungsional hasil peroksidasi lipid semakin pekat (Gambar 7).
IR64 Krowal
IR64 Krowal
1m
m
1m
m
0 15 30 45 60 0 15 30 45 60
Gambar 7 Analisis histokimia peroksidasi lipid pada akar padi IR64 dan Krowal setelah perlakuan Al 60 ppm selama 0, 6, 12, 24, dan 48 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Hasil analisis periode cekaman Al menunjukkan warna akar padi varietas IR64 lebih pekat dan lebih luas dibanding akar padi varietas Krowal. Gejala ini lebih jelas terlihat saat dibandingkan antara akar padi tanpa Al dengan akar padi yang telah mendapat cekaman Al 60 ppm selama 48 jam (Gambar 8).
Gambar 8 Perbandingan Analisis Histokimia peroksidasi lipid pada akar padi varietas IR64 dan Krowal setelah perlakuan Al 60 ppm selama 48 jam. Tanda panah menunjukkan batas terbentuknya kompleks warna merah.
Analisis Kuantitatif Peroksidasi Lipid
Malondyaldehyde (MDA) adalah produk akhir peroksidasi lipid, dan diakumulasi ketika tanaman mengalami cekaman oksidatif. Perlakuan cekaman Al meningkatkan konsentrasi MDA pada kedua varietas. Namun peningkatan konsentrasi MDA ini baru terlihat berbeda nyata pada perlakuan Al 60 ppm di-bandingkan dengan konsentrasi MDA pada perlakuan lainnya (Gambar 9). Al 0 60 0 60 ppm
IR64 Krowal
IR64 Krowal
0 48 0 48 0 6 12 24 48 0 6 12 24 48
1m
m
1m
m
1 mm
Gambar 9 Rata-rata konsentrasi MDA pada akar padi varietas IR64 dan Krowal setelah mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Rata-rata dari tiga ulangan.
Perbandingan konsentrasi MDA sebagai produk akhir peroksidasi lipid yang dilakukan pada padi varietas IR64 dengan kedelai varietas Lumut menunjukkan bahwa kedelai varietas Lumut mempunyai nilai yang jauh lebih tinggi dibandingkan padi varietas IR64 (Gambar 10). Hal ini menunjukkan bahwa pada perlakuan yang sama, padi lebih sedikit mengalami peroksidasi lipid dibanding kedelai akibat cekaman Al.
0 500 1000 1500 2000 2500 3000 0 45
Konse ntrasi Alumini um (ppm)
[M D A ] n m ol / g ak a r IR 64 Lumut
Gambar 10 Konsentrasi MDA pada akar padi varietas IR64 dan kedelai varietas Lumut pada konsentrasi cekaman Al 0 dan 45 ppm selama 24 jam.
Akar tanaman padi yang mendapat perlakuan Al 60 ppm, menunjukkan peningkatan konsentrasi MDA mulai jam ke-12, dan terus meningkat sampai jam ke-48 (Gambar 11). 0 50 100 150 200 250 300
0 6 12 24 48
Lama Pe rl akuan Al umuni um (jam)
[M D A ] n m ol
/ g a
k
ar
IR 64 Krowal
Gambar 11 Rata-rata konsentrasi MDA pada akar padi IR64 dan Krowal setelah mendapat cekaman Al 60 ppm selama 0, 6, 12, 24, dan 48 jam. Rata- rata dari tiga ulangan.
PEMBAHASAN
0 50 100 150 200 250 3000 15 30 45 60
Konse ntrasi Al umunium (ppm)
[M D A ] n m ol / g ak ar IR 64 Krowal
Penghambatan pemanjangan akar adalah gejala awal yang terlihat akibat cekaman Al. Pada penelitian ini, perlakuan cekaman Al telah dapat menghambat pertumbuhan akar pada konsentrasi Al 15 ppm. Menurut Matsumoto (1991), pemanjangan akar berhubungan dengan pembelahan dan pemanjangan sel. Aluminium yang masuk ke dalam sel dapat berikatan dengan gugus fosfat dari DNA yang menyebabkan terhambatnya proses replikasi pada mitosis sehingga pembelahan sel terhambat. Alumunium juga menyebabkan akumulasi polisakarida dinding sel, khususnya polisakarida hemiselulosa pada daerah pertumbuhan (Tabuchi dan Matsu-moto, 2001) yang berakibat pada penebalan dinding sel. Selain itu, Al3+ berinteraksi dengan pektin yang berada pada dinding sel menggantikan posisi Ca menyebabkan dinding sel kaku dan menghambat proses pertukaran kation, sehingga sel tidak dapat membesar dan memanjang (Blamey et al.
1993).
Kollmeier et al. (2000) menemukan bahwa Al3+ juga dapat menyebabkan penghambatan transport auksin ke pangkal akar yang diduga sebagai salah satu mekanisme Al3+ dalam menginduksi penghambatan pemanjangan sel akar. Namun mekanisme penghambatannya belum diketahui dengan pasti. Selain mengalami penghambatan pertumbuhan, akar tanaman yang mendapat perlakuan Al juga terlihat lebih tebal atau gemuk, serta lebih sedikit jumlah akar sampingnya bila dibandingkan dengan akar tanaman yang tidak mendapat perlakuan Al (Gambar 2). Hal ini terjadi pada varietas IR64 dan Krowal yang menunjukkan bahwa keduanya mempunyai respon pertumbuhan akar yang sama terhadap cekaman Al.
Gambar 9 Rata-rata konsentrasi MDA pada akar padi varietas IR64 dan Krowal setelah mendapat cekaman Al 0, 15, 30, 45, dan 60 ppm selama 24 jam. Rata-rata dari tiga ulangan.
Perbandingan konsentrasi MDA sebagai produk akhir peroksidasi lipid yang dilakukan pada padi varietas IR64 dengan kedelai varietas Lumut menunjukkan bahwa kedelai varietas Lumut mempunyai nilai yang jauh lebih tinggi dibandingkan padi varietas IR64 (Gambar 10). Hal ini menunjukkan bahwa pada perlakuan yang sama, padi lebih sedikit mengalami peroksidasi lipid dibanding kedelai akibat cekaman Al.
0 500 1000 1500 2000 2500 3000 0 45
Konse ntrasi Alumini um (ppm)
[M D A ] n m ol / g ak a r IR 64 Lumut
Gambar 10 Konsentrasi MDA pada akar padi varietas IR64 dan kedelai varietas Lumut pada konsentrasi cekaman Al 0 dan 45 ppm selama 24 jam.
Akar tanaman padi yang mendapat perlakuan Al 60 ppm, menunjukkan peningkatan konsentrasi MDA mulai jam ke-12, dan terus meningkat sampai jam ke-48 (Gambar 11). 0 50 100 150 200 250 300
0 6 12 24 48
Lama Pe rl akuan Al umuni um (jam)
[M D A ] n m ol
/ g a
k
ar
IR 64 Krowal
Gambar 11 Rata-rata konsentrasi MDA pada akar padi IR64 dan Krowal setelah mendapat cekaman Al 60 ppm selama 0, 6, 12, 24, dan 48 jam. Rata- rata dari tiga ulangan.
PEMBAHASAN
0 50 100 150 200 250 3000 15 30 45 60
Konse ntrasi Al umunium (ppm)
[M D A ] n m ol / g ak ar IR 64 Krowal
Penghambatan pemanjangan akar adalah gejala awal yang terlihat akibat cekaman Al. Pada penelitian ini, perlakuan cekaman Al telah dapat menghambat pertumbuhan akar pada konsentrasi Al 15 ppm. Menurut Matsumoto (1991), pemanjangan akar berhubungan dengan pembelahan dan pemanjangan sel. Aluminium yang masuk ke dalam sel dapat berikatan dengan gugus fosfat dari DNA yang menyebabkan terhambatnya proses replikasi pada mitosis sehingga pembelahan sel terhambat. Alumunium juga menyebabkan akumulasi polisakarida dinding sel, khususnya polisakarida hemiselulosa pada daerah pertumbuhan (Tabuchi dan Matsu-moto, 2001) yang berakibat pada penebalan dinding sel. Selain itu, Al3+ berinteraksi dengan pektin yang berada pada dinding sel menggantikan posisi Ca menyebabkan dinding sel kaku dan menghambat proses pertukaran kation, sehingga sel tidak dapat membesar dan memanjang (Blamey et al.
1993).
Kollmeier et al. (2000) menemukan bahwa Al3+ juga dapat menyebabkan penghambatan transport auksin ke pangkal akar yang diduga sebagai salah satu mekanisme Al3+ dalam menginduksi penghambatan pemanjangan sel akar. Namun mekanisme penghambatannya belum diketahui dengan pasti. Selain mengalami penghambatan pertumbuhan, akar tanaman yang mendapat perlakuan Al juga terlihat lebih tebal atau gemuk, serta lebih sedikit jumlah akar sampingnya bila dibandingkan dengan akar tanaman yang tidak mendapat perlakuan Al (Gambar 2). Hal ini terjadi pada varietas IR64 dan Krowal yang menunjukkan bahwa keduanya mempunyai respon pertumbuhan akar yang sama terhadap cekaman Al.
sistem pertumbuhannya sehingga masih tetap dapat bertahan hidup walaupun telah mendapat cekaman Al.
Selain menghambat pertumbuhan akar, Al3+ dapat menyebabkan peroksidasi lipid serta kerusakan membran (Cakmak dan Horst 1991). Malondyaldehyde (MDA) adalah produk oksidasi lipid membran, dan keberadaannya bisa menunjukkan tingkat cekaman oksidatif yang dialami tanaman. Pada penelitian ini, konsentrasi MDA meningkat secara signifikan ketika tanaman mendapat perlakuan Al 60 ppm. Hal ini menunjukkan bahwa cekaman Al 60 ppm menyebabkan tanaman mengalami cekaman oksidatif dan peroksidasi lipid pada membran. Nilai MDA yang diperoleh dari penelitian ini berbeda dengan hasil penelitian-penelitian sejenis sebelumnya yang dilakukan oleh Cakmak dan Horst (1991) pada tanaman kedelai (Glycine max L.) dan Yamamoto et al.
(2001) pada tanaman kapri (Pisum sativum
L.). Menurut hasil penelitian mereka, akar tanaman yang diberi perlakuan Al mengalami peningkatan peroksidasi lipid yang meningkat seiring dengan meningkatnya konsentrasi Al yang diberikan pada media tumbuh. Sedangkan pada padi, perlakuan Al 15, 30, dan 45 ppm tidak mempengaruhi peroksidasi lipid pada kedua varietas. Pada ketiga konsentrasi cekaman Al tersebut, kedua varietas tanaman belum mengalami cekaman oksidatif yang cukup berarti.
Kenyataan ini berbeda dengan hasil analisis kuantitatif peroksidasi lipid yang dilakukan terhadap kedelai varietas Lumut. Jika dibandingkan dengan tanaman padi IR64 dengan perlakuan cekaman Al yang sama (45 ppm), pembentukan MDA pada kedelai varietas Lumut jauh lebih tinggi. Hal ini menunjukkan bahwa membran sel padi lebih toleran terhadap peroksidasi lipid yang disebabkan oleh Al dibanding membran sel kedelai.
Pembentukkan MDA pada akar Krowal yang lebih rendah daripada MDA yang terbentuk pada akar IR64 menandakan bahwa pada perlakuan cekaman yang sama varietas Krowal mengalami cekaman oksidatif yang lebih rendah dibanding IR64.
Setiap spesies mempunyai mekanisme toleransi yang berbeda-beda terhadap cekaman Al. Begitupun dengan mekanisme terjadinya peroksidasi lipid pada membran plasma sebagai respon tanaman terhadap keberadaan Al. Mekanisme awal terjadinya
peroksidasi lipid disebabkan oleh terjadinya modifikasi struktur membran. Menurut Cakmak dan Horst (1991), modifikasi struktur membran karena interaksi Al3+ dengan protein dan lipid membran dapat meningkatkan produksi spesies oksigen reaktif (ROS) seperti O2- dan H2O2 dan peroksidasi lipid. Oksigen
radikal (O2-) berasal dari beberapa proses
metabolik seperti respirasi pada membran plasma. Sedangkan H2O2 diproduksi oleh
dismutasi enzimatik dan dismutasi spontan dari O2-. Kombinasi O2- dan H2O2,
membentuk radikal hidroksi reaktif tinggi yang menginisiasi rantai reaksi radikal bebas yang menghasilkan peroksidasi lipid. Hasil penelitian ini menunjukkan bahwa pada padi pun terdapat mekanisme toleransi tersendiri terhadap cekaman Al yang dapat menghambat terjadinya peroksidasi lipid. Sehingga pada konsentrasi cekaman Al yang pada tanaman lain (seperti kedelai) telah menyebabkan peningkatan peroksidasi lipid, peningkatan peroksidasi lipid masih dapat dihambat pada padi varietas IR64 dan Krowal.
Hasil analisis peroksidasi lipid pada penelitian ini tidak sejalan dengan hasil analisis root regrowth dimana penghambatan pemanjangan akar sudah terlihat pada cekaman Al 15 ppm, sedangkan peroksidasi lipid baru terlihat secara nyata pada konsentrasi Al 60 ppm. Penelitian Yamamoto
et al. (2001) menunjukkan bahwa pada Pisum sativum, peroksidasi lipid merupakan gejala yang tampak sebagai akibat cekaman Al, tapi bukan merupakan penyebab utama terjadinya penghambatan pemanjangan akar. Hasil penelitian tersebut sejalan dengan hasil penelitian ini yang juga membuktikan bahwa peroksidasi lipid bukan merupakan faktor utama penyebab penghambatan akar pada tanaman padi.
SIMPULAN DAN SARAN
Simpulansistem pertumbuhannya sehingga masih tetap dapat bertahan hidup walaupun telah mendapat cekaman Al.
Selain menghambat pertumbuhan akar, Al3+ dapat menyebabkan peroksidasi lipid serta kerusakan membran (Cakmak dan Horst 1991). Malondyaldehyde (MDA) adalah produk oksidasi lipid membran, dan keberadaannya bisa menunjukkan tingkat cekaman oksidatif yang dialami tanaman. Pada penelitian ini, konsentrasi MDA meningkat secara signifikan ketika tanaman mendapat perlakuan Al 60 ppm. Hal ini menunjukkan bahwa cekaman Al 60 ppm menyebabkan tanaman mengalami cekaman oksidatif dan peroksidasi lipid pada membran. Nilai MDA yang diperoleh dari penelitian ini berbeda dengan hasil penelitian-penelitian sejenis sebelumnya yang dilakukan oleh Cakmak dan Horst (1991) pada tanaman kedelai (Glycine max L.) dan Yamamoto et al.
(2001) pada tanaman kapri (Pisum sativum
L.). Menurut hasil penelitian mereka, akar tanaman yang diberi perlakuan Al mengalami peningkatan peroksidasi lipid yang meningkat seiring dengan meningkatnya konsentrasi Al yang diberikan pada media tumbuh. Sedangkan pada padi, perlakuan Al 15, 30, dan 45 ppm tidak mempengaruhi peroksidasi lipid pada kedua varietas. Pada ketiga konsentrasi cekaman Al tersebut, kedua varietas tanaman belum mengalami cekaman oksidatif yang cukup berarti.
Kenyataan ini berbeda dengan hasil analisis kuantitatif peroksidasi lipid yang dilakukan terhadap kedelai varietas Lumut. Jika dibandingkan dengan tanaman padi IR64 dengan perlakuan cekaman Al yang sama (45 ppm), pembentukan MDA pada kedelai varietas Lumut jauh lebih tinggi. Hal ini menunjukkan bahwa membran sel padi lebih toleran terhadap peroksidasi lipid yang disebabkan oleh Al dibanding membran sel kedelai.
Pembentukkan MDA pada akar Krowal yang lebih rendah daripada MDA yang terbentuk pada akar IR64 menandakan bahwa pada perlakuan cekaman yang sama varietas Krowal mengalami cekaman oksidatif yang lebih rendah dibanding IR64.
Setiap spesies mempunyai mekanisme toleransi yang berbeda-beda terhadap cekaman Al. Begitupun dengan mekanisme terjadinya peroksidasi lipid pada membran plasma sebagai respon tanaman terhadap keberadaan Al. Mekanisme awal terjadinya
peroksidasi lipid disebabkan oleh terjadinya modifikasi struktur membran. Menurut Cakmak dan Horst (1991), modifikasi struktur membran karena interaksi Al3+ dengan protein dan lipid membran dapat meningkatkan produksi spesies oksigen reaktif (ROS) seperti O2- dan H2O2 dan peroksidasi lipid. Oksigen
radikal (O2-) berasal dari beberapa proses
metabolik seperti respirasi pada membran plasma. Sedangkan H2O2 diproduksi oleh
dismutasi enzimatik dan dismutasi spontan dari O2-. Kombinasi O2- dan H2O2,
membentuk radikal hidroksi reaktif tinggi yang menginisiasi rantai reaksi radikal bebas yang menghasilkan peroksidasi lipid. Hasil penelitian ini menunjukkan bahwa pada padi pun terdapat mekanisme toleransi tersendiri terhadap cekaman Al yang dapat menghambat terjadinya peroksidasi lipid. Sehingga pada konsentrasi cekaman Al yang pada tanaman lain (seperti kedelai) telah menyebabkan peningkatan peroksidasi lipid, peningkatan peroksidasi lipid masih dapat dihambat pada padi varietas IR64 dan Krowal.
Hasil analisis peroksidasi lipid pada penelitian ini tidak sejalan dengan hasil analisis root regrowth dimana penghambatan pemanjangan akar sudah terlihat pada cekaman Al 15 ppm, sedangkan peroksidasi lipid baru terlihat secara nyata pada konsentrasi Al 60 ppm. Penelitian Yamamoto
et al. (2001) menunjukkan bahwa pada Pisum sativum, peroksidasi lipid merupakan gejala yang tampak sebagai akibat cekaman Al, tapi bukan merupakan penyebab utama terjadinya penghambatan pemanjangan akar. Hasil penelitian tersebut sejalan dengan hasil penelitian ini yang juga membuktikan bahwa peroksidasi lipid bukan merupakan faktor utama penyebab penghambatan akar pada tanaman padi.
SIMPULAN DAN SARAN
Simpulanperoksidasi lipid tidak berhubungan langsung dengan penghambatan panjang akar.
Saran
Diperlukan analisis anatomi akar untuk mengetahui tingkat kerusakan jaringan. Selain itu analisis peroksidasi lipid perlu dilakukan terhadap varietas padi toleran sehingga dapat diketahui mekanisme toksisitas Al pada padi.
DAFTAR PUSTAKA
Blamey FPC, Edwards DG, Asher CJ. 1993. Factors affecting aluminium sorption by calcium pectate. Plant and Soil. 113: 1447-1455
Cakmak I, Horst WJ. 1991. Effect of alu-minum on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycine max L.). PlantPhysiol 83: 463-468. Kollmeier M, Felle HH, Horst WJ. 2000.
Genotypical differences in aluminum resistance of maize are expressed in the distal part of the transition zone. Is reduced basipetal auxin flow involved in inhibition of root elongation by aluminium? Plant Physiol. 122: 945-956. Matsumoto H. 1991. Biochemical mechanism
of toxicity of aluminium and the sequestration of aluminium in plant cells.
Di dalam: Wright RJ, editor. Plant Soil Interaction at Low pH. Netherland: Kluwer Academic Publ. hal 825-838. Matsumoto H. 2000. Cell biology of
aluminum toxicity and tolerance in higher plants. Int Rev Cytol 200: 1-46.
Miftahudin, Scoles GJ, Gustafson JP. 2002. AFLP markers tightly linked to the aluminum tolerance gene Alt3 in rye (Secale sereale L.). Theor. Appl. Genet.
104:626-631.
Mihara M, Uchiyama M, Fukazawa K. 1980. Thiobarbituric acid value on fresh homogenate of rat as parameter of lipid peroxidation in aging, CCl4 intoxication
and vitamin edeficiency. Biochem Med
23:302-311.
Pompella LA, Maellaro E, Casini AF, Comporti M. 1987. Histochemical detec-tion of lipid peroxidadetec-tion in the liver of bromobenzene-poisoned mice. Am. J Pathol. 129:295-301.
Tabuchi A, Matsumoto H. 2001. Changes in cell wall properties of wheat (Triticum aestivum) roots during aluminum-induced growth inhibition. Physiol. Plant. 112: 353-358.
Yamamoto Y, Yukiko k, Hideaki M. 2001. Lipid peroxidation is an early symptom triggered by alumunium, but not primary cause of elongation inhibition in pea roots.
peroksida