KETERLIBATAN PROTEIN HETEROTRIMERIK G
α
TERHADAP
CEKAMAN ALUMINIUM PADA KEDELAI (
Glycine
max
(L) Merryl)
MELALUI STUDI HISTOKIMIA
Oleh :
Tuti Srimulyati
G34102009
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TUTI SRIMULYATI. Keterlibatan Protein Heterotrimerik G α terhadap Cekaman Aluminium pada Kedelai (Glycine max (L) Merryl) melalui Studi Histokimia. Dibimbing oleh UTUT WIDYASTUTI SUHARSONO dan JULIARNI.
Penelitian ini bertujuan menganalisis keterlibatan protein heterotrimerik G α pada mekanisme toleransi kedelai toleran kultivar Slamet dan peka Lumut terhadap cekaman alumunium (Al) melalui studi histokimia. Keterlibatan protein heterotrimerik G α terhadap cekaman aluminium dianalisis dari akar tanaman yang ditumbuhkan pada media hara kultur air pH 6.0, pH 4.0, pH 4.0 + 1.6 mM AlCl3 selama 8, 24, 48, dan 72 jam dan pH 4.0 + 1.6 mM AlCl3 + 30 µM Mastoparan 7 (sigma) (aktivator protein heterotrimerik G α) selama 8 dan 24 jam.
Pertama, pengaruh cekaman Al terhadap pertumbuhan akar kedelai dianalisis dengan menumbuhkan biji kedelai pada media hara kultur air pH 6.0, pH 4.0 dan pH 4.0 + 1.6 mM AlCl3 selama 8, 24, 48, dan 72 jam. Hasil menunjukkan bahwa cekaman Al selama 24 jam menyebabkan peningkatan reduksi panjang akar; akumulasi Al, kandungan peroksidasi lipid, dan kalosa; dan kehilangan integritas membran yang lebih tinggi pada kultivar Lumut daripada kultivar Slamet.
Keterlibatan protein heterotrimerik G α dalam respon terhadap cekaman Al dianalisis setelah penambahan Mastoparan 7 (sigma) pada cekaman Al selama 8 dan 24 jam. Reduksi panjang akar; akumulasi Al, kandungan peroksidasi lipid, dan kalosa; dan penurunan integritas membran menurun pada perlakuan 8 dan 24 jam baik pada kultivar Slamet maupun kultivar Lumut dibandingkan dengan perlakuan cekaman Al saja.
Hasil penelitian menunjukkan keterlibatan protein heterotrimerik G α terhadap cekaman Al pada kedelai.
ABSTRACT
TUTI SRIMULYATI. Role of The Heterotrimeric G Protein α Sub Unit in Aluminum Toxicity of Soybean through Histochemical Analyzes. Supervised by UTUT WIDYASTUTI SUHARSONO and JULIARNI.
The aim of this research was to examine the role of G protein α sub unit in aluminum toxicity of soybean cv. Slamet and cv. Lumut through histochemical study. Involvement of the heterotrimeric G protein α sub unit in the aluminum toxicity were investigated using plant root which grown in liquid nutrient media pH 6.0, pH 4.0, pH 4.0 + 1.6 mM AlCl3 for 8, 24, 48, and 72 h and pH 4.0 + 1.6 mM AlCl3 + 30 µM Mastoparan 7 (sigma) (the activator of heterotrimeric G protein α sub unit) for 8 and 24 h.
First, the influence of aluminum toxicity on root growth was examined by growing soybean seedling in liquid nutrient media with pH 6.0, pH 4.0 and pH 4.0 + 1.6 mM AlCl3 for 8, 24, 48, and 72 h. Result indicated that aluminum treatment for 24 h highly increased root elongation inhibition; accumulation of aluminum, lipid peroxidation, and callose; and loss of membrane integrity in cultivar Lumut compared to cv. Slamet.
To examine whether the heterotrimeric G protein α sub unit involved in response to aluminum toxicity, Mastoparan 7 (sigma) was applicated into aluminum treatment for 8 and 24 h. Root elongation inhibition; accumulation of aluminum, lipid peroxidation, and callose; and loss of membrane integrity were decreased at 8 and 24 h in cv. Slamet and cv. Lumut compared to aluminum treatment only.
KETERLIBATAN PROTEIN HETEROTRIMERIK G
α
TERHADAP
CEKAMAN ALUMINIUM PADA KEDELAI (
Glycine
max
(L) Merryl)
MELALUI STUDI HISTOKIMIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Insitut Pertanian Bogor
Oleh :
Tuti Srimulyati
G34102009
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Keterlibatan Protein Heterotrimerik G α terhadap Cekaman
Aluminium pada Kedelai (
Glycine max
(L) Merryl) melalui
Studi Histokimia
Nama
: Tuti Srimulyati
NIM
:
G34102009
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Ir Utut Widyastuti Suharsono, M.Si Dr. Ir. Juliarni, M.Agr
NIP 131851279 NIP 132216226
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP 131473999
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang pada tanggal 15 Februari 1984 dari ayah Karsoma dan ibu Mamah. Penulis merupakan anak ketiga dari tiga bersaudara.
Pada tahun 2002 penulis lulus dari SMU Negeri I Situraja, Sumedang dan diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan karya ilmiah yang berjudul Keterlibatan Protein Heterotrimerik G α terhadap Cekaman Aluminium pada Kedelai (Glycine max (L) Merryl) melalui Studi Histokimia. Penelitian ini dilaksanakan mulai bulan Februari sampai dengan Desember 2006, bertempat di laboratorium Biologi Seluler dan Molekuler, laboratorium Biorin (Biotechnology Research Indonesia-The Netherland) Pusat Penelitian Sumber Daya Hayati dan Bioteknologi IPB, dan laboratorium Anatomi dan Morfologi Tumbuhan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada proyek hibah bersaing XII atas nama Dr. Ir. Utut Widyastuti Suharsono, M.Si yang telah membiayai penelitian ini dengan topik Analisis Gen Penyandi Protein Heterotrimerik G α yang Terlibat dalam Sistem Toleransi Tanaman Kedelai terhadap Cekaman Aluminium.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Utut Widyastuti Suharsono, M.Si dan Ibu Dr. Ir. Juliarni, M.Agr selaku dosen pembimbing yang telah memberikan saran, dukungan dan bimbingannya selama pelaksanaan karya ilmiah ini. Tidak lupa terima kasih penulis ucapkan kepada Ibu Dr. Ir. Theresia Prawitasari selaku dosen penguji yang telah memberikan saran dan masukannya dalam penulisan karya ilmiah.
Terima kasih juga penulis sampaikan kepada Bapak Mulya, Bapak Adi, Mba Pepi, Ibu Dorly, Ibu Liza, Bapak Bambang, Bapak Wawan, Ibu Siti Maemunah, Mba Retno, Bapak Edi dan Bapak Joni yang telah membantu kelancaran pelaksanaan karya ilmiah.
Ungkapan terima kasih juga penulis ucapkan kepada mamah, bapak, kedua kakakku beserta keluarga, keluarga paman di Bogor dan A Lukman atas segala doa, semangat, perhatian dan kasih sayangnya. Tidak lupa terima kasih untuk mas Huda, mas Firda, M Bahrelfi, Hakiim, mba Rida, mba Budi, Lulut, Uzy, Popi, Ammay dan semua rekan di laboratorium Biologi Seluler dan Molekuler Tanaman dan laboratorium BIORIN atas segala bantuan dan kerjasamanya. Terima kasih juga penulis sampaikan untuk Neng Nur, Wida, Dessy, Ela, Ade, Ayu, Lena dan teman biologi 39 atas dukungan semangat dan bantuannya.
Bogor, Maret 2007
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE Kultur Air ... 1
Pengamatan Panjang Akar ... 1
Uji Histokimia Kandungan Aluminium... 1
Pembuatan Sediaan Mikroskopis Akar... 2
Uji Histokimia Kandungan Peroksidasi Lipid... 2
Uji Histokimia Kandungan Kalosa ... 2
Uji Histokimia Kehilangan Integritas Membran ... 2
Kuantifikasi Kandungan Aluminium... 2
Kuantifikasi Kandungan Peroksidasi Lipid ... 2
Kuantifikasi Kandungan Kalosa ... 2
Kuantifikasi Kandungan Kehilangan Integritas Membran... 2
HASIL DAN PEMBAHASAN Hasil... 3
Pengaruh Cekaman Aluminium... 3
Pengaruh Mastoparan terhadap Cekaman Aluminium... 7
Pembahasan ... 10
Pengaruh Cekaman Aluminium... 10
Pengaruh Mastoparan terhadap Cekaman Aluminium... 12
SIMPULAN... 13
DAFTAR TABEL
Halaman
1 Reduksi perpanjangan akar tanaman perlakuan dibandingkan dengan tanaman
kontrol pH 4... 3
2 Reduksi perpanjangan akar tanaman perlakuan dibandingkan dengan tanaman kontrol pH 4 + 1.6 mM Al ... 7
DAFTAR GAMBAR
Halaman 1 Uji histokimia Al dengan pewarnaan hematoksilin pada akar... 32 Kandungan Al akar... 4
3 Sayatan melintang akar pada daerah 3 mm dari ujung akar... 4
4 Uji histokimia peroksidasi lipid dengan larutan Schiff,s pada akar... 4
5 Kandungan peroksidasi lipid akar... 5
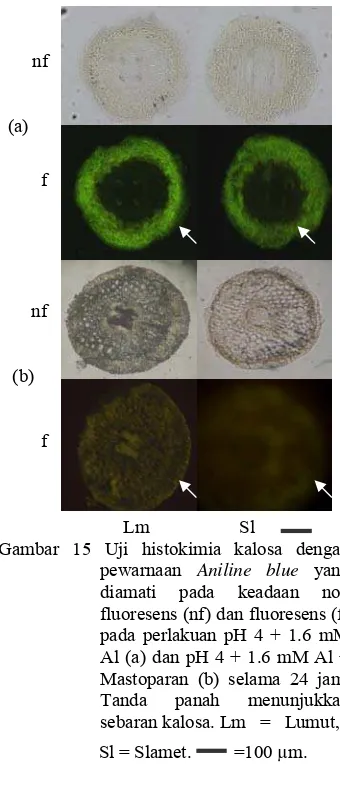
6 Uji histokimia kalosa dengan pewarnaan Aniline blue yang diamati pada keadaan non fluoresens (nf) dan fluoresens (f). ... 5
7 Kandungan kalosa akar ... 6
8 Uji histokimia integritas membran dengan pewarnaan Evans blue pada akar. ... 6
9 Kehilangan integritas membran akar ... 6
10 Sayatan melintang akar pada daerah 3 mm dari ujung akar yang diwarnai dengan hematoksilin... 7
11 Uji histokimia kandungan Al akar pada perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam. ... 7
12 Kandungan Al akar tanpa dan dengan penambahan Mastoparan selama 24 jam... 8
13 Kandungan peroksidasi lipid akar tanpa dan dengan penambahan Mastoparan selama 24 jam ... 8
14 Uji histokimia peroksidasi lipid akar dengan pewarnaan Schiff,s pada perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam... 9
15 Uji histokimia kalosa dengan pewarnaan Aniline blue yang diamati pada keadaan non fluoresens (nf) dan fluoresens (f) pada perlakuanpH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam... 9
16 Kandungan kalosa akar tanpa dan dengan penambahan Mastoparan selama 24 jam. ... 9
17 Uji histokimia kehilangan integritas membran dengan pewarnaan Evans blue pada perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam... 10
PENDAHULUAN
Latar Belakang
Biji kedelai (Glycine max) merupakan salah satu produk pertanian yang memiliki tingkat permintaan yang tinggi di masyarakat. Upaya peningkatan produksi kedelai dapat dilakukan melalui program intensifikasi dan ekstensifikasi. Namun program ekstensifikasi menghadapi beberapa kendala dalam pelaksanaannya yaitu meningkatnya perubahan fungsi lahan pertanian antara lain menjadi pemukiman, jalan, dan industri. Di samping itu sebagian lahan yang berpotensi untuk pengembangan kedelai terutama lahan di luar pulau jawa merupakan lahan masam dengan kandungan aluminium (Al) yang tinggi. Menurut Mulyani (2006) lahan yang berpotensi dalam pengembangan kedelai di daerah Sumatra, Kalimantan, dan Papua mencapai 18.2 juta ha termasuk lahan masam. Lahan yang memiliki pH rendah (pH < 4) memiliki tingkat kelarutan Al sangat tinggi. Salah satu bentuk Al yang bersifat toksik bagi tumbuhan yaitu Al3+ (Matsumoto 2000).
Cekaman Al dapat menurunkan integritas membran, menginduksi pembentukan peroksidasi lipid dan kalosa sehingga menghambat pertumbuhan perpanjangan akar primer tumbuhan (Yamamoto et al. 2001). Selain itu cekaman Al dapat menginduksi sejumlah gen yang berperan dalam sistem pertahanan tumbuhan. Salah satu gen yang diduga terlibat yaitu protein heterotrimerik G α (Asmann 2002). Menurut Weiss et al. (1997) protein heterotrimerik G α ditemukan pada membran sel Arabidopsis.
Protein G merupakan salah satu protein yang berperan dalam sistem transduksi sinyal. Protein ini terdiri atas 3 sub unit yaitu α, β, dan γ; dan berperan sebagai penerus penyampaian informasi dari reseptor membran ke efektor intraseluler (Ma 1994). Sinyal yang datang dari luar akan berikatan dengan reseptor yang ada di membran; dan mengaktifkan protein G yang ada di membran. Perubahan konformasi protein G menyebabkan terputusnya ikatan guanosin diphosphate (GDP) dengan sub unit α. Sub unit α akan berpisah dengan kompleks β dan γ, kemudian berikatan dengan guanosin triphosphate (GTP) dan mengaktivasi adenylil cyclase dalam mengubah adenosin triphosphate (ATP) menjadi cyclic adenosin monophosphate (cAMP). cAMP merupakan second messenger yang mengaktifkan protein
kinase yaitu enzim yang memfosforilasi protein target yang berpengaruh dalam sistem metabolisme yang berperan dalam sistem pertahanan (Sadava 1993). Oleh karena itu akan sangat menarik untuk melihat keterlibatan protein heterotrimerik G α pada sistem pertahanan tumbuhan terhadap cekaman Al.
Tujuan
Penelitian ini bertujuan menganalisis keterlibatan protein heterotrimerik G α pada mekanisme toleransi kedelai kultivar Slamet dan Lumut terhadap cekaman aluminium melalui studi histokimia.
BAHAN DAN METODE
Kultur Air
Benih kultivar Slamet dan Lumut yang memiliki ukuran yang seragam disterilisasi dengan NaOCl 1.5 % (b/v) selama 15 menit, kemudian dicuci dengan air steril sebanyak 3 kali. Benih dikecambahkan di dalam wadah yang telah dialasi dengan tisu basah kemudian disimpan di dalam ruang gelap selama 48 jam. Kecambah yang memiliki panjang akar lebih kurang 3 cm ditanam di trays, kemudian trays ditempatkan di dalam bak plastik berisi media hara pH 6.0 (Anwar 1999) selama 48 jam dengan aerasi.
Pada hari ke-3 (jam ke-0) media diganti dengan media perlakuan yaitu pH 6.0 tanpa cekaman Al (kontrol), pH 4.0 tanpa cekaman Al , pH 4.0 + 1.6 mM AlCl3,dan pH 4.0 + 1.6 mM AlCl3 + 30 μM Mastoparan 7 (sigma) (aktivator G α). Perlakuan dengan Mastoparan hanya dilakukan sampai jam ke-24, sedangkan tiga perlakuan lainnya dilakukan selama 72 jam. Media perlakuan diganti setiap 24 jam. Penentuan konsentrasi cekaman Al didasarkan pada hasil penelitian sebelumnya (Anwar 1999; Mashuda 2006).
Pengamatan Panjang Akar
Akar tanaman diukur panjangnya dari ujung sampai bagian pangkal sebanyak 3 ulangan. Satu ulangan terdiri atas 5 akar.
Uji Histokimia Alumunium
Pembuatan Sediaan Mikroskopis Akar
Lima akar tanaman sepanjang 10 mm dari setiap perlakuan diwarnai dengan hematoksilin 0.2 % (b/v) dalam akuades selama 15 menit. Kelima akar tersebut kemudian dicuci dengan air selama 30 menit, dipotong sepanjang 5 mm dan difiksasi di dalam larutan FAA (formaldehid 37% (v/v):asam asetat glasial:alkohol 70%(v/v)=5:5:90) selama 24 jam. Akar yang telah difiksasi dimasukkan ke dalam seri larutan dehidrasi yang terdiri atas n-butanol-alkohol-akuades (Nakamura 1995). Infiltrasi parafin dilakukan secara bertahap. Blok parafin dipotong setebal 10 μm. Pita sayatan diletakkan di atas gelas objek, ditetesi balsam (Entellan) dan ditutup dengan gelas penutup. Parameter yang diamati adalah akumulasi Al pada jaringan akar.
Uji Histokimia Peroksidasi Lipid
Tiga akar tanaman sepanjang 10 mm dari setiap perlakuan diwarnai dengan larutan Schiff’s selama 20 menit, dibilas dengan larutan potasium metabisulfit ( K2S2O5 0.5 % (b/v) dalam 0.05 M HCl ) (Pompella et al.1987), kemudian diamati dengan mikroskop stereo (Olympus VE-3).
Uji Histokimia Kalosa
Lima akar tanaman sepanjang 5 mm dari setiap perlakuan dipotong melintang, ditetesi dengan Aniline blue 0.1 % (b/v) dalam larutan penyangga 1 M Gly-NaOH pH 9.5 (Kauss 1992) dan diberi gliserin 30%, kemudian diamati dengan mikroskop fluoresens (Olympus CX40RF200).
Uji Histokimia Kehilangan Integritas Membran
Tiga akar tanaman sepanjang 10 mm dari tiap perlakuan diwarnai dengan Evans blue 0.025% (b/v) dalam 100 µM CaCl2 pH 5.6 selama 10 menit, dicuci dengan 100 µM CaCl2 pH 5.6 sebanyak 3 kali (Yamamoto et
al. 2001), kemudian diamati dengan mikroskop stereo (Olympus VE-3).
Kuantifikasi Kandungan Alumunium
Bagian ujung akar sepanjang 10 mm dikeringkan menggunakan oven suhu 500 C selama semalam (12 jam). Sampel akar tersebut ditimbang, dimasukkan ke dalam 5 ml HNO3 pekat, didiamkan semalam; kemudian dipanaskan sampai campuran berwarna bening. Homogenate akar
diencerkan dengan akuades sampai volume 25 ml dan diukur menggunakan spektro absorpsi atom (Spectra-A30) (Cunniff 1999).
Kuantifikasi Kandungan Peroksidasi Lipid
Empat akar dipotong sepanjang 10 mm dari ujung akar, dihaluskan di dalam mortar dan ditambahkan 0.5 ml larutan TCA 15 % (b/v) yang mengandung 1 mM butil hidroksitoluen. Homogenate ditambahkan ke dalam 0.375 ml larutan H3PO4 2% (v/v) dan 0.25 ml thio barbituric acid (TBA) 0.6% (b/v). Campuran diinkubasi pada suhu 1000 C selama 30 menit, kemudian didinginkan pada suhu ruang. Campuran ditambahkan 1 ml n-butanol kemudian dikocok. Butanol dan fase cair dipisahkan dengan cara disentrifugasi. Malondialdehyde (MDA) merupakan produk akhir peroksidasi lipid. Absorbansi TBA-MDA kompleks diukur dengan menggunakan spektrofotometer (Cecil CE 2020) pada λ 532 nm dan komponen karbohidrat lainnya selain MDA diukur pada panjang gelombang 520 nm. Selisih nilai dari kedua panjang gelombang dihitung sebagai nilai MDA (Mihara et al. 1980).
Kuantifikasi Kandungan Kalosa
Sebanyak 20 akar diinkubasi di dalam etanol 96% selama 1 jam, kemudian dipotong sepanjang 10 mm dari ujung akar. Potongan akar dihaluskan di dalam mortar dan ditambahkan 1 ml NaOH 1M. Homogenate dipanaskan pada suhu 800 C selama 15 menit, didinginkan, dan disentrifugasi. Supernatan dan pelet dipisahkan. Pelet ditambahkan 250 µl NaOH 1M dan dipanaskan pada suhu 800 C selama 5 menit. Pelet ditambah 400 µl Aniline blue 0.1%, 200 µl HCl 1 N, dan 500 µl buffer Gly-NaOH pH 9.5. Sampel dipanaskan pada suhu selama 20 menit kemudian disimpan pada suhu ruang dan diukur dengan spektro fluoresens (OSK 6561) pada panjang gelombang 484 nm (Kohle et al. 1985).
Kuantifikasi Kehilangan Integritas Membran
HASIL DAN PEMBAHASAN
Hasil
Pengaruh Cekaman Aluminium
Penghambatan panjang akar.
Perlakuan cekaman 1.6 mM Al menyebabkan reduksi perpanjangan akar baik pada kultivar Slamet maupun kultivar Lumut. Kultivar peka Lumut mengalami reduksi perpanjangan akar (77%-89%) lebih besar daripada kultivar toleran Slamet (70%-86%). Perbedaan pH dapat menyebabkan perbedaan pertumbuhan akar. Pada perlakuan pH 6 tidak terjadi reduksi perpanjangan akar. Hal ini ditunjukkan dengan nilai reduksi perpanjangan akar yang negatif. Akar tumbuhan kedelai pH 6 lebih panjang daripada akar kedelai pH 4. Lamanya waktu cekaman Al menyebabkan peningkatan penghambatan panjang akar (Tabel 1).
Kandungan aluminium
.
Perlakuancekaman 1.6 mM Al menyebabkan kandungan Al yang tinggi pada kedua kultivar. Kultivar Lumut memiliki kandungan Al lebih tinggi dibandingkan dengan kultivar Slamet yang ditunjukkan dengan warna merah pekat hematoksilin setelah perlakuan cekaman Al selama 24 jam (Gambar 1).
Kandungan Al pada akar kedua kultivar semakin tinggi dengan semakin meningkatnya waktu cekaman. Kultivar Lumut memiliki kandungan Al lebih tinggi daripada kultivar Slamet sampai 48 jam setelah perlakuan cekaman, namun kandungan Al cenderung sama pada 72 jam setelah
Lm Sl Lm Sl Lm Sl Lm Sl (a) (b) (c) (d)
Uji histokimia Al dengan pewarnaan hematoksilin pada akar. Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al, jam ke-24 (d). Tanda panah menunjukkan akumulasi Al pada akar. Lm = Lumut, Sl = Slamet.
perlakuan cekaman. Akar tanaman yang direndam pada pH 6 dan 4 memiliki kandungan Al paling sedikit. Diduga kandungan tersebut berasal dari kontaminasi ion Cl- pada saat mengatur pH media (Gambar 2). Cekaman Al dapat menyebabkan luka pada akar. Pelukaan akar terlihat pada daerah 3-5 mm dari ujung akar. Kerusakan akar yang lebih parah terjadi pada daerah 3 mm dari ujung akar daripada daerah 5 mm dari ujung akar. Kerusakan jaringan akar pada kultivar Lumut terjadi sampai ke lapisan dalam korteks, sedangkan pada kultivar Slamet terjadi hanya pada bagian luar korteks (Gambar 3).
Reduksi perpanjangan akar dibandingkan dengan tanaman kontrol pH 4 pH 4 pH 6 pH 4+ 1.6 mM Al * PPA (cm) RPA (%) PPA (cm) RPA (%) PPA (cm) RPA (%) Lama
Cekaman
Sl Lm Sl Lm Sl Lm Sl Lm Sl Lm Sl Lm
8 Jam 1.33 1.12 100 100 1.6 1.18 -20 -5 0.4 0.26 70 77 24 Jam 2.86 2.33 100 100 3.29 2.58 -15 -10 0.71 0.42 75 82 48 Jam 5.2 3.85 100 100 5.95 4.84 -14 -20 0.87 0.5 83 87 72 Jam 6.69 5.19 100 100 7.86 6.1 -17 -18 0.95 0.58 86 89 Tabel 1 Reduksi perpanjangan akar tanaman perlakuan (pH 4 + 1.6 mM Al) dibandingkan
dengan tanaman kontrol pH 4
* PPA : Pertambahan Panjang Akar = Panjang akar jam ke-t – Panjang akar jam ke-0
RPA : Reduksi Perpanjangan Akar terhadap perlakuan pH 4 = PPA pH 4 – PPA perlakuan X 100% PPA pH 4
Sl : Slamet
(a)
(b)
(c)
(d)
Lm Sl Gambar 3 Sayatan melintang akar pada daerah
3 mm dari ujung akar.
Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan, pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al, jam ke-24 (d). Tanda panah menunjukkan jaringan akar yang rusak. Lm = Lumut, Sl = Slamet. = 100
μm.
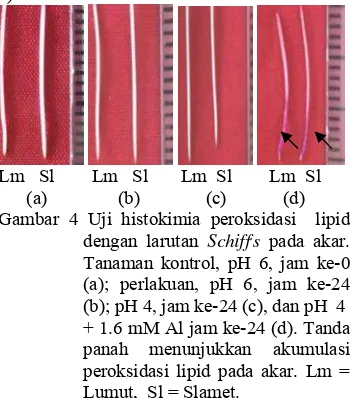
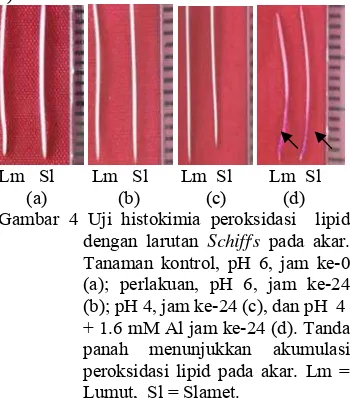
Kandungan peroksidasi lipid. Perlakuan cekaman 1.6 mM Al menyebabkan kandungan peroksidasi lipid yang tinggi padakedua kultivar. Kultivar Lumut memiliki kandungan
peroksidasi lipid lebih tinggi dibandingkan dengan kultivar Slamet. Hal ini ditunjukkan dengan akar yang berwarna merah setelah diwarnai dengan larutan Schiff,s selama 24 jam. Warna akar kultivar Lumut lebih pekat daripada warna akar kultivar Slamet (Gambar 4).
Lm Sl Lm Sl Lm Sl Lm Sl (a) (b) (c) (d) Gambar 4 Uji histokimia peroksidasi lipid
dengan larutan Schiff,s pada akar. Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan, pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al jam ke-24 (d). Tanda panah menunjukkan akumulasi peroksidasi lipid pada akar. Lm = Lumut, Sl = Slamet.
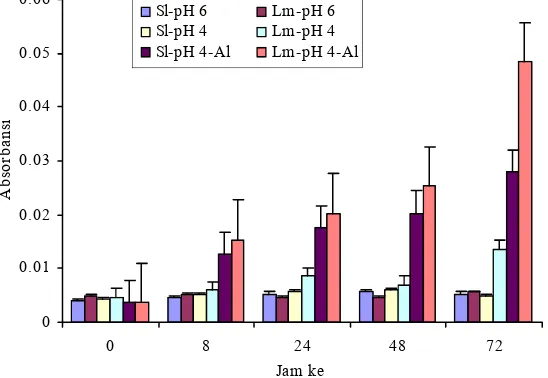
Peroksidasi lipid pada kultivar Lumut meningkat mulai jam ke-0 sampai jam ke-24 dan menurun mulai jam ke-48, sedangkan pada kultivar Slamet peningkatan kandungan peroksidasi lipid terjadi mulai jam ke-0 sampai jam ke-48 dan penurunan terjadi mulai jam ke-72. Peningkatan peroksidasi lipid pada kultivar Lumut lebih tinggi daripada kultivar Slamet. Kedua kultivar memiliki kandungan peroksidasi lipid yang rendah pada pH 6 dan 4 (Gambar 5).
Gambar 2 Kandungan Al akar. Lm = Lumut, Sl = Slamet.
0 2 4 6 8 10 12
0 8 24 48 72
Jam ke
m
g
A
l/g
a
k
a
r
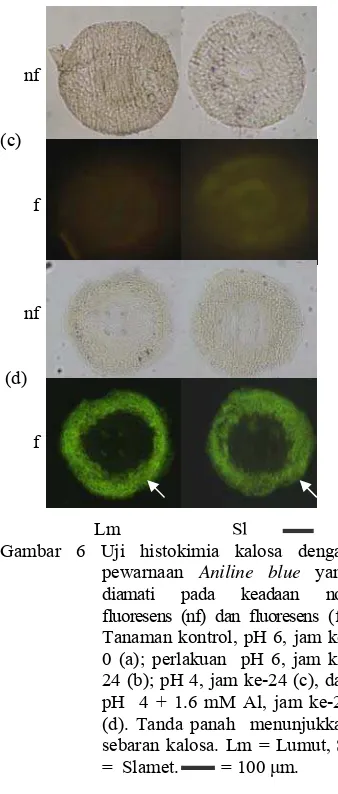
Kandungan kalosa. Cekaman Al menyebabkan peningkatan kandungan kalosa pada kedua kultivar. Kultivar Lumut memiliki kandungan kalosa lebih tinggi dibandingkan dengan kultivar Slamet. Hal ini dapat dilihat dari jaringan akar yang berpendar jika diamati dengan mikroskop fluoresens. Jaringan akar kultivar Lumut pada daerah 1-5 mm berpendar lebih pekat daripada akar kultivar Slamet (Gambar 6).
nf
(a)
f
nf
(b) nf
f
nf
(c)
f
nf
(d)
f
Lm Sl Gambar 6 Uji histokimia kalosa dengan
pewarnaan Aniline blue yang diamati pada keadaan non fluoresens (nf) dan fluoresens (f). Tanaman kontrol, pH 6, jam 0 (a); perlakuan pH 6, jam ke-24 (b); pH 4, jam ke-ke-24 (c), dan pH 4 + 1.6 mM Al, jam ke-24 (d). Tanda panah menunjukkan sebarankalosa. Lm = Lumut, Sl = Slamet. = 100 μm.
Gambar 5 Kandungan peroksidasi lipid akar. Lm = Lumut, Sl = Slamet. 0
2 4 6 8 10 12 14
0 8 24 48 72
Jam ke
n
M
M
D
A
/cm
ak
a
r
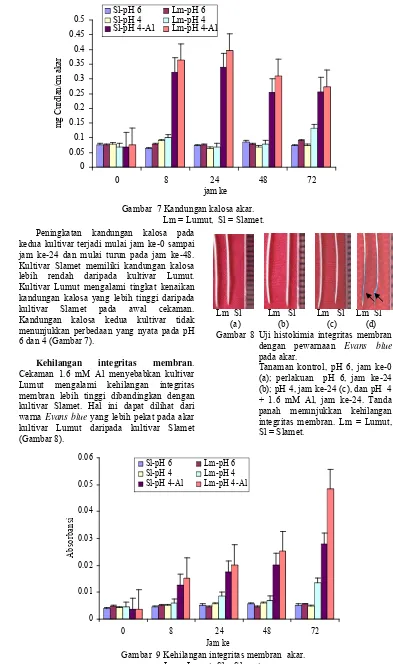
Peningkatan kandungan kalosa pada kedua kultivar terjadi mulai jam ke-0 sampai jam ke-24 dan mulai turun pada jam ke-48. Kultivar Slamet memiliki kandungan kalosa lebih rendah daripada kultivar Lumut. Kultivar Lumut mengalami tingkat kenaikan kandungan kalosa yang lebih tinggi daripada kultivar Slamet pada awal cekaman. Kandungan kalosa kedua kultivar tidak menunjukkan perbedaan yang nyata pada pH 6 dan 4 (Gambar 7).
Kehilangan integritas membran.
Cekaman 1.6 mM Al menyebabkan kultivar Lumut mengalami kehilangan integritas membran lebih tinggi dibandingkan dengan kultivar Slamet. Hal ini dapat dilihat dari warna Evans blue yang lebih pekat pada akar kultivar Lumut daripada kultivar Slamet (Gambar 8).
Lm Sl Lm Sl Lm Sl Lm Sl (a) (b) (c) (d) Gambar 8 Uji histokimia integritas membran
dengan pewarnaan Evans blue pada akar.
Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al, jam ke-24. Tanda panah menunjukkan kehilangan integritas membran. Lm = Lumut, Sl = Slamet.
Gambar 7 Kandungan kalosa akar. Lm = Lumut, Sl = Slamet.
Gambar 9 Kehilangan integritas membran akar. Lm = Lumut, Sl = Slamet.
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
0 8 24 48 72
jam ke
m
g
C
u
rd
la
n
/c
m
ak
ar
Sl-pH 6 Lm-pH 6 Sl-pH 4 Lm-pH 4 Sl-pH 4-Al Lm-pH 4-Al
0 0.01 0.02 0.03 0.04 0.05 0.06
0 8 24 48 72
Jam ke
A
b
so
rb
an
si
Sl-pH 6 Lm-pH 6
Sl-pH 4 Lm-pH 4
Penurunan kehilangan integritas membran semakin naik seiring dengan lamanya cekaman Al. Kehilangan integritas membran pada kultivar Lumut lebih tinggi daripada kultivar Slamet. Kedua kultivar mengalami sedikit kehilangan integritas membran pada pH 6 dan 4 (Gambar 9).
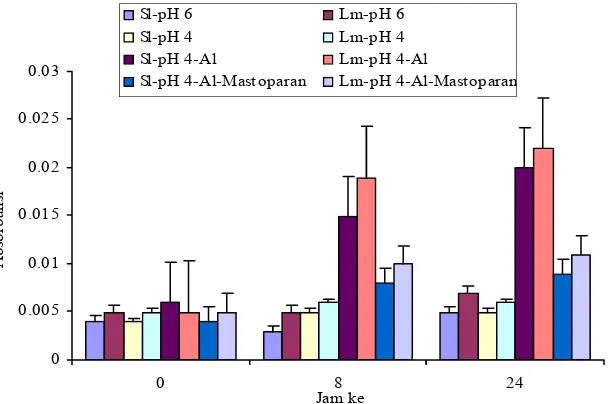
Pengaruh Mastoparan terhadap Cekaman Aluminium
Penghambatan panjang akar.
Mastoparan 7 (sigma) merupakan aktivator protein heterotrimerik G α sehingga protein ini berada dalam keadaan aktif mengikat GTP (Assmann 2002). Penambahan Mastoparan (30 µM) dapat menurunkan reduksi perpanjangan akar pada kedua kultivar. Kultivar Lumut mengalami tingkat
(a)
(b)
Lm Sl Gambar 10 Sayatan melintang akar pada
daerah 3 mm dari ujung akar yang diwarnai dengan hematoksilin.
Perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6mM Al +
Mastoparan (b) selama 24 jam.
Lm = Lumut, Sl = Slamet. = 100 μm.
penurunan perpanjangan akar lebih tinggi dibandingkan dengan kultivar Slamet (Tabel 2).
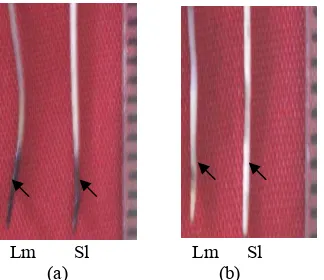
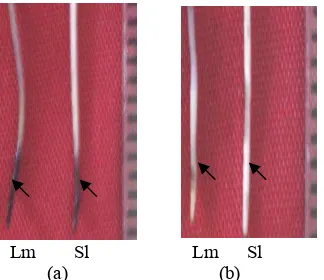
Perlakuan cekaman Al tanpa penambahan Mastoparan menyebabkan luka pada jaringan akar baik pada kultivar Lumut maupun kultivar Slamet. Penambahan Mastoparan (30 µM) mengakibatkan tidak terdapatnya kerusakan jaringan akar pada kedua kultivar (Gambar 10) dan menurunkan kandungan Al pada kedua kultivar. Hal ini ditunjukkan dengan sedikitnya penyerapan warna hematoksilin pada kedua kultivar pada perlakuan penambahan Mastoparan dibandingkan dengan perlakuan cekaman Al (Gambar 11). Kultivar Slamet memiliki kandungan Al lebih rendah daripada kultivar Lumut (Gambar 12).
Lm Sl Lm Sl (a) (b)
Gambar 11 Uji histokimia kandungan Al akar pada perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam. Tanda panah menunjukkan
akumulasi Al pada akar. Lm = Lumut, Sl = Slamet.
Reduksi perpanjangan akar dibandingkan dengan tanaman kontrol pH 4 + 1.6 mM Al
pH 4+ 1.6 mM Al pH 4+1.6 mM Al+Mastoparan * PPA (cm) RPA (%) PPA (cm) RPA (%) Lama
Cekaman
Sl Lm Sl Lm Sl Lm Sl Lm
8 Jam 0.29 0.16 100 100 0.34 0.26 -17 -63 24 Jam 0.52 0.28 100 100 0.69 0.6 -33 -114
* PPA : Pertambahan Panjang Akar = Panjang akar jam ke-t – Panjang akar jam ke-0
RPA : Reduksi Perpanjangan Akar terhadap perlakuan pH 4 + 1.6 mM Al = PPA pH 4+1.6 mM Al – PPA perlakuan X 100% PPA pH 4+1.6 mM Al
Sl : Slamet Lm : Lumut
Kandungan peroksidasi lipid. Penambahan Mastoparan (30 µM) dapat menurunkan kandungan peroksidasi lipid pada akar. Hal ini ditunjukkan dengan sedikitnya penyerapan warna larutan Schiff,s pada akar
kedua kultivar. Akar kultivar Slamet menyerap warna lebih sedikit daripada akar kultivar Lumut (Gambar 14). Kultivar Slamet memiliki kandungan peroksidasi lipid lebih rendah daripada kultivar Lumut (Gambar 13). Gambar 12 Kandungan Al akar tanpa dan dengan penambahan Mastoparan
selama 24 jam.
Lm = Lumut, Sl = Slamet.
Gambar 13 Kandungan peroksidasi lipid akar tanpa dan dengan penambahan Mastoparan selama 24 jam.
Lm = Lumut, Sl = Slamet. 0
2 4 6 8 10 12 14
0 8 24
Jam ke
m
g
Al
/ g
ak
ar
Sl-pH 6 Lm-pH 6 Sl-pH 4 Lm-pH 4 Sl-pH 4-Al Lm-pH 4-Al
Sl-pH 4-Al-Mastoparan Lm-pH 4-Al-Mastoparan
0 2 4 6 8 10 12 14
0 8 24
Jam ke
n
M
M
D
A
/cm
ak
ar
Sl-pH 6 Lm-pH 6
Sl-pH 4 Lm-pH 4
Sl-pH 4-Al Lm-pH 4-Al
Lm Sl Lm Sl
(a) (b)
Gambar 14 Uji histokimia peroksidasi lipid akar dengan pewarnaan Schiff,s pada perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam. Tanda panah menunjukkan akumulasi peroksidasi lipid pada akar. Lm = Lumut, Sl = Slamet.
Kandungan kalosa. Penambahan
Mastoparan (30 µM) mengakibatkan tidak terdapat kerusakan pada jaringan akar dan menurunkan kandungan kalosa. Hal ini terlihat dari kurang berpendarnya jaringan akar perlakuan Mastoparan dibandingkan dengan perlakuan cekaman Al (Gambar 15). Akar kultivar Slamet memiliki kandungan kalosa lebih rendah daripada kultivar Lumut (Gambar 16).
nf
(a)
f
nf
(b)
f
Lm Sl
Gambar 15 Uji histokimia kalosa dengan pewarnaan Aniline blue yang diamati pada keadaan non fluoresens (nf) dan fluoresens (f) pada perlakuanpH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam. Tanda panah menunjukkan sebarankalosa. Lm = Lumut,
Gambar 16 Kandungan kalosa akar tanpa dan dengan penambahan Mastoparan selama 24 jam.
Lm = Lumut, Sl = Slamet. 0
0.05 0.1 0.15 0.2 0.25 0.3 0.35
0 8 24
Jam ke
mg
C
u
rd
la
n
/c
m a
k
ar
Sl-pH 6 Lm-pH 6
Sl-pH 4 Lm-pH 4
Sl-pH 4-Al Lm-pH 4-Al
Sl-pH 4-Al-Mastoparan Lm-pH 4-Al-Mastoparan
Kehilangan integritas membran. Mastoparan tidak menyebabkan kerusakan akar, sehingga kehilangan integritas membran sel akar menjadi menurun. Hal ini terlihat dari rendahnya penyerapan warna Evans blue oleh akar kedua kultivar. Kultivar Lumut menyerap warna lebih banyak daripada kultivar Slamet. Akar kultivar Slamet bahkan terlihat tidak menyerap warna Evans blue (Gambar 17). Akar kultivar Slamet memiliki penurunan integritas membran lebih kecil daripada kultivar Lumut (Gambar 18).
Lm Sl Lm Sl (a) (b)
Gambar 17 Uji histokimia kehilangan integritas membran dengan pewarnaan Evans blue pada perlakuan pH 4 + 1.6 mM Al (a) dan pH 4 + 1.6 mM Al + Mastoparan (b) selama 24 jam.
Tanda panah menunjukkan kehilangan integritas membran. Lm = Lumut, Sl = Slamet.
Pembahasan
Pengaruh Cekaman Aluminium
Alumunium larut pada tanah masam (pH < 4) dan menyebabkan penghambatan pertumbuhan tumbuhan. Ketika Al diabsorbsi oleh tumbuhan, efek toksisitasnya akan terlihat pada pertumbuhan akarnya. Al diketahui antara lain berikatan pada dinding sel, membran plasma, dan nukleus (Kataoka et al. 2001). Perubahan morfologi akar akibat cekaman Al terjadi beberapa jam setelah perlakuan cekaman. Ujung akar menebal dan permukaannya retak. Keretakan ini disebabkan oleh kerusakan pada lapisan kedua dan ketiga korteks (Matsumoto 2000). Sejumlah besar Al diakumulasi pada zona pemanjangan akar dan menyebabkan penghambatan perpanjangan akar akibat perubahan struktural zona tersebut pada tahap awal toksisitas Al (Matsumoto 2000).
Alumunium dapat berikatan dengan gugus polifosfat DNA dan menyebabkan terganggunya proses replikasi DNA (Kochian 1995). Al akan berikatan dengan molekul yang berhubungan dengan DNA misalnya protein histon kromosom yang menyebabkan pembelahan sel terganggu. Menurut Sivaguru et al. (1999) kultur sel yang mendapat cekaman Al, pembelahan selnya terhambat akibat hilangnya benang-benang gelendong (spindel) pada proses mitosis. Aktivitas mitosis yang menurun dengan cepat akan menyebabkan terjadinya reduksi perpanjangan akar.
Gambar 18 Kehilangan integritas membran pada akar tanpa dan dengan penambahan Mastoparan selama 24 jam.
Lm = Lumut, Sl = Slamet. 0
0.005 0.01 0.015 0.02 0.025 0.03
0 8 24
Jam ke
A
b
so
rb
an
si
Sl-pH 6 Lm-pH 6
Sl-pH 4 Lm-pH 4
Sl-pH 4-Al Lm-pH 4-Al
Kultivar yang peka terhadap cekaman Al mengakumulasi Al lebih banyak daripada kultivar yang toleran (Matsumoto 2000). Menurut Matsumoto (2000) penghambatan perpanjangan akar akibat cekaman Al berbeda antar spesies atau kultivar. Kultivar Lumut mengalami reduksi perpanjangan akar lebih besar daripada kultivar Slamet. Penghambatan perpanjangan akar berhubungan dengan akumulasi Al pada jaringan akar. Reduksi perpanjangan akar lebih dari 50 % pada kedua kultivar tersebut terjadi 8 jam setelah perlakuan. Hasil penelitian yang sama juga dilaporkan oleh Mashuda (2006) dan Suharsono et al. (2006).
Akumulasi Al pada akar ditemukan mulai dari ujung akar sampai 5 mm di atas ujung akar, namun kerusakan akar terdeteksi pada daerah 3-5 mm dari ujung akar dengan pewarnaan hematoksilin. Menurut Matsumoto (2000) Al diakumulasi di tudung, meristem apikal dan zona pemanjangan akar. Menurut Kataoka et al. (2001) sel-sel pada daerah tersebut relatif lebih muda. Sel yang lebih muda dapat berikatan dengan Al lebih mudah daripada sel yang lebih dewasa. Hal ini disebabkan karena sel yang lebih muda memiliki potensial membran yang lebih rendah dibandingkan dengan sel yang lebih dewasa. Berdasarkan sayatan melintang akar, akumulasi Al pada umumnya dijumpai pada lapisan epidermis dan sub epidermis (korteks) akar. Hasil penelitian yang sama juga dilaporkan oleh Matsumoto (2000). Menurut Kataoka (2001) akumulasi Al dijumpai pada nukleus sel-sel parenkima korteks yang terletak pada daerah 1 dan 2 mm dari ujung akar hanya dengan perlakuan cekaman selama 15 menit, bahkan Al juga dapat dijumpai pada protoxilem meskipun dengan konsentrasi yang rendah. Hal ini menunjukkan Al ditransportasikan ke bagian atas tumbuhan melalui xilem.
Semakin lama waktu cekaman semakin tinggi kandungan Al. Kultivar Slamet memiliki kandungan Al lebih tinggi daripada kultivar Lumut pada perlakuan cekaman selama 8 jam. Namun respon yang terjadi tetap menunjukkan bahwa kultivar Slamet tetap memiliki tingkat ketahanan yang lebih tinggi daripada kultivar Lumut. Hal ini dapat dilihat dari kandungan peroksidasi lipid dan kalosa, serta penurunan integritas membran yang lebih rendah pada kultivar Slamet daripada kultivar Lumut pada perlakuan cekaman selama 8 jam. Diduga kultivar Slamet memiliki kemampuan untuk mendetoksifikasi Al pada perlakuan cekaman
tersebut. Kultivar Slamet menunjukkan kandungan Al pada akar lebih rendah dibandingkan dengan kultivar Lumut pada perlakuan cekaman selama 24 dan 48 jam. Perbedaan akumulasi kandungan Al berhubungan dengan perbedaan tingkat sensitivitas tumbuhan (Matsumoto 2000). Menurut Samuel et al. (1997) perbedaan genotipe pada kedua kultivar dapat menyebabkan perbedaan akumulasi kandungan Al. Kandungan Al kedua kultivar cenderung sama pada perlakuan cekaman selama 72 jam. Diduga hal ini disebabkan oleh adanya mekanisme transduksi sinyal lain yang menyebabkan kultivar Lumut menjadi cenderung tahan terhadap cekaman.
Aluminium berikatan kuat dengan komponen lipid membran plasma. Kemampuan pengikatan Al oleh membran plasma bergantung pada kemampuan pengikatan gugus karboksil dan gugus fosfat membran plasma yang bermuatan negatif. Potensial permukaan membran dapat menjadi faktor yang terlibat dalam pertahanan tumbuhan terhadap cekaman Al (Matsumoto 2000). Tegangan negatif permukaan sel dapat menarik kation yang bersifat toksik. Ikatan Al dengan membran plasma dapat mengubah struktur membran plasma. Di samping itu pengikatan Al dengan komponen lipid pada membran plasma menyebabkan membran plasma menjadi kaku. Hal ini berpengaruh terhadap metabolisme yang terjadi pada membran plasma karena perubahan fungsi membran plasma tersebut. Beberapa respon yang ditimbulkan oleh tumbuhan akibat cekaman Al berkaitan dengan perubahan fungsi membran plasma (Matsumoto 2000).
Modifikasi struktur membran oleh Al berhubungan dengan interaksi antara Al dengan lipid dan protein membran yang dapat menyebabklan terbentuknya oksigen reaktif seperti O2
-
dan H2O2. O2 -
berasal dari beberapa proses metabolik seperti respirasi dan aktivasi NADPH oksidase pada membran plasma, sedangkan H2O2 diproduksi secara spontan atau dari hasil dismutasi enzimatik O2
(Yamamoto et al. 2001). Kombinasi O2
- dan H2O2 menghasilkan hidroksil reaktif radikal yang tinggi yang menginisiasi terbentuknya peroksidasi lipid. Katalase, peroksidase, dan superoksida dismutase merupakan enzim yang penting bagi tumbuhan untuk mengurangi pengaruh negatif oksigen radikal bebas (Legendre et al. 1993).
kultivar Lumut. Penurunan peroksidasi lipid kultivar Slamet terjadi mulai jam ke-72, sedangkan pada kultivar Lumut terjadi mulai jam ke-48. Kultivar Lumut mengalami tingkat kerusakan sel-sel korteks akar lebih banyak daripada kultivar Slamet, sehingga kultivar Lumut mengalami penurunan kandungan peroksidasi lipid lebih cepat daripada kultivar Slamet. Hal ini menyebabkan perbedaan ketahanan kedua kultivar tersebut terhadap cekaman Al, kultivar Slamet lebih tahan daripada kultivar Lumut. Peroksidasi lipid mengalami peningkatan yang nyata setelah diberi perlakuan Al selama 8 jam dan terus meningkat sampai 48 jam setelah perlakuan (Cakmak 1991).
Kalosa merupakan senyawa -1,3-glukan yang dibentuk pada membran plasma yang sangat sensitif terhadap cekaman Al. Menurut Wissemeier et al. (1992) pembentukan kalosa sangat intensif terjadi pada ujung akar dan hanya ditemukan pada lapisan korteks paling luar (sub epidermis). Kalosa dapat terbentuk sebagai respon terhadap stres fisik atau kimia pada membran plasma dan sering dijumpai pada jalur penghubung antar sel (plasmodesmata dan pori pembuluh tapis) atau untuk mengisolasi jaringan yang rusak (Kohle 1985). Induksi pembentukan kalosa oleh Al berhubungan dengan perubahan fungsi membran plasma. Kalosa dibentuk pada bagian dalam membran plasma yang diaktivasi oleh peningkatan konsentrasi ion Ca2+ intraseluler akibat meningkatnya influk Ca2+ melalui membran plasma yang rusak (Yamamoto et al. 2001). Kalosa dilepaskan oleh membran plasma ke dalam apoplas, sehingga dinding sel pada akar tanaman yang tercekam Al terlihat seperti mengandung deposit kalosa (Matsumoto 2000).
Kultivar Slamet memiliki kandungan kalosa lebih rendah daripada kultivar Lumut. Perbedaan akumulasi kandungan kalosa menunjukkan perbedaan tingkat stres fisiologi setiap kultivar (Zhang et al. 1994). Kedua kultivar mengalami kenaikan kandungan kalosa sampai jam ke-24 dan mengalami penurunan mulai jam ke-48 perlakuan cekaman Al. Hal ini diduga karena kedua kultivar mengalami peningkatan kerusakan sel-sel korteks seiring dengan lamanya waktu cekaman.
Menurut Matsumoto (2000) cekaman Al menyebabkan ujung akar menjadi tebal dengan retakan pada permukaannya dan menjadikan akar rapuh sehingga membran selnya mengeras dan menyebabkan integritas membran menurun. Kultivar Slamet
mengalami kehilangan integritas membran lebih rendah daripada Lumut. Perbedaan tersebut diduga disebabkan oleh perbedaan genotipe. Analisis histokimia dan kuantifikasi kehilangan integritas membran menggunakan Evans blue mengindikasikan bahwa kerusakan membran yang diinduksi oleh cekaman Al merupakan kerusakan mekanik sel pada permukaan akar di daerah pemanjangan setelah perlakuan cekaman Al yang panjang (Yamamoto et al. 2001). Evans blue merupakan pewarna yang digunakan sebagai indikator untuk menandai sel yang mati atau mengalami kerusakan. Sel yang mati atau rusak akan tetap terwarnai meskipun telah mengalami pencucian dikarenakan sel tersebut tidak lagi mempunyai kemampuan transporter untuk mengeluarkan larutan pewarna yang telah diserapnya.
Tumbuhan memiliki mekanisme dalam mempertahankan diri terhadap cekaman Al diantaranya melepaskan asam organik dari ujung akar seperti asam sitrat, oksalat, dan malat; meningkatkan pH rizosfer untuk mengurangi tingkat kelarutan Al; mengakumulasi Al dan mengeluarkannya kembali; serta menginduksi fitokelatin untuk mengkelat Al (Kochian 1995).
Pengaruh Mastoparan terhadap Cekaman Aluminium
Respon yang terjadi pada tanaman akibat cekaman Al terlihat jelas pada jam ke-24. Oleh karena itu penambahan mastoparan untuk mengetahui keterlibatan G α terhadap mekanisme toleransi tanaman kedelai dilakukan sampai jam ke-24.
Pemberian Mastoparan (30 µM) menyebabkan kultivar Lumut mengalami stimulasi perpanjangan akar lebih besar daripada kultivar Slamet. Lumut merupakan kultivar peka, sehingga penambahan Mastoparan pada perlakuan cekaman Al diharapkan dapat menyebabkan kultivar Lumut lebih tahan terhadap kerusakan akar daripada kultivar Slamet yang pada dasarnya sudah bersifat toleran. Pemberian Mastoparan (30 µM) dapat menurunkan kandungan Al, peroksidasi lipid, dan kalosa; dan menurunkan kehilangan integritas membran pada kedua kultivar, sehingga pemberian Mastoparan (30 µM) tidak menyebabkan kerusakan akar baik pada kultivar Lumut maupun Slamet.
sistem pengantar dari luar (Legendre et al. 1992). Mastoparan juga merupakan aktivator protein heterotrimerik G α yang berperan dalam sistem transduksi sinyal. Terdapat dua bentuk Mastoparan yaitu bentuk analog aktif (Mastoparan 7) dan inaktif (Mastoparan 17). Perbedaan bentuk tersebut terdapat pada sekuen asam aminonya. Menurut Fujisawa et al. (2001) Mastoparan 7 sebagai analog aktif dapat meningkatkan permeabilitas membran plasma terhadap ion yaitu menginduksi pengeluaran K+ dan pemasukan H+ dan Ca2+ dari kultur sel kultivar normal dan kultivar mutan. Mastoparan 7 juga dapat meningkatkan aktivitas pengikatan GTP S dengan protein membran plasma pada konsentrasi 10-100 µM dan pengaruhnya terlihat berbeda antara kultivar normal dengan kultivar mutan pada konsentrasi kurang lebih 30 µM.
Mastoparan mengkatalisis pengaktivasian protein heterotrimerik G α supaya tetap berada dalam keadaan aktif dalam bentuk ikatan dengan GTP. Reseptor yang berikatan dengan protein heterotrimerik G α adalah reseptor yang termasuk ke dalam kelas reseptor 7 segmen transmembran (Krauss 2001). Protein heterotrimerik G α membawa informasi dari reseptor dan mengaktivasi phospholipase C (PLC) untuk pemecahan phospatidylinositol-4,5-bisphosphate (PIP2) menjadi inositol triphosphate (IP3) yang dilepaskan ke sitoplasma dan diacylglycerol (DAG) ke membran serta mengaktivasi protein kinase C (Kochian 1995). IP3 akan berikatan dengan vesikel dan membran retikulum endoplasma yang menyebabkan pengeluaran Ca2+ ke dalam sitoplasma. Kation ini akan menstimulasi beberapa proses seperti sekresi dan pembelahan sel. DAG mengaktifkan protein kinase C yaitu enzim yang menempatkan gugus fosfat pada protein target dan mengaktifkannya. Target tersebut diantaranya kanal ion, transporter, transkripsi mRNA, motilitas, sekresi, dan berbagai macam metabolik enzim lainnya (Sadava 1993). Menurut Chen et al. (2006) dengan menggunakan mutan yang kehilangan kopi gen subunit α telah terbukti bahwa protein heterotrimerik G α pada tanaman Arabidopsis berfungsi sebagai modulator positif proses pembelahan sel. Hasil yang sama dilaporkan juga oleh Barbeoch et al. (2004) bahwa dengan menggunakan mutan yang kehilangan satu kopi gen subunit α terbukti bahwa protein heterotrimerik G α berperan dalam
pengaturan pembelahan sel pada daerah meristem ujung akar pada tanaman Arabidopsis dan padi. Ma (1994) juga melaporkan peranan protein heterotrimerik G α dalam pembelahan dan diferensiasi sel pada tumbuhan. Meskipun akar mengalami cekaman Al, namun dengan adanya Mastoparan dapat meningkatkan kembali pembelahan sel yang terganggu akibat pengikatan Al dengan gugus DNA. Peningkatan pembelahan sel tersebut dapat menurunkan respon tanaman yang diakibatkan stres terhadap cekaman Al yaitu dengan menurunkan kandungan Al, peroksidasi lipid dan kalosa; kehilangan integritas membran dan penghambatan perpanjangan akar. Oleh karena itu Mastoparan sebagai aktivator protein heterotrimerik G α dapat membantu akar dalam mencegah kerusakan sel akibat cekaman Al khususnya pada kultivar peka Lumut melalui pengaktifan pembelahan sel dan sistem transduksi sinyal lainnya yang berperan dalam sistem pertahanan tumbuhan.
SIMPULAN
Mastoparan sebagai aktivator protein heterotrimerik G α dapat meningkatkan sistem pertahanan tanaman kedelai terutama pada kultivar peka Lumut terhadap cekaman aluminium melalui pertambahan perpanjangan akar; penurunan kandungan aluminium, peroksidasi lipid, dan kalosa; serta peningkatan integritas membran sel.
TERIMA KASIH
Terima kasih penulis ucapkan kepada Proyek Hibah Bersaing XII atas nama Dr. Ir Utut Widyastuti Suharsono, M.Si. yang telah membiayai penelitian ini.
DAFTAR PUSTAKA
Anwar S. 1999. Pengklonan gen-gen yang diinduksi oleh aluminum pada kedelai (Glycine max (L) Merryl) [disertasi]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Barbeoch LP, Jones AM, Asmann SM. 2004. Plant heterotromeric G protein function: insight from Arabidopsis and rice mutants. Curr Opin Plant Biol 7:719-731. Cakmak I & Horst WJ. 1991. Effect
aluminum on lipid peroxidation, superoxidase dismutase, catalase, and peroxidase activities in root tips of soybeans (Glycine max). Physiol Plant 83:463-468.
Chen JG, Gao Y, Jones AM. 2006. Differential roles of Arabidopsis heterotrimeric G protein subunits in modulating cell division in roots. Plant Physiol 141:887-897.
Cunniff P, editor. 1999. Official Methods of Analysis of AOAC International. 16th Edition. Volume ke-1. Gaithersburg. AOAC International.
Fujisawa Y, Sawaki S, Kato H, Asahi T, Iwasaki Y. 2001. Biochemical responses of rice cells to Mastoparan 7 an activator of heterotrimeric G proteins. Plant Biotechnol 18(4):241-249.
Kataoka T, Nakanishi TM. 2001. Aluminium distribution in soybean root tip for a short time Al treatment. Plant Physiol 158:731-736.
Kauss H. 1992. Callose and Callose Synthase. Di dalam: MC Pherson MJ, Bowles DJ, editor. Molecular Plant Physiology: A Practical Approach. Volume ke-2. New York:Oxford Univ. hlm 1-8.
Kochian LV. 1995. Cellular mechanisms of aluminum toxicity and resistance in plants. Plant Physiol 46:237-260.
Kohle et al. 1985. Chitosan elicited callose synthesis in soybeans cells as a Ca2+ dependent process. Plant Physiol 77:544-551.
Krauss G. 2001. Biochemistry of Signal Transduction and Regulation. Wienheim:Wiley VCH.
Legendre L, Heinstein PF, Low PS. 1992. Evidence for participation of GTP-binding proteins in elicitation of the rapid oxidative burst in cultured soybeans cells.Biochem 267(28):20140-20147. Legendre L, Rueter S, Heinstein PF, Low PS.
1993. Characterization of the oligalacturonide-induced oxidative burst in cultured soybean (Glycine max) cells. Plant Physiol 102:233-240.
Ma H. 1994. GTP binding protein in plants: new members of an old family. Plant Molec Biol 26:1611-1636.
Mashuda. 2006. Ekspresi gen G α pada kedelai kultivar slamet yang mendapat cekaman aluminium [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Matsumoto H. 2000. Cell biology of aluminum toxicity and tolerance in higher plants. Int Molecrev of Cytoy 200:1-17 Mihara M, Uchiyama M, Fukazawa K. 1980.
Thiobarbituric acid value on fresh homogenate of rat as parameter of lipid peroxidation aging CCl4 intoxication and vitamin E deficiency. Biochem Med 23:302-311
Nakamura T. 1995. Plant Tissue Observation Using Microscope. Di dalam: Hinata K, Hashiba T, editor. A Manual of Experiment for Plant Biology. Tokyo: Soft Science Publications.hlm 15-22. Polle E, Konzak CF, Kittrick JA. 1987. Visual
detection of aluminum tolerance in wheat by hematoxylin staining of seedling roots. Crop Sci 18:823-827
Pompella LA, Maellaro E, Casini AF, Comporti M. 1987. Histochemical detection of lipid peroxidation in the liver of bromobenzene-poisoned mice. Am J Pathol 129:295-301.
Sadava DE. 1993. Cell Biology Organelle Structure and Function. London: Jones and Bartlett.
Samuel T, Kucukakyuz K, Zachari MR. 1997. Al partitioning pattern and root growth as related to Al sensitivity and Al tolerance in wheat. Plant Physiol 113:527-534. Sivaguru M, Baluska F, Volkmann D, Felle
HH, Horst WJ. 1999. Impacts of aluminum on the cytoskeleton of the maize root apex short-term effects on the distal part of transition zone. Plant Physiol 116:155-163.
Suharsono UW, Suharsono. 2006. Analisis gen penyandi protein heterotrimerik G subunit α yang terlibat dalam sistem toleransi tanaman kedelai terhadap cekaman Al [laporan akhir hibah bersaing XII]. Bogor: Lembaga Penelitian dan Pemberdayaan Masyarakat, Institut Pertanian Bogor.
Wissemeier AH, Diening A, Hergenroder A, Horst WJ, Mix-Wegner G. 1992. Callose formation as parameter for assesing genotypical plant tolerance of aluminum and manganase. Plant Soil 146:67-75. Yamamoto Y, Kobayashi Y, Matsumoto H.
2001. Lipid peroxidation is an early symptom triggered by alumunium, but not the primary cause of elongations inhibition in pea roots. Plant Physiol 125:199-208.
Zhang G, Hoddinott J, Taylor Gj. 1994. Characterization of 1,3- -D-glucan (callose) synthesis in roots of Triticum aestivum in response to Al toxicity. Plant Physiol 144:229-234.
KETERLIBATAN PROTEIN HETEROTRIMERIK G
α
TERHADAP
CEKAMAN ALUMINIUM PADA KEDELAI (
Glycine
max
(L) Merryl)
MELALUI STUDI HISTOKIMIA
Oleh :
Tuti Srimulyati
G34102009
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TUTI SRIMULYATI. Keterlibatan Protein Heterotrimerik G D terhadap Cekaman Aluminium
pada Kedelai (Glycine max (L) Merryl) melalui Studi Histokimia. Dibimbing oleh UTUT WIDYASTUTI SUHARSONO dan JULIARNI.
Penelitian ini bertujuan menganalisis keterlibatan protein heterotrimerik G D pada
mekanisme toleransi kedelai toleran kultivar Slamet dan peka Lumut terhadap cekaman alumunium (Al) melalui studi histokimia. Keterlibatan protein heterotrimerik G D terhadap
cekaman aluminium dianalisis dari akar tanaman yang ditumbuhkan pada media hara kultur air pH 6.0, pH 4.0, pH 4.0 + 1.6 mM AlCl3selama 8, 24, 48, dan 72 jam dan pH 4.0 + 1.6 mM AlCl3+ 30 μM Mastoparan 7 (sigma) (aktivator protein heterotrimerik G D) selama 8 dan 24 jam.
Pertama, pengaruh cekaman Al terhadap pertumbuhan akar kedelai dianalisis dengan menumbuhkan biji kedelai pada media hara kultur air pH 6.0, pH 4.0 dan pH 4.0 + 1.6 mM AlCl3 selama 8, 24, 48, dan 72 jam. Hasil menunjukkan bahwa cekaman Al selama 24 jam menyebabkan peningkatan reduksi panjang akar; akumulasi Al, kandungan peroksidasi lipid, dan kalosa; dan kehilangan integritas membran yang lebih tinggi pada kultivar Lumut daripada kultivar Slamet.
Keterlibatan protein heterotrimerik G D dalam respon terhadap cekaman Al dianalisis
setelah penambahan Mastoparan 7 (sigma) pada cekaman Al selama 8 dan 24 jam. Reduksi panjang akar; akumulasi Al, kandungan peroksidasi lipid, dan kalosa; dan penurunan integritas membran menurun pada perlakuan 8 dan 24 jam baik pada kultivar Slamet maupun kultivar Lumut dibandingkan dengan perlakuan cekaman Al saja.
Hasil penelitian menunjukkan keterlibatan protein heterotrimerik G D terhadap cekaman Al
pada kedelai.
ABSTRACT
TUTI SRIMULYATI. Role of The Heterotrimeric G Protein D Sub Unit in Aluminum Toxicity
of Soybean through Histochemical Analyzes. Supervised by UTUT WIDYASTUTI SUHARSONO and JULIARNI.
The aim of this research was to examine the role of G protein D sub unit in aluminum
toxicity of soybean cv. Slamet and cv. Lumut through histochemical study. Involvement of the heterotrimeric G protein D sub unit in the aluminum toxicity were investigated using plant root
which grown in liquid nutrient media pH 6.0, pH 4.0, pH 4.0 + 1.6 mM AlCl3for 8, 24, 48, and 72 h and pH 4.0 + 1.6 mM AlCl3+ 30 μM Mastoparan 7 (sigma) (the activator of heterotrimeric G protein D sub unit) for 8 and 24 h.
First, the influence of aluminum toxicity on root growth was examined by growing soybean seedling in liquid nutrient media with pH 6.0, pH 4.0 and pH 4.0 + 1.6 mM AlCl3for 8, 24, 48, and 72 h. Result indicated that aluminum treatment for 24 h highly increased root elongation inhibition; accumulation of aluminum, lipid peroxidation, and callose; and loss of membrane integrity in cultivar Lumut compared to cv. Slamet.
To examine whether the heterotrimeric G protein D sub unit involved in response to
aluminum toxicity, Mastoparan 7 (sigma) was applicated into aluminum treatment for 8 and 24 h. Root elongation inhibition; accumulation of aluminum, lipid peroxidation, and callose; and loss of membrane integrity were decreased at 8 and 24 h in cv. Slamet and cv. Lumut compared to aluminum treatment only.
Result of this study demonstrated that the heterotrimeric G protein D sub unit playing a role
PENDAHULUAN
Latar Belakang
Biji kedelai (Glycine max) merupakan salah satu produk pertanian yang memiliki tingkat permintaan yang tinggi di masyarakat. Upaya peningkatan produksi kedelai dapat dilakukan melalui program intensifikasi dan ekstensifikasi. Namun program ekstensifikasi menghadapi beberapa kendala dalam pelaksanaannya yaitu meningkatnya perubahan fungsi lahan pertanian antara lain menjadi pemukiman, jalan, dan industri. Di samping itu sebagian lahan yang berpotensi untuk pengembangan kedelai terutama lahan di luar pulau jawa merupakan lahan masam dengan kandungan aluminium (Al) yang tinggi. Menurut Mulyani (2006) lahan yang berpotensi dalam pengembangan kedelai di daerah Sumatra, Kalimantan, dan Papua mencapai 18.2 juta ha termasuk lahan masam. Lahan yang memiliki pH rendah (pH < 4) memiliki tingkat kelarutan Al sangat tinggi. Salah satu bentuk Al yang bersifat toksik bagi tumbuhan yaitu Al3+ (Matsumoto 2000).
Cekaman Al dapat menurunkan integritas membran, menginduksi pembentukan peroksidasi lipid dan kalosa sehingga menghambat pertumbuhan perpanjangan akar primer tumbuhan (Yamamoto et al. 2001). Selain itu cekaman Al dapat menginduksi sejumlah gen yang berperan dalam sistem pertahanan tumbuhan. Salah satu gen yang diduga terlibat yaitu protein heterotrimerik G α (Asmann 2002). Menurut Weiss et al. (1997) protein heterotrimerik G α ditemukan pada membran sel Arabidopsis.
Protein G merupakan salah satu protein yang berperan dalam sistem transduksi sinyal. Protein ini terdiri atas 3 sub unit yaitu α, β, dan γ; dan berperan sebagai penerus penyampaian informasi dari reseptor membran ke efektor intraseluler (Ma 1994). Sinyal yang datang dari luar akan berikatan dengan reseptor yang ada di membran; dan mengaktifkan protein G yang ada di membran. Perubahan konformasi protein G menyebabkan terputusnya ikatan guanosin diphosphate (GDP) dengan sub unit α. Sub unit α akan berpisah dengan kompleks β dan γ, kemudian berikatan dengan guanosin triphosphate (GTP) dan mengaktivasi adenylil cyclase dalam mengubah adenosin triphosphate (ATP) menjadi cyclic adenosin monophosphate (cAMP). cAMP merupakan second messenger yang mengaktifkan protein
kinase yaitu enzim yang memfosforilasi protein target yang berpengaruh dalam sistem metabolisme yang berperan dalam sistem pertahanan (Sadava 1993). Oleh karena itu akan sangat menarik untuk melihat keterlibatan protein heterotrimerik G α pada sistem pertahanan tumbuhan terhadap cekaman Al.
Tujuan
Penelitian ini bertujuan menganalisis keterlibatan protein heterotrimerik G α pada mekanisme toleransi kedelai kultivar Slamet dan Lumut terhadap cekaman aluminium melalui studi histokimia.
BAHAN DAN METODE
Kultur Air
Benih kultivar Slamet dan Lumut yang memiliki ukuran yang seragam disterilisasi dengan NaOCl 1.5 % (b/v) selama 15 menit, kemudian dicuci dengan air steril sebanyak 3 kali. Benih dikecambahkan di dalam wadah yang telah dialasi dengan tisu basah kemudian disimpan di dalam ruang gelap selama 48 jam. Kecambah yang memiliki panjang akar lebih kurang 3 cm ditanam di trays, kemudian trays ditempatkan di dalam bak plastik berisi media hara pH 6.0 (Anwar 1999) selama 48 jam dengan aerasi.
Pada hari ke-3 (jam ke-0) media diganti dengan media perlakuan yaitu pH 6.0 tanpa cekaman Al (kontrol), pH 4.0 tanpa cekaman Al , pH 4.0 + 1.6 mM AlCl3,dan pH 4.0 + 1.6 mM AlCl3 + 30 μM Mastoparan 7 (sigma) (aktivator G α). Perlakuan dengan Mastoparan hanya dilakukan sampai jam ke-24, sedangkan tiga perlakuan lainnya dilakukan selama 72 jam. Media perlakuan diganti setiap 24 jam. Penentuan konsentrasi cekaman Al didasarkan pada hasil penelitian sebelumnya (Anwar 1999; Mashuda 2006).
Pengamatan Panjang Akar
Akar tanaman diukur panjangnya dari ujung sampai bagian pangkal sebanyak 3 ulangan. Satu ulangan terdiri atas 5 akar.
Uji Histokimia Alumunium
PENDAHULUAN
Latar Belakang
Biji kedelai (Glycine max) merupakan salah satu produk pertanian yang memiliki tingkat permintaan yang tinggi di masyarakat. Upaya peningkatan produksi kedelai dapat dilakukan melalui program intensifikasi dan ekstensifikasi. Namun program ekstensifikasi menghadapi beberapa kendala dalam pelaksanaannya yaitu meningkatnya perubahan fungsi lahan pertanian antara lain menjadi pemukiman, jalan, dan industri. Di samping itu sebagian lahan yang berpotensi untuk pengembangan kedelai terutama lahan di luar pulau jawa merupakan lahan masam dengan kandungan aluminium (Al) yang tinggi. Menurut Mulyani (2006) lahan yang berpotensi dalam pengembangan kedelai di daerah Sumatra, Kalimantan, dan Papua mencapai 18.2 juta ha termasuk lahan masam. Lahan yang memiliki pH rendah (pH < 4) memiliki tingkat kelarutan Al sangat tinggi. Salah satu bentuk Al yang bersifat toksik bagi tumbuhan yaitu Al3+ (Matsumoto 2000).
Cekaman Al dapat menurunkan integritas membran, menginduksi pembentukan peroksidasi lipid dan kalosa sehingga menghambat pertumbuhan perpanjangan akar primer tumbuhan (Yamamoto et al. 2001). Selain itu cekaman Al dapat menginduksi sejumlah gen yang berperan dalam sistem pertahanan tumbuhan. Salah satu gen yang diduga terlibat yaitu protein heterotrimerik G α (Asmann 2002). Menurut Weiss et al. (1997) protein heterotrimerik G α ditemukan pada membran sel Arabidopsis.
Protein G merupakan salah satu protein yang berperan dalam sistem transduksi sinyal. Protein ini terdiri atas 3 sub unit yaitu α, β, dan γ; dan berperan sebagai penerus penyampaian informasi dari reseptor membran ke efektor intraseluler (Ma 1994). Sinyal yang datang dari luar akan berikatan dengan reseptor yang ada di membran; dan mengaktifkan protein G yang ada di membran. Perubahan konformasi protein G menyebabkan terputusnya ikatan guanosin diphosphate (GDP) dengan sub unit α. Sub unit α akan berpisah dengan kompleks β dan γ, kemudian berikatan dengan guanosin triphosphate (GTP) dan mengaktivasi adenylil cyclase dalam mengubah adenosin triphosphate (ATP) menjadi cyclic adenosin monophosphate (cAMP). cAMP merupakan second messenger yang mengaktifkan protein
kinase yaitu enzim yang memfosforilasi protein target yang berpengaruh dalam sistem metabolisme yang berperan dalam sistem pertahanan (Sadava 1993). Oleh karena itu akan sangat menarik untuk melihat keterlibatan protein heterotrimerik G α pada sistem pertahanan tumbuhan terhadap cekaman Al.
Tujuan
Penelitian ini bertujuan menganalisis keterlibatan protein heterotrimerik G α pada mekanisme toleransi kedelai kultivar Slamet dan Lumut terhadap cekaman aluminium melalui studi histokimia.
BAHAN DAN METODE
Kultur Air
Benih kultivar Slamet dan Lumut yang memiliki ukuran yang seragam disterilisasi dengan NaOCl 1.5 % (b/v) selama 15 menit, kemudian dicuci dengan air steril sebanyak 3 kali. Benih dikecambahkan di dalam wadah yang telah dialasi dengan tisu basah kemudian disimpan di dalam ruang gelap selama 48 jam. Kecambah yang memiliki panjang akar lebih kurang 3 cm ditanam di trays, kemudian trays ditempatkan di dalam bak plastik berisi media hara pH 6.0 (Anwar 1999) selama 48 jam dengan aerasi.
Pada hari ke-3 (jam ke-0) media diganti dengan media perlakuan yaitu pH 6.0 tanpa cekaman Al (kontrol), pH 4.0 tanpa cekaman Al , pH 4.0 + 1.6 mM AlCl3,dan pH 4.0 + 1.6 mM AlCl3 + 30 μM Mastoparan 7 (sigma) (aktivator G α). Perlakuan dengan Mastoparan hanya dilakukan sampai jam ke-24, sedangkan tiga perlakuan lainnya dilakukan selama 72 jam. Media perlakuan diganti setiap 24 jam. Penentuan konsentrasi cekaman Al didasarkan pada hasil penelitian sebelumnya (Anwar 1999; Mashuda 2006).
Pengamatan Panjang Akar
Akar tanaman diukur panjangnya dari ujung sampai bagian pangkal sebanyak 3 ulangan. Satu ulangan terdiri atas 5 akar.
Uji Histokimia Alumunium
Pembuatan Sediaan Mikroskopis Akar
Lima akar tanaman sepanjang 10 mm dari setiap perlakuan diwarnai dengan hematoksilin 0.2 % (b/v) dalam akuades selama 15 menit. Kelima akar tersebut kemudian dicuci dengan air selama 30 menit, dipotong sepanjang 5 mm dan difiksasi di dalam larutan FAA (formaldehid 37% (v/v):asam asetat glasial:alkohol 70%(v/v)=5:5:90) selama 24 jam. Akar yang telah difiksasi dimasukkan ke dalam seri larutan dehidrasi yang terdiri atas n-butanol-alkohol-akuades (Nakamura 1995). Infiltrasi parafin dilakukan secara bertahap. Blok parafin dipotong setebal 10 μm. Pita sayatan diletakkan di atas gelas objek, ditetesi balsam (Entellan) dan ditutup dengan gelas penutup. Parameter yang diamati adalah akumulasi Al pada jaringan akar.
Uji Histokimia Peroksidasi Lipid
Tiga akar tanaman sepanjang 10 mm dari setiap perlakuan diwarnai dengan larutan Schiff’s selama 20 menit, dibilas dengan larutan potasium metabisulfit ( K2S2O5 0.5 % (b/v) dalam 0.05 M HCl ) (Pompella et al.1987), kemudian diamati dengan mikroskop stereo (Olympus VE-3).
Uji Histokimia Kalosa
Lima akar tanaman sepanjang 5 mm dari setiap perlakuan dipotong melintang, ditetesi dengan Aniline blue 0.1 % (b/v) dalam larutan penyangga 1 M Gly-NaOH pH 9.5 (Kauss 1992) dan diberi gliserin 30%, kemudian diamati dengan mikroskop fluoresens (Olympus CX40RF200).
Uji Histokimia Kehilangan Integritas Membran
Tiga akar tanaman sepanjang 10 mm dari tiap perlakuan diwarnai dengan Evans blue 0.025% (b/v) dalam 100 µM CaCl2 pH 5.6 selama 10 menit, dicuci dengan 100 µM CaCl2 pH 5.6 sebanyak 3 kali (Yamamoto et
al. 2001), kemudian diamati dengan mikroskop stereo (Olympus VE-3).
Kuantifikasi Kandungan Alumunium
Bagian ujung akar sepanjang 10 mm dikeringkan menggunakan oven suhu 500 C selama semalam (12 jam). Sampel akar tersebut ditimbang, dimasukkan ke dalam 5 ml HNO3 pekat, didiamkan semalam; kemudian dipanaskan sampai campuran berwarna bening. Homogenate akar
diencerkan dengan akuades sampai volume 25 ml dan diukur menggunakan spektro absorpsi atom (Spectra-A30) (Cunniff 1999).
Kuantifikasi Kandungan Peroksidasi Lipid
Empat akar dipotong sepanjang 10 mm dari ujung akar, dihaluskan di dalam mortar dan ditambahkan 0.5 ml larutan TCA 15 % (b/v) yang mengandung 1 mM butil hidroksitoluen. Homogenate ditambahkan ke dalam 0.375 ml larutan H3PO4 2% (v/v) dan 0.25 ml thio barbituric acid (TBA) 0.6% (b/v). Campuran diinkubasi pada suhu 1000 C selama 30 menit, kemudian didinginkan pada suhu ruang. Campuran ditambahkan 1 ml n-butanol kemudian dikocok. Butanol dan fase cair dipisahkan dengan cara disentrifugasi. Malondialdehyde (MDA) merupakan produk akhir peroksidasi lipid. Absorbansi TBA-MDA kompleks diukur dengan menggunakan spektrofotometer (Cecil CE 2020) pada λ 532 nm dan komponen karbohidrat lainnya selain MDA diukur pada panjang gelombang 520 nm. Selisih nilai dari kedua panjang gelombang dihitung sebagai nilai MDA (Mihara et al. 1980).
Kuantifikasi Kandungan Kalosa
Sebanyak 20 akar diinkubasi di dalam etanol 96% selama 1 jam, kemudian dipotong sepanjang 10 mm dari ujung akar. Potongan akar dihaluskan di dalam mortar dan ditambahkan 1 ml NaOH 1M. Homogenate dipanaskan pada suhu 800 C selama 15 menit, didinginkan, dan disentrifugasi. Supernatan dan pelet dipisahkan. Pelet ditambahkan 250 µl NaOH 1M dan dipanaskan pada suhu 800 C selama 5 menit. Pelet ditambah 400 µl Aniline blue 0.1%, 200 µl HCl 1 N, dan 500 µl buffer Gly-NaOH pH 9.5. Sampel dipanaskan pada suhu selama 20 menit kemudian disimpan pada suhu ruang dan diukur dengan spektro fluoresens (OSK 6561) pada panjang gelombang 484 nm (Kohle et al. 1985).
Kuantifikasi Kehilangan Integritas Membran
HASIL DAN PEMBAHASAN
Hasil
Pengaruh Cekaman Aluminium
Penghambatan panjang akar.
Perlakuan cekaman 1.6 mM Al menyebabkan reduksi perpanjangan akar baik pada kultivar Slamet maupun kultivar Lumut. Kultivar peka Lumut mengalami reduksi perpanjangan akar (77%-89%) lebih besar daripada kultivar toleran Slamet (70%-86%). Perbedaan pH dapat menyebabkan perbedaan pertumbuhan akar. Pada perlakuan pH 6 tidak terjadi reduksi perpanjangan akar. Hal ini ditunjukkan dengan nilai reduksi perpanjangan akar yang negatif. Akar tumbuhan kedelai pH 6 lebih panjang daripada akar kedelai pH 4. Lamanya waktu cekaman Al menyebabkan peningkatan penghambatan panjang akar (Tabel 1).
Kandungan aluminium
.
Perlakuancekaman 1.6 mM Al menyebabkan kandungan Al yang tinggi pada kedua kultivar. Kultivar Lumut memiliki kandungan Al lebih tinggi dibandingkan dengan kultivar Slamet yang ditunjukkan dengan warna merah pekat hematoksilin setelah perlakuan cekaman Al selama 24 jam (Gambar 1).
Kandungan Al pada akar kedua kultivar semakin tinggi dengan semakin meningkatnya waktu cekaman. Kultivar Lumut memiliki kandungan Al lebih tinggi daripada kultivar Slamet sampai 48 jam setelah perlakuan cekaman, namun kandungan Al cenderung sama pada 72 jam setelah
Lm Sl Lm Sl Lm Sl Lm Sl (a) (b) (c) (d)
Uji histokimia Al dengan pewarnaan hematoksilin pada akar. Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al, jam ke-24 (d). Tanda panah menunjukkan akumulasi Al pada akar. Lm = Lumut, Sl = Slamet.
perlakuan cekaman. Akar tanaman yang direndam pada pH 6 dan 4 memiliki kandungan Al paling sedikit. Diduga kandungan tersebut berasal dari kontaminasi ion Cl- pada saat mengatur pH media (Gambar 2). Cekaman Al dapat menyebabkan luka pada akar. Pelukaan akar terlihat pada daerah 3-5 mm dari ujung akar. Kerusakan akar yang lebih parah terjadi pada daerah 3 mm dari ujung akar daripada daerah 5 mm dari ujung akar. Kerusakan jaringan akar pada kultivar Lumut terjadi sampai ke lapisan dalam korteks, sedangkan pada kultivar Slamet terjadi hanya pada bagian luar korteks (Gambar 3).
Reduksi perpanjangan akar dibandingkan dengan tanaman kontrol pH 4 pH 4 pH 6 pH 4+ 1.6 mM Al * PPA (cm) RPA (%) PPA (cm) RPA (%) PPA (cm) RPA (%) Lama
Cekaman
Sl Lm Sl Lm Sl Lm Sl Lm Sl Lm Sl Lm
8 Jam 1.33 1.12 100 100 1.6 1.18 -20 -5 0.4 0.26 70 77 24 Jam 2.86 2.33 100 100 3.29 2.58 -15 -10 0.71 0.42 75 82 48 Jam 5.2 3.85 100 100 5.95 4.84 -14 -20 0.87 0.5 83 87 72 Jam 6.69 5.19 100 100 7.86 6.1 -17 -18 0.95 0.58 86 89 Tabel 1 Reduksi perpanjangan akar tanaman perlakuan (pH 4 + 1.6 mM Al) dibandingkan
dengan tanaman kontrol pH 4
* PPA : Pertambahan Panjang Akar = Panjang akar jam ke-t – Panjang akar jam ke-0
RPA : Reduksi Perpanjangan Akar terhadap perlakuan pH 4 = PPA pH 4 – PPA perlakuan X 100% PPA pH 4
Sl : Slamet
(a)
(b)
(c)
(d)
[image:30.612.107.382.75.664.2]Lm Sl Gambar 3 Sayatan melintang akar pada daerah
3 mm dari ujung akar.
Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan, pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al, jam ke-24 (d). Tanda panah menunjukkan jaringan akar yang rusak. Lm = Lumut, Sl = Slamet. = 100
μm.
Kandungan peroksidasi lipid. Perlakuan cekaman 1.6 mM Al menyebabkan kandungan peroksidasi lipid yang tinggi padakedua kultivar. Kultivar Lumut memiliki kandungan
peroksidasi lipid lebih tinggi dibandingkan dengan kultivar Slamet. Hal ini ditunjukkan dengan akar yang berwarna merah setelah diwarnai dengan larutan Schiff,s selama 24 jam. Warna akar kultivar Lumut lebih pekat daripada warna akar kultivar Slamet (Gambar 4).
[image:30.612.331.506.370.569.2]Lm Sl Lm Sl Lm Sl Lm Sl (a) (b) (c) (d) Gambar 4 Uji histokimia peroksidasi lipid
dengan larutan Schiff,s pada akar. Tanaman kontrol, pH 6, jam ke-0 (a); perlakuan, pH 6, jam ke-24 (b); pH 4, jam ke-24 (c), dan pH 4 + 1.6 mM Al jam ke-24 (d). Tanda panah menunjukkan akumulasi peroksidasi lipid pada akar. Lm = Lumut, Sl = Slamet.
Peroksidasi lipid pada kultivar Lumut meningkat mulai jam ke-0 sampai jam ke-24 dan menurun mulai jam ke-48, sedangkan pada kultivar Slamet peningkatan kandungan peroksidasi lipid terjadi mulai jam ke-0 sampai jam ke-48 dan penurunan terjadi mulai jam ke-72. Peningkatan peroksidasi lipid pada kultivar Lumut lebih tinggi daripada kultivar Slamet. Kedua kultivar memiliki kandungan peroksidasi lipid yang rendah pada pH 6 dan 4 (Gambar 5).
Gambar 2 Kandungan Al akar. Lm = Lumut, Sl = Slamet.
0 2