ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI BUNGA
TEMBELEKAN (Lantana camara L)
SKRIPSI
YULIA SHARA BR SEMBIRING
120822007
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI BUNGA
TEMBELEKAN (Lantana camara L)
SKRIPSI
Diajukkan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
YULIA SHARA BR SEMBIRING
120822007
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Analisis Komponen Kimia Dan Uji Aktivitas
Antibakteri Minyak Atsiri Bunga Tembelekan (Lantana camara L)
Kategori : Skripsi
Nama : Yulia Shara Br Sembiring
Nomor Induk Mahasiswa : 120822007
Program Studi : Sarjana S-1 Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di Medan, Juni 2014
Komisi Pembimbing
Pembimbing 2, Pembimbing 1,
Dr. Mimpin Ginting,MS Dr. Cut Fatimah Zuhra,M.Si
NIP:195510131986011001 NIP:197404051999032001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU
PERNYATAAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI BUNGA TEMBELEKAN (Lantana camara L)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2014
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, yang telah melimpahkan kasih dan karuniaNya sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk menyelesaikan pendidikan Sarjana Sains di Fakultas MIPA USU. Adapun judul skripsi adalah “Analisis Komponen Kimia dan Uji Aktivitas Antbakteri Minyak Atsiri Bunga Tembelekan (Lantana camara L)”.
Dalam penulisan skripsi ini, Penulis banyak mengalami kesulitan karena kemampuan yang terbatas, tetapi atas perhatian, bimbingan, dorongan dan bantuan yang diberikan dari berbagai pihak kepada penulis sehingga skripsi ini dapat diselesaikan. Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Dr. Sutarman, M.Sc selaku Dekan FMIPA USU
2. Ibu Rumondang Bulan, MS dan Bapak Albert Pasaribu, M.Sc selaku ketua dan sekertaris Departemen Kimia FMIPA-USU.
3. Ibu Dr. Cut Fatimah Zuhra, M.Si selaku pembimbing I serta Bapak Dr. mimpin Ginting, MS selaku pembimbing II yang telah membimbing dan meluangkan waktunya selama penulis melakukan penelitian dan penyusunan skripsi ini hingga selesai.
4. Bapak Prof. Dr. Jamaran Kaban, M.Sc selaku Kepala Bidang Kimia Organik. 5. Bapak dan Ibu Staff pengajar FMIPA-USU serta pegawai Departemen Kimia
FMIPA-USU
6. Asisten Laboratorium Kimia Organik FMIPA-USU Yabes, Lianta, Dian, Shopia, Indah, Priska dan Yulia serta sahabat-sahabat Adelia, Cindy,Echa,Irekha, Martina, Mawar, Maria, Wahida,Windy, Kak Siska, Hamdan P.Purba serta rekan-rekan mahasiswa Kimia Ekstensi 2012 yang memberikan bantuan dan semangat kepada penulis.
Secara khusus penulis ingin menyampaikan terima kasih sebesar-besarnya kepada keluarga terkasih, Ayahanda B. Sembiring, SKM dan Ibunda R.br Barus yang senantiasa memberikan doa serta dukungan moril dan materil hingga akhirnya penulis menyelesaikan studi, serta kepada kedua adik saya Andrea B. Sembiring dan Ferdy R. Sembiring yang telah memberikan semangat dan dukungan.
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI BUNGA TEMBELEKAN (Lantana camara L)
ABSTRAK
Minyak atsiri bunga tembelekan ( Lantana camara L) telah diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Bunga tembelekan didestilasi selama ± 4-5 jam menghasilkan kadar minyak atsiri sebesar 0,0466 %(b/b) . Komponen kimia minyak atsiri bunga tembelekan dianalisis menggunakan GC-MS dan menunjukkan ada 72 senyawa dengan 13 senyawa utama yaitu Kariofilen (10.87%), Davanone (9,84%), α-humulen (7,59 %), α- Kurkumin (3,35%), Germakren-D (3,09%), Kalaren (2,42%), α- murolen (2,27%),p-Cimene
(1,79%), 1,8 sineol (1,59%), Delta-Kadinen (1,59%) ,α-Kopaen
ANALYSIS OF CHEMICAL COMPONENTS AND ANTIBACTERIAL ACTIVITY IN ESSENTIAL OIL OF LANTANA FLOWERS
(Lantana camara L)
ABSTRACT
DAFTAR ISI
Bab 2. Tinjauan Pustaka 2.1. Bunga tembelekan ( Lantana camara L) 5
Bab 3. Metode Penelitian
3.1. Alat-alat 25
3.2. Bahan-bahan 26
3.3. Prosedur Penelitian 26
3.3.1. Penyediaan Sampel 26
3.3.2. Isolasi Minyak Atsiri Bunga
Tembelekan dengan Alat Stahl 26 3.3.3. Analisa Minyak Atsiri Bunga
Tembelekan dengan GC-MS 27
3.3.4. Pengujian Sifat Antibakteri Minyak Atsiri Bunga
Tembelekan 28
3.3.4.1. Pembuatan Media Nutrient
Agar (NA) 28
3.3.4.2. Pembuatan Media Agar Miring
dan Stok Kultur bakteri 28 3.3.4.3. Pembuatan Media Mueller
Hinton Agar (MHA) 29 3.3.4.4. Penyiapan Inokulum Bakteri 29 3.3.4.5. Pembuatan Variasi Konsentrasi
Minyak Atsiri Bunga Tembelekan
(Lantana camara L) 29 3.3.4.6. Uji Aktivitas Antibakteri Minyak
Atsiri Bunga Tembelekan 30
3.4. Bagan Penelitian 31
3.4.1. Isolasi Minyak Atsiri Bunga Tembelekan
dengan Alat Sthal 31
3.4.2. Pengujian Sifat Antibakteri Minyak Atsiri
Bunga Tembelekan 32
3.4.2.1. Pembuatan Media Nutrient Agar (NA) Miring dan Stok
kultur Bakteri 32
3.4.2.2. Pembuatan Media Mueller
Hinton Agar (MHA) 33
3.4.2.3. Penyiapan Inokulum Bakteri 34 3.4.2.4. Uji Aktivitas Antibakteri 35
BAB 4. HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 36
4.1.1. Penetuan Kadar Minyak Atsiri 36
4.1.2. Hasil Analisa dengan GC-MS 39
4.1.3. Hasil Uji Aktivitas Antibakteri 39
4.2. Pembahasan 41
4.2.1. Minyak Atsiri dari Hasil Destilasi
dengan Alat Stahl 41
4.2.2. Analisa Minyak Atsiri Bunga Tembelekan 42 4.2.3. Uji Antibakteri Minyak Arsiri
Bab 5. Kesimpulan dan Saran
5.1. Kesimpulan 60
5.2. Saran 60
Daftar Pustaka 61
DAFTAR TABEL
Halaman
2.1 Perbedaan relatif sifat bakteri gram positif
dan bakteri gram negatif 23
4.1 Hasil Hidrodestilasi Minyak Atsiri Bunga Tembelekan 36 4.2 Senyawa Hasil Analsia GC-MS Minyak Atsiri
Bunga Tembelekan 39
4.3 Hasil Pengukuran diameter zona bening beberapa
DAFTAR LAMPIRAN
Halaman
1. Hasil Indentifikasi Tumbuhan 65
2. Gambar Alat Destilasi Stahl 66
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI BUNGA TEMBELEKAN (Lantana camara L)
ABSTRAK
Minyak atsiri bunga tembelekan ( Lantana camara L) telah diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Bunga tembelekan didestilasi selama ± 4-5 jam menghasilkan kadar minyak atsiri sebesar 0,0466 %(b/b) . Komponen kimia minyak atsiri bunga tembelekan dianalisis menggunakan GC-MS dan menunjukkan ada 72 senyawa dengan 13 senyawa utama yaitu Kariofilen (10.87%), Davanone (9,84%), α-humulen (7,59 %), α- Kurkumin (3,35%), Germakren-D (3,09%), Kalaren (2,42%), α- murolen (2,27%),p-Cimene
(1,79%), 1,8 sineol (1,59%), Delta-Kadinen (1,59%) ,α-Kopaen
ANALYSIS OF CHEMICAL COMPONENTS AND ANTIBACTERIAL ACTIVITY IN ESSENTIAL OIL OF LANTANA FLOWERS
(Lantana camara L)
ABSTRACT
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Indonesia merupakan negara yang cukup berpotensi dalam produksi minyak atsiri.
Penggunaan minyak atsiri dari bahan alam sebagai obat semakin diminati
masyarakat, seiring dengan gerakan kembali ke alam (back to nature) yang
dilakukan masyarakat. Tanaman obat makin penting peranannya dalam
pembuatan makanan, minuman dan obat-obatan. Minyak atsiri dikenal dengan
nama minyak eteris atau minyak terbang (essential oil, volatile) yang merupakan
salah satu hasil metabolisme pada tanaman. Minyak atsiri bersifat mudah
menguap pada suhu kamar, mempunyai rasa getir, berbau wangi sesuai dengan
bau tanaman penghasilnya dan larut dalam pelarut organik dan tidak larut dalam
air (Sudaryani dan Sugiharti, 1990).
Tanaman tembelekan (Lantana camara L) biasa tumbuh liar, tetapi
tembelekan kerap ditemui sebagai pengisi taman ataupun tanaman pekarangan.
Tanaman ini tumbuh di daerah ketinggian sampai 1.700 meter diatas permukaan
laut dan merupakan tumbuhan perdu yang tingginya dapat mencapai 4 meter.
Tanaman Tembelekan mengandung senyawa kimia alkaloid, flavonoid, lemak,
protein, senyawa fenolik dan minyak atsiri (Wirakusumah et al, 1994).
Tembelekan digunakan masyarakat untuk mengobati beberapa macam
penyakit seperti batuk, luka, peluruh air seni, peluruh keringat, penurun panas,
obat bengkak, encok dan bisul. Pemanfaatan tembelekan untuk berbagai penyakit,
digunakan dengan dua cara yaitu pengobatan dari dalam dan dari luar
(Mardisiswojo, 1986).
Hasil analisa komponen minyak atsiri dari daun tembelekan (Lantana
camara L) secara Kromatografi Gas-Spektrometri Massa (GC-MS) yang telah
dilakukan oleh Yuliani (2013) komponen minyak atsiri dalam daun Lantana
Indentifikasi komponen minyak atsiri pada beberapa tanaman Indonesia
yang memiliki bau yang tidak sedap telah dilakukan oleh Indriyanti (2013), hasil
penelitian menunjukkan bahwa dalam daun Lantana camara L diperoleh 37
senyawa minyak atsiri dengan komponen utama 1H-siklopenta[1,3]
siklopropa[1,2] benzene, oktahidro-7-metil-3-metilen-4-(1-metiletil)-,[3aS(3a.
alfa, 3b.beta.,4.beta.,7.alfa.,7aS)] dari hasil analisa GC-MS.
Uji aktivitas antibakteri minyak atsiri dari daun Lantana camara L hasil
isolasi daun basah dan daun kering telah dilakukan oleh Gunawan (1991) dari
hasil penelitian ini diperoleh baik daun yang masih segar maupun yang telah
dikeringkan uji hambat terhadap pertumbuhan bakteri memberikan hasil positif
pada Staphylococcus aureus, namun sama sekali tidak memberikan aktivitas
terhadap Escherechia coli.
Dari uraian yang telah di kemukakan diatas menggambarkan bahwa
penelitian terhadap komponen kimia utama minyak atsiri bunga tembelekan
belum ada dilakukan, atas dasar itu peneliti tertarik untuk mengindentifikasi
komponen atsiri bunga tembelekan (Lantana camara L) serta uji aktivitas
antibakteri dengan menggunakan metode difusi agar terhadap bakteri Basillus
substilis, Propionibacterium acnes, Escherchia coli dan Pseudomonas
aeruginosa.
1.2. Permasalahan
1. Komponen senyawa kimia utama yang terdapat pada minyak atsiri bunga
Tembelekan (Lantana camara L).
2. Bagaimanakah aktivitas antibakteri minyak atsiri bunga Tembelekan
terhadap bakteri Basillus subtilis, Propionibacterium acnes, Eschechia
coli dan Pseudomonas aeruginosa.
1.3. Pembatasan Masalah
1. Bunga Tembelekan berwarna jingga diperoleh dari Desa Lau Simomo
2. Penentuan komponen kimia utama minyak atsiri dari bunga Tembelekan
dilakukan dengan analisa GC-MS.
3. Minyak atsiri bunga Tembelekan diuji terhadap bakteri Basillus subtilis,
Propionibacterium acnes, Eschechia coli dan Pseudomonas aeruginosa
dengan menggunakan metode difusi agar.
1.4. Tujuan Penelitian
1. Untuk mengetahui komponen kimia utama minyak atsiri yang terkandung
di dalam bunga tembelekan melalui analisa GC-MS.
2. Untuk mengetahui aktivitas antibakteri dari minyak atsiri bunga
tembelekan terhadap Basillus subtilis, Propionibacterium acnes,
Eschechia coli dan Pseudomonas aeruginosa.
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai komponen
kimia utama minyak atsiri dalam bunga Tembelekan serta sifat antibakteri
terhadap bakteri yakni Basillus substilis, Propionibacterium acnes, Escherchia
coli dan Pseudomonas aeruginosa.
1.6. Lokasi Penelitian
Penelitian untuk isolasi minyak atsiri dilakukan di Laboratorium Kimia
Organik FMIPA USU Medan, penelitian untuk uji aktivitas antibakteri dilakukan
di laboratorium Mikrobiologi Fakultas Farmasi USU Medan dan analisa GC-MS
1.7. Metodologi Penelitian
Penelitian ini dilakukan melalui eksperimen laboratorium dengan
menggunakan sampel bunga tembelekan berwarna jingga. Dimana minyak atsiri
bunga tembelekan diperoleh dengan metode hidrodestilasi menggunakan alat
Stahl. Minyak atsiri yang diperoleh dipisahkan dari lapisan airnya kemudian
ditambahkan Na2SO4 anhidrous untuk menghilangkan kandungan airnya,
kemudian disaring.Minyak atsiri yang diperoleh dianalisa dengan metode GC-MS
untuk mengetahui komponen kimianya, serta dilakukan pengujian aktivitas
antibakteri dengan menggunakan metode difusi agar terhadap bakteri Basillus
substilis, Propionibacterium acnes, Escherchia coli dan Pseudomonas
BAB 2
TINJAUAN PUSTAKA
2.1. Bunga Tembelekan (Lantana camara L)
Berdasarkan taksonomi tanaman, bunga tembelekan termasuk dalam dalam:
Kingdom : Plantae
Nama lokal: bunga tahi ayam, kembang telek, tembelekan, embang satek,
saliyara, saliyere, tahi ayam, tahi kotok, cente (Sunda); kembang telek, obio,
puyengan, tembelek, tembelekan, teterapan (Jawa); Kamanco, mainco, tamanjho
(Madura); bunga pagar, kayu singapur, lai ayam (Sumatera).
Nama asing : Lantana, common lantana, yellow sage (Inggris, Amerika);
wusemeigen (akar), wusemeiye (daun atau ranting muda), wusemei (bunga, Cina);
utot-utot, baho-baho (Filipina) (Tim Trubus, 2013).
Morfologi dari tanaman tembelekan yaitu:
a. Batang
Perdu, tegak hingga setinggi 4 m. Batang persegi, berkayu, bercabang
banyak. Ranting persegi, sedikit berduri, dan berambut.
b. Daun
Tangkai daun sekitar 1 cm. Daun tunggal tersusun saling bertolak
belakang. Lembaran daun oval, bulat telur, permukaan atas kasar, berambut
pendek dan banyak sedangkan permukaan bawahnya berambut jarang. Ujung
daun meruncing dengan pangkap tumpul. Panjang daun 5-8 cm dengan lebar 3,5-5
cm. Tepian daun bergerigi halus. Ketika diremas mengeluarkan aroma kuat.
c. Bunga
Bunga tembelekan mempunyai warna perpaduan warna krem, merah muda
jingga. Terkadang bunga terdiri dari campuran dua warna. Bunga membentuk
kumpulan bunga kecil membulat, perbungaan majemuk.Mahkota bagian dalam
berambut.
d. Buah
Buah tembelekan berbentuk sperikal. Buah jenis beri berair yang
membentuk satu kumpulan. Warna buah hijau berubah menjadi warna hitam
ketika masak. Tangkai berambut (Tim Trubus, 2013).
Gambar 2.1. Bunga Tembelekan (Lantana camara L)
2.1.1. Kandungan Kimia Tembelekan
Ekstrak metanol daun Tembelekan menghasilkan euphene triterpene
lakton. Akar mengandung verbascose, ajugose, lantanose, A, B, theveside,
theveiridoside, shanzhiside metil ester, dan lantanolic acid. Daun yang terdapat
di cabang yang lunak mengandung lantadene A, B, lantanolic acid, oleanolic
acid, oleanonic acid, betulic acid, betulic acid, dan lantabetulic acid. Bunga
mengandung minyak volatile humule, alpa-terpinene, gama-Terpinene, alpa-
Pinene, beta–Pinene dan P-cymene. Minyaknya mengandung sesquiterpene
curcumene dan safrole. Selain flavon glikosida, bunganya mengandung
digalacturonide flavon, leuteolin 7-0-beta-galacturonyl-(2-1)-0-
beta-galacturonide (Abou El-Kassem et al, 2012). Kandungan utama minyak esensial
tembelekan yaitu Germacrene-D dan E-caryophyllene. Akarnya mengandung
3beta,19alpa dihydroxy ursan-28-oic acid dan 21, 22beta-epoxy-3-beta-hydroxy
olean-12-en-28-oic acid dalam bentuk metil ester (Passos JL et al, 2012).
2.1.2. Manfaat Tembelekan
Tumbuhan Lantana camara L digolongkan ke dalam tumbuhan berkhasiat obat
sebab bagian dari tumbuhan ini sering digunakan sebagai bahan dasar untuk
pengobatan tradisional dan diyakini dapat menyembuhkan beberapa macam
penyakit. Misalnya, bagian akar digunakan untuk obat reumatik yaitu dengan
menggunakan air rebusan akar untuk mandi. Bagian kulit digunakan sebagai obat
sakit kulit yaitu cara menempelkan daun segar yang dilumatkan ke tempat yang
sakit atau direbus secukupnya dan digunakan sebagai pencuci penyakit kulit, bisul
menghilangkan rasa gatal (anti pruritas) dan pembengkakan (anti swelling).
Sedangkan bagian bunga dapat digunakan sebagai obat untuk penyakit tbc
(Kloppenburg dan Verteegh, 1983; Wijayakusuma et al,1995).
Pemanfaatan tembelekan untuk pengobatan berbagai penyakit digunakan
dengan dua cara yaitu pengobatan dari dalam dan dari luar. Pengobatan dari dalam
dengan cara merebus bagian yang diperlukan dengan ukuran secukupnya, dicuci
bersih dan direbus dengan air secukupnya. Setelah itu, disaring dan didinginkan.
Dalam kondisi hangat diminum oleh penderita. Hal ini dilakukan secara rutin
setiap hari sampai sembuh. Ini digunakan untuk menyembuhkan penyakit sesak
nafas, kencing nanah dan lain-lain. Sedangkan untuk pengobatan luar biasanya
untuk penyakit bisul, luka dan lain-lain yang terlihat dari luar caranya cukup
mengambil bagian yang diperlukan secukupnya, cuci bersih setelah itu tumbuk
halus. Balurkan hasil tumbukan tersebut pada bagian yang sakit (Suparni dan
Wulandari, 2012).
2.2 Minyak Atsiri
Minyak atsiri dikenal dengan nama minyak eteris atau minyak terbang
(essential oil, volatile) yang merupakan salah satu hasil metabolisme tanaman.
wangi sesuai dengan bau tanaman penghasilnya. Minyak atsiri larut dalam pelarut
organik dan tidak larut dalam air (Sudaryani dan Sugiharti, 1990).
Minyak atsiri yang juga disebut minyak ateris merupakan minyak yang
mudah menguap dengan komposisi yang berbeda-beda sesuai sumber
penghasilnya. Minyak atsiri bukan merupakan zat kimia murni, melainkan terdiri
dari berbagai campuran zat yang memiliki sifat fisika dan kimia berbeda-beda
(Lutony, 2002).
Minyak atsiri yang dihasilkan baik yang berasal dari bagian tanaman yang
basah maupun kering menunjukkan variasi yang cukup besar dalam sifat-sifat
fisika kimia maupun komposisi kimia yang terkandung. Sifat-sifat ini ditunjukkan
pada minyak atisiri yang berasal dari bunga-bunga, daun, herba, dan akar di mana
dalam keadaan basah mengandung banyak uap air. Selama pelayuan dan
pengeringan, membran sel berangsur-angsur akan pecah, cairan bebas melakukan
penetrasi dari satu sel ke sel lain hingga membentuk senyawa-senyawa yang
mudah menguap. Daun nilam yang dipanen dalam keadaan segar hampir tidak
berbau, namun bau akan muncul bila daun dikeringkan dan diawetkan
(Sastrohamidjojo, 2004).
Minyak atsiri pada industri banyak digunakan sebagai bahan pembuat
kosmetik, parfum, antiseptik dan lain-lain. Beberapa jenis minyak atsiri mampu
bertindak sebagai bahan terapi (aromaterapi) atau bahan obat suatu jenis penyakit.
Fungsi minyak atsiri sebagai bahan obat tersebut disebabkan adanya bahan aktif
sebagai contoh bahan anti radang, hepatoprotektor, analgetik, anestetik, antiseptik,
psikoaktif dan antibakteri (Agusta,2000).
2.2.1 Isolasi Minyak Atsiri dengan Destilasi
Destilasi dapat didefenisikan sebagai cara penguapan dari suatu zat dengan
perantara uap air dan proses pengembunan berdasarkan perbedaan titik didihnya.
Destilasi merupakan metode yang paling berfungsi untuk memisahkan dua zat
yang berbeda, tetapi tergantung beberapa faktor, termasuk juga perbedaan tekanan
tersebut. Destilasi melepaskan uap air pada sebuah zat yang tercampur yang kaya
dengan komponen yang mudah menguap daripada zat tersebut ( Pasto, 1992).
Minyak atsiri, minyak mudah menguap, atau minyak terbang merupakan
campuran dari senyawa yang berwujud cairan atau padatan yang memiliki
komposisi maupun titik didih yang beragam. Penyulingan dapat didefenisikan
sebagai proses pemisahan komponen-komponen suatu campuran yang terdiri atas
dua cairan atau lebih berdasarkan perbedaan titik didih komponen-komponen
senyawa tersebut.
Penyulingan suatu campuran yang berwujud cairan yang tidak saling
bercampur, hingga membentuk dua fase atau dua lapisan. Keadaan ini terjadi pada
pemisahan minyak atsiri dengan uap air. Penyulingan dengan uap air sering
disebut hidrodestilasi. Pengertian umum ini memberikan gambaran bahwa
penyulingan dapat dilakukan dengan cara mendidihkan bahan tanaman atau
minyak dengan air. Pada proses ini akan dihasilkan uap air yang dibutuhkan alat
penyuling (Sastrohamidjojo, 2004).
Dalam pengertian industri minyak atsiri dibedakan tiga tipe destilasi, yaitu:
1.Penyulingan Air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak
langsung dengan air mendidih. Bahan dapat mengapung di atas air atau terendam
secara sempurna, tergantung pada berat jenis dan jumlah bahan dan air mendidih
(Lutony, 2002). Perbandingan jumlah air perebus dan bahan baku dibuat
seimbang, sesuai dengan kapasitas ketel. Bahan yang telah mengalami proses
pendahuluan seperti perajangan dan pelayuan dimasukkan dan dipadatkan.
Selanjutnya ketel ditutup rapat agar tidak terdapat celah yang mengakibatkan uap
keluar (Armando, 2009).
2.Penyulingan Uap dan Air
Bahan tanaman yang akan diproses secara penyulingan uap dan air
ditempatkan dalam suatu tempat yang bagian bawah dan tengah berlobang-lobang
yang ditopang di atas dasar alat penyulingan. Bagian bawah alat penyulingan diisi
air sedikit di bawah dimana bahan ditempatkan. Air dipanaskan dengan api seperti
pada penyulingan air di atas. Bahan tanaman yang akan disuling hanya terkena
3.Penyulingan Uap
Penyulingan uap disebut juga penyulingan tak langsung. Didalam proses
penyulingan dengan uap ini, uap dialirkan melalui pipa uap berlingkar yang berpori
dan berada si bawah bahan tanaman yang akan disuling. Kemudian uap akan bergerak
menuju ke bagian atas melalui bahan yang disimpan di atas saringan (Lutony, 1994).
Sistem penyulingan ini baik untuk mengekstraksi minyak dari biji-bijian, akar dan
kayu-kayuan yang umumnya mengandung komponen minyak yang bertitik didih
tinggi dan tidak baik dilakukan terhadap bahan yang mengandung minyak atsiri yang
mudah rusak oleh pemanas dan air (Ketaren, 1985).
2.2.2 Komponen Kimia Minyak Atsiri
Pada umumnya perbedaan minyak atsiri komposisi minyak atsiri disebabkan
perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur
pemanenan, metode ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri terdiri dari berbagai campuran persenyawaan kimia yang
terbentuk dari unsur Karbon (C), Hidrogen (H), dan Oksigen (O). Pada umumnya
komponen kimia minyak atsiri dibagi menjadi dua golongan yaitu : 1) Hidrogen
yang terutama terdiri dari persenyawaan terpen dan 2) Hidrokarbon teroksigenasi.
1. Golongan hidrokarbon yang terdiri dari persenyawaan Terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur karbon (C)
dan Hidrogen (H). Jenis hidrokarbon yang terdapat dalam minyak atsiri
sebagian besar terdiri dari monoterpen ( 2 unit isoprene), sesquiterpen ( 3
unit isoprene), diterpen ( 4 unit isoprene) dan politerpen.
2. Golongan hidrokarbon teroksigenasi
Komponen kimia dari golongan persenyawaan ini terbentuk dari unsur
Karbon (C), Hidrogen (H), dan Oksigen (O). Persenyawaan yang termasuk
dalam golongan ini adalah persenyawaan alkohol, aldehid, keton, ester,
eter dan fenol. Ikatan karbon yang terdapat dalam molekulnya dapat terdiri
dari ikatan tunggal, ikatan rangkap tiga. Terpen mengandung ikatan
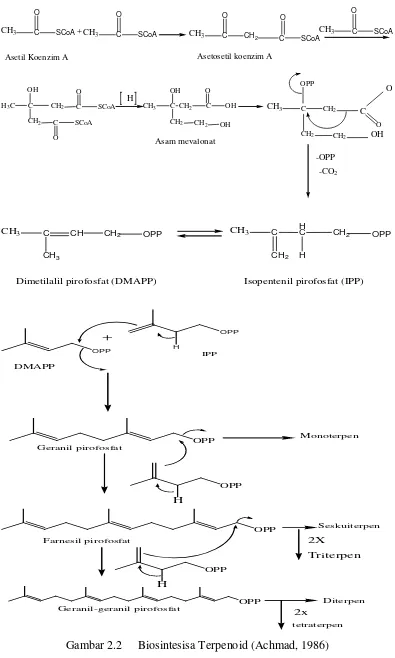
2.2.3 Biosintesis Minyak Atsiri
Berdasarkan proses biosintesisnya atau pembentukan komponen minyak
atsiri di dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan.
Golongan pertama adalah turunan terpena yang terbentuk dari asam asetat melalui
jalur biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang
terbentuk dari biosintesis asam sikimat melalui jalur fenil propanoid (Agusta,
2000). Mekanisme dari tahap-tahap reaksi biosintesis terpenoid yaitu asam asetat
yang telah diaktifkan oleh koenzim A melalui kondensasi jenis Claisen
menghasilkan asam asetoasetat. Senyawa yang dihasilkan ini dengan koenzim A
melakukan kondensasi sejenis aldol menghasilkan rantai karbon bercabang
sebagaimana ditemukan pada asam mevalonat. Reaksi-reaksi berikutnya ialah
fosforilasi, eliminasi asam fosfat dan dekarboksilasi menghasilkan IPP
(Isopentenil Pirofosfat) yang selanjutnya berisomerisasi menjadi DMAPP
(Dimetilalil Pirofosfat) oleh enzim isomerase. IPP sebagai unit isoprene aktif
bergabung secara kepala ke ekor dengan DMAPP dan penggabungan ini
merupakan langkah pertama dari polimerisasi isopren untuk menghasilkan
terpenoid. Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap
IPP terhadap atom karbon dari DMAPP yang kekurangan elektron diikuti oleh
penyingkiran ion pirofosfat. Serangan ini menghasilkan geranil pirofosfat (GPP)
yakni senyawa antara bagi semua senyawa monoterpen.
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi
organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi
selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan
senyawa-senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi
sekunder pula. Reaksi –reaksi sekunder ini lazimnya adalah hidrolisa, siklisasi,
oksidasi, reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan
mudah dalam suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi,
dekarboksilasi, dan sebagainya.Berikut ini adalah gambar biosintesa terpenoid
CH3 C
Asetil Koenzim A Asetosetil koenzim A
CH3 C
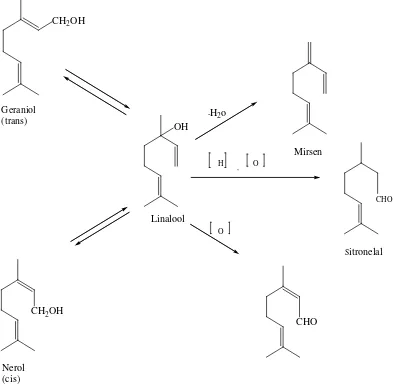
Untuk menjelaskan hal diatas dapat diambil beberapa contoh monoterpen. Dari
segi biogenetik, perubahan geraniol, nerol, dan linalool dari satu menjadi yang
lain berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang
berasal dari hidrolisa geranil pirofosfat (GPP) dapat menjalani reaksi-reaksi
sekunder berikut, misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi
sitral dan oksidasi reduksi menghasilkan sitronelal.
Berikut ini contoh perubahan senyawa monoterpen dapat dilihat pada gambar 2.3
CH2OH
Geraniol (trans)
OH
-H2o
Mirsen
CHO
Sitronelal
H , O
Linalool
CH2OH
Nerol (cis)
O
CHO
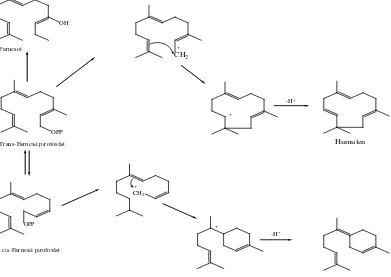
Senyawa-senyawa seskuiterpen diturunkan dari cis-farsenil pirofosfat dan
trans-farsenil pirofosfat melalui reaksi siklisasi dan reaksi sekunder lainnya.
Kedua isomer farsenil pirofosfat ini dihasilkan in vivo melalui mekanisme yang
sama seperti isomerisasi antara geraniol dan nerol.
Perubahan farsenil pirofosfat menjadi sekuiterpen dapat dilihat pada gambar 2.4.
OH
Farnesol
OPP
Trans-Farnesil pirofosfat
CH2 +
+
OPP
cis-Farnesil pirofosfat
CH2
+
+
-H+ -H+
Humulen
Bisabolen
Gambar 2.4 Reaksi biogenetik beberapa seskuiterpena
2.3 Analisa Komponen Kimia Minyak Atsiri
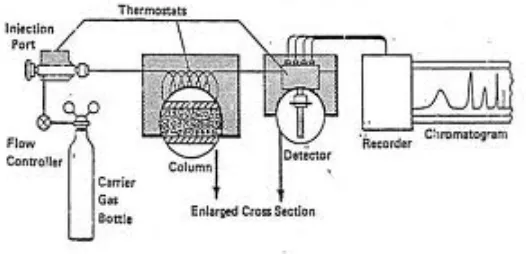
2.3.1 Kromatografi Gas-Spektroskopi Massa (GCMS)
GCMS merupakan metode pemisahan senyawa organik yang menggunakan dua
senyawa secara kuantitatif dan Spektrometri Massa (MS) untuk mengetahui massa
molekul relatif dan pola fragmentasi senyawa yang dianalsis.
Kromatografi Gas merupakan salah satu tehnik analisa yang menggunakan
prinsip pemisahan migrasi komponen-komponen penyusunya. Kromatografi gas
biasa digunakan untuk mengindentifikasi suatu senyawa yang terdapat pada
campuran gas dan juga menentukan konsentrasi suatu senyawa dalam fase gas.
Spektroskopi massa adalah suatu metode untuk mendapatkan berat
molekul dengan cara mencari perbandingan massa terhadap muatan dari ion yang
muatannya diketahui dengan mengukur jari-jari orbit melingkarnya dalam medan
magnetik seragam. Penggunaan kromatografi gas dapat dipadukan dengan
spektroskopi massa. Paduan keduanya dapat menghasilkan data lebih akurat
dalam mengindentifikasi senyawa yang dilengkapi dengan struktur molekulnya
(Pavia, 2006).
Sekarang ini sistem GC-MS sebagian digunakan sebagai peran utama
untuk analisa makanan dan aroma, petroleum, petrokimia dan zat-zat kimia di
laboratorium. Kromatografi gas merupakan kunci dari suatu tehnik analitik dalam
pemisahan komponen mudah menguap, yaitu dengan mengkombinasikan secara
tepat analisa sehingga pemecahan yang tinggi mengurangi pengoperasian.
Keuntungan dari kromatografi gas adalah hasil kuantitatif yang bagus dan
harganya lebih murah. Sedangkan kerugiannya tidak dapat memberikan indentitas
atau struktur untuk setiap puncak yang dihasilkan dan saat proses karateristik yang
didefenisikan sistem tidak bagus (Mcnair, 2009).
Adapun Prinsip kerja dari alat GC-MS adalah sebagai berikut
1. Kromatografi Gas
Kromatografi gas (GC) merupakan jenis kromatografi yang digunakan
dalam kimia organik untuk pemisahan dan analisis. Kromatografi Gas dapat
digunakan untuk menguji kemurniaan dari bahan tertentu, atau memisahkan
berbagai komponen dari campuran. Dalam beberapa situasi, GC dapat membantu
dalam mengindentifikasi sebuah senyawa kompleks. Dalam kromatografi gas,
fase yang bergerak atau mobile phase adalah sebuah operator gas, yang biasanya
gas murni seperti helium atau yang tidak reaktif seperti gas nitrogen. Fase diam
atau stationary phase merupakan tahap mikroskopis lapisan cair atau polimer
yang mendukung gas murni, di dalam bagian dari sistem pipa-pipa kaca atau
logam yang disebut kolom. Instrumen yang digunakan untuk melakukan
kromatografi gas disebut gas chromatograph (Fowlis, 1998).
Instrumentasi dari alat GC antara lain:
a.Gas Pembawa
Gas pembawa yang paling sering dipakai adalah helium (He), argon (Ar),
nitrogen (N2), hidrogen (H2), dan karbondioksida (CO2
b.Injeksi Sampel
). Keuntungannya adalah
karena semua gas ini tidak reaktif dan dapat dibeli dalam keadaan murni dan
kering yang dikemas dalam tangki tekanan tinggi. Pemilihan gas pembawa
tergantung pada detektor yang dipakai. Gas pembawa harus memenuhi sejumlah
persyaratan, antara lain harus inert (tidak bereaksi dengan sampel, pelarut sampel,
material dalam kolom), murni, dan mudah diperoleh (Agusta, 2000).
Cuplikan dimasukkan ke dalam ruang suntik melalui gerbang suntik,
biasanya berupa lubang yang ditutupi dengan septum atau pemisah karet. Ruang
suntik harus dipanaskan tersendiri, terpisah dari kolom dan biasanya pada suhu
10-15ºC lebih tinggi dari suhu maksimum. Jadi seluruh cuplikan diuapkan segera
setelah disuntikkan dan dibawa ke kolom ( Gritter et al, 1991).
c. Kolom
Kolom merupakan tempat terjadinya proses pemisahan karena di
dalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen
sentral pada kromatografi gas (Rohman, 2009). Keberhasilan suatu proses
pemisahan terutama ditentukan oleh pemilihan kolom. Kolom dapat terbuat dari
lurus,melengkung,atau gulungan spiral sehingga lebih menghemat ruang (Agusta,
2000).
Fase diam disapukan pada permukaan dalam medium, seperti tanah diatom
dalam kolom atau dilapiskan pada dinding kapiler. Berdasarkan bentuk fisiknya,
fase diam yang umum digunakan pada kolom adalah fase diam padat dan fase
diam cair.
Berdasarkan sifatnya fase diam dibedakan berdasarkan kepolarannya, yaitu
nonpolar, sedikit polar, setengah polar (semi polar), dan sangat polar. Berdasarkan
sifat minyak atsiri yang non polar sampai sedikit polar, untuk keperluan analisis
sebaiknya digunakan kolom dalam fase diam yang bersifat sedikit polar. Jika
dalam analisis minyak atsiri digunakan kolom yang lebih polar, sejumlah puncak
yang dihasilkan menjadi lebar (lebih tajam) dan sebagai puncak tersebut juga
membentuk ekor.Begitu juga dengan garis dasarnya tidak rata dan terlihat
bergelombang. Bahkan kemungkinan besar komponen yang bersifat nonpolar
tidak akan terdeteksi sama sekali (Agusta, 2000).
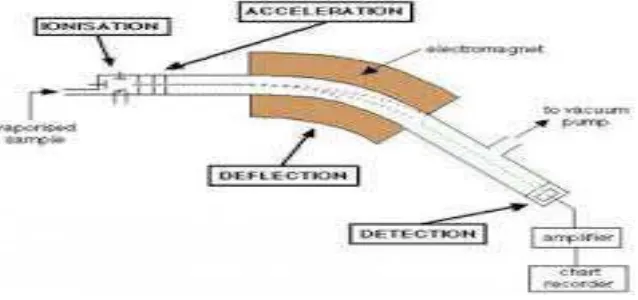
1. Spektrometri Massa
Gambar 2.6 Skema Alat Spektroskopi Massa
Prinsip spektrometri massa (MS) ialah molekul senyawa organik (sampel)
ditembak dengan berkas elektron dan menghasilkan ion bermuatan positif yang
mempunyai energi yang tinggi karena lepasnya elektron dari molekul yang dapat
pecah menjadi ion positif yang lebih kecil (ion fragmen). Spektrum massa
merupakan grafik antara limpahan relatif lawan perbandingan massa/muatan (m/z)
Adapun instrumentasi dari alat spektroskopi massa sebagai berikut:
a.Sumber Ion
Setelah melewati rangkaian kromatografi gas, sampel gas akan dijuji
dilanjutkan melalui rangkaian spektroskopi massa. Molekul-molekul yang
melewati sumber ion ini diserang untuk melewati filter, partikel-partikel sampel
haruslah bermuatan.
b.Filter
Selama ion melalui rangkaian spektroskopi massa, ion-ion ini melalui
rangkaian elektromagnetik yang menyaring ion berdasarkan perbedaan massa.
Para ilmuwan memisahkan komponen-komponen massa untuk kemudian dipilih
yang mana yang boleh melanjutkan yang mana tidak (prinsip penyaringan). Filter
ini terus menyaring ion-ion yang berasal dari sumber ion untuk kemudian
diteruskan ke detektor.
c.Detektor
Ada beberapa tipe detektor yang biasa digunakan. Dalam mekanisme
reaksi, pembakaran senyawa organik merupakan hal yang sangat kompleks.
Selama proses, sejumlah ion-ion dan elektron-elektron dihasilkan dalam nyala.
Kehadiran ion dan elektron dideteksi. Seluruh detektor ditutup dalam oven yang
lebih panas dibanding dengan temperatur kolom. Hal ini menghentikan
kondensasi dalam detektor.
Pada metode analasis GCMS (Gas Chromatography Mass Spectroscopy)
adalah dengan membaca spektra yang terdapat pada kedua metode yang digabung
tersebut. Pada spektra GC jika terdapat bahwa dari sampel mengandung banyak
senyawa, terlihat dari banyaknya puncak (peak) dalam spektra GC tersebut.
Berdasarkan data waktu retensi yang sudah diketahui dari literatur, bisa diketahui
senyawa apa saja yang ada dalam sampel.
Selanjutnya adalah dengan memasukan senyawa yang diduga tersebut
kedalam instrument spektroskopi massa. Hal ini dapat dilakukan karena salah satu
kegunaan dari kromatografi gas adalah untuk memisahkan senyawa-senyawa dari
suatu sampel. Setelah itu, didapat hasil dari spektra spektroskopi massa pada
Informasi yang diperoleh dari kedua tehnik ini yang digabung dalam
instrumen GCMS adalah hasil dari masing-masing spektra. Untuk spektra GC,
informasi terpenting yang didapat adalah waktu retensi untuk tiap-tiap senyawa
dalam sampel. Sedangkan untuk spektra MS bias diperoleh informasi mengenai
massa molekul relatif dari sampel tersebut (Skoog, 1991).
Peningkatan penggunaan GC-MS banyak digunakan yang dihubungkan
dengan komputer dimana dapat merekam dan menyimpan data dari sebuah
analisis akan berkembang pada pemisah yang lebih efesien. Karena komputer
dapat diprogram untuk mencari spektra library yang langka, membuat
indentifikasi dan menunjukkan analisis campuran gas tersebut (Willet, 1987).
2.4 Bakteri
Bakteri (tunggal: bacterium) adalah kelompok mikroorganisme yang
sangat penting karena pengaruhnya yang membahayakan maupun
menguntungkan. Mereka tersebar luas di lingkungan sekitar kita. Mereka dijumpai
di udara, air dan tanah, dalam usus binatang, lapisan yang lembab pada mulut,
hidung atau tenggorokan, pada permukaan tubuh atau tumbuhan (Gaman,1981).
Bakteri merupakan organisme yang sangat kecil (berukuran mikroskopi).
Bakteri rata-rata berukuran lebar 0,5 – 1 mikron dan panjang hingga 10 mikro
(1 mikron – 103
Bakteri dibedakan atas dua kelompok bedasarkan komposisi dinding sel
serta sifat pewarnaannya, yaitu bakteri gram positif dan bakteri gram negatif.
Selain perbedaan dalam sifat pewarnaannya, bakteri gram positif dan bakteri gram
negatif berbeda dalam sensivitasnya terhadap kerusakan mekanis/fisis, terhadap
enzim, disinfektan dan antibiotik (Lay, 1994).
mm). Untuk melihat bakteri dengan jelas, tubuhnya perlu diisi
dengan zat warna, pewarna ini disebut pengecatan bakteri (Irianto, 2006).
2.4.1 Bakteri Gram Positif
Bakteri gram positif, yaitu bakteri yang dapat mengikat zat warna pertama
warna ungu tersebut akan tetap kelihatan. Kemudian ditambahkan zat warna
kedua (safranin), warna ungu pada bakteri tidak berubah (Lay, 1994).
2.4.1.1 Basillus subtilis
Berbentuk batang dan membentuk spora. Sering menimbulkan
permasalahan pada industri pengalengan karena sporanya sangat tahan terhadap
panas. Basillus antracis menyebabkan penyakit anthrax pada manusia dan hewan,
B.subtilis (B.mesentericus) menyebabkan suatu tipe kerusakan yang disebut
dengan ropiness pada roti, dan B.cereus dapat menyebabkan keracunan pangan
(Gaman, 1992). Berikut ini adalah gambar dari bakteri Basillus subtilis pada
gambar 2.7.
Gambar 2.7 Basillus subtilis
2.4.1.2 Propionibacterium acnes
Propionibacterium acnes termasuk dalam kelompok bakteri orynebacteria.
Bakteri ini termasuk flora normal kulit, berperan pada pathogenesis jerawat
dengan menghasilkan lipase yang memecah asam lemak bebas dari lipid kulit.
Asam lemak ini dapat mengakibatkan inflamasi jaringan ketika berhubungan
dengan sistem imun dan mendukung terjadinya akne. Propionibacterium acnes
termasuk bakteri yang tumbuh relatif lambat. Bakteri ini tipikal bakteri anaerob
Berikut ini adalah gambar dari bakteri Propionibacterium acnes pada gambar 2.8.
Gambar 2.8 Propionibacterium acne
2.4.2 Bakteri Gram Negatif
Bakteri gram negatif, yaitu bakteri yang kehilangan warna Kristal violet ketika
dicuci dengan alkohol dan setelah diberi zat warna kedua (Safranin), bakteri akan
memberikan warna merah muda (Lay, 1994).
2.4.2.1 Pseudomonas aeruginosa
Pseudomonas aeruginosa berupa bakteri gram negatif obligat, berkapsul,
mempunyai flagella polar sehingga bakteri ini bersifat motil, berukuran sekitar
0,5-1,0 µm, tidak menghasilkan spora dan tidak dapat memfermentasikan
karbohidrat. Pseudomonas aeruginosa dapat menginfeksi seseorang yang
mengalami gangguan pada sistem pertahanan tubuhnya, misalnya pada orang
yang menderita luka bakar, pada orang yang mengalami gangguan metabolisme
dan pada penderita yang mendapat pengobatan radiasi (Pelczar, 1988).
Pseudomonas merupakan salah satu jenis dalam kelompok ini yang sering
menimbulkan kebusukan makanan. Pertumbuhan pada kondisi aerobik berjalan
cepat, dan biasanya membentuk lendir. Kebanyakan Pseudomonas, kecuali P.
Syringe, bersifat oksidase positif, dan akan membentuk warna biru jika ditambah
senyawa dimetil-p-fenilenediamin dihidroklorida. Tidak tahan terhadap panas dan
keadaan kering. Oleh karena itu, mudah dibunuh dengan proses pemanasan dan
Berikut ini adalah gambar dari bakteri Pseudomonas aeruginosa pada gambar
2.9.
Gambar 2.9 Pseudomonas aeruginosa
2.4.2.1. Escherichia coli
Bakteri Escherichia coli yang merupakan flora normal pada saluran pencernaan
dapat berubah menjadi oportunis patogen bila hidup di luar usus, misalnya pada
infeksi saluran kemih, infeksi luka dan mastitis. E.coli merupakan bakteri batang
gram negatif, tidak berkapsul, umumnya mempunyai fimbria dan bersifat motile
(Supardi dan Sukamto, 1999).
E. coli mungkin menyebabkan diare dengan salah satu dari dua mekanisme
: (1) dengan produksi enterotoksin yang secara tidak langsung menyebabkan
kehilangan cairan; dan (2) dengan invasi yang sebenarnya lapisan epitelium
dinding usus, yang menyebabkan peradangan dan kehilangan cairan (Volk, 1989).
Berikut ini adalah gambar dari bakteri Esherichia coli pada gambar 2.10.
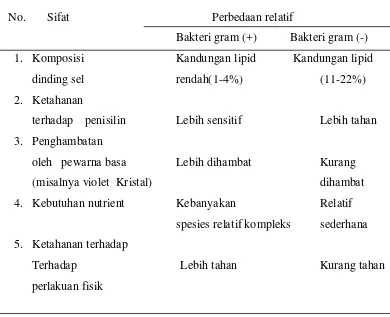
Tabel 2.1 Perbedaan relatif sifat bakteri gram positif dan bakteri gram negatif dapat dilihat sebagai berikut (Fardiaz, 1992)
No. Sifat Perbedaan relatif
Bakteri gram (+) Bakteri gram (-)
1. Komposisi Kandungan lipid Kandungan lipid
dinding sel rendah(1-4%) (11-22%)
2. Ketahanan
terhadap penisilin Lebih sensitif Lebih tahan
3. Penghambatan
oleh pewarna basa Lebih dihambat Kurang
(misalnya violet Kristal) dihambat
4. Kebutuhan nutrient Kebanyakan Relatif
spesies relatif kompleks sederhana
5. Ketahanan terhadap
Terhadap Lebih tahan Kurang tahan
perlakuan fisik
2.5Antibakteri
Antibakteri merupakan bahan atau senyawa yang khusus digunakan untuk
kelompok bakteri. Antibakteri dapat dibedakan berdasarkan mekanisme kerjanya,
yaitu antibakteri yang menghambat pertumbuhan dinding sel, antibakteri yang
mengakibatkan perubahan permeabilitas membran sel atau menghambat
pengangkutan aktif melalui membran sel, antibakteri yang menghambat sintesis
protein, dan antibakteri yang menghambat sintesis asam nukleat sel. Aktivitas
antibakteri dibagi menjadi 2 macam yaitu aktivitas bakteriostatik (menghambat
pertumbuhan tetapi tidak membunuh patogen) dan aktivitas bakterisidal (dapat
2.5.1 Uji Efek Antibakteri
Pengujian antimikroba dilakukan untuk mengukur respon pertumbuhan
populasi mikroorganisme terhadap agen antimikroba. Kegunaan uji antimikroba
adalah diperolehnya suatu sistem pengobatan yang efektif dan efesien. Ada dua
metode utama dalam pengujian antimikroba , yaitu:
2.5.1.1Metode Difusi
Metode difusi merupakan salah satu metode yang sering digunakan, metode difusi
dapat dilakukan dalam 5 cara menurut Pratiwi (2005), yaitu metode disc diffusion
(tes Kirby& Bauer), e-test, disc-plate technique, cup-pate technique,
gradient-palte technique.
Penentuan aktivitas antimikroba dapat dilakukan dengan metode difusi
agar, diantaranya dimana menggunakan piringan yang berisi agen antimikroba,
kemudian diletakkan pada media agar yang sebelumnya telah ditanami
mikroorganisme sehingga agen antimikroba dapat berdifusi pada media agar
tersebut. Area jernih mengindikasi adanya hambatan pertumbuhan
mikroorganisme oleh agen antimikroba pada permukaan agar (Aziz, 2010).
2.5.1.2. Metode Dilusi
Metode dilusi (metode pengenceran) merupakan metode yang dilakukan dengan
mengencerkan zat antimikroba dan dimasukkan kedalam tabung-tabung reaksi
steril. Masing-masing tabung tersebut ditambahkan sejumlah mikroba uji yang
telah diketahui jumlahnya. Pada interval tertentu, dilakukan pemindahan dari
tabung reaksi ke dalam tabung-tabung berisi media steril kemudian diinkubasi dan
diamatipenghambatan pertumbuhan (Kusmiyati dan Agustini, 2007). Menurut
Pratiwi (2008), metode dilusi dibedakan menjadi dua, yaitu dilusi cair (bruch
BAB 3
METODE PENELITIAN
3.1 Alat-alat Alat Stahl
GC-MS Shimadzu
Gelas ukur 100 mL Pyrex
Gelas ukur 10 mL Pyrex
Gelas Erlenmeyer 250 mL Pyrex
Beaker Glass 50 mL Pyrex
Labu destilasi 2000 mL Pyrex
Pipet tetes
Tabung reaksi Pyrex
Pipet serologi Pyrex
Neraca analitis Mettler AE 2000
Spatula
Cawan Petri
Bola karet
Botol vial
Jarum suntik
Inkubator Fiber Scientific
Batang pengaduk
Jangka sorong
Kapas
Oven
Autoklaf Yamato SN20
Hot Plate stirrer Cimarec2
Kertas cakram Oxoid
Pinset
Kertas perkamin
Fortex Fisions Whirch Mixer
3.2 Bahan-bahan Bunga tembelekan
Na2SO4
Etanol 96%
anhidrous p.a . Merck
Alkohol 70%
Nutrient Agar (NA) p.a Oxoid
Nutrient Broth (NB) p.a Oxoid
Mueller Hinton Agar (MHA) p.a Oxoid
Larutan standar Mcfarland
Aquadest
Dimetil Sulfoksida (DMSO)
Basillus subtilis
Propionibacterium acne
Eschechia coli
Pseudomonas aeruginosa
3.3. Prosedur Penelitian 3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah bunga tembelekan (Lantana camara L)
berwarna jingga. Bunga tembelekan dipisahkan dari tangkai bunga kemudian
ditimbang.
3.3.2 Isolasi Minyak Atsiri Bunga Tembelekan dengan Alat destilasi Stahl Sebanyak 200 g bunga tembelekan dimasukkan labu destilasi 1000 mL
ditambahkan air suling 150 mL, dipasang pada alat penyuling Stahl dan
dipanaskan selama ± 4-5 jam diatas penangas minyak hingga minyak atsiri
diperoleh merupakan campuran minyak dengan air yang selanjutnya ditambahkan
NaCl hingga jenuh, kemudian minyak atsiri yang masih tercampur dengan air
diekstraksi dengan eter.Ekstrak eter yang masih tercampur dengan minyak atsiri
ditambahkan Na2SO4 anhidrous, kemudian disaring, filtrat hasil saringan
diuapkan hingga diperoleh minyak atsiri sebagai residu yang selanjutnya disimpan
dilemari pendingin pada suhu 4°C. Minyak yang diperoleh dianalisa kandungan
kimianya menggunakan alat GC-MS dan diuji aktivitas antibakteri terhadap
Basillus subtilis, Propionibacterium acnes, Eschechia coli dan Pseudomonas
aeruginosa dengan metode difusi agar (Supriyanto dan Cahyono, 2012).
3.3.3 Analisis Minyak Atsiri Bunga Tembelekan dengan GC-MS
Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS.
Selanjutnya kondisi disesuaikan dengan kondisi dibawah ini kemudian diamati
kromatogram yang dihasilkan oleh rekorder dan mass recorder serta mass spektra
masing-masing senyawa.
Kondisi alat GC-MS yaitu :
Kolom : AGILENT HP 5MS
Kecepatan Linear : 25.9 cm/sec
Aliran Pembersih : 3.0 mL/min
Waktu Kesetimbangan : 1.0 min
GCMS-QP2010
Suhu sumber Ion : 250°C
Suhu Interface : 305°C
Waktu Pemecah Pelarut : 2.80 min
Detektor Gain Mode : Relative
Detektor Gain : 0,00 kV
MS
Waktu Mulai : 3.00 min
Waktu Berhenti : 80 min
ACQ Mode : Scan
Event Time : 0.50 sec
Kecepatan Scan : 1250
Mulai m/z : 28
Berhenti m/z : 600
3.3.4 Pengujian Sifat Antibakteri Minyak Atsiri Bunga Tembelekan 3.3.4.1 Pembuatan Media Nutrient Agar (NA)
Sebanyak 7 gram nutrient agar dimasukkan dalam Erlenmeyer lalu
dilarutkan dengan 250 mL dan dipanaskan hingga semua larut. Kemudian
disterilkan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit.
3.3.4.2 Pembuatan Media Agar Miring dan Stok Kultur Bakteri
Kedalam tabung reaksi yang steril dimasukkan 3 mL media nutrient agar
steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring
membentuk sudut 30-45°. Biakan bakteri Basilus subtilis dari strain utama
diambil dengan jarum ose steril lalu diinokulasikan pada permukaan media
nutrient agar miring dengan cara menggores, kemudian diinkubasi pada suhu 35
± 2°C selama 18-24 jam. Hal yang sama juga dilakukan pada biakan bakteri
3.3.4.3 Pembuatan Media Mueller Hinton agar (MHA)
Dimasukan 9.5 g serbuk Mueller Hinton Agar diamsukkan dalam
Erlenmeyer lalu dilarutkan dalam 250 mL aquades dan dipanaskan hingga semua
larut dan mendidih. Kemudian disterilkan di autoklaf pada suhu 121°C selama 15
menit.
3.3.4.4 Penyiapan Inokulum Bakteri
Sebanyak 3.25 g nutrient broth dilarutkan dengan 250 mL aquades dalam
Erlenmeyer dan dipanaskan hingga semua larut, kemudian disterilkan di autoklaf
121°C selama 15 menit dan didinginkan. Lalu koloni bakteri Basillus subtilis
diambil dari stok kultur menggunakan jarum ose steril kemudian disuspensikan ke
dalam 10 mL media nutrient broth steril dalam tabung reaksi dan diinkubasikan
pada suhu 35±2°C selama ± 3 jam, lalu dibandingkan kekeruhannya dengan
kekeruhan standar Mcfarland. Hal yang sama juga dilakukan untuk koloni bakteri
Propionibacterium acnes, Escherchia coli dan Pseudomonas aeruginosa.
3.3.4.5 Pembuatan Variasi Konsentrasi Minyak Atsiri Bunga Tembelekan (Lantana camara L)
Minyak atsiri bunga tembelekan dibuat dalam konsentrasi 10 % dan 20%
(v/v), dengan memipet 0.5 mL dan 1 mL minyak atsiri dengan menggunakan mat
pipet dan dimasukkan kedalam labu ukur 5 mL, kemudian ditambahkan Dimetil
Sulfoksida (DMSO) pada masing-masing minyak atsiri hingga garis batas dan
dihomogenkan.
3.3.4.6 Uji Aktivitas Antibakteri Minyak Atsiri Bunga Tembelekan
Sebanyak 0,1 mL inokulum Basilus subtilis dimasukkan ke dalam cawan
petri, setelah itu dituang media Mueller Hinton Agar sebanyak 15 mL dengan
suhu 45-50°C dihomogenkan sampai media bakteri tercampur rata, kemudian
direndam dengan minyak atsiri bunga tembelekan dengan berbagai konsentrasi
kedalam cawan petri yang telah berisi bakteri, kemudian diinkubasi dalam
inkubator pada suhu 35±2°C selama 18-24 jam. Selanjutnya diukur diameter
daerah hambat di sekitar larutan penguji dengan jangka sorong. Dilakukan dengan
cara yang sama terhadap bakteri Propionibacterium acnes, Escherchia coli dan
3.4 Bagan Penelitian
3.4.1 Isolasi Minyak Atsiri Bunga Tembelekan dengan Alat Stahl
dimasukkan kedalam labu
Stahl 1Liter
ditambahkan air suling 150 mL
dirangkai alat Stahl
dipanaskan hingga keluar uap
air bersama minyak
dimasukkan kedalam gelas erlenmeyer
ditambahkan NaCl jenuh
diekstraksi dengan eter dalam corong pemisah
ditambahkan Na2SO4 anhidrous
disaring
diuapkan pasa suhu 40º C
200 g Bunga Tembelekan Segar
Destilat
Lapisan atas Lapisan
Residu Filtrat
Minyak atsiri
3.4.2 Pengujian Sifat Antibakteri Minyak Atsiri Bunga Tembelekan
3.4.2.1 Pembuatan Media Nutrien Agar (NA) Miring dan Stok Kulkur Bakteri
Dilarutkan dengan 250 mL aquadest dalam Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15 menit
Dituangkan kedalam tabung reaksi sebanyak 3 mL
Dibiarkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30°-45°C
Diambil biakan bakteri Basillus subtilis dari strain utama dengan jarum ose lalu digoreskan pada Media NA yang telah memadat
Diinkubasi pada suhu 35°C selama 18-24 jam
Dilakukan hal yang sama untuk bakteri Propionibacterium acne, Escherchia coli dan Pseudomonas aeruginosa.
7 g Media NA
Media NA Steril
3.4.2.2 Pembuatan Media Mueller Hinton Agar (MHA)
Dilarutkan dengan 250 mL aquadest dalam erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15 menit
9.5 g Media Mueller Hionton Agar (MHA)
3.4.2.3 Penyiapan Inokulum Bakteri
Dialrutkan dengan 250 mL aquadest dalam erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15 menit
Dimasukkan sebanyak 10 mL kedalam tabung reaksi
Diambil koloni bakteri Basillus subtilis dari stok kultur bakteri dengan jarum ose
Disuspensikan kedalam media Nutrient Broth (NB)
Diinokulasi pada suhu 35°C selama 3 jam
Dibandingkan kekeruhannya dengan standar Mcfarland (BaCl2 : H2SO4)
Dilakukan hal yang sama untuk Propionibacterium acne, Escherchia coli dan Pseudomonas aeruginosa.
3.25 g Media Nutrien Broth (NB)
Media NB Steril
3.4.2.4 Uji Aktivitas Antibakteri
Dimasukkan kedalam cawan petri
Ditambahkan 15 mL MHA dengan suhu 45°C-50°C
Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan minyak atsiri bunga tembelekan kedalam cawan petri yang telah berisi bakteri
Diinkubasi pada suhu 35°C selama 1-24 jam dalm inkubator
Diukur diameter zona bening disekitar cakram dengan jangka sorong
Dilakukan hal yang sama untuk Propionibacterium acnes, Escherchia coli dan Pseudomonas aeruginosa.
0.1 mL inokulum bakteri Basillus subtilis
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Minyak Atsiri
Minyak Atsiri bunga tembelekan berwarna jingga diperoleh dengan
metode hidrodestilasi menggunakan alat Stahl. Proses ini dilakukan secara triplo.
Hasilnya seperti yang ditunjukkan pada tabel 4.1.
Tabel 4.1 Minyak Atsiri bunga tembelekan yang diperoleh dengan metode
hidrodestilasi
Berat Sampel Hasil(mL) Rata-rata Berat Minyak Atsiri
(g) I II II (mL) (gr)
200 0,13 0,12 0,10 0,11 0,0932
4.1.2 Hasil Analisa dengan GC-MS
Minyak atsiri yang dihasilkan secara hidrodestilasi dianalisa dengan Gas
Chromatography-Mass Spectroscopy (GS-MS). Kromatogram Kromatografi Gas
dari bunga tembelekan hasil hidrodestilasi diperoleh 72 puncak senyawa (gambar
4.1) dan masing-masing senyawa dari hasil interpretasi yang dapat diindentifikasi
Gambar 4.1. Kromatogram hasil analisa Kromatografi Gas minyak atsiri bunga
Tabel 4.2. Senyawa Hasil Analisa GC-MS Minyak Atsiri Bunga Tembelekan
4.1.3. Hasil Uji Aktivitas Antibakteri
Sifat antibakteri minyak atsiri bunga tembelekan menunjukkan zona
hambat pada pertumbuhan beberapa bakteri patogen yaitu Basillus subtilis,
Propionibacterium acnes, Eschechia coli dan Pseudomonas aeruginosa. Zona
hambat minyak atsiri dapat dilihat pada gambar 4.2
(c) Escherchia coli (d) Pseudomonas aeruginosa
Gambar 4.2. Zona hambat dari minyak atsiri bunga tembelekan terhadap bakteri (a)Basillus subtilis, (b) Propionibacterium acnes, (c) Escherchia coli, (d)Pseudomonas aeruginosa
Hasil pengujian minyak atsiri bunga tembelekan terhadap pertumbuhan
bakteri gram positif Basillus subtilis dan Propionibacterium acnes serta
pertumbuhan bakteri gram negatif Escherchia coli dan Pseudomonas aeruginosa
setelah inkubasi 24 jam dapat dilihat pada tabel 4.3.
Tabel 4.3. Hasil Pengukuran diameter zona bening beberapa kultur bakteri oleh
minyak atsiri bunga tembelekan
Bakteri Diameter zona bening minyak atsiri (mm)
10% 20%
Basillus subtilis 9.6 10.8
Propionibacterium acnes 7.6 8.7
Escherchia coli 8.4 9.6
4.2. Pembahasan
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Stahl
Dari hasil penelitian yang telah dilakukan diperoleh minyak atsiri bunga
tembelekan (Lantana camara L) rata-rata sebanyak 0,11 mL (0,0932 g) dari 200
gram. Dengan demikian kadar minyak atsiri adalah 0,0466% (b/b) yang diperoleh
dari perhitungan berikut :
% kadar minyak atsiri = berat minyak atsiri yang diperoleh
berat bunga tembelekan
x
100%% kadar Minyak Atsiri = 0,0932
200 g x 100%
= 0,0466%
Minyak atsiri bunga tembelekan diperoleh berwarna kuning pucat. Kadar
minyak atsiri yang diperoleh sebesar 0,0466%. Kadar minyak atsiri bunga
tembelekan lebih kecil dibandingkan dengan minyak atsiri daun tembelekan yaitu
sebesar 0,28 % (Indriyanti, 2013). Jika dilakukan perbandingan dengan penelitian
sebelumnya diduga kadar minyak atsiri dari daun tembelekan lebih besar
dibanding dengan kadar minyak atsiri pada bunga tembelekan. Selain segi
komponen senyawa yang diduga terdapat perbedaan ada beberapa jenis yang
terkandung di anatara daun dan bunga tembelekan seperti kandungan α-Limonena
yang terdapat pada daun tembelekan sedangkan senyawa ini tidak terdapat pada
bunga tembelekan dan ada beberapa senyawa lain yang berbeda. Senyawa kimia
bunga tembelekan yang diperoleh terdiri dari senyawa terpen dan terpenoid yang
tersusun dari unsur karbon, hidrogen dan oksigen dimana komoponen senyawa
minyak atsiri bunga tembelekan paling banyak adalah seskuiterpen ( 3 unit
isoprene). Selain itu diperoleh juga kandungan dari minyak atsiri yang bukan
golongan senyawa terpen dan terpenoid yaitu aldehid dan ester. Menurut (Harris,
1990) minyak atsiri dapat campuran beberapa senyawa dari bahan-bahan hayati,
yang termasuk aldehid, alkohol, ester dan keton. Bahan-bahan ini kemungikinan
merupakan sisa metabolise tumbuh-tumbuhan yang digunakan untuk peran ganda
4.2.2. Analisa Minyak Atsiri Bunga Tembelekan
1. Puncak dengan RT 22,317 menit merupakan senyawa dengan rumus molekul
C15H24.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 175, 161, 147, 133, 119, 107, 93,
79,69, 39. Dengan membandingkan data spektrum yang diperoleh dengan data
spektrum library NIST12, yang lebih mendekati adalah senyawa golongan
seskuiterpen yaitu Kariofilen sebanyak 10,87 % dengan spektrum 4.3
b.
Gambar 4.3. Spektrum massa senyawa Kariofilen dengan RT 22,317
Keterangan : a : Senyawa Kariofilena dari sampel
b : Standart Library NIST12
Selanjutnya pola fragmentasi dari senyawa Kariofilen tersebut secara hipotesis pada gambar 4.4
CH3
2. Puncak dengan RT 23,225 menit merupakan senyawa dengan rumus molekul
C15H24.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 175, 161, 147, 133, 119, 107, 93,
80,67, 43,41. Dengan membandingkan data spectrum yang diperoleh dengan data
spektrum library Wiley229, yang lebih mendekati adalah senyawa golongan
seskuiterpen yaitu α-Humulen sebanyak 7,59 % dengan spektrum 4.5
b.
Gambar 4.5 Spektrum massa senyawa α-Humulen dengan 23,225
Keterangan a: Senyawa α-Humulen dari sampel
Selanjutnya pola fragmentasi pada senyawa α-Humulen tersebut secara hipotesis seperti gambar 4.6
CH3
3. Puncak dengan RT 23,852 menit merupakan senyawa dengan rumus molekul
C15H22.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 202 diikuti
puncak-puncak fragmentasi pada m/e 189, 159, 145, 132, 119. Dengan
membandingkan data spektrum yang diperoleh dengan data spektrum library
Wiley229, yang lebih mendekati adalah senyawa golongan seskuiterpen yaitu α
-Kurkumen sebanyak 3,35% dengan spektrum 4.7
b.
Gambar 4.7 Spektrum massa senyawa α-Kurkumen dengan RT 23,850
Keterangan a: Senyawa α-Kurkumen dari sampel
Selanjutnya pola fragmentasi dari senyawa α-Kurkumin tersebut secara
hipotesis seperti gambar 4.8
CH3
4. Puncak dengan RT 22.521 menit merupakan senyawa dengan rumus molekul
C15H24.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 161, 147, 133, 119, 105, 91, 79, 67,
43,41. Dengan membandingkan data spektrum yang diperoleh dengan data
spektrum library Wiley229, yang lebih mendekati adalah senyawa golongan
seskuiterpen yaitu Kalaren sebanyak 2,42 % dengan spektrum 4.9
b.
Gambar 4.9 Spektrum massa senyawa Kaleren dengan RT 22,521
Keterangan a: Senyawa Kaleren dari sampel
Selanjutnya pola fragmentasi dari senyawa Kaleren tersebut secara hipotesis seperti pada gambar 4.10
CH3
5. Puncak dengan RT 23,933 menit merupakan senyawa dengan rumus molekul
C15H24.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 177, 161, 147, 133, 119, 105, 91, 79,67,
43,41. Dengan membandingkan data spektrum yang diperoleh dengan data
spektrum library Wiley229, yang lebih mendekati adalah senyawa golongan
seskuiterpen yaitu Germakren-D sebanyak 3,09 % dengan spektrum 4.11
b.
Gambar 4.11.Spektrum massa senyawa Germakren-D dengan RT 23,933
Keterangan a: Senyawa germakren-D dari sampel
Selanjutnya pola fragmentasi dari senyawa germakren-D tersebut secara hipotesis seperti gambar 4.12
CH3
6. Puncak dengan RT 24,346 menit merupakan senyawa dengan rumus molekul
C15H24.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 161, 147, 133, 119, 105, 91, 77, 67,
43,41. Dengan membandingkan data spektrum yang diperoleh dengan data
spektrum library Wiley229, yang lebih mendekati adalah senyawa golongan
seskuiterpen yaitu α-Murolen sebanyak 2,27 % dengan spektrum 4.13
b.
Gambar 4.13 Spektrum massa senyawa α-Murolen dengan RT 24,350
Keterangan a: Senyawa α-Murolen dari sampel
Selanjutnya pola fragmentasi dari senyawa α-muurolene tersebut secara hipotesis seperti pada gambar 4.14
CH3
7. Puncak dengan RT 9,875 menit merupakan senyawa dengan rumus molekul
C10H18O.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 154 diikuti
puncak-puncak fragmentasi pada m/e 139, 125, 108, 84, 81, 69, 43, 41. Dengan
membandingkan data spektrum yang diperoleh dengan data spektrum library
Wiley229, yang lebih mendekati adalah senyawa golongan seskuiterpen yaitu 1,8
Sineol (Eucalyptol) sebanyak 1,59 % dengan spektrum 4.15
b.
Gambar 4.15 Spektrum massa senyawa 1,8 Sineol( Eucalyptol) dengan RT 9,875
Keterangan: a: Senyawa 1,8 Sineol ( Eucalyptol) dari sampel
Selanjutnya pola fragmentasi dari senyawa 1,8 Sineol (Eucalyptol)
tersebut secara hipotesis seperti pada 4.16
o
8. Puncak dengan RT 20,942 menit merupakan senyawa dengan rumus molekul
C15H24.
a.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 161, 147, 133, 119, 105, 91, 77, 67,
43,41. Dengan membandingkan data spektrum yang diperoleh dengan data
spektrum library Wiley229, yang lebih mendekati adalah senyawa golongan
seskuiterpen yaitu α-Kopaen sebanyak 1,12% dengan spektrum 4.17
b.
Gambar 4.17 Spektrum massa senyawa α-kopaen
Keterangan a: Senyawa α-Kopaen dari senyawa
Selanjutnya pola fragmentasi dari α-Kopaen tersebut secara hipotesis pada
4.2.3. Uji Antibakteri Minyak Atsiri Bunga Tembelekan
Dari tabel 4.3 diketahui minyak atsiri bunga tembelekan dapat menghambat
pertumbuhan bakteri Basillus subtilis, Propionibacterium acnes, Eschechia coli
dan Pseudomonas aeruginosa. Hal ini disebabkan minyak atsiri mengandung
senyawa-senyawa golongan terpenoid yang berfungsi sebagai senyawa aktif yang
salah satunya adalah 1,8 Sineole dan beberapa senyawa yang tidak dapat
diindentifikasi. Menurut conner (1993) senyawa terpenoid yang mempunyai
aktivitas antimikroba antara lain borneoil, sineol, pinene dan kamper. Minyak
atsiri dari bunga tembelekan mengandung senyawa 1,8 Sineole, Nerolidol-B,
Davanone yang merupakan senyawa terpenoid yang mempunyai sifat
menghambat aktivitas antimikroba.
Senyawa golongan terpenoid yang terdapat dalam minyak atsiri yang
terdapat dalam bunga tembelekan menghambat pertumbuhan bakteri yaitu dengan
cara merusak dinding sel bakteri, karena bakteri memiliki lapisan luar yang
disebut dinding sel yang dapat mempertahankan bentuk bakteri dan melindungi
membran protoplasma dibawahnya. Selain itu minyak atsiri juga memiliki
kemampuan merubah molekul protein dan asam nukleat. Minyak atsiri dapat
mengubah keadaaan ini dengan mendenaturasi protein dan asam-asam nukleat
sehingga merusak sel tanpa dapat diperbaiki lagi (Suryaningrum, 2009).
Bakteri gram positif lebih sensitif terhadap senyawa aktif dibandingkan
bakteri gram negatif. Hal ini disebabkan karena adanya perbedaan komposisi dan
struktur dinding selnya. Struktur dinding sel bakteri gram positif lebih sederhana
yang berlapis tunggal dengan kandungan lipid yang lebih rendah (1-4%) sehingga
memudahkan bahan senyawa aktif masuk kedalam sel struktur dinding sel
sedangkan sel bakteri gram negatif lebih kompleks, berlapis tiga lapisan luar
lipoprotein, lapisan tengah polisakarida yang berperan sebagai penghalang
masuknya bahan senyawa aktif dan lapisan dalam berupa peptidoglikan dengan
kandungan lipid tinggi (11-22%) (Salni et al, 2011).
Sifat antibakteri minyak atsiri bunga tembelekan menunjukkan zona