KINERJA ANTIKOROSI ZINK DIARILDITIOFOSFAT
DENGAN TEKNIK POLARISASI POTENSIODINAMIKA
FAISAL RIZKI GUMELAR
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Kinerja Antikorosi Zink Diarilditiofosfat dengan Teknik Polarisasi Potensiodinamika adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari pebulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Faisal Rizki Gumelar
ABSTRAK
FAISAL RIZKI GUMELAR. Kinerja Antikorosi Zink Diarilditiofosfat dengan Teknik Polarisasi Potensiodinamika. Dibimbing oleh KOMAR SUTRIAH dan MOHAMMAD KHOTIB.
Zink diarilditiofosfat (ZDTP) merupakan senyawa aditif pelumas yang memiliki banyak fungsi antara lain sebagai antiaus, antikorosi, antioksidan, dan antifriksi. Fungsi ZDTP yang dikaji dalam penelitian ini adalah sebagai antikorosi yang dapat diukur dengan teknik polarisasi potensiodinamika. Rendemen terbesar ZDTP hasil sintesis yang diperoleh 70%. Pengukuran menunjukkan bahwa ZDTP ini memiliki efektivitas inhibisi (EI) korosi yang besar, terbukti nilai optimum %EI terdapat pada konsentrasi larutan inhibitor 1%, yaitu 84.45% dengan derajat penutupan permukaannya 0.84. Parameter termodinamika yang diukur menunjukkan nilai spontanitas korosi berkurang dengan kehadiran inhibitor. Nilai energi aktivasi pada proses korosi logam Cu dengan adanya ZDTP sebesar 52.32 kJ mol-1. Nilai tersebut lebih besar dibandingkan dengan blangko, yaitu 31.47 kJ mol-1. Hal ini menunjukkan terjadinya penurunan laju korosi seiring naiknya energi minimun reaksi.
Kata kunci: efektivitas inhibisi, energi aktivasi, termodinamika, zink diarilditiofosfat
ABSTRACT
FAISAL RIZKI GUMELAR. The Performance of Zinc Diaryldithiophosphate as Anti-Corrosion using Potentiodynamic Polarization Technique. Supervised by KOMAR SUTRIAH and MOHAMMAD KHOTIB.
Zinc diaryldithiophosphate (ZDTP) is a lubricant additive that functions as antiwear, anticorrosion, antioxidant, and antifriction. The ZDTP function has been studied in this experiment by measuring its function as anticorrosion using potentiodynamic polarization technique. The highest ZDTP yield was 70%. The measurement shows that ZDTP has high corrosion inhibiton effectivity as proved by the optimum value of %IE in the concentration 1% of inhibitor solution of 84.45% with surface coverage of 0.84. Thermodynamic parameter shows corrosion spontaneity decreased due to the present of inhibitor. The value of activation energy in Cu metal corrosion process with the present of inhibitor was 52.32 kJ mol-1, the value is higher than the blank activation energy, i.e 31.47 kJ mol-1. This fact shows a decreasing corrosion rate with increasing minimum energy of reaction.
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Departemen Kimia
KINERJA ANTIKOROSI ZINK DIARILDITIOFOSFAT
DENGAN TEKNIK POLARISASI POTENSIODINAMIKA
FAISAL RIZKI GUMELAR
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kinerja Antikorosi Zink Diarilditiofosfat dengan Teknik
Polarisasi Potensiodinamika Nama : Faisal Rizki Gumelar
NIM : G44100027
Disetujui oleh
Dr Komar Sutriah, MS M Khotib, MSi Pembimbing 1 Pembimbing 2
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Kinerja Antikorosi Zink Diarilditiofosfat dengan Teknik Polarisasi Potensiodinamika. Penelitian ini dilaksanakan sejak bulan Maret 2014 hingga Juli 2014 di Laboratorium Terpadu IPB Baranangsiang.
Terima kasih penulis ucapkan kepada Bapak Dr Komar Sutriah, MS dan Bapak Mohammad Khotib, SSi, MSi selaku pembimbing yang telah banyak
memberikan arahan, serta Bapak Dr Zainal Alim Mas’ud DEA atas fasilitas
Laboratorium Terpadu IPB, dan Bapak Drs Muhammad Farid, MSi yang telah memberi saran. Penghargaan juga diberikan kepada Denar Zuliandanu, SSi dan Lestari Ainun, SSi yang telah membantu penulis selama penelitian hingga akhir penulisan skripsi ini. Terima kasih juga kepada Sujono, SSi, MSi dan staf analis Laboratorium Terpadu IPB, serta Bapak Yani dari Bengkel Fisika IPB yang telah membantu selama pengumpulan data.
Ungkapan terima kasih juga disampaikan kepada kedua orang tua atas doa dan motivasinya, Siti Askiya Indah Dwicahya atas motivasinya, serta Maulana Septiana, Yunita Primasanti, dan Nofianita Khairunnisa selaku rekan satu tim atas saran dan motivasinya. Terima kasih juga disampaikan kepada seluruh civitas Kimia 47 atas doa dan dukungannya.
Semoga skripsi ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode 2
Sintesis Zink Diarilditiofosfat 2
Pencirian Produk 3
Pengukuran dengan Teknik Polarisasi Potensiodinamika 3
Parameter Termodinamika Proses Korosi 4
Kinetika Laju Korosi dengan Tinjauan Energi Aktivasi 4
HASIL DAN PEMBAHASAN 5
Hasil Sintesis Zink Diarilditiofosfat dan Penciriannya 5
Efektivitas Inhibisi Korosi ZDTP Alkil Aromatik Berdasakan Teknik
Polarisasi Potensiodinamika 8
Pengaruh Perbedaan Suhu pada Kinerja ZDTPA dan Parameter
Termodinamika-Kinetika Korosi 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR TABEL
1 Hasil pengukuran AAS ZDTP dengan penambahan NaOH dan ZDTP tanpa
penambahan NaOH 7
2 Parameter korosi larutan ZDTP alkil aromatik berdasarkan perbedaan konsentrasi yang diukur pada suhu 28 °C 8
3 Pengaruh perbedaan suhu terhadap arus korosi 10
4 Parameter termodinamika-kinetika korosi 11
DAFTAR GAMBAR
1 Rute Sintesis ZDTP 5
2 Struktur disulfida diarilditiofosfat 6
3 Produk sintesis ZDTP alkil aromatik 6
4 Spektrum FTIR ZDTPA 7
5 Hubungan konsentrasi larutan ZDTP alkil aromatik
dengan efektivitas inhibisi 9
6 Mekanisme adsorpsi ZDTP terhadap permukaan logam 9
7 Kurva persamaan Arrhenius transisi 11
8 Kurva persamaan Arrhenius 12
DAFTAR LAMPIRAN
1 Diagram Alir Penelitian 16
2 Rangkaian alat sintesis ZDTP 17
3 Rangkaian alat pengukuran elektrokimia 18
4 Perhitungan rendemen ZDTP 19
5 Data polarisasi potensiodinamika dengan variasi suhu 20
7 Data variasi suhu dan perhitungan CR 23
PENDAHULUAN
Korosi merupakan salah satu faktor penyebab daya guna logam menurun. Pengertian umum korosi adalah penurunan mutu material logam akibat reaksi elektrokimia dengan lingkungan sekitar dan terjadinya proses transfer elektron dari logam ke lingkungan (Permana dan Darminto 2012). Kerugian yang ditimbulkan korosi dapat berdampak luas, seperti dalam segi ekonomi, fenomena korosi bisa berakibat fatal seperti korosi pada mesin industri menyebabkan alat-alat yang digunakan untuk proses industri tidak dapat bekerja. Selain itu dampak dari korosi juga dapat menyebabkan sarana yang menggunakan bahan material logam tidak dapat digunakan bahkan logam menjadi rusak sebelum waktunya. Salah satu cara untuk mencegah terjadinya kerusakan material yang diakibatkan oleh korosi dapat dilakukan dengan penggunaan senyawa inhibitor yang dapat menekan laju korosi serendah mungkin sehingga kerusakan material yang diakibatkannya dapat diminimalisasi.
Senyawa yang memiliki sifat sebagai inhibitor korosi dapat berupa senyawa organik, anorganik, bahan alam, dan senyawa koordinasi. Senyawa koordinasi yang memiliki potensi sebagai antikorosi adalah zink dialkilditiofosfat (ZDTP) (Rudnick 2009). Selain memiliki potensi sebagai antikorosi, senyawa ZDTP ini memiliki potensi sebagai antiaus, dan antioksidan. Senyawa ZDTP dapat teradsorpsi pada antarmuka logam, sehingga dapat melindungi logam dari korosi (Liston 1992).
Rantai alkil memiliki pengaruh terhadap kestabilan termal dan sifat antioksidan senyawa ZDTP. Rantai alkil yang panjang cenderung memiliki kestabilan termal yang lebih baik dibandingkan dengan rantai alkil yang pendek
(Evstaf’ev et al. 2001). Senyawa ZDTP yang mengandung alkil aromatik
memiliki kestabilan termal dan antioksidan yang sangat baik, kestabilan hidrolitik yang cukup baik akan tetapi memiliki kinerja antiaus yang tidak terlalu baik jika dilakukan pada tekanan biasa, berbeda jika dilakukan pada suasana extreme pressure (EP) (Liston 1992). Sintesis ini menggunakan senyawa aromatik sebagai alkil.
Sintesis ZDTP dengan alkil aromatik (ZDTPA) dilakukan dalam 2 tahap
sintesis. Sintesis tahap pertama akan dibentuk ligan diarilditofsfat dengan pemanasan pada suhu 120 °C sambil diaduk, sedangkan sintesis tahap kedua dilakukan adisi logam pusat Zn dalam bentuk ZnCl2 pada kondisi tanpa
pemanasan (Dinoiu et al.2007).
Zink diarilditiofosfat (ZDTPA) diukur kinerja antikorosinya menggunakan
teknik polarisasi potensiodinamika dengan ekstrapolasi Tafel. Teknik polarisasi potensiodinamika ini umum dilakukan untuk mengukur kinerja antikorosi berdasarkan arus korosi. Parameter yang digunakan dalam pengukuran antikorosi adalah parameter polarisasi seperti arus korosi, potensial korosi, dan kemiringan Tafel (Perez 2004). Kinerja antikorosi yang dihasilkan dapat dilihat dari perubahan besaran termodinamikanya, yaitu perubahan entropi (S) dan perubahan energi bebas Gibbs (G). Energi bebas Gibbs ini menjelaskan spontanitas reaksi dan diharapkan nilainya berkurang seiring adanya senyawa antikorosi sehingga menghambat proses oksidasi (Rafiquee et al. 2008).
melakukan uji kinerja antikorosinya dan mengukur parameter termodinamika dan kinetika antikorosi dengan teknik polarisasi potensiodinamika.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah P2S5 (Merck), ZnCl2 (Merck),alkohol
aromatik (Merck), n-heptana (Merck), logam Zn, CH3COOH (Merck), akuades,
NaOH 50% (b/v), NaOH pelet (Merck), HCl 37% (b/b) (Merck), HNO3 pekat.
Bahan-bahan tersebut digunakan dalam sintesis ZDTPA, sedangkan untuk uji
kinerja antikorosi bahan-bahan yang digunakan adalah aseton, ampelas silikon karbida 100 CW, HCl 5% (v/v), dan kupon tembaga (elektrode kerja). Alat-alat yang digunakan dalam penelitian ini adalah termometer, labu didih, penangas minyak, pengaduk magnetik, corong pisah, neraca analitik, stopwatch, potensiostat DY 2300 yang dilengkapi program DY2300EN, ChemBio office 2008, Rotavapor, spektrofotometer serapan atom (AAS) Shimadzu AA-6300, dan spektrofotometer inframerah transformasi fourier (FTIR) prestige-21 Shimadzu.
Metode
Sintesis Zink Diarilditiofosfat
Sintesis Zink Diarilditiofosfat mengacu pada Dinoiu et al. (2007) dan Khotib (2011) dengan sedikit modifikasi. Sintesis ini dilakukan 2 tahapan, tahap pertama adalah pembentukan ADTP dan tahap kedua merupakan sintesis Zink diarilditiofosfat. Pembentukan ADTP dibuat dengan mereaksikan P2S5 dan
alkohol aromatik dengan nisbah 1:4 dalam pelarut n-heptana di dalam labu didih yang telah dilengkapi pendingin balik dan disambungkan pada penangkap gas H2S
yang berupa larutan Zn-asetat dengan penambahan NaOH 50% (Lampiran 2). Sintesis ADTP dilakukan pada suhu +120 °C di atas penangas minyak selama 12 jam sambil diaduk. ADTP yang dihasilkan direaksikan dengan NaOH pelet dengan jumlah nisbah yang sama dengan ADTP sambil diaduk dengan waktu 6 jam, kemudian ditambahkan akuades sebanyak 5 tetes. Setelah itu ditambahkan ZnCl2 sebesar jumlah mol P2S5 dan diaduk selama 6 jam. Produk yang dihasilkan
3
Pencirian Produk
Pencirian dengan FTIR. ZDTPA hasil sintesis diidentifikasi gugus fungsi dan
ikatan kimia yang terdapat pada produk menggunakan FTIR dengan cara menggerus produk dengan KBr, kemudian dibuat pelet dan diukur pada bilangan gelombang 4000-500 cm-1.
Penetapan Kadar Zn dengan AAS. Sampel ZDTPA ditimbang sebanyak 0,5 g
dan ditambahkan 10 mL HNO3 pekat, kemudian didestruksi hingga larutan tidak
berwarna. Selanjutnya ditambahkan HCl 37% sebanyak 5 mL dan didestruksi kembali hingga asap pada larutan hilang. Larutan hasil destruksi disaring ke labu takar lalu ditera dengan akuades. Larutan ini kemudian diukur kadar Zn-nya dengan AAS Shimadzu pada panjang gelombang 213.9 nm dengan lebar celah 0.7 nm.
Pengukuran dengan Teknik Polarisasi Potensiodinamika
Mula-mula elektrode kerja tembaga (Cu) dipreparasi dengan cara diampelas permukaannya lalu dibilas dengan akuades dan aseton. Elektrode Cu tersebut kemudian dimasukkan ke dalam reservoir yang berisi larutan uji NaCl 1%. Reservoir diberikan sirkulasi air pada dindingnya untuk memelihara kestabilan suhu. Selanjutnya digunakan elektrode Ag/AgCl dan kawat Pt berturut-turut dipasang sebagai elektrode pembanding dan elektrode pembantu. Kabel yang berwarna hitam, putih, dan merah dari potensiostat DY 2300 berturut-turut disambungkan pada elektrode kerja, pembanding, dan pembantu. Larutan uji dibiarkan mencapai kesetimbangan dengan elektrode sekitar 5 menit. Setelah itu, program DY2300EN pada perangkat komputer dinyalakan dan dipilih teknik
linier Sweep Voltammetry pada kotak dialog. Pengukuran blangko dilakukan pada rentang potensial 60 sampai 100 mV untuk anode dan 60 sampai 0 mV untuk katode dengan scan rate 0,20 mV/s. Setelah pengukuran blangko selesai, elektrode Cu kemudian dibersihkan kembali dengan cara dibilas HCl 5% lalu dicuci dengan akuades dan diampelas kembali. Setelah itu, dicuci kembali menggunakan akuades dan aseton. Elektrode Cu yang telah dibersihkan lalu dicelupkan ke dalam larutan Zink diarilditiofosfat pada konsentrasi 0.5, 1, 2, 3 selama + 20 detik dan ditiriskan beberapa saat. Setelah itu elektrode kerja dirangkai kembali pada reservoir dan dilakukan lagi pengondisian sekitar 2 menit. Setelah pengondisian selesai, sampel diukur pada rentang potensial yang sama baik untuk anode maupun katode. Data yang diperoleh dari hasil pengukuran tersebut diolah dengan software Microsoft Excel sehingga didapatkan kurva polarisasi. Selanjutnya diperoleh informasi berupa potensial korosi (Ecorr), tetapan
Tafel anode (a) dan katode (c), serta arus korosi (icorr). Selanjutnya dilakukan
perhitungan efektifitas inhibitor dengan menggunakan persamaan:
%EI =
Parameter Termodinamika Proses Korosi
Parameter termodinamika ditentukan dengan menggunakan persamaan Arrhenius keadaan transisi (Rafiquee et al. 2008).
Ln
Nilai H* dan S* merupakan perubahan entalpi dan entropi keadaan transisi, sedangkan NAh merupakan tetapan Planck molar (3,99 x 10-10 J S mol-1). Dengan
memvariasikan suhu sebesar 30, 40, dan 50 oC (T), maka H* dan S* dapat ditentukan dari kurva ln(icorr/T) vs 1/T, sedangkan perubahan energi bebas Gibbs
transisi (G*) dihitung menurut persamaan termodinamika berikut:
Kinetika Laju Korosi dengan Tinjauan Energi Aktivasi
Energi aktivasi dihitung dari luaran data antara Ln Icorr dan 1/T berdasarkan
persamaan Arrhenius berikut (Morad et al. 2006):
dengan A adalah konstanta Arrhenius yang ditentukan secara empiris, Ea adalah
HASIL DAN PEMBAHASAN
Hasil Sintesis Zink Diarilditiofosfat dan Penciriannya
Sintesis Zink Diarilditiofosfat dilakukan dengan 2 tahap sintesis, yaitu tahap pembentukan senyawa asam diarilditiofosfat (ADTP) dan selanjutnya tahap pembentukan ZDTPA. Langkah pertama pada proses sintesis ZDTPA merupakan
langkah yang sangat menentukan keberhasilan sintesis. Pembentukan ini terjadi antara reaksi P2S5 dengan alkohol dalam pelarut n-heptana. Senyawa ADTP ini
tidak stabil sehingga harus langsung dilakukan sintesis tahap 2 dengan memasukkan logam Zn dalam ZnCl2 untuk membentuk ZDTP (Gambar 1).
(tahap 1)
(ADTP)
(tahap 2)
(ZDTP)
Gambar 1 Rute Sintesis ZDTP
Jika ADTP tidak langsung diadisi dengan Zn dikhawatirkan akan teroksidasi dengan oksigen sehingga akan terbentuk dimer dialkilditiofosfat (Gambar 2) yang menyebabkan tahap adisi Zn akan sulit terjadi (Jaenudin 1998 dan Rudnick 2009). Sebelum ADTP direaksikan dengan ZnCl2 dilakukan penambahan NaOH pada
ADTP. Penambahan NaOH ini bertujuan meningkatkan reaktivitas atom sulfur pada ADTP dan mengikat klorida pada ZnCl2 sehingga adisi Zn akan lebih mudah
(Khotib 2011). Penggunaan suhu 120 oC pada sintesis tahap 1 dilakukan untuk memudahkan adisi alkohol aromatik pada P2S5 dan mengeluarkan gas H2S sebagai
alkohol sehingga ZDTP tidak terbentuk. Reaksi adisi alkohol terhadap P2S5
berlangsung secara eksotermik.
Gambar 2 Struktur disulfida diarilditiofosfat
Pengaruh penambahan NaOH sebelum tahap adisi logam Zn berpengaruh pada nilai rendemen produk ZDTPA yang dihasilkan, kadar Zn, dan warna produk.
Produk ZDTPA yang ditambahkan NaOH memiliki rendemen yang lebih besar
dibandingkan dengan ZDTPA tanpa penambahan NaOH, yaitu sebesar 70%
begitupun dengan kadar Zn yang dihasilkan, ZDTPA dengan penambahan NaOH
memiliki kadar Zn yang lebih besar dibandingkan dengan ZDTPA tanpa
penambahan NaOH, yaitu sebesar 2.70%. Warna produk ZDTPA yang dihasilkan
berwarna jingga kemerahan (Gambar 3).
Gambar 3 Produk sintesis ZDTP alkil aromatik
7
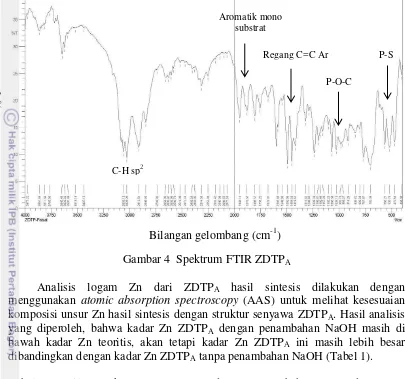
Gambar 4 Spektrum FTIR ZDTPA
Analisis logam Zn dari ZDTPA hasil sintesis dilakukan dengan
menggunakan atomic absorption spectroscopy (AAS) untuk melihat kesesuaian komposisi unsur Zn hasil sintesis dengan struktur senyawa ZDTPA. Hasil analisis
yang diperoleh, bahwa kadar Zn ZDTPA dengan penambahan NaOH masih di
bawah kadar Zn teoritis, akan tetapi kadar Zn ZDTPA ini masih lebih besar
dibandingkan dengan kadar Zn ZDTPA tanpa penambahan NaOH (Tabel 1).
Tabel 1 Hasil pengukuran AAS ZDTPA dengan penambahan NaOH dan ZDTP
tanpa penambahan NaOH
Sampel Ulangan Bobot sampel (g)
keterangan : ZDTP A tanpa penambahan NaOH, ZDTP B ditambahkan NaOH.
Rendahnya kadar Zn ZDTPA yang diperoleh dari kadar teoritisnya diduga
produk yang terbentuk bukan ZDTP dengan alkil aromatik, karena konfirmasi struktur yang diberikan dari FTIR dan AAS tidak saling mendukung.
%
T
Bilangan gelombang (cm-1)
C-H sp2
Aromatik mono substrat
Efektivitas Inhibisi Korosi ZDTP Alkil Aromatik Berdasakan Teknik Polarisasi Potensiodinamika
Kinetika dari pengkaratan logam dapat dicirikan dengan menentukan 3 minimum parameter polarisasi, yaitu potensial korosi (Ecorr), arus korosi (Icorr),
dan kemiringan Tafel (). Proses penghambatan korosi oleh inhibitor pada dasarnya terjadi dengan menurunnya sifat polarisasi anode atau katode (slope Tafel), berkurangnya pergerakan atau terjadinya difusi ion-ion ke permukaan logam, dan meningkatnya daya tahan listrik pada permukaan logam (Roberge 2012). Kurva polarisasi (Lampiran 6) merupakan hubungan E vs Log i (Perez 2004) yang dapat menginterpretasikan sifat korosi suatu logam. Nilai arus korosi (I) didapat dari perpotongan antara Tafel katode dan Tafel anode (Lampiran 5). Tabel 2 menunjukkan penurunan arus korosi berdasarkan perbedaan konsentrasi sampel. Selain itu nilai arus korosi terhadap logam Cu semakin menurun seiring kenaikan persen efektivitas inhibisi dan derajat penutupan permukaan serta nilai laju korosinya (CR) yang semakin menurun seiring dengan kenaikan konsentrasi
larutan ZDTP alkohol aromatik.
Tabel 2 Parameter korosi larutan ZDTP alkil aromatik berdasarkan perbedaan konsentrasi yang diukur pada suhu 28 °C
Konsentrasi
Kenaikan konsentrasi larutan ZDTPA tidak selalu diiringi penurunan nilai
arus korosi secara signifikan, hal ini dilihat dari nilai arus korosi pada konsentrasi larutan ZDTP 2% dan 3% tidak berbeda jauh. Nilai potensial korosi yang semakin menurun seiring dengan naiknya konsentrasi larutan ZDTPA mengindikasikan
terjadinya penurunan polarisasi di anode yang berarti bahwa oksidasi logam semakin terhambat seiring dengan penambahan inhibitor. Begitupun dengan nilai derajat penutupuan permukaan (surface coverage) yang semakin bertambah dengan kenaikan konsentrasi larutan ZDTPA. Hal tersebut berarti bahwa semakin
besarnya nilai surface coverage (ϴ) maka perlindungan logam terhadap konstituen korosif seiring hadirnya inhibitor semakin besar sehingga logam akan semakin sulit mengalami korosi (El-lateef et al. 2012).
Berdasarkan (Gambar 5) dosis efektif larutan ZDTPA terdapat pada
konsentrasi 1%, hal tersebut dilihat dari titik belok kurva logaritmik yang menandakan bahwa pada konsentrasi 1% ini merupakan titik maksimum dari kinerja ZDTPA yang meningkatkan proses inhibisi secara signifikan sedangkan
9
Gambar 5 Hubungan konsentrasi larutan ZDTP alkil aromatik dengan efektivitas inhibisi
Senyawa ZDTP terdiri atas bagian hidrofilik, yaitu inti organologamnya sedangkan bagian hidrofobik terletak pada alkilnya. Sifat atom Zn pada inti yang akan teradsorpsi pada permukaan elektrode akan menyebabkan terbentuknya lapisan pasif pada permukaan elektrode sehingga akan terlindung dari konstituen korosif (Zen-Yu et al. 2011). Sifat elektrode yang tidak aktif akibatnya akan terjadi adsorpsi secara fisika, yaitu terjadinya gaya adhesi antara gugus polar pada ZDTP dan permukaan elektrode logam, gugus polar yang aktif dalam senyawa ZDTP ini yang kemungkinan akan teradsoprsi pada permukaan elektrode antara lain sulfur, fosfor, dan oksigen (Jaenudin 1998, Wahyuningsih et al. 2010, dan Zen-Yu et al. 2011). Sedangkan untuk bagian hidrofobik, yaitu rantai alkil lebih bersifat sebagai pengahalang (barrier) yang akan memproteksi permukaan elektrode dari konstituen korosif. Kedua mekanisme tersebut yang akhirnya akan menurunkan laju korosi secara optimal. Mekanisme adsorpsi ini dapat dilihat pada Gambar 6.
Pengaruh Perbedaan Suhu pada Kinerja ZDTPA dan Parameter Termodinamika-Kinetika Korosi
Arus korosi merupakan salah satu parameter korosi yang peka terhadap perubahan suhu (McCafferty 2010 dan Atkins 2010). Beberapa faktor yang dapat meningkatkan korosivitas pada logam adalah kenaikan suhu dan adanya padatan terlarut (Al-Abdallah et al.2009 dan Satpati et al. 2011) dalam hal ini digunakan NaCl sebagai padatan terlarutnya. Ion Cl- adalah ion yang sangat agresif terhadap logam Cu dengan menyerang lapisan mild steel dan lapisan stainless steel. Ion ini juga dapat menyebabkan terjadinya piting, korosi retak, dan juga menyebabkan pecahnya aloi (Al-Abdallah et al. 2009). Kehadiran ion Cl- pada reservoir menyebabkan terjadinya korosi pada logam Cu dan membentuk senyawa CuCl2
(Khaled 2011). Penambahan berbagai variasi suhu yang diberikan terhadap reservoir akan semakin meningkatkan arus korosi pada logam (Tabel 3).
Tabel 3 Pengaruh perbedaan suhu terhadap arus korosi
Suhu Keterangan: b = blangko
a = sampel
Nilai arus korosi (I) pada blangko maupun sampel semakin meningkat seiring dengan kenaikkan suhu sebesar 10 °C pada rentang suhu 30-50 °C. Penggunaan suhu lebih dari 50 °C menyebabkan nilai arus yang semakin tidak stabil, bahkan tidak terbaca saat pengukuran. Hal tersebut berkolerasi jika semakin tingginya suhu yang diberikan maka pergerakan ion Cl- akan semakin cepat pula di dalam reservoir, akan tetapi jika suhu yang diberikannya terlampau tinggi maka waktu kontak ion Cl- dengan elektrode logam yang diuji akan semakin cepat. Sehingga efektivitas ion Cl- sebagai konstituen korosif untuk mengkorosi elektrode logam akan berkurang pula. Kehadiran ZDTPA memberikan
11
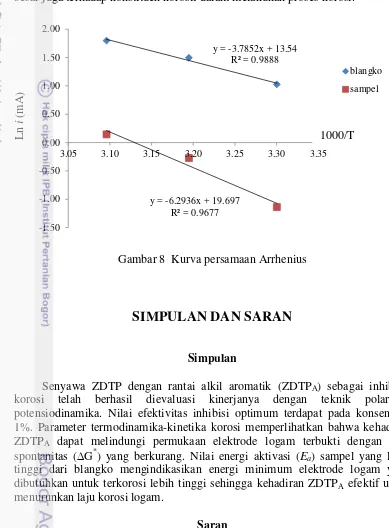
Gambar 7 menunjukkan hubungan kurva ln (i/T) terhadap 1000/T sebagai parameter termodinamika korosi dan ditunjukkan pula pada Lampiran 7.
Gambar 7 Kurva persamaan Arrhenius transisi
Kurva hubungan tersebut sesuai dengan persamaan Arrhenius keadaan transisi yang berikutnya akan berhubungan dengan nilai H*, S*, dan G*. Sebagaimana yang ditunjukkan pada Tabel 4, nilai H* pada sampel lebih besar dibandingkan dengan nilai H* blangko. Efektivitas kinerja sampel lebih baik dibandingkan blangko, terbukti selisih H* antara sampel dan blangko yang cukup besar. Selain itu nilai derajat ketidakteraturan S* yang diperoleh meningkat seiring dengan kehadiran inhibitor korosi. Hubungan antara H* dan
S* akan menghasilkan nilai spontanitas atau G. Nilai H* dan S* sampel yang lebih besar dari blangko menjelaskan bahwa kehadiran inhibitor korosi menyebabkan reaksi berjalan semakin tidak spontan artinya dengan kehadiran inhibitor korosi ini, reaksi logam untuk terkorosi semakin sulit.
Tabel 4 Parameter termodinamika-kinetika korosi
Ea (kJ/mol) H* (kJ/mol) S* (J/mol K) G* (kJ/mol) Blangko 31.47 28.87 -141.06 71.62
Sampel 52.32 49.73 -89.86 76.96
Parameter kinetika korosi dapat dilihat dari nilai energi aktivasi (Ea) yang
diperoleh. Nilai energi aktivasi ini diperoleh dari kurva Arrhenius hubungan antara Ln i terhadap 1000/T (Gambar 8) dengan mengalikan nilai kemiringan kurva yang didapat dengan nilai tetapan gas ideal (R). Tabel 4 yang menunjukkan bahwa nilai energi aktivasi sampel yang lebih besar dibandingkan dengan blangko memberikan definisi bahwa elektrode logam yang telah ditambahkan dengan ZDTPA akan menaikkan energi minimum logam untuk terjadinya korosi, sehingga
y = -3.4724x + 6.7938
3.05 3.10 3.15 3.20 3.25 3.30 3.35
logam lebih sulit untuk terkorosi. Kehadiran ZDTPA yang akan membentuk
lapisan protektif pada permukaan logam, akan memberikan energi yang lebih besar juga terhadap konstituen korosif dalam melakukan proses korosi.
Gambar 8 Kurva persamaan Arrhenius
SIMPULAN DAN SARAN
Simpulan
Senyawa ZDTP dengan rantai alkil aromatik (ZDTPA) sebagai inhibitor
korosi telah berhasil dievaluasi kinerjanya dengan teknik polarisasi potensiodinamika. Nilai efektivitas inhibisi optimum terdapat pada konsentrasi 1%. Parameter termodinamika-kinetika korosi memperlihatkan bahwa kehadiran ZDTPA dapat melindungi permukaan elektrode logam terbukti dengan nilai
spontanitas (G*) yang berkurang. Nilai energi aktivasi (Ea) sampel yang lebih
tinggi dari blangko mengindikasikan energi minimum elektrode logam yang dibutuhkan untuk terkorosi lebih tinggi sehingga kehadiran ZDTPA efektif untuk
menurunkan laju korosi logam.
Saran
Pengujian lebih lanjut perlu dilakukan dengan penggunaan inti yang bersifat trivalen dan inti divalen selain zink. Selain itu dapat dilakukan variasi rantai alkil yang berbeda-beda dalam satu struktur ZDTP. Selanjutnya dilakukan konfirmasi ulang pada struktur ZDTP alkil aromatik dengan melakukan pencirian produk menggunakan NMR dan HPLC.
3.05 3.10 3.15 3.20 3.25 3.30 3.35
DAFTAR PUSTAKA
Al-Abdallah MM, Maayta AK, Al-Qudah MA, Al-Rawashdeh NAF. 2009. Corrosion behavior of copper in chloride media. Corrosion Journal. 9(2):71-76.
Atkins P, Paula JD. 2010. Physical Chemistry 9th Ed. Oxford (UK): Oxford Press. Dinoiu V, Danilian F, Bogatu L. 2007. The influence of synthesis method of zinc
dialkyldithiophosphates on the process of additivation. Rev Chim (Bucureoti). 58(2):183-185.
El-Lateef HM, Abbasov VM, Asadov ZH, Tantawy AH, Marzouk AA, Khalaf MM. 2012. Adsorption of some complex surfactants based on pelargonic acid at carbon steel in aqueous carbon dioxide solutions. Chemistry Journal. 2(3):126-135.
Evstaf’ev VP, Kononova EA, Levin AYA, Trofimova, Ivanova OV. 2001. A new
ditihiophosphate additive for lubricating oils. Chem and of Fuels and Oils. 37(6):427-431.
Khaled KF. 2011. Studies of the corrosion inhibiton of copper in sodium chloride solutions using chemical and electrochemical measurements. Materials Chemistry and Physics. 125(11):427-433.
Jaenudin. 1998. Pembuatan Zn-Diisobutilditiofosfat dan Penggunaannya Sebagai Aditif Minyak Lumas Otomotif [thesis]. Depok (ID):Universitas Indonesia. Khotib M. 2011. Density Functional Theory dalam Sintesis, Karakterisasi, dan
Prediksi Aplikasi. Kasus: Senyawa Zn-Dialkylditiokarbamat Rantai Panjang [thesis]. Bogor (ID): Institut Pertanian Bogor.
Liston TV. 1992. Engine lubricant additives what they are and how they function.
Journal of the Society Tribologists and Lubrication Engineers. 92(7)389-397.
McCafferty E. 2010. Introduction to Corrosion Science. New York (US): Springer.
Morad MS, El-Dean AMK. 2006. 2,2'-Dithiois(3-cyano-4,6-dimethylpyridine): A new class of acid corrosion inhibitors for mild steel. Corrosion Science. 48(11):3398-3412. doi:10.1016/j.corsci.2005.12.006.
Pavia DL, Lapman GM, Kriz GS. 2001. Introduction to Specroscopy Ed ke-3. Washington (US): Thomson Learning.
Perez N. 2004. Electrochemistry and Corrosion Science. New York (US): Kluwer Academic Publisher.
Permana A, Darminto. 2012. Fabrikasi polianilin-tio2 dan aplikasinya sebagai
pelindung anti korosi pada lingkungan statis, dinamis, dan atmosferik.
Jurnal Fisika dan Aplikasinya. 8(1):1-4.
Rafiquee MZA, Saxena N, Khan S, Quraishi MA. 2008. Influence of surfactants on the corrosion inhibition behavior of 2-aminophenyl-5-mercapto-1-oxa-3,4-diazole (AMOD) on mild steel. Materials Chemistry and Physics. 107(2-3):528-533.doi:10.1016/j.matchemphys.2007.08.022
Rismawati. 2013. Pengaruh jenis alkohol pada rendemen sintesis zink dialkilditiofosfat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rudnick LR. 2009. Lubricant Additives Chemistry and Applications Ed ke-2. Prancis: CRC Pr.
Satpati AK, Reddy AVR. 2011. Electrochemical study on corrosion inhibition of copper in hydrochloric acid medium and the rotating ring-disc voltammetry for studying the dissolution. Journal of Electrochemistry. 1(11):1-8. doi:10.4061/2011/173462.
Wahyuningsih A, Sunarya Y, Aisyah S. 2010. Metenamina sebagai inhibitor korosi baja karbon dalam lingkungan sesuai kondisi pertambangan minyak bumi. Jurnal Sains dan Teknologi Kimia. 1(1):17-29.
Zen-Yu Chang, Lubrizol Breeden D, Newpark Drilling Fluids, McDonald M, PQ Corp. 2011. The use of zinc dialkyl dithiophosphate as a lubricant enhancer for drilling fluids particulary silicate-based drilling fluids [review]. Society of Petroleum Engineers. SPE 141327:1-7.
Lampiran 1 Diagram Alir Penelitian
Alkohol
aromatik
Pencirian produk Zink diarilditiofosfat
CRUDE PRODUK 1
ZDTP
1. Pemisahan 2. Pencucian
ZnCl2
P2S5
1 2
Kinerja antikorosi (Potensiostat DY2300)
Karakterisasi dengan FTIR
Analisis kadar logam Zn dengan AAS
NaOH
17
Lampiran 2 Rangkaian alat sintesis ZDTP
Keterangan:
a. campuran pereaksi-pereaksi b. penangas minyak
Lampiran 3 Rangkaian alat pengukuran elektrokimia
Reservoir
Elektrode Cu
Potensiostat DY2300
19
Lampiran 4 Perhitungan rendemen ZDTP
Ulangan Varian Alkohol Pelarut
Suhu
Aromatik n-heptana 120
10.2641 49.80
2 ZDTP B 10.3421 50.18
3 ZDTP C 11.7113 56.82
4 ZDTP D 14.3357 70.00
Ket: ZDTP A dan B tidak dilakukan penambahan NaOH
Contoh perhitungan rendemen (ZDTP D):
Bobot alkohol aromatik yang ditimbang = 12.9768 g Mol alkohol aromatik =
= 0.12 mol
Mol produk = ¼ × mol alkohol aromatik = ¼ × 0.12 mol
= 0.03 mol
Lampiran 5 Data polarisasi potensiodinamika dengan variasi suhu
Suhu
(celcius) Larutan
Garis Tafel Arus korosi
(mA) %EI ϴ Anode katode
30 b y=-0.0064x + 0.0767 y=0.0048x +0.0455 2.785 88.51 0.88 a y=-0.035x + 0.082 y=0.066x +0.0496 0.320
40 b y=-0.0027x + 0.0715 y=0.0028x +0.047 4.454 83.27 0.83 a y=-0.023x + 0.0769 y=0.024x +0.041 0.76
50 b y=-0.0018x + 0.0718 y=0.0019x +0.0495 6.027 82.13 0.82 a y=-0.01x + 0.0665 y=0.0083x +0.0454 1.153
b= blangko a= sampel
Perhitungan Ekstrapolasi Tafel
Arus blangko Derajat Penutupan permukaan Persamaan garis Tafel anode y1 =0.0767 – 0.0064x ϴ = 1 -
Persamaan garis Tafel katode y2 = 0.0455 + 0.0048x = 1 –
Arus korosi merupakan persamaan y1=y2, maka = 0.8
0.0767 – 0.0064x = 0.0455 + 0.0048x 0.0112x = 0.0312
x = 2.785 mA Efektifitas Inhibisi
%EI =
× 100%
=
= 88.51%
21
Penentuan persamaan garis tafel anode dan katode (blangko 40 °C)
Tafel katode (garis biru)
0.00 1.00 2.00 3.00 4.00 5.00 6.00
Lampiran 6 Kurva polarisasi Zink Diarilditiofosfat
ZDTP aromatik
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08
0 0.5 1 1.5 2 2.5 3
Blangko 0.5 1 2 3
Arus (mA)
P
ot
en
sial
(V
23
Lampiran 7 Data variasi suhu dan perhitungan CR
Larutan Suhu (K) 1000/T I (mA) Ln i i/T Ln (i/T)
Blangko
303 3.30 2.785 1.0242 0.0092 -4.6895 313 3.19 4.454 1.4938 0.0142 -4.2524 323 3.09 6.027 1.7962 0.0187 -3.9814
1% ZDTP
303 3.30 0.320 -1.1394 0.0011 -6.8532 313 3.19 0.76 -0.2744 0.0024 -6.0206 323 3.09 1.153 0.1424 0.0036 -5.6353
Contoh perhitungan CR ZDTP alkil aromatik blangko:
CR =
CR =
CR =
CR = 3.5964 × 10-7 cm s-1
Lampiran 8 Analisis kadar Zn menggunakan AAS
Ket: ZDTP A tanpa penambahan NaOH, ZDTP B ditambahkan NaOH
Diketahui: Ar Zn = 65 g/mol Mr ZnCl2 = 136 g/mol
Contoh perhitungan (ZDTP B):
Bobot Zn yang ditambahkan dalam sintesis ZDTP alkohol aromatik
=
× bobot ZnCl2 ditambahkan dalam sintesis ZDTP alkil aromatik
=
× 4.9521 g = 2.3668 g
Kadar Zn diperoleh dalam ZDTP alkil aromatik (g)
= % Kadar Zn diperoleh dalam ZDTP x hasil ZDTP diperoleh =
× 11.7113 g = 0.3162 g
Kadar Zn dalam ZDTP alkil aromatik secara teoritis (%)
=
× 100%
=
× 100% = 9.46 %
Kadar Zn dalam ZDTP alkil aromatik secara teoritis (g)
= Sampel Ulangan Bobot
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya pada tanggal 7 Mei 1992 sebagai putra pertama dari 2 bersaudara pasangan Yunus Winoto dan Yayah Supiati. Tahun 2010 penulis lulus dari SMA Al-Masoem Sumedang dan pada tahun yang sama penulis diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).