PEMANFAATAN SENYAWA HASIL SAMPING BIODIESEL
MINYAK JELANTAH UNTUK PRODUKSI BIOHIDROGEN
OLEH
Rhodobium marinum
DICKA WAHYU SETIASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pemanfaatan Senyawa Hasil Samping Biodiesel Minyak Jelantah untuk Produksi Biohidrogen oleh Rhodobium marinum adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia.
ABSTRAK
DICKA WAHYU SETIASARI. Pemanfaatan Senyawa Hasil Samping Biodiesel Minyak Jelantah untuk Produksi Biohidrogen oleh Rhodobium marinum. Dibimbing oleh MEGA SAFITHRI dan DWI SUSILANINGSIH
Biohidrogen merupakan energi alternatif terbarukan yang ramah lingkungan dan berpotensi untuk mengatasi permasalahan energi. Biohidrogen dapat dihasilkan oleh bakteri fotosintetik Rhodobium marinum dengan memanfaatkan limbah organik. Penelitian ini bertujuan untuk produksi biohidrogen dengan memanfaatkan substrat berupa senyawa hasil samping biodiesel dari minyak jelantah menggunakan bakteri R. marinum, serta memperoleh formulasi media produksi yang efektif untuk menghasilkan biohidrogen secara optimal. Substrat diperoleh dari reaksi esterifikasi dan transesterifikasi minyak jelantah. Optimasi produksi biohidrogen dilakukan dengan cara kombinasi konsentrasi senyawa hasil samping biodiesel, ekstrak khamir, dan basal medium ASY dalam media produksi. Gas hidrogen dianalisis menggunakan kromatografi gas. Media produksi dengan komposisi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, dan basal medium ASY 0.5% merupakan kombinasi terbaik yang dapat memproduksi hidrogen hingga 1.23 l/l kultur. Hidrogen yang diproduksi tersebut berasal dari konsumsi gula total sebesar 182 ppm dan senyawa organik sebesar 4185 ppm yang terkandung dalam substrat.
Kata kunci: Biohidrogen, senyawa hasil samping biodiesel, Rhodobium marinum, kromatografi gas.
ABSTRACT
DICKA WAHYU SETIASARI. The Utilization of Byproduct from Waste Cooking Oil Biodiesel for Biohydrogen Production by Rhodobium marinum. Supervised by MEGA SAFITHRI and DWI SUSILANINGSIH
Biohydrogen is a renewable alternative energy which is environmentally friendly and potentially overcoming energy issues. Biohydrogen can be produced by photosynthetic bacteria Rhodobium marinum by utilizing organic waste. The objectives of this research were to produce by utilizing byproduct compound of biodiesel production from waste cooking oil as the substrate for bacteria R. marinum and to obtain the effective formula of production media for producing biohydrogen optimally. The substrate was obtained from esterification and transesterification reaction of waste cooking oil. The optimization of biohydrogen production was conducted by combining the byproduct compound of biodiesel, yeast extract, and basal medium ASY in production medium. The hydrogen gas was analyzed using gas chromatography. Production medium containing byproduct compound of biodiesel 4%, yeast extract 0.15%, and basal medium ASY 0.5% was the best combination which was able to produce hydrogen up to 1.23 l/l culture. The hydrogen production from total sugar consumption of 182 ppm and organic compound consumption of 4185 ppm in the substrate.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PEMANFAATAN SENYAWA HASIL SAMPING BIODIESEL
MINYAK JELANTAH UNTUK PRODUKSI BIOHIDROGEN
OLEH
Rhodobium marinum
DICKA WAHYU SETIASARI
DEPARTEMEN BIOKIMA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Bismillahirrahmanirrahim,
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian tentang produksi biohidrogen yang dihasilkan oleh bakteri fotosintetik ini dilaksanakan sejak bulan Maret 2015 hingga bulan Oktober 2015, dengan judul Pemanfaatan Senyawa Hasil Samping Biodiesel Minyak Jelantah Untuk Produksi Biohidrogen Oleh Rhodobium marinum.
Terima kasih kasih penulis ucapkan kepada Ibu Dr Mega Safithri, SSi MSi selaku dosen pembimbing yang telah banyak memberikan pengarahan dan saran. Terima kasih kepada ibu Dr Dwi Susilaningsih, MPharm untuk segala bimbingan, proyek penelitian, serta kesempatan melakukan penelitian sampai selesai di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Bogor. Penghargaan juga penulis sampaikan kepada Bapak Khairul Anam, MSi Apt, Kak Peza Batamarlia Reko, SSi, Kak Tami Astie Ulhiza, BEng, beserta seluruh staf Laboratorium Bioenergi dan Bioproses, Pusat penelitian Bioteknologi LIPI yang telah membantu selama penelitian berlangsung hingga pengumpulan data. Terima kasih juga kepada rekan-rekan penelitian atas segala bantuannya dalam menyelesaikan penelitian dan skripsi ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga atas segala do’a dan kasih sayangnya. Terima kasih juga kepada teman -teman statistika yang membantu dalam mengolah data, keluarga Biokimia 48, keluarga SEL, lingkaran ukhuwah, teman-teman Andika house, serta keluarga Serum G IPB untuk segala do’a, bantuan, dan dukungan yang terus diberikan.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
PENDAHULUAN 1
METODE 2
Alat dan Bahan 2
Prosedur Penelitian 3
HASIL 7
Karakterisasi Senyawa Hasil Samping Biodiesel 7
Kurva Pertumbuhan Bakteri 8
Pengaruh Kombinasi Media Produksi terhadap Produksi Hidrogen 9 Pengaruh Konsumsi Gula Total dan Senyawa Organik terhadap Hasil 12 Foto Fermentasi
PEMBAHASAN 15
Karakterisasi Senyawa Hasil Samping Biodiesel 15
Kurva Pertumbuhan Bakteri 16
Pengaruh Kombinasi Media Produksi terhadap Produksi Hidrogen 18 Pengaruh Konsumsi Gula Total dan Senyawa Organik terhadap Hasil 20 Foto Fermentasi
SIMPULAN DAN SARAN 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Komposisi media produksi 5
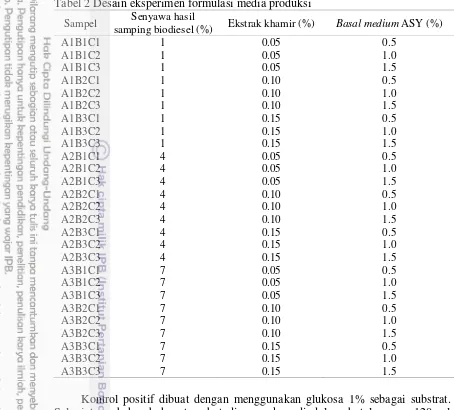
2 Desain eksperimen formulasi media produksi 6
3 Karakteristik senyawa hasil samping biodiesel 8
4 Produksi hidrogen pada berbagai kombinasi media produksi 10
5 Signifikasi konsentrasi masing-masing faktor terhadap produksi 11
hidrogen 6 Jumlah konsumsi gula total dan senyawa organik 13
DAFTAR GAMBAR
1 Sampel minyak jelantah 72 Hasil esterifikasi dan transesterifikasi minyak jelantah 8
3 Kurva pertumbuhan bakteri R. marinum 9
4 Diagram hasil produksi hidrogen 11
5 Diagram konsumsi gula total, konsumsi senyawa organik dan 14
produksi H2
DAFTAR LAMPIRAN
1 Diagram alir penelitian 282 Kadar asam lemak bebas (FFA) 28
3 Diagram alir pembuatan biodiesel 29
4 Kultivasi bakteri R. marinum 30
5 Foto fermentasi bakteri R. marinum 30
6 Hasil pengukuran OD bakteri R. marinum pada λ = 680 nm 30
7 Hasil produksi hidrogen pada berbagai kombinasi media produksi 31
8 Kromatogram hasil analisis gas H2 sampel A1B1C1 32
9 Hasil analisis statistika pengaruh kombinasi konsentrasi media produksi 32 terhadap produksi H2 menggunakan SPSS 16.00 10 Absorbansi standar glukosa pada λ = 490 nm 34
11 Hasil pengukuran kadar gula total 35
12 Absorbansi standar KHP pada λ = 600 nm 36
13 Hasil pengukuran kadar senyawa organik 37
PENDAHULUAN
Energi menjadi komponen penting bagi kelangsungan hidup manusia karena hampir semua aktivitas kehidupan manusia sangat tergantung pada ketersediaan energi. Hari ini dan beberapa tahun ke depan, diperkirakan manusia masih akan tergantung pada sumber energi fosil dan minyak bumi. Eksploitasi energi dari sumber daya alam yang berlebihan terutama minyak bumi menyebabkan menipisnya kandungan minyak bumi sehingga menimbulkan berbagai masalah, yaitu kerusakan lingkungan, perubahan iklim global, dan krisis energi di seluruh dunia (Irawulan 2009). Krisis energi dan kerusakan lingkungan ini memerlukan penanganan serius, serta diperlukan usaha untuk mengurangi dampak negatif kerusakan lingkungan dan mengembangkan sumber energi alternatif.
Perhatian masyarakat dunia saat ini semakin meningkat pada penggunaan bahan bakar yang ramah lingkungan (green energy) dan dapat diperbaharui (renewable energy). Saat ini banyak penelitian yang menaruh perhatian pada produksi dan pengolahan hidrogen. Hal tersebut dikarenakan hidrogen merupakan sumber energi yang bersih dan efisien. Dibandingkan dengan bahan bakar fosil, hidrogen menghasilkan energi sebesar 122 kJ/g, 2.75 kali lebih besar dibandingkan dengan bahan bakar hidrokarbon yang hanya dapat menghasilkan energi sebesar 44.36 kJ/g (Agrawal et al. 2007). Selain itu, pembakaran hidrogen di udara hanya akan menghasilkan uap air dan energi panas. Dengan demikian, pembakaran hidrogen tidak akan menimbulkan efek rumah kaca, penipisan lapisan ozon, atau hujan asam. Gas hidrogen juga dapat diaplikasikan menjadi bahan bakar melalui sistem fuel cell yang dapat menghasilkan listrik (Miyamoto 1997).
Beberapa metode dapat digunakan untuk menghasilkan hidrogen, diantaranya adalah dengan cara steam reforming, elektrolisis, gasifikasi dan biologi (Chen et al. 2006, Kapdan dan Kargi 2006, Li dan Fang 2008, Kirtay 2011). Menurut Li dan Fang (2008), pendekatan biologi paling efektif untuk digunakan dalam produksi biohidrogen. Biohidrogen diproduksi secara biologi, yaitu dengan memanfaatkan organisme mikroalga atau bakteri melalui proses fermentasi atau fotoproduksi untuk merombak substrat organik (limbah atau non limbah) menjadi energi hidrogen (Kotay dan Das 2008). Beberapa mikroorganisme yang dapat menghasilkan hidrogen antara lain adalah cyanobacteria, bakteri anaerob, dan bakteri fotosintetik. Miyake (1998) menyatakan bahwa penggunaan bakteri fotosintetik dinilai lebih efektif, karena dapat menghasilkan hidrogen yang lebih banyak, serta dapat memanfaatkan senyawa organik berupa limbah sebagai substrat. Salah satu bakteri fotosintetik yang mampu memproduksi hidrogen adalah Rhodobium marinum (Sirait 2007). Maka dari itu, dalam penelitian ini digunakan bakteri R. marinum untuk memproduksi hidrogen.
2
Minyak jelantah merupakan minyak yang berasal dari sisa minyak penggorengan bahan makanan. Minyak goreng bekas selama ini selalu dianggap sebagai limbah oleh sebagian masyarakat. Minyak jelantah yang tidak termanfaatkan selama ini juga menjadi masalah tersendiri, karena jumlahnya yang melimpah, serta dapat berkontribusi sebagai agen pencemar lingkungan. Banyaknya eksplorasi yang dilakukan untuk mencari energi alternatif, membuat minyak goreng bekas mulai dilirik pemanfaatannya. Salah satunya adalah sebagai bahan baku untuk pembuatan biodiesel (Aziz 2008). Biodiesel dari minyak nabati dapat dihasilkan melalui proses transesterifikasi trigliserida dari minyak goreng. Minyak jelantah, menurut Ruhyat dan Firdaus (2006) merupakan miyak nabati yang paling layak digunakan sebagai bahan baku biodiesel. Hal tersebut dikarenakan jumlahnya yang melimpah sehingga efektif dapat menurunkan biaya produksi serta dapat mengurangi angka pencemaran lingkungan akibat pembuangan limbah minyak (Zhang et al. 2003).
Pembuatan biodiesel dengan reaksi transesterifikasi minyak goreng bekas menghasilkan produk samping atau limbah biodiesel. Limbah (byproduct) biodiesel ini dihasilkan sekitar 10-20 % dari total volume produk. Tahun 2010 Indonesia memproduksi biodiesel sekitar 1,24 juta ton, dengan jumlah biodiesel sebesar itu akan dihasilkan senyawa hasil samping biodiesel sekitar 124000-248000 ton pertahun (Darnoko dan Cheryan 2000). Selama ini limbah biodiesel yang dihasilkan tersebut belum dimanfaatkan secara optimal. Siregar (2008) menyebutkan bahwa limbah biodiesel ini mengandung beberapa senyawa organik dan juga gliserol dengan tingkat kemurnian yang rendah, yang biasa disebut dengan crude glycerol. Crude glyserol yang dihasilkan selama ini belum banyak dimanfaatkan oleh industri penghasil biodiesel, karena banyaknya zat pengotor (Darnoko dan Cheryan 2000). Senyawa organik dan crude glycerol yang terdapat dalam limbah biodiesel ini dapat dimanfaatkan oleh bakteri sebagai substrat pada proses fermentasi untuk menghasilkan biohidrogen. Oleh karena itu, dalam penelitian ini dilakukan studi pemanfaatan limbah biodiesel sebagi substrat dalam produksi biohidrogen sebagai energi alternatif menggunakan bakteri R. marinum.
Penelitian ini bertujuan untuk mendapatkan produksi biohidrogen dengan memanfaatkan substrat berupa senyawa hasil samping biodiesel dari minyak jelantah menggunakan bakteri fotosintetik R. marinum. Hasil penelitian diharapkan dapat memperoleh formulasi media produksi yang efektif untuk menghasilkan biohidrogen secara optimal.
METODE PENELITIAN
Penelitian ini dilaksanakan di Laboratorium Bioenergi dan Bioproses, Pusat penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Bogor. Penelitian ini berlangsung dari bulan Maret hingga Oktober 2015.
Alat dan Bahan
3 (Hitachi), syringe, lampu TL (tubular lamp, Philips) 4 x 15 watt, kromatografi gas (GC) (HP 5890), neraca analitik, termometer, viskometer, alumunium foil, kertas saring, buret, dan alat gelas.
Bahan-bahan yang digunakan yaitu minyak goreng bekas, stok kultur bakteri Rhodobium marinum yang diperoleh dari NBRC, Jepang (NITE Biological Resource Center) dengan nomor koleksi 100434, amonium sulfat (Merck), dinatrium suksinat (Merck), ekstrak khamir (Wako), D-glukosa (Merck), K2HPO4,
KH2PO4, EDTA.2Na, H3BO3, Na2MoO4. 2H2O, ZnSO4.7H2O, MnCl2, Cu(Mo3)2.
3H2O, FeSO4. 7H2O, CaCl2. 2H2O, MgSO4. 7 H2O, HCl 1N, NaOH 1N, H2SO4
pekat, fenol 5%, indikator fenolftalein (PP), etanol 96%, etanol 70%, AgSO4
(Merck), K2Cr2O7 1N, larutan KHP (kalium hidrogen phtalat), metanol teknis,
NaOH teknis, akuades, gas N2 ultra high purity, dan gas H2 ultra high purity.
Prosedur Penelitian
Pengambilan Sampel Limbah Minyak Jelantah
Sampel limbah yang digunakan yaitu minyak jelantah yang didapat secara acak dari beberapa rumah makan di daerah Dramaga, Bogor. Minyak jelantah tersebut merupakan minyak bekas yang telah dipakai beberapa kali untuk menggoreng hingga berubah warna dan tidak layak untuk digunakan kembali.
Karakterisasi Fisik (Husni dan Esmiralda 2009)
Uji karakteristik fisik meliputi uji bau dan warna. Uji ini dilakukan dengan menghirup bau limbah minyak yang telah didapat. Sedangkan uji warna dilakukan secara visual dengan melihat warna minyak jelantah yang telah didapat
Karakterisasi Kimia (SNI 01-3555-1998)
Uji karakterisasi kimia dilakukan dengan mengukur kadar asam lemak bebas atau free fatty acid (FFA) dalam minyak jelantah. Sebanyak 2 g contoh minyak ditimbang dan dimasukkan ke dalam labu erlenmeyer. Kemudian ditambahkan 50 ml alkohol 95% netral. Indikator phenolphthalein (PP) ditambahkan sebanyak 3-5 tetes pada larutan dan ditirasi dengan 0.1 N KOH standar. Akhir titrasi tercapai jika terbentuk warna merah muda yang tidak hilang selama 0.5 menit.
Pembuatan Biodiesel (Farobie 2009)
4
dengan menggunakan corong pisah. Lapisan atas sebagai biodiesel dan lapisan atas sebagai hasil samping biodiesel.
Karakterisasi Senyawa Hasil Samping Biodiesel (Pagliaro et al 2008)
Karakterisasi senyawa hasil samping biodiesel ini dilakukan untuk mengetahui kondisi fisika dan kimia awal dari senyawa tersebut dengan beberapa parameter uji. Sehingga dapat diketahui kondisi senyawa yang dihasilkan dari percobaan sebelumnya sesuai dengan lingkungan bakteri dan layak untuk dijadikan substrat media produksi. Karakterisasi ini juga dilakukan selama fermentasi hingga beberapa hari. Limbah minyak jelantah yang sudah didapat dipreparasi dan diukur pH, densitas, kandungan glukosa total, dan kebutuhan oksigen kimiawi (COD).
Penentuan pH dan Densitas
Pengukuran pH cairan sampel senyawa hasil samping biodiesel dilakukan dengan menggunakan pH-meter yang telah dikalibrasi dengan menggunakan larutan buffer standar. Sampel cairan langsung diukur dengan pH-meter tanpa dilakukan pengenceran terlebih dahulu. Pengukuran densitas dilakukan dengan menimbang 1 ml sampel hasil samping biodiesel selanjutnya ditentukan densitasnya.
Pengukuran Kadar Gula Total (Dubois et al. 1956)
Pengukuran ini dilakukan dengan metode fenol asam sulfat. Sampel disentrifugasi pada 6000 rpm selama 5 menit. Supernatan kemudian diencerkan 100 kali, kemudian diambil 0.5 ml dari larutan hasil pengenceran tersebut ke dalam tabung reaksi kecil, setelah itu ditambahkan fenol 5% sebanyak 0.5 ml dan 2.5 ml larutan H2SO4 lalu dikocok dengan vortex. Setelah dikocok, sampel didiamkan 10
menit dan diletakkan di dalam water bath dengan suhu 400C selama 20 menit. Kadar glukosa (gula total) dalam sampel dianalisis dengan diukur absorbansinya menggunakan spektrofotometer vis 490 nm. Sebelumnya dibuat standar glukosa dengan konsentrasi 10, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 ppm untuk mendapatkan persamaan matematis dan regresi liner agar nilai absorbansi sampel gula dapat diubah menjadi ppm.
Pengukuran Kebutuhan Oksigen Kimiawi (COD) (SNI 2004)
Pertama-tama dibuat reagen alkali asam sulfat dengan cara mencampurkan 1.02 g AgSO4 dan 100 ml H2SO4 di dalam labu takar. Larutan dihomogenkan
dengan magnetic stirrer. Sampel disentrifugasi dengan kecepatan 6000 rpm selama
5 menit. Kemudian supernatannya diencerkan dengan air bebas mineral. Sebanyak 1.25 ml sampelyang telah diencerkan ditambah 0.5 ml oksidator K2Cr2O7 1N, dan
5
Pembuatan Media Tumbuh Bakteri (Habibi 2009)
Mula-mula dibuat media dasar dengan komposisi: 1 g ekstrak khamir, 2.75 g natrium suksinat, 1.35 g amonium sulfat, 0.75 g K2HPO4, 0.85 g KH2PO4, 2 mg
EDTA.2Na, 2.8 mg H3BO3, 0.75 mg Na2MoO4.2H2O, 0.24 mg ZnSO4.7H2O, 2.1
mg MnCl2.4H2O, 0.04 mg CuCl2.2H2O, 10 mg FeSO4.7H2O, 0.75 mg CaCl2.2H2O,
dan 0.2 g MgSO4.7H2O dalam 1L akuades. Kemudian media dasar ini dilarutkan
dalam 1 L akuades dan diaduk hingga homogen serta disesuaikan pH-nya hingga 6,8-7 dengan menggunakan larutan NaOH (Merck) 0,1 N dan HCl (Merck) 0,1 N. Setelah itu, media tersebut disterilisasi (autoklaf 121ºC selama 15 menit). Selanjutnya ditambahkan 250 µl biotin, 250 µl niasin, 250 µl p-aminobenzoat, dan 250 µl tiamin.
Kultivasi Bakteri (Anam 2012)
Media tumbuh yang telah steril kemudian ditambahkan stok kultur dari R. marinum sebanyak sepersepuluh bagian (v/v) dan dikultivasi di atas shaker (Certomat) dengan kecepatan 120 rpm yang disertai lampu TL dalam suhu kamar. Kultur sel akan dipanen setelah mencapai OD ± 1 atau lebih dengan ditandai semakin memerahnya warna kultur bakteri (± 2 minggu)
Pembuatan Media Produksi
Media produksi dibuat dengan cara menyampurkan bahan-bahan antara lain ekstrak khamir, basal medium ammonium sulfate succinate yeast (ASY), dan senyawa hasil samping biodiesel yang diperoleh dari percobaan sebelumnya. Terdapat 3 faktor yang digunakan dalam percobaan ini, yaitu senyawa hasil samping biodiesel sebagai faktor A, ekstrak khamir sebagai faktor B, dan basal medium ASY sebagai faktor C. Masing-masing faktor terdiri dari 3 level konsentrasi, yaitu senyawa hasil samping biodiesel dengan konsentrasi sebesar 1%, 4%, dan 7%, ekstrak khamir dengan konsentrasi sebesar 0.05%, 0.10%, dan 0.15%, serta basal medium ASY dengan konsentrasi sebesar 0.5%, 1.0%, dan 1.5%. Total dari ketiga kombinasi pelakuan tersebut akan menghasilkan 27 kombinasi media produksi. Kombinasi media produksi dapat dilihat pada Tabel 1. Desain eksperimen formulasi media produksi disajikan dalam Tabel 2.
Tabel 1 Komposisi media produksi
Faktor A Senyawa hasil samping biodiesel(%)
Faktor B Ekstrak khamir(%)
Faktor C
Basal medium ASY (%)
Level 1 Level 2 Level 3
1 4 7
0.05 0.10 0.15
6
Tabel 2 Desain eksperimen formulasi media produksi
Sampel Senyawa hasil
sampingbiodiesel(%) Ekstrak khamir(%) Basal medium ASY (%) A1B1C1
Kontrol positif dibuat dengan menggunakan glukosa 1% sebagai substrat. Selanjutnya bahan-bahan tersebut dicampurkan di dalam botol serum 120 ml dengan volume kerja 40 ml. Kemudian, dihomogenisasi menggunakan magnetic stirrer. Media produksi dinetralisasi hingga pH 7 dengan menambahkan NaOH 1 M atau HCl 1 M. Lalu sterilisasi menggunakan autoklaf selama 15 menit dengan suhu 1210C 1 atm. Respon yang akan diukur dalam percobaan ini yaitu kadar hidrogen.
Foto Fermentasi (Zaborsky 1998, Kawaguchi et al. 2001)
7
Analisis Gas Hidrogen (Susilaningsih et al. 2008)
Pengukuran produk fermentasi (gas H2) dilakukan menggunakan GC dengan
metode detektor TCD (thermal conductivity detector). Kolom yang digunakan adalah kolom poropak, dengan temperatur injektor, detektor, dan kolom masing-masing adalah 150, 250, dan 80 °C. Gas pembawa yang digunakan adalah gas nitrogen (N2). Sebanyak 1 ml sampel diinjeksikan ke dalam kolom, kemudian
hasilnya dapat dilihat pada layar monitor setelah tiga menit.
Analisis Data
Seluruh analisis statistik yang diperlukan dilakukan dengan bantuan perangkat lunak statistika SPSS 16.0. Model percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan jenis analisis ANOVA one-way. Uji yang digunakan adalah Uji Duncan pada taraf nyata 5%.
HASIL
Karakteristik Senyawa Hasil Samping Biodiesel
Minyak jelantah yang digunakan pada penelitian ini memiliki kadar asam lemak bebas (free fatty acid, FFA) sebesar 3.827%. Minyak jelantah ini berwana coklat kehitaman, keruh, dan berbau tengik, serta terdapat endapan tepung (Gambar 1). Endapan tepung pada minyak perlu dihilangkan dengan cara disaring menggunakan kertas saring. Minyak juga perlu dipanaskan untuk menghilangkan air yang tercampur dalam minyak.
Gambar 1 Sampel minyak jelantah
Pembuatan biodiesel dilakukan melalui reaksi transesterifikasi minyak jelantah. Oleh karena kadar FFA yang tinggi pada minyak, maka diperlukan dua tahap reaksi pembentukan biodiesel, yaitu tahap esterifikasi sebelum dilakukannya tahap transesterifikasi. Tahap esterifikasi dilakukan dengan mereaksikan minyak jelantah dengan metanol dan asam sulfat (H2SO4). Hasil dari reaksi esterifikasi
8
Gambar 2 Hasil esterifikasi dan transesterifikasi
Senyawa hasil samping biodiesel yang telah diperoleh kemudian dipisahkan dan dikarakterisasi dengan beberapa parameter. Karakterisasi tersebut dilakukan untuk mengetahui kondisi fisika dan kimia awal senyawa yang akan digunakan sebagai substrat dalam produksi hidrogen. Karakteristik senyawa hasil samping pembuatan biodiesel tersebut dapat dilihat pada Tabel 3.
Tabel 3 Karakteristik senyawa hasil samping biodiesel
Parameter Uji Nilai
Gula total
Kebutuhan oksigen kimia (COD) pH
2700 ppm 426000 ppm
11
Berdasarkan data pada Tabel 3, dapat dilihat bahwa senyawa hasil samping biodiesel mempunyai kadar gula total sebesar 2700 ppm dan kadar COD sebesar 4426000 ppm serta bersifat basa, dengan pH yaitu 11. Sementara, karakteristik fisik senyawa tersebut berupa larutan berwarna coklat kehitaman, dengan densitas sebesar 880 g/L. Nilai gula total dan COD pada Tabel 3 menunjukkan bahwa terdapatnya senyawa organik dalam senyawa tersebut, yang akan dimanfaatkan oleh bakteri R. marinum sebagai substrat dalam produksi hidrogen.
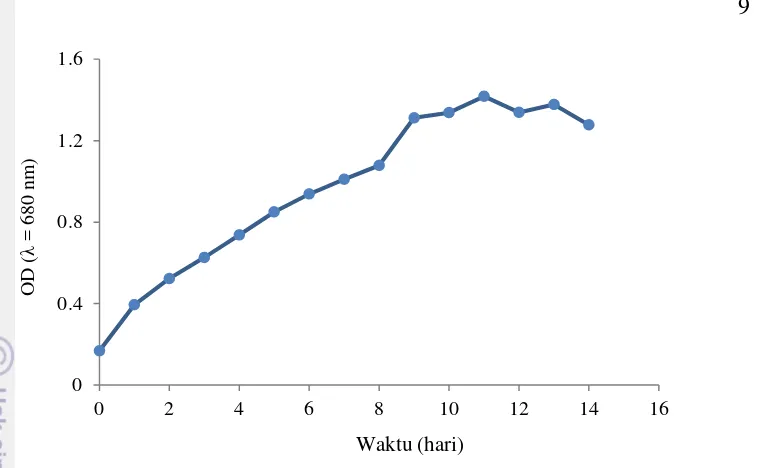
Kurva Pertumbuhan Bakteri
9
Gambar 3 Kurva pertumbuhan bakteri R. marinum
Kurva pertumbuhan bakteri (Gambar 3) menunjukkan bahwa nilai OD meningkat dari hari ke-0 hingga hari ke-11. Penurunan nilai OD terjadi pada hari 12, lalu meningkat kembali pada hari 13, dan menurun kembali pada hari ke-14. Nilai OD maksimum pada penelitian ini dicapai pada hari ke-11, dengan nilai OD sebesar 1.417 A dari OD awal sebesar 0.168 A. Berdasarkan Gambar 3, dapat dilihat bahwa bakteri R. marinum mengalami fase log selama 12 hari, dari hari ke-0 hingga hari ke-11, dengan puncak fase log pada hari ke-11. Hari ke-11 hingga hari ke-14 merupakan fase stasioner, sedangkan fase lag tidak terlihat.
Pengaruh Kombinasi Media Produksi terhadap Produksi Hidrogen
Biohidrogen pada penelitian ini dihasilkan oleh bakteri R. marinum melalui proses foto fermentasi. Bakteri ini mampu mengonversi substrat yang terdapat dalam media produksi menjadi gas hidrogen. Beberapa perlakuan dilakukan untuk memperoleh gas hidrogen tertinggi, yaitu dengan mengkombinasikan konsentrasi dari senyawa hasil samping biodiesel, ekstrak khamir, dan basal medium ASY dalam media produksi. Hidrogen akan dihasilkan oleh R. marinum melalui proses foto fermentasi selama dua hari. Fermentasi dilakukan dengan sistem diskontinyu (batch). Gas hidrogen yang dihasilkan kemudian diukur dengan meggunakan kromatografi gas. Hasil produksi hidrogen dapat dilihat pada Tabel 4 berikut.
0 0.4 0.8 1.2 1.6
0 2 4 6 8 10 12 14 16
OD
(
λ
=
6
8
0
n
m
)
10
Tabel 4 Produksi hidrogen pada berbagai kombinasi media produksi
Sampel Produksi H2 (l/l)
Keterangan : Produksi hidrogen pada berbagai perlakuan. (A1 = konsentrasi senyawa hasil samping biodiesel 1%, A2 = konsentrasi senyawa hasil samping biodiesel 4%, A3 = konsentrasi senyawa hasil sampingbiodiesel 7%, B1 = konsentrasi ekstrak khamir0.05%, B2 = konsentrasi ekstrak khamir 0.10%, B3 = konsentrasi ekstrak khamir 0.15%, C1 = konsentrasi basal medium ASY 0.5%, C2 = konsentrasi basal medium ASY 1.0%, C3 = konsentrasi basal medium ASY 1.5%. Kontrol = substrat glukosa 1%. * = Produksi hidrogen tertinggi).
11
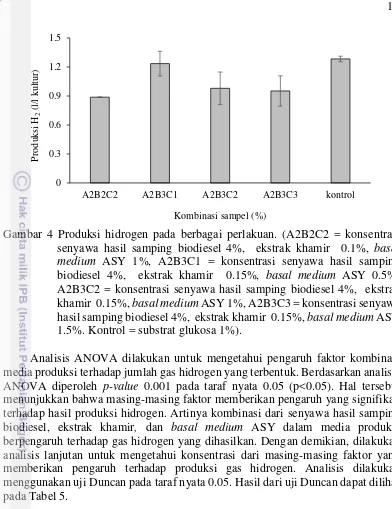
Gambar 4 Produksi hidrogen pada berbagai perlakuan. (A2B2C2 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.1%, basal medium ASY 1%, A2B3C1 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 0.5%, A2B3C2 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 1%, A2B3C3 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 1.5%. Kontrol = substrat glukosa 1%).
Analisis ANOVA dilakukan untuk mengetahui pengaruh faktor kombinasi media produksi terhadap jumlah gas hidrogen yang terbentuk. Berdasarkan analisis ANOVA diperoleh p-value 0.001 pada taraf nyata 0.05 (p<0.05). Hal tersebut menunjukkan bahwa masing-masing faktor memberikan pengaruh yang signifikan terhadap hasil produksi hidrogen. Artinya kombinasi dari senyawa hasil samping biodiesel, ekstrak khamir, dan basal medium ASY dalam media produksi berpengaruh terhadap gas hidrogen yang dihasilkan. Dengan demikian, dilakukan analisis lanjutan untuk mengetahui konsentrasi dari masing-masing faktor yang memberikan pengaruh terhadap produksi gas hidrogen. Analisis dilakukan menggunakan uji Duncan pada taraf nyata 0.05. Hasil dari uji Duncan dapat dilihat pada Tabel 5.
Tabel 5 Signifikasi konsentrasi masing-masing faktor terhadap produksi hidrogen
Faktor Konsentrasi pada media produksi (%)
Senyawa hasil samping biodiesel
1a
4b
7c
Ekstrak khamir 0.05a
0.10b
0.15c
Basal medium ASY 0.5a
1.0ab
1.5b
Keterangan : Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
0 0.3 0.6 0.9 1.2 1.5
A2B2C2 A2B3C1 A2B3C2 A2B3C3 kontrol
P
ro
d
u
k
si H
2
(l/l k
u
ltu
r)
12
Hasil analisis menggunakan uji Duncan menunjukkan bahwa variabel (huruf) yang berbeda pada tiap faktor menunjukkan bahwa masing-masing konsentrasi pada tiap faktor tersebut memberikan pengaruh yang signifikan terhadap produksi hidrogen. Berdasarkan Tabel 5, pada faktor senyawa hasil samping biodiesel dan ekstrak khamir menunjukkan variabel yang berbeda satu sama lain. Artinya tiap-tiap konsentrasi dari senyawa hasil samping biodiesel (1%, 4%, 7%) dan ekstrak khamir (0.05%, 0.10%, 0.15%) memberikan pengaruh yang signifikan (p<0.05) terhadap produksi hidrogen. Sedangkan pada faktor basal medium ASY, terdapat beberapa variabel yang sama, yaitu pada konsentrasi 0.5% tidak berbeda nyata dengan konsentrasi 1.0% dan konsentrasi 1.0% tidak berbeda nyata dengan konsentrasi 1.5%, akan tetapi pada konsentrasi 0.5% berbeda nyata dengan konsentrasi 1.5%. Artinya pada konsentrasi 0.5% memberikan pengaruh yang tidak signifikan (p>0.05) terhadap produksi hidrogen pada konsentrasi 1.0%. Pada konsentrasi 1.0% memberikan pengaruh yang tidak signifikan terhadap produksi hidrogen pada konsentrasi 1.5%. Akan tetapi pada konsentrasi 0.5% memberikan pengaruh yang signifikan (p<0.05) terhadap produksi hidrogen pada konsentrasi 1.5%.
Pengaruh Konsumsi Gula Total dan Senyawa Organik terhadap Hasil Foto Fermentasi
Tujuan dilakukannya pengukuran kadar gula total adalah untuk mengetahui jumlah gula total yang diubah oleh bakteri R. marinum menjadi hidrogen. Pengukuran dilakukan menggunakan metode fenol asam sulfat, dan diukur absorbansinya menggunakan spektrofotometer dengan panjang gelombang 490 nm. Pengubahan gula total menjadi hidrogen ditentukan dengan menghitung penurunan kadar gula selama proses foto fermentasi, yaitu dengan cara menghitung selisih kadar gula total awal dengan kadar gula akhir. Pengukuran kadar gula total awal dilakukan sebelum proses foto fermentasi atau pada hari ke-0, sedangkan pengukuran kadar gula total akhir dilakukan setelah proses foto fermentasi atau hari ke-2. Kadar gula total sebelum dan sesudah proses foto fermentasi dapat dilihat pada Tabel 6.
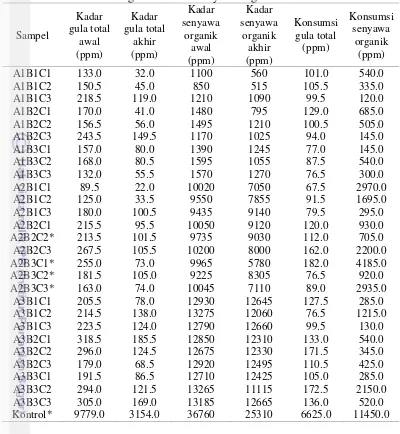
13 Tabel 6 Jumlah konsumsi gula total dan senyawa organik
Sampel
Keterangan : Produksi hidrogen pada berbagai perlakuan. (A1 = konsentrasi senyawa hasil samping biodiesel 1%, A2 = konsentrasi senyawa hasil sampingbiodiesel 4%, A3 = konsentrasi senyawa hasil sampingbiodiesel 7%, B1 = konsentrasi ekstrak khamir 0.05%, B2 = konsentrasi ekstrak khamir 0.10%, B3 = konsentrasi ekstrak khamir 0.15%, C1 = konsentrasi basal medium ASY 0.5%, C2 = konsentrasi basal medium ASY 1.0%, C3 = konsentrasi basal medium ASY 1.5%. Kontrol = substrat glukosa 1%. * = Sampel dengan produksi hidrogen tertinggi).
14
kelima sampel tersebut untuk dianalisis pengaruh konsumsi gula total dan senyawa organik pada sampel tersebut terhadap hasil foto fermentasinya.
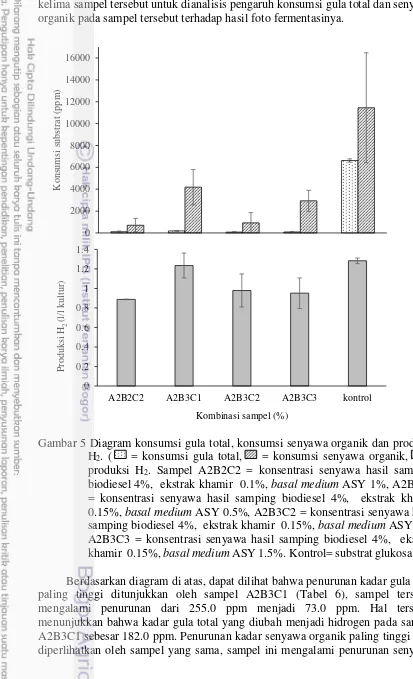
Gambar 5 Diagram konsumsi gula total, konsumsi senyawa organik dan produksi H2. ( = konsumsi gula total, = konsumsi senyawa organik, =
produksi H2. Sampel A2B2C2 = konsentrasi senyawa hasil samping
biodiesel 4%, ekstrak khamir 0.1%, basal medium ASY 1%, A2B3C1 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 0.5%, A2B3C2 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 1%, A2B3C3 = konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 1.5%. Kontrol= substrat glukosa 1%). Berdasarkan diagram di atas, dapat dilihat bahwa penurunan kadar gula total paling tinggi ditunjukkan oleh sampel A2B3C1 (Tabel 6), sampel tersebut mengalami penurunan dari 255.0 ppm menjadi 73.0 ppm. Hal tersebut menunjukkan bahwa kadar gula total yang diubah menjadi hidrogen pada sampel A2B3C1 sebesar 182.0 ppm. Penurunan kadar senyawa organik paling tinggi juga diperlihatkan oleh sampel yang sama, sampel ini mengalami penurunan senyawa
0 2000 4000 6000 8000 10000 12000 14000 16000
A2B2C2 A2B3C1 A2B3C2 A2B3C3 Kontrol
Ko
n
su
m
si
su
b
strat
(p
p
m
)
0 0.2 0.4 0.6 0.8 1 1.2 1.4
A2B2C2 A2B3C1 A2B3C2 A2B3C3 kontrol
P
ro
d
u
k
si H
2
(l/l k
u
ltu
r)
15 organik dari 9965.0 ppm menjadi 5789.0 ppm. Hal tersebut menunjukkan bahwa kadar senyawa organik yang diubah menjadi hidrogen pada sampel ini sebesar 4185.0 ppm. Hal ini yang membuat sampel A2B3C1 menghasilkan gas hidrogen paling tinggi, yaitu sebesar 1.23 l/l kultur.
Beberapa sampel lain dengan produksi hidrogen tertinggi (Tabel 4) yaitu sampel A2B2C2, sampel A2B3C2, dan sampel A2B3C3 mengalami penurunan kadar gula total masing-masing sebesar 112.0 ppm, 76.5 ppm, dan 89.0 ppm, serta mengalami penurunan kadar senyawa organik sebesar 705.0 ppm, 920.0 ppm, dan 2935.0 ppm. Sampel-sampel tersebut dapat menghasilkan hidrogen masing-masing sebesar 0.89 l/l kultur, 0.98 l/l kultur, dan 0.95 l/l kultur. Akan tetapi, penurunan kadar gula total dan senyawa organik pada sampel-sampel tersebut tidak lebih tinggi dari penurunan kadar gula total dan senyawa organik pada variabel kontrol, yaitu rata-rata sebesar 6625.0 ppm dan 11450.0 ppm. Oleh sebab itu, variabel kontrol menghasilkan gas hidrogen yang lebih banyak pula, yaitu sebanyak 1.28 l/l kultur.
PEMBAHASAN
Karakteristik Senyawa Hasil Samping Biodiesel
Hasil pengamatan pada Tabel 3 menunjukkan bahwa senyawa hasil samping pembuatan biodiesel yang didapat dari proses transesterifikasi memiliki kadar gula total sebesar 2700 ppm. Kadar gula tersebut sangat tinggi bila dibandingkan dengan penelitian yang dilakukan oleh Aziz et al. (2014) yang menyatakan bahwa pada senyawa hasil samping biodiesel tidak mengandung gula. Pengukuran kadar senyawa organik pada penelitian ini dilakukan dengan cara mengukur kebutuhan oksigen kimia (COD). Kebutuhan oksigen kimia adalah jumlah oksigen yang diperlukan agar senyawa organik di dalam air dapat teroksidasi melalui reaksi kimia (Nurhasanah 2009). Dengan kata lain jumlah oksigen yang teranalisis dapat merepresentasikan jumlah senyawa organik dalam sampel. Berdasarkan penelitian, senyawa organik yang terkandung dalam sampel hasil samping biodiesel yaitu sebesar 426000 ppm. Kadar COD dalam sampel ini sangat tinggi bila dibandingkan dengan pengukuran kadar COD yang dilakukan oleh Fauzi et al. (2012), dengan sampel yang sama yaitu senyawa hasil samping biodiesel hanya didapat kadar COD sebesar 1200 ppm. Nilai COD yang tinggi tersebut tidak memenuhi baku mutu yang diterapkan oleh pemerintah dalam membatasi kadar COD limbah yang boleh dibuang ke badan sungai, yaitu sebesar 300 ppm (Fauzi et al. 2012). Berdasarkan hasil analisis GC-MS yang dilakukan oleh Siregar (2008), limbah biodiesel sebelum dipurifikasi mengandung beberapa senyawa organik, diantaranya adalah gliserol, metil ester tetradekanoat, metil ester palmitat, asam n-heksadekanoat, metil ester 9-oktadekanoat, metil ester 9-oktadekanoat, asam oleat, dodekenilsuksinat anhidrid, etil ester heksadekanoat, 2-hidroksi-1-(hidroksimetil), serta beberapa seyawa tidak teridentifikasi. Senyawa-senyawa organik tersebut juga dapat dimanfaatkan oleh bakteri sebagai substrat dalam produksi biohidrogen.
16
optimum yang dibutuhkan bakteri untuk produksi gas hidrogen (Habibi et al. 2010). Selain itu, senyawa hasil samping biodiesel ini memiliki densitas sebesar 880 g/l.
Senyawa hasil samping biodiesel dalam penelitian ini didapatkan dari proses pembuatan biodiesel menggunakan minyak jelantah sebagai bahan bakunya. Biodiesel yang dihasilkan kemudian dipisahkan dan dapat digunakan kembali untuk kebutuhan yang lain, sedangkan hasil sampingnya dimanfaatkan untuk menghasilkan biohidrogen dalam penelitian ini. Pembuatan biodiesel dari minyak jelantah dapat dilakukan dengan dua cara, yaitu melalui satu tahap reaksi, yakni reaksi transesterifikasi ataupun dalam dua tahap reaksi, yakni reaksi esterifikasi dan reaksi transesterifikasi. Pertimbangan perlunya reaksi esterifikasi dilakukan sebelum reaksi transesterifikasi, karena minyak jelantah mengandung asam lemak bebas yang cukup tinggi. Asam lemak bebas (FFA) yang tinggi pada minyak akan bereaksi dengan katalis KOH, sehingga membentuk sabun ketika proses transesterifikasi (Gerpen 2005). Sabun yang terbentuk tersebut menghalangi reaksi metanol terhadap trigliserida. Selain itu keberadaan sabun dapat menyulitkan pemisahan biodiesel dan seyawa hasil sampingnya, sehingga rendemen yang dihasilkan menurun, serta dapat mengurangi kualitas biodiesel yang dihasilkan (Hambali et al. 2008). Nakpong dan Wootthikanokkhan (2010) menyatakan bahwa sebagian peneliti membatasi proses produksi biodiesel yang memungkinkan hanya dengan reaksi transesterifikasi adalah minyak nabati yang memiliki kandungan FFA dibawah 1%. FFA pada minyak yang digunakan pada penelitian ini adalah sebesar 3.827%. Oleh sebab itu, proses esterifikasi tetap perlu dilakukan sebelum proses transesterifikasi minyak jelantah.
Proses esterifikasi asam lemak dilakukan menggunakan metanol dengan katalis asam (Farobie 2009). Hasil penelitian menunjukkan bahwa terbentuk dua lapisan pada proses esterifikasi. Lapisan bawah ialah ester metil asam lemak (fatty acid metil ester, FAME) dan trigliserida sedangkan lapisan atas ialah sisa metanol yang tidak bereaksi. Lapisan bawah kemudian dipisahkan dan digunakan untuk tahap transesterifikasi (Gambar 2).
Transesterifikasi adalah penggantian gugus alkohol dari ester dengan alkohol lain dalam suatu proses yang menyerupai hidrolisis. Namun berbeda dengan hidrolisis, pada proses transesterifikasi bahan yang digunakan bukan air melainkan alkohol (Farobie 2009). Dari hasil tahap transesterifikasi ini diperoleh dua lapisan, yaitu biodiesel pada lapisan atas dan senyawa hasil samping biodiesel pada lapisan bawah. Lapisan atas tidak larut dalam air sedangkan lapisan bawah larut dalam air. Hal ini karena biodiesel merupakan senyawa nonpolar sedangkan hasil samping biodiesel merupakan senyawa organik polar (Farobie 2009).
Kurva Pertumbuhan Bakteri
17 melalui kuncup. R. Marinum berhasil diisolasi dari laut pada tahun 1995 (Hiraishi et al. 1995).
Kultivasi bakteri R. marinum dilakukan untuk meremajakan dan memperbanyak jumlah sel bakteri. Pola pertumbuhan bakteri menurut Pelczar dan Chan (1986) membentuk pola pembelahan binner. Pertumbuhan ini dapat ditandai dengan pertambahan volume dan ukuran sel dan juga sebagai pertambahan jumlah sel. Pertumbuhan sel bakteri biasanya mengikuti suatu pola pertumbuhan tertentu berupa kurva pertumbuhan sigmoid.
Kurva pertumbuhan bakteri dapat dipisahkan menjadi empat fase utama, yaitu fase lag, fase log, fase stasioner, dan fase kematian. Fase lag atau fase adaptasi merupakan fase yang terjadi pada saat bakteri pertama kali ditumbuhkan pada media tumbuh yang baru. Pada fase ini terjadi penyesuaian terhadap perubahan komposisi kimiawi media tumbuh. Walaupun begitu, sel bakteri akan tetap mensintesis komponen selulernya dan mengalami pertambahan substansi intraseluler serta ukurannya (Pelczar dan Chan 1986). Pada fase ini bakteri melakukan sintesis ribosom serta essential cofactors sebelum pertumbuhan berlangsung. Lama fase ini bervariasi tergatung pada kondisi sel dan sifat dari media. Sel yang sudah tua atau baru saja dikeluarkan dari tempat penyimpanan dan dikultur dalam suatu media dengan kandungan nutrisi yang berbeda akan membutuhkan waktu yang lebih panjang jika dibandingkan dengan sel yang masih muda muda dan dikulturkan pada media baru yang sama (Hamdiyati et al. 2008). Berdasarkan kurva pertumbuhan (Gambar 3), didapatkan hasil bahwa fase lag tidak terlihat, hal tersebut dikarenakan fase lag terjadi secara cepat, kemungkinan fase ini terjadi dalam hitungan jam, sedangkan pengecekan terhadap sel bakteri pada penelitian ini dilakukan dalam rentang waktu satu hari. Fase lag yang cepat pada penelitian ini juga disebabkan karena kultivasi bakteri dilakukan pada media pertumbuhan yang sama dengan media stok kultur.
Fase kedua adalah fase log atau fase eksponensial, pada fase ini organisme tumbuh dan membelah pada keceptan maksimum tergantung pada sifat genetik, medium, dan kondisi pertumbuhan (Hamdiyati et al. 2008). Berdasarkan penelitian, fase ini terjadi pada hari ke-0 sampai hari ke-11. Fase ini ditandai dengan kecepatan pertumbuhan yang konstan, aktivitas metabolik yang seimbang, serta sel membelah dan meningkat jumlahnya dalam interval yang teratur (Hamdiyati et al. 2008, Pelczar dan Chan 1986). Puncak fase log berdasarkan Gambar 3 dicapai pada hari ke-11, dengan nilai OD sebesar 1.417 A. Pada puncak fase log tersebut, kultur bakteri R. marinum siap dipanen dan dipindahkan dalam media produksi untuk proses fermentasi produksi hidrogen. Hasil penelitian Habibi (2009) menunjukkan bahwa R. marinum memproduksi gas H2 terbanyak saat pertumbuhan bakteri berada
di fase log. Hal tersebut mungkin dikarenakan pertumbuhan bakteri yang sedang meningkat pesat memicu pembentukan hidrogen dari pemecahan senyawa organik dan juga dari hasil fotosintesis (Hastuti 2011).
18
hari ke-14, sel bakteri mengalami fase stasioner. Fase ini mungkin dapat berjalan lebih lama, akan tetapi pengukuran jumlah bakteri dalam penelitian ini hanya dilakukan hingga hari ke-14.
Fase kematian merupakan fase terakhir dalam pertumbuhan bakteri. Pada fase ini terjadi perubahan lingkungan tumbuh seperti kehabisan nutrisi dan akumulasi senyawa toksik sehingga menyebabkan menurunnya jumlah sel hidup. Sel mengalami kematian dalam pola logaritik (Hamdiyati et al. 2008).
Pengaruh Kombinasi Media Produksi terhadap Produksi Hidrogen
Berdasarkan hasil karakterisasi (Tabel 3), dapat dinyatakan bahwa senyawa hasil samping biodiesel layak dijadikan substrat dalam produksi biohidrogen, karena mengandung gula dan senyawa organik yang cukup tinggi, yang dapat dimanfaatkan bakteri untuk menghasilkan biohidrogen. Senyawa hasil samping biodiesel ini kemudian dikombinasikan dengan bahan lain yaitu ekstrak khamir, dan basal medium ASY sebagai penyusun komposisi media produksi. Selanjutnya dilakukan optimasi untuk mengetahui kombinasi konsentrasi bahan-bahan dalam media produksi yang paling optimal dalam meningkatkan produksi hidrogen. Hasil pengukuran pada Tabel 4 dan Gambar 4 menunjukkan bahwa produksi hidrogen tertinggi dihasilkan oleh sampel A2B3C1 atau senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, dan basal medium ASY 0.5%, yaitu sebesar 1.23 l/l kultur. Produksi hidrogen tertinggi kemudian dihasilkan oleh sampel A2B2C2 (senyawa hasil samping biodiesel 4% ekstrak khamir 0.1%, basal medium ASY 1%) sebesar 0.89 l/l kultur, sampel A2B3C2 (senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 1%) sebesar 0.98 l/l kultur, dan sampel A2B3C3 (senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, basal medium ASY 1.5%) sebesar 0.95 l/l kultur. Akan tetapi jumlah tersebut tidak lebih tinggi dari produksi hidrogen yang dihasilkan oleh variabel kontrol, yaitu rata-rata sebesar 1.28 l/l kultur.
Masing-masing senyawa yang ada dalam media produksi mengandung unsur-unsur yang dibutuhkan oleh bakteri. Senyawa hasil samping biodiesel merupakan senyawa organik berperan sebagai sumber karbon (C). Bakteri R. marinum merupakan bakteri fotosintetik nonsulfur yang menggunakan senyawa organik sebagai sumber karbonnya dan menghasilkan hidrogen dalam kondisi fotoheterotopik (Hastuti 2011). Ekstrak khamir juga merupakan senyawa yang dibutuhkan bakteri sebagai sumber nitrogen (N) (Hastuti 2011). Nitrogen merupakan komponen utama protein dan asam nukleat, yaitu sebesar 10% dari berat kering sel bakteri (Waluyo dan Lud 2005). Basal medium ASY pada media produksi terdiri atas beberapa senyawa, antara lain K2HPO4, KH2PO4, EDTA.2Na,
H3BO3, Na2MoO4. 2H2O, ZnSO4.7H2O, MnCl2, Cu(Mo3)2. 3H2O, FeSO4. 7H2O,
CaCl2. 2H2O, MgSO4. 7 H2O. Basal medium ASY ini berfungsi sebagai
mikroelemen yang dibutuhkan oleh bakteri (Habibi 2009).
19 Hal tersebut dikarenakan senyawa hasil samping biodiesel ini memiliki warna yang gelap (coklat kehitaman), sehingga semakin tinggi konsentrasi yang diberikan maka warna media produksi juga menjadi semakin gelap. Bakteri R. marinum merupakan bakteri fotosintetik, bakteri ini mampu mengubah substrat menjadi hidrogen melalui proses fotofermentatif (Habibi 2009). Bakteri ini membutuhkan cahaya yang cukup sebagai sumber energi untuk menghasilkan hidrogen (Hastuti 2011). Keberadaan substrat berupa senyawa hasil samping biodiesel dengan konsentrasi yang tinggi menyebabkan warna media produksi menjadi semakin gelap, sehingga menghalangi penyerapan cahaya oleh sel bakteri, sehingga dengan konsentrasi senyawa hasil samping biodiesel yang lebih tinggi justru akan menurunkan produksi hidrogennya.
Hasil analisis ANOVA menyatakan bahwa masing-masing faktor dalam media produksi, yaitu senyawa hasil samping biodiesel, ekstrak khamir, dan basal medium ASY memberikan pengaruh yang signifikan terhadap respon yaitu produksi hidrogen pada taraf nyata 0.05. Dengan demikian, dilakukan analisis lanjutan dengan menggunakan uji Duncan untuk mengetahui konsentrasi pada masing-masing faktor dalam media produksi yang memberikan pengaruh signifikan terhadap produksi hidrogen. Berdasarkan uji Duncan pada α=0.05, diperoleh data bahwa masing-masing konsentrasi pada faktor senyawa hasil samping biodiesel memberikan pengaruh yang signifikan terhadap respon, artinya pada konsentrasi senyawa hasil samping biodiesel 1%, 4%, maupun 7% masing-masing memberikan pengaruh yang berbeda terhadap produksi hidrogen. Begitu pula dengan faktor ekstrak khamir, masing-masing konsentrasi ekstrak khamir yaitu 0.05%, 0.10%, dan 0.15% memberikan pengaruh yang berbeda terhadap produksi hidrogen. Sementara pada faktor basal medium ASY, pada konsentrasi 0.5% memiliki taraf yang tidak berbeda nyata dengan konsentrasi 1.0%, akan tetapi keduanya memiliki taraf yang berbeda terhadap konsentrasi 0.15%. Artinya produksi hidrogen pada konsentrasi basal medium ASY 0.5% tidak berbeda nyata dengan produksi hidrogen pada konsentrasi basal medium ASY 1.0%. Akan tetapi keduanya memberikan pengaruh yang berbeda nyata terhadap produksi hidrogen pada konsentrasi basal medium ASY 1.5%.
Proses pembentukan hidrogen pada bakteri R. marinum melalui proses fotofementasi yang dikatalisasi oleh enzim nitrogenase dan hidrogenase (Akkerman et al. 2002, Koku et al. 2002, Basak dan Das 2007). Secara keseluruhan fotosistem bakteri fotosintetik ini mengubah komponen utama dari senyawa organik menjadi gas hidrogen (H2) dan karbon dioksia (CO2). Enzim nitrogenase berfungsi
mereduksi proton yang diperoleh dari pemecahan substrat menjadi gas hidrogen (H2) dibantu dengan energi dalam bentuk ATP dan elektron yang diperoleh dari
feridoksin (Fd) (Chen et al.2005). Enzim hidrogenase secara umum berperan dalam mengkatalisis proton menjadi gas hidrogen pada mikroalga maupun bakteri. Namun, selain mampu mengkatalisis pembentukan hidrogen, enzim hidrogenase juga memiliki kemampuan untuk mengoksidasi kembali hidrogen yang telah diproduksi, sehingga produksi hidrogen menjadi berkurang (Tamagnini et al. 2002, Miyake 1998, Hallenbeck et al. 2009).
20
menyatakan bahwa selain pH, kondisi lingkungan lain yang berpengaruh berpengaruh terhadap produksi hidrogen melalui foto fermentasi adalah intensitas cahaya, suhu, dan kecepatan penggoyangan. Intensitas cahaya 2000 lux, pada suhu 300C dan kecepatan penggoyangan 120 rpm merupakan kondisi lingkungan yang optimum untuk produksi hidrogen. Selain itu, glukosa merupakan susbstrat yang baik dalam produksi hidrogen oleh R. marinum. Menurut Habibi (2009), glukosa potensial dalam menghasilkan H2 paling banyak dengan menggunakan R. marinum,
secara stoikiometri, 1 mol glukosa akan menghasilkan 12 mol H2. Dalam penelitian
tersebut, Habibi (2009) menggunakan glukosa dengan kadar 1%. Oleh sebab itu, penelitian ini juga menggunakan substrat berupa glukosa 1% sebagai kontrol. Sementara, pada penelitian yang dilakukan Anam (2012) menggunakan ekstrak khamir sebesar 0.1%.
Pengaruh Konsumsi Gula Total dan Senyawa Organik terhadap Hasil Foto Fermentasi
Bakteri R. marinum menggunakan substrat berupa senyawa organik yang terkandung dalam senyawa hasil samping pembuatan biodiesel. Konversi senyawa organik menjadi hidrogen dapat dilihat dengan cara menghitung kadar gula total, dan kadar senyawa organik selama proses foto fermentasi. Berdasarkan hasil pengukuran kadar gula total dan kadar senyawa organik menunjukkan bahwa masing-masing sampel mengalami penurunan kadar setelah proses foto fermentasi. Berkurangnya kadar gula total dan senyawa organik disebabkan karena bakteri mengkonsumsi atau memanfaatkan gula total dan senyawa organik untuk diubah menjadi hidrogen. Berdasarkan Gambar 3, dapat dilihat bahwa sampel A2B3C1 mengalami penurunan gula total dan senyawa organik paling tinggi diantara yang lain, yaitu sebesar 182 ppm untuk gula total dan 4185 ppm untuk senyawa organik. Hal tersebut menunjukkan bahwa bakteri mengkonsumsi gula total sebesar 182 ppm dan senyawa organik sebesar 4185 ppm untuk diubah menjadi hidrogen sebesar 1.23 l/l kultur.
Beberapa sampel dengan produksi hidrogen tertinggi lainnya yaitu sampel A2B2C2, sampel A2B3C2, dan sampel A2B3C3 juga mengalami penurunan kadar gula total maupun senyawa organik selama proses fotofermetasi. Sampel A2B2C2, sampel A2B3C2, dan sampel A2B3C3 mengalami penurunan kadar gula total masing-masing sebesar 112 ppm, 76.5 ppm, dan 89 ppm, dan penurunan kadar senyawa organik masing-masing sebesar 705 ppm, 920 ppm, dan 2935 ppm. Masing-masing sampel tersebut mampu menghasilkan hidrogen sebesar 0.89 l/l kultur, 0.98 l/l kultur, dan 0.95 l/l kultur. Sementara pada variabel kontrol menunjukkan penurunan kadar gula total dan senyawa organik paling tinggi dari sampel lainnya, yakni sebesar 6625 ppm untuk gula total dan 11450 ppm untuk senyawa organik, sehingga menghasilkan jumlah gas hidrogen yang lebih tinggi pula, yaitu sebesar 1.28 l/l kultur.
21 produksi. Selain itu, substrat yang digunakan dalam penelitian ini berasal dari senyawa hasil samping (limbah) biodiesel, yang belum diketahui secara detail komposisi senyawa yang terkandung di dalamnya. Komposisi senyawa yang berbeda tersebut dapat mempengaruhi jumlah produksi hidrogen pada masing-masing sampel. Anam (2012) menyebutkan bahwa pada proses foto fermentasi biohidrogen, media produksi yang mengandung komposisi senyawa yang berbeda akan menghasilkan produk yang berbeda pula. Menurut Miyake (1998) dan Hellenbeck et al. (2009), produksi hidrogen yang rendah dapat disebabkan karena pada proses foto fermentasi dihasilkan juga produk lain berupa gas CO2, dan
asam-asam organik. Faktor lain yang juga dapat mempengaruhi jumlah produksi hidrogen adalah aktifitas enzim nitrogenase dan hidrogenase (Akkerman et al. 2002, Koku et al. 2002, Basak dan Das 2007).
Evaluasi kinerja produksi hidrogen pada penelitian ini dilakukan dengan cara membandingkan produksi hidrogen dengan produksi hidrogen dari berbagai sumber substrat berdasarkan penelitian-penelitian yang telah dilakukan sebelumnya. Penelitian sebelumnya yang dilakukan oleh Ike et al. (1999) memperlihatkan bahwa dengan menggunakan bakteri R. marinum A-501, dari substrat berupa glukosa dapat menghasilkan hidrogen sebesar 0.48 l/l kultur, dari sumber karbon (C) sebesar 4500 ppm, selain itu dengan bakteri yang sama, dengan substrat berupa maltosa, sukrosa, asam laktat, asam malat, asam asetat, dan gliserol dapat menghasilkan hidrogen masing-masing sebesar 0.30 l/l kultur dari 4275 ppm sumber C, 0.28 l/l kultur dari 4275 ppm sumber C, 0.84 l/l kultur dari 4599 ppm sumber C, 0.52 l/l kultur dari 6700 ppm sumber C, 0.005 l/l kultur dari 4500 ppm sumber C, dan 0.19 l/l kultur dari 3956 ppm sumber C. Sedangkan penelitian yang dilakukan oleh Zhu et al. (1999) menunjukkan bahwa bakteri R. sphaeroides RV, menggunakan substrat berupa limbah cair industri tahu, mampu menghasilkan hidrogen sebesar 1.9 l/l kultur dari sumber C sebesar 8810 mg TOC. Penelitian serupa juga dilakukan oleh Yetis et al. (2000) dan Eroglu et al. (2004), menggunaan bakteri yang sama, yaitu R. sphaeroides OU 001, dengan substrat berupa limbah industri gula dan limbah minyak zaitun mampu menghasilkan hidrogen masing-masing sebesar 0.86 l/l kulur dari 70 mM sumber C dan 0.25 l/l kultur dari 100 ppm sumber C. Selain itu, penelitian yang dilakukan oleh Anam (2012) dan Reko (2014), menunjukkan bahwa bakteri R. marinum menggunakan substrat limbah cair industri susu, limbah cair industri kecap, dan limbah cair industri pempek mampu menghasilkan hidrogen masing-masing sebesar 0.86 l/l kultur dari 6264 ppm sumber C, 1.33 l/l kultur dari 16200 ppm sumber C, dan 0.19 l/l kultur dari 3222 ppm sumber C.
22
SIMPULAN DAN SARAN
Simpulan
Senyawa hasil samping pembuatan biodiesel dari minyak jelantah dapat dijadikan substrat dalam produksi biohidrogen. Media produksi dengan substrat hasil samping biodiesel mampu menghasilkan biohidrogen sebesar 1.23 l/l kultur. Media produksi yang optimal menghasilkan biohidrogen tertinggi adalah media produksi dengan kombinasi konsentrasi senyawa hasil samping biodiesel 4%, ekstrak khamir 0.15%, dan basal medium ASY 0.5%.
Saran
23
DAFTAR PUSTAKA
Agrawal P, R Hema, S Mahesh K. 2007. Experimental investigation on biological hydrogen producing using different biomass. J Teknol Keluaran Khas. 47:13-24
Akkerman I, M Janssen, J Rocha, RH Wijffels. 2002. Photobiological hydrogen production photochemical efficiency and bioreactor design. Int J Hydrogen Energ. 27: 1195-1208
Anam K. 2012. Studi pemanfaatan limbah cair industri makanan lokal untuk produksi hidrogen dengan menggunakan bakteri fotosintetik Rhodobium marinum [tesis]. Bogor (ID): Institut Pertanian Bogor.
Aziz I. 2008. Pemurnian gliserol dari hasil samping pembuatan biodiesel menggunakan bahan baku minyak goreng bekas. J Val. 1:19-23.
Aziz I, Thamzil L, Annisa S. 2014. Pemurnian crude glycerol dengan cara pengasaman dan adsorpsi menggunakan zeolit alam lampung. J Kim. 7:2 Barbosa MJ, Rocha JMS, Tramper J, Wijnels RH. 2001. Acetate as a carbon source
for hydrogen production by photosynthetic bacteria. J Biotechnol 85:25-33. Basak N, Das D. 2007. The prospect of purple non-sulfur (PNS) photosynthetic
bacteria for hydrogen production: the present state of the art. World J Microb Biot 23:31-42.
Chen WH, SY Chen, SK Khanal, S Sung. 2006. Kinetic study of biological hydrogen production by anaerobic fermentation. Int J of Hydrogen energ. 31: 2170-2178.
Darnoko D, Cheryan M. 2000. Kinetics of palm oil transeterification in a batch reactor. J Am Oil Chem Soc. 77: 1263-1267
Das D, Veziroglu T. 2008. Advances in biological hydrogen production processes. Int J Hydrogen Energ 33:6046-6057.
Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric method for determination of sugars and related substances. J Anal Chem. 28(3): 350-356.
Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric method for determination of sugars and related substances. J Anal Chem. 28(3): 350-356.
Eroglu E, Gunduz U, Yucel M, Turker L. 2004. Photobiological hydrogen production by using olive mill wastewater as a sole substrate source. Elements 29:163-171
24
Fauzi MA, Setyani HS, Indro S. 2012. Efektivitas pengolahan limbah cair dengan aerasi dalam menurunkan kadar COD pada limbah biodiesel. J Tek Kim Indones. 1:320-328
Gerpen JV. 2005. Biodiesel processing and production. Fuel Process Technol 86: 1097-1107.
Habibi MS. 2009. Produksi biohidrogen melalui fermentasi bakteri fotosintetik Rhodobium marinum dan isolat Sanur[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hallenbeck PC, Ghosh D, Skonieczny MT, Yargeau, V. 2009. Microbiological and engineering aspects of biohydrogen production. J Microbiol 49:48-59. Hambali E, S Mujdalipah, AH Tambunan, AW Pattiwiri, R Hendroko. 2008.
Teknologi bioenergi, Cetakan kedua. Jakarta (ID): Agromedia Pustaka.
Hamdiyati Y, Kusnadi, Rahadian I. 2008. Aktivitas antibakteri ekstrak daun patikan kebo (Euphorbia hirta) terhadap pertumbuhan bakteri Staphylococcus epidermidis. JPMIPA 2:12.
Hastuti F. 2011. Produksi biohidrogen oleh bakteri fotosintetik Rhodobium marinum pada pencahayaan berbeda. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hiraishi A, Urata K, Satoh T. 1995. A new genus of marine budding phototrophic bacteria, Rhodobium gen. nov., which includes Rhodobium orientis sp. nov. and Rhodobium marinum comb. nov. Int J Systematic Bacteriol, 45:226-234. Husni H, Esmiralda. 2009. Uji toksisitas akut limbah cair industri tahu terhadap ikan mas (Cyprinus carpio Lin). Padang (ID): Jurusan Teknik Lingkungan, Universitas Andalas
Ike A, Murakawa T, Kawaguchi H, Hirata K, Miyamoto K. 1999. Photoproduction of hydrogen from raw starch using a halophilic bacterial community. J Biosci Bioeng 88:72-77
Irawulan. 2009. Cadangan minyak bumi di Indonesia menipis. Detik Surabaya. Kapdan IK, Kargi F. 2006. Bio-hydrogen production from waste materials. J
Enzyme Microb Tech 38:569-582.
Kawaguchi H, K Hashimoto, K Hirata, K Miyamoto. 2001. Hydrogen production from algal biomass by a mixed culture of R. marinum A-501 and Lactobacillus amylovorus. J Biosci Bioeng. 91: 27-282.
Kirtay E. 2011. Recent advances in production of hydrogen from biomass. J Energy 52:1778-1789.
Koku H, Inci E, Ufuk G, Meral Y, Lemi T. 2002. Aspect of the metabolism of hydrogen production by Rhodobacter sphaeroides. Int J Hydrogen Energ 27:1315-1329.
25 Li RY, Fang HHP. 2008. Hydrogen production characteristics of photoheterotrophic Rubrivivax gelatinosus L31. Int J Hydrogen Energ 33: 974-980.
Miyake J. 1998. The science of biohydrogen. Di dalam: Zaborsky OR, editor. Biohydrogen. Proceedings of an International Conference on Biological Hydrogen Production; Hawai, 23-26 June 1997. New York (US): Plenum Press. hlm 7-18.
Miyamoto K, editor. 1997. Renewable biological systems for alternative sustainable energy production. Food and Agriculture Organization (FAO), United Nations, Osaka
Nakpong P, Wootthikanokkhan S. 2010. Optimization of biodiesel production from Jatropha curcas L. Oil via alkali-catalyzed methanolysis. J Sus Energ Env 1:105-109
Nurhasanah. 2009. Penentuan kadar COD (chemical oxygen demand) pada limbah cair pabrik kelapa sawit, pabrik karet, dan domestik [skripsi]. Medan (ID): Universitas Sumatera Utara.
Pagliaro, Mario, Rossi, Michele. 2008. The Future of Glycerol: New Uses of a Versatile Raw Material. New York (US): RSC Green Chemistry Book Series.
Pelczar MJ Jr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T. Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Elements of Microbiology.
Reko PB. 2014. Pemanfaatan limbah cair industri pempek dalam produksi biohidrogen menggunakan bakteri fotosintetik Rhodobium marinum. [skripsi]. Jakarta (ID): Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta. Ruhyat N, Firdaus A. 2006. Analisis pemilihan bahan baku biodiesel di DKI Jakarta.
Jakarta (ID): Universitas Mercu Buana.
Sirait LR. 2007. Produksi gas hidrogen dari limbah cair tahu dengan bakteri fotosintetik Rhodobium marinum [tesis]. Depok (ID): Universitas Indonesia. Siregar YDI. 2006. Biosintesis 1,3-propanadiol dari gliserol (hasil samping
biodiesel) oleh bakteri Enterobacter aerogenes [tesis]. Bogor (ID): Institut Pertanian Bogor.
Susilaningsih D, Harwati TU, Anam K, Yopi. 2008. Preparasi substrat limbah biomassa kekayuan tropika untuk produksi biohidrogen. Makara Teknol. 12(1):38-42.
Tamagnini P, Axelsson R, Lindberg P, Oxelfelt F, Wunschiers R, Lindblad P. 2002. Hydrogenases and hydrogen metabolism of cyanobacteria. J Microbiol Mol Biol Rev 66(1):1
Waluyo, Lud. 2005. Mikrobiologi Umum. Malang (ID): Universitas Muhammadiyah Malang Press.
26
Zaborsky. 1998. BioHydrogen. New York (US): Plennum Pr.
Zhang, Y.,Dube, M.A., McLean, D.D. and Kate, M. (2003). Biodiesel production from waste cooking oil process design and technological assessment. J Bior Tech, 89(1): 1-16.
27
28
Lampiran 1 Diagram alur penelitian
Lampiran 2 Kadar Asam lemak bebas (FFA) Contoh perhitungan:
Konsentrasi KOH : 0.1 N Volume titrasi KOH : 0.89 ml Bobot molekul minyak jelantah : 860 Massa minyak jelantah : 2 g
% FFA = KOH KOH
= . .
= 3.827 %
Pembuatan media tumbuh bakteri Karakterisasi minyak
jelantah
Pembuatan biodiesel
Karakterisasi senyawa hasil samping biodiesel
Pembuatan media produksi
Kultivasi bakteri Rhodobium
marinum Foto fermentasi
Analisis gas hidrogen Pengukuran
kadar gula total dan kadar
senyawa organik
Senyawa hasil samping biodiesel
29 Lampiran 3 Diagram alir pembuatan biodiesel
+
+ Reaksi
transesterifikasi Pemisahan sisa metanol
dan metil ester asam lemak + trigliserida
Pemisahan biodiesel dan senyawa hasil samping biodiesel
Reaksi esterifikasi
Metanol teknis sebanyak 15%
minyak
KOH sebanyak 1% minyak
Pemanasan suhu 550C Waktu 1 jam
Pemanasan suhu 550C Waktu 1 jam
Senyawa hasil samping biodiesel
Metil ester asam lemak + trigliserida
Minyak jelantah FFA = 3.827% Metanol teknis
sebanyak 225% FFA
Asam sulfat sebanyak 5%
FFA
30
Lampiran 4 Kultivasi bakteri R. marinum
Lampiran 5 Foto fermentasi bakteri R. marinum
Lampiran 6 Hasil pengukuran OD bakteri R. marinum pada λ = 680 nm
Waktu (hari) OD bakteri (A)
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
31 Lampiran 7 Hasil produksi hidrogen pada berbagai kombinasi media produksi
Sampel Volume gas
produk (ml)
263.4060 ± 32.8943 283.9869 ± 18.8290 198.5413 ± 33.3154 314.0494 ± 17.7245 279.7619 ± 13.4373 276.6620 ± 3.2849 270.3666 ± 46.0983 441.3215 ± 47.7304 174.4898 ± 15.9810 207.3053 ± 6.9614 441.3215 ± 3.6301 252.4192 ± 63.8564 670.1441 ± 130.8874
887.8519 ± 2.8590 711.1009 ± 166.9534 1234.9200 ± 127.4281
979.2136 ± 168.7988 951.5008 ± 156.3862 203.3699 ± 5.5171 189.3322 ± 6.2408 419.3271 ± 79.0756 434.3606 ± 12.6302 550.7992 ± 25.7118 208.2108 ± 2.6197 728.2301 ± 237.1956
346.8285 ± 48.5995 503.7916 ± 43.2246 1283.0971 ± 28.7180
Contoh perhitungan produksi H2 sampel A1B1C1:
Luas area standar : 516882 Volume kerja produk : 40 ml
Produksi H2 = puncak
= . .
32
Lampiran 8 Kromatogram hasil analisis gas H2 sampel A1B1C1
Lampiran 9 Hasil analisis statistika pengaruh kombinasi konsentrasi media produksi terhadap produksi H2 menggunakan SPSS 16.00
Faktor-Taraf- Ulangan N Gliserol 1 18
4 18
7 18
Yeast 0.05 18 0.1 18 0.15 18 Basal 0.5 18
1 18
33
Uji pengaruh kombinasi konsentrasi media produksi terhadap produksi H2
Dependent Variable:Produksi H2
Source
Type III Sum of
Squares Df Mean Square F Sig. Corrected Model 7079.879a 26 272.303 23.724 .000
Intercept 17614.730 1 17614.730 1.535E3 .000 Gliserol 2428.829 2 1214.415 105.803 .000 Yeast 2097.529 2 1048.764 91.371 .000 Basal 76.491 2 38.246 3.332 .051 Gliserol * Yeast 1639.325 4 409.831 35.706 .000 Gliserol * Basal 62.728 4 15.682 1.366 .272 Yeast * Basal 309.895 4 77.474 6.750 .001 Gliserol * Yeast * Basal 465.082 8 58.135 5.065 .001
Error 309.908 27 11.478
Total 25004.517 54 Corrected Total 7389.787 53
a. R Squared = .958 (Adjusted R Squared = .918)
Uji lanjut Duncan
Senyawa hasil samping biodiesel Produksi H2
Duncan
Gliserol N
Subset
1 2 3
1 18 11.1226
7 18 15.9300
4 18 27.1303
Sig. 1.000 1.000 1.000 Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 11.478.
Ekstrak khamir Produksi H2
Duncan
Yeast N
Subset
1 2 3
0.05 18 9.9002
0.1 18 19.2575
0.15 18 25.0252
Sig. 1.000 1.000 1.000 Means for groups in homogeneous subsets are displayed. Based on observed means.
34
Basal medium ASY Produksi H2
Duncan
Basal N
Subset
1 2
1.5 18 16.4269
1 18 18.5287 18.5287
0.5 18 19.2273
Sig. .074 .541
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 11.478.
Lampiran 10 Absorbansi standar glukosa pada λ = 490 nm
Konsentrasi (ppm) Absorbansi
0 10 20 30 40 50 60 70 80 90 100
0 0.126 0.258 0.361 0.400 0.520 0.610 0.711 0.806 0.935 1.034
y = 0.010x + 0.026 R² = 0.9958
0 0.2 0.4 0.6 0.8 1 1.2
0 20 40 60 80 100 120
Ab
so
rb
an
si
35 Lampiran 11 Hasil pengukuran kadar gula total
Sampel
Contoh perhitungan kadar gula total awal sampel A1B1C1: y = 0.010x + 0.026
y = absorbansi sampel x = kadar gula total faktor pengenceran = 10 x = − .
. x faktor pengenceran
= . − .
. x 10
= 133 ppm
Konsumsi gula total = kadar gula total awal – kadar gula total akhir
= 133 – 32
36
Lampiran 12 Absorbansi standar KHP pada λ = 600 nm
Konsentrasi (ppm) Absorbansi
0 100 200 400 600 800 1600
0 0.162 0.329 0.567 0.750 1.006 1.868
y = 0.0011x + 0.0636 R² = 0.9962
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2
0 200 400 600 800 1000 1200 1400 1600 1800
Ab
so
rb
an
si
37 Lampiran 13 Hasil pengukuran kadar senyawa organik
Sampel
Contoh perhitungan kadar senyawa organik awal sampel A1B1C1: y = 0.001x + 0.064
y = absorbansi sampel x = kadar senyawa organik faktor pengenceran = 10 x = − .
. x faktor pengenceran
= . − .
. x 10
= 1100 ppm
Konsumsi senyawa organik = kadar gula total awal – kadar gula total akhir
= 1100 – 560
38
Lampiran 14 Hasil produksi biohidrogen melalui foto fermentasi dengan berbagai sumber substrat pada beberapa literatur (Anam 2012)
Substrat Bakteri Konsentrasi Hidrogen Referensi
Glukosa R. marinum
A-R. marinum 6264 ppm sumber C
0.86 l/l kultur Anam 2012
Limbah cair industri kecap
R. marinum 16200 ppm sumber C
1.33 l/l kultur Anam 2012
Limbah cair industri pempek
R. marinum 3222 ppm sumber C
0.19 l/l kultur Reko 2014
Senyawa hasil samping biodiesel
R. marinum 4367 ppm sumber C
1.23 l/l kultur Hasil
39
RIWAYAT HIDUP
Penulis dilahirkan di Malang pada tanggal 14 Maret 1993 dari ayah bernama Aji Junaidah dan ibu bernama Susianah. Penulis merupakan anak kedua dari dua bersaudara. Tahun 2011 penulis menyelesaikan pendidikan menengah atas di Madrasah Aliyah Negeri 3 Kota Malang dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur SNMPTN Tulis dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.