APLIKASI KITOSAN UNTUK MENCEGAH
KONTAMINASI AFLATOKSIN B1 PADA KACANG TANAH
(Arachis hypogaea L.) SAAT PENYIMPANAN SUHU RUANG
NUR HIDAYAH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aplikasi Kitosan untuk Mencegah Kontaminasi Aflatoksin B1 pada Kacang Tanah (Arachis hypogaea L.) saat Penyimpanan Suhu Ruang adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
iii
ABSTRAK
NUR HIDAYAH. Aplikasi Kitosan untuk Mencegah Kontaminasi Aflatoksin B1 pada Kacang Tanah (Arachis hypogaea L.) saat Penyimpanan Suhu Ruang. Dibimbing oleh PIPIH SUPTIJAH dan KUSTIARIYAH TARMAN.
Kitosan merupakan polimer kationik yang tidak beracun dan biodegradabel serta memiliki potensi sebagai zat antifungi sehingga mampu menghambat pertumbuhan kapang. Kemampuan kitosan sebagai antifungi dapat dimanfaatkan dalam penyimpanan kacang tanah (Arachis hypogaea L.) sebagai penghambat pertumbuhan kapang yang dapat menghasilkan mikotoksin. Kapang jenis Aspergillus flavus dan A. parasiticus merupakan penghasil aflatoksin yang sangat berbahaya. Dampak dari aflatoksin yaitu dapat menimbulkan penyakit pada hati seperti kanker, sirosis dan hepatitis. Tujuan penelitian ini adalah menentukan konsentrasi kitosan yang tepat untuk mencegah kontaminasi aflatoksin B1 dan menentukan komposisi kimia kacang tanah. Metode penentuan kadar aflatoksin B1 yang digunakan adalah ELISA (Enzyme-Linked Immunosorbent Assay). Perlakuan yang dilakukan pada penelitian ini adalah penambahan kitosan dengan konsentrasi yang berbeda, yaitu 0%, 0,1% dan 1% dan dilakukan pengujian tiga kali yaitu pada hari ke-0, hari ke-15 dan hari ke-30. Kandungan aflatoksin B1 terendah didapat pada perlakuan perendaman kitosan 1% pada hari ke-30 yaitu kurang dari batas limit pengukuran ELISA (<0,3 ppb) dan memiliki kadar air 9,30%. Komposisi kimia yang didapatkan adalah kadar air sebesar 9,30%; abu 2,46%; protein 25,64%; lemak 39,41%; serat kasar 6,58% dan karbohidrat 16,62%.
Kata kunci: Aflatoksin, Arachis hypogaea, Aspergillus flavus, kitosan
ABSTRACT
NUR HIDAYAH. The Application of chitosan to prevent aflatoxin B1 contaminant on the peanut (Arachis hypogaea L.) during storage at room temperature. Supervised by PIPIH SUPTIJAH and KUSTIARIYAH TARMAN. Chitosan is non-toxic cationic polymer, biodegradable and has potential as antifungal agent to inhibit the growth of fungi. Chitosan as antifungal can be used in the storage of peanuts (Arachis hypogaea L.) as barrier to inhibit the
growth of fungi that can produce mycotoxin. Aspergillus flavus and A. parasiticus produce aflatoxin. Aflatoxin cause liver disease such as cancer,
v
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
vii
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
APLIKASI KITOSAN UNTUK MENCEGAH
KONTAMINASI AFLATOKSIN B1 PADA KACANG TANAH
(Arachis hypogaea L.) SAAT PENYIMPANAN SUHU RUANG
NUR HIDAYAH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
xi
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi yang berjudul “Aplikasi kitosan
untuk mencegah kontaminasi Aflatoksin B1 pada Kacang Tanah (Arachis hypogaea L.) saat Penyimpanan Suhu Ruang” ini berhasil diselesaikan
dengan baik.
Penulis mengucapkan terima kasih kepada semua pihak yang sudah membantu dan memberikan dukungan selama penulisan skripsi ini, terutama kepada:
6 Staf dosen dan Administrasi Departemen Teknologi Hasil Perairan. 7 Staf Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil
Perairan.
8 Staf Laboratorium Balai Penelitian Bioteknologi Perkebunan Indonesia. 9 Kementerian Agama Republik Indonesia yang telah memberikan beasiswa
selama penulis menempuh studi di IPB.
10 Bapak dan Ibu tercinta yang selalu memberikan doa, semangat dan kasih sayangnya. Kepada Kakak Suyanto, Kak Sri dan keponakanku Rani dan Ringgo yang telah memberikan semangat dan dukungannya kepada penulis.
11 Eling Purwanto, terima kasih untuk semangat, kesabaran dan motivasinya. 12 Teman seperjuangan Dewi Ulfa dan Zulfi, terima kasih atas semangat dan
dukungannya.
13 Keluarga besar CSS MoRA IPB, khususnya CSS 47 cie cie, terima kasih atas semangat, kebersamaan dan kekeluargaan kita selama ini.
14 Keluarga besar THP, khususnya THP 47 Smart and Strong, terima kasih atas semangat dan kebersamaan kita selama ini.
15 Seluruh pihak yang telah banyak membantu dan memberikan dukungan, yang tidak bisa disebutkan satu per satu.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis memohon maaf apabila terdapat kesalahan penulisan. Semoga skripsi ini bermanfaat.
i
DAFTAR ISI
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 3
Latar Belakang ... 3
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 3
Waktu dan Tempat Penelitian ... 3
Bahan dan Alat ... 3
Prosedur Penelitian ... 3
Preparasi Sampel ... 4
Pembuatan Larutan Kitosan ... 5
Pengamatan Kapang ... 5
Prosedur Analisis ... 5
Analisis Proksimat ... 5
Analisis ELISA (Rachmawati et al. 2004) ... 7
Analisis Data ... 9
HASIL DAN PEMBAHASAN ... 9
Kadar Aflatoksin B1 Kacang Tanah (A. hypogaea L.) ... 10
Komposisi Kimia Kacang Tanah (A. hypogaea) ... 15
KESIMPULAN DAN SARAN ... 16
Kesimpulan ... 16
Saran ... 16
DAFTAR PUSTAKA ... 16
LAMPIRAN ... 20
DAFTAR TABEL
1 Kadar aflatoksin B1 kacang tanah (A. hypogaea L.) ... 10
2 Hasil pengamatan kapang pada kacang tanah setelah penyimpanan 30 hari ... 13
3 Kadar air kacang tanah (A. hypogaea L.) ... 13
4 Komposisi kimia kacang tanah (A. hypogaea L.) ... 15
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian ... 42 Kenampakan kacang tanah, (A, A') perlakuan tanpa kitosan; (B, B') penambahan kitosan 0,1% dan (C, C') penambahan kitosan 1% yang terinfeksi kapangsetelah penyimpanan 30 hari ... 12
3 Miselia yang tumbuh pada( ) polong kacang tanah ( ) biji kacang tanah 12 4 Genus Aspergillus (A) hifa bersekat perbesaran 100 x, (B) bentuk konidia perbesaran 400 x) ... 14
DAFTAR LAMPIRAN
1 Kitosan ... 212 Preparasi sampel ... 21
3 Contoh perhitungan proksimat ... 21
4 Mikroplat ELISA ... 21
5 Kurva kalibrasi standar AFB1 ... 23
iii
PENDAHULUAN
Latar Belakang
Kitosan merupakan polimer kationik yang memiliki 2000-3000 monomer bersifat biodegradabel dan tidak toksik dengan LD50=16 g/kg BB serta memiliki BM sekitar 88 kD (Suptijah 2006). Kitosan dapat diproduksi dengan memanfaatkan limbah Crustacea seperti kulit udang dan cangkang rajungan yang jumlahnya cukup melimpah di Indonesia. Kitosan telah banyak dimanfaatkan dalam berbagai bidang salah satunya adalah untuk menangani masalah pertanian. Sethulekshmi (2014) menjelaskan bahwa penggunaan zat bioaktif seperti kitosan berguna untuk mengontrol penyakit yang disebabkan kapang saat pasca panen saat ini telah menarik banyak perhatian menyangkut masalah peningkatan jumlah fungisida patogen pasca panen. Hasil berbagai studi menunjukkan bahwa pelapisan buah dan sayuran dengan kitosan atau turunannya berguna dalam penyimpanan sehingga buah dan sayuran dapat disimpan lebih lama. Menurut Simpson et al. (1997), interaksi antara kitosan dengan kapang patogen menunjukkan bahwa kitosan dapat menahan pertumbuhan kapang dengan cara mengikat DNA inangnya dan merusak membran biologisnya sehingga kitosan dapat dijadikan agen antifungi yang potensial.
Kacang tanah (Arachis hypogaea L.) merupakan salah satu tanaman palawija yang mempunyai banyak kegunaan yaitu sebagai bahan makanan, bahan baku industri dan pakan ternak. Kacang tanah sebagai bahan pangan memegang peranan penting dalam memenuhi kebutuhan protein dan lemak nabati yang bermanfaat untuk perbaikan gizi. Berdasarkan data BPS tahun 2013, produksi kacang tanah di Indonesia mencapai 701.680 ton. Produksi kacang tanah pada tahun 2013 ini mengalami penurunan dibandingkan pada tahun 2012 yang mencapai 712.857 ton. Penurunan produksi kacang tanah ini disebabkan adanya penurunan luas panen dari 559.538 ha pada tahun 2012 menjadi 519.056 ha pada tahun 2013.
2
Aflatoksin ini dapat menyebabkan penyakit hati diantaranya kanker, sirosis, hepatitis dan penyakit kuning pada manusia dan hewan (FSAI 2009).
Menurut Avivi (2005), petani dan pedagang kacang tanah di Indonesia masih belum memperhatikan penanganan pascapanen dengan baik. Petani di Indonesia pada umumnya mengeringkan kacang tanah di bawah sinar matahari. Setelah itu kacang tanah disimpan pada suhu ruang selama berhari-hari bahkan berminggu-minggu hingga sampai ke tangan konsumen, sehingga tidak menutup kemungkinan kapang A. flavus dapat tumbuh dan menghasilkan aflatoksin. Penanganan yang kurang baik saat pendistribusian juga akan meningkatkan pertumbuhan kapang pada kacang tanah. Oleh karena itu perlu dilakukan upaya peningkatan penanganan pascapanen yang mudah diaplikasikan oleh petani maupun pedagang di Indonesia agar dapat menekan pertumbuhan kapang patogen penghasil aflatoksin B1. Pengaplikasian kitosan yang berpotensi sebagai antifungi diharapkan dapat menekan pertumbuhan kapang A. flavus sehingga produksi aflatoksin oleh kapang ini pun dapat dihambat.
Perumusan Masalah
Infeksi Aspergillus flavus pada kacang tanah akan menghasilkan toksin yang disebut aflatoksin. Aflatoksin B1 memiliki dampak bahaya pada kesehatan manusia dan hewan yaitu penyakit hati diantaranya kanker, sirosis, hepatitis dan penyakit kuning. Kontaminasi aflatoksin B1 pada kacang tanah yang terkonsumsi oleh manusia maupun hewan tidak dapat dihilangkan sehingga perlu adanya solusi pencegahan terhadap ancaman bahaya aflatoksin B1 sedangkan upaya pencegahan yang banyak dilakukan saat ini masih kurang efektif untuk mencegah terjadinya kontaminasi aflatoksin pada kacang tanah.
Tujuan Penelitian
Tujuan penelitian ini adalah menentukan konsentrasi kitosan yang tepat untuk mencegah kontaminasi aflatoksin B1 dan menentukan komposisi kimia kacang tanah setelah penyimpanan dengan penambahan kitosan.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai aplikasi kitosan sebagai anti kapang sehingga dapat digunakan untuk mencegah kontaminasi aflatoksin B1 khususnya pada kacang tanah. Penelitian ini juga diharapkan dapat memberikan informasi mengenai konsentrasi yang baik untuk pencegahan kontaminasi aflatoksin B1 pada kacang tanah.
Ruang Lingkup Penelitian
3
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai Juni 2014 hingga September 2014. Pengambilan sampel dilakukan di pasar tradisional Dramaga, Bogor. Analisis proksimat (kadar air, abu, protein, lemak dan serat kasar) dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, pengamatan kapang dengan mikroskop di Laboratorium Biologi Mikro, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Analisis kandungan aflatoksin B1 dilakukan di Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Bahan dan Alat
Bahan utama yang digunakan pada penelitian ini adalah kacang tanah (A. hypogaea L.) sebanyak 10 kg yang diperoleh dari pasar tradisional Dramaga, Bogor kemudian dicuci menggunakan air dan dikeringkan dibawah sinar matahari selama ± 8 jam. Kitosan serbuk yang diperoleh dari Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dengan derajat deasetilasi 86% (Lampiran 1). Bahan lain yang digunakan adalah asam asetat 1%, bahan untuk analisis proksimat dan analisis kandungan aflatoksin B1 dengan metode ELISA meliputi akuades, larutan H2SO4 pekat, NaOH, H3BO3 2%, larutan HCl, pelarut lemak (n-heksana), selenium, alkohol, metanol 60%, standar AFB1, enzim konjugat (AFB1-HRPO), antibodi IgG kelinci, stop solution (H2SO4) dan substrat warna (tetrametilbenzidin/DMSO dan buffer asetat).
Alat-alat yang digunakan pada penelitian ini adalah desikator, tabung Soxhlet, labu Kjeldahl, destilator, mikroskop, mikroplat ELISA dan ELISA reader (λ 450 nm; limit deteksi 0,3 ppb).
Prosedur Penelitian
4
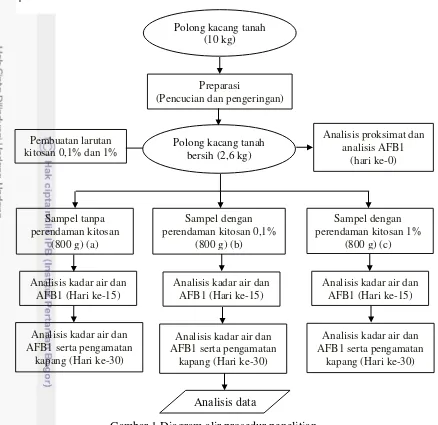
Gambar 1 Diagram alir prosedur penelitian Preparasi Sampel
Sampel polong kacang tanah sebanyak 10 kg dibersihkan dari tanah, dicuci dan dikeringkan di bawah sinar matahari selama ± 8 jam (Lampiran 2). Sampel polong kacang tanah bersih yang didapatkan yaitu 2,6 kg. Sampel diambil untuk analisis proksimat dan kadar AFB1 sebanyak 200 g (hari ke-0). Sisa sampel sebanyak 2,4 kg ditimbang, dibagi menjadi 3 masing-masing 800 g yaitu sampel (a), (b) dan (c). Perlakuan yang digunakan yaitu (a) sampel kontrol (tidak dilakukan perendaman, (b) sampel direndam dalam larutan kitosan 0,1% dan (c) sampel direndam dalam larutan kitosan 1%. Perendaman dilakukan dengan memasukkan sampel polong kacang tanah sebanyak (a) 800 g ke dalam wadah berisi 1 L larutan kitosan dengan konsentrasi 0,1% dan (b) sebanyak 800 g ke dalam wadah berisi larutan kitosan 1%, masing-masing sampel diaduk dengan tangan menggunakan sarung tangan plastik hingga rata dan tidak ada polong kacang tanah yang belum terkena larutan kitosan, proses dilakukan selama 5 menit. Masing-masing sampel kemudian ditiriskan dan dikeringkan di bawah sinar matahari selama ± 8 jam. Sampel polong kacang tanah (a), (b) dan (c) kemudian disimpan pada wadah terbuka selama 30 hari. Hari ke-15, beberapa sampel polong kacang tanah dikupas
5 hingga didapatkan 100 g sampel biji kacang tanah untuk analisis kadar AFB1 dan 5 g sampel biji kacang tanah untuk analisis kadar air dari masing-masing sampel (a), (b) dan (c). Hari ke-30, beberapa sampel polong kacang tanah dikupas hingga didapatkan 100 g sampel biji kacang tanah untuk analisis kadar AFB1 dan 5 g sampel biji kacang tanah untuk analisis kadar air dari masing-masing sampel (a), (b) dan (c). Sampel yang memiliki kadar AFB1 paling rendah diambil sebanyak 20 g untuk dilakukan analisis proksimat. Selanjutnya pengamatan kapang secara visual dan mikroskopis dilakukan pada masing-masing sampel (a), (b) dan (c). Pembuatan Larutan Kitosan
Konsentrasi larutan kitosan yang digunakan adalah 0,1% dan 1%. Setiap 1 g kitosan dilarutkan dengan 20 mL asam asetat 1% (tepat jenuh). Larutan kitosan 0,1% dibuat dengan melarutkan 1 g kitosan dengan 20 mL asam asetat 1% dan larutan kitosan 1% dibuat dengan melarutkan 10 g kitosan dengan 200 mL asam asetat 1%. Kemudian masing-masing larutan dihomogenisasikan menggunakan magnetic stirer (350 rpm) selama 1 jam. Setelah itu, masing-masing ditambahkan akuades hingga 1000 mL. Larutan kitosan yang telah terbentuk baik diindikasikan dengan warna bening kekuningan dan tidak adanya lagi serbuk kitosan yang tertinggal (No dan Meyers 1995).
Pengamatan Kapang
Sampel polong kacang tanah (a), (b) dan (c) disiapkan masing-masing sebanyak 150(*) buah. Masing-mansing dari perlakuan diamati secara visual dan dihitung jumlah polong kacang tanah yang ditumbuhi miselia. Setelah itu diambil 30 buah polong sampel polong kacang tanah (jumlah sampel yang ditumbuhi miselia + sampel dari 150 buah polong sampel awal(*)). Sampel polong kacang tanah sebanyak 30 buah ini kemudian dikupas dan diamati secara visual biji kacang tanah yang ditumbuhi miselia kapang. Sampel polong kacang tanah dan biji kacang tanah yang ditumbuhi miselia kapang kemudian diamati secara mikroskopis. Pengamatan mikroskopis dilakukan dengan mengambil inokulum dari sampel menggunakan jarum ose dan diletakkan pada kaca preparat kemudian ditutup menggukan kaca penutup. Setelah itu diamati di bawah mikroskop dengan perbesaran 400 kali kemudian difoto.
Prosedur Analisis Analisis Proksimat
Analisis proksimat adalah suatu analisis yang dilakukan dengan tujuan mengetahui komposisi kimia suatu bahan, antara lain kadar air, abu, protein, lemak dan serat kasar.
Analisis kadar air (AOAC 2005)
6
suhu 105°C selama 6 jam. Cawan tersebut dimasukkan ke dalam desikator ± 30 menit dan dibiarkan sampai dingin dan ditimbang. Kadar air ditentukan dengan
rumus sebagai berikut. (Lampiran 3):
Kadar air % =B − A x B − C %
Keterangan : A = Berat cawan kosong (g)
B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel yang sudah dikeringkan (g) Analisis kadar abu (AOAC 2005)
Tahap awal analisis kadar abu yaitu pengeringan cawan pengabuan di dalam oven pada suhu 105°C selama 30 menit, kemudian cawan dimasukkan ke dalam desikator selama 15 menit dan ditimbang hingga didapatkan berat konstan. Kemudian sampel sebanyak 5 g dimasukkan ke dalam cawan pengabuan dibakar sampai tidak berasap, kemudian dimasukkan ke dalam tanur pengabuan dengan suhu 600°C selama 6 jam, kemudian dimasukkan ke dalam desikator dan ditimbang hingga didapatkan berat konstan. Kadar abu ditentukan dengan rumus sebagai berikut. (Lampiran 3):
Kadar abu % = C − A
B − A x %
Keterangan: A = Berat cawan pengabuan kosong (g) B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel setelah ditanur (g) Analisis kadar protein (AOAC 2005)
Tahapan yang dilakukan dalam analisis kadar protein terbagi menjadi tiga tahap yaitu destruksi, destilasi, dan titrasi. Pertama tahap destruksi dilakukan dengan memasukkan sampel sebanyak 0,25 g kedalam labu Kjeldahl 100 mL, ditambahkan 0,25 g selenium dan 3 mL H2SO4 pekat. Kemudian dilakukan destruksi pada suhu 410°C selama ± 1 jam sampai larutan terlihat jernih kemudian didinginkan. Tahap selanjutnya yaitu destilasi, larutan yang telah dingin ditambahkan akuades sebanyak 50 mL dan NaOH 40% sebanyak 20 mL kemudian didestilasi dalam destilator 100°C. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran H3BO3 2% sebanyak 25 mL dan 2 tetes indikator Brom Cresol GreenMethyl Red dan hasil destilat berwarna hijau kebiruan. Tahap terakhir yaitu titrasi dilakukan dengan menggunakan HCl 0,1 N sampai larutan berubah warna menjadi merah muda. Volume titran dibaca dan dicatat. Kadar protein ditentukan dengan rumus sebagai berikut. (Lampiran 3):
N % = mL HCl − mL blanko x N HCl x ,mg sampel x %
Kadar protein (%) = % nitrogen x faktor konversi
7
Analisis kadar lemak (AOAC 2005)
Sampel sebanyak 5 g (W1) dimasukkan ke dalam kertas saring dan dimasukkan ke dalam selongsong lemak, sampel yang telah dibungkus kemudian dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak hexana 150 mL, setelah itu dilakukan ekstraksi selama 6 jam. Labu lemak yang berisi larutan lemak di masukkan ke dalam destilator untuk didestilasi hingga semua pelarut lemak menguap. Saat destilasi berlangsung pelarut akan tertampung di ruang ekstraktor, pelarut ini dikeluarkan sehingga tidak kembali ke dalam labu lemak. Selanjutnya labu lemak dikeringkan dalam oven dengan suhu 100°C selama 1 jam, kemudian labu didinginkan dalam desikator hingga peratnya konstan (W3). Kadar lemak ditentukan dengan rumus sebagai berikut. (Lampiran 3):
Kadar lemak % =W − WW x %
Keterangan: W1 = Berat sampel (g)
W2 = Berat labu lemak kosong (g)
W3 = Berat labu lemak dengan lemak setelah dioven (g) Analisis kadar serat kasar (AOAC 2005)
Sampel sebanyak 1 g dilarutkan dalam 100 mL H2SO4 1,25%, kemudian dipanaskan hingga mendidih, selanjutnya dilakukan destruksi selama 30 menit. Filtrat disaring kemudian residu hasil saringan di dibilas dengan 20-30 mL air 30 menit dan dinginkan lalu ditimbang kembali (Wˈ). Kadar serat kasar ditentukan
dengan perhitungan sebagai berikut. (Lampiran 3):
Serat kasar % = W − W′
Bobot sampel x %
Keterangan: W = Bobot setelah dioven (g) W'= Bobot setelah ditanur (g) Analisis ELISA ( Rachmawati et al. 2004)
Analisis ELISA dilakukan untuk mengetahui kontaminasi aflatoksin B1 pada sampel kacang tanah. Analisis ELISA dilakukan di Balai Penelitian Bioteknologi Perkebunan Indonesia - Bogor, dengan limit 0,3 ppb dan panjang gelombang 450 nm.
8
pencampuran dilakukan menggunakan Shaker selama 30 menit. Setelah itu sentrifuse (3000 rpm) selama 15 menit. Larutan yang jernih diambil sebagai bahan analisis secara ELISA. Mikroplat ELISA, baik plat pencampur maupun plat berlapis antibodi tgerdiri atas lubang-lubang (sumur), sumur ke bawah mulai dari A sampai H, ke samping mulai dari No 1 sampai 12, sehingga jumlahnya 96 lubang (Lampiran 4 ).
Tahapan cara kerja metode ELISA:
(a) Pencampuran larutan standar AFB1 dengan konjugat AFB1-HRPO dan ekstrak sampel dengan konjugat AFB1-HRPO.
(b) Larutan standar 0 AFB1 sebanyak 100 µL dimasukkan ke dalam sumur deret A1 (untuk blanko) dan 100 µL pada sumur H1 (untuk kontrol). Selanjutnya dimasukkan standar AFB1 mulai dari konsentrasi terkecil agar dapat menggunakan pipet tip yang sama. Larutan standar 1 (30 ppb) dipipet 100 µL ke dalam sumur deret B1
(d) Ekstrak sampel biji kacang tanah sampel 1 dipipet sebanyak 100 µL kemudian dimasukkan ke dalam sumur A2, selanjutnya ekstrak sampel 2 ke dalam sumur B2, dan seterusnya. Pipet tip diganti untuk setiap sampel.
(e) Larutan konjugat AFB1 HRPO sebanyak 100 µL ditambahkan ke dalam deret sumur 1 (B-H), kecuali sumur A1 (untuk blanko, standar AFB1 0 ppb tidak ditambah konjugat), dan ke dalam sumur yang yang berisi ekstrak sampel (A2 sampai H2, A3 sampai H3, dan seterusnya). Sebanyak 100 µL standar AFB1 ditambahkan lagi ke dalam sumur A1.
(f) Kemudian dilakukan pencampuran standar AFB1 dengan konjugat dan ekstrak sampel dengan konjugat menggunakan multichannel pipet, dipipet dan dikeluarkan kembali dalam sumur yang sama sebanyak 5 kali, kemudian dipindahkan sebanyak 75 µL larutan yang telah dicampur dalam plat pencampuran ke dalam plat yang sudah dilapisi antibodi sumur A1 sampai H1, dilakukan 2 kali untuk duplikasinya (A2 sampai H2).
(g) 75 µL larutan ekstrak sampel (A2-H2) yang telah dicampur dengan konjugat dimasukkan ke dalam plat pencampuran kemudian dimasukkan ke dalam sumur yang sudah dilapisi antibodi A3 sampai H3, dilakukan duplikasi (A4-H4), dan seterusnya. Setelah selesai kemudian diinkubasi dan biarkan selama 5 menit.
(h) Larutan dibuang dan plat dicucisebanyak 3 kali menggunakan akuades. (i) Masukkan ke dalam sumur yang telah dicuci larutan (warna) substrat A
9 (j)Kemudian tambahkan 50 µL stop solution, warna larutan pada mikroplat berubah menjadi kuning. Larutan dengan warna yang terbentuk di baca pada ELISA reader (λ 450 nm)
Pembacaan mikroplat pada ELISA reader diperoleh nilai absorbansi warna untuk masing-masing sumur (blanko standar, standar dan sampel). Selanjutnya nilai inhibisi standar AFB1 dan sampel dihitung dengan rumus (Lampiran 6):
Inhibisi Standar AFB % = −Abs Standar − Abs blankoAbs kontrol − Abs blanko × %
Inhibisi Sampel % = −Abs kontrol − Abs blanko ×Abs Sampel − Abs blanko %
ppb AFB =bobot sampelx × fp
Keterangan: x = hasil perhitungan dari kurva kalibrasi standar (Lampiran 5) faktor pengenceran = 2000
Analisis Data
Analisis data pada penelitian ini dilakukan secara deskriptif.
HASIL DAN PEMBAHASAN
Karakteristik Kitosan
10
Kadar Aflatoksin B1 Kacang Tanah (Arachis hypogaea L.)
Mikotoksin merupakan senyawa hasil metabolisme sekunder dari kapang tertentu yang dapat menyebabkan gangguan kesehatan bagi manusia maupun hewan (Fardiaz 1989). Mikotoksin dihasilkan sebagai metabolit sekunder kapang selama penyimpanan, namun mikotoksin juga dapat mengontaminasi bahan sebelum panen (pre-harvest contamination) maupun setelah panen (post-harvest contamination). Indonesia merupakan negara tropis dengan kelembaban yang tinggi sehingga sangat ideal untuk pertumbuhan kapang, terutama kapang penghasil toksin.
Kapang jenis A. flavus dan A. parasiticus diketahui mampu menghasilkan
mikotoksin jenis aflatoksin. Namun yang paling banyak dan dominan adalah A. flavus. Kacang tanah dapat menjadi substrat yang baik bagi kapang toksigenik
yang menghasilkan mikotoksin. Kapang toksigenik yang umum menginfeksi kacang tanah adalah A. flavus dan A. parasiticus (Kasno 2004). Aflatoksin yang dihasilkan oleh kapang toksigenik tersebut adalah B1, B2, G1 dan G2, namun dari semua jenis aflatoksin ini aflatoksin B1 merupakan yang paling patogen karena bersifat karsinogenik, hepatotoksik dan mutagenik bagi manusia, mamalia dan unggas. Dampak buruk dari gangguan akut oleh aflatoksin adalah kanker hati yang tidak jarang berujung pada kematian (Mehan 1989).
A. flavus biasanya tumbuh dan hidup sebagai saprofit atau disebut juga miselia saprofit di dalam tanah yang didukung dengan adanya sisa-sisa tanaman dan hewan. Miselium atau hifa kapang merupakan struktur yang cukup dominan ditemukan dalam tanah. Ketika A. flavus masih muda dan tumbuh, miselium membentuk banyak konidiofor. Konidiofor tumbuh secara tunggal dari badan hifa. Konidiofor yang matang akan membentuk konidia pada ujungnya. Konidia memiliki bentuk bulat dan unisel dengan dinding yang kasar (Sulfiah 2012).
Kacang tanah berpotensi terserang kapang A. flavus bahkan sebelum masa panen dan akan berlangsung hingga kacang tanah dipanen dan disimpan. Analisis kadar aflatoksin B1 pada kacang tanah dilakukan menggunakan metode ELISA. Hasil analisis menunjukkan kadar aflatoksin B1 yang disajikan pada Tabel 1.
Tabel 1 Kadar aflatoksin B1 kacang tanah (A. hypogaea L.)
Perlakuan Aflatoksin B1 (ppb)
Hari ke -0 Hari ke -15 Hari ke -30 Tanpa Kitosan 79,15 ± 4,59 43,71 ± 1,08 29,28 ± 0,78 Penambahan Kitosan 0,1% 20,06 ± 1,56 24,56 ± 0,69
Penambahan Kitosan 1% 35,53 ± 0,96 ttd*
Keterangan: *tidak terdeteksi (<batas limit ELISA=0,3 ppb)
11 terendah yaitu dibawah limit deteksi ELISA (<0,3 ppb), tetapi pada sampel dengan penambahan kitosan 0,1% memiliki kadar aflatoksin B1 yang cenderung meningkat. Munurut Cuero et al. (1988), konsentrasi kitosan sebesar 0,12 dan 0,25% mengurangi pertumbuhan kapang A. flavus dan produksi aflatoksinnya. Peningkatan kadar aflatoksin pada konsentrasi kitosan tertentu terjadi karena adanya percepatan perubahan fase pada kapang yaitu dari fase aktif ke fase stasioner. Fase aktif yaitu pada mulainya sel-sel membelah, sedangkan fase stasioner yaitu fase jumlah sel yang bertambah dan jumlah sel yang mati relatif seimbang. Menurut Doyle dan Marth (1979), jenis mikrooganisme seperti Rhizopus spp., Aspergillus niger dan Aspergillus terreus dapat mengubah aflatoksin B1 menjadi senyawa yang memiliki toksisitas lebih rendah daripada aflatoksin B1. Sugipriatini (2009) menambahkan penghambatan pertumbuhan kapang juga terjadi karena kemampuan kitosan sebagai antikapang. Dinding sel kapang umumnya tersusun atas lapisan peptidoglikan dan lipopolisakarida yang merupakan lemak dan protein, serta gugus asam amino dan glukosamin dalam kitosan bermuatan positif dapat berikatan dengan bagian makromolekul bermuatan negatif pada permukaan sel kapang, sehingga menyebabkan apresorium dan pertumbuhan kapang akan terhambat.
Tabel 1 juga menunjukkan adanya kadar aflatoksin B1 yang cenderung meningkat dari hari ke-15 hingga hari ke-30 yaitu pada perlakuan perendaman kitosan 0,1%. Peningkatan kadar Aflatoksin B1 diduga, kitosan 0,1% yang diberikan menghambat pertumbuhan mikroorganisme antagonis bagi kapang penghasil aflatoksin B1. Berkurangnya penghambat ini menyebabkan produksi aflatoksin B1 dapat meningkat kembali. Berdasarkan Dharmaputra (2003) pada penelitiannya, terjadi interaksi hambatan tipe B dan D (B: interaksi saling hambat antara kapang toksigenik A. flavus dan A. niger secara kontak langsung atau pada jarak < 2 mm; D interaksi saling hambat terjadi pada jarak >2 mm) pada media PDA, MEA 1%, SMKYA dan MEA 1% + SMKYA dan diasumsikan bahwa A. niger. Persentase hambatan pada pertumbuhan miselia oleh A. niger mencapai 44,01% pada media SMKY.
Batas maksimum kandungan aflatoksin B1 pada kacang tanah di Indonesia adalah 15 ppb (BSN 2009). Berdasarkan hasil pada Tabel 1, semua sampel kacang tanah memiliki kadar aflatoksin B1>15 ppb kecuali pada sampel dengan perlakuan perendaman kitosan 1% dan disimpan selama 30 hari. Menurut
Dharmaputra et al. (2010) berdasarkan penelitiannya, frekuensi kacang tanah
terkontaminasi aflatoksin B1>15 ppb yang telah terinfeksi oleh A. flavus yaitu
± 20% dari 240 sampel. Menurut Ramisz (2005) kitosan yang dilarutkan dalam asam asetat dapat menjadi penghambat bakteri dan kapang. Usaha penghilangan toksin seperti pemanasan hanya dapat membunuh kapang, sedangkan aflatoksin
tidak mudah terurai oleh panas karena memiliki titik leleh yang tinggi. Hastuti (2010) menyatakan bahwa titik lebur aflatoksin B1 terjadi pada suhu yang
sangat tinggi yaitu 269°C-271°C.
12
menjelaskan bahwa terjadi aktivitas fungistatis oleh kitosan pada sampel apel yang disimpan selama 10 hari pada suhu 25°C dengan reduksi kontaminan kapang hingga 40%.
Pertumbuhan kapang ditandai dengan adanya miselia atau benang-benang yang menyelimuti substrat. Miselia ini berwarna putih keabuan hingga kehijauan. Pertumbuhan kapang yang semakin banyak didukung oleh suhu dan kelembaban yang optimal, saat sebelum panen maupun setelah dilakukan pemanenan (penyimpanan). Kenampakan miselia pada polong kacang tanah dapat dilihat pada Gambar 2.
Gambar 2 Kenampakan kacang tanah, (A, A') perlakuan tanpa kitosan; (B, B') penambahan kitosan 0,1% dan (C, C') penambahan kitosan 1% yang terinfeksi kapangsetelah penyimpanan 30 hari
Gambar 2 memperlihatkan kenampakan kacang tanah setelah diberikan perlakuan perendaman kitosan (0%; 0,1% dan 1%) dan disimpan selama 30 hari. Sampel diamati secara visual dan memperlihatkan adanya kapang yang tumbuh ditandai dengan adanya miselia pada ketiga perlakuan. Persentase hasil pengamatan dapat dilihat pada Gambar 3.
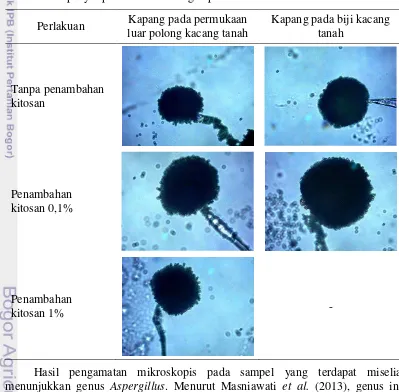
13 Gambar 3 menunjukkan bahwa pada perlakuan tanpa penambahan kitosan persentase polong yang ditumbuhi miselia yaitu 10% (15 polong dari 150 polong) dan sampel yang telah direndam kitosan 0,1% memiliki persentase lebih tinggi yaitu 10,67% (16 polong dari 150 polong), sedangkan miselia yang tumbuh pada sampel dengan perendaman kitosan 1% memiliki persentase paling rendah yaitu 4,67% (7 polong dari 150 polong). Miselia yang juga tumbuh pada biji kacang tanah terdapat pada sampel dengan perlakuan tanpa penambahan kitosan yaitu 4,76% (3 biji dari 63 biji) dan sampel dengan perendaman kitosan 0,1% yaitu 2,94% (2 biji dari 68 biji), sedangkan pada sampel dengan perendaman kitosan 1% tidak terdapat adanya miselium yang tumbuh. Menurut Cuero et al. (1988), efek pada produksi aflatoksin dan pertumbuhan kapang toksigenik diduga disebabkan oleh kitosan yang merubah permeabilitas dinding sel kapang. Hasil pengamatan kapang menggunakan mikroskop dapat dilihat pada Tabel 2.
Tabel 2 Hasil pengamatan mikroskopis kapang pada kacang tanah setelah penyimpanan 30 hari dengan perbesaran 400 kali.
Perlakuan Kapang pada permukaan luar polong kacang tanah
Kapang pada biji kacang tanah
Tanpa penambahan kitosan
Penambahan kitosan 0,1%
Penambahan
kitosan 1% -
14
tumbuh pada ketiga sampel polong kacang tanah, sedangkan pada sampel biji kacang tanah miselia hanya terdapat pada sampel dengan perlakuan tanpa penambahan kitosan dan dengan penambahan kitosan 0,1%. Perlakuan penambahan kitosan 1% diduga dapat menghambat pertumbuhan kapang sehingga miselia tidak tumbuh pada biji kacang tanah.
Gambar 4 Genus Aspergillus (A) hifa bersekat perbesaran 100 kali, (B) bentuk konidia perbesaran 400 kali (Masniawati et al. 2013)
Pertumbuhan kapang dipengaruhi oleh beberapa faktor diantaranya kadar air sampel, suhu lingkungan, dan kelembaban serta kerusakan sampel. Menurut Kasno (2004), fase pengisian biji merupakan fase pertumbuhan yang sangat efektif terhadap cekaman suhu dan kekeringan. Faktor tersebut memicu pertumbuhan kapang lebih optimal. Suhu optimum perkembangan A. flavus berkisar 25,70ºC-31,30ºC dan kisaran suhu optimum tercapai bila tanaman mengalami cekaman kekeringan pada umur 4-6 minggu sebelum panen. Kontaminasi aflatoksin mulai terjadi pada suhu 26,30ºC, kandungan aflatoksin akan terus meningkat sejalan dengan peningkatan suhu hingga mencapai 31,20ºC. Kacang tanah di Indonesia memiliki peluang cukup besar untuk terinfeksi A. flavus dan kontaminasi aflatoksin karena kondisi penanaman kacang tanah pada lahan kering saat musim kemarau dengan suhu optimum untuk pertumbuhan kapang A. flavus. Faktor kerusakan sampel kacang tanah juga dapat meningkatkan pertumbuhan kapang. Kerusakan sampel disebabkan antara lain penanganan pasca panen yang kurang hati-hati serta pemanenan kacang tanah yang terlalu awal. Dharmaputra et al. (2013) menyatakan bahwa biji kacang tanah yang keriput disebabkan oleh panen yang terlalu awal, kadar air kacang tanah yang masih tinggi sehingga ketika dikeringkan bijinya menjadi keriput.
Pertumbuhan kapang A. flavus sangat dipengaruhi oleh kadar air bahan. Menurut Dharmaputra et al. (1989), laju infeksi A. flavus dan produksi aflatoksin sangat dipengaruhi oleh kadar air biji (kacang tanah). Analisis kadar air disajikan pada Tabel 3.
Tabel 3 Kadar air kacang tanah (A. hypogaea L.)
Perlakuan perendaman Kadar Air (%)
Hari ke -0 Hari ke -15 Hari ke -30 Tanpa Kitosan 48,45 ± 0,08 9,65 ± 0,15 9,08 ± 0,17
Penambahan Kitosan 0,1% 9,45 ± 0,10 9,29 ± 0,11
Penambahan Kitosan 1% 11,70 ± 0,09 9,30 ± 0,03
15 Hasil analisis kadar air pada Tabel 3 menunjukkan pada hari ke-0 kadar air sebesar 48,45%. Kadar air kacang tanah mengalami penurunan hingga hari ke-30 pada setiap perlakuan. Penurunan kadar air suatu bahan dipengaruhi oleh aktivitas penguapan air bahan pada saat pengeringan dan lamanya penyimpanan sampel. Dharmaputra et al. (1989) menyatakan, 80% sampel biji kacang tanah berkadar air 3,60-11% mengandung aflatoksin lebih dari 30 ppb. Tabel 1 menunjukkan adanya penurunan kadar aflatoksin B1 pada hari ke-30 hingga dibawah 30 ppb. Hal ini diduga pertumbuhan kapang A. flavus berhasil dihambat oleh adanya perlakuan perendaman kitosan 1% sehingga kadar aflatoksin B1 menurun.
Faktor lain yang dapat mempengaruhi pertumbuhan A. flavus adalah faktor lingkungan diantaranya suhu dan kelembaban. Aflatoksin dihasilkan secara optimum pada suhu 25-35° C dan hasil produksi bervariasi berdasarkan substrat. Aflatoksin tidak dapat dihasilkan pada suhu dibawah 12°C atau dihasilkan
aflatoksin namun jumlahnya sangat kecil terutama pada suhu 15°C (Syarief et al. 2003). Menurut Sudibyo (2003), kapang A. flavus dapat
memproduksi toksin pada suhu sekitar 12-42°C, tetapi kondisi optimalnya adalah pada suhu 28-30°C. Penyimpanan sampel pada penelitian ini dilakukan pada suhu 25,5-29,5ºC dan kelembaban ruangan sebesar 62-80%.
Komposisi Kimia Kacang Tanah (Arachis hypogaea L.)
Komposisi kacang tanah ditentukan dengan analisis proksimat. Analisis proksimat (kadar air, abu, protein, lemak, serat kasar dan karbohidrat) dilakukan pada kacang tanah dengan perlakuan perendaman kitosan 1%. Hasil analisis proksimat disajikan pada Tabel 3.
16
namun terjadi peningkatan pada kadar protein dari 22,45 menjadi 28,27%. Kadar air, protein dan lemak sampel kacang tanah setelah perlakuan masih cukup tinggi bila dibandingkan dengan kadar komposisi kimia kacang tanah berdasarkan Departemen Kesehatan RI (1996), yaitu kadar air 4%; protein 25,3% dan lemak 42,8%.
KESIMPULAN DAN SARAN
Kesimpulan
Kitosan memiliki potensi sebagai agen antifungi. Kadar aflatoksin B1 pada sampel kacang tanah menurun setelah direndam dengan kitosan dan disimpan selama 30 hari. Kadar aflatoksin B1 terendah terdapat pada perlakuan perendaman kitosan 1%, kadar aflatoksin B1 menurun pada penyimpanan sampel selama 30 hari dengan kadar aflatoksin B1 dibawah batas limit deteksi ELISA (<0,3 ppb). Kadar komposisi kimia kacang tanah menurun setelah penyimpanan 30 hari dan penambahan kitosan 1% kecuali protein yang meningkat dari 22,45% menjadi 28,27%.
Saran
Saran yang diajukan dari penelitian ini adalah perlu dilakukan peningkatan intensitas pengujian kadar aflatoksin B1 pada sampel sehingga dapat diketahui efektifitas waktu penurunan kadar aflatoksin B1 dengan kitosan sebagai agen antifungi.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis 18th ed. Arlington, Virginia, USA (US): The Association of Analytical Chemist Inc.
Assis OBG. 2008. The effect of chitosan as a fungistatic agent on cut apples. Rev. Iber. Tecnologia Postcosecha. 9(2):148-152
Avivi S. 2005. Pengaruh perlakuan sortasi, natrium hipoklorit dan fungisida pada kacang tanah untuk mengeliminasi kontaminasi Aspergillus flavus. Jurnal Hama dan Penyakit Tumbuhan Tropika. 5(1): 58-65
[BPS] Badan Pusat Statistik. 2013. Tabel luas panen produktivitas tanaman kacang tanah seluruh provinsi [Internet]. [diunduh 2014 september 10]. Tersedia pada: http://www.bps.go.id/tnmn_pgn.php
17 [BSN] Badan Standardisasi Nasional. 2009. SNI 7385:2009 Batas Maksimum
Kandungan Mikotoksin dalam Pangan. Jakarta (ID): BSN.
Cuero RG, Lillehoj EB, Cleveland TE, Reine AH. 1988. Chitosan as a control agent of toxigenic fungal growth and aflatoxin production. Proceeding of Japanese Association of Mycotoxicology, Supp. 1. IUPAC ‘88 and ICPP ’88. Mycotoxins and Phycotoxins.: 194-198.
Departemen Kesehatan Republik Indonesia. 1996. Daftar Komposisi Kimia Bahan Makanan. Jakarta (ID): Bhratara Karya Aksara.
Dharmaputra OS, Tjitrosomo HSS, Susilo H, Sulaswati. 1989. Aspergillus flavus and aflatoxin in peanut collected from three markets in Bogor, West Java, Indonesia. Proceeding of the Twelfth ASEAN Seminar on Grain Postharvest Technology in Surabaya. 111
Dharmaputra OS. 2003. Antagonistic effect of three fungal isolated to aflatoksin production^spergiY/HS/JavHS. Journal of Tropical Biology. 21:19-31. Dharmaputra OS, Retnowati I, Ambarwati S. 2003. Toxigenic Aspergillus flavus
in the soils of peanut farms in Wonogiri regency, Central Java.
Australian Centre for International Agriculture Research Project # PHT 97/017. Bogor (ID): Seameo Biotrop.
Dharmaputra OS, Retnowati I, Ambarwati S. 2010. Aspergillus flavus infection and aflatoxin contamination in peanuts stored at wholesales and retail levels in Bandung, Bogor and Jakarta (West Java, Indonesia). 10th International Working Conference on Stored Product Protection. Bogor (ID):Seameo Biotrop.
Dharmaputra OS, Ambarwati S, Retnowati I, Windyarani A. 2013. Kualitas fisik, populasi Aspergillus flavus, dan kandungan aflatoksin B1 pada biji kacang tanah merah. Jurnal Fitopatologi Indonesia. 9(4): 99-106.
Doyle MP, Marth EH. 1979. Peroxidase activity in mycelia of Aspergillus parasiticus that degradate aflatoxin. Journal of Apllied Microbology and Biotechnology. 7: 211-217.
Fardiaz S. 1989. Mikrobiologi Pangan. Bogor (ID): PAU IPB
[FSAI] Food Safety Authority of Ireland. 2009. Mycotoxins in food. Toxicology Factsheet Series. ISSUE No.1
Hastuti US. 2010. Pencemaran bahan makanan dan makanan hasil olahan oleh berbagai spesies kapang kontaminan serta dampaknya bagi kesehatan [Internet]. Malang (ID): Univerversitas Negeri Malang. [diunduh 2014 september 10]. Tersedia pada: http://library.um.ac.id/images/stories /pidatogurubesar/okt2010/Prof%20Utami%20Sri%20Hastuti%201.pdf Hirano S. 1989. Production and application of chitin and chitosan in Japan. Di
18
Kasno A. 2004. Pencegahan infeksi Aspergillus flavus dan kontaminasi aflatoksin pada kacang tanah. Jurnal Penelitian dan Pengembangan Pertanian. 23(3):75-79.
Khan TA, Peh KK, Hung SC. 2002. Reporting degree of deacetylation values of chitosan: the influence methods. Journal of Pharmacy and Pharmaceutical Student Centered Learning. 5(3):205-212.
Kurniasih M, Kartika D. 2009. Aktivitas antibakteri kitosan terhadap bakteri S. aureus. Jurnal Molekul. 4(1):1-5.
Masniawati A, Kuswinanti T, Gobel R B, Risnawaty R. 2013. Identifikasi cendawan terbawa pada benih padi lokal aromatik pulu mandoti, pulu pinjan, dan pare lambau asal Kabupaten Enrekang, Sulawesi Selatan. Jurnal Matematika dan Natural Sains Terevitalisasi. 1(1):51-59.
Majeti NV, Kummar R. 2000. A review of chitin and chitosan applications. Journal of Reactive and Functional Polymers. 48: 1-27.
Mehan VK. 1989. Screening groundnut for resistance to seed invasion by and to aflatoxin production. Di dalam Aspergillus flavusAflatoxin Contamination of Groundnut: Proceeding of the International Workshop 6-9 Oct 1987, ICRISAT Center, India (IN).
No HK, Meyers SP. 1995. Preparation and characterization of chitin and chitosan – a review. Journal of Aquatic Product Technology 4(2): 27-52.
Rachmawati S, Lee A, Murdiati TB, Kennedy I. 2004. Pengembangan enzyme linked immunosorbent assay (ELISA) teknik untuk analisis aflatoksin B1 pada pakan ternak. Di dalam: Sani Y, Darminto, Luckins, Kurniawan E, Laksono B editor. Seminar Parasitologi dan Toksikologi Veteriner. Prosiding Seminar Parasitologi dan Toksikologi Veteriner. 2004 April 20-21; Bogor (ID) : 143-159
Ramisz AB, Pajak AW, Pilarczyk B, Ramisz A, Laurans L. 2005. Antibacterian and antifungal activity of chitosan. International Congress on Animal Hygiene Vol 2. Poland (PL): Sea Fisheries Institute Gdynia.
Simpson BK, Gagne N, Ashie INA, Noroozi E. 1997. Utilization of Chitosan for Preservation of Raw Shrimp (Pandalus boreallis). Journal of Food Biotechnology. 7(1): 25-44
Sethulekshmi C. 2014. Chitin and its benefits. Journal of Advertising Research Bology Science. 1(6): 171-175. ISSN: 2348-8069.
Sudibyo A. 2003. Aflatoksin dalam produk pangan dan cara mengurangi kandungan racunnya. Warta Industri Hasil Pertanian. 20(1-2).
Sugipriatini D. 2009. Potensi penggunaan khamir dan kitosan untuk pengendalian busuk buah Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) pada buah mangga selama penyimpanan. [thesis]. Bogor (ID): Sekolah Pascasarjana. Institut Pertanian Bogor. Sulfiah. 2012. Aspergillus flavus. Makalah Mikologi. Surabaya (ID): Jurusan
19 Suptijah P. 2006. Deskripsi Karakterisasi Fungsional dan Aplikasi Kitin dan Kitosan. Di dalam Prosiding Seminar Nasional Kitin Kitosan. Bogor (ID): Departemen Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Syarief RL, Ega, Nurwitri CC. 2003. Mikotoksin Bahan Pangan. Bogor (ID): IPB Press.
20
21 Lampiran 1 Kitosan
Lampiran 2 Pencucian dan pengeringan kacang tanah
Lampiran 3 Contoh perhitungan proksimat kacang tanah (Arachis hypogaea) pada Penambahan kitosan 1% setelah penyimpanan 30 hari (ulangan 1).
a) Kadar Air
Kadar air % =B − A x B − C %
Keterangan : A = Berat cawan kosong (gram)
B = Berat cawan dengan sampel (gram) C = Berat cawan dengan sampel yang sudah dikeringkan (gram)
Kadar air % = , g − , g x , g − , g % = , %
Pencucian polong kacang tanah Penirisan setelah perendaman dalam kitosan
22
b) Kadar Abu
Kadar abu % =B − A x C − A %
Keterangan: A = Berat cawan pengabuan kosong (gram)
B = Berat cawan dengan sampel (gram)
C = Berat cawan dengan sampel setelah ditanur (gram)
Kadar abu % = , g − , g x , g − , g %
= , % c) Kadar Lemak
Kadar lemak % =W − WW x %
Keterangan: W1 = Berat sampel (gram)
W2 = Berat labu lemak kosong (gram)
W3 = Berat labu lemak dengan lemak setelah pengovenan (gram)
Kadar lemak % = , g − , g, g x %
= , % d) Kadar Protein
% N = mL HCl − mL blanko x N HCl x ,bobot sampel g x x , x %
Kadar protein % = % N x ,
% N = , mL − , mL x , x ., g x x , x %
= , %
Kadar protein % = , % x 6,25 = , % e) Kadar Serat Kasar
Bobot serat kasar = W- Wˈ
23
Keterangan: W = Bobot setelah dioven (gram) Wˈ= Bobot setelah ditanur (gram)
% serat kasar = , g x , g %
= , % Lampiran 4 mikroplat ELISA
Lampiran 5 Kurva kalibrasi standar
Lampiran 6 Contoh perhitungan kadar aflatoksin B1
% Inhibisi Standar
= −
A S −AA −A
×
%
% Inhibisi Standar
= −
, − ,, − ,
×
%
= 86,83%
% Inhibisi Sampel
= −
A S −AA −A
×
%
0 20 40 60 80 100 120
0 10 20 30 40
%
i
n
h
ib
isi
A
FB1
Standar AFB1
24
(Sampel hari ke-0 ulangan 1)
% Inhibisi Sampel
= −
, − ,, − ,
×
%
= 36, 98% Masukkan ke persamaan kalibrasi : Y = 16,528 ln(x) +37,85
36,98 = 16,528 ln(x) +37,85 36,98-37,85 = 16,528 ln(x)
ln(x) = − ,
,
ln(x) = -0,0526 x = 0,9487 ppb AFB1 = x ×
25
RIWAYAT HIDUP
Penulis dilahirkan di Bojonegoro, 10 Mei 1992. Penulis merupakan anak ketiga dari tiga bersaudara dari pasangan Bapak Sudjono (Alm) dan Ibu Watimah. Penulis memulai jenjang pendidikan formal di TK Mekar Sari, Mojosari, Kepohbaru, Bojonegoro (1996-1998). Kemudian penulis melanjutkan pendidikan di SDN Mojosari, Kepohbaru, Bojonegoro (1998-2004), selanjutnya penulis melanjutkan pendidikan di SMPN 2 Kepohbaru, Bojonegoro (2004-2007) dan menempuh pendidikan menengah atas di SMA Mazra’atul Ulum Paciran, Lamongan (2007-2010). Selanjutnya pada tahun 2010 penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur BUD PBSB (Program Beasiswa Santri Berprestasi).