EFEKTIVITAS AIR PERASAN BATANG PISANG AMBON SEBAGAI
IMUNOSTIMULAN TERHADAP INFEKSI
Aeromonas hydrophila
PADA IKAN LELE (
Clarias gariepinus
)
QORIE ASTRIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Efektivitas Air Perasan Batang Pisang Ambon sebagai Imunostimulan terhadap Infeksi Aeromonas hydrophila pada Ikan Lele (Clarias gariepinus)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Qorie Astria
RINGKASAN
QORIE ASTRIA. Efektivitas air perasan batang pisang ambon sebagai imunostimulan terhadap infeksi Aeromonas hydrophila pada ikan lele (Clarias gariepinus). SRI NURYATI, KUKUH NIRMALA dan ALIMUDDIN.
Infeksi Aeromonas hydrophila dapat menyebabkan wabah penyakit dengan tingkat kematian tinggi pada ikan lele (80−100%) dalam waktu 1−2 minggu. Upaya yang dapat dilakukan untuk menghindari dampak penggunaan antibiotik dalam menanggulangi penyakit ikan adalah dengan penggunaan fitofarmaka. Salah satu fitofarmaka yang dapat digunakan dalam upaya pencegahan penyakit ikan adalah batang pisang ambon lumut (Musa cavendishii var dwarf Paxton), hal ini karena tanaman pisang adalah tanaman yang berbuah sekali sepanjang hidupnya, sehingga batang pisang berpotensi menjadi limbah bila tidak termanfaatkan. Oleh karena itu, penelitian ini dilakukan bertujuan untuk menguji efektivitas perendaman benih ikan lele dengan menggunakan air perasan batang pisang ambon, sehingga dengan metode ini diharapkan dapat lebih efektif pengaplikasiannya dalam mencegah Motile Aeromonad Septicemia (MAS) yang menyerang benih ikan lele pada kegiatan budidaya. Air perasan batang pisang mengandung senyawa aktif saponin, flavonoid dan tanin yang dapat digunakan sebagai antioksidan, antibakteri, antiinflamasi, dan antijamur.
Penelitian ini dilaksanakan pada bulan Januari sampai Mei 2016. Pemeliharaan hewan uji, analisis mikroba dan uji hematologi ikan dilakukan di Laboratorium Kesehatan Ikan, sedangkan analisis ekspresi gen lisozim tipe-C ikan dilakukan di Laboratorium Reproduksi dan Genetik Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pengujian kandungan saponin, tanin dan flavonoid dilakukan di Balai Penelitian Tanaman Rempah dan Obat Bogor. Sekuensing produk PCR gen lisozim tipe-C dilakukan di Laboratorium 1st Base Sequencing Malaysia. Parameter yang diamati selama penelitian adalah tingkat kelangsungan hidup, pertumbuhan bobot mutlak, rasio konversi pakan, total eritrosit, hemoglobin, total leukosit, aktivitas fagositik, aktivitas lisozim, analisis ekspresi gen lisozim tipe-C, dan parameter kualitas air. Penelitian ini menggunakan rancangan acak lengkap yang terdiri atas 5 perlakuan dengan 3 ulangan yaitu kontrol negatif (K-) tanpa perendaman air perasan batang pisang dan tanpa diuji tantang dengan bakteri A. hydrophila; kontrol positif (K+) tanpa perendaman air perasan batang pisang ambon dan dengan diuji tantang menggunakan bakteri A. hydrophila; Perlakuan A, B dan C dilakukanperendaman dengan air perasan batang pisang ambon masing-masing dengan konsentrasi 5 mL L-1, 13 mL L-1 dan 21 mL L-1 serta diuji tantang menggunakan bakteri A. hydrophila.
bakteri A. hydrophila, akan tetapi tingkat ekspresi gen lisozim tipe-C perlakuan 13 mL L-1 yang diukur akhir pemeliharaan (H23) lebih rendah bila dibandingkan dengan perlakuan kontrol negatif. Persentase kemiripan gen lisozim tipe-C ikan lele sebesar 44.44% bila dibandingkan dengan gen lisozim tipe-C ikan nila (Orechromis niloticus).
SUMMARY
QORIE ASTRIA. Effectiveness Ambon Banana Stem Juice as Immunostimulatory against Aeromonas hydrophila Infections in African Catfish
Clarias gariepinus. SRI NURYATI, KUKUH NIRMALA dan ALIMUDDIN. Aeromonas hydrophila infection can cause high mortality in catfish (80-100%) within 1-2 weeks. Efforts to avoid the impact of the antibiotics usage can be made by using medicinal plants to prevent or treat fish diseases. One of the phytopharmaceuticals that known to prevent the fish diseases is ambon banana stem (Musa cavendishii var dwarf Paxton), this is because the banana plant is a plant that bears fruit once in his whole life, so that the banana stems potentially be a waste if not utilized. Therefore, this study was conducted to test the effectiveness of soaking catfish using banana stem juice, so with this method is expected to be more effective application in preventing Motile Aeromonad Septicemia (MAS), which attacks the catfish on farming activities. Banana stem juice contains saponins, flavonoids and tannins that can be used as an antioxidant, antibacterial, anti-inflammatory and antifungal.
This research was conducted on January until May 2016. Rearing of fish, analysis of microbial and fish hematology profiles was done in Fish Health Laboratory, while gene expression analysis was done in Reproduction and Genetics of Aquatic Organisms Laboratory of the Department of Aquaculture, Faculty of Fisheries and Marine Sciences. Saponins, tannins and flavonoids content were tested in Crops Research Institute for Spice and Drug, Bogor. Sequencing PCR products of C-type lysozyme gene was performed at the Laboratory of 1st Base Sequencing Malaysia. The observed parameters were total erythrocytes, hemoglobin, total leukocyte phagocytic activity, lysozyme activity, C-type lysozyme gene expression level, survival rate, feed conversion ratio, daily growth rate, and water quality. This study consisted of five treatments in triplicate which were negative control (K-) without banana stem extract immersion and without challenge tests; (K +) without immersion the banana stem extract and the challenge tests using bacteria A. hydrophila; treatment A, B and C were the immersion of banana stem juice of 5 mL L-1, 13 mL L-1 and 21 mL L-1 with a challenge tests using bacteria A. hydrophila.
The results showed that fish treated with banana stem juice at a concentration of 13 mL L-1 had the survival rate of 53.33±6.67% which is higher than positive control (33.33±6.67%). Based on haematology observations on the 3rd day post-challenge test (H12) with A. hydrophila, total erythrocytes, haemoglobin, total leukocytes, phagocytic activity, and lysozyme activity were highest in treatment 13 mL L-1. Thus immersing catfish in banana stem juice can boost the immune system against the infection of A. hydrophila. However, the C-type lysozyme gene expression analysis at the end of rearing (H23) in 13 ml L-1 was lower compared to the negative control. The percentages of catfish C-type lysozyme gene similarity to the tilapia (Oreochromis niloticus) C-type lysozyme gene was 44.44%.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
QORIE ASTRIA
EFEKTIVITAS AIR PERASAN BATANG PISANG AMBON SEBAGAI
IMUNOSTIMULAN TERHADAP INFEKSI
Aeromonas hydrophila
PRAKATA
Puji syukur penulis ucapkan hanya kepada Allah Yang Maha Suci dan Ditinggikan, sumber inspirasi yang menggerakkan penulis hingga dapat menyelesaikan tesis dengan judul “Efektivitas Air Perasan Batang Pisang Ambon sebagai Imunostimulan terhadap Infeksi Aeromonas hydrophila pada Ikan Lele (Clarias gariepinus)” pada Mayor Ilmu Akuakultur, Program Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan kali ini penulis ingin menyampaikan ucapan terimakasih kepada Ibu Dr Sri Nuryati, SPi MSi, Bapak Dr Ir Kukuh Nirmala, MSc dan Bapak Dr Alimuddin, SPi MSc selaku pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis. Penulis juga mengucapkan terimakasih kepada Ibu Dr Dinamella Wahjuningrum, SSi MSi selaku komisi program studi dan Bapak Dr Ir Irzal Effendi, MSi sebagai dosen penguji luar komisi yang telah memberikan saran dalam ujian sidang tesis ini.
Terima kasih dan penghargaan yang tinggi penulis persembahkan kepada Ayahanda dan Ibunda, serta seluruh keluarga atas doa, bantuan, dukungan, dan semangatnya selama penulis menjalani masa studi.
Selain itu, ungkapan terima kasih juga disampaikan kepada rekan-rekan S2 Ilmu Akuakultur IPB angkatan 2014 atas kebersamaannya dalam menempuh studi, keluarga besar Laboratorium Kesehatan Ikan (Bapak Ranta, Afriani Ramadhan SPi MSi, Aminatul Zahra Batubara SPi MSi, Windu Sukendar SPi MSi Dendi Hidayatullah SPi MSi, Stefanno Rijoly SPi MSi, Mad Rudi SPi MSi, Ardana Kurniaji SPi MSi), rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik (Hasan Nasrullah SPi, Pak Asep Sopian SPi MSi, Ibu Reni Agustina SPi MSi, Haryayu SPi MSi, Rinaldi Fakhrurrazi SPi MSi), rekan-rekan UNILA yang melanjutkan studi di IPB (Nadisa Theresia Putri SPi MSi dan Megawati Wijaya SPi MSi) terima kasih atas bantuannya selama penelitian dan penyusunan tesis. Ungkapan terima kasih juga penulis sampaikan kepada semua pihak yang tidak dapat disebutkan satu-persatu yang telah membantu dalam penyusunan tesis ini.
Semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan, khususnya perikanan budidaya.
Bogor, Februari 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
2 METODE 2
Waktu dan Tempat Penelitian 2
Rancangan Penelitian 3
Persiapan Air Perasan Batang Pisang Ambon dan Uji Toksisitas 3
Persiapan Wadah dan Pemeliharaan Ikan 4
Penyediaan Bakteri A. hydrophila dan Uji Tantang 4
Pengambilan Sampel Darah 5
Parameter Uji 5
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 15
4 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR TABEL
1. Perendaman menggunakan air perasan batang pisang ambon dengan
perlakuan dan konsentrasi yang berbeda 3
2. Tingkat Kelangsungan Hidup (KH) dan Relative Percent Survival (RPS)
Ikan Lele 8
3. Rasio ekspresi gen lisozim tipe-C dan β-aktin pada ikan lele 12 4. Persentase kemiripan gen lisozim tipe-C ikan lele uji dibandingkan
dengan lisozim tipe-C ikan nila (Oreochromis niloticus) 12 5. Persentase kemiripan gen lisozim tipe-C perlakuan B dan kontrol positif
(K+) dibandingkan dengan kontrol negatif (K-) 13
6. Kisaran kualitas air pada setiap perlakuan selama penelitian 14
DAFTAR GAMBAR
1. Pola mortalitas harian ikan lele pascauji tantang bakteri A. hydrophila. 9 2. Kinerja produksi ikan lele selama penelitian: (a) Pertumbuhan bobot
mutlak; (b) Rasio konversi pakan. 9
3. Total eritrosit (a) dan hemoglobin (b) ikan uji baik sebelum uji tantang (H0 dan H8) maupun setelah uji tantang dengan A. hydrophila (H12, H17
dan H23). 10
4. Total leukosit (a); Aktivitas fagositik (b); Aktivitas lisozim (c) ikan uji, baik sebelum uji tantang (H0 dan H8) maupun setelah uji tantang dengan A.
hydrophila (H12, H17 dan H23). 11
5. Ekspresi gen lisozim tipe-C (a) dan β-aktin ikan lele (b). 12 6. Ikan lele yang sama pada perlakuan K+ pascauji tantang bakteri A.
hydrophila (a) hari ke-1; (b) hari ke-4; (c) hari ke-9. 13 7. Gejala klinis perubahan morfologi ikan lele pascauji tantang dengan bakteri
A. hydrophila (a) bercak merah pada sungut (hemorraghe); (b) sirip ekor
geripis; adanya bercak merah; (c) perut gembung (abdominal dropsy); (d) luka atau borok pada bekas penyuntikan. 14 8. Kisaran hasil pengukuran kualitas air: (a) pH air perendaman; (b) DO air
perendaman dengan perlakuan tanpa diberi air perasan, awal diberi air perasan, dan pada 30 menit diberi air perasan batang pisang ambon. 15
DAFTAR LAMPIRAN
1. Analisis probit (LC50-24 jam) air perasan batang pisang ambon 24
2. Hasil identifikasi bakteri A. hydrophila secara uji biokimia 25 3. Hasil identifikasi bakteri A. hydrophila menggunakan uji KIT API 20E 25
4. Perhitungan nilai LD50 26
5. Skema bagan jadwal sampling parameter uji selama penelitian 26 6. Elektroforegram dan plot kurva analisis ekspresi gen lisozim tipe-C dan
7. Penyejajaran nukleotida produk PCR pada pita DNA gen lisozim tipe-C ikan lele uji dengan ukuran sekitar 500 bp dibandingkan dengan lisozim
tipe-C ikan nila (Oreochromis niloticus) 27
8. Penyejajaran nukleotida produk PCR pada pita DNA gen lisozim tipe-C
ikan lele antar perlakuan 28
1
PENDAHULUAN
Latar Belakang
Ikan lele Afrika (Clarias gariepinus) varietas sangkuriang adalah komoditas perikanan yang memiliki nilai ekonomis tinggi dan disenangi oleh masyarakat di Indonesia. Berdasarkan hasil kajian Direktorat Jenderal Perikanan Budidaya Tahun 2013, kenaikan rata-rata produksi ikan lele tahun 2010−2013 meningkat hingga 47.21% yaitu dari 242811 ton tahun 2010 menjadi 788455 ton pada tahun 2013 (KKP 2013). Permintaan akan ikan lele mendorong dilakukannya budidaya secara intensif untuk memenuhi kebutuhan pasar, akan tetapi pengembangan sistem intensif hingga kini masih terkendala oleh berbagai masalah (FAO 2007). Salah satu penyebabnya adalah penyakit yang disebabkan oleh bakteri Aeromonas hydrophila, karena dapat mengakibatkan kematian dalam jumlah besar. Menurut Lukistyowati dan Kurniasih (2011) bakteri ini dapat menimbulkan wabah penyakit dengan tingkat kematian tinggi (80−100%) dalam waktu 1−2 minggu.
Penanggulangan penyakit ikan dapat dilakukan menggunakan bahan-bahan kimia dan antibiotik. Akan tetapi, pemakaian antibiotik dan bahan-bahan kimia lainnya secara terus-menerus dapat menyebabkan dampak negatif dengan meningkatnya pencemaran lingkungan yang sulit didegradasi (Rairakhwada et al. 2007), akumulasi residu antibiotik dalam tubuh hewan dapat mempengaruhi pertumbuhan dan resistensi hewan tersebut terhadap obat-obatan serta imunosupresi (Maqsood et al. 2009). Residu antibiotik juga dapat menimbulkan ancaman potensial terhadap kesehatan manusia bila dikonsumsi dalam waktu yang lama (Lukman 1994), hal ini dikarenakan terjadinya perpindahan sifat resistensi antibiotika bakteri dari hewan ke manusia dan lingkungan (Kusumaningsih 2007). Upaya yang dapat dilakukan untuk menghindari dampak penggunaan antibiotik dalam menanggulangi penyakit ikan adalah dengan penggunaan fitofarmaka untuk mencegah ataupun mengobati penyakit ikan, sehingga memiliki keamanan pangan bagi manusia yang mengkonsumsinya. Salah satu fitofarmaka yang dapat digunakan dalam upaya pencegahan penyakit ikan (imunostimulan) adalah batang pisang ambon lumut (Musa cavendishii var dwarf Paxton).
Tanaman pisang adalah tanaman yang tumbuh di daerah tropis dan berbuah sekali sepanjang hidupnya, serta batang pisang berpotensi menjadi limbah bila tidak termanfaatkan. Rahman (2006) menyatakan bahwa perbandingan bobot segar antara batang, daun dan buah pisang berturut-turut 63%, 14% dan 23%, sehingga batang pisang menjadi limbah yang berpotensi sebagai fitofarmaka. Menurut Prasetyo (2008), batang pisang ambon merupakan salah satu limbah yang tidak termanfaatkan akan tetapi berguna bagi kesehatan. Hasil analisis fitokimia dari Badan Penelitian Tanaman Rempah dan Obat, menunjukkan bahwa air perasan batang pisang mengandung saponin, flavonoid dan tanin. Flavonoid merupakan senyawa aktif yang dapat digunakan sebagai antioksidan, antibakteri, antiinflamasi, dan antijamur.
2
menunjukkan pengaplikasian yang kurang efektif. Selain itu, batang pisang ambon yang dibuat ekstrak dengan menggunakan larutan etanol menunjukkan hasil yang baik (Indraswari 2016), namun kurang ekonomis bila diterapkan dalam skala budidaya ikan lele. Oleh karena itu, perlu dikaji metode lain yang lebih praktis dan ekonomis pengaplikasiannya dalam mencegah Motile Aeromonad Septicemia
(MAS) yang menyerang benih ikan lele, yaitu dengan metode perendaman ikan menggunakan air perasan batang pisang ambon.
Rumusan Masalah
Keamanan pangan merupakan suatu kewajiban yang harus dipenuhi oleh pelaku usaha atau pembudidaya. Penggunaan antibiotik berbasis bahan kimia dikhawatirkan menimbulkan dampak negatif baik terhadap organisme budidaya maupun konsumen yang mengkonsumsinya. Saat ini banyak studi yang meneliti tentang fitofarmaka, yaitu pemanfaatan bahan alami sebagai pengganti antibiotik untuk mencegah terjadinya penginfeksian bakteri A. hydrophila. Salah satu tanaman yang diharapkan efektif sebagai bahan fitofarmaka adalah tanaman pisang. Diketahui dalam batang pisang ambon mengandung senyawa aktif tanin, saponin dan flavonoid yang bersifat antiseptik sehingga memiliki kemampuan antibakteri (Prasetyo 2008). Penyakit Motile Aeromonad Septicemia (MAS) yang menyerang benih ikan lele dapat menyebabkan kerugian yang besar pada pembudidaya, oleh sebab itu untuk mencegah terserangnya bakteri patogen dilakukan perendaman benih ikan lele pada air perasan batang pisang ambon.
Metode pemberian imunostimulan melalui air perasan batang pisang diharapkan dapat efektif dan efisien diterapkan pada pembudidaya, serta dengan memperhatikan konsentrasi yang optimal. Respons imun pada ikan terlihat dari kelangsungan hidup ikan pascauji tantang dengan bakteri A. hydrophila dan uji hematologi yang mengekspresikan respons imun pada ikan berupa total eritrosit, hemoglobin, total leukosit, aktivitas fagositik, aktivitas lisozim, dan ekspresi gen lisozim tipe-C. Perendaman dengan air perasan batang pisang ambon pada konsentrasi yang berbeda dilakukan untuk mendapatkan konsentrasi yang optimal, sehingga dapat menekan kerugian akibat serangan Motile Aeromonad Septicemia
pada benih ikan lele dan meningkatkan keuntungan usaha budidaya perikanan.
Tujuan Penelitian
Tujuan dari penelitian ini adalah menguji efektivitas perendaman benih ikan lele dengan menggunakan air perasan batang pisang ambon lumut sebagai imunostimulan terhadap infeksi bakteri A. hydrophila.
2
METODE
Waktu dan Tempat Penelitian
3 Laboratorium Reproduksi dan Genetik Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pengujian kandungan saponin, tanin dan flavonoid dilakukan di Balai Penelitian Tanaman Rempah dan Obat Bogor. Sekuensing produk PCR gen lisozim tipe-C dilakukan di Laboratorium 1st Base Sequencing Malaysia.
Rancangan Penelitian
Penelitian ini menggunakan rancangan acak lengkap dengan 5 perlakuan dan 3 ulangan. Perendaman dengan air perasan batang pisang dilakukan dengan menyiapkan air perasan pada konsentrasi 5 mL L-1, 13 mL L-1 dan 21 mL L-1 dalam wadah. Ikan sebanyak 15 ekor direndam dalam 1.5 L air selama 30 menit setiap hari selama tujuh hari. Uji tantang (penginfeksian bakteri A. hydrophila) dilakukan pada hari ke-9. Rincian perlakuan tersaji dalam Tabel 1.
Tabel 1 Perendaman menggunakan air perasan batang pisang ambon dengan perlakuan dan konsentrasi yang berbeda
Perlakuan Keterangan
Kontrol Negatif Tanpa perendaman air perasan batang pisang dan disuntik dengan PBS(phosphate buffer salin)
Kontrol Positif Tanpa perendaman air perasan batang pisang dan disuntik dengan bakteri A. hydrophila
Perlakuan A Perendaman dengan air perasan batang pisang ambon sebanyak 5 mL L-1 dan disuntik dengan bakteri A. hydrophila
Perlakuan B Perendaman dengan air perasan batang pisang ambon sebanyak 13 mL L-1 dan disuntik dengan bakteri A. hydrophila Perlakuan C Perendaman dengan air perasan batang pisang ambon
sebanyak 21 mL L-1 dan disuntik dengan bakteri A. hydrophila Persiapan Air Perasan Batang Pisang Ambon dan Uji Toksisitas
Batang pisang ambon lumut yang digunakan pada penelitian ini didapatkan dari Desa Pabuaran Kecamatan Ciampea, Kabupaten Bogor. Air perasan batang pisang ambon didapatkan dengan memotong seluruh bagian batang pisang yang telah dipanen berumur sekitar 5 bulan dan diperas menggunakan mesin pemeras tebu. Air perasan batang pisang kemudian disaring menggunakan kertas saring Whatman nomor 41 dengan ukuran pori 20–25 µm agar tidak ada ampas batang pisang pada air perasan. Kandungan air perasan batang pisang ambon dianalisis secara kuantitatif di Balai Penelitian Tanaman Rempah dan Obat Bogor dengan mengikuti prosedur Harborne (2006). Hasil analisis menunjukkan batang pisang ambon mengandung saponin 0.22%, tanin 0.011% dan flavonoid 2.02%.
4
konsentrasi 5 mL L-1, 10 mL L-1 dan 20 mL L-1 sebanyak 100 mL air wadah-1 dengan tiga ulangan. Semua uji diinkubasi pada suhu kamar (25−28 ºC) selama 24 jam. Pengamatan dilakukan setelah 24 jam dengan melihat jumlah Artemia salina
yang mati dan masih hidup pada setiap wadah. Hasil uji BSLT setelah dilakukan pengamatan 24 jam didapatkan nilai LC50 16 mL L-1 (Lampiran 1).
Persiapan Wadah dan Pemeliharaan Ikan
Wadah pemeliharaan yang digunakan berupa akuarium berukuran 65×30×35 cm3 dengan ketinggian air 25 cm dan diberi satu titik sumber aerasi. Pergantian air dilakukan tiap tiga hari sekali pada pagi hari sebanyak 30−50% dari volume air (49 L) sebelum pemberian pakan dilakukan.
Ikan lele berukuran panjang total 5−7 cm diperoleh dari Kampung Babakan Desa Bambu Kuning Kecamatan Pamijahan, Kabupaten Bogor. Benih ikan lele diadaptasi di akuarium pemeliharaan terlebih dahulu selama tujuh hari. Sebelum ikan ditebar ke wadah pengujian, dilakukan pengukuran bobot dan panjang awal 15 ekor ikan. Ikan ditebar dengan kepadatan 15 ekor per akuarium dan dipelihara selama 23 hari, serta diberi pakan berupa pelet komersial (kadar protein 39−41%) sebanyak dua kali sehari secara at satiation.
Penyediaan Bakteri A. hydrophila dan Uji Tantang
Bakteri A. hydrophila diperoleh dari Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan, Depok. Bakteri A. hydrophila
ditumbuhkan dalam medium TSB (Tripticase Soy Broth) dengan volume 5 mL, selanjutnya diinkubasi dalam waterbath shaker selama 24 jam. Setelah itu bakteri ditingkatkan virulensinya dengan Postulat Koch (Sarono et al. 1993) yakni dengan menyuntikkan bakteri sebanyak 0.1 mL pada masing-masing ikan lele secara intramuskuler. Setelah ikan lele menunjukkan tanda gejala klinis, lalu dilakukan reisolasi bakteri A. hydrophila pada bagian tubuh yang terdapat luka, serta pada hati dan ginjal ikan lele ke media RS (Rimmler Shotts) dan diinkubasi selama 24 jam pada suhu 37 ºC. Bakteri dikarakterisasi kembali menggunakan uji fisiologis dan biokimia berdasarkan metode MacFaddin (1980) yakni melalui pewarnaan Gram, uji oksidatif/fermentatif, uji motilitas, uji katalase, uji oksidase, dan uji gelatin. Identifikasi bakteri dilakukan dengan metode konvensional menggunakan KIT API 20 E. Berdasarkan hasil uji biokimia (Lampiran 2) dan uji KIT API 20E (Lampiran 3), bahwa bakteri tersebut adalah bakteri A. hydrophila.
Penentuan dosis bakteri yang digunakan pada uji tantang, dilakukan melalui uji LD50 dengan menyuntikkan bakteri mulai dari kepadatan 103 sampai
108 cfu mL-1. Tingkat mortalitas ikan diamati selama tujuh hari. Jumlah ikan yang mati dihitung dan nilai LD50 dianalisis menggunakan rumus Reed dan Muench
(1938), dapat dilihat pada Lampiran 4.
5 Pengambilan Sampel Darah
Ikan dipingsankan terlebih dahulu menggunakan pembius ikan Ocean free special arowana stabilizer pada konsentrasi 1 mL L-1, kemudian sampel darah ikan diambil pada pembuluh darah bagian vena caudal. Ikan yang digunakan pada uji hematologi berasal dari ulangan yang berbeda dengan uji kinerja pertumbuhan. Darah yang diperoleh dari 4 ekor ikan/perlakuan dimasukkan ke dalam mikrotube yang telah dibilas dengan antikoagulan (Na sitrat 3.8%).
Parameter Uji
Parameter uji yang diamati selama penelitian yaitu kinerja produksi, uji hematologi, analisis ekspresi gen lisozim tipe-C, pengamatan gejala klinis, serta kualitas air media pemeliharaan dan perendaman. Skema bagan jadwal sampling parameter uji selama penelitian dapat dilihat pada Lampiran 5.
Kinerja Produksi
Parameter uji kinerja produksi meliputi kelangsungan hidup yang diamati setiap hari hingga akhir perlakuan, pertumbuhan bobot mutlak diamati hingga hari ke-8 sebelum dilakukan uji tantang (H9), dan rasio konversi pakan yang dilakukan pada akhir perlakuan.
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup ikan dihitung menggunakan rumus (Effendie 1997) sebagai berikut:
Perhitungan relative percent survival dilakukan dilakukan dengan persamaan Ellis (1988) sebagai berikut:
RPS (%) =
Keterangan:
RPS = Relative percent survival (%)
Mn = Persentase mortalitas ikan perlakuan ke-n M0 = Persentase mortalitas ikan kontrol
Pertumbuhan Bobot Mutlak
6
W = Wt − Wo Keterangan:
W : Pertumbuhan bobot mutlak
Wo : Bobot total ikan pada awal penelitian (g) Wt : Bobot total ikan pada akhir penelitian (g)
Rasio Konversi Pakan
Rasio konversi pakan dihitung dengan menggunakan rumus (Huisman 1987) sebagai berikut:
Keterangan:
FCR : Konversi pakan
∑ Pakan : Jumlah pakan yang diberikan selama penelitian (g) Bt : Biomassa ikan di akhir penelitian (g)
BM : Biomassa ikan yang mati selama penelitian (g) B0 : Biomassa ikan pada awal penelitian (g) Uji Hematologi
Parameter hematologi yang dilakukan terdiri atas total eritrosit, kadar hemoglobin, total leukosit, aktivitas fagositik, dan aktivitas lisozim diamati pada awal sebelum perlakuan (H0), setelah perlakuan (H8), 3 hari setelah uji tantang (H12), 8 hari setelah uji tantang (H17), dan akhir pemeliharaan (H23).
Perhitungan Total Eritrosit
Total eritrosit dihitung menggunakan menggunakan rumus (Blaxhall & Daisley 1973) sebagai berikut:
∑Eritrosit (sel mm-3)= ∑ sel terhitung ×
× faktor pengenceran Kadar Hemoglobin
Kadar hemoglobin diukur menurut metode sahli (Wedemeyer & Yasutake 1977)dan dinyatakan dalam g dL-1 pada skala kuning.
Perhitungan Total Leukosit
Total Leukosit dihitung rumus (Blaxhall & Daisley 1973) sebagai berikut: ∑ Leukosit (sel mm-3) = ∑ sel terhitung ×
× faktor pengenceran
Pengamatan Aktivitas Fagositik
Aktivitas fagositik dihitung menggunakan rumus (Anderson & Siwicki 1995) sebagai berikut:
Aktivitas Fagositik =
7
Analisis ekspresi gen lisozim tipe-C dilakukan menggunakan RT-PCR semikuantitatif. Ekspresi gen penyandi lisozim dianalisis pada akhir pemeliharaan. RNA total diekstraksi dari ginjal (3 ekor ikan/perlakuan) menggunakan RNAse mini kit (Qiagen, USA) dan sintesis cDNA dilakukan menggunakan kit omniscript RT (Qiagen, USA) mengikuti metode dalam manual. Tujuh set primer dirancang berdasarkan alel ikan Nila (Oreochromis niloticus)pada Bank Gen yang terkait dengan gen lisozim tipe-C. Amplifikasi gen lisozim tipe-C menggunakan primer forward lys-F (5’-GCA GCA ACT GTG menggunakan gen β-aktin universal dengan primer forward bact-F (5’-GAC CTC ACA GAC TAC CTC ATG-3’) dan primer reverse bact-R (5’TCA TTG CCG ATG GTG ATG ACC-3’). Program PCR yang digunakan untuk β-aktin adalah pre-denaturasi 94 ºC selama 3 menit; denaturasi 94 ºC selama 30 detik, annealing
55 ºC selama 30 detik, ekstensi 72 ºC selama 1 menit dengan total 35 siklus amplifikasi, dan ekstensi akhir 72 ºC selama 5 menit. Hasil PCR dialirkan dalam gel agarosa 1% dan ukuran fragmen diprediksi menggunakan marka plus DNA
ladder (Vivantis, USA). Elektroforesis dilakukan pada tegangan 200 volt selama 80 menit.
Produk PCR kemudian disekuensing di Laboratorium 1st Base Sequencing Malaysia menggunakan mesin ABI PRISM 3730 XL (Genetic Analyzer Develop by Applied Biosystem, USA). Hasil sekuensing dianalisis dengan penyejajaran (alignment) untuk memperoleh kemiripan sekuen gen lisozim tipe-C.
Pengamatan Gejala Klinis
Pengamatan gejala klinis meliputi tingkah laku, yaitu respons makan dan refleks gerak serta abnormalitas (peradangan) dilakukan setiap hari selama 14 hari setelah ikan diinfeksi bakteri A. hydrophila.
Kualitas Air Media Pemeliharaan dan Perendaman
8
suhu (ºC), pH, DO (mg L-1), dan amonia (mg L-1). Pengukuran kualitas air perendaman meliputi pH dan DO (mg L-1). Pengukuran suhu, DO dan pH dilakukan dengan menggunakan alat berupa DO-meter dan pH-meter. Pengukuran amonia didapatkan dari hasil konversi nilai TAN yang diukur menggunakan spektrofotometri. Nilai amonia pada media pemeliharaan dihitung dengan menggunakan rumus nilai pKa (Emerson et al. 1975).
Analisis Data
Data parameter kinerja produksi dan uji hematologi dianalisis menggunakan software SPSS ver 16.00 dan apabila hasil uji ANOVA berbeda nyata, dilanjutkan dengan uji Duncan pada selang kepercayaan 95%. Analisis ekspresi gen lisozim, gejala klinis dan hasil pengukuran kualitas air dianalisis secara deskriptif.
3
HASIL DAN PEMBAHASAN
Hasil
Kinerja Produksi
Tingkat Kelangsungan Hidup dan Relative Percent Survival (RPS)
Tingkat kelangsungan hidup ikan lele pada perlakuan B dan A tidak berbeda nyata (P<0.05), dan lebih tinggi (P<0.05) daripada perlakuan C dan K+. Nilai RPS tertinggi terdapat pada perlakuan B bila dibandingkan dengan perlakuan A dan C. Hasil pengamatan tingkat kelangsungan hidup dan perhitungan RPS tersaji dalam Tabel 2.
Tabel 2 Tingkat Kelangsungan Hidup (KH) dan Relative Percent Survival (RPS) Ikan Lele
Parameter Perlakuan
K- K+ A B C
KH (%) 100±0a 33.33±6.67d 44.44±3.85bc 53.33±6.67b 40.00±6.67cd
RPS (%) - - 16.67 30 10
Keterangan :
Kontrol negatif (K-); kontrol positif (K+); air perasan batang pisang ambon konsentrasi 5 mL L-1 (A); 13 mL L-1 (B); 21 mL L-1 (C). Huruf superskrip yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Uji jarak berganda Duncan; P<0.05).
Pola Mortalitas Harian
9 bila dibandingkan dengan perlakuan A (55.55%), C (60%) dan K+ (66.66%) pada akhir pemeliharaan ikan uji (H23).
Keterangan :
Tanpa perendaman dan tidak diuji tantang bakteri (K-); tanpa perendaman dan diuji tantang bakteri (K+); perendaman dengan air perasan batang pisang ambon konsentrasi 5 mL L-1 (A); 13 mL L-1 (B); 21 mL L-1 (C) dan diuji tantang bakteri.
Gambar 1 Pola mortalitas harian ikan uji pascauji tantang bakteri A.hydrophila.
Pertumbuhan Bobot Mutlak dan Rasio Konversi Pakan
Pertumbuhan bobot mutlak yang diukur selama 8 hari sebelum uji tantang hari ke-9, tidak terdapat perbedaan yang nyata (P>0.05) antar perlakuan namun pertumbuhan bobot mutlak tertinggi terdapat pada kontrol negatif (23.26±1.36 g). Rasio konversi pakan/feed conversion ratio (FCR) terendah (P<0.05) juga diperoleh pada perlakuan B (1.08±0.04), sementara FCR perlakuan dengan perendaman air perasan batang pisang lainnya adalah sama.
(a) (b) Keterangan :
Tanpa perendaman dan tidak diuji tantang bakteri (K-); tanpa perendaman dan diuji tantang bakteri (K+); perendaman dengan air perasan batang pisang ambon konsentrasi konsentrasi 5 mL L-1 (A); 13 mL L-1 (B); 21 mL L-1 (C) dan diuji tantang bakteri. Huruf superskrip yang berbeda ditiap bar menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; P<0.05).
Gambar 2 Kinerja produksi ikan uji selama penelitian: (a) Pertumbuhan bobot mutlak; (b) Rasio konversi pakan.
10
Parameter Hematologi
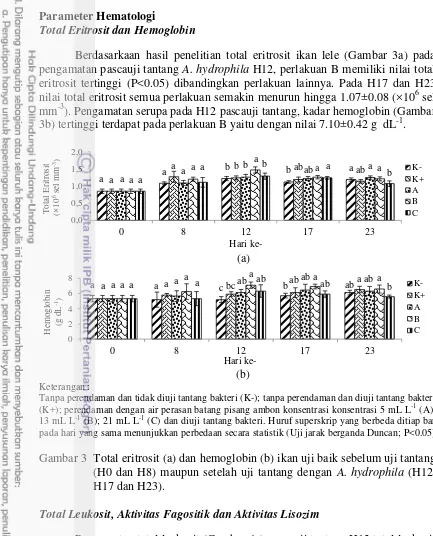
Total Eritrosit dan Hemoglobin
Berdasarkaan hasil penelitian total eritrosit ikan lele (Gambar 3a) pada pengamatan pascauji tantang A. hydrophila H12, perlakuan B memiliki nilai total eritrosit tertinggi (P<0.05) dibandingkan perlakuan lainnya. Pada H17 dan H23 nilai total eritrosit semua perlakuan semakin menurun hingga 1.07±0.08 (×106 sel mm-3). Pengamatan serupa pada H12 pascauji tantang, kadar hemoglobin (Gambar 3b) tertinggi terdapat pada perlakuan B yaitu dengan nilai 7.10±0.42 g dL-1.
(a)
(b)
Keterangan :
Tanpa perendaman dan tidak diuji tantang bakteri (K-); tanpa perendaman dan diuji tantang bakteri (K+); perendaman dengan air perasan batang pisang ambon konsentrasi konsentrasi 5 mL L-1 (A); 13 mL L-1 (B); 21 mL L-1 (C) dan diuji tantang bakteri. Huruf superskrip yang berbeda ditiap bar pada hari yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; P<0.05).
Gambar 3 Total eritrosit (a) dan hemoglobin (b) ikan uji baik sebelum uji tantang (H0 dan H8) maupun setelah uji tantang dengan A. hydrophila (H12, H17 dan H23).
Total Leukosit, Aktivitas Fagositik dan Aktivitas Lisozim
11
(a)
(b)
(c)
Keterangan :
Tanpa perendaman dan tidak diuji tantang bakteri (K-); tanpa perendaman dan diuji tantang bakteri (K+); perendaman dengan air perasan batang pisang ambon konsentrasi konsentrasi 5 mL L-1 (A); 13 mL L-1 (B); 21 mL L-1 (C) dan diuji tantang bakteri. Huruf superskrip yang berbeda ditiap bar pada hari yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Duncan; P<0.05).
Gambar 4 Total leukosit (a); Aktivitas fagositik (b); Aktivitas Lisozim (c) ikan uji, baik sebelum uji tantang (H0 dan H8) maupun setelah uji tantang dengan
A. hydrophila (H12, H17 dan H23).
Analisis Ekspresi Gen Lisozim Tipe-C
Ekspresi gen lisozim tipe-C pada organ ginjal ikan lele dianalisis menggunakan metode RT-PCR semikuantitatif. Visualisasi gel elektroforesis dari gen lisozim tipe-C (Gambar 5a) memperlihatkan pendaran pita cDNA pada ukuran sekitar 100 bp, 500 bp dan 1000 bp, namun yang telihat cukup jelas yakni pada ukuran pita sekitar 500 bp dan tidak terdapat produk PCR pada kontrol negatif bahan (N). Berdasarkan hasil amplifikasi dengan primer β-aktin menggunakan PCR, diperoleh amplikon gen β-aktin (Gambar 5b) ikan lele berukuran sekitar 300 bp yang terlihat jelas pada semua sampel perlakuan, sedangkan kontrol negatif (N) tidak ada produk PCR.
12
(a) (b)
Keterangan :
Marker 1 kb DNA ladder (M); perendaman dengan air perasan batang pisang ambon konsentrasi 13 mL L-1 dan diuji tantang bakteri (B); tanpa perendaman dan diuji tantang bakteri (K+); tanpa perendaman dan tidak diuji tantang bakteri (K-); kontrol negatif bahan (N).
Gambar 5 Ekspresi gen lisozim tipe-C (a) dan β-aktin ikan lele (b).
Rasio ekspresi gen ikan lele ditampilkan pada Tabel 3, dan hasil analisis densitas pita cDNA disajikan pada Lampiran 6. Berdasarkan hasil rasio ekspresi gen lisozim tipe-C dan β-aktin, ikan lele pada perlakuan K- memiliki ekspresi gen lebih tinggi daripada ikan lele pada perlakuan B dan K+.
Tabel 3 Rasio ekspresi gen lisozim tipe-C dan β-aktin pada ikan lele
Perlakuan Lisozim tipe-C β-aktin Rasio Lis tipe-C : β-aktin
K- 21249.827 13988.61 1.52
K+ 30523.492 31809.51 0.96
B 35462.685 33831.48 1.05
Keterangan :
Perlakuan tanpa perendaman dan tidak diuji tantang bakteri (K-); tanpa perendaman dan diuji tantang bakteri (K+); perendaman dengan air perasan batang pisang ambon pada konsentrasi 13 mL L-1 dan diuji tantang bakteri (B).
Hasil penyejajaran (alignment) nukleotida produk PCR gen lisozim tipe-C ikan lele pada pendaran pita dengan ukuran sekitar 500 bp menunjukkan terdapat kemiripan sekuen yang sama dengan gen lisozim ikan nila (Oreochromis niloticus), dapat dilihat pada Tabel 4.
Tabel 4 Persentase kemiripan gen lisozim tipe-C ikan lele uji dibandingkan dengan lisozim tipe-C ikan nila.
Perlakuan Persentase kemiripan (%)
B 44.44
K+ 42.82
K- 42.82
Keterangan :
13 Persentase kemiripan gen lisozim tipe-C antar perlakuan ditampilkan pada Tabel 5. Kemiripan nukleutida produk PCR gen lisozim tipe-C ikan lele pada perlakuan B dan K+ memiliki persentase kemiripan sekuen yang tinggi bila dibandingkan dengan K-.
Tabel 5 Persentase kemiripan gen lisozim tipe-C Perlakuan B dan Kontrol positif (K+) dibandingkan dengan kontrol negatif (K-).
Perlakuan Persentase kemiripan (%)
K+ 89.46
B 90.08
Keterangan :
Perlakuan perendaman dengan air perasan batang pisang ambon pada konsentrasi 13 mL L-1 dan diuji tantang bakteri (B); tanpa perendaman dan diuji tantang bakteri (K+).
Gejala Klinis
Gejala klinis ikan lele diamati selama 14 hari pascauji tantang. Hasil pengamatan terhadap gejala klinis ikan lele yang sama pada perlakuan K+ pascauji tantang dengan bakteri A. hydrophila (Gambar 6), pada hari ke-1 luka pada tubuh ikan terlihat besar, namun pada hari ke-4 semakin mengecil bila dibandingkan dengan sebelumnya. Pada hari ke-9 luka semakin menutup dan terjadi perubahan warna pada tubuh ikan semakin memucat. Pada perlakuan yang dilakukan perendaman air perasan batang pisang ambon (perlakuan A, B dan C) mengalami penutupan luka lebih cepat dibanding perlakuan K+, yakni pada hari ke-7 luka sebagian besar ikan uji sudah menutup.
(a) (b) (c)
Gambar 6 Ikan lele yang sama pada perlakuan K+ pascauji tantang bakteri A. hydrophila (a) hari ke-1; (b) hari ke-4; (c) hari ke-9.
14
(a) (b)
(c) (d)
Gambar 7 Gejala klinis perubahan morfologi ikan lele pascauji tantang dengan bakteri A. hydrophila (a) bercak merah pada sungut (hemorraghe); (b) sirip ekor geripis; adanya bercak merah; (c) perut gembung (abdominal dropsy); (d) luka atau borok pada bekas penyuntikkan. Kualitas Air
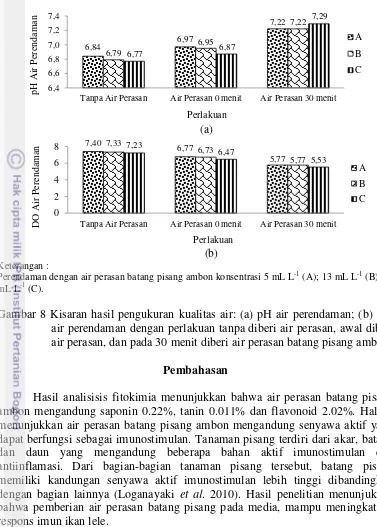
Parameter kualitas air yang diamati selama penelitian adalah suhu, pH, DO dan amonia yang diukur pada awal penelitian dan pada akhir penelitian. Data hasil pengukuran disajikan pada Tabel 6. Menurut Standar Nasional Indonesia (2000) kualitas air yang optimum untuk budidaya yaitu dengan suhu berkisar antara 25 hingga 30 ºC, pH 6.5−8.5, nilai DO lebih besar dari 4 mg L-1, dan kandungan amonia kurang dari 0.01 mg L-1. Suhu pada air pemeliharaan berkisar antara 30−33 ºC, kisaran pH yang terukur berkisar antara 5.2−7, DO berkisar antara 5.0−7.3 mg L-1, dan kandungan amonia berkisar antara 0.001−0.005 mg L-1. Hal ini menunjukkan bahwa kualitas air pemeliharaan sudah layak. Parameter kualitas air yang diamati pada air perasan batang pisang ambon (Gambar 8) adalah pH dan DO yang diukur pada awal pemberian air perasan dan pada menit ke-30 pemberian air perasan.
Tabel 6 Kisaran hasil pengukuran kualitas air pada setiap perlakuan selama penelitian
Perlakuan Parameter
Suhu (oC) pH DO (mg L-1) Amonia (mg L-1) Kontrol Negatif 31−33 5.4−7.0 6.1−7.1 0.001−0.005 Kontrol Positif 30−32 5.4−6.9 6.0−7.0 0.001−0.002 Perlakuan A 31−33 5.2−7.0 5.0−7.3 0.001 Perlakuan B 30−32 5.3−6.8 5.2−7.4 0.001−0.002 Perlakuan C 31−33 5.2−6.6 5.0−7.2 0.001−0.002
SNI (2000) 25−30 6.5−8.5 ≥ 4 ≤ 0.01
Keterangan :
15
(a)
(b)
Keterangan :
Perendaman dengan air perasan batang pisang ambon konsentrasi 5 mL L-1 (A); 13 mL L-1 (B); 21 mL L-1 (C).
Gambar 8 Kisaran hasil pengukuran kualitas air: (a) pH air perendaman; (b) DO air perendaman dengan perlakuan tanpa diberi air perasan, awal diberi air perasan, dan pada 30 menit diberi air perasan batang pisang ambon.
Pembahasan
Hasil analisisis fitokimia menunjukkan bahwa air perasan batang pisang ambon mengandung saponin 0.22%, tanin 0.011% dan flavonoid 2.02%. Hal ini menunjukkan air perasan batang pisang ambon mengandung senyawa aktif yang dapat berfungsi sebagai imunostimulan. Tanaman pisang terdiri dari akar, batang dan daun yang mengandung beberapa bahan aktif imunostimulan dan antiinflamasi. Dari bagian-bagian tanaman pisang tersebut, batang pisang memiliki kandungan senyawa aktif imunostimulan lebih tinggi dibandingkan dengan bagian lainnya (Loganayaki et al. 2010). Hasil penelitian menunjukkan bahwa pemberian air perasan batang pisang pada media, mampu meningkatkan respons imun ikan lele.
Sistem imun mempengaruhi tingginya nilai kelangsungan hidup ikan lele yang diberi air perasan batang pisang ambon. Tingkat kelangsungan hidup ikan lele yang diberi perlakuan, sebelum uji tantang adalah 100% untuk semua perlakuan, akan tetapi kelangsungan hidup ikan semakin menurun pascauji tantang dengan bakteri A. hydrophila. Nilai kelangsungan hidup tertinggi pascauji tantang terdapat pada perlakuan B yaitu sebesar 53.33±6.67%, jika dibandingkan dengan perlakuan A (44.44±3.85%), C (40±6.67%) dan K+ (33.33±6.67%). Berdasarkan nilai RPS, perlakuan B memiliki persentase lebih tinggi yakni 30% dibandingkan dengan perlakuan A (16.67%) dan C (10%). Berbedanya nilai tingkat kelangsungan hidup pada masing-masing perlakuan membuktikan bahwa
6,84
Tanpa Air Perasan Air Perasan 0 menit Air Perasan 30 menit
p
Tanpa Air Perasan Air Perasan 0 menit Air Perasan 30 menit
16
terdapat konsentrasi optimum dari senyawa aktif pada batang pisang ambon terhadap kelangsungan hidup. Didukung dengan hasil penelitian Lidiawati (2014) yang menunjukkan bahwa perendaman ikan lele pada ekstrak batang pisang ambon mampu meningkatkan kelangsungan hidup hingga 83.33% dibandingkan dengan perlakuan tanpa perendaman batang pisang yaitu dengan kelangsungan hidup 30%.
Nilai tingkat kelangsungan hidup yang diperoleh ditandai dengan adanya mortalitas ikan uji yang tinggi hingga hari ke-4 pascauji tantang pada semua perlakuan. Hal ini ditunjukkan berdasarkan hasil pengamatan total eritrosit hari ke-3 pascauji tantang (H12) dengan bakteri A. hydrophila, pada semua perlakuan mengalami peningkatan dibandingkan dengan sebelum dilakukan uji tantang (H8), yaitu berkisar antara 1.07±0.08 (×106 sel mm-3) hingga 1.47±0.09 (×106 sel mm-3). Peningkatan total eritrosit ini masih dalam kisaran normal, hal ini sesuai dengan pernyataan Alamanda et al. (2007) yang menyatakan bahwa jumlah eritrosit normal pada ikan lele berkisar antara 1.0–3.0 (×106 sel mm-3). Peningkatan jumlah eritrosit diduga karena ikan dalam keadaan stres akibat terdapatnya patogen dalam tubuh pascainfeksi bakteri. Sesuai dengan pernyataan Mones (2008) bahwa tingginya jumlah eritrosit dalam darah disebabkan karena ikan dalam keadaan stres. Purwanti et al. (2014) menyatakan bahwa semakin meningkatnya jumlah eritrosit maka meningkat pula kadar hemoglobinnya. Sesuai dengan pernyataan tersebut, kadar hemoglobin dalam darah meningkat pascauji tantang, yaitu berkisar antara 5.6±0.2 g dL-1 hingga 7.1±0.42 g dL-1.
17
al. (2008), bahwa lisozim memiliki aktivitas bakterisidal yang mampu menghidrolisis asam N-asetil glukosamin dan asam N-asetil muramat dari peptidoglikan yang merupakan penyusun dinding sel bakteri gram positif dan bakteri gram negatif.
Berdasarkan pengamatan mortalitas pada hari ke-5 hingga hari ke-14 pascauji tantang, tidak terdapat kematian ikan uji. Hal ini diikuti oleh penurunan nilai total eritrosit, hemoglobin, total leukosit dan aktivitas lisozim pada hari ke-8 pascauji tantang (H17) dan hari ke-14 pascauji tantang (H23). Penurunan nilai eritrosit dan hemoglobin diduga terjadi karena patogenitas bakteri sudah berkurang sehingga tingkat stres ikan menurun. Nilai total leukosit yang juga semakin menurun disebabkan oleh sebagian besar leukosit bergerak menuju jaringan-jaringan yang terinfeksi. Hal ini sependapat dengan Nuryati et al. (2010) bahwa penurunan jumlah leukosit setelah uji tantang disebabkan karena leukosit tersebut aktif dan keluar dari pembuluh darah menuju jaringan yang terinfeksi. Aktivitas lisozim juga semakin menurun hingga akhir pemeliharaan yang diikuti oleh ekpresi gen lisozim tipe-C, yang menunjukkan bahwa perlakuan K- memiliki ekspresi gen lisozim lebih tinggi bila dibandingkan dengan perlakuan B dan K+. Hal ini diduga gen lisozim perlakuan B dan K+ telah terekspresi pada saat awal dilakukan uji tantang, sehingga pada akhir pemeliharaan (H23) gen lisozim terekspresi rendah karena telah dimanfaatkan sebagai sistem imunostimulan saat terinfeksi bakteri A. hydrophila. Berdasarkan hasil sekuensing yang dilakukan penyejajaran (alignment) nukleotida produk PCR gen lisozim tipe-C ikan lele pada pendaran pita dengan ukuran sekitar 500 bp menunjukkan terdapat kemiripan sekuen yang sama dengan gen lisozim ikan nila (Oreochromis niloticus), persentase kemiripan tertinggi terdapat pada perlakuan B yakni 44.44%, sedangkan perlakuan K- dan K+ memiliki persentase kemiripan yang sama (42.82%). Dengan demikian, dapat diyakini bahwa ikan lele uji memiliki gen lisozim tipe-C yang dapat berperan sebagai imunostimulan terhadap bakteri A. hydrophila.
18
perlakuan yang dilakukan perendaman air perasan batang pisang ambon (perlakuan A, B dan C) mengalami penutupan luka lebih cepat dibandingkan dengan perlakuan K+, yakni pada hari ke-7 luka sebagian besar ikan uji sudah menutup. Perendaman dengan air perasan batang pisang diduga dapat menghambat pertumbuhan bakteri, karena mengandung senyawa aktif flavonoid. Krisnata et al. (2014) dalam penelitiannya menyatakan bahwa, flavonoid merupakan senyawa yang berfungsi sebagai antibakteri dan antifungi. Menurut Kusdarwati et al. (2010), mekanisme kerja senyawa antibakteri dengan merusak membran sel sehingga menyebabkan tidak berlangsungnya transport senyawa dan ion ke dalam sel bakteri hingga bakteri mengalami kekurangan nutrisi yang diperlukan bagi pertumbuhannya dan akhirnya bakteri akan mati.
Senyawa aktif yang terdapat pada batang pisang tidak mempengaruhi bobot mutlak ikan lele yang diamati. Hal ini terlihat pada hasil bobot mutlak yang seragam sampai sebelum uji tantang. Bobot yang dihasilkan pascauji tantang digambarkan oleh nilai konversi pakan yang berbeda pada semua perlakuan kecuali perlakuan K-. Nilai terendah didapat pada perlakuan K- (0.81±0.04), karena perlakuan ini merupakan keadaan normal ikan uji yang dipelihara tanpa adanya pengaruh, baik dari perlakuan atau uji tantang. Selanjutnya, semua perlakuan yang diuji tantang dengan bakteri A. hydrophila memiliki nilai konversi pakan yang berbeda. Perlakuan B memiliki nilai konversi pakan sebesar 1.08±0.04 lebih rendah dibandingkan dengan perlakuan A, C dan K+. Hal ini menunjukkan bahwa ikan uji pada perlakuan B mampu memanfaatkan pakan yang diberikan. Effendi (2002) menyatakan bahwa semakin kecil nilai konversi pakan maka semakin efektif pakan yang diberikan dan semakin tinggi pula nutrien pakan yang tercerna, sehingga semakin besar kemungkinan nutrien tersebut dimanfaatkan oleh ikan untuk pertumbuhannya dan menurunkan porsi nutrien yang akan terbuang ke lingkungan.
19
4
SIMPULAN DAN SARAN
Simpulan
Perendaman dengan menggunakan air perasan batang pisang ambon pada konsentrasi 13 mL L-1 selama 30 menit setiap hari selama tujuh hari efektif meningkatkan imunitas sehingga kelangsungan hidup ikan lele menjadi lebih tinggi terhadap infeksi A. hydrophila.
Saran
Pencegahan infeksi bakteri A. Hydrophila terhadap benih ikan lele berukuran 5–7 cm dapat dilakukan menggunakan perendaman dengan konsentrasi 13 mL L-1 selama 30 menit setiap hari selama tujuh hari, maka perlu dilakukan penelitian lebih lanjut mengenai pemberian air perasan batang pisang dengan frekuensi dan waktu perendaman yang lebih lama sehingga dapat meningkatkan kelangsungan hidup ikan lele.
DAFTAR PUSTAKA
Alamanda EI, Handajani NS, Budiharjo A. 2007. Penggunaan metode hematologi dan pengamatan endoparasit darah untuk penetapan kesehatan ikan lele dumbo (Clarias gariepinus) di kolam budidaya desa Mangkubumen Boyolali. Biodeversitas. 8(1):34-38.
Anderson DP, Siwicki AK. 1995. Basic haemotology and serology for fish health programs. in: Shariff M, Arthur JR and Subasinghe RP (Eds). Diseases in Asian Aquaculture II. Fish Health Section, Asian Fisheries Society. Philippines (PH): Manila. pp:185-202.
Angka SL. 2005. Kajian Penyakit Motile Aeromonad Septicemia (MAS) pada Ikan Lele Dumbo (Clarias sp.): Patologi, Pencegahan dan Pengobatannya dengan Fitofarmaka [disertasi]. Bogor (ID): Institut Pertanian Bogor. 96 hlm. Blaxhall PC, Daisley KW. 1973. Routine haemotologycal methods for use with
fish blood. Journal Fish Biology. 5:577-581.
Effendie, MI. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
Effendie MI. 2002. Metodologi Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
Ellis AE. 1988. General principles of fish vaccination, in: Ellis AE. (ed), Fish vaccination. London (GB): Academic press. pp:255.
Emerson KR, Russo RC, Lund RE, Thurston RV. 1975. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal Fish Research Board Canada. 32:2377-2383.
[FAO] Food and Agriculture Organization. 2007. The state of world fisheries and aquaculture 2006. Rome (IT): FAO Fisheries and Aquaculture Department. Galina J, Yin G, Ardo L, Jeney Z. 2009. The use of immunostimulating herb in
20
Hanif A, Bakopoulos V, Dimitriadis GJ. 2004. Maternal transfer of humoral specific and non-specific immune parameters to sea bream Sparus aurata
larvae. Fish & Shellfish Immunology.17:411-435.
Harborne JB. 2006. Metode Fitokimia. Patmawinata K, Soediro I, penerjemah. Bandung (ID): ITB Pr. Terjemahan dari: Phytochemical Methods. Ed ke-2. Huisman EA. 1987. The principles of Fish Culture Production. Netherland:
Development of Aquaculture. Wageningen University.
Indraswari DAP. 2016. Pemberian ekstrak batang pisang ambon (Musa paradisiaca) melalui pakan untuk mencegah penyakit Motile Aeromonad Septicaemia pada ikan lele (Clarias sp.) [skripsi]. Bogor (ID): Institut Pertanian Bogor. 36 hlm.
Juniarti, Osmeli D, Yuhernita. 2009. Kandungan senyawa kimia, uji toksisitas
brine shrimp lethality test dan antioksidan 1,1-diphenyl-2-pikrilhydrazyl dari ekstrak daun saga Abrus precatorius L. Makara Sains.13(1):50-54.
[KKP] Kementrian Kelautan dan Perikanan. 2013. Laporan Tahunan Direktorat Produksi Tahun 2013 [internet]. Waktu unduh [19 November 2016]. Tersedia pada: www.djpb.kkp.go.id .
Krisnata BA, Rizka Y, Mulawarmanti D. 2014. Daya hambat ekstrak daun mangrove (Avicennia marina) terhadap pertumbuhan bakteri Mixed periodontopatogen. Jurnal Kedokteran Gigi. 8(1):22-25.
Kusdarwati R, Ludira S, Akhmad TM. 2010. Daya antibakteri ekstrak buah adas (Foeniculum vulgare) terhadap bakteri Micrococcus luteus secara in vitro.
Jurnal Ilmiah Perikanan dan Kelautan. 2(1):32-41.
Kusumaningsih A. 2007. Profil dan gen resistensi antimikroba Salmonella enteritidis asal ayam, telur dan manusia [disertasi]. Bogor (ID): Institut Pertanian Bogor. 113 hlm.
Loganayaki N, Rajendrakumaran D, Manian S. 2010. Antioxidant capacity and phenolic content of different solvent extracts from banana (Musa paradisiaca) and mustai Rivea hypocrateriformis. Food Sci Biotechnol. 19:1251-1258.
Li H, Parisi MG, Toubiana M, Cammarata M, Roch P. 2008. Lysozyme Gene expression and hematocyte behaviour in the Mediterranean mussel, Mytilus galloprovincialis, after injection of various bacteria or temperatur stresses.
Fish & Shellfish Immunology. 25(1-2):143-152.
Lidiawati E. 2014. Efektivitas perendaman ikan lele (Clarias sp.) pada ekstrak batang pisang Ambon (Musa paradisiaca) yang diinfeksi bakteri
Aeromonas hydrophila [skripsi]. Bogor (ID): Institut Pertanian Bogor. 21 hlm.
Lukistyowati I, Kurniasih. 2011. Kelangsungan hidup ikan mas (Cyprinus carpio
L) yang diberi pakan ekstrak bawang putih (Allium sativum) dan diinfeksi
Aeromonas hydrophila. Jurnal Perikanan & Kelautan. 16(1):144-160. Lukistyowati I. 2012. Studi efektifitas sambiloto (Andrographis paniculata Ness)
untuk mencegah penyakit edwardsiellosis pada ikan patin (Pangasius hypopthalmus). Berkala perikanan Terubuk. 40(2):56-74.
21 MacFaddin JF. 1980. Biochemical Tests for Identification of Medical Bacteria.
Philadelphia (US): Lippincott Williams & Wilkins. pp:912.
Maqsood S, Samoon MH, Singh P. 2009. Immunomodulatory and growth promoting effect of dietary levamisole in (Cyprinus carpio) fingerlings against the challenge of Aeromonas hydrophila. Turkish Journal of Fisheries & Aquatic Sciences. 9:111-120.
Mones RA. 2008. Gambaran darah pada ikan mas (Cyprinus carpio) strain majalaya yang berasal dari daerah Ciampea Bogor [skripsi]. Bogor (ID): Institut Pertanian Bogor. 23 hlm.
Nitis IM. 1999. Non-conventional roughages in tropical and subtropical Asian-Australian Countries. In: Nitis IM, Shin HT, editor. Management of Feed Resources and Animal Waste for Sustainable Animal Production in Asia-Pasific Region Beyond 2.000 and Pre-Conference Symposia; 1998 June 28; Seoul, Korea. Bali (ID): Asian-australia Journal Animal Sciences. hlm 449-459.
Nuryati S, Maswan NA, Alimuddin, Sukenda, Sumantadinata K, Pasaribu FH, Soejoedono RD, Santika A. 2010. Gambaran darah ikan mas setelah divaksinasi dengan vaksin DNA dan diuji tantang dengan koi herpesvirus.
Jurnal Akuakultur Indonesia. 9(1):9-15.
Prasetyo BF. 2008. Aktivitas dan uji stabilitas sediaan gel ekstrak batang pisang ambon (Musa paradisiaca var sapientum) dalam proses persembuhan luka pada mencit (Mus musculus albinus) [tesis]. Bogor (ID): Institut Pertanian Linn.var uter)pascapanen dengan proses soda [skripsi]. Yogyakarta (ID): Universitas Gadjah Mada.
Rairakhwada, Dina, Pal AK, Bhathena ZP, Sahu NP, Jha A, Mukherjee SC. 2007. Dietary microbial levan enhances cellular non-specific immunity and survival of common carp (Cyprinus carpio) juveniles. Fish & Shellfish Immunology. 22:477-486.
Reed MJ, Muench M. 1938. A simple method for estimating fifty percent endpoints. The American Journal of Hygiene. 27(3):493-497.
[SNI] Standar Nasional Indonesia. 2000. Produksi benih ikan lele dumbo (Clarias gariepinus x C. Fuscus) kelas benih sebar. Indonesia (ID): Badan Standardisasi Nasional.
Sarono A, Nitimulyo KH, Lelono IWYB, Widodo, Thaib N, Haryani EBS, Hariyanto S, Triyanto, Ustadi, Kusumahati AN, Novianti W, Wardani, Setaningsih S. 1993. Hama dan Penyakit Ikan Karantina Golongan Bakteri.
Yogyakarta (ID): Universitas Gajah Mada. Ed ke-2.
22
Taqwa FH, Sasanti AD, Gaffar K. 2012. Kelangsungan hidup, kerja osmotik dan konsumsi oksigen pascalarva udang galah selama penurunan salinitas dengan air rawa pengencer yang ditambahkan kalium. Di dalam: Karmiadji DW, Notosudjono D, Nurzal ER, Syafarudin, Djarot I, Wicaksono H, Saufi A, editor. Membangun Sinergi Riset Nasional untuk Kemandirian Teknologi; 2012 Nov 29-30; Bandung, Indonesia. Jakarta (ID): Asdep Relevansi Program Riptek. hlm 98-102.
Wedemeyer IWT, Yasutake WT. 1977. Clinical methods for the assessment of the effect on environmental stress on fish health. Journal Fish & Wildlife Service. 89:1-17.
Taqwa FH, Sasanti AD, Gaffar K. 2012. Kelangsungan hidup, kerja osmotik dan konsumsi oksigen pascalarva udang galah selama penurunan salinitas dengan air rawa pengencer yang ditambahkan kalium. Di dalam: Karmiadji DW, Notosudjono D, Nurzal ER, Syafarudin, Djarot I, Wicaksono H, Saufi A, editor. Membangun Sinergi Riset Nasional untuk Kemandirian Teknologi; 2012 Nov 29-30; Bandung, Indonesia. Jakarta (ID): Asdep Relevansi Program Riptek. hlm 98-102.
23
24
Lampiran 1 Analisis probit (LC50-24 jam) air perasan batang pisang ambon
d
Hubungan nilai logaritma konsentrasi uji dengan presentasi mortalitas (dalam probit), merupakan fungsi linear : Y = A + Bx. Nilai LC50-24 jam
diperoleh anti log m. Nilai m merupakan nilai X pada saat kematian sebesar 50% sehingga fungsi linearnya adalah 5= a + Bx. Untuk menentukan nilai a maupun b digunakan pesamaan sebagai berikut:
Y = Nilai probit mortalitas hewan uji X = Logaritma konsentrasi uji A = Konstanta
b = Slope
m = Nilai X pada Y = 5 (nilai probit 50% mortalitas hewan uji) (Finney 1971)
25 Lampiran 2 Hasil identifikasi bakteri A. hydrophila secara uji biokimia
Parameter Isolat Murni Isolat Reisolasi
Gram - -
O/F F F
Motilitas + +
Katalase + +
Oksidase + +
Gelatin + +
Lampiran 3 Hasil identifikasi bakteri A. hydrophila menggunakan uji KIT API 20E
Tests Active ingredients Hasil
ONPG 2-nitrophenyl ßdgalactopyranoside +
ADH L-arginine +
ODC L-lysine -
CIT L-ornithine -
H2S Trisodium citrate -
URE Sodium thiosulfate -
TDA Urea -
IND L-tryptophane -
VP Sodium pyruvate -
GEL Gelatin (bovine origin) +
GLU D-glucose +
MAN D-mannitol +
INO Inositol -
SOR D-sorbitol -
RHA L-rhamnose -
SAC D-sucrose +
MEL D-melibiose +
AMY Amygdalin +
ARA Amygdalin +
26
Lampiran 4 Perhitungan nilai LD50
Kepadatan
Bakteri Mati Hidup
Akumulasi
Mati Hidup
Rasio Kematian
%
108 20 0 83 0 83/83 100
107 20 0 63 0 63/63 100
106 17 3 43 3 43/46 93.47
105 12 8 26 11 26/37 70.27
104 9 11 14 22 14/36 38.89
103 5 15 5 37 5/42 11.90
Selang proporsi = Kematian di atas 50% − 50
Kematian di atas 50% − Kematian di bawah 50% = 70.27 −50
70.27 − 38,89 = 0.64
Log negatif LD50 = Log negatif di atas 50% + selang proporsi
= -Log 105 + 0.64 = 4.36
LD50 = 104.36 cfu ml-1
LD50 = 104 cfu ml-1
Jadi bakteri A. hydrophila pada kepadatan 104 cfu ml-1 dapat membuat populasi ikan lele mati sebanyak 50% selama tujuh hari.
27 Lampiran 6 Elektroforegram dan plot kurva analisis ekspresi gen lisozim
tipe-C dan β-aktin
(a)
(b)
Keterangan :
Profil elektroforegram dan plot kurva analisis ekspresi gen lisozim tipe-C (b) dan gen β-aktin (a). Marker 1 kb DNA ladder (M); perendaman dengan air perasan batang pisang ambon konsentrasi 13 mL L-1 dan diuji tantang bakteri (B); tanpa perendaman dan diuji tantang bakteri (K+); tanpa perendaman dan tidak diuji tantang bakteri (K-); kontrol negatif (N).
28
Lampiran 8 Penyejajaran nukleotida produk PCR pada pita DNA gen lisozim tipe-C ikan lele antar perlakuan
Lampiran 9 Pembuatan preparat dan pengamatan parameter gambaran darah
Perhitungan Total Eritrosit
Total Eritrosit (TE) dihitung menggunakan metode Blaxhall dan Daisley (1973), yaitu sampel darah ikan dihisap dengan pipet yang berisi bulir pengaduk warna merah sampai skala 0.5. Selanjutnya ditambah larutan Hayem’s sampai skala 101. Darah dalam pipet diaduk dengan cara menggoyangkan pipet membentuk angka delapan selama 3−5 menit sehingga darah tercampur rata. Dua tetes pertama larutan darah dalam pipet tersebut dibuang, selanjutnya larutan darah tersebut diteteskan di atas hemasitometer yang telah diletakkan gelas penutup di atasnya.
Kadar Hemoglobin
Kadar hemoglobin diukur menurut metode sahli (Wedemeyer & Yasutake 1977) yaitu dengan mengisi tabung sahlinometer dengan larutan HCl 0,1 N sampai garis skala 10 merah, kemudian ditempatkan diantara dua tabung warna standar. Darah ikan dari tabung mikro diambil dengan pipet Sahli sebanyak 0.02 mL dan dimasukkan ke tabung Sahli, kemudian didiamkan selama tiga menit. Selanjutnya ditambahkan akuades dengan pipet tetes sedikit demi sedikit dan diaduk sampai berubah warna tepat sama dengan warna standar. Kadar hemoglobin dinyatakan dalam g dL-1 pada skala kuning.
Perhitungan Total Leukosit
29 sampai skala 0.5. Ditambahkan dengan larutan Turk’s sampai skala 11, pipet diayun membentuk angka delapan (sama dengan pengadukan untuk perhitungan jumlah sel darah merah) selama 3−5 menit sehingga darah bercampur rata. Larutan Turk’s ini bersifat asam yang akan mengakibatkan lisisnya sel darah merah sehingga tertinggal hanya sel darah putih. Dua tetes pertama larutan darah dari dalam pipet dibuang, kemudian diteteskan larutan pada Haemocytometer tipe neubaur kemudian ditutup dengan gelas penutup. Cairan akan memenuhi ruang hitung secara kapiler.
Pengamatan Aktivitas Fagositik
Aktivitas fagositik dihitung menggunakan metode Anderson dan Siwicki (1995), sebanyak 50 μL darah diambil dan dimasukkan ke dalam tabung mikro, ditambahkan 50 μL suspensi Staphylococcus aerus dalam PBS (107 sel mL-1), dihomogenkan dan diinkubasi dalam suhu ruang selama 20 menit. Membuat sediaan ulas dan dikering udarakan. Setelah itu direndam dengan metanol selama lima menit dan dikeringkan, diwarnai dengan cara direndam kedalam pewarna giemsa selama 15 menit, dicuci dengan air mengalir dan dikering udarakan. Preparat ulas diamati menggunakan mikroskop dengan pembesaran 400x untuk mengetahui aktivitas fagositik yang didasarkan pada persentase dari 100 sel fagositik yang menujukkan proses fagositosis .
Aktivitas Lisozim
Aktivitas lisozim diukur dengan metode yang digunakan oleh Hanif et al.
30
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 20 Agustus 1990, anak keempat dari empat bersaudara dari pasangan Bapak Kosasih Achyar dan Ibu Asmiati. Penulis terdaftar sebagai mahasiswa Budidaya Perairan, Fakultas Pertanian, Universitas Lampung pada tahun 2008 sampai 2013. Pada tahun 2014 penulis melanjutkan studi dengan menempuh Program Magister pada Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian yang dilakukan dalam menyelesaikan studi Magister berjudul “Efektivitas Air Perasan Batang Pisang Ambon sebagai Imunostimulan terhadap Infeksi
Aeromonas hydrophila pada Ikan Lele (Clarias gariepinus)”. Artikel yang berjudul “Efektivitas Air Perasan Batang Pisang Ambon sebagai Imunostimulan terhadap Infeksi Aeromonas hydrophila pada Ikan Lele Clarias gariepinus”