AKTIVITAS INHIBISI
α
-GLUKOSIDASE DAN
SITOTOKSISITAS EKSTRAK XANTORIZOL TEMULAWAK
(Curcuma xanthorriza Roxb.) DARI BERBAGAI DAERAH
AHMAD AJRUDDIN MUNSHIF
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Inhibisi α -Glukosidase dan Sitotoksisitas Ekstrak Xantorizol Temulawak (Curcuma xanthorriza Roxb.) dari Berbagai Daerah adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Ahmad Ajruddin Munshif
ABSTRAK
AHMAD AJRUDDIN MUNSHIF. Aktivitas Inhibisi α-Glukosidase dan Sitotoksistas Ekstrak Xantorizol Temulawak (Curcuma xanthorriza Roxb.) dari Berbagai Daerah. Dibimbing oleh WARAS NURCHOLIS dan EDY DJAUHARI.
Temulawak (Curcuma xanthorrhiza Roxb.) sudah lama dijadikan sebagai obat herbal di Indonesia. Kualitas bahan baku obat herbal temulawak pada penelitian ini dilihat dari tingginya kadar xantorizol dan bioaktivitasnya. Penelitian ini bertujuan memilih temulawak terbaik dari daerah yang berbeda (Karanganyar, Ngawi, Wonogiri, Bogor, dan Ciemas-Sukabumi) berdasarkan kandungan bioaktif (xantorizol) dan bioaktivitasnya (sitotoksisitas dan inhibisi terhadap α-glukosidase). Ekstraksi xantorizol dilakukan dengan cara maserasi. Kadar xantorizol diukur dengan menggunakan HPLC (High Performance Liquid Chromatoghraphy). Kadar xantorizol tertinggi terdapat pada temulawak asal Wonogiri dan Karanganyar dengan konsentrasi masing-masing 479.82 mg/g dan 467.25 mg/g. Temulawak asal Karanganyar mempunyai nilai LC50 sebesar sebesar 52.02 µg/mL. Temulawak asal Karanganyar mempunyai aktivitas penghambatan α-glukosidase terbaik dengan nilai IC50 sebesar 362.20 µg/mL. Temulawak asal Karanganyar berpotensi untuk dikembangkan sebagai obat herbal dengan aktivitas antidiabetes.
Kata kunci: α-glukosidase, temulawak, xantorizol
ABSTRACT
AHMAD AJRUDDIN MUNSHIF. Activity of α-Glucosidase Inhibition and Cytotoxicity Effect from Xanthorrhizol Extract Temulawak (Curcuma xanthorriza Roxb.) from Different Region. Supervised by WARAS NURCHOLIS and EDY DJAUHARI.
Temulawak (Curcuma xanthorrhiza Roxb.) has been widely used as herbal medication in Indonesian. The quality of temulawak herbal medication can be known from xanthorrhizol concentration and the bioactivity. The objectives of this research was to determine the best temulawak rhizomes from various regions (Karanganyar, Ngawi, Wonogiri, Bogor, and Ciemas-Sukabumi) based on xanthorrhizol concentration and its bioactivity (by BSLT method and its inhibitory against α-glucosidase). Extraction of xanthorrhizol was done by maceration. Xanthorrhizol concentration was measured with HPLC. The highest xanthorrhizol concentration was found at temulawak from Wonogiri and Karanganayar with values of 479.82 mg/g and 467.25 mg/g. Temulawak from Karanganyar has cytotoxicity activity with LC50 52.02 µg/mL. Temulawak from Karanganyar has the best inhibitory activity against α-glucosidase with IC50 values 362.20 µg/mL. Temulawak from Karanganyar has potential to be developed as a herbal medicine with bioactivity as antidiabetic.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS INHIBISI
α
-GLUKOSIDASE DAN
SITOTOKSISITAS EKSTRAK XANTORIZOL TEMULAWAK
(Curcuma xanthorriza Roxb.) DARI BERBAGAI DAERAH
AHMAD AJRUDDIN MUNSHIF
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi :Aktivitas Inhibisi α-Glukosidase dan Sitotoksistas Ekstrak Xantorizol Temulawak (Curcuma xanthorriza Roxb.) dari Berbagai Daerah
Nama : Ahmad Ajruddin Munshif NIM : G84100018
Disetujui oleh
Waras Nurcholis, SSi, MSi Pembimbing I
Drs Edy Djauhari PK, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji syukur penulis ucapkan pada Allah SWT, pencipta semesta alam yang telah mencurahkan nikmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih ialah mengenai antidiabetes dengan judul Aktivitas Inhibisi α-Glukosidase dan Sitotoksistas Ekstrak Xantorizol Temulawak (Curcuma xanthorriza Roxb.) dari Berbagai Daerah. Penelitian ini dilaksanakan pada bulan Januari 2014 hingga bulan Mei 2014 di Laboratorium Pusat Studi Biofarmaka, Taman Kencana, Bogor.
Terima kasih penulis ucapkan pada Bapak Waras Nurcholis, SSi, MSi dan Bapak Drs Edy Djauhari PK, MSi atas bimbingan, arahan, kritik, dan sarannya dalam penulisan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada kedua orang tua penulis yang telah memberikan motivasi dan semangat selama penulisan karya ilmiah. Tidak lupa penulis juga mengucapkan terima kasih kepada seluruh staf laboratorium Pusat Studi Biofarmaka dan teman-teman biokimia 47 yang telah membantu dalam menyelesaikan penelitian ini.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk memperbaiki tulisan ini. Atas kritik dan saran yang diberikan, penulis ucapkan terima kasih. Semoga tulisan ini dapat bermanfaat baik bagi penulis maupun pembaca.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE PENELITIAN 2
Alat 2
Bahan 2
Prosedur Penelitian 2
HASIL 4
PEMBAHASAN 7
Rendemen Ekstrak Temulawak 7
Konsentrasi Xantorizol Ekstrak Temulawak 8
Sitotoksisitas Ekstrak Temulawak 9
Aktivitas Inhibisi Ekstrak Temulawak terhadap α-Glukosidase 9
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Kadar air simplisia temulawak 4
2 Rendemen ekstrak temulawak 5
3 Konsetrasi xantorizol ekstrak temulawak 5
4 Nilai LC50 ekstrak temulawak berdasarkan uji BSLT 6
5 Nilai IC50 ekstrak temulawak 7
7 Hubungan konsentrasi acarboseterhadap inhibisi α-glukosidase 27
DAFTAR LAMPIRAN
1 Gambaran umum penelitian 15
2 Kadar air simplisia 16
3 Rendemen ekstrak temulawak 16
4 Profil kromatogram standar xantorizol 200 ppm 17
5 Profil kromatogram temulawak asal Ciemas 18
6 Profil kromatogram temulawak asal Bogor 19
7 Profil kromatogram temulawak asal Wonogiri 20
8 Profil kromatogram temulawak asal Ngawi 21
9 Profil kromatogram temulawak asal Karanganyar 22
10 Konsentrasi xantorizol ekstrak temulawak 23
11 Sitotoksisitas ekstrak temulawak dengan metode BSLT 23 12 Nilai inhibisi ekstrak temulawak terhadap α-glukosidase 24 13 Grafik pengaruh konsentrasi ekstrak temulawak terhadap % inhibisi α
-glukosidase 25
14 Nilai IC50 ekstrak temulawak 26
15 Nilai inhibisi acarbose(glucobay®) terhadap α-glukosidase 27 16 Uji korelasi antara konsentrasi ekstrak temulawak dengan % inhibisi α
PENDAHULUAN
Diabetes melitus atau kencing manis merupakan penyakit yang ditandai dengan tingginya kandungan glukosa dalam darah. Berdasarkan data dari
International Diabetes Federation (IDF), penderita diabetes di Indonesia pada tahun 2013 adalah 8.5 juta orang, sementara diperkirakan pada tahun 2020 nanti penderita diabetes di Indonesia akan meningkat menjadi 12 juta orang. Jika penyakit diabetes dibiarkan terlalu lama, maka akan menjadi semakin parah dan muncul penyakit komplikasi lainnya. Komplikasi jangka panjang yang mungkin terjadi akibat diabetes antara lain ketoasidosis, hiperosmolaritas, gagal ginjal, kerusakan mata, komplikasi syaraf, dan gangguan sirkulasi periferal (Burroughs et al. 2007).
Akhir-akhir ini, banyak upaya yang dilakukan untuk mengobati penyakit diabetes. Salah satunya ialah dengan mengkonsumsi obat hipoglikemia oral. Namun, penggunaan obat sintetik dapat menyebabkan efek samping yang merugikan jika dikonsumsi tidak sesuai dosis yang dianjurkan. Salah satu obat hipoglikemia oral yang biasa digunakan ialah acarbose. Efek samping yang sering dikeluhkan ketika mengkonsumsi acarbose ialah diare dan produksi gas yang berlebih di dalam perut (Chiasson et al. 2002). Efek samping yang ditimbulkan dari obat sintetik inilah yang menyebabkan masyarakat untuk memilih menggunakan obat tradisional sebagai obat alternatif.
Temulawak telah lama digunakan oleh masyarakat sebagai obat tradisional. Berdasarkan beberapa penelitian yang pernah dilakukan, temulawak mempunyai banyak khasiat antara lain sebagai hepatoproteksi, antiinflamasi, antimikroba, antihiperlipidemia, dan pencegah kolera (Hwang 2006). Banyaknya manfaat temulawak ini disebabkan oleh rimpang temulawak yang mempunyai komponen utama yang berkhasiat. Beberapa penelitian menunjukkan bahwa komponen aktif utama dalam minyak atsiri temulawak yang juga merupakan senyawa khas dari rimpang temulawak adalah xantorizol. Xantorizol pada temulawak berpotensi sebagai antibakteri terhadap Streptococcus mutans
(Rukayadi & Hwang 2006), sebagai anticandida (Rukayadi et al. 2006), sebagai antiinflamasi (Lee 2002), dan sebagai neuroproteksi (Lim 2005).
2
inhibisi terhadap α-glukosidase). Penelitian ini diharapkan juga dapat memberi informasi terkait manfaat manfaat xantorizol temulawak sebagai obat herbal penyakit diabetes melitus.
METODE PENELITIAN
Alat
Alat-alat yang digunakan adalah oven, cawan porselen, neraca analitik, pipet volumetrik, gelas piala, labu Erlenmeyer, kertas saring Whatman, rotavapor, corong pisah, sonikator, pH meter, labu takar, sudip, corong, HPLC merk Shimadzu, microplate reader, plate sampel, pipet mikro, tip, bulb, multipipet, inkubator.
Bahan
Bahan-bahan yang digunakan adalah simplisia rimpang temulawak yang berasal dari Karanganyar, Ciemas, Ngawi, Wonogiri, dan Bogor, kertas saring, metanol 75%, akuades, etil asetat, DMSO, air laut, Artemia salina, etanol 96%, H3PO4, Na2CO3, KH2PO4, K2HPO4, air deionisasi, substrat p-NPG, α-glukosidase, tablet acarbose, dan HCl 2 N.
Prosedur Penelitian
Pengukuran Kadar Air
Penentuan kadar air dilakukan dengan metode AOAC (2005). Cuplikan simplisia ditimbang dengan bobot 3 g pada sebuah cawan yang sudah diketahui bobotnya. Cawan yang berisi simplisia dikeringkan pada oven 105 0C selama 3 jam. Selanjutnya, cawan tersebut didinginkan dalam eksikator. Cawan yang berisi simplisia kemudian ditimbang. Pekerjaan ini dilakukan hingga diperoleh bobot yang tetap. Pengukuran kadar air dilakukan sebanyak 3 kali ulangan.
Kadar air = –
x 100%
Ekstraksi Xantorizol
3 asetat (1:1). Fraksi etil asetat kemudian dipisahkan dengan corong pisah dan diuapkan dengan penguap vakum hingga menghasilkan ekstrak kental.
Pengukuran Konsentrasi Xantorizol dengan HPLC (High Performance Liquid Chromatography)
Pengukuran konsentrasi xantorizol dilakukan dengan mengacu pada metode Asriani (2010). Sebanyak 0.05 g ekstrak ditimbang dan dilarutkan ke dalam 25 mL etanol 96%. Larutan disaring dengan kertas saring 0.45 μm, kemudian dimasukkan ke dalam vial HPLC. Sebanyak 20 µL larutan diinjeksikan ke dalam kolom HPLC. Standar xantorizol dibuat dengan konsentrasi 200 μg/mL. Sistem HPLC yang digunakan ialah kolom C18, detektor UV-Vis, eluen H3PO4, dan suhu kolom 40 °C. Pengukuran kadar xantorizol dilakukan sebanyak 2 kali. Perhitungan kadar xantorizol sampel didasarkan dari standar xantorizol.
Rumus perhitungan xantorizol: [inject] (μg/mL) =
x [standar]
Konsentrasi xantorizol = [ ]
Uji Sitotoksisitas dengan metode BSLT (Brine Shrimp Lethality Test)
Uji sitotoksisitas dilakukan dengan mengunakan metode Meyer (1982). Telur udang Artemia salina Leach dimasukkan kedalam sebuah wadah yang telah diberi air laut, lalu didiamkan selama 2 x 24 jam hari hingga tumbuh menjadi larva. Ekstrak temulawak dibuat dalam beberapa konsentrasi melalui pengenceran bertingkat, yaitu 200, 100, 50, 10 µg/mL. Semua konsentrasi tersebut dibuat sebanyak 3 kali ulangan. Pemanenan larva dilakukan secara hati-hati, yaitu larva dimasukkan ke dalam plate sebanyak masing-masing sepuluh ekor dengan menggunakan pipet. Larva udang didiamkan selama satu hari. Jumlah larva udang yang mati dihitung menggunakan kaca pembesar. Nilai LC50 ditentukan dengan menggunakan analisis dengan probit program SPSS.
Uji Inhibisi α-Glukosidase
Pengujian inhibisi α-glukosidase dilakukan dengan modifikasi metode Mayur et al. (2010). Larutan enzim dibuat dengan melarutkan 1.0 mg α -glukosidase dalam larutan bufer fosfat (pH 7) yang mengandung 200 mg bovine serum albumin (BSA). Larutan enzim kemudian diencerkan 25 kali dengan bufer fosfat (pH 7). Campuran reaksi sampel terdiri atas 25 μL p-NPG 10 mM, 50 μL bufer fosfat (pH 7) 100 mM, dan 10 μL larutan ekstrak dalam DMSO. Selanjutnya campuran tersebut ditambahkan larutan enzim sebanyak 25 μL dan diinkubasi selama 30 menit di ruang gelap. Setelah itu reaksi enzim dihentikan dengan menambahkan Na2CO3 200 mM sebanyak 100 μL. Selanjutnya larutan diukur dengan microplate reader pada panjang gelombang 410 nm.
4
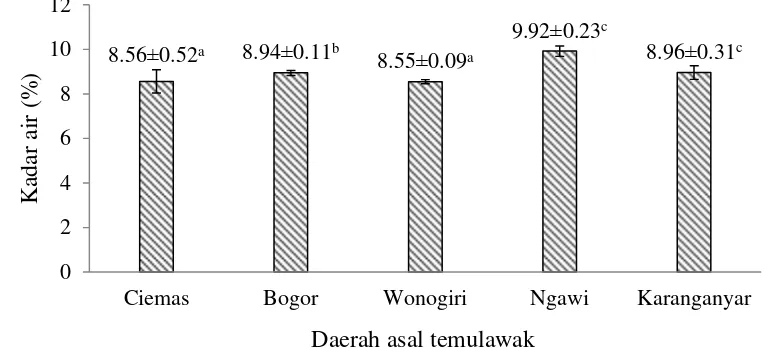
nm. Percobaan dilakukan sebanyak tiga kali ulangan dan dihitung dalam inhibisi dengan rumus: 9.92%. kadar air tertingi terdapat pada temulawak asal Ngawi sebesar 9.92% dan kadar air terendah terdapat pada temulawak asal Wonogiri sebesar 8.55%. Hasil uji statistik menunjukkan bahwa kadar air temulawak asal Ciemas dan Wonogiri berbeda nyata dengan temulawak asal Ngawi dan Karanganyar, sedangkan temulawak asal Bogor memiliki nilai kadar air yang berbeda nyata dengan sampel temulawak lain.
Gambar 1 Kadar air simplisia temulawak
Keterangan: Angka-angka pada grafik yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% berdasarkan uji perbandingan berganda Duncan
Hasil pengukuran rendemen ekstrak temulawak yang berasal dari Wonogiri, Ciemas, Ngawi, Bogor, dan Karanganyar dapat dilihat pada Gambar 2. Rendemen ekstrak dari seluruh sampel berkisar antara 8.24-13.13%. Rendemen tertinggi dimiliki oleh temulawak asal Bogor sebesar 13.13% dan rendemen terendah dimiliki oleh temulawak asal Karanganyar sebesar 8.24%. Nilai rendemen ekstrak yang tinggi menunjukkan semakin banyak kandungan senyawa yang terekstrak dalam sampel.
5
Gambar 2 Rendemen ekstrak temulawak
Konsentrasi Xantorizol Ekstrak Temulawak
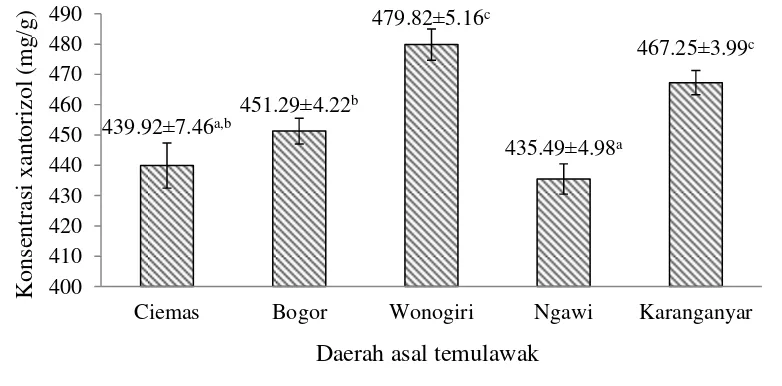
Hasil pengukuran konsentrasi xantorizol ekstrak temulawak yang berasal dari Wonogiri, Ciemas, Ngawi, Bogor, dan Karanganyar dapat dilihat pada Gambar 3. Konsentrasi xantorizol tertinggi terdapat pada temulawak asal Wonogiri sebesar 479.82 mg/g. Konsentrasi xantorizol terendah terdapat pada temulawak asal Ngawi sebesar 435.49 mg/g. Konsentrasi xantorizol ekstrak temulawak asal Wonogiri dan Karanganyar berbeda nyata dengan temulawak asal Ciemas, Bogor, dan Ngawi berdasarkan uji perbandingan berganda Duncan pada taraf uji 5%. Konsentrasi temulawak asal Bogor berbeda nyata dengan temulawak asal Ngawi berdasarkan uji statistik pada taraf uji 5%.
Gambar 3 Konsentrasi xantorizol ekstrak temulawak
Keterangan: Angka-angka pada grafik yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% berdasarkan uji perbandingan berganda Duncan
6
Sitotoksisitas Ekstrak Temulawak
Uji sitotoksisitas ekstrak temulawak dilakukan dengan metode BSLT (Brine Shrimp Lethality Test). Hasil yang diperoleh dihitung sebagai nilai LC50 (letha1
concentration) yang menunjukkan jumlah dosis atau konsentrasi ekstrak uji yang dapat menyebabkan kematian larva udang sejumlah 50%. Nilai LC50 yang rendah menunjukkan tingkat sitotoksisitas yang tinggi dalam membunuh larva udang. Nilai sitotoksisitas tertinggi terdapat pada temulawak asal Wonogiri dengan nilai LC50 sebesar 32.56 µg/mL dan sitotoksisitas terendah terdapat pada temulawak asal Bogor dengan nilai LC50 sebesar 58.11 µg/mL. Hasil uji perbandingan berganda Duncan pada taraf uji 5% menunjukkan bahwa nilai LC50 temulawak asal Bogor dan Karanganyar berbeda nyata dengan temulawak asal Wonogiri dan Ngawi, sedangkan temulawak asal Ciemas tidak berbeda nyata dengan temulawak lainnya.
Gambar 4 Nilai LC50 ekstrak temulawak berdasarkan uji BSLT
Keterangan: Angka-angka pada grafik yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% berdasarkan uji perbandingan berganda Duncan
Aktivitas Inhibisi Ekstrak Temulawak terhadap α-Glukosidase
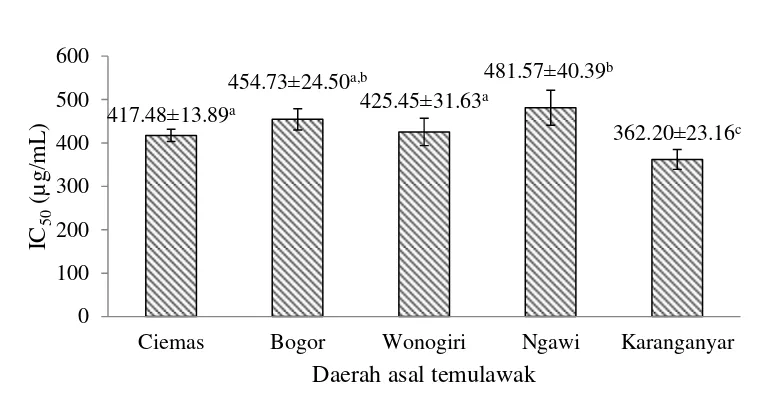
Aktivitas inhibisi ekstrak temulawak terhadap α-glukosidase dihitung sebagai nilai IC50. Hasil pengukuran nilai IC50 ekstrak temulawak terhadap enzim α-glukosidase dapat dilihat pada Gambar 5. Nilai IC50 dari seluruh ekstrak temulawak berkisar 362.20 – 481.57 µg/mL. Nilai IC50 yang rendah menunjukkan bioaktivitas yang tinggi dalam menghambat α-glukosidase. Aktivitas inhibisi tertinggi terdapat pada temulawak asal Karanganyar dengan nilai IC50 sebesar 362.20 µg/mL dan aktivitas inhibisi terendah terdapat pada temulawak asal Ngawi dengan nilai IC50 sebesar 481.57 µg/mL. Hasil uji statistik pada taraf uji 5% menujukkan bahwa nilai IC50 temulawak asal Karanganyar berbeda nyata dengan temulawak lainnya, temulawak asal Ciemas dan Wonogiri berbeda nyata dengan temulawak asal Ngawi, sedangkan temulawak asal Bogor tidak berbeda nyata dengan temulawak asal Cemas, Wonogiri, dan Ngawi.
7
Gambar 5 Nilai IC50 ekstrak temulawak
Keterangan: Angka-angka pada grafik yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5 % berdasarkan uji perbandingan berganda Duncan
PEMBAHASAN
Rendemen Ekstrak Temulawak
Rimpang temulawak yang digunakan dalam penelitian ini berasal dari daerah yang berbeda. Daerah asal kelima sampel temulawak yang diuji ialah Ciemas-Sukabumi, Bogor dengan varietas yang telah dikembangkan oleh Balitro (Balai Penelitian Tanaman Obat dan Aromatik), Wonogiri, Ngawi, dan Karanganyar. Daerah tersebut merupakan daerah penghasil temulawak di provinsi Jawa Barat dan Jawa Tengah. Jawa Tengah merupakan salah satu provinsi penghasil utama temulawak dengan produksi mencapai 5747 ton pada tahun 2007 (Deptan 2009). Kelima sampel rimpang temulawak kemudian dipanen pada usia siap panen yaitu sekitar 9-10 bulan. Usia panen temulawak mempengaruhi kadar pati, kadar serat, dan kadar minyak atsiri yang terdapat di dalam temulawak. Temulawak dengan umur panen 9 bulan mempunyai kadar minyak atsiri sebesar 8.76% (Yulius et al. 2009).
Rimpang temulawak yang telah dipanen kemudian dikeringkan dan digiling untuk dijadikan serbuk. Pengeringan rimpang temulawak dilakukan untuk mencegah pertumbuhan kapang dan aktivitas enzim sehingga bahan lebih awet dan kandungan zat aktifnya tidak berkurang (Katno et al. 2008). Serbuk simplisia temulawak yang telah kering kemudian diukur kadar airnya. Berdasarkan hasil pengukuran, kadar air rimpang temulawak yang diuji berkisar antara 8.55% - 9.92% (Gambar 1). Kadar air hasil penelitian ini sudah sesuai dengan standar mutu simplisia yaitu dibawah 10% (Katno et al. 2008). Kadar air yang rendah pada serbuk simplisia temulawak ini menjadikan umur simpan serbuk simplisia temulawak lebih lama karena terhindar dari kontaminasi mikroba (Winarno 1997).
8
Kadar air temulawak yang diperoleh digunakan untuk mengetahui bobot temulawak kering sehingga rendemen ekstrak temulawaknya dapat diketahui.
Metode ekstraksi yang dilakukan ialah dengan cara maserasi. Maserasi merupakan proses perendaman sampel dengan pelarut organik yang digunakan pada suhu ruangan. Proses ini sangat menguntungkan dalam isolasi senyawa bahan alam karena dengan perendaman sampel tumbuhan akan terjadi pemecahan dinding dan membran sel akibat perbedaan tekanan antara dalam dan luar sel sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut organik (Lenny & Zuhra 2005).
Pelarut awal yang digunakan untuk ekstraksi pada penelitian ini ialah metanol. Metanol hampir dapat mengekstraksi semua senyawa pada jaringan tumbuhan (Harborne 1987). Maserasi 25 gram kelima simplisia temulawak dengan metanol 75% menghasilkan ekstrak kasar metanol sebanyak 18.13% - 29.52% (Lampiran 3). Ekstrak kasar metanol kemudian dipartisi dengan pelarut air:etil asetat (1:1) dan diperoleh rendemen ekstrak temulawak sebanyak 8.24 - 13.13% (Gambar 2). Penggunaan etil asetat sebagai pelarut bertujuan memisahkan senyawa polar karena xantorizol bersifat lebih nonpolar. Hwang et al. (2000) berhasil mengekstraksi xantorizol dalam fraksi etil asetat dengan rendemen sebesar 4.8%. Perbedaan hasil rendemen ini dapat dipengaruhi oleh waktu ekstraksi dan kehalusan bahan. Menurut Heath & Reineocius (1986), semakin kecil ukuran bahan yang digunakan maka semakin luas bidang kontak antara bahan dengan pelarut dan semakin besar kecepatan mencapai kesetimbangan sistem. Ukuran bahan yang sesuai akan menjadikan proses ekstraksi berlangsung dengan baik dan tidak memakan waktu lama.
Konsentrasi Xantorizol Ekstrak Temulawak
9
Sitotoksisitas Ekstrak Temulawak
Uji sitotoksisitas ekstrak temulawak dilakukan dengan menggunakan metode BSLT (Brine Shrimp Lethality Test). Metode ini ditujukan terhadap tingkat mortalitas larva udang Artemia salina L. yang disebabkan olehekstrak uji. Metode ini sering digunakan untuk skrining awal terhadap senyawa aktif yang terkandung di dalam ekstrak tanaman karena murah, cepat, mudah (tidak perlu kondisi aseptis) dan dapat dipercaya (Meyer 1982). Hasil uji dari metode BSLT dapat digunakan untuk menduga kemampuan bahan yang diuji untuk membunuh sel kanker, hama penyakit, dan untuk menduga efek farmakologi bahan. Hasil yang diperoleh dari metode ini dihitung sebagai nilai LC50 (leta1 concentration) yang menunjukkan jumlah dosis atau konsentrasi ekstrak uji yang dapat menyebabkan kematian larva udang sejumlah 50% setelah masa inkubasi 24 jam. Senyawa yang aktif akan menghasilkan mortalitas yang tinggi (Meyer 1982).
Tingkat toksisitas suatu bahan alam seperti temulawak erat kaitannya dengan senyawa aktif yang terkandung di dalam bahan tersebut. Hal ini dapat terlihat dari temulawak asal Wonogiri yang mempunyai senyawa aktif berupa xantorizol dengan kadar tertinggi diantara kelima sampel lainnya dan mempunyai nilai toksisitas yang tinggi pula. Hal berbeda terjadi pada temulawak asal Ngawi. Temulawak asal Ngawi mempunyai kadar xantorizol terendah tetapi mempunyai nilai toksistas yang tidak jauh berbeda dengan nilai sitotoksisitas temulawak asal Wonogiri. Nilai toksisitas yang tidak jauh berbeda ini dapat disebabkan oleh pemisahan senyawa aktif yang kurang sempurna sehingga masih terdapat senyawa aktif lain selain xantorizol di dalam ekstrak temulawak yang dapat mempengaruhi hasil uji sitotoksisitas dengan metode BSLT. Salah satu senyawa aktif lain yang terdapat di dalam temulawak ialah kurkuminoid. Kurkuminoid yang terdapat pada rimpang temulawak sendiri terdiri atas 2 komponen, yaitu kurkumin dan desmetoksisikurkumin (Sidik et al. 1992). Menurut Nurcholis (2008), kadar kurkumin di dalam temulawak dapat mencapai 0.06 gram per tanaman temulawak. Kurkuminoid dalam temulawak berkhasiat sebagai antioksidan, antikarsinogenik, dan antihiperkolesterolemia (Peschel et al. 2006). Menurut Meyer (1982), senyawa dengan LC50 < 1000 μg/mL (1000 ppm) dapat dianggap sebagai suatu senyawa aktif. Nilai LC50 kelima sampel temulawak yang diuji dibawah 60 µg/mL (Gambar 4). Hal ini menunjukkan bahwa kelima sampel yang diuji berpotensi mengandung senyawa bioaktif karena dapat menyebabkan 50% kematian larva udang dengan konsentrasi yang rendah (LC50 < 1000 μg/mL).
Aktivitas Inhibisi Ekstrak Temulawak terhadap α-Glukosidase
10
mempunyai kemampuan untuk menghambat α-glukosidase ditunjukan dengan berkurangnya p-nitrofenol. Aktivitas penghambatan enzim diukur berdasarkan hasil absorbansi p-nitrofenol yang berwarna kuning (Sutedja 2003).
Acarbose merupakan salah satu obat yang sering dipakai sebagai inhibitor α-glukosidase. Acarbose bekerja dengan cara menginhibisi secara reversibel kompetitif terhadap α-glukosidase. Inhibisi terhadap α-glukosidase dengan menggunakan acarbose secara efektif dapat mengurangi digesti karbohidrat kompleks dan absorpsinya sehingga pada pasien diabetes dapat mengurangi peningkatan kadar glukosa postprandial. Acarbose tidak merangsang sekresi insulin oleh sel-sel ß-langerhans kelenjar pankreas. Oleh sebab itu, acarbose tidak menyebabkan hipoglikemia (Sugiwati 2005).
Aktivitas penghambatan kelima sampel temulawak dari berbagai daerah terhadap α-glukosidase pada uji ini dilihat berdasarkan nilai IC50. Nilai IC50 yang semakin rendah menunjukkan bahwa sampel tersebut mempunyai aktvitas penghambatan yang baik. Nilai IC50 kelima sampel yang diuji lebih besar dibandingkan acarbose (glucobay®) yang digunakan sebagai pembanding. Nilai IC50 acarbose ialah 1.11 x 10-4 µg/mL (Lampiran 15). Aktivitas inhibisi α -glukosidase kelima sampel temulawak yang lebih rendah dibandingkan dengan
acarbose ini dapat disebabkan oleh kurang terpisah dengan baik senyawa aktif yang terdapat pada temulawak. Asriani (2010) berhasil memisahkan xantorizol dari temulawak dengan kemurnian mencapai 99.5%. Proses ekstraksi xantorizol yang dilakukan oleh Asriani (2010) meliputi proses maserasi, asetilasi, pemisahan dengan kromatografi lapis tipis, dan deasetilasi.
Temulawak asal Karanganyar mempunyai aktivitas penghambatan terbaik dibandingkan dengan sampel temulawak lainnya. Temulawak asal Karanganyar ini mempunyai kadar xantorizol yang sama dengan kadar xantorizol temulawak asal Wonogiri berdasarkan uji perbandingan berganda Duncan (Gambar 3). Aktivitas penghambatan terhadap α-glukosidase pada sampel temulawak asal Karanganyar dapat disebabkan oleh kandungan xantorizol yang terdapat di dalam sampel tersebut. Xantorizol diperkirakan dapat menghambat α-glukosidase karena mempunyai struktur terpena pada senyawanya. Hasil penelitian Kim et al. (2006) menunjukkan bahwa gugus lavandulyl yang termasuk terpena pada tanaman
Sophora flavescens dapat menghambat aktivitas α-glukosidase. Senyawa flavonoid terlavandulilasi yang berhasil diisolasi oleh Kim et al. (2006) mampu menghambat α-glukosidase secara nonkompetitif. Penghambatan secara nonkompetitif terjadi ketika inhibitor membentuk kompleks enzim inhibitor pada tempat yang bukan sisi aktif enzim. Inhibitor nonkompetitif menyebabkan adanya perubahan struktur enzim sehingga substrat tidak dapat berikatan dengan enzim (Harvey & Ferrier 2011).
11 Kim et al. (2000) berhasil mengisolasi luteolin dari tanaman Lonicera japonica. Luteolin tersebut dapat menghambat aktivitas α-glukosidase dengan nilai IC50 berkisar 0.5 – 1.0 mg/mL (500 - 1000 µg/mL). Nilai IC50 semua sampel temulawak yang diuji menunjukan aktivitas penghambatan yang lebih tinggi dibandingkan dengan senyawa luteolin dari Lonicera japonica yang berhasil diekstrasi oleh Kim et al. (2000). Hal ini menunjukkan bahwa kelima sampel temulawak dapat berpotensi sebagai obat antidiabetes dibandingkan dengan
Lonicera japonica. Hal ini didukung pula berdasarkan uji korelasi antara konsentrasi ekstrak temulawak dengan % inhibisi α-glukosidase menggunakan program SPSS 16 yang menunjukkan adanya korelasi pada taraf nyata 1% (Lampiran 16). Berdasarkan hasil uji korelasi tersebut, nilai penghambatan α -glukosidase berbanding lurus dengan konsentrasi ekstrak temulawak yang diuji.
SIMPULAN DAN SARAN
Simpulan
Sampel temulawak terbaik berdasarkan kandungan bioaktif (xantorizol) dan bioaktivitas (sitotoksisitas dan inhibisi terhadap α-glukosidase) adalah temulawak asal Karanganyar. Temulawak asal Karanganyar mempunyai konsentrasi xantorizol sebesar 467.25 mg/g. Temulawak asal Karanganyar mempunyai nilai LC50 (sitotoksisitas) dan IC50 (inhibisi terhadap α-glukosidase) masing-masing sebesar 52.02 µg/mL dan 362.20 µg/mL. Temulawak asal Karanganyar berpotensi untuk dikembangkan sebagai obat herbal dengan bioaktivitas sebagai antidiabetes.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai senyawa lain di dalam temulawak yang mempunyai aktivitas inhibisi terhadap α-glukosidase. Temulawak asal Karanganyar memiliki potensi untuk diteliti lebih lanjut dan dikembangkan sebagai varietas baru.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method Of Analysis Of The Association Analytical Of Chemist. Arlington (US): The Association of Official Analysis Chemist, Inc.
Asriani D. 2010. Isolasi xantorizol dari temulawak terpilih berdasarkan nomor harapan [tesis]. Bogor (ID): Institut Pertanian Bogor.
12
Burroughs TE, Swindle J, Takemoto S, Lentine KL, Machnicki G, Irish WD, Brennan DC, Schnitzler MA. 2007. Diabetic complications associated with new-onset diabetes mellitus in renal transplant recipients. Transplantation
83(8):1027-1034.
Chiasson JL, Josse RG, Gomis R, Hanefeld M, Karasik A, Laakso M. 2002. Acarbose for prevention of type 2 diabetes mellitus: the STOP-NIDDM randomised trial. The Lancet359(9323):2072–2077.
[Deptan] Departemen Pertanian. 2009. Database Hortikultura: Daerah Penghasil Utama Hortikultura. Jakarta (ID): Deptan.
Du ZY, Liu RR, Shao WY, Mao XP, Ma L, Gu LQ, Huang ZS, Chan AS. 2006. Alpha-glucosidase inhibition of natural curcuminoids and curcumin analogs. Eur J Med Chem 41(2):213-218.
Harborne JB. 1997. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. K. Padmawinata K, Soediro I, Penerjemah; Nikosolihin S, Editor. Bandung (ID): Penerbit ITB. Terjemahan dari: Phytochemical Methods. Harvey RA, Ferrier DR. 2011. Lippincott’s Illustrated Reviews: Biochemistry. 5th
Edition. New York (US): Lippincott Williams & Wilkins.
Hwang JK. 2006. Xanthorrizol: A New Bioactive Natural Compound. Yonsei (KR): Yonsei University.
Hwang JK, Shim JS, Pyun YR. 2000. Antibacterial activity of xanthorrhizol from curcuma xanthorrhiza against oral pathogens. Fitoterapia. 71:321-323.
Heath HB, Reineocius G. 1986. Flavor Chemistry and Technology. Westport (US): The Avi Publishing Co. Inc.
Katno, Kusumadewi AW. Sutjipto. 2008. Pengaruh waktu pengeringan terhadap kadar tanin daun jati belanda (Guazuma ulmifolia Lamk.). J Tumb Obat Indones. 1(1):38-46.
Khaerana. 2007. Pengaruh cekaman kekeringan dan umur panen yang berbeda terhadap kandungan xanthorrhizol tanaman temulawak (Curcuma xanthorrhiza Roxb.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Kim JS, Kwon CS, Son KH. 2000. Inhibition of alpha-glucosidase and amylase by luteolin, a flavonoid. Biosci Biotechnol Biochem. 64(11):2458-2461.
Kim JH, Ryu YB, Kang NS, Lee BW, Heo JS, Jeong IY, Park KH. 2006. Glycosidase inhibitory flavonoids from Sophora flavescens. Biol Pharm Bull.
29(2):302-305.
Lee SK. 2002. Supressive Effect Of Natural Sesquiterpenoids On Inducible Cyclooxigenase (Cox-2) And Nitric Oxide Syntase (Inos) Activity In Mouse Macrofaphage Cells. Environ Pathol Toxicol Oncol 21:141-148.
Lenny S, Zuhra CF. 2005. Isolasi dan uji bioaktivitas kandungan kimia utama puding merah dengan metode uji brine shrimp. J Kom Pen. 17(5).
13 Mayur B, Sandesh S, Shruti S, Seo SY. 2010. Antioxidant and α-glucosidase inhibitory properties of Carpesium abrotanoides L. J Medicinal Plant Research 4(15):1547-1553.
Meyer HN. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Medica. 45:32-33.
Nurcholis W. 2008. Profil senyawa penciri dan bioaktivitas tanaman temulawak pada agrobiofisik berbeda [tesis]. Bogor (ID): Institut Pertanian Bogor. Peschel D, Koerting R, Nass N. 2006. Curcumin induces changes in expression of
genes involved in cholesterol homeostasis. J Nutr Biochem. 18:113–119. Rukayadi Y, Hwang JK. 2006. In vitro activity of xanthorrhizol against
Streptococcus mutans biofilm. Appl Microbiol. 42:400-404.
Rukayadi Y, Yong D, Hwang JK. 2006. In vitro anticandidal activity of xanthorrhizol isolated from Curcuma xanthorrhiza Roxb. J Antimicrob Chemother. 132:1-4.
Sembiring BB, Mamun, Ginting EI. 2006. Pengaruh kehalusan bahan dan lama ekstraksi terhadap mutu ekstrak temulawak (Curcuma xanthorriza Roxb).
Bul. Littro. 17(2):53–58.
Sidik, Mulyono MW, Muhtadi A. 1992. Temulawak (Curcuma Xanthorrhiza
Roxb.). Jakarta (ID): Yayasan Pengembangan Obat Bahan Alam Phytomedica.
Sugiwati S. 2005. Aktivitas antihiperglikemik dari ekstrak buah mahkota dewa [Phaleria Macrocarpa (Scheff.) Boerl.] sebagai inhibitor alfa-glukosidase in vitro dan in vivo pada tikus putih [tesis]. Bogor (ID): Institut Pertanian Bogor.
Sutedja L. 2003. Bioprospekting Tumbuhan Obat Indonesia Sebagai Sediaan Fitofarmaka Antidiabetes. Jakarta (ID): Pusat Penelitian Kimia, LIPI.
14
15 Lampiran 1 Gambaran umum penelitian
Preparasi sampel
Ekstraksi dengan metanol 75%
Pemekatan dengan rotavapour
(fraksi metanol)
Fraksinasi dengan etil asetat
Pemekatan dengan rotavapour
Uji BSLT Uji inhibisi α
-glukosidase Pengukuran
konsentrasi xantorizol (HPLC)
16
Lampiran 2 Kadar air simplisia
Sampel temulawak Ulangan Kadar air (%) Rata-rata (%) Wonogiri
17 Lampiran 4 Profil kromatogram standar xantorizol 200 ppm
Peak# Ret. time Area Height Area % Height %
1 2.693 41347 6385 0.764 2.409
2 3.562 113264 7167 2.093 2.704
3 4.257 13057 1121 0.241 0.423
4 4.610 903465 75649 16.697 28.542
5 5.949 9521 901 0.176 0.34
6 6.536 354467 21605 6.551 8.151
7 7.480 5835 320 0.108 0.121
8 10.670 1920 134 0.035 0.051
9 14.331 3967980 151764 73.334 57.259
18
Lampiran 5 Profil kromatogram temulawak asal Ciemas
Peak# Ret. time Area Height Area % Height %
1 2.699 118565 14782 3.128 8.976
2 3.638 790902 27254 20.865 16.549
3 4.149 23761 1998 0.627 1.213
4 4.527 120233 8342 3.172 5.066
5 5.462 65119 3482 1.718 2.114
6 5.904 56004 3300 1.477 2.004
7 6.477 47458 3270 1.252 1.986
8 6.910 317226 20099 8.369 12.205
9 8.060 4450 246 0.117 0.15
10 8.855 3571 189 0.094 0.115
11 10.707 465000 20399 12.267 12.386
12 11.823 22875 784 0.603 0.476
13 12.573 10070 392 0.266 0.238
14 14.444 1745347 60149 46.044 36.524
Contoh perhitungan:
[inject] (μg/mL) =
x [standar]
=
x 200 ppm = 87.9716 ppm
Konsentrasi xantorizol =[ ]
= ⁄
=
434.64 mg/g19 Lampiran 6 Profil kromatogram temulawak asal Bogor
Peak# Ret. time Area Height Area % Height %
1 2.693 140331 18573 3.761 11.013
2 3.271 275652 14032 7.387 8.320
3 3.642 452960 24098 12.138 14.289
4 4.141 23922 1881 0.641 1.116
5 4.641 30421 1429 0.815 0.847
6 5.460 77473 4027 2.076 2.388
7 5.916 48904 2696 1.311 1.599
8 6.907 329166 19606 8.821 11.625
9 8.077 3482 195 0.093 0.116
10 8.855 3049 161 0.082 0.096
11 10.704 486904 20797 13.048 12.331
12 11.806 21387 723 0.573 0.429
13 12.634 10215 384 0.274 0.227
14 14.454 1827805 60047 48.981 35.605
20
Lampiran 7 Profil kromatogram temulawak asal Wonogiri
Peak# Ret. time Area Height Area % Height %
1 2.712 121354 17008 3.187 10.277
2 3.645 838335 29479 22.015 17.811
3 4.154 22656 1920 0.595 1.160
4 4.594 58778 3407 1.544 2.058
5 5.476 67699 3657 1.778 2.210
6 5.954 37809 2113 0.993 1.276
7 6.537 17210 1344 0.452 0.812
8 6.916 300637 19435 7.895 11.743
9 8.057 3505 208 0.092 0.126
10 8.854 3023 172 0.079 0.104
11 10.720 399797 17935 10.499 10.836
12 11.843 17878 637 0.469 0.385
13 12.636 10987 441 0.289 0.267
14 14.479 1908344 67750 50.114 40.935
21 Lampiran 8 Profil kromatogram temulawak asal Ngawi
Peak# Ret. time Area Height Area % Height %
1 2.723 131207 15345 3.506 9.536
2 3.657 718209 24590 19.194 15.281
3 4.161 29680 2403 0.793 1.494
4 4.665 41864 2475 1.119 1.538
5 5.475 75459 4083 2.017 2.538
6 5.899 73496 4468 1.964 2.777
7 6.918 374313 22809 10.003 14.174
8 8.092 4298 247 0.115 0.153
9 8.881 3881 205 0.104 0.127
10 10.714 526839 23249 14.079 14.447
11 11.801 23160 843 0.619 0.524
12 12.610 8314 344 0.222 0.214
13 14.473 1731216 59859 46.265 37.198
22
Lampiran 9 Profil kromatogram temulawak asal Karanganyar
Peak# Ret. time Area Height Area % Height %
1 2.703 133783 15388 3.389 9.318
2 3.642 831291 28151 21.061 17.046
3 4.140 26143 2134 0.662 1.292
4 4.651 32478 1902 0.823 1.152
5 5.457 74964 4024 1.899 2.437
6 5.882 64137 3810 1.625 2.307
7 6.900 365585 22380 9.262 13.551
8 8.073 4526 250 0.115 0.152
9 8.841 3522 190 0.089 0.115
10 10.695 506669 21979 12.836 13.308
11 11.785 24557 856 0.622 0.518
12 12.584 10830 404 0.274 0.245
13 14.454 1868634 63683 47.342 38.560
23 Lampiran 10 Konsentrasi xantorizol ekstrak temulawak
Sampel temulawak Ulangan Konsentrasi xantorizol
(mg/g) Rata-rata (mg/g)
Karanganyar 1 470.0661 467.25
2 464.4263
Lampiran 11 Toksisitas ekstrak temulawak dengan metode BSLT Sampel
24
Lampiran 12 Nilai inhibisi ekstrak temulawak terhadap α-glukosidase
Sampel Konsentrasi (µg/mL) % inhibisi
Ulangan 1 Ulangan 2 Ulangan 3
Ciemas 2000 92.91 89.20 90.38
1000 78.39 80.75 76.53
800 72.82 69.78 71.30
500 62.86 60.66 61.51
250 31.16 29.06 32.88
100 5.91 3.94 8.15
Bogor 2000 82.99 84.40 84.65
1000 72.12 74.55 77.49
800 64.96 65.60 67.14
500 47.57 45.65 45.78
250 30.79 36.06 39.27
100 13.94 13.60 13.94
Wonogiri 2000 82.36 81.11 84.29
1000 72.49 77.35 73.48
800 65.06 65.63 67.22
500 48.90 51.06 52.54
250 44.22 35.71 37.84
100 19.60 7.90 17.02
Ngawi 2000 92.42 91.28 83.38
1000 74.82 75.79 78.54
800 68.85 69.82 68.85
500 53.68 57.88 55.14
250 37.54 20.91 22.40
100 1.99 0.41 -9.09
Karanganyar 2000 81.29 72.71 86.28
1000 77.23 78.17 76.92
800 73.18 72.40 72.09
500 58.68 57.90 54.47
250 44.80 44.87 53.57
25 Lampiran 13 Grafik pengaruh konsentrasi ekstrak temulawak terhadap % inhibisi
α-glukosidase
0 500 1000 1500 2000 2500
%
i
nhi
bi
si
Konsentrasi ekstrak temulawak Ciemas (µg/mL)
ulangan 1
0 500 1000 1500 2000 2500
%
i
nhi
bi
si
Konsentrasi ekstrak temulawak Bogor (µg/mL)
ulangan 1
0 500 1000 1500 2000 2500
%
i
nhi
bi
si
Konsentrasi ekstrak temulawak Wonogiri (µg/mL)
26
Lampiran 14 Nilai IC50 ekstrak temulawak
Sampel Ulangan Persamaan garis IC50
(µg/mL)
0 500 1000 1500 2000 2500
%
i
nhi
bi
si
Konsentrasi ekstrak temulawak Ngawi (µg/mL)
ulangan 1
0 500 1000 1500 2000 2500
%
i
nhi
bi
si
Konsentrasi ekstrak temulawak Karanganyar (µg/mL)
27 Contoh perhitungan:
Sampel temulawak asal Ciemas ulangan 1 y = a + b ln x
50 = -132.07 + 30.278 ln(x) 182.07 = 30.278 ln(x)
ln(x) = 6.0133 x = 408.83
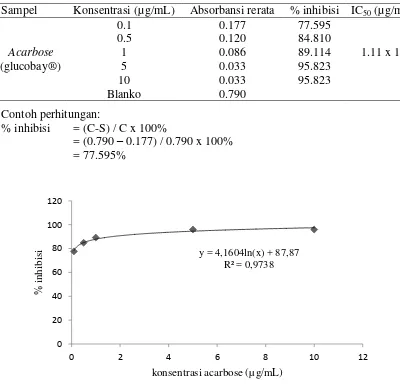
Lampiran 15 Nilai inhibisi acarbose(glucobay®) terhadap α-glukosidase
Sampel Konsentrasi (µg/mL) Absorbansi rerata % inhibisi IC50 (µg/mL)
Acarbose
(glucobay®)
0.1 0.177 77.595
1.11 x 10-4
0.5 0.120 84.810
1 0.086 89.114
5 0.033 95.823
10 0.033 95.823
Blanko 0.790
Contoh perhitungan:
% inhibisi = (C-S) / C x 100%
= (0.790 – 0.177) / 0.790 x 100% = 77.595%
Gambar 6 Hubungan konsentrasi acarboseterhadap inhibisi α-glukosidase y = 4,1604ln(x) + 87,87
R² = 0,9738
0 20 40 60 80 100 120
0 2 4 6 8 10 12
%
inhibi
si
28
Lampiran 16 Uji korelasi antara konsentrasi ekstrak temulawak dengan % inhibisi α-glukosidase menggunakan program SPSS 16
% inhibisi
Ciemas Bogor Wonogiri Ngawi Karanganyar Konsentrasi
ekstrak
Pearson
correlation 0.850 *
0.887* 0.865* 0.845* 0.778* Sig. (2-tailed) 0.000 0.000 0.000 0.000 0.000
N 18 18 18 18 18
* correlation is significant at the 0.01 level (2-tailed)
Hipotesis:
H0 : Tidak ada hubungan antara konsentrasi ekstrak dengan % inhibisi α -glukosidase
H1 : Ada hubungan antara konsentrasi ekstrak dengan % inhibisi α-glukosidase Kesimpulan:
29
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang pada tanggal 19 Oktober 1992 dari ayah Ido Akhmad Nurdin dan ibu Hayati. Penulis adalah putra pertama dari tiga bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 4 Tangerang provinsi Banten dan pada tahun yang sama penulis lulus Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Penulis merupakan penerima beasiswa Peningkatan Prestasi Akademik (PPA) dari Kementrian Pendidikan dan Kebudayaan periode 2011-2014. Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Biokimia Umum, Struktur dan Fungsi Biomolekul, dan Metabolisme. Penulis pernah aktif berorganisasi menjadi salah satu anggota divisi internal di Badan Eksekutif Mahasiswa (BEM) Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) periode 2011/2012 dan 2012/2013. Penulis juga aktif dalam berbagai kepanitiaan diantaranya anggota divisi liaison officer (LO) Pesta Sains Nasional (PSN) IPB 2011, anggota divisi acara Masa Perkenalan Departemen (MPD) 2012, anggota divisi acara Masa Perkenalan Fakultas (MPF) 2012, panitia magang lembaga kemahasiswaan BEM FMIPA IPB, anggota divisi konsumsi SPIRIT (Sport Competition and Art Festival on MIPA Faculty) 2012, anggota divisi acara IDEA (IPB’s Dedication for Education) 2012, anggota divisi acara Seminar dan Kajian Ilmiah Kehalalan (SKIK) 2012, anggota divisi LO PSN IPB 2012, anggota divisi LO pada acara sehari kuliah menjadi mahasiswa IPB 2013, anggota divisi acara SPIRIT 2013, anggota divisi acara PSN IPB 2013, volunteer sebagai LO di Bogor