AKAR KAWAO (Millettia sericea) DAN KULIT BATANG
MANGGIS (Garcinia mangostana L.)
FITRY FILIANTY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
(Saccharum Officinarum) Menggunakan Akar Kawao (Millettia Sericea) dan Kulit Batang Manggis (Garcinia Mangostana L.). Dibimbing oleh SAPTA RAHARJA dan PRAYOGA SURYADARMA.
Akar kawao (Millettia sericea) dan kulit batang manggis (Garcinia mangostana) termasuk bahan pengawet yang sering dipakai petani aren tradisional agar nira aren tidak cepat rusak. Aplikasi penggunaan kedua bahan pengawet alami tersebut dalam nira tebu memerlukan kondisi proses tertentu agar dihasilkan kinerja pengawetan yang optimal. Pengaturan pH, suhu dan waktu reaksi mempengaruhi laju reaksi enzimatis dan mikrobiologis. Berdasarkan hal tersebut maka penelitian untuk menguji kemampuan akar kawao dan kulit batang manggis menghambat laju degradasi sukrosa dalam nira tebu perlu dilakukan. Aplikasi kedua bahan pengawet alami tersebut juga perlu diuji dengan kondisi proses tertentu agar menghasilkan aktivitas optimal untuk menghambat laju degradasi sukrosa dalam nira tebu.
Penelitian ini mempunyai tujuan untuk (1) mengetahui faktor-faktor yang mempengaruhi degradasi sukrosa dalam nira tebu dengan penambahan bahan pengawet (akar kawao dan kulit batang manggis) dan (2) mengetahui perubahan kualitas nira tebu selama penyimpanan. Penelitian ini dilakukan dalam 3 tahapan percobaan. Tahap pertama melakukan karakterisasi nira tebu dan bahan pengawet yang digunakan (akar kawao dan kulit batang manggis). Tahap kedua melakukan pengujian faktor yang mempengaruhi degradasi sukrosa dalam nira tebu. Tahap ketiga melakukan pengukuran perubahan kualitas nira tebu selama penyimpanan. Parameter yang diukur meliputi kadar sukrosa, gula pereduksi, total asam dan nilai pH.
Hasil penelitian ini menunjukan kadar sukrosa dalam nira tebu yang digunakan dalam percobaan bernilai cukup tinggi yaitu 10,29%, dengan kandungan gula pereduksi 2,43% untuk glukosa dan 0,94% untuk fruktosa, total asam 62,5 mleq dan nilai pH 5,1. Akar kawao dan kulit batang manggis mengandung komponen fitokimia yang hampir sama, dimana komponen utamanya terdiri dari alkaloid, flavonoid dan glikosida. Komponen lain seperti saponin, fenolik, triterpenoid dan steroid terdapat dalam jumlah yang kecil.
Hasil analisis pengaruh faktor menunjukan bahwa faktor suhu dan nisbah pengawet memberikan pengaruh positif, baik terhadap kadar sukrosa maupun gula pereduksi. Sedangkan faktor nilai pH dan lama inkubasi memberikan pengaruh negatif, baik terhadap kadar sukrosa maupun gula pereduksi. Suhu dan pengawet memberikan pengaruh positif terhadap kadar sukrosa masing-masing sebesar 0.452% dan 2.019% dengan signifikansi 94.6% dan 94%. Kedua faktor tersebut juga memberikan pengaruh positif terhadap kadar gula reduksi masing-masing sebesar 0.554% dan 2.072% dengan signifikansi 97.9% dan 97.3%. Nilai pH dan lama inkubasi memberikan pengaruh negatif terhadap kadar sukrosa masing-masing sebesar 4.423% dan 0.125% dengan signifikansi 94.5% dan 93.5%. Kedua faktor tersebut juga memberikan pengaruh positif terhadap kadar gula reduksi masing-masing sebesar 3.820% dan 0.126% dengan signifikansi yang sama yaitu 97%.
Saya menyatakan dengan sebenar-benarnya bahwa tesis saya dengan
judul Teknik Penghambatan Degradasi Sukrosa dalam Nira Tebu (Saccharum officinarum) Menggunakan Akar Kawao (Millettia Sericea) dan
Kulit Batang Manggis(Garcinia mangostana L.) adalah benar-benar asli karya saya dengan arahan komisi pembimbing dan bukan hasil jiplakan atau tiruan dari tulisan siapapun serta belum diajukan dalam bentuk apapun kepada perguruan
tinggi manapun.
Bogor, 30 Juli 2007
Fitry Filianty
© Hak Cipta Milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
AKAR KAWAO (Millettia sericea) DAN KULIT BATANG
MANGGIS (Garcinia mangostana L.)
FITRY FILIANTY
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Sericea) dan Kulit Batang Manggis (Garcinia mangostana L.) Nama : Fitry Filianty
NRP : F351030161
Disetujui
Komisi Pembimbing
Dr. Ir. Sapta Raharja, DEA Prayoga Suryadarma, STP, MT Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Industri pertanian
Dr. Ir. Irawadi Jamaran Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
Alhamdulillah, segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karuniaNya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih pada penelitian yang dilaksanakan sejak bulan September 2005 ini adalah pengawetan nira tebu, dengan judul Teknik Penghambatan Degradasi Sukrosa dalam Nira Tebu (Saccharum officinarum) menggunakan Akar Kawao (Millettia sp.)dan Kulit Batang Manggis (Garcinia mangostana L.)
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Sapta Raharja, DEA dan Bapak Prayoga Suryadarma, STP, MT selaku komisi pembimbing, serta Bapak Dr. Ir Sukardi, MM yang telah bersedia menjadi penguji luar komisi untuk memberikan masukan-masukan yang berharga untuk menyempurnakan tesis ini.
Penulis juga mengucapkan terimakasih kepada Pemerintah Provinsi Riau atas bantuan pendidikan untuk mahasiswa pascasarjana asal Riau dan Program B yang telah membantu memfasilitasi penelitian ini. Ucapan terimakasih juga penulis sampaikan kepada rekan-rekan tim penelitian gula (Rheni, Nisa, Rian dan Ikhsan), Tiners‘38 dan Tiners’39 yang bersama-sama berjuang di laboratorium TIN. Demikian juga kepada laboran - laboran TIN, Pak Edi, Pak Sugi, Bu Rini dan Bu Ega atas bantuannya kepada penulis selama penelitian.
Tesis ini penulis persembahkan untuk almarhum ayahanda tercinta yang selalu memotivasi untuk melanjutkan pendidikan pada jenjang yang lebih tinggi selama hidupnya. Akhirnya ucapan terimakasih yang tak terhingga penulis sampaikan kepada keluarga tercinta lainnya, mama, suami, abang dan adik-adik atas doa, kasih sayang, pengorbanan serta dukungan moril dan materil yang tak terhingga dalam menyelesaikan studi ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2007
Penulis dilahirkan di Jakarta pada tanggal 31 Maret 1978 dari ayah Drs Chaerul Suflan, BBA (Alm) dan Ibu Zuretty. Penulis merupakan putri kedua dari enam bersaudara dan istri dari Tonny F. Kurniawan.
FITRY FILIANTY. Inhibition Process Method on Sucrose Degradation in Sugar Cane (Saccharum officinarum) Juice Using Kawao Root (Millettia sericea) and Mangosteen Bark (Garcinia mangostana L.). Supervised by SAPTA RAHARJA dan PRAYOGA SURYADARMA.
The inhibition process method on sucrose degradation in sugar cane juice was studied by using kawao root and mangosteen bark. The degradation caused by invertation reaction and microorganism activity. Kawao root and mangosteen bark often use as preservative on sugar juice by traditional farmer to inhibit the degradation process. Temperature, pH value and time of incubation also influence the enzymatic reaction and microorganism activity. Refer to the condition, the research need to conduct to measure the inhibition ability of kawao root and mangosteen bark at certain condition.
This research aim to (1) knowing factors influencing the sucrose degradation sugar cane juice by adding preservative (kawao root and mangosteen bark) (2) knowing quality change of sugarcane juice during incubation.
This research was conducted in three steps. First step conduct characterization of sugarcane juice and preservative material (kawao root and mangosteen bark). Second phase conduct factor examination influencing sucrose degradation in sugarcane juice. Third phase conduct quality change measurement of sugarcane juice during incubation. The measurements consist of sucrose content, reduction sugar content, acid total and pH value.
The result of this research showed the amount of sucrose in higher level, (10,29%), reduction sugar is 2,43% of glucose and 0,94% of fructose, acid value is 62,5 mleq and pH value is 5,1. Kawao root and mangosteen bark consist of alkaloid, flavonoid, triterpenoid and glycoside in large number and saponin, fenolik, triterpenoid and steroid in small number.
The result of factor influence analysis that temperature and preservative ratio factor give positive influence in sucrose content and reduction sugar. While factor of pH value and time of incubation give negative influence in sucrose content and reduction sugar. Temperature and preservative ratio factor give positive influence to sucrose content each equal to 0.452% and 2.019% by significance 94.6% and 94%. Both of the factors also give positive influence to reduction sugar content each equal to 0.554% and 2.072% by significance 97.9% and 97.3%. The pH value and time of incubation give negative influence to sucrose content each equal to 4.423% and 0.125% by significance 94.5% and 93.5%. Both of the factors also give negative influence to reduction sugar content each equal to 3.820% and 0.126% by significance 97%.
DAFTAR TABEL... viii
Penghambatan Kerusakan Nira Tebu... 16
Pengaruh Suhu dan pH ... 16
Pengaruh Penambahan Bahan Pengawet ... 18
Fitokimia sebagai Bahan Pengawet ... 19
Kawao (Millettia sp) ... 19
Manggis (Garcinia mangostana L.) ... 22
METODOLOGI PENELITIAN ... 26
Waktu dan Tempat... 26
Karakteristik Kawao (Millettia sericea) ... 33
Karakteristik Kulit Batang Manggis (Garcinia mangostana L.)... 36
Pengaruh Faktor Suhu, pH, Bahan Pengawet dan Waktu... 38
Sukrosa ... 39
Gula Pereduksi ... 48
Perubahan Kualitas Nira Tebu... 56
Kadar Sukrosa ... 56
Kadar Gula Pereduksi ... 59
Total Asam ... 62
Hubungan perubahan kadar gula pereduksi, total asam dan nilai pH... 66
Analisis kebutuhan bahan pengawet untuk industri gula ... 67
SIMPULAN DAN SARAN ... 70
Simpulan ... 70
Saran ... 70
DAFTAR PUSTAKA ... 71
DAFTAR TABEL
Halaman
1. Komposisi kimia nira tebu ... 9
2. Kemampuan penghambatan aktifitas invertase oleh berbagai produk metabolit dan ion logam ... 14
3. Beberapa jenis tanaman millettia dengan komponen fitokimianya... 21
4. Nilai rendah dan tinggi perlakuan ... 29
5. Matrik satuan percobaan uji pengaruh faktor penghambatan laju degradasi sukrosa dalam nira tebu dengan rancangan komposit fraksional berfaktor 2IV4-1 ... 30
6. Karakterisasi nira tebu... 31
7. Hasil uji fitokimia kawao (Milletia sericea) ... 34
8. Hasil uji fitokimia kulit batang manggis... 37
9. Koefisien, signifikansi dan persen pengaruh berdasarkan analisis kadar sukrosa ... 40
DAFTAR GAMBAR
Halaman
1. Tanaman tebu (Saccharum officinarum) ... 8
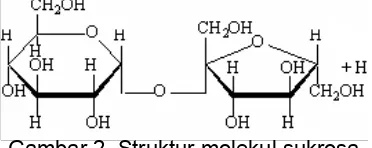
2. Struktur molekul sukrosa ... 10
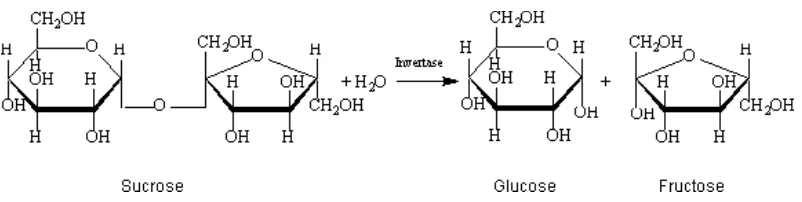
3. Reaksi invertase atau hidrolisis sukrosa ... 11
4. Pengaruh pH terhadap aktivitas invertase pada tebu ... 13
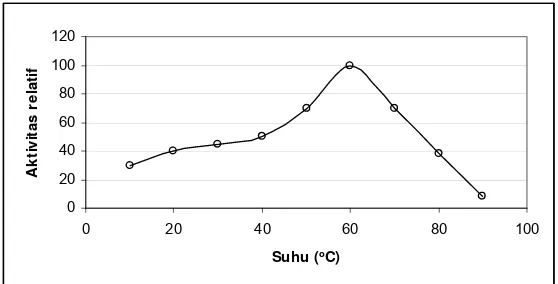
5. Pengaruh suhu terhadap aktivitas invertase pada tebu ... 13
6. Tahapan reaksi fermentasi pada nira tebu ... 15
7. Grafik hubungan perubahan pH dan suhu terhadap aktivitas enzim... 17
8. Tanaman kawao (Millettia) ... 20
9. Struktur kimia rotenoid dan flavonoid lain yang diisolasi dari spesies millettia ... 22
10. Tanaman manggis (Garcinia mangostana L.) ... 23
11. Struktur Mangostin ... 25
12. Diagram Alir Tahapan Penelitian ... 27
13. Pola interaksi faktor suhu dan pH terhadap kadar sukrosa... 46
14. Pola interaksi faktor suhu dan nisbah pengawet terhadap kadar sukrosa ... 47
15. Pola interaksi faktor suhu dan lama inkubasi terhadap kadar sukrosa ... 48
16. Pola interaksi faktor suhu dan pH terhadap kadar gula pereduksi ... 53
17. Pola interaksi faktor suhu dan nisbah pengawet terhadap kadar gula pereduksi ... 55
18. Pola interaksi faktor suhu dan lama inkubasi terhadap kadar gula pereduksi ... 56
19. Grafik perubahan kadar sukrosa pada nira murni dan nira tebu yang ditambahkan pengawet ... 58
20. Grafik perubahan kadar gula pereduksi selama inkubasi 48 jam ... 60
21. Grafik perubahan total asam selama inkubasi 48 jam... 63
DAFTAR LAMPIRAN
Halaman
1. Prosedur analisis nira tebu ... 78
2 . Hasil pengujian fitokimia akar kawao dan kulit batang manggis ... 79
3 . Pengaruh faktor terhadap kadar sukrosa (dalam brix) ... 80
4 . Pengaruh faktor terhadap kadar gula pereduksi (dalam mM) ... 82
5 . Perubahan nira tebu selama penyimpanan 240 menit ... 84
Latar belakang
Kebutuhan konsumsi gula di Indonesia sejak tahun 1970-an selalu
melebihi kapasitas produksi dalam negeri sehingga menyebabkan Indonesia menjadi negara pengimpor gula. Indonesia telah mengimpor gula sejak tahun
1980-an dengan kapasitas impor yang terus meningkat hingga sekarang. Pemerintah Indonesia mengatur tataniaga gula tersebut secara langsung karena
komoditas tersebut menguasai hajat hidup sebagian besar masyarakat Indonesia.
Pemerintah sebelumnya pernah mencanangkan swasembada gula pada tahun 1991 namun tidak tercapai karena masih rendahnya kapasitas produksi gula secara nasional. Rendahnya produksi gula dapat disebabkan oleh berbagai
faktor, mulai dari pemilihan bibit, teknologi tanam, budidaya, pemanenan, dan pengolahan gula di pabrik. Di Indonesia, produksi gula diperoleh dari pengolahan
tebu (Saccharum officinarum). Pengalaman produksi dalam dasawarsa 1980-an lebih menekankan pada perluasan areal tanaman tebu tanpa diikuti peningkatan
produktivitas dalam semua tahap produksi. Contohnya, peningkatan produksi melalui perluasan areal tanaman tanpa memperhatikan kualitas bibit tebu
(rendemen rendah) hanya akan memberatkan instalasi pabrik sehingga produksi menjadi tidak ekonomis dan boros. Kondisi mesin pengolahan di pabrik yang
sering rusak saat proses produksi berlangsung (downtime) juga mempengaruhi penurunan rendemen gula yang diperoleh.
Industri gula sebagai industri yang sudah lama berkembang, saat ini
sedang mencapai tahap pematangan. “Trend” teknologi yang sedang diupayakan oleh industri-industri gula khususnya di negara maju mengarah pada
peningkatan kecepatan pengolahan sambil memperbaiki proses recovery gula. Teknologi yang dikembangkan pada industri gula tersebut meliputi komputasi
aliran dinamik, pencarian bahan baku baru, peralatan elektronik digital, pemilihan peralatan pengolahan yang efisien, otomatisasi mesin dan pengembangan
teknologi informasi (Alvarez dan Johnson, 2003). Berbagai metode pengukuran cepat pada tebu, nira tebu dan gula hasil pengolahan telah banyak
dikembangkan industri gula di negara-neraga maju seperti metode pengukuran dextran pada nira secara cepat (Day dan Rauh, 2003) dan metode pengukuran
White dan Rein. 2003). Semua peralatan pengukuran terinstalasi pada pabrik sehingga memudahkan proses pengontrolan. Perkembangan lain dari industri
gula adalah penggunaan membran sebagai metoda pemurnian nira tebu, diantaranya dengan menggunakan membran ultrafiltrasi yang dapat
menghasilkan nira dengan warna lebih cerah, mengurangi dextran hingga 100% dan mengurangi polisakarida hingga 76% (Kaseno, Wulyoadi dan Koesnandar,
2003). Kinerja produksi industri gula juga diperbaiki melalui pengembangan berbagai metode manajemen, misalnya aplikasi sistem manajemen perawatan terkomputerisasi (Computerized Maintenance Management System / CMMS)
(Elliott, 2003) yang dapat mengatasi dampak downtime pabrik dan mengoptimalkan produksi. Semua upaya-upaya yang dijelaskan diatas ditujukan
untuk meningkatkan kapasitas produksi gula yang bermutu sekaligus meningkatkan keuntungan perusahaan.
Perkembangan industri gula di negara-negara maju didukung dengan teknologi yang aplikasinya membutuhkan investasi yang cukup besar.
Kenyataannya industri gula di Indonesia, khususnya industri gula milik pemerintah, kurang didukung dengan investasi yang memadai, terutama
investasi untuk peralatan pengolahan. Pemilihan penerapan teknologi industri gula di Indonesia diupayakan tidak membutuhkan investasi yang terlalu besar
untuk keuntungan maksimal (rendemen gula tinggi).
Salah satu permasalahan yang menyebabkan rendemen gula rendah di pabrik-pabrik gula di Indonesia adalah masalah downtime pabrik yang
disebabkan kerusakan mesin yang sudah tua usia teknisnya. Masalah downtime pabrik adalah terhentinya proses produksi, sehingga nira yang sedang diolah
menjadi terbuang atau tetap digunakan tetapi kadar sukrosa dalam nira sudah sangat rendah akibat kerusakan enzimatis dan mikrobiologis. Upaya mengganti
mesin yang sering rusak dengan membeli mesin baru membutuhkan investasi besar terutama bila dilakukan secara bersamaan untuk seluruh pabrik. Hal lain
yang dapat dilakukan untuk mengatasi permasalahan tersebut adalah dengan penambahan bahan pengawet ke dalam nira tebu agar kadar sukrosa
didalamnya dapat dipertahankan secara maksimal. Sukrosa adalah gula yang akan dikristalkan dalam pengolahan nira tebu dan secara langsung jumlahnya
sukrosa menjadi meningkat setelah terbentuknya endapan, 3-4 hari setelah pembersihan evaporator (Eggleston, Monge dan Ogier, 2003).
Penurunan kadar sukrosa juga dapat terjadi selama proses pengolahan, terutama sejak tahap ekstraksi hingga evaporasi. Kondisi proses pengolahan
dapat mempengaruhi aktivitas enzimatis dan mikrobiologis dalam nira tebu. Kondisi proses pengolahan tersebut meliputi pH, suhu, waktu, migrasi komponen
logam peralatan pengolahan dan pengadukan. Permasalahan ini dapat diatasi dengan pemilihan kondisi proses pengolahan yang tepat dan dapat juga ditambahkan pengawet yang bersifat inhibitor enzim atau antimikrobial ke dalam
nira tebu.
Tanaman tebu (Saccharum sp.) adalah salah satu sumber bahan baku
industri gula. Sumber gula lainnya adalah tanaman sugar beet yang banyak dikembangkan di Eropa Utara dan Amerika Utara. Pemanenan tanaman tebu
ditandai dengan pencapaian kadar sukrosa dalam batang tebu yang maksimal. Berbagai penelitian tentang akumulasi sukrosa dalam batang tebu telah banyak
dilakukan, diantaranya adalah pemodelan akumulasi sukrosa dalam tebu (Rohwer, dan Frederik, 2001), efek suhu terhadap metabolisme sukrosa dalam
tebu selama pertumbuhan (Lingle, 2004), pemodelan estimasi kematangan tebu (Scarpari, dan de Beauclair, 2004) dan hubungan akumulasi sukrosa dengan
aktivitas invertase (Zhu, Komor dan Moore, 1997).
Penurunan kadar sukrosa dalam proses pengolahan nira tebu menjadi gula dapat disebabkan oleh tiga hal yaitu reaksi enzimatis (terutama invertase),
reaksi mikrobiologis dan kondisi proses yang secara tidak langsung mempercepat reaksi enzimatis dan mikrobiologis (pH, suhu, waktu, agitasi, dan
lain-lain).
Reaksi enzimatis yang memicu kerusakan nira tebu karena penurunan
kadar sukrosa adalah reaksi invertasi. Reaksi invertasi dikatalis oleh enzim invertase yang terdapat dalam nira tebu, menginvertasi sukrosa sehingga
menghasilkan glukosa dan fruktosa. Aktivitas invertase ini menyebabkan kadar sukrosa semakin berkurang dalam nira tebu. Invertase pada tanaman tebu telah
diteliti aktivitasnya, optimum pada pH 7.2 dan suhu 600 C (Rahman, Palash dan Fida, 2004, Vorster dan Frederik, 1998).
Aktivitas invertase dalam nira tebu hasil ekstraksi adalah aktivitas yang
dihambat oleh substrat (sukrosa) dan produk (glukosa dan fruktosa) reaksi itu sendiri dengan model inhibisi non-kompetitif (Filho, Hori dan Ribero, 1999).
Substrat sukrosa dapat menghambat reaksi invertasi pada konsentrasi 80% (b/v). Produk reaksi invertasi adalah, glukosa dan fruktosa, dapat menghambat
aktivitas invertase masing-masing sebesar 27% dan 37% (Vorster dan Frederik, 1998). Aplikasi glukosa dan fruktosa sebagai inhibitor invertase pada proses
pengolahan nira tebu menjadi gula menimbulkan permasalahan lain yaitu rendahnya rendemen proses kristalisasi gula karena terhambat oleh glukosa dan fruktosa yang terakumulasi dalam sirup. Jenis inhibitor lain yang dapat
menghambat aktivitas invertase adalah beberapa jenis garam, terutama HgCl2,
FeCl2, CuCl2 dan CdCl2, yang dapat menurunkan aktifitas hingga 45-99%
(Mahbubur Rahman, et.al., 2004, Vorster dan Frederik, 1998). Aplikasi garam-garam tersebut dalam pengolahan nira tebu juga tidak dapat dilakukan karena
garam-garam tersebut bukan golongan food grade.
Penyebab lain kerusakan nira tebu adalah reaksi mikrobiologis. Salah
satu mikroba yang dapat mengkontaminasi tebu dan niranya adalah Leuconostoc mesenteroides, dengan kemampuannya mengkonversi sukrosa menjadi fruktosa dan dextran. Kerusakan lebih lanjut dari degradasi sukrosa adalah terbentuknya asam-asam organik seperti asam laktat dan asetat (Mathlouthi, 2000). Upaya
mencegah kerusakan akibat reaksi mikrobiologis ini salah satunya adalah dengan menambahkan antimikrobial, seperti natrium benzoat dan larutan amoniak (Bobadilla dan Preston, 1981, Duarte, Elliott dan Preston, 1981).
Secara tradisional petani nira menggunakan bahan-bahan alami tertentu sebagai pengawet seperti akar kawao, kulit dan buah manggis, laru janggut, kulit
batang kusambi, remasan daun jambu mete, tangkal dan kulit batang nangka, serta kulit batang ralu (Sedarnawati, Suliantari dan Iwan, 1999) dan mendidihkan
nira secepat mungkin selama menunggu waktu proses pengolahan. Tujuan pemanasan selain membunuh mikroorganisme dalam nira dapat juga berfungsi
menginaktivasi enzim. Bahan-bahan alami yang selama ini dipakai oleh petani belum banyak diidentifikasi komponen aktifnya, apakah bersifat inhibitor enzim
atau antimikrobial. Selama ini penggunaan bahan-bahan tersebut hanya didasarkan pada pengalaman bahwa dengan penambahan bahan-bahan
Akar kawao (Millettia sericea) dan kulit batang manggis (Garcinia mangostana) termasuk bahan pengawet yang sering dipakai petani aren tradisional. Menurut Teysmann dalam Menninger (1970), orang Jawa memberikan sepotong akar kawao dalam cairan palem yang masih segar agar cairan tersebut
(nira) tidak menjadi asam. Bila petani tidak menemukan akar kawao, mereka menggantinya dengan kulit batang atau buah manggis sebagai pengawet.
Aplikasi penggunaan pengawet dalam nira tebu memerlukan kondisi proses tertentu agar dihasilkan kinerja pengawetan yang optimal. Pengaturan pH, suhu dan waktu reaksi mempengaruhi laju reaksi enzimatis dan
mikrobiologis. Waktu reaksi berhubungan dengan lamanya reaksi bahan pengawet bekerja hingga kehilangan aktivitas pengawetannya disebabkan
kehabisan bahan aktif. Optimasi produksi diperlukan dengan mengkombinasikan kondisi-kondisi proses tertentu dengan konsentrasi tertentu bahan pengawet.
Berdasarkan pemaparan diatas maka penelitian untuk menguji kemampuan akar kawao dan kulit batang manggis menghambat laju degradasi
sukrosa dalam nira tebu perlu dilakukan. Aplikasi kedua bahan pengawet alami tersebut juga perlu diuji dengan kondisi proses tertentu agar menghasilkan
aktivitas optimal untuk menghambat laju degradasi sukrosa dalam nira tebu.
Tujuan Penelitian
Penelitian ini bertujuan untuk (1) mengetahui faktor-faktor yang mempengaruhi degradasi sukrosa dalam nira tebu dengan penambahan bahan
pengawet (akar kawao dan kulit batang manggis) dan (2) mengetahui perubahan kualitas nira tebu selama penyimpanan.
Manfaat Penelitian
Manfaat penelitian ini diharapkan untuk (1) mendapatkan informasi faktor-faktor penghambat degradasi nira tebu dengan aplikasi bahan pengawet akar
kawao dan kulit batang manggis, (2) menyediakan data yang dapat dipakai sebagai dasar untuk penelitian selanjutnya, (3) memberikan masukan kepada
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah sebagai berikut :
1. Karakterisasi nira tebu
2. Analisis fitokimia akar kawao dan kulit batang manggis.
3. Pengujian faktor-faktor yang mempengaruhi degradasi sukrosa dalam nira tebu berupa pengujian suhu, pH, nisbah pengawet dan lama inkubasi
terhadap perubahan kadar sukrosa dan gula pereduksi.
4. Pengujian perubahan kualitas nira tebu berupa perubahan kadar sukrosa, gula pereduksi, total asam dan nilai pH selama penyimpanan.
Tanaman Tebu
Tanaman tebu (Saccharum officinarum) merupakan tanaman tahunan
dari famili Gramineae (keluarga rumput) yang sudah dibudidayakan sejak lama di
daerah asalnya di Asia, Papua Nugini. Tanaman tebu memiliki kemiripan bentuk
fisik dengan tanaman jagung dan sorgum. Tanaman tebu dikembangkan sebagai
salah satu sumber gula komersil sejak tahun 1800an dan menjadi sumber
ekonomi utama dari gula bersama gula bit. Tanaman tebu diklasifikasikan dalam
divisi Maqnoliophyta, kelas Liliopsida, ordo Cyperales, famili Poaceae
(Gramineae) (Barnes, 1973). Tanaman ini dapat tumbuh di daerah beriklim tropik
dan subtropik dengan kelembaban tahunan minimum 600 mm. Tanaman tebu
termasuk tanaman yang paling efisien dalam berfotosintesis dimana hanya
membutuhkan 2% saja dari energi matahari untuk dikonversi menjadi biomassa
(Sharpe, 1998).
Lebih dari 100 negara melakukan budidaya tanaman tebu, dengan luas
keseluruhan lahan sekitar 130.000 km2. Jumlah tebu yang dipanen oleh 20
negara terbesar penghasil tebu mencapai 1200 juta m3 dalam tahun 2002 untuk
diolah menjadi gula. Hal tersebut berarti 6 kali lebih besar daripada produksi gula
bit (Sharpe, 1998). Selama 100 tahun terakhir produksi gula dari tanaman tebu di
dunia mengalami peningkatan yang pesat hasil dari perbaikan proses budidaya,
penggunaan pupuk, pengontrolan hama dan penyakit tanaman, perbaikan
proses di pabrik, mekanisasi produksi dan penggunaan varietas yang
menghasilkan rendemen gula tertinggi. Negara yang terbesar dalam
memproduksi gula dari tebu ini adalah Brazil, India dan Cina.
Bagian dari tanaman tebu yang diambil untuk pembuatan gula adalah
batangnya. Batang tebu diekstrak untuk memperoleh sukrosa. Batang tebu
berdiri tegak dengan diameter 3-4 cm dan tinggi 2-5 meter serta tidak bercabang
(Soebroto, 1983). Batang terdiri dari ruas-ruas dan dibatasi dengan buku-buku,
dimana setiap buku terdapat mata ruas. Gambar tanaman tebu dapat dilihat
Gambar 1 Tanaman tebu (Saccharum officinarum)
Tanaman tebu dipanen pada usia 8-12 bulan. Pemanenan merupakan
tahapan yang penting dalam penanganan tebu. Makin mendekati umur panen,
kadar sukrosa dalam batang tebu semakin meningkat dan setelah melampaui
umur panen terjadi penurunan kadar sukrosa yang diikuti peningkatan kadar
glukosa dan frukrosa. Penurunan kadar sukrosa tersebut disebabkan oleh
aktifitas enzim invertase dalam batang tebu yang meningkat aktifitasnya.
Peningkatan aktifitas invertase dalam jaringan tanaman disebabkan karena
adanya signal kebutuhan energi bagi tanaman untuk metabolisme selanjutnya
(Foyer et. a/. 1997). Energi tersebut dapat diserap tanaman dalam bentuk gula
sederhana (glukosa dan frukrosa) sehingga aktifitas invertase pada sukrosa
terpacu untuk bekerja.
Nira Tebu
Nira tebu adalah suatu ekstrak cairan yang berasal dari batang tebu,
mengandung kadar gula relatif tinggi, dijadikan bahan baku pembuatan gula
kristal. Selain tebu, sumber nira lain yang banyak digunakan dalam pembuatan
gula adalah aren, kelapa, lontar dan sugarbeet. Dalam pabrik gula, proses
ekstraksi nira tebu dari batangnya dilakukan dengan cara pencacahan dan
penggilingan. Nira tebu hasil ekstraksi selain mengandung sukrosa yang akan
menjadi bahan baku pembuatan gula kristal, juga mengandung komponen lain
Komposisi nira tebu tidak akan selalu sama, tergantung pada jenis tebu, kondisi
geografis, tingkat kematangan serta cara penanganan selama penebangan dan
pengankutan (Reece, 2003). Umumnya nira terdiri atas 73-76% air, 11-16%
serat dan 11-16% padatan-padatan terlarut dan tersuspensi (James dan Chen,
1985). Komposisi kimia nira tebu hasil ekstraksi dalam susunan rata-rata
disajikan pada Tabel 1.
Tabel 1 Komposisi kimia nira tebu
Komposisi Kimia Jumlah (%)
Sukrosa
Sumber : Moerdokusumo (1993)
Beberapa jenis polisakarida lain juga terdapat dalam nira tebu sebagai
hasil metabolisme tanaman seperti dextran, levan, pektin, selulosa,
hemiselulosa, pati dan gum (Cuddihy et.al., 2000). Semua bahan selain sukrosa
dapat memberikan efek negatif terhadap proses pembuatan gula kristal, seperti
memberi kesempatan mikroorganisme untuk tumbuh, mempersulit proses
pemurnian dan menghambat proses kristalisasi. Keberadaan pati yang relative
tinggi nira lebih kental sehingga menyebabkan filtrasi berjalan lambat dan larutan
tampak lebih keruh.
Menurut Paine (1953) nira tebu mengandung komponen senyawa
nitrogen organik berupa protein tinggi (albumin), protein sederhana (albuminosa
dan peptosa), asam amino (glisin, asam aspartat) dan asam amida (asparagin,
glutamin). Selain itu nira tebu juga mengandung komponen asam organik lain
seperti akonitat, oksalat, suksinat, glikolat dan malat. Kandungan garam organik
yang teridentifikasi dalam nira tebu diantaranya adalah fosfat, klorida, sulfat,
silikat dan nitrat dari Na, K, Ca, Al dan Fe. Menurut Legaz et. al. (2000), nira tebu
dapat mengandung glikoprotein bila nira tersebut dihasilkan dari batang yang
mengalami kerusakan atau terserang mikroorganisme pathogen.
Dalam keadaan segar, nira tebu berwarna coklat kehijau-hijauan dengan
terdapat dalam nira tebu adalah klorofil yang berasosiasi dengan xantofil,
karoten, antosianin, tannin dan sakretin. Sedangkan warna coklat timbul akibat
reaksi pencoklatan enzimatis dari polifenol.
Proses pengolahan nira tebu menjadi gula terbagi dalam 2 bagian
(Pancoast dan W. Ray, 1980). Pertama, proses ekstraksi batang tebu untuk
diambil niranya, kemudian dilakukan rafinasi sebagian dan kristalisasi,
menghasilkan gula mentah (raw sugar). Bahan selain sukrosa dipisahkan
semaksimal mungkin dengan proses-proses defekasi, sulfitasi, karbonatasi,
defekasi-sulfitasi serta kombinasi keempat proses tersebut. Kedua, proses
purifikasi gula mentah dan kristalisasi lebih lanjut, menghasilkan gula (refine
sugar). Proses kerusakan banyak terjadi pada tahap pertama pembuatan gula
dimana nira tebu masih memiliki aktivitas enzimatis dan mikrobiologis.
Dalam proses pembuatan gula kristal, degradasi sukrosa (inversi atau
hidrolisis) harus dicegah sebesar mungkin. Degradasi sukrosa menghasilkan
molekul glukosa dan fruktosa, yang dikenal sebagai gula invert. Glukosa dan
fruktosa bersifat tidak dapat dikristalkan dan menghambat proses kristalisasi
sukrosa dalam pengolahan gula. Hal tersebut menyebabkan rendemen gula
menjadi rendah. Faktor-faktor yang dapat meningkatkan degradasi sukrosa
diantaranya adalah peningkatan keasaman, suhu dan lama inkubasi nira tebu
pada suhu yang terus meningkat.
Kerusakan pada Nira Tebu
Sukrosa dan Degradasinya
Sukrosa adalah jenis gula disakarida yang dikenal juga sebagai "gula
meja", berwarna putih, berbentuk kristal padat dengan rasa manis dan dapat
membentuk caramel serta terdekomposisi pada suhu 186°C. Pada saat sukrosa
mengalami dekomposisi akan menghasilkan karbondioksida dan air serta
menghasilkan warna coklat pada produknya. Rumus empirik sukrosa adalah
C12H22O11, sama seperti laktosa dan maltosa tetapi berbeda struktur molekulnya
(lihat Gambar 2).
Dalam molekul sukrosa, molekul penyusunnya (glukosa dan fruktosa)
diikat oleh ikatan glikosidik 1→2-α, -. Dengan demikian secara sistemik sukrosa
dinamakan sebagai α-D-glucopyranosyl-(1→2)-β-D-fructofuranoside. Sukrosa
memiliki sifat-sifat lainnya sebagai berikut (Chaplin. 2004) :
• Dapat larut dalam air dengan kelarutan 2,1 g dalam 1 g air pada suhu 25°C
• Menunjukan indeks refraktif pada larutannya 10%
• Suhu melting pada 186°C
• Densitas energi: 17 kJ/g
• Berat molekul: 342,3 g/mol
Degradasi sukrosa, khususnya pada nira tebu, terjadi disebabkan oleh
reaksi invertasi terhadap molekul sukrosa. Reaksi invertasi merupakan reaksi
hidrolisis irreversible dimana satu molekul sukrosa dan satu molekul air
menghasilkan satu molekul glukosa dan satu molekul fruktosa. Proses ini
dipercepat dengan panas. Invertasi molekul sukrosa murni diproses paling cepat
sampai mendekati 5000 kali pada 90°C dibanding pada 20°C. Pada prakteknya
reaksi ini terjadi pada pH dibawah 7 dan proses dipercepat dengan penurunan
pH. Reaksinya adalah indotermik dengan energi aktivasi 25,9 kilokalori per mol
pada 20°C. Reaksi ini dapat juga melalui katalisis biokimia dengan beberapa
enzim, khususnya invertase (Pennington dan Charles, 1990 dan Wang, 2004).
Proses inversi dapat terjadi secara sempurna selama 48 - 72 jam pada suhu
50°C dengan pH 4,5 (Chaplin. 2004). Reaksi invertasi atau hidrolisis sukrosa
selengkapnya disajikan pada Gambar 3.
Gambar 3 Reaksi invertasi atau hidrolisis sukrosa
Invertase
Nama lain dari invertase adalah -fructofuranosidase yang menunjukan
reaksi yang dikatalis enzim ini adalah reaksi hidrolisis pada gugus ujung
non-reduksi -fructofuranoside dalam -fructofuranosides. Selain itu reaksi tersebut
unit glukosa. Selain oleh invertase, sukrosa juga dapat dihidrolisis dalam kondisi
lingkungan yang asam walaupun tanpa adanya enzim (Wang, 2004).
Invertase dapat dihasilkan oleh beberapa jenis mikroorganisme dengan
menggunakan substrat sukrosa. Secara komersil invertase dihasilkan dari jenis
khamir Saccharomyces cerevisiae atau Saccharomyces carisbergensis.
Walaupun berasal dari kultur yang sama, invertase dapat memiliki bentuk yang
berbeda-beda. Sebagai contoh, invertase intraselular mempunyai berat molekul
135.000 dalton sedangkan invertase ekstraselular mempunyai berat molekul
270.000 dalton (Wang, 1999).
Berbeda dengan kebanyakan enzim, invertase memiliki kisaran wilayah
pH yang cukup besar yaitu pH 3,5-5,5, dengan pH optimum 4,5. Aktivitas
invertase optimum pada suhu sekitar 55°C. Pada beberapa jenis enzim, nilai
Michaelis-Mentennya mempunyai kisaran nilai Km antara 2 mM dan 5 mM,
namun pada invertase mempunyai nilai Km sekitar 30 mM.
Invertase Dalam Nira Tebu
Dalam tanaman tebu mengandung berbagai jenis enzim, diantaranya
adalah enzim invertase yang berperan dalam reaksi invertasi sukrosa menjadi
glukosa dan fruktosa. Selain dalam tanaman tebu, invertase juga teridentifikasi
dalam buah apel (Qiu Hong PAN, et. a/., 2005), umbi kentang (Ewing et. a/.,
1977, Pressey dan Row Shaw, 1966, Ewing et. a/., 1977), buah tomat (Pressey,
1994) dan ubi (Matsushita dan Uritani, 1976).
Tanaman tebu mengandung invertase dalam bentuk yang sama (isoform)
dengan keberadaan atau posisi yang berbeda-beda sebagai berikut : invertase
netral (neutral invertase), invertase asam vakuola (vacuolar acid invertase),
invertase asam yang terikat pada dinding sel (cell-wall bound acid invertase) dan
invertase asam apoplastik terlarut (apoplastic soluble acid invertase) (Vorster dan
Botha, 1998). Pengelompokan invertase juga dapat didasarkan pada pH
optimum aktifitasnya, yaitu : invertase asam, invertase netral dan invertase alkali.
Pengelompokan invertase lainnya adalah berdasarkan lokalisasi terhadap
intraseluler yaitu : invertase terlarut dan invertase terikat (Mahbubur et.al. 2004).
Menurut Zhu et.al. (1997), aktifitas invertase asam yang terlarut memiliki
korelasi dengan akumulasi sukrosa dalam batang tebu. Sementara itu hal yang
sama tidak terjadi pada invertase netral. Menurut Vorster dan Botha (1998),
menunjukan korelasi yang signifikan. Invertase netral memiliki aktifitas spesifik
yang lebih tinggi daripada invertase asam terlarut (apoplastik dan vakuola).
Invertase asam yang terikat pada dinding sel teridentifikasi keberadaannya
dalam batang tebu sejak sebelum batang tebu matang atau siap panen.
Invertase pada tebu termasuk jenis glikoprotein dengan kadar gula 7,29%
dan berat molekul 218 kDa (Mahbubur et. al., 2004). Aktifitas invertase maksimal
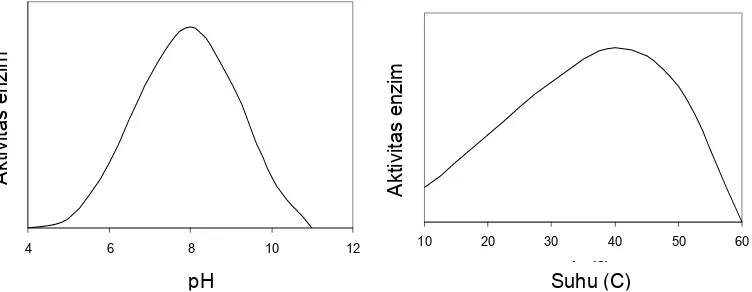
pada pH 7,2 dan suhu 60°C. Pengaruh pH dan suhu terhadap aktivitas invertase
dalam nira tebu selengkapnya disajikan pada Gambar 4 dan Gambar 5.
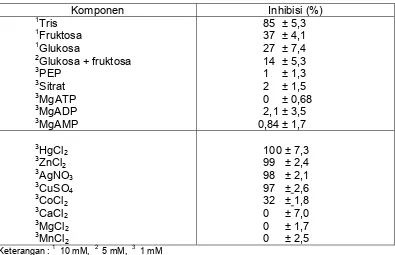
Kemampuan penghambatan aktivitas invertase oleh berbagai produk metabolit
dan ion logam disajikan pada Tabel 2.
0
Gambar 4 Pengaruh pH terhadap aktivitas invertase pada tebu (Mahbubur et.al., 2004)
Tabel 2 Kemampuan penghambatan aktivitas invertase oleh berbagai produk metabolit dan ion logam (Vorster, dan Frederik, 1998)
Komponen Inhibisi (%)
1Tris
Kerusakan pada nira tebu juga dapat disebabkan oleh aktivitas
mikroorganisme melalui proses fermentasi. Beberapa jenis mikroba dapat juga
memproduksi invertase seperti Cladosporium cladosporioides (Almeida et. a/.,
2000) dan kamir methylotropik (Hansenula polymorpha dan Pichia pastoris)
(Niuris et.al., 2000) sehingga kontaminannya dapat meningkatkan konsentrasi
invertase dalam nira tebu. Kontaminasi mikroorganisme ke dalam nira tebu
dimulai sejak pemanenan hingga berlangsungnya proses pengolahan, termasuk
kontaminasi dari peralatan pengolahan.
Salah satu jenis mikroorganisme yang sering teridentifikasi
mengkontaminasi nira tebu adalah Leuconostoc mesenteroides yang mempunyai
kemampuan menghasilkan enzim untuk mengkonversi sukrosa menjadi fruktosa
dan dextran. Dekstran dihasilkan oleh reaksi enzim dextransucrase pada
sukrosa. Dekstran memiliki struktur sukrosa dan menghambat kristalisasi
sukrosa.
Kerusakan lebih lanjut dari degradasi sukrosa adalah terbentuknya
asam-asam organik seperti asam-asam laktat dan asetat (Mathlouthi, 2000). Leuconostoc
mesenteroides dapat mengkonsumsi sukrosa dengan sangat cepat (8.05 g/l/jam
Guglielmone et. a/., 2000 di dalam Mathlouthi, 2000 ). Proses fermentasi tersebut
berarti terjadi kehilangan sukrosa sebanyak 59% pada suhu 25 °C dan 62% pada
suhu 30 °C. pada suhu yang lebih tinggi (37 °C and 40 °C) persentase konsumsi
sukrosa dapat menurun menjadi 47% dan 27% (Mathlouthi, 2000).
Jenis mikroorganisme lain yang teridentifikasi mengkontaminasi nira tebu
adalah Flavobacterium rigenes, Brevibacterium sulferens, Flavobacterium
devorans, Candida pulcherrima, Klebsiela azaenae, Chromabacterium lividum,
Bactobacillus arabinosus dan Saccharomyces lactis. Mikroba lain yang dapat
mengkontaminasi nira tebu adalah Saccharococcus sacchari yang diindikasikan
dengan terbentuknya glikoprotein dalam batang tebu (Legaz et. a/., 2000).
Kerusakan nira akibat aktivitas mikroorganisme ditandai dengan rasa
asam pada nira, berbuih putih dan berlendir dengan reaksi kimia seperti yang
disajikan pada Gambar 6 (Goutara dan Wijandi, 1985). Menurut Legaz et. a/.,
(2000), adanya glikoprotein juga menjadi indikasi kontaminasi mikroba dalam nira
tebu dan telah terjadi kerusakan terlebih dahulu pada batang tebu.
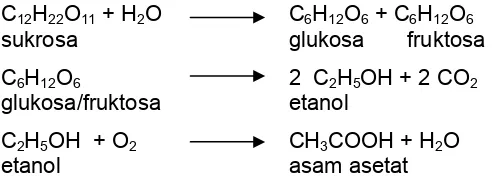
C12H22O11 + H2O C6H12O6 + C6H12O6
sukrosa glukosa fruktosa
C6H12O6 2 C2H5OH + 2 CO2
glukosa/fruktosa etanol
C2H5OH + O2 CH3COOH + H2O
etanol asam asetat
Gambar 6 Tahapan reaksi fermentasi pada nira tebu
Pada reaksi pertama terjadi reaksi invertasi pada sukrosa dengan katalis
invertase atau reaksi hidrolisis karena adanya asam. Pada reaksi kedua, hasil
reaksi invert atau hidrolisis sukrosa dapat dikonsumsi oleh mikroorganisme dan
diubah menjadi alkohol dan selanjutnya dioksidasi menjadi asam asetat.
Terbentuknya asam menyebabkan reaksi hidrolisis sukrosa terjadi lagi dan nira
menjadi asam. Menurut Goutara dan Wijandi (1985), proses degradasi sukrosa
diikuti dengan pembentukan warna coklat tua. Semakin tinggi jumlah
dekomposisi sukrosa makin nyata warnanya. Selanjutnya komponen glukosa
dan fruktosa yang telah terbentuk dari reaksi hidrolisa sukrosa, mengalami
proses fermentasi membentuk etil alkohol. Etil alkohol kemudian dioksidasi
menjadi asam asetat. Kondisi nira yang asam akan semakin meningkatkan
Pertumbuhan mikroorganisme secara umum mengikuti pola tertentu yang
terdiri atas 6 fasa yaitu fasa awal, fasa penyesuaian, fasa eksponensial, fasa
pelambatan, fasa stasioner dan fasa penurunan. Perubahan antar fasa
merupakan fungsi dari waktu pertumbuhan. Fasa awal adalah masa
penyesuaian mikroorganisme sejak mengkontaminasi bahan. Pada fasa ini
terjadi sintesis enzim oleh sel yang diperlukan untuk metabolisme metabolit.
Setelah fasa awal selesai, mulai terjadi reproduksi sel mikroorganisme.
Konsentrasi sel mikroorganisme atau biomassa meningkat, mula-mula perlahan
kemudian makin lama makin meningkat. Pada saat laju pertumbuhan sel
mikroorganisme mencapai titik maksimal, maka terjadi pertumbuhan secara
eksponensial. Pada fasa ini keadaan pertumbuhan mikroorganisme mantap.
Penurunan laju pertumbuhan atau fasa pelambatan terjadi pada saat substrat
yang diperlukan mikroorganisme untuk pertumbuhan mendekati habis dan terjadi
penumpukan produk-produk penghambat pertumbuhan. Fasa pertumbuhan
akan terhenti dan terjadi modifikasi struktur biokimiawi sel mikroorganisme pada
fasa stasioner. Fasa selanjutnya adalah fasa penurunan , dimana jumlah sel
mikroorganisme berkurang akibat terjadi kematian yanbg diikuti autolisis oleh
enzim selular.
Penghambatan Kerusakan Nira Tebu
Pengaruh Suhu dan pH
Aktivitas enzim sangat dipengaruhi oleh perubahan pH dan suhu. Setiap
enzim memiliki pH dan suhu optimum untuk aktivitasnya. Pada saat reaksi
berjalan dibawah titik optimum, kecepatan reaksi berlangsung semakin cepat
hingga titik optimum. Setelah melampaui titik optimumnya, kecepatan reaksi
berlangsung semakin menurun, bahkan pada menjadi inaktif. Perubahan
kecepatan aktivitas enzim akibat pengaruh pH dan suhu disebabkan karena
perubahan struktur tersier enzim dan ikatan kovalen yang mempengaruhi bentuk
enzim (seperti interaksi ion dan ikatan hydrogen). Sebagai contoh, perubahan pH
akan mengubah posisi ionisasi asam amino yang akhirnya akan mempengaruhi
aktivitas katalitiknya sebagai enzim. Sementara itu ikatan hydrogen juga sangat
dipengaruhi oleh peningkatan suhu, dimana pada suhu tinggi ikatan hydrogen
akan putus, sehingga struktur enzim akan berubah dan kemampuannya bereaksi
dengan substrat akan hilang (Harrow dan Mazur, 1958). Grafik hubungan
Pengaruh suhu dan pH dapat digunakan sebagai faktor untuk mencegah
aktifitas enzim yang tidak dikehendaki. Dengan penggunaan suhu yang
menyebabkan inaktivasi enzim maka kerusakan enzimatis dapat dicegah. Pada
nira tebu, enzim yang sangat berperan dalam kerusakan nira tebu adalah
invertase. Enzim ini terdapat secara alami dalam nira tebu dan juga dihasilkan
oleh mikroorganisme kontaminan, khususnya Saccharomices cereviceae.
4 6 8 10 12
Gambar 7 Grafik hubungan perubahan ph dan suhu terhadap aktivitas enzim
Kerusakan pada nira tebu dapat dihambat dengan mengontrol reaksi
kerusakan melalui pengaturan pH dan suhu. Kedua parameter tersebut memiliki
peran besar mempengaruhi aktivitas enzimatis dan mikrobiologis. Setiap enzim
memiliki kondisi pH dan suhu tertentu untuk reaksinya, demikian pula aktifitas
mikrobiologi. Enzim invertase dalam tebu memiliki aktivitas maksimal pada pH
7,2 dan suhu 60° C, dan mencapai setengah aktivitas maksimalnya pada pH 6,4
dan 8,2 (Mahbubur et.al., 2004, Vorsterdan Frederik, 1998). Untuk mengurangi
kehilangan sukrosa pada tahap pemurnian dan evaporasi, pH harus diatur agar
mencapai 6,3-6,4 pada akhir evaporator (Eggleston et.al., 2003). Penggunaan
suhu tinggi selain membunuh mikroorganisme dalam nira dapat juga berfungsi
menginaktivasi enzim seperti invertase yang aktivitasnya terhenti dengan
pemanasan selama 2 menit pada suhu 90° C (Vorster dan Frederik, 1998).
Suhu dan pH juga mempengaruhi aktivitas mikroorganisme. Seperti
halnya enzim, mikroorganisme juga memiliki batas optimum agar dapat bertahan
hidup. Umumnya mikroorganisme tidak dapat bertahan hidup pada kondisi suhu
Pengaruh Penambahan Bahan Pengawet
Upaya pencegahan kerusakan akibat reaksi enzimatis dan mikrobiologis
juga dapat dilakukan dengan penambahan bahan pengawet, baik yang bersifat
inhibitor enzim ataupun antimikrobial. Inhibisi enzim atau penghambatan aktifitas
enzim merupakan hal penting yang perlu diperhatikan dalam penelitian yang
menyangkut kesehatan. Misalnya Pb, Hg dan logam berat lainnya bersifat sangat
beracun pada manusia karena kerjanya sebagai penghambat kerja enzim.
Meskipun mekanisme penghambatan kerja invertase oleh logam-logam berat
berbeda dengan mekanismenya pada enzim lain, namun dapat dipastikan bahwa
logam-logam berat tersebut sangat menghambat kerja invertase. Sebagai
contoh, ion Ag++ menyerang rantai sisi histidin pada molekul invertase dan
menyebabkan invertase tidak aktif.
Beberapa jenis logam sangat efektif menghambat aktivitas enzim
invertase seperti HgCI2, ZnCI2, AgNO3, dan CuSO4 (Vorster dan Frederik, 1998,
Mahbubur et.al., 2004). Natrium benzoat dan larutan amoniak dalam jumlah
0.05% dan 0.32% dapat menghentikan fermentasi pada nira tebu selama 2-3
hari, pada konsentrasi 0.10% dan 1.28% dapat menghentikan fermentasi hingga
6 hari (Bobadilla dan Preston, 1981, Duarte et. al., 1981).
Inhibisi enzim juga dapat dilakukan oleh selektif enzim, pestisida atau
herbisida yang cara kerjanya adalah dengan menghambat pertumbuhan atau
pertahanan organisme yang menghasilkan invertase. Berbagai perlakuan untuk
penyakit juga dapat bersifat penghambat enzim. Jenis inhibitor lainnya adalah
substrat dan produk reaksi enzimatis itu sendiri. Pada invertase, sukrosa dan
gula invertnya dapat menghambat kerja invertase pada konsentrasi yang tinggi
(Wang, 1999).
Aplikasi penambahan pengawet pada pembuatan gula dari nira tebu
harus mengikuti aturan pemerintah dan mengikuti standar food grade.
Penggunaan beberapa jenis bahan kimia dalam bahan pangan seperti formalin
dan borax kini sangat dilarang karena membahayakan kesehatan. Berbagai
bahan alami kini dikembangkan sebagai pengawet seperti yang dilakukan oleh
petani-petani nira aren sejak lama, yaitu memanfaatkan akar kawao, kulit dan
buah manggis, laru janggut, kulit batang kusambi, remasan daun jambu mete,
tangkal dan kulit batang nangka (Sedarnawati et. al,, 1999). Pemanfaatan
komponen kimia dari ekstrak tanaman atau komponen fitokimia telah
masa kini komponen-komponen fitokimia tersebut banyak diteliti untuk
diidentifikasi lebih lanjut.
Fitokimia sebagai Bahan Pengawet
Fitokimia adalah segala jenis zat kimia atau nutrien yang diturunkan dari
sumber tumbuhan, termasuk sayuran dan buah-buahan. Fitokimia dapat
berperan sebagai antimikroba, antivirus, antiimflamantori, perlakuan pengobatan
penyakit dan bahan pengawet. Penelitian berbagai fitokimia telah banyak
dilakukan dalam rangka pemanfaatan lebih lanjut senyawa tersebut. Beberapa
senyawa fitokimia yang banyak dimanfaatkan adalah (Murray, 1996):
• Glikosida, suatu molekul yang dibangun oleh struktur molekul gula
(glikon) dan non-gula (aglikon). Biasanya senyawa non-gula (aglikon)
penyusun glikosida adalah senyawa fitokimia lain yang akan
membebaskan jdiri jika diperlukan. Struktur glikosida dapat pecah
disebabkan oleh reaksi hidrolisis dan enzimatis. Pemanfaatan glikosida
akan didasarkan oleh kemampuan senyawa aglikonnya. Glikosida juga
dapat digunakan sebagai pengikat toksik.
• Flavonoid, termasuk didalamnya adalah isoflavonoid, biasa digunakan
sebagai antioksidan. Fitokimia ini juga berperan dalam pigmentasi
(merah, kuning dan biru), bersifat antimikroba, antialergik,
antiimflamantori, dan antikanker.
• Alkaloid, merupakan turunan senyawa amina, bersifat racun dan dapat
membentuk garam dengan asam (asam mineral dan organik). Senyawa
ini bersifat anastetik dan analgesik, sering dimanfaatkan sebagai bahan
obat-obatan.
• Terpenoid, terdiri atas beberapa unit isopren, berperan dalam
menghasilkan aroma, rasa dan warna pada tanaman. Senyawa ini juga
bersifat antimikroba dan antineoplastik.
• Tannin, senyawa yang dapat mengendapkan protein, bersifat antidiare,
hemostatik dan antihemordial.
Kawao (Millettia sp.)
Kawao (millettia) merupakan tanaman perdu yang memanjat, tegak,
panjang 10 - 30 m, tumbuh di hutan hutan dan di tepi-tepi sungai mulai dari
Tanaman kawao atau Millettia termasuk dalam famili Fabaceae (sub-famili
papillionoidae). Tanaman ini memiliki 200 spesies dengan bentuk pohon,
tanaman merambat dan perdu, yang tersebar di daerah tropis Afrika (Irvine,
1961), Asia, Australia, and America (Thulin, 1983). Pada Gambar 8 disajikan
salah satu jenis tanaman kawao atau millettia.
Gambar 8 Tanaman kawao (Millettia).
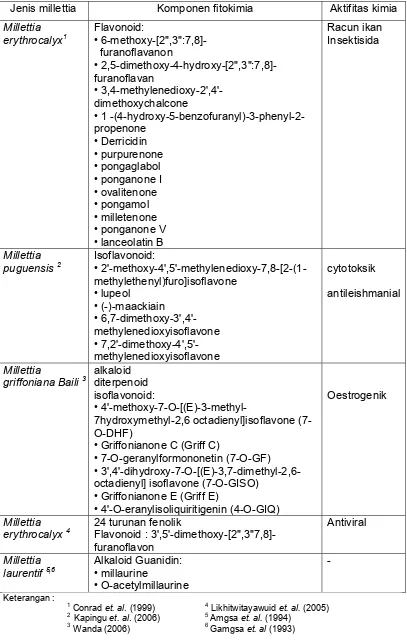
Tanaman kawao (millettia) mengandung komponen fitokimia, diantaranya
adalah alkaloid, diterpenoid, coumarin, flavonoid dan isoflavonoid (Amgsa et. a/.,
1994; Dewick, 1994; Wanda, 2006). Jenis isoflavon pada millettia yang telah
diidentifikasi oleh Yankep et. al., (1997; 1998; 2001) adalah chalcone, a rotenoid,
a phenylcoumarine dan beberapa jenis isoflavon lain. Komponen-komponen
tersebut diekstraksi dari bagian akar dengan menggunakan heksan. Pada Tabel
3 disajikan beberapa jenis tanaman Millettia dengan komponen fitokimianya.
Tanaman millettia banyak dimanfaatkan sebagai trypanocidal,
anti-plasmodial, insektisida, piscisida, molluscicida (Teesdale, 1954; Singhal et al.,
1982; Amgsa et. al., 1994). Akar tanaman ini digunakan sebagai obat tradisional
oleh sebagian masyarakat Indonesia seperti obat cacing, mata dan luka luar
(Menninger, 1970). Menurut Teysmann dalam Menninger (1970), orang Jawa
memberikan sepotong akar dalam cairan palem yang masih segar agar cairan
tersebut (nira) tidak menjadi asam. Tanaman ini juga dimanfaatkan dalam bidang
pengobatan (Gamgsa et. al., 1993;) Millettia conraui, Millettia laurantii and
Millettia sanagana digunakan sebagai obat sakit perut yang disebabkan parasit
pada anak (Singhal, 1982). Millettia zechiana digunakan sebagai obat bronchial
rhinopharyngial. Ekstrak akar dan batang Millettia griffoniana digunakan sebagai
obat tradisional, insektisida, mengurangi peradangan yang disebabkan penyakit
paru dan asma, infertilitas, smenorrhea dan masalah menopause (Sandberg and
Cronlund, 1977). Ekstrak akar Millettia griffoniana mengandung isoflavon
Griffonianone D yang bersifat mengurangi peradangan (antiimflamantory)
Tabel 3. Beberapa jenis tanaman Millettia dengan komponen fitokimianya
Jenis millettia Komponen fitokimia Aktifitas kimia
Millettia
• Griffonianone E (Griff E)
Tanaman kawao (millettia) juga mengandung komponen rotenoid yang
dikenal sebagai salah satu insektisida alami, termasuk untuk membasmi larva
nyamuk Aedes aegypti (Abe et al., 1985). Menurut Yenesew et. al., 2003)
rotenoid bersifat larvisida sebagaimana penelitiannya pada jenis millettia : M.
dura, M. lasiantha, M. leucantha, M. oblata, M. tanaensis and M. Usaramensis.
Struktur kimia rotenioid dan flavonoid lain yang diisolasi dari spesies Millettia
disajikan pada Gambar 9.
Gambar 9. Struktur kimia rotenoid dan flavonoid lain yang diisolasi dari salah satu spesies millettia (Yenesew et. a/., 2003)
Manggis (Garcinia mangostana L.)
Tanaman manggis (Garcinia mangostana L) termasuk dalam famili
Clusiaceae (Guttiferae). Tanaman manggis berbentuk pohon yang selalu hijau
dengan tinggi 6-20 m. Batangnya tegak dengan batang pokok yang jelas. Kulit
batang berwarna coklat dan memiliki getah kuning. Asal usul tanaman manggis
tidak diketahui. Waktu berbunga dimulai pada bulan Mei hingga bulan Januari.
Tanaman ini dapat tumbuh di Jawa pada ketinggian 1-1000 m di atas permukaan
laut, pada berbagai tipe tanah (pada tanah liat dan lempung yang kaya bahan
kelembaban dan panas dengan curah hujan yang merata (IPTEKnet, 2005).
Pada Gambar 10 disajikan bentuk pohon, daun dan buah tanaman manggis
(Garcinia mangostana L).
Gambar 10 Tanaman manggis (Garcinia mangostana)
Kulit kayu, kulit buah dan lateks kering Garcinia mangostana
mengandung sejumlah zat warna kuning yang berasal dari dua metabolit yaitu
mangostin dan -mangostin yang berhasil diisolasi. Mangostin merupakan
komponen utama sedangkan -mangostin merupakan konstituen minor
(IPTEKnet, 2005). Dari hasil suatu penelitian dilaporkan bahwa Mangostin
(1,3,6-trihidroksi-7-metoksi-2,8-bis(3metil-2-butenil)-9H-xanten-9-on) hasil isolasi dari
kulit buah mempunyai aktivitas antiinflamasi dan antioksidan. Dari hasil studi
farmakologi dan biokimia dapat diketahui bahwa mangostin secara kompetitif
menghambat tidak hanya reseptor histamin H, mediator kontraksi otot lunak
tetapi juga epiramin yang membangun tempat reseptor H1, pada sel otot lunak
secara utuh. Mangostin merupakan tipe baru dari histamine (IPTEKnet, 2005).
Dalam penelitian lain ditemukan komponen fitokimia dalam batang
manggis adalah tannin (Abbiw, 1990), α-mangostin dan -mangostin (Sakagami
et. al., 2005; linuma et. al., 7996; Dharmaratne et al., 2005; Suksamrarn et. a/.,
2002) dan xantonin (Ee et. al., 2006; Nilar e.t al., 2002; Gopalakrishnan et. al.,
1997). Menurut Ee et. al., (2006) komponen xantonin pada batang manggis yang
(2,6-dihydroxy-8-methoxy-5-(3-methylbut-2-enyl)-xanthone) dan 6 jenis xantonin prenilat yaitu : α-mangostin, -mangostin,
garcinone D, 1,6-dihydroxy-3,7-dimethoxy-2-(3-methylbut-2-enyl)-xanthone,
mangostanol dan
5,9-dihydroxy-8-methoxy-2,2-dimethyl-7-(3-methylbut-2-enyl)-2H,6H-pyrano-[3,2-b]-xanthene-6-one. Komponen xantonin juga terdapat pada
lateks batang manggis hingga 75% (Dharmaratne et. al., 2005). Ekstraksi
komponen xantonin dilakukan menggunakan heksan (Nilar e.t al., 2002).
Komponen-komponen fitokimia dalam batang manggis memiliki sifat
antibacterial, anti-inflammatory, antifungal, larvisida, antiviral, antioksidan dan
sejumlah aktifitas biologi lainnya (Dharmaratne et. al., 2005; Sundaram et. al.,
2002; Ee et. al., 2006; Perry, 2007). Senyawa α-mangostin telah diteliti bersifat
antimikroba, khususnya pada Enterococci and S. aureus, dengan nilai
konsentrasi penghambatan minimum atau minimum inhibitory concentration
(MIC) masing-masing 6,25 dan 12,5 microg/ml (Sakagami et. al., 2005; linuma et.
al., 1996). Pada Mycobacterium tuberculosis, α- and -mangostins memiliki nilai
konsentrasi penghambatan minimum atau minimum inhibitory concentration
(MIC) 6.25 μg/ml (Suksamrarn et. al., 2002). Beberapa xantonin yang diekstrak
dari manggis bersifat antifungal (Geetha et. al., 1997; Gopalakrishnan et. al.,
1997). Ekstrak komponen batang manggis juga telah diuji bersifat larvisida,
khususnya pada larva nyamuk Aedes aegypti (Ee et. al., 2006). Dalam beberapa
penelitian, komponen dalam manggis berupa mangostin dan xantonin bersifat
inhibitor terhadap beberapa jenis protein, enzim dan reaksi kimia lain
(Chairungsrilerd, 2002; Mahabusarakam et. al., 2002; Furukawa et. al., 2002;
Jinsart et. al., 2002). Dengan sifat-sifat yang telah dijelaskan, batang manggis
digunakan untuk berbagai keperluan, diantaranya sebagai obat seperti diare,
disentri dan penyakit lainnya (Jayaweera, 1981; Quisumbing, 1978; Morton,
Gambar 11. Struktur Mangostin (Nilar e.t al., 2002)
α-mangostin R1 = H. R2 = CH3 -mangostin R1 = H. R2 = H -mangostin R1 = H. R2 = H
Tanaman manggis juga digunakan oleh sebagian petani aren untuk
mencegah kerusakan niranya, dengan memasukan kulit batang atau buah
manggis ke dalam larutan nira. Kulit batang manggis juga digunakan sebagai
antioksidan karena mengandung xantones (α dan y-mangostens) dengan
kemampuan yang lebih baik daripada antioksidan BHA dan α-tocopherol
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Bioindustri TIN Fateta IPB,
Laboratorium Teknologi Kimia TIN Fateta IPB dan Laboratorium Rekayasa
Bioproses PAU IPB. Penelitian ini dilakukan pada bulan September 2005 sampai
bulan September 2006.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi nira tebu
(Saccharum Officinarum), akar kawao (Millettia sp.) dari kawasan agropolitan leuwiliang, kulit batang manggis (Garcinia mangostana L.), kapur (CaO) dan bahan-bahan kimia untuk analisis.
Peralatan yang digunakan dalam penelitian ini adalah alat pemeras tebu,
saringan, tangki berpengaduk dengan pengatur suhu, refraktometer, pH-meter,
spektrofotometer, HPLC (High Performance Liquid Chromatografi) dan alat-alat gelas.
Tahapan Penelitian
Penelitian ini dilakukan dalam 3 tahapan percobaan. Tahap pertama
melakukan karakterisasi bahan yang akan digunakan dalam penelitian yaitu : nira
tebu dan bahan pengawet (akar kawao dan kulit batang manggis). Tahap kedua
melakukan pengujian faktor yang mempengaruhi degradasi sukrosa dalam nira
tebu, meliputi faktor suhu, pH, nisbah pengawet (akar kawao dan kulit batang
manggis) dan lama inkubasi dengan parameter pengamatan kadar sukrosa dan
gula pereduksi. Tahap ketiga melakukan pengukuran perubahan kualitas nira
tebu selama penyimpanan dengan parameter pengamatan kadar sukrosa, gula
pereduksi, total asam dan pH. Bagan tahapan penelitian selengkapnya disajikan
Mulai
Selesai
Penentuan Perubahan Kualitas Nira Tebu Selama Penyimpanan
Penentuan Pengaruh Faktor
Suhu, pH, Nisbah Pengawet, Lama inkubasi Karakterisasi Bahan
Nira Tebu, Akar Kawao, Kulit Batang Manggis
Gambar 12 Diagram alir tahapan penelitian
Prosedur Penelitian
Karakterisasi nira tebu dilakukan terhadap hasil ekstraksi batang tebu
menggunakan alat penggiling atau pemeras tebu sehingga diperoleh niranya.
Parameter yang diukur dari nira tebu tersebut meliputi kadar sukrosa, gula
pereduksi, total asam dan nilai pH. Kadar sukrosa dan gula pereduksi (glukosa
dan fruktosa) diukur menggunakan HPLC, total asam diukur dengan metoda
titrasi dengan NaOH 0,005N dan nilai pH diukur menggunakan alat pH-meter.
Karakterisasi akar kawao dan kulit batang manggis dilakukan dengan
membawa kedua jenis bahan tersebut ke tempat pengujian fitokimia bahan yaitu
di Laboratorium Balai Penelitian Tanaman Rempah dan Obat, Cimanggu, Bogor.
Pengukuran dilakukan secara kualitatif terhadap parameter komponen fitokimia,
yaitu alkaloid, saponin, tannin, fenolik, flavonoid, triterpenoid, steroid dan
glikosida. Standar pengukuran komponen fitokimia mengikuti standar yang
disepakati oleh Komite Akreditasi Nasional (KAN).
Pengujian pengaruh faktor yang mempengaruhi degradasi sukrosa pada
tahap kedua dari penelitian ini meliputi faktor suhu, pH, nisbah pengawet dan
lama inkubasi. Parameter yang diukur pada tahapan ini meliputi kadar sukrosa
dan gula pereduksi. Metoda pengukuran kadar sukrosa dilakukan menggunakan
metoda refraktometrik yaitu nira tebu hasil perlakuan diukur nilai brixnya
dikonversikan pada tabel hubungan brix dengan kadar sukrosa (Pancoast dan
Junk, 1980). Gula pereduksi diukur menggunakan metoda DNS, dimana nira
tebu direaksikan dengan pereduksi 3,5-dinitrosalicylate (3,5-DNS). Prinsip kerja
metoda DNS adalah, dalam suasana alkali gula pereduksi akan mereduksi asam
3,5-dinitrosalicylate (3,5-DNS) membentuk senyawa yang dapat diukur
absorbansi pada panjang gelombang 540 nm menggunakan spektrofotometer
(Apriantono, et. al., 1989).
Pemilihan suhu yang digunakan pada penelitian ini untuk diuji
pengaruhnya terhadap degradasi sukrosa dalam nira tebu didasarkan pada studi
literatur tentang suhu optimal penghambatan aktivitas invertase. Invertase
memiliki aktivitas optimal pada suhu 600C (Mahbubur, et.al., 2004), sehingga suhu yang dipilih adalah suhu di bawah atau di atas 600C. Pada percobaan ini
dipilih suhu 65˚C, 75˚C dan 85˚C mengingat pada suhu tersebut aktivitas enzim
dan mikroorganisme menunjukan kecendrungan menurun.
Pemilihan pH juga didasarkan pada studi literatur dan kondisi proses
yang biasa dilakukan di industri gula. Aktivitas invertase optimal pada pH 7,2
(Mahbubur, et.al., 2004). Kondisi proses di pabrik gula rata-rata menggunakan pH di atas 7 karena adanya pemberian kapur pada nira mentah untuk
mengendapkan zat-zat pengotor bukan gula (Moerdokusumo, 1993). Dengan
kedua dasar di atas maka pH yang dipilih untuk percobaan ini adalah pH 7,5; 8,5
dan 9,5. Penggunaan pH yang terlalu tinggi juga tidak dikehendaki dalam proses
pengolahan nira karena dapat meningkatkan reaksi pencoklatan (browning) akibat degradasi lanjut gula pereduksi. Pada percobaan ini nira ditambahkan
kapur (CaO) untuk mengatur pH nira awal dan sebagai pengkondisian agar tidak
jauh berbeda dengan kondisi di pabrik gula.
Pengawet yang digunakan dalam penelitian ini adalah bahan yang biasa
digunakan petani gula aren di Jawa Barat yaitu akar kawao dan kulit batang
manggis. Pada percobaan ini kedua bahan tersebut digunakan secara
bersamaan dengan perbandingan tertentu yaitu 3:7, 5:5 dan 7:3 (g/g) (ekstrak
akar kawao : kulit batang manggis) dengan jumlah total bahan dalam nira tebu
adalah 2% (v/v). Ekstraksi ini dilakukan berdasarkan pengalaman empiris petani
dalam menggunakan akar kawao dan kulit batang manggis sebagai pengawet
nira aren.
Waktu reaksi ditentukan dengan percobaan menggunakan bahan
sebanyak 2% dari total larutan nira tebu pada suhu kamar dan pH 8,5.
berdasarkan percobaan pendahuluan, perubahan kadar sukrosa dan gula
pereduksi yang terpilih untuk pengujian pengaruh adalah selama selang waktu
50, 80 dan 110 menit
Pengujian perubahan kualitas nira tebu selama penyimpanan pada tahap
ketiga penelitian ini meliputi pengukuran parameter berupa kadar sukrosa, gula
pereduksi, total asam dan pH. Metode pengukuran masing-masing parameter
sama dengan tahap sebelumnya dengan lama inkubasi selama 240 menit dan
diuji lanjut hingga 48 jam. Metoda pengukuran kadar sukrosa dilakukan
menggunakan metoda refraktometrik yaitu nira tebu hasil perlakuan diukur nilai
brixnya menggunakan refraktometer kemudian hasil pembacaan brix tersebut
dikonversikan pada tabel hubungan brix dengan kadar sukrosa (Pancoast dan
Junk, 1980). Gula pereduksi diukur menggunakan metoda DNS, dimana nira
tebu direaksikan dengan pereduksi 3,5-dinitrosalicylate (3,5-DNS) dan diukur
absorbansinya pada panjang gelombang 540 nm menggunakan spektofotometer.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah
rancangan faktorial dua taraf (two level factorial design) dengan empat variabel proses, yaitu suhu reaksi (X1), pH (X2), nisbah pengawet (X3) dan lama inkubasi
(X4). Nilai tertinggi dan terendah dari variabel yang akan diuji pengaruhnya
disajikan pada Tabel 4.
Tabel 4 Nilai rendah dan tinggi perlakuan
Jenis perlakuan Kode Nilai rendah (-) Nilai tinggi (+) Suhu (ºC)
Matriks satuan percobaan uji pengaruh faktor penghambatan laju
degradasi sukrosa dalam nira tebu menggunakan rancangan Komposit
Tabel 5 Matriks satuan percobaan uji pengaruh faktor penghambatan laju degradasi sukrosa dalam nira tebu dengan rancangan komposit fraksional berfaktor 2IV4-1
No.
Model rancangan percobaan untuk mengetahui pengaruh variabel proses
terhadap respon yang diinginkan adalah sebagai berikut :
4
Y = ao + ∑ aixi + ∑ aijxixj
i=1 i<j Keterangan:
Y : respon dari masing-masing perlakuan
ao, ai, aij : parameter regresi
xi : pengaruh linier variabel utama
Karakteristik Nira Tebu
Nira tebu adalah suatu ekstrak cairan yang berasal dari batang tebu,
mengandung kadar gula relatif tinggi, dijadikan bahan baku pembuatan gula
kristal. Selain tebu, sumber nira lain yang banyak digunakan dalam pembuatan
gula adalah aren, kelapa, lontar dan bit. Nira tebu diekstrak dari batang tebu
dengan usia panen 8-12 bulan. Pada masa yang kurang atau melebihi masa
panen, kadar sukrosa dalam tebu memiliki jumlah yang lebih rendah. Bagi
industri gula, pemanenan tebu dilakukan pada masa kadar sukrosa mencapai
jumlah tertinggi.
Selain kandungan sukrosa, nira tebu juga mengandung gula pereduksi
yaitu glukosa dan fruktosa yang merupakan hasil invertasi sukrosa dengan
adanya enzim invertase. Jenis gula lain yang mungkin terdapat dalam nira tebu
adalah dekstran yang merupakan hasil hidrolisis sukrosa dengan bantuan enzim
dekstransukrase yang dihasilkan dari bakteri kontaminan. Selain komponen gula,
nira tebu juga mengandung komponen lain non gula seperti asam, protein, serat,
garam-garam organik dan lain-lain. Pada penelitian ini dilakukan karakteristik nira
tebu menggunakan HPLC (High Performance Liquid Chromatografi) pada
beberapa jenis gula, asam dan nilai pH seperti yang disajikan pada Tabel 6.
Tabel 6 Karakterisasi nira tebu
Komposisi Kimia Jumlah
Sukrosa (%)
Glukosa (%)
Fruktosa (%)
Dekstran (%)
Total asam (mleq)
Nilai pH
10,29
2,43
0,94
1.41
62,50
5,10
Kadar sukrosa dalam nira tebu yang diukur pada percobaan ini masih
agak rendah yaitu 10,29%. Menurut Moerdokusumo (1993), kadar sukrosa dalam
nira tebu untuk pengolahan menjadi gula mencapai 11 – 14%. Kadar sukrosa
tersebut dapat dipengaruhi oleh jenis tebu, umur panen dan penanganan
gula pereduksi pada nira tebu yang diuji adalah 2,43% untuk glukosa dan 0,94%
untuk frukrosa. Gula pereduksi merupakan hasil degradasi sukrosa dalam nira
tebu melalui reaksi invertasi atau hidrolisis asam. Dalam reaksi invertasi,
perbandingan jumlah molekul glukosa dan fruktosa adalah sama, namun dalam
pengukurannya jumlah fruktosa tidak sama lagi dengan glukosa karena molekul
fruktosa bersifat lebih labil dan mudah terdegradasi lebih lanjut menjadi senyawa
yang lebih sederhana (Chaplin. 2004). Menurut Moerdokusumo (1993), kadar
gula pereduksi dalam nira tebu berkisar 0,5 – 2,0%. Dalam percobaan ini berarti
jumlah gula pereduksi yang diukur termasuk agak tinggi, hal itu dapat
disebabkan karena adanya kerusakan pada nira tebu, baik yang disebabkan oleh
enzim maupun mikroorganisme. Dalam pengolahan nira tebu menjadi gula,
keberadaan gula pereduksi tidak dikehendaki karena merupakan indikasi
degradasi sukrosa dan keberadaannya juga dapat menghalangi proses
kristalisasi sukrosa. Adanya mikroorganisme juga dapat diduga dengan adanya
senyawa dekstran dalam nira tebu. Pada percobaan ini nira tebu mengandung
1,41% dekstran. Dekstran merupakan senyawa gula hasil hidrolisis sukrosa
dengan adanya enzim dekstransukrase yang dihasilkan Leuconostoc
mesenteroides (Guglielmone, et. a/., 2000 di dalam Mathlouthi, 2000 ). Adanya
dekstran juga dapat menghalangi kristalisasi sukrosa, sehingga keberadaan
senyawa tersebut tidak dikehendaki.
Karakterisasi nira tebu lainnya yang diukur pada percobaan ini adalah
nilai total asam. Pengukuran total asam untuk mengetahui kadar asam yang
sudah ada sejak pemanenan. Tingginya total asam yang dikandung nira tebu
sebelumnya juga dapat memicu reaksi degradasi sukrosa, dimana dalam kondisi
asam, walaupun tanpa keberadaan enzim invertase, sukrosa dapat terhidrolisis
(Chaplin. 2004). Dengan menggunakan metoda titrasi dengan NaOH 0,05N, total
asam yang dapat diukur pada nira tebu dalam percobaan ini mencapai 62,5
mleq. Keberadaan asam dalam nira tebu juga berkaitan dengan keberadaan
mikroorganisme yang mendegradasi gula pereduksi lebih lanjut. Mikroorganisme
yang mendegradasi sukrosa lebih lanjut dapat berupa Flavobacterium rigenes,
Brevibacterium sulferens, Flavobacterium devorans, Candida pulcherrima,
Klebsiela azaenae, Chromabacterium lividum, Bactobacillus arabinosus dan
Saccharomyces lactis (Legaz, et. a/., 2000). Reaksi degradasi sukrosa hingga
menghasilkan asam adalah sebagaimana yang ditunjukkan pada Gambar 6.