PENGARUH MEDIA MULTIPLIKASI TERHADAP PEMBENTUKAN
AKAR PADA TUNAS IN VITRO NENAS (Ananas comosus (L.) Merr.) cv. SMOOTH CAYENNE DI MEDIA PENGAKARAN
Oleh
Nurfathanah Anwar
A34402014
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
PENGARUH MEDIA MULTIPLIKASI TERHADAP PEMBENTUKAN
AKAR PADA TUNAS IN VITRO NENAS (Ananas comosus (L.) Merr.) cv. SMOOTH CAYENNE Di MEDIA PENGAKARAN
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut pertanian Bogor
Oleh
Nurfathanah Anwar
A34402014
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
NURFATHANAH ANWAR. Pengaruh Media Multiplikasi terhadap Pembentukan Akar Pada Tunas In Vitro Nenas (Ananas comosus (L.) Merr.) cv. Smooth Cayenne Di Media Pengakaran. (Dibimbing oleh M. R. SUHARTANTO dan DINY DINARTI).
Percobaan ini dilakukan untuk mempelajari pengaruh media multiplikasi tunas terhadap kemampuan tunas untuk membentuk akar pada media pengakarann serta keberhasilannya dalam aklimatisasi yang dilaksanakan di laboratorium Kultur Jaringan Pusat Kajian Buah-buahan Tropika (PKBT), Lembaga Penelitian dan Pemberdayaan Masyarakat (LPPM) IPB, Baranang Siang, Bogor pada bulan Juni hingga Oktober 2006.
Percobaan ini menggunakan rancangan kelompok lengkap teracak dua faktor yaitu konsentrasi TDZ dan NAA pada media multiplikasi tunas. Faktor pertama adalah TDZ dengan 4 taraf konsentrasi, yaitu 0 µM, 0.05 µM, 0.1 µM, dan 0.5 µM. Faktor kedua adalah NAA dengan 4 taraf konsentrasi, yaitu 0 µM, 0.5 µM, 1 µM, dan 2 µM. Terdapat 16 kombinasi perlakuan dengan 3 kali ulangan untuk setiap kombinasi perlakuan. Setiap satu satuan percobaan terdiri dari 6 botol kultur dengan 1 eksplan per botol kultur. Sehingga terdapat 288 unit percobaan.
Bahan tanaman (propagula) yang digunakan adalah bagian pangkal batang tunas nenas (Ananas comosus (L.) Merr.) kultivar Smooth Cayenne, hasil perbanyakan kultur jaringan di laboratorium kultur jaringan PKBT pada media multiplikasi tunas. Media multiplikasi tunas nenas yang digunakan adalah MS padat ditambah dengan sitokinin (TDZ) dan auksin (NAA). Media untuk pengakaran MS padat diperkaya dengan 0.5 µM NAA.
Pengamatan dilakukan pada saat tanaman di dalam botol kultur dan di lapangan (aklimatisasi). Pengamatan di dalam botol kultur dilakukan setiap seminggu sekali selama 5 minggu, peubah yang diamati adalah : persentase kultur yang terkontaminasi, persentase tunas yang berakar, dan jumlah akar. Peubah yang diamati pada akhir pengamatan di botol kultur adalah : panjang akar, jumlah daun, dan tinggi tanaman. Pengamatan di lapangan (aklimatisasi) dilakukan setiap minggu selama 4 minggu, peubah yang diamati adalah : persentase planlet hidup, jumlah daun, dan tinggi tanaman.
Hasil percobaan menunjukkan bahwa pada pembentukan akar pada tunas yang berasal dari media multiplikasi dengan berbagai taraf konsentrasi TDZ tidak menunjukkan adanya perbedaan dengan persentase tunas berakar yang berasal dari media multiplikasi tanpa penambahan TDZ. Pada konsentrasi TDZ 0.1-0.5
Planlet hidup dipengaruhi oleh interaksi antara TDZ dan NAA pada 1 MSA. Tunas yang berasal dari media multiplikasi dengan berbagai taraf konsentrasi TDZ dan NAA menghasilkan persentase planlet hidup yang cukup tinggi di atas 85% pada 1 MSA, kemudian terus mengalami penurunan pada minggu pengamatan selanjutnya. Tinggi tanaman pada 2 MSA dipengaruhi oleh interaksi antara TDZ dengan NAA dari media multiplikasi sebelumnya. Pada konsentrasi NAA 1 dan 2 µM yang disertai penambahan TDZ cenderung menurunkan tinggi tanaman pada 2 MSA, pada minggu selanjutnya pengaruh pemberian TDZ dan NAA tidak nyata.
Judul : PENGARUH MEDIA MULTIPLIKASI TERHADAP PEMBENTUKAN AKAR PADA TUNAS IN VITRO NENAS (Ananas comosus (L.) Merr.) cv. SMOOTH CAYENNE DI MEDIA PENGAKARAN
Nama : Nurfathanah Anwar NRP : A34402014
Menyetujui, Dosen Pembimbing
Pembimbing I
Dr. Ir. M. R. Suhartanto, MSi NIP : 131 803 641
Pembimbing II
Ir. Diny Dinarti, MSi NIP : 131 999 963
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. Supiandi Sabiham, M.Agr NIP : 130 422 698
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu, Propinsi Jawa Barat pada tanggal 18 November 1984. Penulis merupakan anak kedua dari empat bersaudara dari Bapak Saeful Anwaruddin D dan Ibu Lianah.
Jenjang pendidikan formal penulis dimulai dari TK Kenari Jatibarang pada tahun 1989. Tahun 1996 penulis lulus dari SD Negeri Bulak I, kemudian pada tahun 1999 penulis menyelesaikan studi di SLTP Negeri I Jatibarang, Indramayu. Selanjutnya penulis lulus dari SMU Negeri I Indramayu pada tahun 2002.
Tahun 2002 penulis diterima di IPB melalui jalur USMI. Selanjutnya tahun 2003 penulis diterima sebagai mahasiswa Program Studi Pemuliaan Tanaman dan Teknologi Benih, Departemen Budi Daya Pertanian, Fakultas Pertanian.
KATA PENGANTAR
Bismillahirrahmanirrahim, puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi kekuatan dan hidayah sehingga penelitian yang berjudul “Pengaruh Media Multiplikasi terhadap Pembentukan Akar Pada Tunas In vitro Nenas (Ananas comosus (L.) Merr.) cv. Smooth Cayenne di Media Pengakaran” sebagai salah satu syarat memperoleh gelar Sarjana Pertanian dapat diselesaikan dengan baik.
Penulis menyampaikan terima kasih yang sebesar-besarnya kepada : 1. Papa, Mama, Ceuk Fifik, Aa Ihya, De Ridha, kalian adalah keluarga terbaik
yang Allah SWT telah berikan. Aku belajar serta menerima kebaikan dan kasih sayang dari kalian, bagi kalianlah skripsi ini kupersembahkan.
2. Dr. Ir. M. R. Suhartanto, MSi dan Ir. Diny Dinarti, MSi sebagai dosen pembimbing skripsi yang banyak memberikan bimbingan dan bantuan kepada penulis. Terima kasih banyak atas waktu dan perhatian yang Bapak dan Ibu berikan di tengah segala kesibukan Bapak dan Ibu selama ini.
3. Dr. Ir. Memen surahman, MSc atas kesediaannya sebagai dosen penguji dan saran yang telah diberikan.
4. Dr. Ir. Satriyas Ilyas, MS selaku dosen pembimbing akademik penulis.
5. Dosen Fakultas Pertanian khususnya dosen Departemen Agronomi dan Hortikultura atas pengajaran dan ilmu yang diberikan selama penulis menjadi mahasiswa.
6. Pusat Kajian Buah-buahan Tropika atas dana dan sarana penelitian yang diberikan kepada penulis serta kesempatan untuk melakukan penelitian dengan topik ini.
7. Keluarga besar mamah di Bulak dan papah di Wanasalam terima kasih atas bantuan, doa dan dorongan semangatnya.
9. Feti, Cempaka, Indri, Dini, Warti, Oci, Yayah, kalian adalah sahabat terbaik yang mengajariku arti dari persaudaraan dan persahabatan yang jujur, tulus dan apa adanya, aku berharap persahabatan kita langgeng.
10. Kru APD dan Arsida 4 (Devi, Retno, Siska, Kismi, Wage, Peni, Dewi dan Bella) terima kasih ukhuwah dan pinjaman komputernya selama penulisan skripsi ini.
11. Mute ’39, Anti, Endah, Atin, Heni, Emi, Cici, Eev, Nuni, Misnen, Ray, Yogo, Jajang, Rofik, Susi, Hardi, dan seluruh teman-temanku yang tidak dapat disebutkan satu persatu, terima kasih banyak atas bantuan dan dukungannya.
12. Aa yang minta dipanggil mas terima kasih atas segala pengertian dan semangatnya. You are my spirit and love.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan. Akhirnya penulis berharap semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, April 2007
DAFTAR ISI
Halaman
PENDAHULUAN ……… 1
Latar Belakang ……… 1
Tujuan ………. 3
Hipotesis ………. 3
TINJAUAN PUSTAKA ………... 4
Taksonomi dan Botani Nenas ………. 4
Syarat Tumbuh Nenas ………. 5
Perbanyakan Nenas ………. 6
Kultur Jaringan ……… 6
Zat Pengatur Tumbuh ………. 8
Aklimatisasi ……… 9
BAHAN DAN METODE ……… 11
Tempat dan Waktu ………. 11
Bahan dan Alat ………... 11
Metode ……… 11
Pelaksanaan ……… 13
Pengamatan ……… 14
HASIL DAN PEMBAHASAN ……… 16
Kondisi Umum ……….... 16
Pembentukan Akar pada Tunas Nenas……… 16
Aklimatisasi ... 21
KESIMPULAN DAN SARAN ……… 26
Kesimpulan ………. 26
Saran ………... 26
DAFTAR PUSTAKA ……….. 27
DAFTAR TABEL
No. Teks Halaman
1. Rekapitulasi Hasil Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Peubah yang Diamati ... 18 2. Pengaruh TDZ terhadap Persentase Tunas Berakar pada Media
Pengakaran 1-5 MST ……….. 19 3. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Panjang
Akar pada Media Pengakaran 5 MST ………. 19 4. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Tinggi
Tanaman pada Media Pengakaran 5 MST ……….. 21 5. Rekapitulasi Hasil Analisis Sidik Ragam Pengaruh TDZ dan
NAA terhadap Peubah yang Diamati 22
6. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Persentase Planlet Hidup pada 1 MSA ………. 23 7. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Tinggi
Tanaman pada 2 MSA ... 25
No. Lampiran Halaman
1. Komposisi Media Murashige-Skoog (MS) ……… 31 2. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap
Persentase Tunas Berakar pada Media Pengakaran ………... 32 3. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Jumlah
Akar pada Media Pengakaran ………. 33 4. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Panjang
Akar pada Media Pengakaran ………. 34 5. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Jumlah
Daun pada Media Pengakaran ... 34 6. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Tinggi
7. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Persentase Planlet Hidup saat Aklimatisasi ... 35 8. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Jumlah
Daun saat Aklimatisasi ……….. 36 9. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Tinggi
DAFTAR GAMBAR
No. Teks Halaman
1. Struktur Molekul Thidiazuron (Gunawan, 1992) ……….. 8 2. Bagan Alur Penelitian ... 12 3. Bentuk Akar di Media Pengakaran 5 MST pada Tunas yang
Berasal dari Media Multiplikasi dengan perlakuan (A) Kontrol (tanpa penambahan ZPT), (B) 0.1 μM TDZ + 0.5 μM NAA, dan (C) 0.5 μM TDZ + 2 μM NAA ... 17 4. Mikroorganisme Penyebab Kontaminasi (A) Bakteri (B)
Cendawan ... 17 5. Grafik Pengaruh Penambahan TDZ dan NAA terhadap
PENDAHULUAN
Latar Belakang
Nenas (Ananas comosus (L.) Merr.) merupakan buah tropika ketiga setelah pisang dan mangga yang diperdagangkan secara global (Petty, Stirling dan Bartholomew, 2002) dalam bentuk nenas segar atau olahan. Nenas sebagai produk olahan dapat berupa buah kaleng, juice (konsentrat) dan keripik. Nenas mempunyai manfaat yang tinggi selain buahnya yaitu limbah dari buah berupa serat dapat digunakan untuk pakan ternak sedangkan cairannya untuk produksi asam organik (seperti asam sitrat, asam askorbat, asam malat) dan alkohol. Daunnya dapat diambil serat untuk digunakan sebagai bahan tekstil. Ekstrak buah nenas juga menghasilkan enzim protease yaitu bromelin digunakan untuk industri makanan dan kosmetik (Wee dan Thongtham, 1997) serta obat-obatan (Nakasone dan Paull, 1999).
Penyediaan bibit yang baik merupakan tahap yang sangat penting dalam produksi nenas terutama untuk memenuhi permintaan perusahaan industri skala besar yang menghendaki bibit dalam jumlah besar, seragam, cepat dan kontinyu. Smooth Cayenne merupakan kultivar tanaman nenas yang digunakan untuk industri pengalengan. Kelebihan Cayenne adalah produksi tinggi, ukuran, bentuk, tekstur, warna dan rasa buah sesuai dengan karakter industri terutama sebagai bahan bahan baku kalengan. Kebutuhan bibit nenas untuk memproduksi buah segar adalah 60000-80000 bibit/ha sedangkan untuk pengalengan buah adalah 40000-50000 bibit/ha (Samson, 1980). Namun sampai sejauh ini tanaman nenas jenis Smooth Cayenne diketahui memiliki jumlah anakan di lapangan yang sedikit (maksimal 3-4 anakan), berbeda dengan jenis Queen yang dapat mencapai anakan 20 anakan (PKBT, 2004).
2
penambahan Thidiazuron (TDZ) 0.23-0.46 μM menghasilkan 17-24 tunas/eksplan selama 24 minggu.
Perbanyakan tanaman nenas dengan teknik kultur jaringan diharapkan memiliki keberhasilan aklimatisasi yang tinggi. Keberhasilan aklimatisasi antara lain dipengaruhi oleh kondisi eksplan, salah satunya keberhasilan perakaran. Tunas yang dihasilkan dari tahap multiplikasi belum memiliki akar yang cukup, sehingga tidak dapat segera diaklimatisasi. Penelitian ini dilakukan untuk memperoleh jumlah akar yang optimum secara in vitro pada media pengakaran (MS + 0.5 μM NAA), sehingga akan diperoleh planlet nenas dengan jumlah akar yang optimum dan perakaran yang kompak. Wetherell (1982) mengemukakan bahwa auksin (NAA) sebagai hormon akar digunakan dengan konsentrasi rendah karena kelebihan auksin justru akan menghambat pertumbuhan akar.
Penggunaan hormon perakaran pada nenas telah dilaporkan oleh beberapa peneliti. Penelitian yang menggunakan kuncup apikal mahkota nenas kultivar Smooth Cayenne menunjukkan bahwa interaksi antara NAA dan IBA dalam media pengakaran dengan konsentrasi rendah dapat menghasilkan jumlah akar terbanyak, yaitu MS + NAA 0.5 mg/l + IBA 0.5 mg/l (Firoozabady dan Gutterson, 2003) juga pada media MS tanpa ZPT (Kiss et al., 1995). Penelitian Marbun (2006) menyatakan bahwa media MS + 2 mg/l NAA dapat menghasilkan jumlah akar terbanyak pada kultivar Queen asal kepulauan Bangka.
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh media multiplikasi tunas terhadap kemampuan tunas untuk membentuk akar pada media pengakaran serta keberhasilannya dalam aklimatisasi.
Hipotesis
4
TINJAUAN PUSTAKA
Taksonomi dan Botani Nenas
Nenas merupakan anggota Bromeliaceae atau bromeliad. Famili ini terdiri atas 45 genus dan 2000 spesies, yang semuanya berasal dari Amerika Selatan, kecuali satu spesies Pitcairnia felicana (Aug. Chev.) Harms & Mildbr., berasal dari Afrika Barat (Nakasone dan Paull, 1999). Menurut taksonomi tumbuhan, nenas diklasifikasikan sebagai berikut (Rukmana, 1996):
Kingdom : Plantae Divisi : Spermatophyta Kelas : Angiospermae
Ordo : Farionsae (Bromeliales) Famili : Bromeliaceae
Genus : Ananas
Spesies : Ananas comosus (L.) Merr.
Ananas comosus (L.) Merr. adalah nenas budidaya yang merupakan tanaman herba tahunan (perenial), sukulen dan serofit, steril bila menyerbuk sendiri, monokotil, epifit atau terestrial (Wee dan Thongtham, 1997; Nakasone dan Paull, 1999). Tanaman nenas mempunyai tinggi 50-100 cm, tinggi batang tanaman dewasa 30-35 cm, diameter 6.5-7.5 cm dengan ruas pendek 1-10 mm (Nakasone dan Paull, 1999).
Menurut Collins (1960) tanaman nenas memiliki perakaran terbatas, tumbuh pada tanah yang mengandung bahan organik tinggi dan dapat menyimpan air pada ketiak daun. Oleh karena itu, tanaman ini dapat bertahan pada keadaan kering dalam waktu relatif lama. Daun nenas berukuran panjang dan sempit, tersusun secara spiral pada batang yang pendek sehingga membentuk roset. Panjang daun sekitar 60-120 cm dan jumlah daun yang terbentuk 70-80 helai.
mengelilingi enam lembar benang sari dan satu lembar tangkai putik yang sempit berisi kepala putik yang bercabang tiga (Wee dan Thongtham, 1997).
Buah nenas berupa senokarp (coenocarpium) yang terbentuk dari penebalan yang luar biasa dari poros pembungaan dan dari peleburan masing-masing bunga kecil, buahnya berbentuk buah buni, kulit buahnya yang keras terbentuk dari kelopak-kelopak dan braktea yang tidak rontok, buahnya berbentuk silinder, panjang ± 20 cm, diameter ± 14 cm, berat 1-2.5 kg, dan daging buahnya kuning pucat sampai kuning keemasan (Wee dan Thongtham, 1997).
Kultivar nenas yang telah dibudidayakan di Indonesia adalah Cayenne, Queen, Spanish dan Abacaxi. Kultivar Cayenne memiliki buah berbentuk silindris berwarna jingga, salah satunya adalah Smooth Cayenne. Kultivar Queen memiliki buah berbentuk kerucut berwarna kuning dan memiliki daun pendek. Kultivar Spanish memiliki buah berbentuk bulat berwarna kuning kemerahan, contohnya Red Spanish dan Singapore Spanish, sedangkan kultivar Abacaxi berbentuk kerucut berwarna kuning. Masing-masing kultivar memiliki duri kecuali kultivar Cayenne, bahkan kultivar Queen berduri tajam dan durinya membelah ke belakang (Nakasone dan Paull, 1999).
Syarat Tumbuh Nenas
Tanaman nenas dibudidayakan di daerah yang tersebar di wilayah antara 25° LU dan 25° LS. Suhu di areal penanamannya antara 23-32°C. Tanaman nenas ini ternyata dapat dipelihara di lahan yang suhunya dapat turun sampai 10°C, akan tetapi tanaman ini tidak toleran terhadap hujan salju dan buahnya sensitif terhadap terik matahari (Wee dan Thongtham, 1997).
6
Tanaman nenas dapat tumbuh pada berbagai jenis tanah dan akan tumbuh baik pada tanah liat berpasir dan mengandung bahan organik tinggi dengan pH 4.5-6.5 (Collins, 1960; Wee dan Thongtham, 1997). Menurut Samson (1980) Smooth Cayenne lebih baik tumbuh pada pH 5-6, jenis tanah merah coklat oxisol yang mengandung persentase besi dan mangan yang tinggi.
Perbanyakan Nenas
Tanaman nenas dapat diperbanyak secara vegetatif maupun generatif. Perbanyakan secara generatif (biji) jarang digunakan karena nenas tidak dapat melakukan penyerbukan sendiri, selain itu pembibitan dari biji membutuhkan waktu yang sangat lama dan memiliki keragaman yang tinggi akibat segregasi (Harjadi, 1996).
Menurut Collins (1960), bahan tanaman yang dapat dijadikan bibit nenas adalah:
1. Sucker yaitu tunas yang timbul dari batang yang terletak di bawah permukaan tanah dan berakar.
2. Shoot yaitu tunas yang tumbuh dari mata tunas aksilar pada batang. 3. Hapas yaitu tunas yang tumbuh dari pangkal tangkai buah.
4. Slip yaitu tunas yang tumbuh di bawah (dasar) buah, perkembangan dari mata tunas pada tangkai buah.
5. Crown yaitu tunas yang tumbuh di atas (pucuk) buah.
Smooth Cayenne membentuk sedikit tunas batang yaitu kurang dari tiga sehingga untuk perbanyakannya lebih sering digunakan tunas ketiak daun (sucker) (Nakasone dan Paull, 1999).
Kultur Jaringan
dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali.
Pada prinsipnya kultur jaringan memerlukan tiga tahap utama. Tahap pertama meliputi usaha-usaha untuk menjaga agar kultur yang ditumbuhkan dapat berkembang dengan baik dalam kondisi aseptik. Tahap kedua adalah melakukan usaha agar dapat terjadi multiplikasi (penggandaan) propagula dengan cepat, sehingga diperoleh tanaman dalam jumlah besar. Tahap ketiga merupakan tahap persiapan pemindahan planlet ke media tanam dalam pot/tanah (Murashige, 1997). Perkembangan teknik perbanyakan klon melalui kultur in vitro mengarah kepada optimasi beberapa aspek penting, yaitu genotipe dari sumber bahan tanaman yang digunakan; media, meliputi komposisi media dan zat pengatur pertumbuhan tanaman yang digunakan; lingkungan tumbuh kultur dan fisiologi jaringan tanaman sebagai eksplan (Wattimena et al., 1992).
Menurut Gunawan (1992) keberhasilan dalam penggunaan metode kultur jaringan sangat bergantung pada media yang digunakan. Media kultur jaringan tanaman menyediakan tidak hanya unsur-unsur hara makro dan mikro, tetapi juga karbohidarat yang umumnya berupa gula untuk menggantikan karbon yang biasanya didapat dari atmosfer melalui fotosintesis. Wetherell (1982) menambahkan satu atau dua macam vitamin dan hormon tanaman untuk merangsang terjadinya pertumbuhan dan atau pengaturan jenis pertumbuhan.
Salah satu formulasi yang sering dipakai sebagai media kultur adalah Murashige-Skoog (MS) yang ditemukan oleh Toshio Murashige. Formulasi dasar mineral dari MS dapat digunakan untuk sejumlah besar spesies tanaman pada perbanyakan secara in vitro (Wetherell, 1982).
8
Zat Pengatur Tumbuh
Zat Pengatur Tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah (< 1 mM) dapat mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Wattimena, 1988). ZPT yang sering digunakan dalam kultur jaringan adalah dari golongan auksin dan sitokinin.
Auksin digunakan untuk merangsang pertumbuhan kalus, perpanjangan tunas dan pembentukan akar. Pada konsentrasi rendah akan memacu akar adventif sedangkan konsentrasi tinggi mendorong terbentuknya kalus (Pierik, 1997). Auksin yang secara alami terdapat dalam tumbuhan adalah Indole-3-Acetic Acid (IAA) sedang auksin sintetik yang sering digunakan adalah Naphthalene Acetic Acid (NAA). NAA memiliki sifat yang lebih tahan, tidak terdegradasi dan lebih murah. Menurut Zaer dan Mapes (1985), NAA memiliki sifat kimia lebih stabil dibanding IAA dan tidak mudah teroksidasi oleh enzim.
Sitokinin merupakan ZPT yang banyak digunakan untuk memacu inisiasi dan proliferasi tunas. Aktivitas yang terutama ialah mendorong pembelahan sel, menginduksi tunas adventif dan dalam konsentrasi tinggi menghambat inisiasi akar (Pierik, 1987). Baik efek mendorong maupun menghambat proses pembelahan tergantung dari adanya fitohormon lainnya, terutama auksin (Wattimena, 1988). Interaksi keduanya dapat meningkatkan pertumbuhan dan ukuran sel (Hartman dan Kester, 1983).
Diantara beberapa jenis sitokinin, sitokinin tipe urea memiliki aktivitas lebih kuat dibanding tipe purin atau adenin (Huetteman dan Preece, 1993). N-phenyl-N’-1,2,3,-thidiazol-5-ylurea, Thidiazuron (TDZ) merupakan sitokinin sintesis turunan dari phenylurea. TDZ mempunyai berat molekul 220.25 dengan rumus molekul C9H8N4OS (Gunawan, 1992). Struktur molekul TDZ dapat dilihat
TDZ yang pada awalnya digunakan untuk merontokkan daun-daun pada tanaman kapas pada saat akan panen, dilaporkan mempunyai aktivitas sitokinin pada kacang (Mok et al., 1982). Konsentrasi di atas 5 nM dan 0.4 μM menstimulasi perkembangan kalus pada kedelai dan pembesaran kotiledon pada bit (Thomas dan Katterman, 1986). TDZ sebagai substitusi 6-benzylaminopurine (BAP), terbukti meningkatkan kapasitas pembentukan tunas pada anggrek bulan (Chen dan Piluek, 1995).
Sitokinin BAP dan TDZ menghambat pembentukan akar secara spontan pada konsentrasi yang berbeda, yaitu BAP dengan konsentrasi 17.76 µM sedangkan TDZ dengan konsentrasi 4.54 x 10-2 µM. Akar dapat diinduksi dengan mensubkultur ke media pengakaran yaitu MS + 0.54 µM NAA untuk yang berasal dari BAP, sedangkan yang berasal dari TDZ sebelumnya disubkultur ke media MS0 dua kali atau lebih tergantung konsentrasi TDZ yang digunakan pada tahap induksi baru selanjutnya disubkultur ke media pengakaran (Nursandi, 2006).
Aklimatisasi
Aklimatisasi merupakan tahap pemindahan planlet dari kondisi buatan (in vitro) ke kondisi lapang (ex vitro) atau dari keadaan heterotrop ke keadaan autotrop. Aklimatisasi merupakan tahap yang sangat penting karena mengindikasikan keberhasilan dalam perbanyakan tanaman melalui in vitro secara keseluruhan.
Tahap aklimatisasi merupakan masa yang kritis bagi tanaman, karena tanaman in vitro menunjukkan keadaan yang kurang menguntungkan bagi tanaman itu sendiri. Beberapa hal yang terjadi pada tanaman hasil in vitro praaklimatisasi antara lain daun tanaman tipis, lunak dan proses fotosintesis belum berjalan baik, lapisan lilin belum berkembang dengan baik, lignifikasi batang kurang, sel-sel palisade daun sedikit, jaringan pembuluh dari akar ke pucuk kurang berkembang dan stomata seringkali tidak berfungsi (Gunawan, 1992).
10
mensyaratkan kondisi lingkungan yang terjaga baik pada kelembaban dan naungan yang tinggi. Hal ini dikarenakan tanaman hasil in vitro peka terhadap evapotranspirasi, serangan cendawan dan bakteri serta intensitas cahaya yang tinggi (Gunawan, 1992).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di laboratorium Kultur Jaringan Pusat Kajian Buah-buahan Tropika (PKBT), Lembaga Penelitian dan Pemberdayaan Masyarakat (LPPM) IPB, Baranang Siang, Bogor. Penelitian dimulai pada bulan Juni hingga Oktober 2006.
Bahan dan Alat
Bahan tanaman (propagula) yang digunakan adalah bagian pangkal batang tunas nenas (Ananas comosus (L.) Merr.) kultivar Smooth Cayenne, hasil perbanyakan kultur jaringan di laboratorium kultur jaringan PKBT pada media multiplikasi tunas.
Media multiplikasi tunas nenas yang digunakan adalah MS padat ditambah dengan sitokinin (TDZ) dan auksin (NAA). Media untuk pengakaran MS padat diperkaya dengan 0.5 µM NAA. Pengaturan pH media dengan menambahkan KOH atau HCl 0.1 N. Bahan untuk sterilisasi berupa alkohol 70% atau 90%. Bahan lainnya seperti agar, gula, karet gelang, plastik, kertas buram, tissue dan label.
Alat yang digunakan antara lain botol kultur, pipet, cawan petri, labu takar, alat ukur gelas, pinset, pisau, timbangan, hand sprayer, bunsen, autoklaf dan laminar air flow cabinet. Rak penyimpanan kultur dilengkapi dengan lampu fluorescence yang mempunyai intensitas 1000-2000 lux sebagai sumber penyinaran selama 16 jam dengan suhu ruang 20°C.
Metode
12
dan 0.5 µM. Faktor kedua adalah NAA dengan 4 taraf konsentrasi, yaitu 0 µM, 0.5 µM, 1 µM, dan 2 µM. Terdapat 16 kombinasi perlakuan dengan 3 kali ulangan untuk setiap kombinasi perlakuan. Setiap satu satuan percobaan terdiri dari 6 botol kultur dengan 1 eksplan per botol kultur, sehingga terdapat 288 unit percobaan.
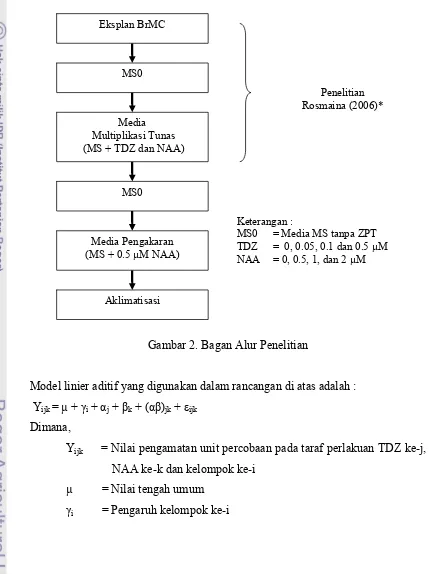
Gambar 2. Bagan Alur Penelitian
Model linier aditif yang digunakan dalam rancangan di atas adalah : Yijk = µ + i + αj + k + (α )jk + εijk
Dimana,
Yijk = Nilai pengamatan unit percobaan pada taraf perlakuan TDZ ke-j,
NAA ke-k dan kelompok ke-i µ = Nilai tengah umum
i = Pengaruh kelompok ke-i
Eksplan BrMC
MS0
Media Multiplikasi Tunas (MS + TDZ dan NAA)
MS0
Media Pengakaran (MS + 0.5 µM NAA)
Penelitian Rosmaina (2006)*
Aklimatisasi
Keterangan :
αj = Pengaruh TDZ ke-j
Data yang diperoleh dianalisa dengan uji F. Jika berbeda nyata maka dilakukan uji lanjut dengan uji Duncan Multiple Range Test (DMRT) pada taraf 5%.
Pelaksanaan Sterilisasi peralatan
Alat-alat yang digunakan untuk penanaman dicuci dengan detergen hingga bersih kemudian disterilkan di dalam autoklaf dengan tekanan 17.5 psi dan suhu 121°C selama 30 menit. Alat-alat yang disterilkan adalah botol kultur, alat tanam, dan cawan petri.
Pembuatan media
Larutan stok baku dibuat untuk memudahkan dalam pembuatan media. Konsentrasi garam organik, vitamin, myoinositol dan zat pengatur tumbuh dalam larutan baku dipekatkan sehingga pada saat pembuatan media hanya memipet sejumlah volume tertentu dari larutan baku tersebut, sesuai konsentrasi yang dibutuhkan.
Pembuatan media pengakaran dilakukan dengan memipet larutan stok ke dalam labu takar. Zat pengatur tumbuh NAA diberikan sesuai perlakuan, yaitu 0.5 µM. Kemasaman media diukur dengan pH meter dan dipertahankan sekitar 5.7 dengan menggunakan KOH dan HCl.
14
Media kemudian diautoklaf pada suhu 121°C dan tekanan 17.5 psi selama 20 menit.
Penanaman
Penanaman dilakukan dalam laminar air flow cabinet yang telah dibersihkan dengan alkohol 70% dan disinari dengan ultraviolet selama 60 menit. Alat tanam yang digunakan harus steril. Pisau dan pinset dimasukkan ke dalam botol berisi alkohol dan sebelum digunakan dibakar dahulu dan setelah dingin dimasukkan kembali ke dalam alkohol.
Eksplan yang digunakan adalah pangkal batang planlet nenas sepanjang 0.5-1 cm dari pangkal batang tanpa akar. Eksplan kemudian ditanam pada media pengakaran.
Aklimatisasi
Planlet dikeluarkan dari botol kultur dan dicuci untuk menghilangkan agar yang melekat, kemudian ditanam pada gelas plastik yang berisi campuran pasir dan kompos dengan perbandingan 1:3. Planlet dipelihara dalam screen house dengan naungan paranet 75%.
Pengamatan
Pengamatan dilakukan pada saat tanaman di dalam botol kultur dan di lapangan (aklimatisasi). Pengamatan di dalam botol kultur dilakukan setiap seminggu sekali selama 5 minggu, peubah yang diamati :
1. Tunas terkontaminasi (%) = x 100% 3. Jumlah akar per eksplan
Peubah yang diamati pada akhir pengamatan di botol kultur adalah :
2. Jumlah daun, planlet dikeluarkan dari botol dan dihitung jumlah daun yang telah membuka sempurna.
3. Tinggi tanaman, planlet dikeluarkan dari botol dan diukur dari pangkal batang hingga ujung daun yang terpanjang.
Pengamatan di lapangan (aklimatisasi) dilakukan setiap minggu selama 4 minggu, peubah yang diamati :
1. Jumlah planlet saat aklimatisasi
2. Planlet Hidup (%) = x 100% ditanam
yang planlet
hidup planlet
∑
∑
3. Jumlah daun, jumlah daun yang telah membuka sempurna.
16
HASIL DAN PEMBAHASAN
Kondisi Umum
Tunas hasil multiplikasi sebelum disubkultur ke media pengakaran (MS padat + 0.5 µM NAA) terlebih dahulu disubkultur ke media MS tanpa zat pengatur tumbuh (MS0) dua kali untuk pembesaran tunas dan merangsang pembentukan akar. Tunas telah menunjukkan pertumbuhan pada umur satu minggu setelah tanam (MST), ditandai dengan pemanjangan daun-daun yang terpotong dan terbentuknya daun baru. Daun-daun baru yang terbentuk berwarna hijau pada hampir semua perlakuan. Pada semua perlakuan, akar mulai terbentuk pada 2 MST. Pembentukan akar terjadi secara langsung tanpa melalui pembentukan kalus terlebih dahulu. Akar yang terbentuk pendek, tipis dan tanpa rambut akar (Gambar 3).
Kultur yang terkontaminasi oleh mikroorganisme pada percobaan ini tergolong rendah yaitu 4.17% dari total populasi. Rendahnya kontaminasi ini karena eksplan yang dipergunakan berasal dari tunas yang steril. Kontaminan yang paling banyak ditemukan ialah bakteri dan cendawan (Gambar 4). Ciri awal media yang terserang bakteri yaitu adanya lendir putih yang ada di permukaan media atau di dalam media sedangkan ciri awal media yang terserang cendawan yaitu adanya spora yang menempel di permukaan media. Kontaminasi muncul pada bagian tepian media yang kontak langsung dengan dinding wadah kultur, dengan demikian diduga bahwa mikroorganisme penyebab kontaminasi berasal dari wadah kultur yang kurang steril, alat tanam atau terbawa oleh sirkulasi udara yang terjadi dari laminar air flow cabinet pada saat penanaman dilakukan.
Pembentukan Akar pada Tunas Nenas
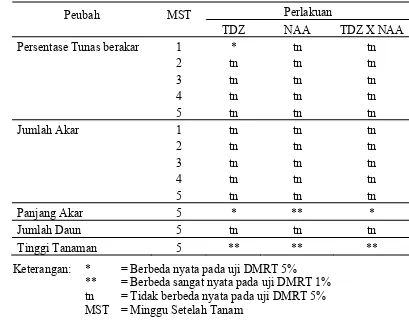
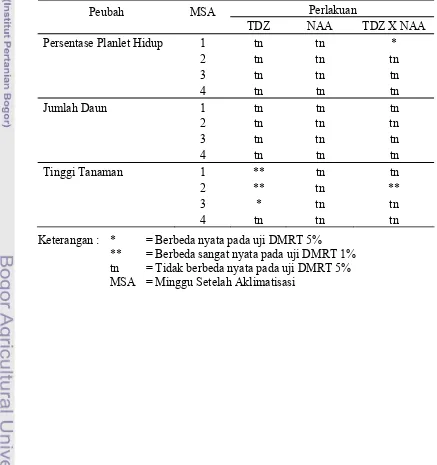
NAA berpengaruh sangat nyata terhadap panjang akar dan tinggi tanaman pada 5 MST. Interaksi antara TDZ dan NAA berpengaruh nyata terhadap panjang akar dan tinggi tanaman pada 5 MST (Tabel 1).
(A) (B) (C)
Gambar 3. Bentuk Akar di Media Pengakaran 5 MST pada Tunas yang Berasal dari Media Multiplikasi dengan Perlakuan (A) Kontrol (tanpa Penambahan ZPT), (B) 0.1 μM TDZ + 0.5 μM NAA, dan (C) 0.5 μM TDZ + 2 μM NAA
(A) (B)
18
Tabel 1. Rekapitulasi Hasil Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Peubah yang Diamati
Perlakuan MST = Minggu Setelah Tanam
Persentase Tunas Berakar
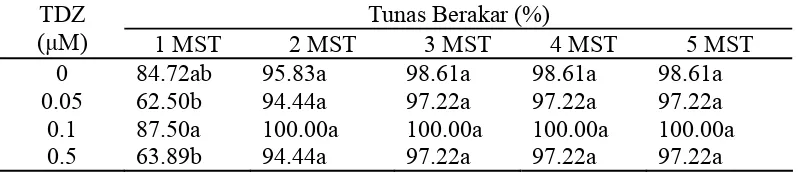
Pada media pengakaran 1 MST tunas yang berasal dari media multiplikasi dengan berbagai taraf konsentrasi TDZ tidak menunjukkan adanya perbedaan dengan persentase tunas berakar yang berasal dari media multiplikasi tanpa penambahan TDZ, meskipun terjadi fluktuasi pertumbuhan akar pada konsentrasi antara TDZ 0.05 dan 0.1 μM. Hal ini diduga karena tunas yang berasal dari media multiplikasi dengan berbagai perlakuan TDZ mulai memasuki masa transisi. Pada masa transisi ini terjadi keseimbangan hormon endogen tunas, sehingga pada minggu pengamatan selanjutnya (2-5 MST) pengaruh penambahan TDZ ke dalam media multiplikasi tidak terlihat dikarenakan terjadi kestabilan hormon endogen tunas (Tabel 2).
dari media multiplikasi dengan konsentrasi 0-0.5 μM TDZ mampu meningkatkan persentase tunas berakar di atas 97%, bahkan pada tunas yang berasal dari media multiplikasi dengan konsentrasi TDZ 0.1 μM mampu meningkatkan persentase tunas berakar hingga 100% (Tabel 2).
Tabel 2. Pengaruh TDZ terhadap Persentase Tunas Berakar pada Media Pengakaran 1-5 MST
Tunas Berakar (%) TDZ
(µM) 1 MST 2 MST 3 MST 4 MST 5 MST
0 84.72ab 95.83a 98.61a 98.61a 98.61a 0.05 62.50b 94.44a 97.22a 97.22a 97.22a 0.1 87.50a 100.00a 100.00a 100.00a 100.00a 0.5 63.89b 94.44a 97.22a 97.22a 97.22a Keterangan: Nilai yang diikuti huruf yang sama pada kolom yang sama tidak
berbeda nyata pada uji DMRT 5%
Panjang Akar
Panjang akar merupakan hasil perpanjangan sel-sel di belakang meristem ujung (Gardner et al., 1991). Pengamatan terhadap panjang akar dilakukan pada akhir percobaan, yaitu pengamatan minggu ke-5. Hasil analisis ragam menunjukkan bahwa panjang akar dipengaruhi oleh TDZ, NAA, serta interaksi antara TDZ dengan NAA (Tabel 1).
Interaksi antara TDZ dan NAA berpengaruh nyata terhadap panjang akar. Gunawan (1992) menyatakan bahwa interaksi dan perimbangan antara zat pengatur tumbuh yang ditambahkan ke dalam media dan yang diproduksi oleh sel secara endogen akan menentukan arah perkembangan suatu kultur.
Tabel 3. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Panjang Akar pada Media Pengakaran 5 MST
NAA (µM) TDZ (µM)
0 0.5 1 2 --- cm ---
0 3.67ab 2.97ab 3.32ab 3.55ab
0.05 3.33ab 3.67ab 3.20ab 3.36ab
0.1 3.46ab 2.59bc 3.20ab 1.91c
0.5 3.12ab 2.54bc 3.79a 1.79c
20
Berdasarkan Tabel 3, terlihat bahwa tunas yang berasal dari media multiplikasi tanpa ZPT menghasilkan panjang akar yang tidak berbeda dengan tunas yang berasal dari media multiplikasi dengan penambahan TDZ atau NAA pada media pengakaran 5 MST. Pada konsentrasi TDZ 0.1-0.5 μM yang disertai dengan penambahan konsentrasi NAA yang semakin tinggi cenderung menurunkan panjang akar. Begitupun pada perlakuan 2 μM NAA, semakin tinggi konsentrasi TDZ yang ditambahkan maka akar semakin tertekan pertumbuhannya. Hal ini diduga karena tunas masih membawa pengaruh rasio sitokinin dan auksin yang tinggi dari media tunas sebelumnya sehingga pertumbuhan akar terhambat.
Menurut Taiz dan Zeiger (1991) pada konsentrasi yang lebih tinggi auksin akan menghambat pertumbuhan tanaman karena auksin akan menginduksi produksi etilen dan menekan pertumbuhan tanaman. Begitupun dengan TDZ dilaporkan dapat menstimulasi biosintesis etilen yang dapat menghambat pengakaran (Hutchinson et al., 1997; Suttle, 1984; Yip dan Yang, 1986). Khalafalla dan Hattori (2000) melakukan penelitian tentang efek senyawa penghasil etilen 1-aminocyclopropane-1-1 carboxylic acid (ACC) dan tiga senyawa penghambat etilen yaitu perak nitrat (AgNO3), asam asetil salisilat
(ASA) dan kobal klorida (CoCl2) terhadap pembentukan akar dengan
menggunakan TDZ pada Vicia faba L. Hasil penelitiannya menunjukkan bahwa penambahan ACC 3-10 mg/l menurunkan efisiensi pengakaran, sebaliknya dengan menambahka AgNO3 meningkatkan efisiensi pengakaran. AgNO3
menghambat etilen melalui ion Ag2+ yang akan mengurangi kapasitas reseptor untuk berikatan dengan etilen. Peningkatan konsentrasi TDZ berarti terjadi juga peningkatan konsentrasi etilen sehingga pada selang konsentrasi TDZ tertentu dapat menghambat pembentukan akar.
Tinggi Tanaman
disebabkan oleh dua proses, yaitu pembelahan dan pemanjangan sel. Kedua proses ini terjadi pada jaringan meristem, yaitu pada titik tumbuh batang.
Pengamatan terhadap tinggi tanaman dilakukan pada akhir percobaan, yaitu pengamatan minggu ke-5. Hasil analisis ragam menunjukkan bahwa konsentrasi TDZ, NAA, dan interaksi antara keduanya memberikan pengaruh yang sangat nyata terhadap tinggi tanaman (Tabel 1).
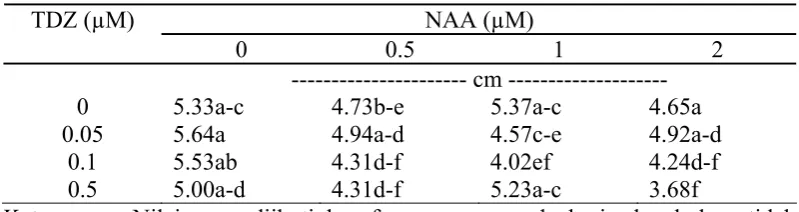
Tinggi tanaman pada 5 MST dipengaruhi oleh interaksi antara TDZ dengan NAA. Tunas yang berasal dari media multiplikasi tanpa ZPT menghasilkan tinggi tanaman yang tidak berbeda dengan tunas yang berasal dari media multiplikasi dengan penambahan TDZ atau NAA. Pada perlakuan 2 µM NAA yang disertai dengan penambahan konsentrasi TDZ yang tinggi cenderung menekan pertumbuhan tanaman (Tabel 4).
Tabel 4. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Tinggi Tanaman pada Media Pengakaran 5 MST
NAA (µM) TDZ (µM)
0 0.5 1 2 --- cm ---
0 5.33a-c 4.73b-e 5.37a-c 4.65a
0.05 5.64a 4.94a-d 4.57c-e 4.92a-d
0.1 5.53ab 4.31d-f 4.02ef 4.24d-f
0.5 5.00a-d 4.31d-f 5.23a-c 3.68f Keterangan: Nilai yang diikuti huruf yang sama pada baris dan kolom tidak
berbeda nyata pada uji DMRT 5%
Aklimatisasi
Aklimatisasi merupakan tahap pemindahan planlet dari kondisi buatan (in vitro) ke kondisi lapang (ex vitro) atau dari keadaan heterotrop ke keadaan autotrop. Tahapan ini diperlukan karena planlet yang berasal dari kultur in vitro tidak dapat beradaptasi atau tidak sesuai untuk kondisi ex vitro.
22
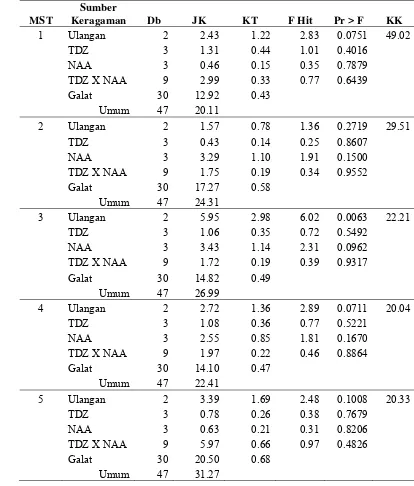
Tabel 5 di bawah merupakan rekapitulasi hasil analisis sidik ragam pengaruh TDZ dan NAA dari Tabel Lampiran 7 sampai dengan Tabel Lampiran 9. Berdasarkan hasil analisis ragam pemberian TDZ berpengaruh sangat nyata terhadap tinggi tanaman pada 1, 2 dan 3 minggu setelah aklimatisasi (MSA). Interaksi antara TDZ dan NAA berpengaruh nyata terhadap persentase planlet hidup pada 1 MSA namun pada minggu pengamatan selanjutnya tidak berpengaruh nyata. Pada Tinggi tanaman interaksi antara TDZ dan NAA berpengaruh sangat nyata pada 2 MSA. Pemberian NAA tidak berpengaruh nyata terhadap semua peubah (Tabel 5).
Tabel 5. Rekapitulasi Hasil Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Peubah yang Diamati
Persentase Planlet Hidup
Planlet diaklimatisasi setelah 5 minggu di media pengakaran. Hasil analisis ragam menunjukkan bahwa persentase planlet hidup dipengaruhi oleh interaksi antara TDZ dan NAA pada 1 MSA (Tabel 5), namun pola interaksi tersebut tidak jelas.
Tabel 6. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Persentase Planlet Hidup pada 1 MSA Keterangan : Nilai yang diikuti huruf yang sama pada baris dan kolom tidak
berbeda nyata pada uji DMRT 5%
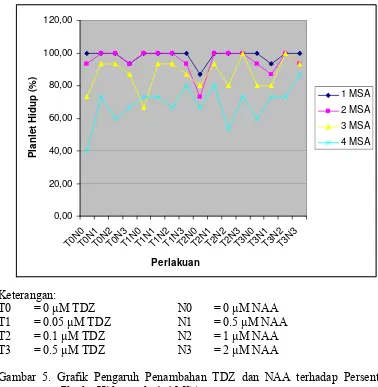
Tunas yang berasal dari media multiplikasi dengan berbagai taraf konsentrasi TDZ dan NAA menghasilkan persentase planlet hidup yang cukup tinggi di atas 85% pada 1 MSA (Tabel 6), kemudian terus mengalami penurunan pada minggu pengamatan selanjutnya (Gambar 5). Penurunan persentase planlet hidup ini diduga karena pada tahap aklimatisasi sudah banyak faktor yang mempengaruhinya, seperti kondisi lingkungan fisik. Lingkungan seperti cahaya, suhu, kelembaban dan sirkulasi udara sangat perlu diperhatikan, karena planlet yang baru dipindahkan sangat rentan terhadap setiap perubahan lingkungan yang terjadi. Suhu di dalam screen house sekitar 29-340C dan paranet yang dipergunakan kurang dari 75%. Suhu yang tinggi dan kurangnya naungan menyebabkan terjadinya penguapan yang cukup tinggi sehingga daun menjadi layu dan kemampuan fotosintesis planlet menurun.
Menurut Sutiyoso (1986) pada tahap aklimatisasi cahaya yang diperlukan sekitar 15-20%, suhu 27-300C dan kelembaban yang diperlukan oleh planlet yang masih kecil antara 70-90%, dengan sirkulasi udara yang lembut dan terus menerus.
24
Gambar 5. Grafik Pengaruh Penambahan TDZ dan NAA terhadap Persentase Planlet Hidup pada 1-4 MSA
Tinggi Tanaman
Hasil analisis ragam menunjukkan bahwa pemberian TDZ berpengaruh nyata terhadap tinggi tanaman pada 1, 2, dan 3 MSA. Interaksi antara TDZ dengan NAA berpengaruh sangat nyata terhadap tinggi tanaman pada 2 MSA, sedangkan NAA tidak berpengaruh nyata terhadap tinggi tanaman (Tabel 5).
auksin berlebih yang dapat beralih menjadi toksik bagi tanaman sehingga berpotensi menghambat pertumbuhan tanaman.
Tabel 7. Pengaruh Interaksi TDZ dan NAA terhadap Rata-rata Tinggi Tanaman pada 2 MSA Keterangan : Nilai yang diikuti huruf yang sama pada baris dan kolom tidak berbeda
nyata pada uji DMRT 5%
Penurunan tinggi tanaman ini kemungkinan juga dikarenakan planlet nenas mengalami stres akibat transplanting shock dan kondisi lingkungan yang kurang menguntungkan. Indikasi stres ini terlihat dari pucuk daun yang mengering terutama pada daun terluar sedangkan pada daun terdalam (yang dekat dengan titik tumbuh) daun tetap berwarna hijau. Beberapa daun terluar gugur akibat suplai air yang kurang mencukupi kebutuhan planlet walaupun telah disiram tiap hari. Hal ini akan mengurangi pengukuran pada peubah tinggi tanaman dimana pengukuran tinggi tanaman diukur dari permukaan media hingga ujung daun terpanjang.
26
KESIMPULAN DAN SARAN
Kesimpulan
Pada tahap pembentukan akar, semua media multiplikasi mampu menginduksi munculnya akar pada media pengakaran MS + 0.5 μM NAA. Tunas yang berasal dari media multiplikasi dengan penambahan TDZ (0.1-0.5 μM) dan NAA (2 μM) yang tinggi menghasilkan panjang akar dan tinggi tanaman yang cenderung menurun.
Pada tahap aklimatisasi, Tunas yang berasal dari media multiplikasi dengan berbagai taraf konsentrasi TDZ dan NAA menghasilkan persentase planlet hidup yang cukup tinggi di atas 85% pada 1 MSA. Pada konsentrasi NAA 1-2 μM yang disertai penambahan TDZ yang tinggi cenderung menurunkan tinggi tanaman.
Saran
DAFTAR PUSTAKA
Ashari, S. 1995. Hortikultura Aspek Budidaya. Penerbit Universitas Indonesia. Jakarta. hal. 364-369.
Budi, R.S., Suwandi, dan C.K.H. Theo. 2000. Perbanyakan mikro dan aklimatisasi bunga gerbera (Gerbera jamessonsii bolus.). [10 Februari 2007].
Brainerd, K.E. and L.H. Fuchigami. 1981. Acclimatization of aseptically culture apple plant to low relative humidity. HortScience 106(4): 515-518.
Chen, Y. and C. Piluek. 1995. Effect of thidiazuron and N-6 benzylaminopurine on shoot regeneration of phalaenopsis. Plant Growth Regulation 16: 99-101.
Collins, J.L. 1960. The Pineapple. Leonard Hill. London. 295p
DeWald, M.G., G.A. Moore, W.B. Sherman and M.H. Evans. 1988. Production of pineapple plants in vitro. Plant Cell Report 7: 535-537.
Firoozabady, E. and N. Gutterson. 2003. Cost-effective in vitro propagation methods for pineapple. Plant Cell Report 21: 844-850.
Fratini, R. dan M.R. Ruiz. 2002. Comparative study different cytokinins in the induction of morphogenesis in lentil (Lensculinaris Medik.). In vitro Cell Dev. Biol. Plant. 38: 46-51.
Gardner, F.P., R.B. Pearce dan L.M. Roger. 1991. Fisiologi Tanaman Budidaya. Universitas Indonesia Press. Jakarta.
George, E.F. and P.D. Sherrington. 1984. Plant Propagation by Tissue Culture. Exegetics Ltd. 709p.
Gunawan, L.W. 1992. Teknik Kultur Jaringan Tumbuhan. Pusat Antar Univ. Bioteknologi. Institut Pertanian Bogor. Bogor. 165 hal.
Harjadi, S.S. 1996. Pengantar Agronomi. Penerbit PT. Gramedia Pustaka Utama. Jakarta.
Hartmann, H.T. and L.P.J. Kester. 1983. Plant Propagation, Principles and Practice (Ed.) 4. Pretice-Hail, Inc. Englewood Cliffs, New Jersey. 523-580p.
28
Kadlecek, P., I. Ticha, D. Haisel, V. Lapkova, and C. Schafer. 2001. Importance of in vitro pretreatmen for ex vitro acclimatization and growth. Plant Science 161: 695-701.
Kiss E., J. Kiss, G. Glylai and L.E. Hezky. 1995. A novel method for rapid micropropagation of pineapple. HortScience 30(1): 127-129.
Marbun, C.L.M. 2006. Perbanyakan Tanaman Nenas (Ananas comosus (L.) Merr.) Varietas Queen Asal Kepulauan Bangka dengan Kultur In vitro. Skripsi. Departemen Biologi. Fakultas Matematika dan Ilmu pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Mok, M.C., D.W. S. Mok, D.J. Amstrong, K. Shudo, Y. Isogai, and T. Okamoto. 1982. Cytokinin activity of N-Phenyl-n-1,2,3-thidiazon-5-yurea (thidiazuron). Phytochemestry 21: 1509-1511.
Murthy, B.N.S., S.J Murch, P.K. Saxena. 1995. Thidiazuron induce somatic embryogenesis in intacle seedling of peanut (Arachis hypogea L.): endogeneous growth regulator levels and significance of cotyledons. Physiol. Plant 94: 268-276.
Nakasone, H.Y. and R.E. Paull. 1999. Tropical Fruit. CAB International. London. p. 292-327.
Nursandi, F. 2006. Studi Perbanyakan In vitro Tanaman Nenas (Ananas comosus (L.) Merr.) dan Analisa Kestabilan Genetik Berdasarkan Karakter Morfologi, Isozim dan RAPD. Disertasi. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor. 148 hal.
Petty G.J., G.R. Stirling, and D.P. Bartholomew. 2002. Pest of Pineapple. p. 157-195. In Pena JE, and Sharp JL, Wysoki M (eds.). Tropical Fruit Pest and Pollinators. CABI Publishing.
Pierik, R.M.L. 1987. In vitro Culture of Higher Plant. Marthinus Mijhoff Pub. Nederland. 344p.
PKBT, IPB. 2004. Pengembangan Teknologi Produksi-Nenas. Laporan Kemajuan Tahap I RUSNAS. Pengembangan Buah-buahan Unggulan Indonesia. Institut Pertanian Bogor. Bogor.
Samson, J.A. 1980. Tropical Agriculture Series Tropical Fruit. Published in the united stated of American by Longman inc. New York. p. 163 – 183. Sukawan, I.K.C. 2000. Perbanyakan Tanaman Nenas Varietas Variegata (Ananas
comosus ”Variegatus”) Secara In vitro. Skripsi. Jurusan Budidaya Pertanian. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Thomas, J.C. and F.R. Katterman. 1986. Cytokinin activity induced by thidiazuron. Plant Physiol 81: 681-683.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor.
Wattimena, G.A., L.W. Gunawan, N.A. Mattjik, E. Syamsudin, N.M.A. Wiendi, A. Ernawati. 1992. Bioteknologi Tanaman. Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas Bioteknologi IPB – Lembaga Sumberdaya Informasi IPB. Bogor.
Wee, Y.C. dan M.C.L. Thongtham. 1997. Nenas. hal 66-71. dalam Verheij, E. W. M. dan R. E. Coronel (eds.). Sumber Daya Nabati Asia Tenggara 2. Buah-buahan Dapat Dimakan. PT. gramedia Pustaka Utama.
Wetherell, D.F. 1982. Pengantar Propagasi Tanaman secara In Vitro. IKIP Semarang Press. Semarang.
Zaer, J.S. and M.O. Mapes. 1985. Action of Growth regulators. p. 231-255. In J. M. Bonga and P. J. Duczan (eds.). Tissue Culture in Forestry. Martinus NIJHOFF. London.
30
Tabel Lampiran 1. Komposisi Media Murashige-Skoog (MS)
Pyridoxine-HCl 50.0 mg/100 ml 0.50
Nicotinic Acid 50.0 mg/100 ml 0.50
Glycine 200.0 mg/100 ml 2.00
H Myo-inositol 10.00 10 100.00
32
Tabel Lampiran 2. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Persentase Tunas Berakar pada Media Pengakaran
MST
Sumber
Keragaman Db JK KT F Hit Pr > F KK
1 Ulangan 2 1886.57 943.29 1.31 0.2853 35.97 TDZ 3 6359.95 2119.98 2.94 0.0491 NAA 3 387.73 129.24 0.18 0.9096
TDZ X NAA 9 4172.45 463.61 0.64 0.7516 Galat 30 21631.94 721.06
Umum 47 34438.66
Tabel Lampiran 3. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Jumlah Akar pada Media Pengakaran
34
Tabel Lampiran 4. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Panjang Akar pada Media Pengakaran
MST
Tabel Lampiran 5. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Jumlah Daun pada Media Pengakaran
MST
Sumber
Keragaman Db JK KT F Hit Pr > F KK
5 Ulangan 2 5.18 2.59 2.17 0.1320 18.96
TDZ 3 2.90 0.97 0.81 0.4997
NAA 3 4.15 1.38 1.16 0.3419
TDZ X NAA 9 9.72 1.08 0.90 0.5350 Galat 30 35.86 1.20
Umum 47 57.81
Tabel Lampiran 6. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Tinggi Tanaman pada Media Pengakaran
Tabel Lampiran 7. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Persentase Planlet Hidup saat Aklimatisasi
MST
Sumber
Keragaman Db JK KT F Hit Pr > F KK
1 Ulangan 2 66.67 33.33 1.36 0.2711 5.03
TDZ 3 66.67 22.22 0.91 0.4483
NAA 3 66.67 22.22 0.91 0.4483
TDZ X NAA 9 533.33 59.26 2.42 0.0333 Galat 30 733.33 24.44
Umum 47 1466.67
2 Ulangan 2 66.67 33.33 0.29 0.7473 11.16 TDZ 3 625.00 208.33 1.84 0.1615
NAA 3 225.00 75.00 0.66 0.5821
TDZ X NAA 9 1475.00 163.89 1.45 0.2134 Galat 30 3400.00 113.33
Umum 47 5791.67
3 Ulangan 2 1666.67 833.33 2.55 0.0948 20.75 TDZ 3 2358.33 786.11 2.41 0.0868
NAA 3 91.67 30.56 0.09 0.9630
TDZ X NAA 9 167.00 186.11 0.57 0.8108 Galat 30 9800.00 326.67
Umum 47 15591.67
4 Ulangan 2 2600.00 1300.00 1.66 0.2076 40.74 TDZ 3 2491.67 83056 1.06 0.3812 NAA 3 1425.00 475,00 0.61 0.6166
TDZ X NAA 9 1875.00 208.33 0.27 0.9793 Galat 30 23533.33 784.44
36
Tabel Lampiran 8. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Jumlah Daun saat Aklimatisasi
MST
4 Ulangan 2 36.33 18.17 10.81 0.0003 23.45
TDZ 3 1.88 0.63 0.37 0.7730
NAA 3 1.77 0.59 0.35 0.7882
TDZ X NAA 9 12.83 1.43 0.85 0.5787 Galat 30 50.40 1.68
Tabel Lampiran 9. Analisis Sidik Ragam Pengaruh TDZ dan NAA terhadap Tinggi Tanaman saat Aklimatisasi
MST
Sumber
Keragaman Db JK KT F Hit Pr > F KK
1 Ulangan 2 7.14 3.57 12.06 0.0001 12.64
TDZ 3 5.01 1.67 5.65 0.0034
NAA 3 1.71 0.57 1.93 0.1457
TDZ X NAA 9 5.43 0.60 2.04 0.0694
Galat 30 8.88 0.30
Umum 47 28.17
2 Ulangan 2 9.54 4.77 17.74 0.0001 11.83
TDZ 3 5.05 1.68 6.26 0.0020
NAA 3 1.36 0.45 1.68 0.1913
TDZ X NAA 9 9.58 1.06 3.96 0.0021
Galat 30 8.06 0.27
Umum 47 33.59
3 Ulangan 2 14.05 7.03 13.49 0.0001 15.75
TDZ 3 7.01 2.34 4.48 0.0103
NAA 3 2.82 0.94 1.81 0.1671
TDZ X NAA 9 9.25 1.03 1.97 0.0788
Galat 30 15.63 0.52
Umum 47 48.76
4 Ulangan 2 17.78 8.89 8.07 0.0016 22.86
TDZ 3 2.31 0.77 0.70 0.5592
NAA 3 3.60 1.20 1.09 0.3681
TDZ X NAA 9 12.06 1.34 1.22 0.3217
Galat 30 33.04 1.10