PENGARUH PEMBERIAN HORMON BAP TERHADAP
MULTIPLIKASI TUNAS TUMBUHAN KANTUNG SEMAR
(
Nepenthes alata
Blanco) PADA MEDIA TANAM
MURASHIGE &
SKOOG
DENGAN TEKNIK
IN VITRO
ADRIAN
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
PENGARUH PEMBERIAN HORMON BAP TERHADAP
MULTIPLIKASI TUNAS TUMBUHAN KANTUNG SEMAR
(
Nepenthes alata
Blanco) PADA MEDIA TANAM
MURASHIGE &
SKOOG
DENGAN TEKNIK
IN VITRO
ADRIAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan di Fakultas Kehutanan Institut Pertanian Bogor
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
RINGKASAN
Adrian. E34062043. Pengaruh Pemberian Hormon BAP terhadap Multiplikasi Tunas Tumbuhan Kantung Semar (Nephentes alata Blanco) pada Media Tanam Murashige & Skoog dengan Teknik In Vitro. Di bawah bimbingan EDHI SANDRA dan SISWOYO.
Nepenthes atau Kantung Semar merupakan tumbuhan yang unik yang saat ini keberadaannya semakin terancam. Saat ini nepenthes termasuk ke dalam tanaman langka berdasarkan kategori IUCN (International Union for Conservation of Nature) dan WCMC (World Conservation Monitoring Centre). Di Indonesia tumbuhan ini dilindungi menurut PP No. 7 tahun 1999 dan termasuk dalam daftar CITES Appendix I (N. rajah dan N. khasiana) dan Appendix II (selain kedua jenis tersebut). Teknik budidaya tumbuhan dengan metode konvensional (menggunakan medium tanah atau pasir) sering dihadapkan kepada kendala teknis, baik dalam segi waktu maupun lingkungan. Oleh karena itu saat ini telah berkembang teknik budidaya kultur jaringan, dan untuk mengoptimalkan multiplikasi tunas N. alata dapat dirangsang dengan menggunakan hormon BAP (6-benzylaminopurine).
Penelitian ini dilaksanakan pada bulan November 2010 hingga Maret 2011 di Laboratorium Konservasi Tumbuhan, Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan, Institut Pertanian Bogor. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh pemberian hormon BAP (0, 0.1, 0.3, dan 0.5 ml/l) dan penggunaan media Murashige & Skoog (0, 1/5, 1/3, dan 1 MS) serta interaksi keduanya terhadap pertumbuhan nepenthes secara in vitro. Pengambilan data kuantitatif berupa jumlah tunas, tinggi tunas, jumlah buku dan jumlah daun, sedangkan data kualitatif berupa deskripsi terhadap kondisi tanaman (pengakaran, pengkalusan, dan kematian).
Hasil penelitian ini menunjukkan bahwa interaksi hormon BAP dan media MS tidak menunjukkan pengaruh berbeda nyata terhadap multiplikasi tunas tumbuhan N. alata, jumlah tunas paling banyak ditunjukkan pada perlakuan 0,5 ml/l BAP, 1/3 MS (A3B2) sebanyak 5,50 tunas. Penggunaan media MS menunjukkan pengaruh beda nyata terhadap multiplikasi tunas tumbuhan N. alata, jumlah paling banyak ditunjukkan pada media 1/3 MS (B2) sebanyak 4,20 tunas; sedangkan pemberian hormon BAP tidak berpengaruh nyata terhadap multiplikasi tunas tumbuhan N. alata, dimana jumlah paling banyak ditunjukkan pada konsentrasi BAP 0,1 ml/l (A1) sebanyak 4,20 tunas.
Kesimpulan dari penelitian ini adalah multiplikasi tunas tumbuhan N. alata paling baik terjadi pada perlakuan 0,5 ml/l BAP, 1/3 MS (A3B2); sedangkan jika hanya menggunakan media MS multiplikasi tunas tumbuhan N. alata paling baik ditunjukkan pada media 1/3 MS (B2), dan jika hanya menggunakan hormon BAP multiplikasi tunas tumbuhan N. alata paling baik ditunjukkan pada 0,1 ml/l (A1).
SUMMARY
Adrian. E34062043. The Effect of BAP Hormones on Shoot Multiplication of Kantung Semar (Nephentes alata Blanco) Planted on Murashige & Skoog Media with In Vitro Techniques. Under Supervision of EDHI SANDRA and SISWOYO.
Nepenthes or pitcher plant is unique plant which existence is increasingly threatened. Currently nepenthes is belong to the category of rare plants on the basis of IUCN (International Union for Conservation of Nature) and WCMC (World Conservation Monitoring Centre). In Indonesia, this plant is protected by PP No.7 / 1999 and included in Appendix I (N. rajah and N. khasiana) and Appendix II (in addition to the two types of these) of CITES. Plant cultivation techniques with conventional methods (using soil or sand media) are often encounter technical challenges, both in terms of time and environment. Nowaday, tissue culture technique had been developed to overcome the challenges, and BAP hormones (6-benzylaminopurine) could be used in stimulating nepenthes shoot multiplication.
The research was conducted in November 2010 to March 2011 in Plant Conservation Laboratory, Department of Forest Resources Conservation and Ecotourism, Faculty of Forestry, Bogor Agricultural University. The purpose of this study was to investigate the effect of BAP hormones (0, 0.1, 0.3, and 0.5 ml/l), the use of Murashige & Skoog media (0, 1/5, 1/3, and 1 MS), and the interaction of both hormone and media effect on the growth nepenthes invitro. Quantitative data collected included the number of shoots, books, and leaves, and the height of shoot, while the qualitative data included description of the condition of the plant (root, callus, and death).
The result showed that the interaction between BAP hormone and Murashige & Skoog medium did not indicate a statistically significantly different effect on the shoot multiplication of N. alata. The highest number of shoot was shown in the treatment of 0.5 ml/l BAP, 1/3 MS (A3B2) with the average number 5.50 units. The use of MS medium indicated a statistically significantly different effect on the shoot multiplication of N. alata, with the highest number of shoot was shown in the use of 1/3 MS (B2) mediawith the average number 4,20 units; while the giving of BAP hormone did not indicate a statistically significantly different effect on the shoot multiplication of N. alata, with the highest number of shoot was shown in the use of BAP 0.1 ml/l (A1) with the average number 4.20 units.
The conclusion of this research was the best shoot multiplication of N. alata happens in the treatment 0.5 ml/l BAP, 1/3 MS (A3B2); while if it just usedthe MS media the best shoot multiplication was shown in the use of 1/3 MS (B2) media, and if it just used BAP hormone the best shoot multiplication is shown in 0.1 ml/l (A1) concentration of BAP.
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Pengaruh
Pemberian Hormon BAP terhadap Multiplikasi Tunas Tanaman Kantung Semar (Nephentes alata Blanco) pada Media Tanam Murashige & Skoog dengan Teknik In Vitro” adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen pembimbing dan belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juni 2011
Judul Skripsi : Pengaruh Pemberian Hormon BAP terhadap Multiplikasi Tunas Tumbuhan Kantung Semar (Nepenthes alata Blanco) pada Media Tanam Murashige & Skoog dengan Teknik In Vitro.
Nama Mahasiswa : Adrian NRP : E34062043
Menyetujui, Komisi Pembimbing
Ketua,
Ir. Edhi Sandra, M.Si NIP. 196610191993031002
Anggota,
Ir. Siswoyo, M. Si NIP. 196502081992031003
Mengetahui,
Ketua Departemen Konservasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan Institut Pertanian Bogor
Prof. Dr. Ir. Sambas Basuni, MS NIP. 195809151984031003
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat, hidayah dan kasih sayang-Nya, sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar Sarjana Kehutanan pada Fakultas Kehutanan Institut Pertanian Bogor, dengan judul “Pengaruh Pemberian Hormon BAP terhadap Multiplikasi Tunas Tumbuhan Kantung Semar (Nepenthes Alata Blanco) pada Media Tanam Murashige & Skoog dengan Teknik In Vitro”.
Penulis mengucapkan terima kasih kepada ibu, bapak, dan seluruh keluarga serta kerabat atas doa dan dukungannya. Ucapan terima kasih juga penulis sampaikan kepada Ir. Edhi Sandra, M.Si dan Ir. Siswoyo, M.Si yang telah memberikan bimbingan dan masukan dalam penulisan skripsi ini, serta semua pihak di Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan IPB yang telah membantu selama penelitian berlangsung.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juni 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 5 Januari 1989 sebagai anak ketiga dari tiga bersaudara pasangan Bapak Nurman Jafar dan Ibu Sumartri Harni. Penulis memulai pendidikan dasar di SD Hang Tuah Jakarta Utara pada tahun 1994, SDN Duren Jaya 3 Bekasi pada tahun 1995, dan SD Bani Saleh 5 Bekasi dari tahun 1996 hingga tahun 2000. Pada tahun yang sama melanjutkan pendidikan di SLTP Negeri 3 Bekasi hingga tahun 2003, kemudian melanjutkan di SMA KORPRI Bekasi hingga tahun 2006. Penulis melanjutkan pendidikan perguruan tinggi di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan.
Selama menjadi mahasiswa di IPB penulis aktif di organisasi DKM „Ibaadurrahman tahun 2009 sebagai Ketua Departemen PSDM dan terlibat dalam kepanitian Masa Perkenalan Kampus Mahasiswa Baru (MPKMB) di divisi Logistik dan Transportasi pada tahun 2007. Selain itu penulis juga pernah menjadi asisten mata kuliah Pendidikan Agama Islam pada tahun 2008-2009.
Praktek yang diikuti penulis terdiri dari Praktek Pengenalan Ekosistem Hutan (P2EH) di kabupaten Garut pada tahun 2008, Praktek Pengelolaan Hutan (P2H) di Hutan Pendidikan Gunung Walat (HPGW) Sukabumi pada tahun 2009, dan Praktek Kerja Lapang Profesi (PKLP) di Balai Besar Taman Nasional Gunung Gede-Pangrango (BBTNGGP) Jawa Barat.
Dalam rangka menyelesaikan pendidikan dan sebagai salah satu syarat memperoleh gelar sarjana pada Fakultas Kehutanan, Institut Pertanian Bogor, penulis melakukan penelitian dan penyusunan skripsi yang berjudul “Pengaruh Pemberian Hormon BAP terhadap Multiplikasi Tunas Tumbuhan Kantung Semar (Nepenthes Alata Blanco) pada Media Tanam Murashige & Skoog dengan Teknik In Vitro” di
UCAPAN TERIMA KASIH
Segala puji bagi Allah, Rabb semesta alam yang telah memberikan hidayah, nikmat, serta kasih sayang. Shalawat serta salam semoga selalu terhaturkan kepada Rasulullah saw. atas suri tauladan dan cinta kasih yang diberikan sehingga penulis dapat menyelesaikan skripsi ini. Pada kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-sebesarnya kepada:
1. Ayahanda Nurman Jafar, ibunda Sumartri Harni, kakak-kakakku (Hardiana & suami, serta Zulfikar), adik-adikku tercinta Trio-R (Rizka, Rani, dan Rasydan), serta kepada keluarga besar lainnya atas do‟a, dukungan, motivasi, serta kasih sayang yang telah diberikan.
2. Bapak Ir. Edhi Sandra, M.Si dan Bapak Ir. Siswoyo, M.Si selaku dosen pembimbing yang telah memberikan bimbingan, nasihat dan dukungan selama penulis melakukan penelitian dan penyusunan skripsi.
3. Bapak Ir. Iwan Hilwan, MS selaku dosen penguji sidang dan Bapak Dr. Ir. Agus Priyono Kartono, M.Si selaku ketua komisi sidang yang telah memberikan masukan dan saran dalam penulisan skripsi.
4. Bapak dan Ibu dosen beserta seluruh staf di Fakultas Kehutanan IPB, khususnya Departemen Konservasi Sumberdaya Hutan dan Ekowisata.
5. Pak Basuki, Pak Santa, dan Bi Minah selaku laboran di Laboratorium Konservasi Tumbuhan atas bantuan yang diberikan selama penelitian.
6. Mutha Ali Khalifa, atas persahabatannya dan jazakallah sudah disambut 5 tahun yang lalu di GWW serta printernya.
7. Teman-teman sekaligus saudara di kostan Badut (Dipa, Saiba, Septian, Anom, Rahmat) yang telah berbagi keceriaan dan kesulitan selama 4 tahun. 8. My brothers di kostan Ash-shaff (Hanif, Cici, Hamdhan, dll) beserta
PeGeTe-nya (Age, Faris, Dwi) atas dukungan moril di saat-saat terakhirPeGeTe-nya.
9. Keluarga besar DKM „Ibaadurrahman.
10.Keluarga besar Ikhwah Fahutan atas “waktu”nya selama ini, semoga ukhuwah ini tetap terjalin.
12.Kepada seluruh pihak yang telah membantu dan tidak dapat disebutkan satu persatu.
Semoga hasil penelitian ini bermanfaat bagi pembaca dan khususnya bagi penulis sendiri. Mohon maaf atas segala kekurangan. Terima kasih.
Bogor, Juni 2011
DAFTAR ISI
D. Metode Pengumpulan Data ... 15
E. Metode Analisis Data ... 16
1. Pengaruh Interaksi Media MS dan Hormon BAP
terhadap Pertumbuhan Tumbuhan Kantung Semar ... 19
2. Pengaruh Media MS terhadap Pertumbuhan Tumbuhan Kantung Semar ... 21
3. Pengaruh Hormon BAP terhadap Pertumbuhan Tumbuhan Kantung Semar ... 26
B. Kematian ... 29
1. Browning (Pencoklatan) ... 29
2. Kontaminasi ... 31
BAB V KESIMPULAN DAN SARAN A. Kesimpulan ... 32
B. Saran ... 32
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
No. Halaman 1. Media perlakuan kombinasi BAP dan MS ... 17 2. Pengaruh interaksi MS dan BAP terhadap jumlah tunas
tumbuhan N. alata (buah) ... 19 3. Pengaruh konsentrasi MS dan BAP terhadap tinggi tunas
tumbuhan N. alata (cm) ... 20 4. Pengaruh konsentrasi MS dan BAP terhadap jumlah buku
tumbuhan N. alata (buah) ... 21 5. Pengaruh konsentrasi MS dan BAP terhadap jumlah daun
tumbuhan N. alata (helai) ... 21 6. Rekapitulasi pengaruh media MS terhadap jumlah tunas,
tinggi tunas, jumlah buku dan daun tumbuhan N. alata ... 22 7. Rekapitulasi sidik ragam media MS terhadap jumlah tunas,
tinggi tunas, jumlah buku dan daun N. alata ... 22 8. Rekapitulasi hasil uji wilayah Duncan penggunaan media MS
terhadap jumlah tunas dan tinggi tunas tumbuhan N. alata ... 23 9. Hasil uji wilayah Duncan penggunaan media MS
terhadap jumlah buku tumbuhan N. alata ... 24 10.Rekapitulasi pengaruh hormon BAP terhadap jumlah tunas,
tinggi tunas, jumlah buku dan daun tumbuhan N. alata ... 26 11.Rekapitulasi sidik ragam media MS terhadap jumlah tunas,
tinggi tunas, jumlah buku dan daun N. alata ... 26 12.Hasil uji wilayah Duncan pemberian hormon BAP terhadap
tinggi tunas tumbuhan N. alata ... 27 13.Rekapitulasi hasil uji wilayah Duncan pemberian hormon BAP
DAFTAR GAMBAR
No. Halaman
1. Kantung Semar (N. alata) ... 4
2. N. alata ... 9
3. Petumbuhan tumbuhan N. alata pada perlakuan A1B2 ... 21
4. Petumbuhan tumbuhan N. alata pada media MS ... 25
5. Pertumbuhan tumbuhan N. alata pada konsentrasi BAP 0,1 ml/l (A1) ... 28
6. Pengkalusan pada tumbuhan N. alata ... 29
7. Gejala awal pencoklatan pada tumbuhan N. alata ... 30
8. Tunas tumbuh pada tumbuhan N. alata yang terserang pencoklatan ... 30
DAFTAR LAMPIRAN
No. Halaman
1. Komposisi Media MS (Murashige & Skoog) ... 38
2. Persentasi tumbuhan N. alata yang hidup (%) ... 39
3. Jumlah tunas tumbuhan N. alata (buah) ... 40
4. Tinggi tunas tumbuhan N. alata (cm) ... 41
5. Jumlah buku tumbuhan N. alata (buah) ... 42
6. Jumlah daun tumbuhan N. alata (helai) ... 43
7. Jumlah tumbuhan N. alata yang hidup (%) ... 44
8. Jumlah kematian tumbuhan N. alata (%) ... 45
9. Jumlah pencoklatan tumbuhan N. alata ... 46
10.Jumlah kontaminasi tumbuhan N. alata ... 47
11.Gambar tumbuhan N. alata pada akhir pengamatan (12 MST) ... 48
12.Gambar tumbuhan N. alata terkena kontaminasi oleh cendawan ... 49
I. PENDAHULUAN
A. Latar Belakang
Nepenthes atau Kantung Semar (pitcher plant) merupakan tumbuhan
karnivora yang di setiap ujung daunnya memiliki kantung yang unik. Kantung yang unik ini dapat menjebak serangga atau hewan kecil lainnya, karena di dalam kantungnya terdapat nectar glands (kelenjar madu) yang dapat memikat serangga khususnya yang menyukai rasa manis. Dinding permukaan kantung licin sehingga ketika mendekati kantung serangga akhirnya terpeleset dan terperangkap di dalam kantung (Handoyo dan Sitanggang, 2006).
Bentuk, warna serta corak kantung yang unik dan cantik telah membawa kantung semar digemari oleh banyak orang sebagai tanaman hias dan koleksi. Selain itu kantung semar juga mempunyai manfaat sebagai obat. Cairan pada kantung yang belum terbuka bisa dimanfaatkan untuk mengobati luka bakar, sakit mata, sakit perut, penyakit kulit, batuk, dan menghentikan ompol pada anak (Handayani, 2008).
N. alata merupakan spesies nepenthes yang berasal dari Filipina dan
merupakan spesies yang sangat adaptif sehingga banyak dipelihara dan digunakan sebagai tanaman hias.
Dewasa ini kelestarian Nepenthes di Indonesia terancam karena konversi hutan dan lahan secara besar-besaran. Saat ini kantung semar termasuk tumbuhan langka berdasarkan kategori IUCN (International Union for Conservation of Nature) dan WCMC (World Conservation Monitoring Centre). Di Indonesia tumbuhan ini dilindungi menurut PP No. 7 tahun 1999 tentang Pengawetan dan Pelestarian Tumbuhan dan Satwa Liar, dan termasuk dalam daftar CITES Appendix I (N. rajah dan N. khasiana) dan Appendix II (selain kedua jenis tersebut).
bencana alam yang seringkali mengganggu perbanyakan tumbuhan di lapangan (Yuwono, 2008).
Dewasa ini telah berkembang teknik budidaya/multiplikasi tanaman yang mulai banyak diaplikasikan di berbagai negara di dunia, yaitu teknik kultur in-vitro. Menurut Nasir (2002), kultur in-vitro merupakan sebuah proses perbanyakan sel, jaringan, organ, atau protoplas dengan teknik steril (aseptik). Kegiatan ini mencakup semua teknik kultur sel dan jaringan yang meliputi perbanyakan, pengamatan, dan manipulasi genetik tumbuhan tanpa melibatkan siklus seksual. Yuwono (2008) mengatakan, umumnya teknik kultur ini menggunakan bagian tumbuhan berupa jaringan sebagai bahan awal perbanyakan, sehingga teknik ini dikenal dengan nama kultur jaringan.
Mariska dan Sukmadjaya (2003) menyebutkan, kelebihan teknik kultur jaringan ini dibandingkan dengan metode konvensional adalah, (1) perbanyakan tinggi, (2) tidak tergantung musim, (3) bahan tanaman yang digunakan relatif sedikit sehingga tidak merusak tanaman induk, (4) tanaman yang dihasilkan bebas dari penyakit maupun dari tanaman induk yang mengandung pathogen internal, dan (5) tidak membutuhkan tempat yang luas untuk menghasilkan tanaman dalam jumlah banyak. Adapun kendala yang sering ditemukan dalam teknik kultur jaringan ini adalah sulitnya mendapatkan tanaman dengan kondisi yang steril sehingga menimbulkan tingginya tingkat kontaminasi pada eksplan yang menyebabkan kematian pada eksplan. Selain itu juga kondisi browning (pencoklatan) yang sering menyerang eksplan yang berbeda kadarnya pada tiap spesies tanaman yang menyebabkan sulitnya penerapan teknik kultur jaringan.
B. Tujuan Penelitian
Tujuan dari penelitian ini antara lain:
1. Menduga pengaruh perbedaan komposisi media MS (1, 1/3, dan 1/5 MS) terhadap multiplikasi tunas N. alata.
2. Menduga pengaruh perbedaan komposisi penggunaan BAP (0.1, 0.3, dan 0.5 ml/l) terhadap multiplikasi tunas N. alata.
3. Menduga kombinasi terbaik penggunaan variasi komposisi MS dan BAP yang diberikan terhadap multiplikasi tunas N. alata.
C. Manfaat
Melalui penelitian ini diharapkan dapat memberikan informasi mengenai konsentrasi zat pengatur tumbuh BAP dan media MS serta kombinasinya yang terbaik untuk meningkatkan multiplikasi tunas N. alata.
D. Hipotesis
II. TINJAUAN PUSTAKA
A. Kantung Semar (Nepenthes alata) 1. Klasifikasi
Gambar 1 Kantung semar (N. alata)
Berikut ini merupakan klasifikasi dari tanaman kantung semar: Kingdom : Plantae
2. Nama Daerah
Nepenthes atau kantung semar, juga dikenal dengan berbagai nama dari
daerah yang berbeda. Selain kantung semar, nama-nama yang biasa dipakai untuk menyebut tanaman tersebut antara lain: periuk monyet; terompet gunung; lonceng gunung; ketakung; entuyut (suku Dayak); kobe-kobe (Papua); kacung beruk; pitcher plant; pelipur lara; kendi setan; Miranda Herba; dan lain sebagainya.
3. Manfaat
Kantung semar memiliki warna, corak, serta bentuk kantung yang unik sehingga banyak dimanfaatkan sebagai tanaman hias. Air dalam kantung Nepenthes dapat digunakan untuk memperlancar persalinan, menghentikan ompol pada anak, mengobati sakit mata, batuk, maag, dan penyakit kulit. Kantungnya juga biasa digunakan untuk memasak lemang oleh orang Sumatera. Sementara itu, masyarakat tradisional di pedalaman menggunakan batangnya sebagai tali atau tempat nasi pada upacara adat (Handoyo dan Sitanggang, 2006).
4. Sejarah
Kantung semar (Nephentes sp.) pertama kali ditemukan dan dideskripsikan oleh Etienne de Flacourt pada tahun 1658 di Madagaskar. Jenis yang ditemukan saat ini dikenal sebagai Nepenthes madagascariensis. Pada tahun 1677 spesies kantung semar kembali ditemukan di Srilanka. Spesies endemik Srilanka ini dikenal dengan sebutan Nepenthes distillatoria. Baru pada tahun 1690, seorang ahli botani asal Belanda bernama Rumphius menemukan spesies baru tanaman kantung semar yang kini lebih dikenal sebagai Nepenthes mirabilis, spesies baru tersebut ditemukan di daerah Maluku.
dari Madagaskar, Kepulauan Seychelles, Srilanka, India, Cina, Asia Tenggara, Papua, Australia, dan Kaledonia Baru.
Dari 103 spesies kantung semar, 33 spesies ada di Kalimantan (wilayah Indonesia dan Malaysia), dengan 25 spesies diantaranya merupakan spesies endemik yang tidak ditemukan di daerah lain, sedangkan di Sumatera terdapat 30 spesies dengan 17 spesies endemik. Kedua pulau tersebut menyimpan jumlah spesies kantung semar terbanyak di dunia, sehingga disebut sebagai sumber plasma nutfah kantong semar terbesar. Sementara di Semenanjung Malaysia terdapat 8 spesies kantung semar, kemudian Filipina dengan 12 spesies, dan Papua 9 spesies dengan 7 spesies endemik.
6. Habitat
Kantung semar tidak hanya tumbuh di daerah lembab dan teduh, tetapi juga pada tempat yang miskin unsur hara seperti rawa-rawa dan pasir pantai. Beberapa spesies juga ditemukan tumbuh di tanah gambut, tanah pasir, tanah kapur, celah bebatuan, serasah daun, tanah gunung, atau di pohon-pohon besar (epifit). Kantong pada kantung semar mampu memberikan cadangan nutrisi sehingga tanaman ini dapat bertahan hidup pada tanah yang miskin hara (Handoyo dan Sitanggang, 2006).
Berdasarkan tempat tumbuhnya kantung semar dapat dibagi menjadi tiga, yaitu dataran rendah (0-300 m dpl), dataran menengah (300-700 m dpl), dan dataran tinggi (> 700 m dpl).
Kantung semar dataran rendah banyak dijumpai di hutan kerangas dengan ciri khas tanah yang berpasir, banyak ditemukan kantung semar pada areal pinggir hutan kerangas pada semak belukar resam. Pada habitat ini ditemukan spesies N. rafflesiana, N. gracilis, N. ampullaria, N. albomarginata, dan N. mirabilis.
Beberapa spesies kantung semar seperti N. rafflesiana, N. gracilis, dan N. ampularia dapat juga ditemukan pada daerah berpayau, yaitu tanahnya masam
bergambut dan selalu basah dengan kelembaban yang sangat tinggi. Spesies kantung semar yang tumbuh di daerah ini umumnya bersifat terestrial yang tampak tumbuh diantara liana.
Selain itu, kantung semar juga ditemukan pada daerah dataran tinggi dengan cuaca yang kerapkali berkabut dan terasa dingin. Tanahnya bersifat masam dengan lumut yang mendominasi dan tanaman bersifat epifit. Kantung semar biasanya tumbuh bertebaran di lokasi hutan yang terkena sinar matahari. Salah satu contohnya adalah N. gymnamphora yang ditemukan di Gunung Slamet. Beberapa spesies juga tumbuh di tanah (N. rajah dan N. villosa) dan tumbuh memanjat (N. muluensis). N. lamii merupakan spesies langka dan endemik yang tumbuh di Papua
pada ketinggian tempat 3.250 m dpl. 7. Morfologi
Di habitat alaminya kantung semar ada yang tumbuh tegak dan ada juga yang merambat. Tumbuhan ini diklasifikasikan sebagai tumbuhan karnivora dikarenakan terdapat organ berbentuk kantung yang menjulur dari ujung daunnya yang mampu memangsa serangga, yang kemudian organ tersebut dikenal dengan pitcher atau kantung. Selain kemampuannya untuk memangsa serangga, tanaman
ini memiliki keunikan pada bentuk, ukuran, warna, dan corak pada kantungnya (Azwar et al., 2007). Namun warna dan corak kantung tidak digunakan untuk membedakan spesies kantung semar, klasifikasi spesies dilihat dari perbedaan bentuk kantung, daun, batang, dan bunga (Handoyo dan Sitanggang, 2006).
a. Batang
Batang pada kantung semar yang merambat menyerupai batang pada tanaman anggur dan vanili. Batang tersebut akan memanjat pada tanaman dan semak perdu yang tumbuh di sekitarnya. Batang umumnya berwarna hijau, terkadang juga berwarna ungu tua atau merah tua. Pada beberapa spesies tumbuh batang roset yang letaknya pada pangkal batang tertua. Batang tersebut memiliki ketebalan 0 - 3 mm.
berbentuk segi empat seperti pada N. spathulata; dan bersudut seperti pada N. adrianii.
b. Daun
Warna daun kantung semar umumnya hijau atau hijau kekuningan, namun terkadang daun berwarna merah tua hingga keunguan. Daun muncul di ruas-ruas batang dan di ujung daun akan muncul sulur panjang yang tipis. Sulur tersebut menjadi penopang ketika tanaman kantung semar merambat ke pohon lain, dan dari ujung sulur tersebut yang kemudian akan muncul kantung.
c. Kantung
Kantung semar memiliki kantung yang berbeda-beda tiap spesiesnya, dan terkadang dapat digunakan untuk mengklasifikasikan antar spesies. Kantung pada nepenthes memiliki warna dan corak yang berbeda-beda, diantaranya: kuning, hijau, merah, cokelat, hitam, merah kecokelatan, hijau semburat merah, dan lain sebagainya. Namun perbedaan warna dan corak ini tidak dapat dijadikan dasar untuk mengklasifikasikan spesies kantung semar.
Berdasarkan bentuk kantungnya, kantung semar memiliki 6 bentuk kantung, diantaranya: berbentuk silinder memanjang; bulat memanjang; bundar; bulat telur; berbentuk kendi; dan berbentuk corong. Pada awal pembentukan, kantung tertutup oleh penutup yang juga bervariasi bentuknya: bundar, lonjong, bulat telur, silinder, segitiga, dan berbentuk taji.
Dilihat dari letaknya, kantung dibedakan menjadi kantung bawah dan kantung atas. Kantung bawah atau disebut juga dengan roset, biasanya memiliki mulut kantung yang lebar. Kantung roset muncul pada tanaman yang masih muda atau tumbuhan yang sudah dipangkas sehingga merangsang pamunculan daun roset. Sayap pada bagian depan kantung sudah berkembang baik dengan tampilan rambut tipis sepanjang tepinya.
Kantung atas pada kantung semar berbentuk cenderung seperti corong dibandingkan dengan kantung bawah. Sayapnya menjadi dua tulang daun tipis dengan sedikit rambut di pinggirnya. Kantung atas juga menyimpan cairan nektar yang lebih sedikit dibandingkan kantung bawah sehingga lebih ringan.
peralihan merupakan peralihan dari bentuk kantung atas dan kantung bawah, memiliki sayap tetapi tipe corong belum seperti kantung bawah, melainkan sudah lebih menyerupai corong pada kantung atas.
d. Bunga
Bunga kantung semar muncul sekali atau dua kali setahun, atau bahkan terus menerus. Satu tanaman menghasilkan bunga jantan atau betina yang muncul di dekat puncak batang utama. Bakal bunga jantan saat belum mekar berbentuk bulat tanpa ada belimbingan. Sedangkan bunga betina memiliki belimbingan (lekukan seperti buah belimbing) di bakal bunganya.
8. N. alata
Jenis kantung semar ini berasal dari Filipina dan tersebar di Kalimantan Barat, Semenanjung Malaysia, Malaysia, dan Sumatera. N. alata (Gambar 2) memiliki ciri-ciri batang dan tulang daun berwarna gelap sampai hitam dan ujung daun lancip. Kantung bawah berbentuk corong, menyempit di bagian tengah, memiliki dua sayap, biasanya berwarna cemerlang, dan bisa mencapai diameter 20 cm. Kantung atas lubangnya lebih sempit dengan warna lebih pucat.
N. alata ini merupakan jenis yang mudah dipelihara dan toleran terhadap
perubahan suhu dan kelembaban, sangat adaptif, tumbuh dari dataran rendah sampai dataran tinggi sehingga menjadi jenis populer yang banyak dipelihara.
Gambar 2Nepenthes alata
B. Kultur Jaringan
totipotensi. Konsep kultur in-vitro mengacu pada kemampuan totipotensi tersebut, yaitu menumbuhkan jasad multiselular dalam medium padat maupun cair dengan menggunakan jaringan atau sel yang diambil dari bagian tubuh spesies tersebut. Teknik kultur in-vitro menggunakan media bukan tanah, melainkan media buatan di dalam tabung. Teknik in-vitro yang menggunakan bahan awal perbanyakan biasanya berupa jaringan tubuh tumbuhan yang kemudian disebut dengan kultur jaringan.
Wetherell (1982) mengelompokkan langkah-langkah kultur in-vitro menjadi tiga tahap. Tahap I merupakan tahap persiapan eksplan. Eksplan disuci-hamakan dan dibebaskan dari mikroorganisme untuk selanjutnya dapat ditanam secara aseptik dalam media kultur. Tahap II adalah inisiasi, yaitu untuk melipatgandakan hasil pertumbuhan (propagul) dari tahap I dengan meningkatkan jumlah cabang asiler atau pembentukan tunas-tunas baru. Hasil pertumbuhan pada tahap II ditanam kembali, sehingga diperoleh jumlah propagul yang lebih besar. Tahap III merupakan tahap penyesuaian atau tahap pra-tanam, dengan merangsang pembentukan akar agar menjadi tanaman yang lebih kuat.
Menurut Yuwono (2008), teknik in-vitro terdapat beberapa tahapan utama yang harus dilakukan untuk mengembangkan bahan awal tanaman sampai menjadi tanaman yang lengkap dan siap dipindah ke medium tanah, yaitu: (1) pemilihan sumber tanaman yang akan digunakan sebagai bahan awal, (2) penanaman pada medium yang sesuai sampai terjadi perbanyakan, (3) pembentukan tunas dan akar sampai berbentuk plantlet, (4) aklimatisasi atau proses adaptasi pada lingkungan di luar sistem in-vitro, dan (5) penanaman pada medium tanah.
Komponen utama yang dibutuhkan dalam kultur in-vitro tanaman, yaitu bahan awal (starting materials), medium yang sesuai, dan tempat kultivasi. Bahan awal yang dapat digunakan dalam kultur in-vitro ini bermacam-macam, antara lain: batang, daun, akar, tunas apikal dan axilari, anther, pollen, dan lain-lain. Bagian tumbuhan tersebut yang digunakan sebagai bahan awal perbanyakan kultur in-vitro disebut dengan eksplan (explants). Bahan yang digunakan sebagai eksplan sebaiknya berasal dari bagian tumbuhan yang masih muda dan sehat.
medium cair biasanya digunakan untuk kultur sel. Medium yang digunakan mengandung lima komponen utama, yaitu senyawa anorganik, sumber karbon (biasanya sukrosa), vitamin, zat pengatur tumbuh (auksin dan sitokinin), dan suplemen organik.
Sub kultur adalah pemindahan tanaman in-vitro kedalam media baru sehingga kebutuhan nutrisi untuk pertumbuhan kalus, protokormus, organ-organ dapat terpenuhi (Hendaryono dan Wijayanti, 1994). Kegiatan pemindahan/transplan dilakukan dalam transport box dan dengan prosedur aseptik yang sama dengan penanaman. Kultur yang ingin ditumbuhkan menjadi tanaman lengkap sebaiknya dipindahkan ke media padat dengan komposisi dasar yang sama dengan dilakukan modifikasi media, penambahan zat pengatur tumbuh atau pesenyawaan organik.
Pertumbuhan dan morfogenesis tanaman pada kultur in-vitro dipengaruhi oleh empat faktor, yaitu: (1) genotip dari sumber bahan tanaman yang digunakan; (2) media yang digunakan, mencakup komponen penyusun media dan penggunaan zat pengatur tumbuh; (3) lingkungan tumbuh, yaitu keadaan fisik tempat kultur ditumbuhkan; dan (4) fisiologi jaringan yang digunakan sebagai eksplan (Wattimena et al., 1992).
C. Zat Pengatur Tumbuh (ZPT)
Zat pengatur tumbuh (ZPT) merupakan senyawa alami yang diproduksi oleh tumbuhan. Arteca (1996) dalam Harjadi (2009) menyebutkan bahwa zat pengatur tumbuh (ZPT) merupakan senyawa yang dikarakterisasi secara kimiawi yang menunjukkan aktivitas biologi spesifik walaupun dalam jumlah konsentrasi yang sangat rendah. Fungsi ZPT sangat bergantung pada dosis yang diberikan dan berdasarkan pada perubahan kepekaan jaringannya. Zat pengatur tumbuh mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen menentukan arah perkembangan suatu kultur.
in-vitro dua golongan zat pengatur tumbuh yang sangat penting dan sering digunakan
adalah sitokinin dan auksin.
Auksin merupakan suatu kelompok senyawa yang mampu merangsang pemanjangan sel pucuk di daerah sub apikal. Auksin biasanya merupakan asam dengan inti tidak jenuh atau derivatnya. Menurut Santoso dan Nursandi (2003), auksin juga mempunyai kemampuan untuk menginduksi terjadinya kalus, mendorong terjadinya proses morfogenesis kalus atau tunas, mendorong embriogenesis dan mempengaruhi kestabilan genetik sel tanaman.
Sitokinin merupakan senyawa yang berfungsi untuk meningkatkan pembelahan sel dan pengaturan pertumbuhan. Sitokinin banyak ditemukan dalam tumbuhan, paling banyak ditemukan pada daerah meristem dan daerah dengan potensi tumbuh berkesinambungan termasuk akar, daun muda, buah yang berkembang, dan biji. Perannya dalam tumbuhan antara lain adalah untuk mengatur pembelahan sel, pembentukan organ, pembesaran sel dan organ, pencegahan kerusakan klorofil, pembentukan kloroplas, pembukaan dan penutupan stomata, dan perkembangan mata tunas dan pucuk (Harjadi, 2009).
Santoso dan Nursandi (2003) menyatakan bahwa peran zat pengatur tumbuh sitokinin dalam kegiatan kultur jaringan dapat menstimulir terjadinya pembelahan sel, poliferasi kalus, pembelahan tunas, mendorong poliferasi meristem ujung, menghambat pembentukan akar, dan mendorong pembentukan klorofil pada kalus.
III. METODE PENELITIAN
A. Lokasi dan Waktu
Penelitian teknik kultur jaringan ini dilaksanakan di Laboratorium Konservasi Tumbuhan, Departemen Konservasi Sumberdaya Hutan dam Ekowisata, Fakultas Kehutanan, Institut Pertanian Bogor, dengan rentang waktu lima bulan dimulai pada bulan November 2010 hingga Maret 2011.
B. Alat dan Bahan
1. Alat
Pada teknik kultur jaringan ini akan mempergunakan alat pada saat preparasi media yang terdiri dari: gelas piala, labu ukur, pipet, timbangan analitik, kompor, sudip, autoklaf, dan tabung kultur. Sedangkan alat pada waktu penanaman di ruang isolasi terdiri dari: Laminar Cabinet Air Flow, api bunsen, pinset, pisau scalpel/pisau steril, dan cawan petri.
2. Bahan
Bahan-bahan yang digunakan untuk membuat media kultur antara lain: air mineral, agar-agar, gula, hormon BAP, dan larutan MS (Murashige & Skoog). Sedangkan bahan yang digunakan pada saat sterilisasi yaitu, alkohol 70%, obat antiseptik, klorox, deterjen, dan aquades.
Bahan tanaman yang digunakan adalah mata tunas hasil induksi tumbuhan kantung semar (N. alata).
C. Prosedur Kerja
1. Sterilisasi
a. Sterilisasi Alat
dengan cara dicelupkan ke dalam alkohol 96% kemudian dibakar dengan api
Sterilisasi dilakukan terhadapa ruangan kerja, terutama pada ruangan kultur (inisiasi) dan ruangan inkubasi (termostatik). Sterilisasi pada ruang inkubasi dilakukan dengan menggunakan disinfektan, sedangkan sterilisasi ruang kultur terutama pada laminar air flow cabinet dengan menggunakan alcohol 96% dan sinar ultra violet setiap selesai penggunaan.
2. Pembuatan Media
a. Pembuatan Larutan Stok
Pembuatan larutan stok berdasarkan pengelompokan yaitu larutan stok makro, stok mikro, stok Fe-EDTA, stok vitamin, dan stok hormon (BAP). Pembuatan larutan stok bertujuan untuk menghemat pekerjaan menimbang bahan yang berulang-ulang setiap kali membuat media. Komposisi larutan stok yang digunakan disajikan pada lampiran 1. Unsur hara yang telah ditimbang sesuai berat yang telah ditentukan kemudian dilarutkan dengan aquades sebanyak 1 liter. Larutan stok kemudian disimpan di dalam lemari es.
b. Pembuatan Media MS
Media MS dibuat dengan mecampurkan bahan MS, gula pasir sebanyak 30 gram, agar-agar sebanyak 6-7 gram, air kelapa sebanyak 150 ml, kemudian dilarutkan dan di encerkan dengan air mineral hingga volume mencapai 1 liter.
c. Pembuatan Media Perlakuan
Setelah larutan media MS ditambahkan ZPT, larutan tersebut kemudian diukur nilai keasamannya dengan kertas pH. Nilai pH media yang digunakan dalam kultur jaringan berkisar antara 5,6-5,8, bila larutan >5,8 ditambahkan HCl 0,1 N dan bila larutan <5,6 ditambahkan KOH 0,1 N, kemudian larutan ditambahkan agar-agar sebanyak 7 gram/l dan dimasak di atas kompor hingga mendidih.
Larutan media yang telah mendidih dituang ke dalam setiap botol kultur sebanyak 10 ml, selanjutnya botol ditutup dan diberi label sesuai dengan perlakuan. Botol yang telah berisi media kemudian disterilkan kedalam autoklaf pada tekanan 17,5 psi (1,21 bar) dan suhu 121oC, 10 atm selama 20 menit. Setelah itu diamkan autoklaf dan tunggu suhu turun sampai 80oC.
3. Penanaman
Eksplan yang digunakan berasal dari induksi tanaman nepenthes. Sebelum dilakukan sub kultur pada media multiplikasi, terlebih dahulu dilakukan sub kultur pada media MS 0 selama 4 minggu. Hal ini bertujuan untuk menetralkan pengaruh perlakuan pada tahap awal dan multiplikasi.
Setelah itu eksplan ditanam pada media sesuai perlakuan, masing-masing 1-2 eksplan per tabung. Bahan tanaman yang digunakan adalah pucuk eksplan dengan meninggalkan 3 daun paling atas.
D. Metode Pengumpulan Data
Parameter yang diamati meliputi parameter kuantitatif dan kualitatif yang dilakukan pada setiap pengamatan. Adapun parameter kuantitatif meliputi:
1. Tinggi plantlet
Pengukuran dilakukan dengan cara mengukur dari pangkal batang sampai titik tumbuh tertinggi.
2. Jumlah buku
Pengukuran dilakukan dengan menghitung buku tanaman. 3. Jumlah tunas baru
4. Jumlah daun
Daun yang dihitung adalah daun yang baru tumbuh.
Parameter kualitatif dilakukan dengan mendeskripsikan kondisi tanaman pada parameter kuantitatif yang meliputi:
1. Pengakaran (berakar/tidak) 2. Pengkalusan (berkalus/tidak)
3. Kontaminasi oleh jamur dan bakteri, browning, dan kematian.
Pengamatan dilakukan selama 12 minggu dan pengambilan data dilakukan setiap satu minggu sekali. Pengukuran dilakukan dengan menggunakan mistar dari luar tabung kultur.
E. Metode Analisis Data
Perhitungan parameter kualitatif meliputi presentase kontaminasi oleh jamur dan bakteri, browning (pencoklatan), dan kematian pada eksplan dengan menggunakan rumus sebagai berikut:
% Tingkat kontaminasi = Σ eksplan terkontaminasi x 100% N
% Tingkat pencoklatan = Σ eksplan mengalami pencoklatan x 100% N
% Tingkat kematian = Σ eksplan mengalami kematian x 100% N
% Tingkat keberhasilan = Σ eksplan yang bertunas x 100% N
Keterangan : N = jumlah total eksplan yang tersedia tiap perlakuan
Rancangan percobaan yang digunakan dalam menganalisis hasil penelitian adalah Rancangan Faktorial dengan Acak Lengkap (RAL-F) dengan jumlah 16 perlakuan dengan masing-masing ulangan sebanyak 10 kali, sehingga total plantlet yang diamati sebanyak 160 satuan percobaan.
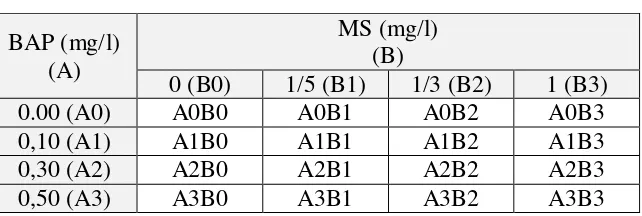
Tabel 1 Media perlakuan kombinasi BAP dan MS
Model rancangan yang digunakan adalah sebagai berikut:
Y
ijk =µ
+ Ai + Bj + (AB)ij + EijkKeterangan:
Yijk = Nilai respon tanaman terhadap perlakuan BAP ke-i, MS ke-j, dan
ulangan ke-k.
µ
= Nilai tengah populasiAi = Pengaruh perlakuan BAP ke-i
B
j = Pengaruh perlakuan MS ke-j(AB)ij = Pengaruh interaksi antara perlakuan BAP ke-i dan MS ke-j. Eijk = Nilai galat percobaan pada perlakuan BAP ke-i, MS ke-j, dan
ulangan ke-k.
Analisis data dilakukan dengan menggunakan Daftar Sidik Ragam. Hipotesis dalam uji F:
Ho = Perlakuan tidak berpengaruh terhadap pertumbuhan tinggi, jumlah ruas, jumlah tunas, dan jumlah daun.
Hi = Perlakuan berpengaruh terhadap pertumbuhan tinggi, jumlah ruas, jumlah tunas, dan jumlah daun.
F hitung < F tabel maka terima Ho.
IV. HASIL DAN PEMBAHASAN
A. Pertumbuhan
Pertumbuhan tunas nepenthes secara in-vitro membutuhkan waktu rata-rata tiga minggu setelah tanam (MST). Tunas yang tumbuh merupakan tunas lateral yaitu tunas yang muncul pada ketiak daun (buku). Dari total 160 percobaan hanya sebanyak 66 eksplan yang hidup atau sebesar 40,63% (Lampiran 7), hal ini dikarenakan eksplan banyak mengalami kematian yang disebabkan oleh pencoklatan (browning) dan kontaminasi oleh cendawan.
Berikut merupakan hasil pengaruh dari penggunaan media MS dan pemberian hormon BAP serta interaksi keduanya terhadap pertumbuhan tanaman kantung semar.
1. Pengaruh Interaksi Media MS dan Hormon BAP terhadap Pertumbuhan Tumbuhan N. alata
Interaksi penggunaan media MS dan hormon BAP dengan konsentrasi yang berbeda memberikan pengaruh yang berbeda terhadap multiplikasi tunas, tinggi tunas, jumlah buku, dan jumlah daun tanaman kantung semar, akan tetapi interaksi media MS dan hormon BAP tidak memberikan pengaruh yang nyata.
Jumlah tunas paling banyak dihasilkan pada perlakuan A3B2 (0,5 ml/l BAP, 1/3 MS) dengan jumlah tunas rata-rata sebanyak 5,50 buah. Pada perlakuan A2B2 (0,3 ml/l BAP, 1/3 MS) jumlah tunas yang tumbuh tidak berbeda banyak yaitu rata-rata sebanyak 5,25 buah, sedangkan pada perlakuan A1B2 (0,1 ml/l BAP, 1/3 MS) dan A0B2 (0 BAP, 1/3 MS) jumlah tunas yang tumbuh rata-rata sebanyak 4,33 dan 4,20 buah (Tabel 2).
alata. Hal ini sesuai dengan penelitian Harahap (2010) yang menunjukkan bahwa
semakin tinggi konsentrasi BAP yang diberikan akan meningkatkan pertambahan jumlah tunas pada tanaman Nepenthes gracilis. Salisbury dan Ross (1995) menyatakan bahwa sitokinin meningkatkan sitokinesis maupun pembesaran sel, terutama pembelahan sel.
Pada pertumbuhan tinggi tunas, paling tinggi ditunjukkan oleh media 1/5 MS tanpa hormon BAP (A0B2) dengan rataan tinggi sebesar 0,94 cm, sedangkan yang terendah ditunjukkan oleh media tanpa MS dengan kandungan BAP 0,3 mg/l (A2B0) dengan rataan tinggi sebesar 0,50 cm (Tabel 3). Salisbury dan Ross (1995) menyatakan bahwa sitokinin meningkatkan sitokinesis, tetapi sitokinesis yang terjadi tidak meningkatkan pertumbuhan organnya sendiri melainkan hanya merupakan proses pembelahan saja sehingga pemberian BAP tidak berpengaruh terhadap pertumbuhan tinggi eksplan. Harahap (2010) menyebutkan bahwa pemberian BAP tidak berpengaruh nyata terhadap panjang/tinggi tunas N. gracilis.
Tabel 3 Pengaruh konsentrasi MS dan BAP terhadap tinggi tunas tumbuhan N. alata (cm).
Perlakuan B0 B1 B2 B3
A0 0,70 0,87 0,94 0,83
A1 0,68 0,65 0,87 0,65
A2 0,50 0,68 0,73 0,60
A3 0,55 0,84 0,67 0,55
Tabel 4 Pengaruh konsentrasi MS dan BAP terhadap jumlah buku tumbuhan N. alata (buah).
Perlakuan B0 B1 B2 B3
A0 1,83 2,83 1,80 1,75
A1 3,00 2,00 2,00 2,00
A2 2,00 2,61 2,33 2,00
A3 1,50 2,20 2,50 3,00
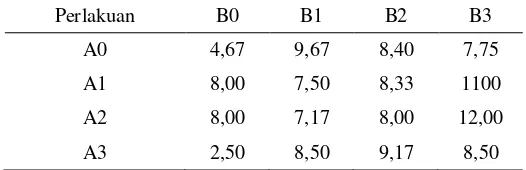
Tabel 5 Pengaruh konsentrasi MS dan BAP terhadap jumlah daun tumbuhan N. alata (helai).
Perlakuan B0 B1 B2 B3
A0 4,67 9,67 8,40 7,75
A1 8,00 7,50 8,33 1100
A2 8,00 7,17 8,00 12,00
A3 2,50 8,50 9,17 8,50
Secara visual pertumbuhan eksplan yang terbaik ditunjukkan pada perlakuan A1B2. Hal ini dapat dilihat dari eksplan yang tumbuh sehat dengan menghasilkan banyak daun, berwarna hijau tua, kekar, dan membentuk banyak kantung (Gambar 3), kemudian diikuti oleh pertumbuhan pada perlakuan A0B2 dengan jumlah kantung lebih sedikit. Pada perlakuan A2B2 eksplan tumbuh dengan ukuran kantung lebih kecil, sedangkan pada perlakuan A3B2 eksplan tumbuh dengan daun yang lebih pendek dan jumlah kantung sedikit (Lampiran 11).
Gambar 3 Pertumbuhan eksplan pada perlakuan A1B2.
2. Pengaruh Media MS terhadap Pertumbuhan Tumbuhan N. alata
sedikit ditunjukkan oleh media tanpa MS (B0) dengan jumlah tunas rata-rata 2,80 buah.
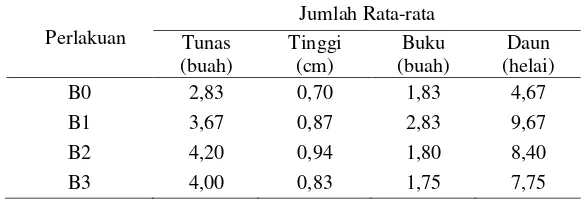
Tabel 6 Rekapitulasi pengaruh media MS terhadap jumlah tunas, tinggi tunas, jumlah buku dan daun N. alata.
Perlakuan
Pada pertumbuhan tinggi tunas N. alata, pertumbuhan paling tinggi ditunjukkan pada media 1/3 MS (B2) dengan tinggi rata-rata 0,94 cm, diikuti pada media 1/5 MS (B1) dengan 0,87 cm dan 1 MS (B3) dengan 0,83 cm, sedangkan yang terendah ditunjukkan pada media tanpa MS (B0) dengan tinggi 0,70 cm.
Jumlah buku paling banyak ditunjukkan oleh media B1 dengan jumlah rata 2,83 buah, kemudian secara berurutan diikuti oleh media B0 dengan jumlah rata-rata 1,83 buah, B2 dengan 1,80 buah, dan terendah ditunjukkan oleh media B3 dengan 1,75 buah; sedangkan pada pertumbuhan jumlah daun paling banyak ditunjukkan oleh media B1 sebanyak 9,67 helai, diikuti oleh media B2 dengan 8,40 helai, B3 dengan 7,75 helai, dan paling sedikit ditunjukkan oleh media B0 dengan 4,67 helai.
Berdasarkan analisis sidik ragam menunjukkan bahwa penggunaan media MS dengan komposisi yang berbeda memberikan pengaruh yang nyata terhadap multipikasi tunas dan tinggi tunas tumbuhan N. alata. (Tabel 7).
Tabel 7 Rekapitulasi sidik ragam media MS terhadap jumlah tunas, tinggi tunas, jumlah buku dan daun N. alata.
Perlakuan Tunas
Keterangan: * : Berpengaruh nyata
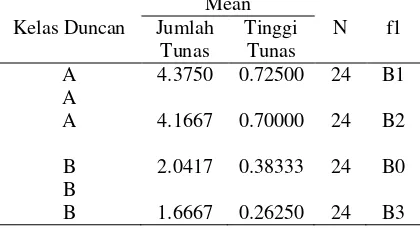
Tabel 8 Rekapitulasi hasil uji wilayah Duncan penggunaan media MS terhadap jumlah tunas dan tinggi tunas N. alata.
Kelas Duncan
Keterangan: Kelas dengan huruf yang sama menunjukkan tidak berbeda nyata.
Dari data Tabel 8 dapat dilihat bahwa kecenderungan multiplikasi tunas dan pertumbuhan tinggi tunas tumbuhan N. alata terjadi pada media yang tidak terlalu kaya nutrisi tetapi juga tidak pada yang miskin nutrisi, akan tetapi antara keduanya yaitu pada media B2 (1/3 MS). Pada media B1 (1/5 MS) dengan kandungan nutrisi lebih sederhana, jumlah dan tinggi tunas tumbuhan kantung semar mulai mengalami penurunan karena meskipun tumbuhan kantung semar sering ditemukan pada tanah yang miskin hara namun masih membutuhkan komposisi yang cukup untuk ditumbuhkan secara in-vitro (Isnaini dan Handini, 2007). Sementara pada media yang kaya nutrisi (1 MS) jumlah dan tinggi tunas tumbuhan N. alata juga mengalami penurunan. Hal ini dikarenakan karakteristik tumbuhan N. alata yang tidak menyukai tempat tumbuh dengan unsur hara/nutrisi yang terlalu banyak, namun tanaman ini lebih sering ditemukan tumbuh pada tanah yang miskin unsur hara seperti hutan kerangas dan tanah gambut. Isnaini dan Handini (2007) menyebutkan bahwa perkecambahan biji nepenthes lebih baik terjadi pada media yang tidak terlalu kaya nutrisi. Mariska et al. (1998) dalam Isnaini dan Handini (2007) menyebutkan bahwa perkecambahan biji panili hasil persilangan terjadi pada media yang lebih sederhana. Pertambahan jumlah buku dan jumlah daun tumbhan N. alata paling banyak ditunjukkan pada media yang lebih sedikit unsur haranya yaitu 1/5 MS. Hasil analisis sidik ragam penggunaan media MS terhadap jumlah buku dan daun tumbuhan N. alata menunjukkan pengaruh dengan beda yang nyata (Tabel 7), dimana berdasarkan
pada pertambahan jumlah daun beda yang nyata ditunjukkan pada media B1 terhadap media B0 dan B3, tetapi tidak beda nyata terhadap media B2 (Lampiran 6).
Tabel 9 Hasil uji wilayah Duncan penggunaan media MS terhadap jumlah buku tumbuhan N. alata.
Kelas Duncan Mean N f1
A 2.3333 24 B1
A
B A 1.7917 24 B2
B
B C 1.2917 24 B0
C
C 0.7083 24 B3
Keterangan: Kelas dengan huruf yang sama menunjukkan tidak berbeda nyata.
Pertambahan jumlah buku dan daun tumbuhan N. alata paling banyak terjadi pada media yang lebih sederhana. Hal ini diduga karena pada media yang lebih sederhana dapat memicu pertumbuhan jumlah daun dan buku pada tumbuhan N. alata yang merupakan awal dari terbentuknya kantung yang berfungsi sebagai
penangkap unsur hara tambahan.
Gambar 4 Pertumbuhan N. alata pada media (a) 0 MS (B0), (b) 1/5 MS (B1), (c) 1/3 MS (B2), dan (d) 1 MS (B3).
Dari hasil deskripsi secara visual di atas, diketahui bahwa pertumbuhan terbaik terjadi pada media 1/3 MS (B2). Hal ini semakin memperkuat dugaan bahwa tumbuhan N. alata tumbuh dengan baik pada media yang sederhana. Akan tetapi walau tumbuhan N. alata tumbuh baik pada tanah yang miskin hara tetapi masih tetap membutuhkan nutrisi untuk dapat tumbuh. Hal ini terbukti pada media 1/5 MS dengan unsur hara yang lebih sedikit dari 1/3 MS, tumbuhan N. alata mulai menunjukkan pertumbuhan yang kurang optimal seperti jumlah daun yang sedikit dan lebar daun yang menyempit. Latha dan Seeni (1994) dalam Isnaini dan Handini (2007) menyatakan bahwa Nepenthes khasiana tumbuh dengan lebih baik pada media dasar MS daripada media KC, karena komposisi media KC jauh lebih sederhana dibandingkan dengan media MS.
Berdasarkan jumlah dan besarnya ukuran kantung, diketahui bahwa semakin sederhana/miskin kandungan hara pada media akan memicu kemungkinan pembentukan kantung yang lebih banyak serta ukuran yang lebih besar (Gambar 4). Hal ini disebabkan karena kantung pada tanaman kantung semar merupakan modifikasi dari daun yang berfungsi untuk menangkap serangga kecil yang kemudian akan dicerna di dalam kantung dengan bantuan enzim protease dan merubahnya menjadi asam-asam amino lalu diserap untuk mendapatkan tambahan nutrisi pada tanah yang miskin akan hara.
a b
3. Pengaruh Hormon BAP terhadap Pertumbuhan Tumbuhan N. alata
Pemberian hormon BAP tidak berpengaruh nyata terhadap multiplikasi tunas tumbuhan N. Alata (Tabel 11). Multiplikasi tunas paling banyak ditunjukkan pada konsentrasi BAP 0,1 ml/l (A1) dengan jumlah tunas sebanyak 4,20 buah, diikuti pada konsentrasi BAP 0,3 ml/l (A2) sebanyak 4,00 buah dan 0,5 ml/l (A3) sebanyak 3,50 buah, sedangkan jumlah tunas paling sedikit dihasilkan pada kontrol (A0) sebanyak 2,80 buah (Tabel 10).
Tabel 10 Rekapitulasi pengaruh hormon BAP terhadap jumlah tunas, tinggi tunas, jumlah buku dan daun tumbuhan N. alata.
Perlakuan
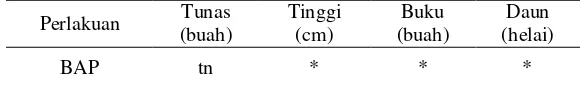
Pada pertumbuhan tinggi tunas tumbuhan N. alata, pertumbuhan paling tinggi ditunjukkan oleh kontrol (A0) dengan tinggi rata-rata 0,7 cm, diikuti pada perlakuan A1 dengan 0,68 cm, kemudian pada perlakuan A3 dengan 0,55 cm, dan paling rendah ditunjukkan pada perlakuan A2 dengan tinggi 0,50 cm. Berdasarkan analisis sidik ragam pemberian hormon BAP berpengaruh nyata terhadap pertumbuhan tinggi tumbuhan N. Alata (Tabel 11).
Tabel 11 Rekapitulasi sidik ragam media MS terhadap jumlah tunas, tinggi tunas, jumlah buku dan daun N. alata.
Perlakuan Tunas
Tabel 12 Hasil uji wilayah Duncan pemberian hormon BAP terhadap tinggi tunas tumbuhan N. alata.
Kelas Duncan Mean N f1
Keterangan: Kelas dengan huruf yang sama menunjukkan tidak berbeda nyata.
Jumlah buku yang muncul pada eksplan setelah 12 MST paling banyak ditunjukkan pada perlakuan A1 sebanyak 3,00 buah, kemudian secara berurutan diikuti pada perlakuan A2 sebanyak 2,00 buah, kontrol (A0) sebanyak 1,83 buah, dan A3 sebanyak 1,50 buah. Sedangkan pertumbuhan jumlah daun paling banyak ditunjukkan oleh perlakuan A1 dan A2 sebanyak 8,00 helai, diikuti oleh kontrol (A0) dengan 4,67 helai, dan paling sedikit ditunjukkan oleh perlakuan A3 dengan 2,50 helai.
Hasil analisis sidik ragam penggunaan hormon BAP menunjukkan pengaruh yang nyata terhadap pertambahan jumlah buku dan daun tumbuhan N. alata. Berdasar uji lanjut wilayah Duncan, beda yang nyata ditunjukkan pada perlakuan A0 (tanpa hormon BAP) terhadap perlakuan lainnya dengan penambahan hormon BAP (Tabel 13).
Tabel 13 Rekapitulasi hasil uji wilayah Duncan pemberian hormon BAP terhadap jumlah buku dan daun tumbuhan N. alata.
Kelas Duncan
Keterangan: Kelas dengan huruf yang sama menunjukkan tidak berbeda nyata.
menyebutkan bahwa penambahan sitokinin ke dalam media induksi tunas lebih efektif dalam konsentrasi tinggi.
Hal tersebut mungkin saja terjadi karena kemampuan genetik setiap tanaman memberikan respon yang berbeda-beda terhadap zat pengatur tumbuh yang diberikan, dan kemampuan metabolisme tanaman sangat tergantung pada kemampuan genetik tanaman (faktor endogen). Ada pula beberapa tanaman yang tidak akan berespon terhadap zat pengatur tumbuh yang diberikan (faktor eksogen) (Wattimena et al., 1991).
Pada penampakan secara visual, tanaman kantung semar pada perlakuan A1 tumbuh dengan warna hijau muda, memunculkan banyak daun (8,00 helai) dan membentuk kantung tiap ujung daunnya (Gambar 5). Pada perlakuan A3, tanaman nepenthes terlihat tumbuh dengan warna hijau pucat, jumlah daun sedikit (2,50 helai)
dan membentuk kantung pada ujungnya. Pada perlakuan ini, tanaman terlihat kurang sehat yang ditunjukkan dengan adanya beberapa helai daun yang berwarna pucat dan mengalami kematian.
Gambar 5 Perumbuhan nepenthes pada konsentrasi BAP 0,1 ml/l (A1).
Pada perlakuan A2, tumbuhan N. alata terlihat tumbuh dengan warna daun yang pucat, membentuk daun dengan ukuran kecil dan sedikit membentuk kantung; sedangkan pada kontrol (A0), tumbuhan N. alata tumbuh dengan warna daun yang pucat, dan membentuk daun serta kantung dengan ukuran yang relatif besar (Lampiran 11). Pada perlakuan kontrol ini juga ditemukan tanaman dengan beberapa daun yang mengalami kematian yang diduga keracunan dari media dan pemberian hormon yang tidak sesuai.
digunakan berasal dari bagian bawah batang tanaman yang sudah tua sehingga memicu pertumbuhan akar lebih cepat. Sedangkan pengkalusan ditemukan sebanyak 1 buah pada perlakuan A2B1 yang diduga disebabkan karena tubuh eksplan yang mengalami luka atau memar pada saat pemotongan (Gambar 6).
Gambar 6 Pengkalusan pada N. alata.
B. Kematian
Secara keseluruhan total jumlah eksplan yang mati sebesar 59,37% (Lampiran 8). Kematian yang terjadi pada eksplan disebabkan oleh 2 hal, yaitu karena pencoklatan (browning) dan kontaminasi oleh cendawan. Eksplan yang terserang browning (pencoklatan) serta sulitnya mendapatkan eksplan dalam kondisi yang steril (kontaminasi) merupakan kendala utaman yang sering ditemukan pada teknik kultur jaringan.
1. Browning (Pencoklatan)
Gambar 7 Gejala awal pencoklatan pada tumbuhan N. alata.
Kematian yang terjadi pada eksplan diduga dikarenakan kecilnya ukuran eksplan yang menyebabkan berkurangnya daya tahan sehingga eksplan tidak dapat bertahan hidup saat senyawa fenolik terbentuk. Wattimena et al. (1992) menyebutkan bahwa daya tahan eksplan akan berkurang saat dikulturkan jika ukurannya terlalu kecil.
Pencoklatan yang terjadi tidak selalu mengakibatkan kematian pada tanaman. Beberapa eksplan ditemukan masih dapat bertahan setelah ditemukan terserang pencoklatan, hal ini diduga pencoklatan yang terjadi hanya menghambat pertumbuhan tunas seperti yang terlihat pada Gambar 8. Tunas baru muncul pada 6-9 MST atau bahkan lebih lama dari itu. Pembentukan senyawa fenolik yang berkumpul di sekitar jaringan yang luka atau rusak pada proses pencoklatan hanya menghambat pembelahan sel, perkembangan sel, dan perkembangan jaringan dan organ.
Gambar 8 Tunas tumbuh pada tumbuhan N. alata yang terserang pencoklatan.
2. Kontaminasi
Kontaminasi merupakan gangguan yang sering ditemukan dalam kultur jaringan. Kontaminasi dapat disebabkan oleh beberapa hal diantaranya adalah bakteri, cendawan, ragi, dan virus (Evans et al., 2003). Kontaminasi yang muncul pada eksplan didominasi disebabkan oleh cendawan.
Kontaminasi yang muncul umumnya berasal dari badan eksplan yang dapat dilihat dari munculnya cendawan yang bermula dan berkumpul dari sekitar eksplan (Gambar 9). Hal ini memunculkan dugaan bahwa kontaminasi yang terjadi berupa kontaminasi sistemik yang berasal dari dalam tubuh tanaman yang masih menyisakan bakteri internal yang belum mati sepenuhnya saat sterilisasi pertama pada proses inisiasi, akan tetapi hanya bersifat dorman dan kemudian aktif kembali saat proses sub-kultur dilakukan.
Dugaan lainnya dapat disebabkan oleh masuknya kontaminan yang terbawa oleh udara atau pada alat saat melakukan proses pemotongan yang dikarenakan kondisi laboratorium tempat penanaman dan penyimpanan hasil kultur yang masih belum cukup memadai. Total jumlah eksplan yang mati disebabkan oleh kontaminasi sebesar 29,37% (Lampiran 10).
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Dari hasil penelitian ini dapat disimpulkan bahwa kombinasi terbaik media MS dengan hormon BAP terhadap multiplikasi tunas N. alata ditunjukkan pada perlakuan A3B2 (0,5 ml/l BAP, 1/3 MS) sebanyak 5,50 tunas, sedangkan untuk pertumbuhan secara visual paling baik ditunjukkan pada perlakuan A1B2 (0,1 ml/l BAP, 1/3 MS).
Penggunaan media yang terbaik untuk multiplikasi tunas N. alata secara in-vitro adalah pada media 1/3 MS (B2) sebanyak 4,20 tunas, dan secara visual media
1/3 MS juga menunjukkan pertumbuhan yang paling baik terhadap tumbuhan kantung semar; sedangkan pemberian hormon BAP terhadap multiplikasi tunas Nepenthes alata paling baik ditunjukkan pada konsentrasi 0,1 ml/l (A1) sebanyak
4,20 tunas, dan secara visual perlakuan ini menunjukkan pertumbuhan paling baik terhadap tumbuhan kantung semar.
Kematian pada eksplan disebabkan oleh kontaminasi cendawan dan pencoklatan (browning) dengan total sebesar 59,37%. Tingginya tingkat pencoklatan yang menyerang eksplan (30%) memunculkan dugaan bahwa pada tanaman N. alata memiliki tingkat pencoklatan yang tinggi yang bearasal dari sistem internal tumbuhan, namun hal ini masih memerlukan penelitian lebih lanjut. Kontaminasi yang terjadi berupa kontaminasi sistemik internal dan karena kondisi laboratotium yang kurang memadai.
B. Saran
Berikut ini merupakan saran yang diberikan:
1. Perlu dilakukan penelitian dengan menggunakan konsentrasi BAP yang lebih besar serta kombinasi dengan auksin.
3. Perlu dilakukan penelitian hingga ke tahapan aklimatisasi dan penanaman di media tanah untuk mendapatkan bibit tanaman yang merupakan parameter utama keberhasilan dari teknik kultur jaringan secara keseluruhan.
4. Penelitian tentang penyebab kematian tumbuhan nepenthes secara in-vitro, baik karena kontaminasi cendawan maupun pencoklatan perlu dilakukan untuk mengurangi risiko kematian dan tindakan pencegahan pada penelitian selanjutnya.
DAFTAR PUSTAKA
Azwar F., Kunarso A., Rahman T. S. 2007. Kantong Semar (Nepenthes sp.) di Hutan Sumatera, Tanaman Unik yang Semakin Langka. Prosiding Ekspose Hasil-hasil Penelitian.
Evans D. E., Coleman J. O. D., Kearns A. 2003. Plant Cell Culture. London: BIOS Scientific Publishers.
Handayani T. 2008. Pitcher Plants (Nepenthes spp.). Eksplorasi Vol. 4 No. 3.
Handoyo F. dan Sitanggang M. 2006. Petunjuk Praktis Perawatan Nepenthes. Depok: Agromedia.
Harahap A. S. 2010. Mikropropogasi Tunas Kantong Semar (Nepenthes gracillis Korth.) dengan Pemberian NAA dan BAP secara In Vitro. Skripsi. Departemen Budidaya Pertanian, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Harjadi S. S. 2009. Zat Pengatur Tumbuh: Pengenalan dan Petunjuk Penggunaan pada Tanaman. Depok: Penebar Swadaya.
Hartmann H. T., Kester D. E., Davies F. T., Geneve R. L. 1997. Plant Propagation. Principles and Practicles. Sixth Edition. Prentice-Hall of India Private Limited. New Delhi.
Hendaryono D. P. S. dan Wijayanti A. 1994. Teknik Kulur Jaringan. Kanisius. Jakarta.
Isnaini Y. dan Handini E.. 2007. Perkecambahan Biji Kantong Semar (Nepenthes gracilis Korth.) secara In Vitro. Buletin Kebun Raya Indonesia Vol. 10 No. 2.
Mansur M. 2006. Nepenthes Kantong Semar Yang Unik. Penebar Swadaya: Jakarta.
Mariska I. dan Sukmadjaya. 2003. Kultur Jaringan Abaka. Balai Besar Penelitian dan Pengembangan Sumberdaya Genetika. Bogor.
Nasir M. 2002. Bioteknologi: Potensi dan Keberhasilannya dalam Bidang Pertanian. Jakarta: Raja Grafindo Persada.
Redaksi Trubus. 2006. Trubus Info Kit Vol. 05: Nepenthes. Depok: Trubus.
Salisbury F. B. dan Ross W. C. 1995. Fisiologi Tumbuhan Jilid Tiga. Penerjemah: Lukman D. R. dan Sumaryono. Penerbit ITB: Bandung.
Wattimena G. A. 1988. Zat Pengatur Tumbuh. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor.
Wattimena G. A., Armini N. M., Gunawan L. W. 1991. Perbanyakan Tanaman Dalam Bioteknologi Tanaman. Pusat Antar Universitas Bioteknologi-IPB. Direktorat Jendral Perguruan Tinggi, Departemen Pendidikan dan Kebudayaan. Bogor.
Wattimena G. A., Matjik N. A., Syansudin E., Wendi N. M. A., Gunawan A. 1992. Bioteknologi Tanaman. Bogor: Laboratorium Kultur Jaringan Tanaman, Pusat Antar Universitas Bioteknologi-IPB. Direktorat Jenderal Pendidikan dan Kebudayaan.
Wetherell D. F. 1982. Pengantar Propagasi Tanaman Secara In Vitro. Semarang: IKIP Semarang press.
Lampiran 1 Komposisi Media MS (Murashige & Skoog)
No. Bahan Kimia Komposisi mg/l Pemipetan untuk 1 liter media
1 MS 1/3 MS 1/5 MS
1 KH2PO4 10 ml 3,3 ml 2 ml
2 MgSO4 10 ml 3,3 ml 2 ml
3 CaCl2 10 ml 3,3 ml 2 ml
4 NH4NO3 10 ml 3,3 ml 2 ml
5 KNO3 10 ml 3,3 ml 2 ml
6 Fe EDTA 5ml 1,7 ml 1 ml
7 Vitamin 5ml 1,7 ml 1 ml
8 Myo Inositol 5ml 1,7 ml 1 ml
9 Gula 30 gr
Lampiran 2 Persentase tumbuhan N. alata yang hidup (%)
Perlakuan
I II III IV V
Ulangan
VI VII VIII IX X Total
Rata-rata (%)
A0B0 v v v v v v * * * * 6,00 60,00
A1B0 v v v v v * * * * * 5,00 50,00
A2B0 v * * * * * * * * * 1,00 10,00
A3B0 v v * * * * * * * * 2,00 20,00
A0B1 v v v v v v * * * * 6,00 60,00
A1B1 v v v v v v * * * * 6,00 60,00
A2B1 v v v v v v * * * * 6,00 60,00
A3B1 v v v v v * * * * * 5,00 50,00
A0B2 v v v v v * * * * * 5,00 50,00
A1B2 v v v v v v * * * * 6,00 60,00
A2B2 * v v v * * * * * * 3,00 30,00
A3B2 v v v v v v * * * * 6,00 60,00
A0B3 v v * * v v * * * * 4,00 40,00
A1B3 v * * * * * * * * * 1,00 10,00
A2B3 v * * * * * * * * * 1,00 10,00
A3B3 v v * * * * * * * * 2,00 20,00
Total 15,00 13,00 10,00 10,00 10,00 7,00 2,00 1,00 * * 65,00
Lampiran 3 Jumlah tunas tumbuhan N. alata (buah)
Keterangan: * = Eksplan tidak tumbuh (mati)
Sumber Keragaman DB JK KT F Hit Pr > F
Model 50 440.4166667 8.8083333 1.86 0.0183
Galat 45 213.2083333 4.7379630
Corrected Tot 95 653.6250000
f1 3 14.5416667 4.8472222 1.02 0.3914
Lampiran 4 Tinggi tunas tumbuhan N. alata (cm)
Keterangan: * = Eksplan tidak tumbuh (mati)
Sumber Keragaman DB JK KT F Hit Pr > F
Model 50 10.89312500 0.21786250 2.29 0.0028
Galat 45 4.28677083 0.09526157
Corrected Tot 95 15.17989583
Keterangan: Kelas dengan huruf yang sama menunjukan tidak berbeda nyata
Lampiran 5 Jumlah buku tumbuhan N. alata (buah)
Keterangan: * = Eksplan tidak tumbuh (mati)
Sumber Keragaman DB JK KT F Hit Pr > F
Model 50 118.8958333 2.3779167 3.24 <0.0001
Galat 45 33.0104167 0.7335648
Corrected Tot 95 151.9062500
Lampiran 6 Jumlah daun tumbuhan N. alata (helai)
Keterangan: * = Eksplan tidak tumbuh (mati)
Sumber Keragaman DB JK KT F Hit Pr > F
Keterangan: Kelas dengan huruf yang sama menunjukan tidak berbeda nyata
47
Lampiran 11 Gambar tumbuhan N. alata pada akhir pengamatan (12 MST)
A0B1 A1B1
A2B1 A3B1
A0B2 A1B2
A2B2 A3B2
A0B3 A1B3
A2B3 A3B3
A3B0 A1B0 A0B0
48 Lampiran 12 Gambar tumbuhan N. alata kontaminasi oleh cendawan