KARAKTERISTIK SEMEN IKAN EKONOMIS BUDIDAYA: MAS (
CYPRINUS
CARPIO
), DAN PATIN (
PANGASIUS HYPOPHTHALMUS
)
NUAH JAPET
SKRIPSI
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
Karakteristik Semen Ikan Ekonomis Budidaya: Mas (Cyprinus carpio), dan Patin (Pangasius hypophthalmus)
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, April 2011
Nuah Japet
RINGKASAN
Nuah Japet. C24053501. Karakteristik Semen Ikan Ekonomis Budidaya: Mas (Cyprinus carpio), dan Patin (Pangasius hypophthalmus). Dibimbing oleh Yunizar Ernawati dan Iis Arifiantini.
Ikan merupakan Filum terbesar dari semua vertebrata yang hidup, sekitar 30000 diantaranya merupakan jenis ikan dari total sekitar 50000 vertebrata (Mananos et al., 2008). Ikan mas dan patin merupakan jenis ikan bernilai ekonomis penting karena sudah memasyarakat dan tersebar hampir di seluruh provinsi di Indonesia. Hal inilah yang menyebabkan kedua ikan tersebut mendapat perhatian dan diminati oleh para pengusaha untuk membudidayakannya.
Penelitian mengenai spermatozoa ikan belum banyak dilakukan, sehingga informasi mengenai hal ini sangat minim, dan perlu dilakukan penelitian mengenai kajian reproduksi ikan-ikan tersebut, salah satunya adalah studi sebagai data dan karakteristik spermatozoa ikan-ikan tersebut secara morfologi dan morfometri agar informasi mengenai ikan-ikan tersebut semakin banyak dan kegiatan budidaya bisa lebih dikembangkan melalui studi aspek ini. Tujuan penelitian ini antara lain, mengkaji karakteristik spermatozoa ikan Mas dan ikan Patin, mengkaji morfologi dan morfometri spermatozoa ikan, mengkaji konsentrasi spermatozoa ikan. Penelitian ini dilaksanakan pada bulan September 2009 s/d September 2010 di Laboratorium Fisiologi dan Reproduksi Unit Rehabilitasi Reproduksi (URR) Fakultas Kedokteran Hewan, Laboratorium Biologi Makro, MSP FPIK IPB, serta Laboratorium Reproduksi Bidang Zoologi Pusat Penelitian Biologi (LIPI) Cibinong.
Hasil penelitian yang diperoleh antara lain karakteristik spermatozoa ikan mas dan patin secara umum berbeda. Volume spermatozoa ikan mas lebih banyak daripada ikan patin. Warna, konsistensi, gerakan massa dan pH memiliki nilai yang hampir sama. Morfologi dan Morfometri spermatozoa ikan mas dan patin memiliki bentuk dan ukuran yang mirip, namun ekor spermatozoa ikan mas lebih panjang. Konsentrasi pada spermatozoa ikan mas lebih besar daripada ikan patin.
Rataan diameter kepala ikan mas didapat sebesar 15,974 μ de ga si pa ga baku , μ da rataa pa ja g ekor sebesar , μm dengan simpangan baku , μ . seda gka pada ika pati , rataa dia eter kepala didapat sebesar , μ de ga si pa ga baku , μ da rataa pa ja g ekor sebesar , de ga si pa ga baku sebesar , μ . Dengan demikian dapat dilihat bahwa diameter kepala spermatozoa ikan mas dan ikan patin tidak jauh berbeda, namun panjang ekor spermatozoa ikan mas sedikit lebih panjang daripada panjang ekor ikan patin, hal tersebut dapat mengindikasikan bahwa dengan ekor yang lebih panjang, pergerakan massa akan lebih sulit pada ikan mas, yang dapat menjadi salah satu faktor pembeda pada keberhasilan suatu proses pembuahan.
Saran untuk penelitian selanjutnya perlu dilakukan perlakuan terhadap ikan yang akan diteliti agar didapat informasi yang lebih, terkait dengan hubungan antara aspek geografis, pakan, panjang dan berat ikan dengan karakteristik spermatozoa ikan.
KARAKTERISTIK SEMEN IKAN EKONOMIS BUDIDAYA: MAS (
CYPRINUS
CARPIO
), DAN PATIN (
PANGASIUS HYPOPHTHALMUS
)
NUAH JAPET C24053501
Skripsi
sebagai salah satu syarat untuk memperoleh
gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PENGESAHAN SKRIPSI
Judul Penelitian : Karakteristik Semen Ikan Ekonomis Budidaya: Mas (Cyprinus carpio), dan Patin (Pangasius hypophthalmus)
Nama Mahasiswa : Nuah Japet Nomor Pokok : C24053501
Program Studi : Manajemen Sumberdaya Perairan
Menyetujui, Komisi Pembimbing
Dr. Ir. Yunizar Ernawati, MS Dr. R.Iis Arifiantini,MSi NIP 19490617 197911 2 001 NIP 19600804 198103 2 001
Mengetahui,
Ketua Departemen Manajemen Sumberdaya Perairan
Dr. Ir. Yusli Wardiatno, M.Sc. NIP 19660728 199103 1 002
PRAKATA
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa yang telah menyatakan kasih dan anugerah-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul Karakteristik Semen Ikan Ekonomis Budidaya: Mas (Cyprinus carpio), dan Patin (Pangasius hypophthalmus) disusun berdasarkan hasil penelitian yang dilaksanakan pada bulan September 2009 s/d September 2010, dan merupakan salah satu syarat untuk memperoleh gelar sarjana perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ikan Mas, dan Patin adalah ikan ekonomis budidaya yang cukup digemari masyarakat, namun pada penelitian mengenai aspek morfologi dan morfometri spermatozoa belum pernah dilakukan. Analisis data dilakukan secara deskriptif dengan melihat rataan dan simpangan baku konsentrasi spermatozoa dan melihat hubungan antara morfologi dan morfometri spermatozoa dengan keberhasilan dalam proses reproduksi dan diharapkan penelitian ini memberikan manfaat yaitu memperoleh informasi lebih lanjut mengenai kajian aspek tersebut.
Penulis menyadari masih banyak kekurangan dalam pembuatan skripsi ini, sehingga penulis sangat mengharapkan adanya kritik dan saran yang bersifat membangun.
Bogor, April 2011
UCAPAN TERIMA KASIH
Terpujilah Tuhan Yang Maha Esa, yang telah memberikan kasih, anugerah, dan penyertaan-Nya serta kesempatan kepada penulis sehingga dapat menyelesaikan skripsi ini. Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Dr. Ir. Yunizar Ernawati, M.S dan Dr. R. Iis Arifiantini, M.Si selaku dosen pembimbing skripsi I dan II atas bimbingan dan arahan-arahan yang telah diberikan selama berlangsungnya penelitian dan penulisan skripsi ini.
2. Dr. Ir. Yusli Wardiatno, M.Sc sebagai dosen pembimbing akademik atas segala bimbingannya selama masa studi di Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3. Dr. Ir. M Mukhlis Kamal, M.Sc selaku dosen penguji tamu dan Ir. Agustinus M. Samosir, M.Phil selaku dosen penguji dari progam studi yang telah memberikan masukan dan saran yang sangat berarti untuk penulis.
4. Ayahanda M Ginting dan Ibunda K Br Sembiring, serta adik Fifandra dan Tri Lestari atas doa, dukungan, dan kasih sayang kepada penulis.
5. Bapak Bondan (Teknisi laboratorium URR Fakultas Kedokteran Hewan IPB) atas arahan, kerjasama, dan bantuannya selama di laboratorium.
6. Bapak Izul (Teknisi laboratorium Reproduksi Bidang Zoologi Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong) atas bantuan dalam pengambilan foto dan penggunaan alat untuk keperluan penelitian ini.
7. Bapak Sukenda dan Bapak Aam (Teknisi laboratorium kolam departemen Budidaya Perairan) atas bantuannya dalam ilmu stripping.
8. Keluarga Perwira 43 atas bantuan moril kepada penulis selama ini.
9. Teman-teman di UKM PMK IPB, Komisi Pembinaan Pemuridan dan Perkantas Bogor yang telah membantu dalam kehidupan rohani penulis.
10.Mbak Widar dan staf Tata Usaha MSP lainnya atas bantuan, perhatian dan pengarahan selama penulisan skripsi.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 3 Februari 1988 sebagai anak pertama dari tiga bersaudara dari Bapak M Ginting dan Ibu K Br Sembiring. Pendidikan formal yang ditempuh penulis yaitu TK Kemala Bhayangkari 5 (1992), SD Ruwabadan Jakarta (1993), SLTP Ruwabadan Jakarta (1999), SMA Negeri 57 Jakarta (2002).
Pada tahun 2005 penulis melanjutkan studi di Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru) dan terdaftar sebagai mahasiswa Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah aktif sebagai asisten mata kuliah agama Kristen Protestan periode 2007-2009. Penulis juga dalam kegiatan kerohanian Unit Kegiatan Mahasiswa Persekutuan Mahasiswa Kristen (UKM PMK IPB) dalam Komisi Pembinaan Pemuridan (KPP), aktif dalam berbagai kepanitiaan kegiatan Paskah, Natal dan Retreat Angkatan. Penulis juga menjadi Anggota Eksekutif Badan Penelitian dan Pengembangan Unit Kegiatan Mahasiswa Persekutuan Mahasiswa Kristen IPB (Balitbang UKM PMK IPB) periode 2008-2010. Penulis juga menjadi staf Himpunan Mahasiswa Manajemen Sumberdaya Perairan (Himasper) divisi kerohanian periode 2007-2008. Selain itu, penulis juga aktif mengikuti beberapa kepanitian dalam acara di lingkungan Departemen.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Fakultas Perikanan dan Ilmu Kelautan, penulis menyusu skripsi ya g berjudul “Karakteristik
5.2 Saran ... 27
DAFTAR TABEL
Halaman
1. Kualitas Semen Segar Ikan ... 20
DAFTAR GAMBAR
Halaman
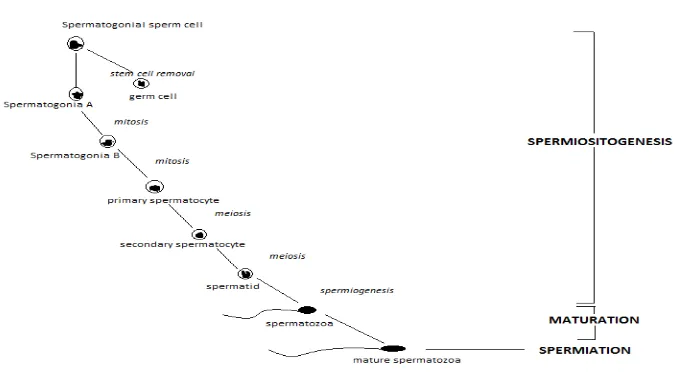
1. Urutan pembentukan spermatozoa dan pematangan pada ikan jantan... 8
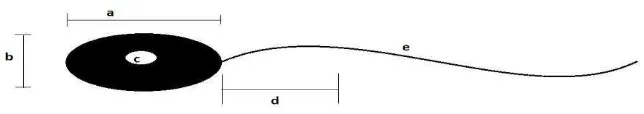
2. Aspek Morfometri Spermatozoa (Salisbury and Van Demark, 1961) ... 13
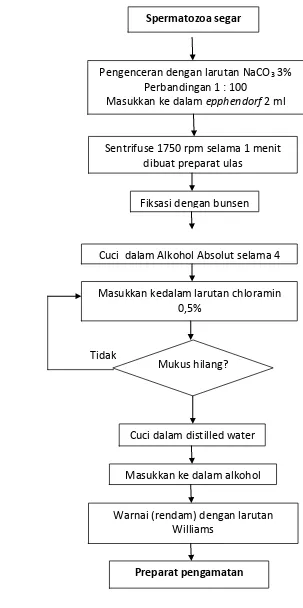
3. Skema pembuatan preparat pewarnaan williams yang dimodifikasi... 17
DAFTAR LAMPIRAN
Halaman
1. Contoh perhitungan konsentrasi Spermatozoa ... 30
I. PENDAHULUAN
1.1. Latar Belakang
Indonesia merupakan negara yang kaya akan hasil alam, termasuk sektor
perikanan. Ikan merupakan bahan pangan yang berprotein tinggi, mudah dicerna
oleh tubuh dan harganya terjangkau. Ikan mas dan patin termasuk jenis-jenis
ikan ekonomis yang dimanfaatkan sebagai ikan konsumsi.
Ikan merupakan Filum terbesar dari semua vertebrata yang hidup, sekitar
30000 diantaranya merupakan jenis ikan dari total sekitar 50000 vertebrata
(Mananos et al., in Cabrita et al., 2008). Ikan hidup pada hampir setiap
lingkungan akuatik di bumi, pada kisaran temperatur, salinitas, oksigen dan juga
karakteristik kimia dan fisika perairan yang luas. Lingkungan tersebut
mengakibatkan tekanan pada ikan untuk beradaptasi dan menghasilkan
keanekaragaman cara dalam melakukan reproduksi.
Ikan mas merupakan jenis ikan bernilai ekonomis penting, karena sudah
memasyarakat dan tersebar hampir di seluruh provinsi di Indonesia dan telah
menjadi sumber mata pencaharian masyarakat pada daerah tertentu, seperti
Jawa Barat, Sumatera Barat, Sulawesi Utara, dan Sulawesi Tengah (Suseno,
2002). Ikan patin dikenal sebagai komoditi yang berprospek cerah, karena
memiliki harga jual yang tinggi. Ikan ini cukup responsif terhadap pemberian
makanan tambahan. Pada pembudidayaan, dalam usia enam bulan ikan patin
bisa mencapai panjang 35-40 cm. Sebagai keluarga Pangasidae, patin tidak
e butuhka peraira ya g e galir u tuk “ e bo gsorka “ tubuh ya. Pada
perairan yang tidak mengalir dengan kandungan oksigen rendahpun sudah
memenuhi syarat untuk membesarkan ikan ini. Hal inilah yang menyebabkan
ikan patin mendapat perhatian dan diminati oleh para pengusaha untuk
membudidayakannya.
Penyediaan benih yang bermutu baik dalam jumlah cukup dan kontinyu
merupakan faktor penting dalam upaya pengembangan budi daya ikan konsumsi
2
spermatozoa ikan. Penelitian mengenai spermatozoa ikan belum banyak
dilakukan, sehingga informasi mengenai hal ini sangat minim, dan perlu
dilakukan penelitian mengenai kajian reproduksi ikan-ikan tersebut, salah
satunya adalah studi karakteristik spermatozoa ikan-ikan tersebut secara
morfologi dan morfometri agar informasi mengenai ikan-ikan tersebut semakin
banyak dan kegiatan budidaya bisa lebih dikembangkan melalui studi aspek ini.
1.2. Rumusan Masalah
Untuk berlangsungnya proses reproduksi, selain sel telur ikan, dibutuhkan
spermatozoa yang normal dan fertil, maka studi mengenai morfologi dan
morfometri spermatozoa ikan perlu dilakukan terkait dengan usaha untuk
mempertahankan spesies tersebut di alam ataupun dengan sistem budidaya.
Salah satu permasalahan fertilisasi pada budidaya ikan air tawar antara lain
rendahnya tingkat fertilisasi dari spermatozoa di dalam air. Hal ini
mengakibatkan banyaknya sel telur yang tidak terbuahi secara sempurna
(Ginzburg, 1972). Dalam satu siklus reproduksi, ikan dapat menghasilkan sel telur
sampai jutaan per ekor, tetapi yang terbuahi hanya mencapai 5% dari total.
Kemudian permasalahan lain adalah kurangnya ketersediaan cairan spermatozoa
pada waktu pembuahan buatan. Hal tersebut dapat disebabkan oleh viabilitas
dan motilitas dari spermatozoa, sehingga kemampuan spermatozoa untuk
menembus lubang mikropil pada sel telur rendah. Kemampuan spermatozoa
hidup pada kebanyakan jenis ikan air tawar secara normal setelah keluar dari
testis hanya berkisar antara 2-3 menit (Ginzburg, 1972). Pada ikan patin,
kematangan gonad ikan jantan dan betina tidak bersamaan, sehingga sering
terjadi kurang tersedianya sperma dan telur dalam saat yang sama. Volume
sperma pada ikan patin relatif sedikit. Jika induk jantan matang gonad terlebih
dahulu, maka selama menunggu kematangan gonad induk betina, sperma yang
relatif lebih sedikit dapat dikeluarkan terlebih dahulu untuk diawetkan ataupun
3
Berbagai metode telah dirancang untuk mengetahui dan mengukur
karakteristik semen pada berbagai makhluk hidup yang akan berhubungan
dengan fertilitas atau tingkat kesuburan dari suatu makhluk hidup dalam
reproduksi, antara lain :
1. Kemampuan ikan untuk menghasilkan spermatozoa. Kemampuan
tersebut biasanya ditentukan oleh volume semen atau ejakulasi
(kemampuan mengeluarkan sel spermatozoa) dan konsentrasi ataupun
kepadatan dari spermatozoa.
2. Kelangsungan hidup pada spermatozoa. Hal tersebut ditentukan dari
pengujian motilitas, rasio hidup/mati, semen dalam keadaan beku, serta
akrosom yang lengkap.
3. Persentase morfologi spermatozoa yang normal (Barth and Oko,
1989).
Parameter-parameter tersebut berhubungan satu dengan yang lain dan
dapat digunakan sebagai tolok ukur untuk menaksir hubungan
parameter-parameter diatas untuk menghindarkan kemungkinan kegagalan dalam
pengujian.
Studi mengenai morfologi dan morfometri sering diabaikan padahal
jumlah morfologi spermatozoa yang abnormal akan berhubungan langsung
dengan tingkat kesuburan. Oleh karena itu, studi mengenai morfologi dan
morfometri spermatozoa dapat mengindikasikan ke dalam tingkatan motilitas
dan produksi spermatozoa yang normal.
1.3.Tujuan
Tujuan penelitian ini antara lain :
1. Mengkaji karakteristik semen ikan Mas dan ikan Patin.
2. Mengkaji morfologi dan morfometri spermatozoa ikan,
II. TINJAUAN PUSTAKA
2.1. Klasifikasi Ikan
2.1.1. Ikan Mas
Ikan mas adalah salah satu jenis ikan bernilai ekonomis penting. Ikan ini
telah memasyarakat dan tersebar hampir di seluruh provinsi di Indonesia. Ikan
Mas berasal dari daratan Cina. Ikan mas pada umumnya (Common carp)
(Cyprinus carpio L. 1758) sudah mulai dibudidayakan dari beberapa ratus tahun
yang lalu. Untuk waktu yang cukup lama reproduksi tidak dapat terkontrol dan
berkembang biak secara spontan di kolam ataupun sungai (Billard, 1995). Karena
sifat ikan mas yang tahan terhadap lingkungan baru maka dengan cepat ikan mas
tersebar ke seluruh penjuru dunia. Penyediaan benih yang bermutu baik dalam
jumlah cukup dan kontinu merupakan faktor penting dalam upaya
pengembangan budi daya ikan konsumsi. Oleh karenanya, informasi teknologi
pengelolaan usaha pembenihan ikan mas yang mencakup ras-ras ikan mas yang
potensial, pemilihan lokasi yang tepat, pengelolaan induk yang baik, pemijahan,
penetasan telur, pendederan, pascapanen, dan analisis kelayakan ekonominya
sangatlah diperlukan (Suseno, 2002).
Secara umum, ikan mas mempunyai sifat-sifat sebagai hewan air
omnivora yang lebih condong ke sifat hewan karnivora. Dalam ilmu taksonomi
hewan, klasifikasi ikan mas adalah sebagai berikut.
Filum : Chordata
Subfilum : Vertebrata
SuperKelas : Pisces
Kelas : Osteichthyes
Subkelas : Actinopterygii
Ordo : Cypriniformes
5
Famili : Cyprinidae
Genus : Cyprinus
Spesies : Cyprinus carpio L.
Tubuh ikan mas agak memanjang dan memipih tegak (compressed).
Mulut terletak di ujung tengah (terminal) dan dapat disembulkan (protaktil).
Bagian anterior mulut terdapat 2 pasang sungut. Secara umum, hampir seluruh
tubuh ikan mas ditutupi oleh sisik. Sirip pada ikan mas yaitu sirip punggung
(dorsal), sirip dada (pektoral), sirip perut (ventral), sirip dubur (anal), dan sirip
ekor (caudal).
Siklus reproduksi ikan mas dimulai dari dalam gonad, yakni ovarium pada
betina dan testis pada jantan. Dari ovarium akan dihasilkan telur, dan dari testis
dihasilkan spermatozoa. Pemijahan ikan mas dapat terjadi sepanjang tahun dan
tidak tergantung pada musim. Secara alami pemijahan terjadi pada tengah
malam sampai akhir fajar (Suseno, 2002).
2.1.2. Ikan Patin
Ikan Patin (jambal) memiliki badan memanjang berwarna putih seperti
perak dengan punggung berwarna kebiru-biruan. Panjang tubuhnya bisa
mencapai 120 cm. Kepala patin relatif kecil dengan mulut terletak di ujung kepala
agak di sebelah bawah. Hal ini merupakan ciri khas golongan catfish. Pada sudut
mulutnya terdapat dua pasang kumis pendek yang berfungsi sebagai peraba.
Sirip punggung memiliki sebuah jari-jari keras yang berubah menjadi patil
yang bergerigi dan besar di sebelah belakangnya. Sementara itu, jari-jari lunak
sirip punggung teerdapat enam atau tujuh buah. Pada punggungnya terdapat
sirip lemak yang berukuran kecil sekali. Adapun sirip ekornya membentuk cagak
dan bentuknya simetris. Ikan patin tidak memiliki sisik. Sirip dubur (anal)
panjang, terdiri dari 30-33 jari-jari lunak, sedangkan sirip perutnya (ventral)
memiliki enam jari-jari lunak. Sirip dada (pektoral) memiliki 12-13 jari-jari lunak
dan sebuah jari-jari keras yang berubah menjadi senjata yang dikenal sebagai
6
Sistematika ikan patin adalah sebagai berikut.
Filum : Chordata
Spesies : Pangasius hypophthalmus.
Ikan patin terkenal dengan sifat kanibalnya. Masa benih ataupun juvenil
merupakan masa yang rentan akan kanibal. Terjadinya kanibal mengakibatkan
sedikitnya individu yang berhasil mencapai umur memijah generasi berikutnya
(Baras et al., 2010). Ikan patin sulit memijah di kolam atau di wadah
pemeliharaan dan termasuk pula ikan yang kawin musiman. Oleh karena itu
pemijahan ikan patin umumnya dilakukan secara buatan karena selama ini belum
ada yang berhasil memanipulasi lingkungan agar ikan patin dapat memijah
secara alami (Susanto, 2008).
2.2. Reproduksi ikan
2.2.1. Organ Reproduksi
Hafez (1987) mengatakan, bahwa organ reproduksi jantan terdiri dari
sepasang testis, vasikular semina dan saluran-saluran sperma. Ginzburg (1972)
menjelaskan, bahwa testis ikan teleostei, Liza aurata terdiri dari tubulus-tubulus
seminiferi yang dibatasi oleh lamina basal. Di dalam tubulus-tubulus tersebut
terdapat sel-sel germinal dan sel-sel sertoli, sedangkan di luar tubulus terdapat
sel-sel interstistial atau sel Leydig. Sel-sel germinal terkumpul di dalam siste-siste
semeniferi yang berbeda, yaitu: spermatosit primer, spermatosit sekunder,
spermatid pada tingkatan yang berbeda dan spermatozoa masing-masing siste
dibatasi oleh sel-sel sertoli.
Testes ikan berbentuk memanjang dalam rongga badan di bawah
7
(mesorchium) menempelkan testes ini pada rongga badan di bagian depan
gelembung renang. Biasanya testes ikan ada sepasang, dapat sama panjang dan
ada pula yang satu lebih panjang dari yang lainnya. Struktur testes terdiri dari
rongga-rongga yang tidak teratur dan banyak sekali. Disekitar dinding rongga
(lumina) terdapat spermatogonia (sel indung sperma) yang nantinya akan
berkembang menjadi spermatozoa melalui proses yang disebut
sper atoge esis sebagai berikut: “per atogo ia e belah se ara itosis
berkali-kali sampai e jadi sper atosit pri er , sela jut ya de ga beberapa
kali pe belaha lagi e jadi sper atosit seku der , hasil dari pe belaha sper atosit seku der e jadi sper atids ya g a ti ya aka
bermetamorfose menjadi gamet yang dapat bergerak aktif disebut sebagai
sper atozoa , sper a. Proses eta orfose dari sper atid tersebut seri g juga disebut sebagai sper ioge esis . “e ara u u , perke ba ga ke ata ga
testes kurang lebih sejalan dengan tingkat perkembangan ovarium.
Ada dua tipe tubulus testis yang dikemukakan oleh Ginzburg (1972),
yaitu: (1) tipe spermatogonia tertutup, spermatogonia membentuk suatu
deretan panjang dan tinggi, terdapat hampir pada semua jenis ikan teleostei, (2)
tipe spermatogonia tertutup, seluruh spermatogonia tertutup oleh bagian ujung
distal tunica albuginea. Selanjutnya, Ginzburg (1972) juga menjelaskan, ada dua
tipe struktur testikular jenis ikan teleostei berdasarkan perbedaan pola
spermatogenesis, spermatologi, dan fisiologi reproduksi, yaitu : (1) tipe
spermatogonia A adalah sama dengan tipe spermatogonia tertutup, (2) tipe
spermatogonia B adalah proses akhir dari spermatogonia A dimana
tubulus-tubulus akan membelah dan membentuk kelompok siste-siste, spermatid
menempel pada sel-sel sertoli, spermatozoa yang dihasilkan mempunyai
kromatin yang lebih tinggi, panjang, dan tebal dengan lapisan tengah yang penuh
8
Gambar 1. Urutan pembentukan spermatozoa dan pematangan pada ikan jantan (Mananos et al., in Cabrita et al., 2008).
Nikolsky (1971), menguraikan tingkat perkembangan testis ikan secara
umum, yaitu :
Tingkat I : Tahap muda (immature),
individu-individu muda belum mempunyai
keinginan reproduksi dan ukuran
testis sangat kecil.
Tingkat II : Tahap istirahat (resting stage), testis
belum mulai berkembang dan
ukurannnya masih sangat kecil.
Tingkat III : Proses pemasakan (maturation),
pertambahan berat testis sangat
cepat, testis berubah dari transparan
menjadi warna pucat.
Tingkat IV : Masak (maturity), testis sudah
mencapai berat maksimum, tetapi
spermatozoa tidak bisa keluar pada
saat perutnya ditekan perlahan.
Tingkat V : Kondisi salin (spent condition),
9
lubang genitalia meradang
kemerah-merahan, gonad telah mengempis
dan testis berisi spermatozoa sisa.
Tingkat istirahat (resting stage) : Spermatozoa telah dikeluarkan,
lubang genitalia tidak
kemerah-merahan lagi dan ukuran testis
sangat kecil.
Pemilihan induk jantan yang sudah matang gonad pada masing-masing
ikan berbeda-beda. Pada ikan mas induk jantan yang dipilih adalah ikan yang
berumur lebih dari 6 bulan dan berbobot minimal 0,5 kg (Suseno, 2002). Pada
ikan patin, induk jantan yang dipilih adalah induk yang berumur setidaknya 2
tahun dan memiliki bobot 1,5 sampai 2 kilogram (Susanto, 2008).
2.2.2. Spermatozoa
Spermatozoa dihasilkan dalam tubula seminiferus (Salisbury and
VanDemark, 1961). spermatozoa ikan tergolong dalam tipe flagellata, karena
mempunyai ekor flagellata yang panjang. Spermatozoa yang sudah matang
terdiri dari kepala, leher, dan ekor flagellata. Inti spermatozoa terdapat pada
bagian kepala (Salisbury and VanDemark, 1961). Ada juga yang mempunyai
middle piece sebagai penghubung atau penyambung antara leher dan ekor. Ekor
flagellata berguna sebagai organ renang. Pada saat dikeluarkan dari alat kelamin
jantan, spermatozoa berada dalam seminal plasma. Campuran antara seminal
plasma dengan spermatozoa disebut semen. Dalam setiap tetes semen terdapat
jutaan spermatozoa. Pada testes bagian dorsal terdapat saluran pengeluaran
spermatozoa yang disebut vas deferens. Secara radial, lumina bermuara ke vas
deferens tersebut.
Sel spermatozoa secara umum terdiri atas dua bagian besar, yaitu kepala
dan ekor, tetapi ada pula yang terdiri atas tiga bagian bila bagian antara kepala
dan ekor cukup besar yang dinamakan bagian tengah. Tiap bagian berbeda-beda
10
Spermatozoa ikan teleostei memiliki struktur yang sederhana, dengan
ukuran panjang kepala 2-3 µm dan panjang total 40 sampai dengan 60 µm.
Kepala spermatozoa mengandung DNA yang berperan dalam penyimpanan dan
menerjemahkan informasi genetik yang dibawa oleh spermatozoa (Hafez, 1987).
Konsentrasi spermatozoa penting untuk diketahui karena hal ini sebagai
kriteria penentu kualitas semen (Toelihere, 1981). Derajat kekeruhannya
ditentukan oleh konsentrasi spermatozoa. Semakin banyak konsentrasinya
semakin keruh warna semennya (Herrick and Self, 1962).
Faktor-faktor yang mempengaruhi daya tahan hidup spermatozoa adalah
sifat-sifat fisik dan kimia bahan pengencer, suhu, cahaya, pH, tekanan osmotik,
elektrolit, nonelektrolit. Spermatozoa akan tahan hidup lama pada pH 7.0 dan
tetap motil dalam waktu lama pada media isotonik darah dan spermatozoa lebih
mudah dipengaruhi oleh keadaan hipertonik daripada hipotonik (Toelihere,
1981). Spermatozoa ikan imotil didalam cairan plasma semennya sendiri dan
baru bergerak apabila telah bercampur dengan air. Respon rangsangan aktifitas
spermatozoa tergantung pada pH, tekanan osmotik, dan kandungan ion pada
medium yang mengelilinginya (Ernawati, 1999).
Salisbury and Vandemark (1961) menyatakan bahwa sel spermatozoa
diselubungi oleh membran lipoprotein. Apabila sel tersebut mati maka
permeabilitas selnya meningkat terutama di daerah pangkal kepala, dan hal ini
merupakan dasar pewarnaan semen yang membedakan spermatozoa yang hidup
dan mati.
Spermatozoa ikan imotil di dalam cairan plasma semennya sendiri dan
baru bergerak apabila telah bercampur dengan air. Respons rangsangan aktifitas
spermatozoa tergantung pada pH, tekanan osmotik, dan kandungan ion pada
medium yang mengelilinginya. Spermatozoa ketika berada di dalam alat
reproduksinya memiliki pH yang berkisar pada 7.0 dan suhu sekitar 6oC, dan ketika dikeluarkan sebaiknya suhu spermatozoa tetap dipertahankan dibawah
11
2.2.3. Morfologi Spermatozoa
Spermatozoa merupakan sel kecil yang kompak dan sangat khas dengan
bentuk yang menyerupai kecebong serta tidak tumbuh dan membelah diri.
Pengetahuan terhadap morfologi spermatozoa diperlukan mengingat sudah
cukup banyak penelitian-penelitian yang membahas korelasi antara morfologi
dengan fertilitas pada berbagai ternak.
Menurut bentuknya, spermatozoa terbagi atas kepala dan ekor. Kepala
spermatozoa dibagi menjadi dua daerah yaitu daerah akrosom anterior yang
dibungkus oleh tudung akrosom dan daerah post akrosomal posterior. Tudung
akrosom berasal dari apparatus golgi selama tahap awal spermiogenesis. Tudung
akrosom mengandung akrosin, hyaluronidase, dan enzim-enzim hidroloitik
lainnya yang terlibat pada proses fertilisasi.
Bentuk kepala oval memanjang, lebar dan datar yang terisi sepenuhnya
dengan materi yang homogen sebagai informasi genetik dari pejantan yaitu
kromosom (Barth and Oko 1989). Benang-benang kromatin terdiri dari deoxyribo
nucleic acid (DNA) kompleks dan bersifat haploid. Sel sperma yang haploid
dihasilkan dari proses meiosis yang terjadi selama proses spermatogenesis.
Ekor sperma berasal dari sentriol spermatid selama proses
spermiogenesis yang berfungsi memberikan gerak maju atau lokomosi kepada
spermatozoa dengan gelombang-gelombang yang dimulai di daerah implantasi
ekor-kepala dan berjalan ke arah belakang. Barth and Oko (1989) menyatakan
bahwa ekor sperma terbagi atas tiga bagian yaitu bagian utama (principal piece)
bagian tengah (midpiece) dan bagian ujung (endpiece).
Permukaan spermatozoa dibungkus oleh suatu membran lipoprotein. Bila
sel tersebut mati maka permeabilitas sel akan meningkat terutama di daerah
pangkal kepala. Hal ini dijadikan dasar pewarnaan sperma untuk membedakan
sperma hidup dan sperma mati berdasarkan kemampuan zat warna untuk
menembus membran sel yang rusak.
Parameter yang dianggap penting bagi spermatozoa yang akan
12
spermatozoa dan persentase morfologi sperma normal. Abnormalitas sperma
diketahui disebabkan oleh berbagai faktor, antara lain penyakit, stres panas dan
musim (Barth and Oko, 1989) termasuk perlakuan preservasi dan kriopreservasi
semen. Beberapa peneliti telah menyebutkan bahwa tingkat abnormalitas juga
bisa disebabkan oleh teknik pengumpulan semen dan teknik pewarnaan.
Secara umum abnormalitas spermatozoa terdiri dari abnormalitas primer
dan sekunder. Abnormalitas primer adalah segala sesuatu perubahan yang
terjadi pada saat proses spermatogenesis di tubuli seminiferi, sedangkan
abnormalitas sekunderterjadi setelah sperma meninggalkan tubuli seminiferi,
selama perjalanannya melalui epididimis, ejakulasi atau penanganan ejakulat
termasuk pemanasan yang berlebihan, pendinginan yang cepat, kontaminasi
dengan air, urine, antiseptik dan sebagainya (Barth and Oko, 1989).
Herrick and Self (1962), mengklarifikasikan abnormalitas spermatozoa
menjadi abnormalitas primer, dan abnormalitas sekunder. Abnormalitas primer
terjadi pada proses spermatogenesis, abnormalitas sekunder kemungkinan
terjadi pada epididimis, dan juga terjadi pada saat ejakulasi termasuk handling
semen (temperatur, pH dan tekanan osmotik).
Abnormalitas primer meliputi kepala yang terlampau besar atau
terlampau kecil, kepala pendek dan melebar, ekor ganda, ekor melingkar, putus
atau bercabang. Sedangkan abnormalitas sekunder meliputi kepala tanpa ekor,
bagian tengah yang terlipat, adanya butiran-butiran sitoplasmik proksimal atau
distal dan selubung akrosom yang terlepas (Hafez, 1987).
Pengamatan morfologi dapat dilakukan dengan berbagai cara, baik secara
manual maupun menggunakan teknologi mutakhir. Cara manual dapat dilakukan
dengan menggunakan teknik pewarnaan dan pengamatan dilakukan dengan
mikroskop cahaya atau mikroskop fase kontras. Sedangkan metode mutakhir
yang dapat digunakan adalah Timen-Exposure Photomicrography (TEP), Multiple
Exposure Photomycrography (MEP), Microcinematography (Cine),
13
2.2.4. Morfometri Spermatozoa
Morfometri spermatozoa dipengaruhi oleh beberapa faktor, antara lain:
teknik fiksasi, teknik pewarnaan, handling semen, kualitas mikroskop dan
ketrampilan personal (Toelihere, 1981). Pengamatan morfometri spermatozoa
dapat dilakukan dengan menggunakan metode manual yaitu dengan teknik
fiksasi dan pewarnaan, sedangkan pengamatan dilakukan di bawah mikroskop
cahaya atau mikroskop fase kontras yang dilengkapi dengan micrometer. Adapun
metode terbaru untuk mengamati morfometri spermatozoa adalah dengan
metode Automated Sperm Morphometry Analysis (ASMA), dengan menggunakan
sistem ini akan memberikan hasil yang akurat dan lebih mudah (Cabrita et al,.
2008). Akan tetapi metode ini sangat mahal dan belum dapat diaplikasikan di
Indonesia.
Gambar 2. Morfometri spermatozoa: a. panjang kepala; b. lebar kepala; c. areal kepala; d. ekor bagian tengah; e. ekor bagian utama.(Salisbury and
Van Demark, 1961).
Ukuran dan bentuk spermatozoa berbeda pada setiap jenis hewan,
namun memiliki struktur morfologis hampir sama. Panjang dan lebar
spermatozoa sapi, domba dan babi berkisar antara 8.0-10 µm x 4.0-4.5 µm, tebal
kepala berkisar 0.5-1.5 µm pada semua jenis. Bagian tengah sperma mempunyai
panjang 1.5-2 kali panjang kepala dengan panjang spermatozoa 35-45 µm.
Panjang keseluruhan spermatozoa pada hewan peliharaan mencapai 50-70 µm
14
2.2.5. Teknik Pewarnaan
Pewarnaan spermatozoa berfungsi untuk membantu proses pengamatan
morfologi dan morfometri spermatozoa. Berbagai metode pewarnaan dapat
dilakukan di lapangan. Laboratorium rujukan Departemen Klinik Divisi
Reproduksi, Kebidanan Dan Kesehatan Ambing Fakultas Kedokteran Hewan
Universitas Pertanian Swedia merekomendasikan penggunaan metode
pewarnaan Williams karena sediaan pengamatan hanya perlu dibuat preparat
ulas dan difiksasi di udara sedangkan pewarnaan dan pengamatan dapat
dilakukan di laboratorium. Metode lain yang direkomendasikan adalah fiksasi
spermatozoa dalam larutan formol-saline. Hal yang perlu diperhatikan dalam
fiksasi formol-saline adalah senyawa formic acid yang terbentuk akibat terlalu
lama disimpan sehingga akan merusak sel sehingga pengamatan morfometri
sebaiknya dilakukan sebelum enam bulan sejak sampel diambil (Arifiantini,
2006). Formol-saline direkomendasikan sebagai media fiksasi spermatozoa yang
baik karena memiliki kelebihan, antara lain: murah, pembuatannya mudah,
memfiksasi lemak dengan baik, daya penetrasi yang baik dan tidak menyebabkan
jaringan menjadi kering (Arifiantini, 2006).
Menurut Arifiantini (2006), pewarnaan dengan metode Williams
merupakan serangkaian proses pewarnaan dengan zat warna dasar basic fuchsin
dan eosin, basic fuchsin merupakan zat warna yang termasuk dalam golongan
III. METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Sampel diambil dari tiga ekor ikan mas jantan yang berasal dari empang
di sekitar Kampus, dan tiga ekor ikan patin jantan yang berasal dari kolam
penelitian jurusan Budidaya Perairan (BDP) dengan kondisi sudah matang gonad,
tanpa perlakuan, dan siap untuk memijah. Penelitian pendahuluan dan penelitian
utama dilakukan kurang lebih 1 tahun (September 2009 sampai september
2010). Pengamatan motilitas spermatozoa dan evaluasi langsung dilakukan di
lapang dan penelitian dilaksanakan di Laboratorium Fisiologi dan Reproduksi Unit
Rehabilitasi Reproduksi (URR) Fakultas Kedokteran Hewan, Laboratorium Biologi
Makro Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan
Ilmu Kelautan, Institut Pertanian Bogor, serta Laboratorium Reproduksi Bidang
Zoologi Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI)
Cibinong.
3.2. Alat dan Bahan
Alat Bahan
Bunsen sampel semen segar
mikropipet 0,5-1,0 µl larutan pewarna Williams tabung epphendorf 2 ml larutan formol saline
kamar hitung Neubauer tissue
Outerslide box alkohol absolut
Counter larutan chloramin 0,5%
pH indikator paper larutan sodium sitrat 0,3%
Stopwatch distilled water
mikroskop cahaya alkohol 96%
mikroskop compound Nikon Optihot 2 kertas label perangkat lunak CorelDraw X4
gelas objek
wadah penampung sperma
Syringe 5 ml
16
3.3. Penelitian Pendahuluan
Sebelum penelitian ini dilakukan, terlebih dahulu dilakukan penelitian
pendahuluan. Hal tersebut dilakukan karena belum ada metode yang ditemukan
untuk menentukan pewarnaan yang tepat pada spermatozoa ikan yang diteliti.
Pada mulanya, dilakukan pewarnaan spermatozoa dengan pewarnaan Williams
sesuai dengan standar pada pewarnaan spermatozoa hewan mamalia. Karena
spermatozoa tidak terlihat, maka dilakukan percobaan dengan pewarnaan eosin
dan juga nigrosin. Namun sampel spermatozoa juga tidak terlihat. Berdasarkan
penelitian yang dilakukan oleh Tuset et al., (2008) pada ikan trout (Onchorynchus
mykiss), perlu dilakukan pengenceran dengan sodium sitrat dan sentrifugasi,
sehingga spermatozoa menjadi cukup jelas terlihat setelah kedua metode
tersebut dikolaborasikan. Langkah-langkah pewarnaan spermatozoa ikan dengan
pewarnaan Williams yang dimodifikasi berdasarkan penelitian pendahuluan,
antara lain :
1. Spermatozoa segar yang diambil dari ikan diencerkan dengan larutan
sodium sitrat 3% dengan perbandingan 1:100 dan dimasukkan ke
dalam tabung epphendorf 2 ml.
2. Sampel spermatozoa disentrifuse dengan kecepatan 300 g atau 1750
rpm selama 1 menit, lalu dibuat preparat ulas.
3. Preparat ulas difiksasi dari semen segar yang dikoleksi dari lapang
dengan bunsen.
4. Cuci dalam alkohol absolut selama 4 menit. Biarkan sampai kering.
5. Masukkan kedalam larutan 0.5% chloramin selama 1-2 menit, sambil
diangkat dan dimasukkan kembali berkali-kali dengan tujuan
menghilangkan mukus dan ulasan terlihat jernih.
6. Cuci dalam distilled water selanjutnya masukkan ke dalam alkohol 95%.
17
Gambar 3. Skema pembuatan preparat pewarnaan williams yang dimodifikasi. Pengenceran dengan larutan NaCO3 3%
Perbandingan 1 : 100
Masukkan ke dalam epphendorf 2 ml
Fiksasi dengan bunsen
Cuci dalam Alkohol Absolut selama 4
Masukkan kedalam larutan chloramin 0,5%
Selama 1-2 menit
Cuci dalam distilled water Sentrifuse 1750 rpm selama 1 menit
18
3.4. Metode Pengumpulan Data
Pengumpulan data dilakukan dengan pengambilan sampel spermatozoa
segar yang langsung dilakukan di lokasi penangkapan ikan dengan cara
memfiksasi preparat ulas dari semen segar yang dikoleksi dari lapang dan
pewarnaan dilakukan di laboratorium. Penampungan dan evaluasi semen
dilakukan secara kontinyu, dengan cara pengambilan sampel ikan ke kolam
sebanyak tiga kali. Setiap pengambilan sampel ikan, pada masing-masing ikan
dilakukan tiga kali pengambilan sperma. Beberapa ml masing-masing
spermatozoa diambil dari tiap ikan lalu dimasukkan ke tabung epphendorf. Dari
setiap tabung epphendorf dijadikan tiga preparat pengamatan. Semen yang
dikoleksi kemudian dievaluasi secara makroskopis dan mikroskopis untuk dilihat
morfologi dan morfometrinya. Evaluasi makroskopis meliputi volume, warna,
dan konsistensi, sedangkan mikroskopis terdiri dari gerakan massa, motilitas dan
konsentrasi spermatozoa (Sorenson, 1979 in Arifiantini, 2006).
3.4. Parameter Pengamatan
Parameter-parameter yang diamati pada penelitian ini antara lain
Morfologi dan Morfometri spermatozoa pada masing-masing ikan (mas dan
patin), dan konsentrasi spermatozoa.
3.5. Analisis Data
Pengamatan morfologi spermatozoa dilakukan dengan menghitung
jumlah spermatozoa baik pada kepala maupun ekor. Pengamatan dilakukan pada
100 sel spermatozoa masing-masing preparat menggunakan mikroskop cahaya
pada perbesaran 100x. Pengamatan kualitas semen segar, morfologi dan
morfometri spermatozoa dilakukan dengan tiga kali ulangan. Pengamatan
Morfometri semen dilakukan dengan melihat diameter kepala sperma, dan
panjang ekor sperma. Hasil yang didapat pada mikrometer dikonversikan ke
19
secara deskriptif dengan melihat rataan dan simpangan baku konsentrasi
spermatozoa dan melihat hubungan antara morfologi dan morfometri
IV. HASIL DAN PEMBAHASAN
4.1 Karakteristik Semen SegarHasil evaluasi semen segar merupakan pemeriksaan awal semen yang
dijadikan dasar untuk menentukan kelayakan semen yang akan diproses lebih
lanjut (Ginzburg, 1972). Volume ejakulat pada hewan ternak dipengaruhi oleh
breeding, ukuran badan, tingkatan umur, frekuensi, metode penampungan dan
kondisi lingkungan (Toelihere, 1981). Sedangkan pada ikan, volume ejakulat
dipengaruhi oleh umur, bobot, frekuensi dan kondisi lingkungan (Billard, 1995).
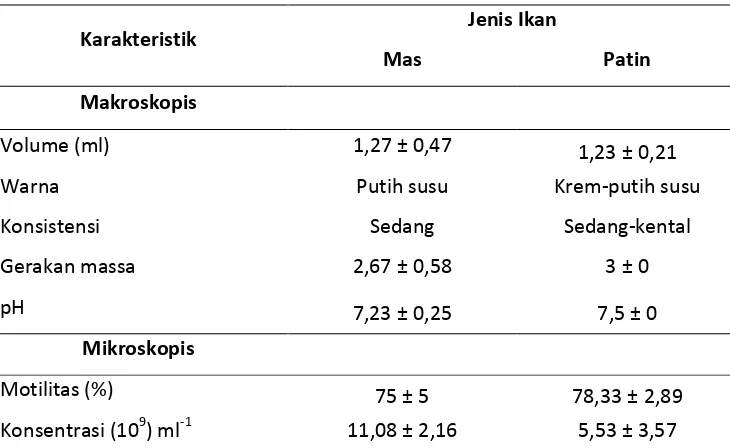
Tabel 1. Kualitas semen segar ikan.
Karakteristik Jenis Ikan
Mas Patin
Makroskopis
Volume (ml) 1,27 ± 0,47 1,23 ± 0,21
Warna Putih susu Krem-putih susu
Konsistensi Sedang Sedang-kental
Keterangan : Gerakan massa diambil berdasarkan nilai tingkat kekentalan sperma
+ = 1 ; ++ = 2 ; +++ = 3
Jumlah sampel pada masing-masing jenis ikan adalah tiga ekor. Pada hasil
penelitian didapatkan volume spermatozoa ikan mas 1,27 ± 0,47 ml sedangkan
pada ikan patin 1,23 ± 0,21 ml. Hal tersebut dapat mengindikasikan bahwa
volume spermatozoa kedua ikan tersebut hampir sama pada penelitian ini.
Volume spermatozoa dapat dikaitkan dengan sex ratio pada ikan. Sex ratio
adalah seberapa banyak perbandingan spermatozoa antara induk jantan dengan
21
Perbedaan volume semen juga dapat mengindikasikan sex ratio yang dibutuhkan
pada ikan jantan dan betina. Salah satu faktor berhasil tidaknya suatu proses
pembuahan bergantung pada perbandingan spermatozoa dengan sel telur.
Warna semen ikan mas adalah putih susu (Tabel 1) dan warna semen ikan
patin adalah krem-putih susu. Warna krem pada semen mamalia disebabkan
oleh pengaruh riboflavin yang disekresikan oleh kelenjar vesikularis dan
dibawakan oleh suatu gen autosomal resesif dan tidak mempunyai pengaruh
terhadap fertilitas (Toelihere, 1981), pada semen ikan patin ditemukan warna
krem, namun itu bukan merupakan akibat adanya riboflavin, karena riboflavin
hanya ditemukan pada spermatozoa mamalia. Warna krem diduga disebabkan
karena adanya pencampuran dengan feses atau lendir yang keluar dari kulit ikan
pada saat pengambilan sperma. Konsistensi semen yang didapatkan berkisar
sedang pada ikan mas, dan kental ke sedang pada ikan patin.
Tebal tipisnya nilai gerakan massa sperma dilihat dari seberapa banyak
spermatozoa yang terlihat pada mikroskop yang diamati pada 7 sampai 10
lapang pandang, dengan menilai gerakan spermatozoa apakah bergerak secara
individu atau secara kelompok yang padat. Menurut Toelihere (1981) Nilai
gerakan massa +++ adalah sangat baik, terlihat gelombang besar, banyak, gelap,
tebal, dan aktif bagaikan gumpalan awan hitam dekat waktu hujan yang bergerak
cepat berpindah-pindah tempat. Nilai ++ adalah jika terlihat
gelombang-gelombang kecil, tipis, jarang, kurang jelas dan bergerak lamban. Nilai + adalah
jika tidak terlihat gelombang melainkan hanya gerakan-gerakan individual aktif
progresif, dan nilai - adalah jika hanya sedikit atau tidak ada gerakan-gerakan
individual. Penilaian gerakan massa pada pemeriksaan makroskopis gerakan
massa diperoleh rataan sebesar 2,67 (++/+++) pada ikan mas dan 3 (+++) pada
ikan patin yang mengindikasikan sperma ikan patin lebih bergerak aktif (rough)
dibandingkan sperma ikan mas. Hal tersebut dapat dikatakan bahwa dengan
gerakan massa yang lebih aktif, maka spermatozoa pada ikan patin mempunyai
daya gerak yang lebih aktif dan dapat memaksimalkan pergerakan untuk proses
22
Persentase spermatozoa yang motil progresif merupakan parameter
kuantitas spermatozoa sebagai ukuran kesanggupan membuahi sel telur. Dari
hasil penelitian diperoleh sperma motil ikan mas sebesar 75 ± 5 %, dan 78,33 ±
2,89 % pada ikan patin, data tersebut menunjukkan persentase kesanggupan
sperma ikan patin dalam membuahi sel telur lebih besar pada penelitian ini.
Penilaian konsentrasi atau jumlah spermatozoa per mililiter semen
menggambarkan sifat-sifat semen dan digunakan sebagai kriteria penentuan
kuantitas semen. Perbedaan volume semen bergantung kepada keadaan gonad
individu ikan. Pada penelitian ini tidak dilakukan pembedahan pada gonad ikan,
sehingga diduga ikan yang diteliti berada pada tingkat kematangan gonad 3 atau
4, hal ini dikarenakan pada tingkat 1 atau 2, jika dilakukan stripping pada ikan
sperma akan keluar namun kemungkinan sedikit ataupun keluar bersamaan
dengan darah.
Nilai pH pada pengamatan berada pada kisaran antara 7,23 pada
spermatozoa ikan mas dan 7,5 pada ikan patin sedangkan pada ikan hake
(Merluccius merluccius), yaitu 7,6 ± 0,1 (Groison et al., 2010). Nilai tersebut
masuk ke dalam kisaran pH netral. Pada hasil penelitian diperoleh konsentrasi
spermatozoa ikan mas sebesar 11,08 ± 2,16 x 109 ml-1 dan konsentrasi spermatozoa ikan patin sebesar 5,53 ± 3,57 x 109 ml-1 sebagai pembanding, konsentrasi spermatozoa pada ikan cod Atlantik Gadus morhua adalah 3,92 ±
0,74 sampai 29,07 ± 11,76 x 109 spermatozoa ml-1 (Rakitin et al., 1999) dan pada penelitian yang dilakukan Tvedt et al,. (2000) konsentrasi spermatozoa pada ikan
Hippoglossus hippoglossus berkisar antara 200 x 109 sampai 600 x 109 spermatozoa ml-1. Konsentrasi spermatozoa dipengaruhi oleh kematangan seksual ikan jantan, kualitas pakan, kesehatan reproduksi, besar testis, umur,
musim dan perbedaan geografis (Salisbury and Van Demark, 1961). Pada usaha
pembiakan ikan maupun alam bebas, faktor biotik dan non abiotik
mempengaruhi kualitas sperma dan bergantung pada interaksi genetik, fisiologi
23
4.2. Morfologi Spermatozoa
Spermatozoa pada hewan mempunyai pola dasar yang sama, namun
secara morfologi terdapat perbedaan-perbedaan tertentu yang menjadi
karakteristik bentuk sperma pada masing-masing spesies. morfologi
spermatozoa memiliki korelasi dengan fertilitas sehingga keberadaan
spermatozoa abnormal akan berpengaruh terhadap kemampuan jantan untuk
membuahi betina. studi terhadap karakteristik morfologi spermatozoa sebaiknya
diikuti oleh kajian histologi pada organ kelamin jantan, khususnya testis (Barth
and Oko, 1989).
Morfologi spermatozoa ikan mas dan ikan patin diambil dari preparat
yang telah diwarnai dengan pewarnaan Williams dan pengolahan gambar
dengan menggunakan perangkat lunak CorelDraw X4 dan dengan skala yang
telah dikalibrasikan dengan lensa mikroskop pada perbesaran 100x.
(a) (b)
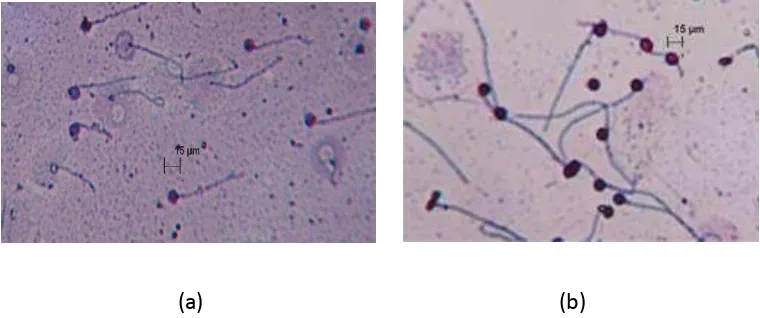
Gambar 4. Morfologi spermatozoa ikan patin (a) dan mas (b).
Gambar diatas menggunakan perbesaran 100x pada mikroskop, dapat
dibandingkan dengan ikan patin, bentuk kepala spermatozoa ikan mas
cenderung lebih bulat, dan ekor yang lebih panjang. Struktur sperma ikan pada
umumnya terdiri dari kepala dan ekor sperma. Kepala sperma berbentuk
cenderung ellips. Ekor sperma terdiri atas midpiece, principal piece, dan
endpiece. Pada kepala sperma terkandung DNA yang membawa sifat genetik dari
24
yang dihasilkan pada induk betina. Sedangkan pada ekor sperma (midpiece)
terdapat sisa-sisa sitoplasma dan mitochondria yang cukup untuk menggerakkan
ekor sperma. Setelah proses spermatogenesis selesai, sperma akan tersimpan
dalam testis. Pada wilayah temperate, spermatogenesis akan sempurna pada
akhir musim panas dan pemijahan terjadi pada musim semi tahun berikutnya,
namun pada wilayah tropis, pemijahan pada ikan bisa berjalan sepanjang tahun
sesuai siklus hidupnya (Billard, 1995).
Umumnya kepala sperma pada gambar berbentuk nyaris bulat
sempurna, dengan ekor yang tidak menggulung kondisi tersebut dapat dikatakan
normal. Namun jika dibandingkan dengan pustaka yang didapat, panjang ekor
sperma tersebut tidak sempurna atau tidak sesuai dengan panjang pada pustaka.
Hal ini diduga karena putusnya sebagian ekor sperma yang disebabkan oleh
proses sentrifugasi yang bertujuan untuk memisahkan fase padatan dan cairan,
karena melalui penelitian pendahuluan, jika tanpa proses sentrifugasi maka
spermatozoa menyebar terlalu soliter sehingga ketika proses pewarnaan, hanya
sedikit sampel individu yang didapatkan. Pada penelitian ini, memakai metoda
Williams yang dimodifikasi dengan proses sentrifugasi pada sampel yang siap
untuk diwarnai, hal tersebut dilakukan karena pada pewarnaan sebelumnya,
spermatozoa ikan yang sudah diwarnai tidak kelihatan secara jelas, maka perlu
pengendapan spermatozoa. Namun hasil yang didapat pada gambar adalah
spermatozoa yang ekornya terputus pada bagian midpiece (bagian ekor tengah)
sampai ke bagian ekor utama (endpiece).
4.3. Morfometri Spermatozoa
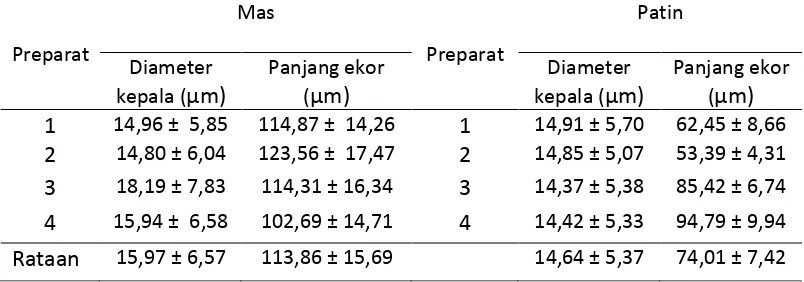
Morfologi spermatozoa ikan diambil berdasarkan panjang diameter
kepala dan panjang ekor pada setiap sel spermatozoa dan dirata-ratakan. Sampel
preparat diambil 46-100 sel tergantung kepadatan pada setiap ulasan.
Pengamatan dilakukan dengan menggunakan mikroskop cahaya dengan
25
Tabel 2. Morfometri spermatozoa ikan Mas dan Patin.
Preparat
ekor sebesar 74,01 dengan simpangan baku sebesar 7,42 μ . Dengan demikian
dapat dilihat bahwa diameter kepala spermatozoa ikan mas dan ikan patin tidak
jauh berbeda, namun panjang ekor spermatozoa ikan mas sedikit lebih panjang
daripada panjang ekor ikan patin, hal tersebut dapat mengindikasikan bahwa
dengan ekor yang lebih panjang, pergerakan massa akan lebih sulit pada ikan
mas, yang dapat menjadi salah satu faktor pembeda pada keberhasilan suatu
proses pembuahan.
4.4. Aplikasi Pengelolaan
Pada ikan mas yang breedingnya secara relatif sinkron atau bersamaan,
maka pada pengelolaan pada perikanan yang bisa diaplikasikan dari penelitian ini
adalah data pada kualitas semen ikan bisa menjadi dasar untuk penentuan sex
ratio antara spermatozoa dengan sel telur untuk bisa menghasilkan bibit yang
optimal ke depannya. Sedangkan pada ikan patin yang breeding antara jantan
dan betina secara tidak bersamaan (Ernawati, 1999) sehingga diperlukan
26
buatan, maka data kualitas semen segar ini bisa menjadi dasar untuk proses
cryopreservasi dan menghasilkan bibit yang optimal dan nantinya untuk produksi
sektor perikanan melalui biologi reproduksi pada kedua ikan tersebut di masa
V. Simpulan dan Saran
5.1. Simpulan
Karakteristik spermatozoa ikan mas dan patin secara umum berbeda.
Volume spermatozoa ikan mas lebih banyak daripada ikan patin. Warna,
konsistensi, gerakan massa dan pH memiliki nilai yang hampir sama. Morfologi
dan Morfometri spermatozoa ikan mas dan patin memiliki bentuk dan ukuran
yang mirip, namun ekor spermatozoa ikan mas lebih panjang. Konsentrasi pada
spermatozoa ikan mas lebih besar daripada ikan patin. Secara keseluruhan, hasil
penelitian ini dapat digunakan sebagai data awal untuk mengetahui karakteristik
spermatozoa ikan secara khusus pada ikan mas dan patin, dan secara umum
sebagai pengelolaan lanjutan dalam produksi benih ikan.
5.2 Saran
Untuk penelitian selanjutnya perlu dilakukan perlakuan terhadap ikan
yang akan diteliti agar didapat informasi yang lebih, yaitu dengan pemeliharaan
terlebih dahulu untuk mendapatkan homogenitas ikan yang diteliti terkait
dengan hubungan antara aspek geografis, pakan, panjang dan berat ikan dengan
karakteristik spermatozoa ikan. Selain itu, juga dilakukan penelitian terhadap
spesies ikan lain agar didapatkan data mengenai spermatozoa ikan yang lebih
DAFTAR PUSTAKA
Arifiantini RI, Wresdiyati T, dan Retnani EF. 2006. Pengujian Morfologi Spermatozoa Sapi Bali (Bos sondaicus) Menggunakan Pewarnaan Willia s . Jur al Pe ge bangan Peternakan Tropis (JPPT). 31(2). 105-110.
Baras E, Slembrouck J, Cochet C, Caruso D, and Legendre M. 2010. Morphological Factors behind the Early Mortality of Cultured Larvae of the Asian Catfish,
Pangasionodon hypophthalmus. Aquaculture 298. 211-219.
Barth AD and Oko RJ. 1989. Abnormal Morphology of Bovine Spermatozoa. Iowa State University Press. Ames. Iowa.
Billard R. 1995. Biology of sperm and artificial reproduction in carp. Aquaculture 129; 112.
Cabrita E, Robles V, and Herraez P. 2008. Methods in Reproductive Aquaculture Marine and Freshwater Species. CRC Press. Boca Raton. New York.
Ernawati Y. 1999. Efisiensi Implantasi Analog LH-RH da 17α-Metil Testosteron serta Pembekuan Semen dalam upaya Peningkatan Produksi Benih Ikan Jambal Siam (Pangasius hypophthalmus). Disertasi. Program Pascasarjana. IPB.
Ginzburg. 1972. Fertilization in fishes and the problem of Polyspermy. Academy of Sciences of the USSR. Institute of Development Biology. Israel Program for Scientific Translations. Jerusalem.
Groison A L. 2010. Sperm Motility in European Hake, Merluccius merluccius, and Characterization of its Spermatozoa Concentration and Volume, Spermatocrit, Osmolality and pH. Aquaculture 301; 31–36.
Hafez E S E. 1987. Reproduction in farm Animals 5th edition. Lea & Febriger. Philadelphia. USA.
Herrick J B and Self H L. 1962. Evaluation of Fertility in the Bull and Boar. Iowa State University Press. Ames. Iowa. USA.
Nikolsky. 1963. The Ecology of Fishes. London. Academic Press.
Rakitin A, Ferguson M, and Trippel E. 1998. Spermatocrit and Spermatozoa Density in Atlantic cod (Gadus morhua): Correlation and Variation during the Spawning Season. Aquaculture 190. 349-358
Rurangwa E, Kime D E, Ollevier F, and Nash JP. 2004. The Measurement of Sperm Motility and Factors Affecting Sperm Quality in Cultured Fish. Aquaculture 234. 1-28.
29
Susanto H. 2008. Budi Daya Ikan Patin. Penebar Swadaya. Jakarta.
Suseno D. 2002. Pengelolaan usaha Pembenihan Ikan Mas. Penebar Swadaya. Jakarta.
Toelihere M R. 1981. Inseminasi Buatan pada Ternak. Penerbit Angkasa. Bandung.
Tuset V M, Dietrich G J, Wojtczak M, Slowinska M, de Monserrat J, and Ciereszko A. 2008. Comparison of Three Staining Techniques for the Morphometric Study of Rainbow Trout (Oncorhynchus mykiss) Spermatozoa. Theriogenology 69.
LAMPIRAN
Lampiran 1.
Rumus perhitungan kepadatan spermatozoa:
Pada setiap ikan, diambil; n = 2 lapang pandang pada chamber dijumlahkan lalu dirata-ratakan
Kepadatan = n (di lapang pandang) x 25 x 106 (individu)
Pengulangan yang terjadi :
Ikan Patin P 1 :
U1 = 194+130= 324/2 =162 x 25 x 10^6= 4050 x 10^6
U2 = 76+138= 214/2 =107 x 25 x 10^6= 2675 x 10^6
U3 = 73+174= 247/2 =123,5 x 25 x 10^6= 3087,5 x 10^6
P1=((4050+2675+3087,5)/3) x 10^6)= 3270,8333 x 10^6 P2 :
U1 = 278+462= 740/2 =370*25*10^6= 9250 x 10^6
U2 = 231+567= 798/2 =399 x 25 x 10^6= 9975 x 10^6
U3 = 325+452= 777/2 =388,5 x 25 x 10^6= 9712,5 x 10^6
P2=((9250+9975+9712,5)/3) x 10^6)= 9645,8333 x 10^6 P3 :
U1 = 146+133= 279/2 = 139,5 x 25 x 10^6= 3487,5 x 10^6
U2 = 116+192= 308/2 = 154 x 25 x 10^6= 3850 x 10^6
U3 = 136+159= 295/2 = 147,5 x 25 x 10^6= 3687,5 x 10^6
31
U1=589+540=1129/2=564,5 x 25 x 10^6=14112,5 x 10^6
U2=624+391=1015/2=507,5 x 25 x 10^6=12687,5 x 10^6
U3=393+643=1036/2=518 x 25 x 10^6=12950 x 10^6
M1=((14112,5+12687,5+12950)/3) x 10^6=13250 x 10^6
M2
U1=553+360=913/2=456,5 x 25 x 10^6=11,412 x 10^6
U2=318+501=819/2=409,5 x 25 x 10^6=10,2375 x 10^6
U3=514+409=923/2=461,5 x 25 x 10^6=11,5375 x 10^6
M2=((11,412+10,2375+11,5375)/3) x 10^6= 11062,33 x 10^6
M3
U1=362+428=790/2= 395 x 25 x 10^6=9875 x 10^6
U2=351+277=628/2=314 x 25 x 10^6=7850 x 10^6
U3=331+396=727/2=363,5 x 25 x 10^6=9087 x 10^6
32
x 10^6 = 11083 x 10^6
1
2x x f
N
2 2 2
) 11083 8937
( ) 11083 11062
( ) 11083 13250
( 3
1
33
Lampiran 2. Sampel morfologi ikan mas dan patin
1.
1. Ikan Mas