VAKSIN INFECTIOUS BURSAL DISEASE (IBD) BERBAGAI
TINGKAT DOSIS
INDRIAWATI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa Thesis Kajian Serologis Dan Molekuler Ayam Pedaging Yang Divaksinasi Menggunakan Vaksin Infectious Bursal Disease (IBD) Berbagai Tingkat Dosis adalah karya saya dengan arahan dari dosen pembimbing serta belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Maret 2012
Indriawati
using Infectious Bursal Disease (IBD) vaccine in different doses.. Under direction of RETNO D. SOEJOEDONO and SRI MURTINI .
Disease of Infectious bursal disease (IBD) is a viral disease that causes economic losses to the poultry industry as it causes high mortality and immunosuppression. IBD disease prevention efforts carried out by means of vaccination and biosecurity. IBD vaccination of day old security needs to be investigated its ability to prevent infection. This study aimed to observe the serological response and clinical condition based on examination of molecular actively vaccinated with IBD vaccine at different dose levels of daily life and challenged with virus field isolates. A total of 180 chickens were divided into four groups: K1 (full dose), K2 (½ Dose), K3 (dose ¼) and K4 (Dose 0). The vaccine used was a live IBD vaccine strains intermediate. Observations carried out on five chickens from each group that includes: antibody titers, the ratio bursa weight/bodyweight and pathology images. Presence of field virus infection and the linical condition due to infection challenge was observed by PCR. Observations made on days 1, 7, 28 and 42. Observations showed that the full dose vaccinated chickens started to show positive antibody formation against IBD at day 28 after vaccination, while in chickens vaccinated with a half and a quarter dose positive antibody titers 42 days post-vaccination. Clinical observations showed that vaccinated chickens various dose levels showed the same clinical symptoms than the control group. Similarly to the results of PCR observations it appears that the chickens from the vaccinated group of IBD viruses detected. The results of this study suggest that active IBD day old vaccination is not effective in preventing infection of the field.
Menggunakan Vaksin Infectious Bursal Disease (IBD) Berbagai Tingkat Dosis. Dibimbing oleh RETNO D. SOEJOEDONO dan SRI MURTINI.
Kebutuhan protein hewani sebagaian besar dipenuhi dari ayam pedaging, Meningkatnya kebutuhan akan protein hewani (daging, telur, susu) diikuti oleh meningkatnya kebutuhan akan vaksin hewan. Akan tetapi masih terdapat kendala penyakit yang masih sering menyerang ternak ayam, diantaranya adalah penyakit
Infectious Bursal Disease (IBD), penyakit Newcastle Disease (ND) dan Infectious Bronchitis (IB). Ketiga penyakit tersebut saling berkaitan karena biasanya setelah ayam terserang IBD maka akan mudah terserang penyakit seperti IB dan ND.
Penyakit Infectious Bursal Disease (IBD) merupakan penyakit viral yang menyebabkan kerugian ekonomi pada industri perunggasan karena menyebabkan kematian tinggi dan imunosupresi. Usaha pencegahan penyakit IBD dilakukan dengan cara vaksinasi dan biosekuriti. Vaksinasi IBD aktif umumnya diberikan pada ayam umur 10-14 hari tergantung pada titer antibodi induknya. Peternak dilapangan memvaksinasi ayamnya untuk kepraktisannya pada umur sehari. Keamanan vaksinasi IBD umur sehari ini perlu diteliti kemampuannya dalam mencegah infeksi. Penyakit Infectious Bursal Disease (IBD) disebabkan oleh Birnavirus yang memiliki RNA utas ganda dan lima protein, yaitu VP1, VP2, VP3, VP4 dan VP5.
Organ target utama virus IBD adalah bursa fabrisius, tempat pemebentuk kekebalan utama pada ayam. Olhe karena itu penyakit ini bersifat imunosupresif, akibatnya, selama hidup ayam mudah terserang penyakit seperti ND dan IB. Penyakit IBD resisten terhadap lingkungan, oleh karena itu letupan akan terjangkitnya penyakit yang terjadi pada suatu peternakan masih dapat terjadi.
Penelitian ini bertujuan untuk mengamati respon serologis dan kondisi klinis berdasarkan pemeriksaan molekuler pada ayam yang divaksin dengan vaksin IBD aktif strain intermediate berbagai tingkat dosis pada umur sehari dan ditantang dengan virus isolat lapang.
Sebanyak seratus enam puluh ekor ayam dibagi menjadi empat kelompok , yaitu K1 (dosis penuh), K2 (Dosis ½), K3 (Dosis ¼ ) dan K4 (Dosis 0). VAksin yang digunakan adalah vaksin virus IBD strain intermediate. Sebanyak 180 ekor ayam dibagi menjadi empat kelompok: K1 (dosis penuh), K2 (Dosis ½), K3 (Dosis ¼) dan K4 (Dosis 0). Vaksin yang digunakan adalah vaksin IBD live strain intermediate.
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
BURSAL DISEASE (IBD) BERBAGAI TINGKAT DOSIS
INDRIAWATI
Tesis
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Master Pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA JURUSAN BIOTEKNOLOGI
INSTITUT PERTANIAN BOGOR
Nama : Indriawati
NIM : P051080071
Disetujui
Komisi Pembimbing
Prof. Dr. Drh. Retno D. Soejoedono, MS Dr. Drh. Hj. Sri Murtini, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Bioteknologi
Prof. Dr. Soeharsono, DEA Dr. Ir. Dahrul Syah, M. Sc. Agr.
Aku persembahkan tesis ini untuk keluargaku yang selalu memberikan kasih, semangat dan penuh dukungan selama menjalankan masa perkuliahan. Untuk ketiga
matahariku: Maraden Pasaribu, Marvel Tiurnauli dan Muammar Awmory Pasaribu yang telah memberikan semangat untuk mama dan juga suami tercinta Juliaman Pasaribu yang terus memberikan dukungan baik moriil dan materiil, serta kedua orang tuaku Ayah H. Achmad Badri dan Ibu Hj. Asmawati yang selalu mendoakan
Alhamdulillah, segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat, nikmat dan karunia-Nya, sehingga penulis dapat menyelasikan penelitian dan penulisan skripsi ini. Shalawat dan salam selalu tercurah kepada Nabi Muhammad SAW beserta keluarga, sahabat dan ummatnya hingga akhir zaman.
Tesis berjudul “Kajian Serologis Dan Molekuler Ayam Pedaging Yang Divaksinasi Menggunakan Vaksin Infectious Bursal Disease (IBD) Berbagai Tingkat Dosis” merupakan salah satu syarat untuk memperoleh gelar Master pada Sekolah Pascasarjana Jurusan Bioteknologi, Institut Pertanian Bogor. Penulis menyadari Thesis ini tidak akan terselesaikan tanpa bantuan dan dukungan dari berbagai pihak. Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada :
1. Prof. Dr. Drh. Retno D. Soejoedono, MS dan Dr. Drh. Hj. Sri Murtini, MSi sebagai pembimbing tesis yang telah banyak memberikan bimbingan, saran dan nasehat serta segala kemudahan dan fasilitas penelitian yang diperoleh selama penelitian hingga penyelesaian penulisan tesis.
2. Selain itu, ucapan terima kasih juga untuk Prof. Dr. Ir. Suharsono, DEA sebagai ketua program studi PS BTK serta seluruh dosen dan staf yang telah memberikan ilmunya selama ini.
3. Keluarga tercinta, Ayah, Ibu serta Adik-adikku yang terus mendoakan dan mendukung selama ini.
4. Dr. Endang T. Margawati (Ketua Kelti), M. Ridwan, Bang Handrie dan kawan-kawan di laboratorium Biologi Molekuler Hewan Pusat Penelitian Bioteknologi-LIPI Cibinong.
5. Rekan-rekan satu angkatan PS BTK Angkatan 2008 (Ari, Eka, Duti, Ety, Dedi dan Pak Zul) atas doa, motivasi, suka duka dan kekeluargaan selama ini.
6. Rekan-rekan MKM-FKH (Ita, Mega, Pak Kuswara, Selyn, Ade, Wahyu dkk) atas bantuan dan semangat yang diberikan selama penelitian berlangsung.
Semua pihak yang telah banyak membantu dalam pelaksanaan penelitian dan penyusunan tesis yang tidak dapat penulis sebutkan satu per satu semoga amal ibadahnya diterima Allah SWT, Amin.
Penulis menyadari masih banyak kekurangan dalam penulisan tesis ini. Saran dan kritik membangun sangat penulis harapkan. Semoga tesis ini dapat bermanfaat bagi kita semua. Amin.
Bogor, Maret 2012
Penulis dilahirkan di Jakarta, pada tanggal 28 April 1974 dari ayah H. Achmad Badri dan Ibu Hj. Asmawati. Penulis merupakan anak pertama dari lima bersaudara.
Penulis melewati pendidikan sekolah dasar (SD) di SDN 09 PAGI Jakarta dan lulus tahun 1986. Pada tahun yang sama penulis melanjutkan ke sekolah lanjutan tingkat pertama (SLTP) di Madrasah Tsanawiyah Darut Tafsir Bogor, lulus tahun 1989 dan melanjutkan ke sekolah menengah umum (SMU) di SMU As-Syafi’iyah 01 Jakarta dan lulus tahun 1992 dan pada tahun yang sama penulis terdaftar sebagai mahasiswa S1 Fakultas Biologi Universitas Nasional Jakarta. Pada tahun 2008, penulis melanjutkan studi S2 di Institut Pertanian Bogor dengan program studi Bioteknologi (BTK).
DAFTAR ISI
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Manfaat ... 3
TINJAUAN PUSTAKA ... 5
Ayam Broiler ... 5
Penyakit Infectious Bursa Disease (IBD) ... 5
Virus IBD di Indonesia ... 9
Imunosupresi ... 10
Deteksi Virus IBD ... 11
Vaksin dan Vaksinasi IBD ... 13
MATEDOLOGI PENELITIAN ... 15
Tempat dan Waktu Penelitian ... 15
Bahan dan Alat Penelitian ... 15
Metodologi Penelitian ... 15
HASIL DAN PEMBAHASAN ... 21
Sebelum Uji Tantang ... 21
Pasca uji Tantan ... 23
Imunosupresi ... 26
Uji Molekuler ... 27
KESIMPULAN DAN SARAN ... 31
DAFTAR TABEL
1. Perlakuan Vaksinasi IBD dan ND Pada Masing-masing Kelompok Ayam…. 16
2. Rataan Berat Bursa Kelompok Ayam... 22
3. Rataan Rasio Berat Bursa (g)/ Berat Badan Kelompok Ayam... 22
4. Rataan Skor Bursa Lesi Masing-masing Kelompok Ayam... 23
5. Pemeriksaan Pathologis Ayam Perlakuan………... 26
DAFTAR GAMBAR
1. Organisasi genom virus IBD... 6
2. Visualisasi struktur virus IBD menggunakan mikroskop electron... 7
3. Pohon filogenetik virus IBD ………... 10
4. Diagram batang titer antibodi IBD hari ke-7 dan 28... 21
5. Diagram batang rataan ELISA-IBD hari ke-42 ...………... 24
6. Gambaran pengamatan patologi anatomi……..………... 26
PENDAHULUAN
Latar Belakang
Kebutuhan protein hewani masyarakat Indonesia saat ini masih tergolong
rendah dibandingkan dengan beberapa Negara ASEAN lainnya. Berdasarkan data
Statistik Peternakan (2010) konsumsi protein hewani masyarakat Indonesia sampai
saat ini baru mencapai 8.5 Kg, sedangkan konsumsi daging ayam hanya 4.5
kg/kapita/tahun. Angka konsumsi tersebut merupakan yang terendah di antara
negara-negara ASEAN. Sumber protein hewani utama saat ini berasal dari ternak
unggas khususnya jenis ayam pedaging (broiler).
Perkembangan industri perunggasan terbukti terus meningkat meskipun
besarannya setiap tahunnya masih berfluktuasi. Masalah utama industri perunggasan
antara lain adalah banyaknya kasus penyakit yang menyebabkan penurunan produksi
daging maupun telur, beberapa penyakit yang sering muncul di dunia perunggasan
diantaranya yaitu dari kelompok penyakit viral seperti Avian Influenza, Newcastle Disease (ND), Infectious Bursa Disease (IBD atau Gumboro), Marek dan penyakit viral lainnya.
Penyakit Infectious Bursal Disease (selanjutnya disebut IBD) menyerang ayam muda berumur sekitar tiga sampai enam minggu. Penyakit ini mudah menular
dan bersifat akut. Penyakit ini dikarakterisasi dengan rusaknya sel limfoid bursa fabricius (Sharma et al. 2000; Cereno 2004). Sejak ditemukannya 40 tahun yang lalu, penyakit ini merupakan masalah yang serius bagi industri unggas komersial.
Dampak ekonomi yang ditimbulkan penyakit ini bermacam-macam, termasuk
kerugian akibat tingginya morbiditas dan mortalitas (Lukert dan Saif 2003). Dampak
lainnya adalah imunosupresi pada ayam yang dapat bertahan terhadap infeksi IBD,
diperburuk dengan infeksi agen penyakit lainnya, menurunnya kemampuan respon
Imunosupresi pada ayam menimbulkan infeksi sekunder yang umumnya berupa
penyakit Newcastle Disease (ND), diketahui penyakit ND juga mempengaruhi
perindustrian unggas. Peternak umumnya melakukan program vaksinasi bersamaan
untuk penyakit IBD dan ND.
Tindakan pencegahan terhadap penyebaran virus IBD telah dilakukan dengan
vaksinasi. Berbagai penelitian telah dilakukan berkaitan dengan efektifitas, efikasi,
efek samping dan daya imunogenik vaksin. Usaha pencegahan penyakit IBD dengan
vaksinasi banyak mengalami kegagalan (Partadiredja et al. 1981) dan kegagalan ini diduga disebabkan oleh adanya perbedaan struktur antigen antara subtipe (varian)
virus IBD dalam serotipe yang sama (Partadiredja dan Soejoedono 1997). Virus
varian mampu meniadakan kekebalan ayam yang divaksinasi.
Babiker et al. (2008) telah melakukan evaluasi terhadap vaksin komersial terhadap ayam komersial, namun masih terjadi outbreak pada sebagian populasi ayam
komersial tersebut. Coletti et al. (2001) telah melakukan penelitian mengenai efikasi dan keamanan vaksinasi intermediate secara in ovo. Vaksinasi dapat memproteksi infeksi virus pada ayam SPF dan memberikan proteksi sebagian pada ayam
komersial.
Vaksin yang beredar saat ini adalah vaksin IBD galur intermediate, disebabkan galur virus lapang yang ada di Indonesia adalah galur yang ganas. Vaksin galur mild
kurang memberikan respon terhadap infeksi penyakit IBD. Oleh karena itu dibuat
vaksin lokal dari galur intermediate (Bahri dan Kusumaningsih 2005)
Vaksinasi umumnya diberikan pada umur dua minggu, dimana saat titer
antibody asal induk sudah menurun. Kenyataan di lapang menunjukkan bahwa kasus
IBD sering terjadi pada ayam dengan umur dibawah 2 minggu. Oleh karena itu pada
penelitian ini, akan diuji vaksinasi dengan vaksin IBD intermediate live pada ayam umur sehari dengan berbagai tingkatan dosis dan diuji dengan virus IBD galur
lapang. Respon akibat vaksinasi tersebut diharapkan dapat memberikan gambaran
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengamati respon serologis dan
kondisi klinis berdasarkan pemeriksaan molekuler pada ayam yang divaksin dengan
vaksin IBD aktif galur intermediate berbagai tingkat dosis pada umur sehari dan ditantang dengan virus galur lapang.
Manfaat Penelitian
Dari hasil penelitian ini, dengan mengetahui dosis yang tepat pada ayam
pedaging umur sehari yang divaksinasi dengan vaksin IBD galur intermediate berbagai tingkatan dosis diharapkan dapat menjadi acuan bagi peternak dalam
TINJAUAN PUSTAKA
Ayam Pedaging
Ayam ras pedaging disebut juga broiler, yang merupakan jenis ras unggulan hasil persilangan dari bangsa-bangsa ayam yang memiliki daya produktivitas tinggi,
terutama dalam memproduksi daging ayam. Sebenarnya ayam pedaging baru
populer di Indonesia sejak tahun 1980-an dimana pemegang kekuasaan
mencanangkan penggalakan konsumsi daging ruminansia yang pada saat itu semakin
sulit keberadaannya.
Pedaging adalah istilah untuk menyebutkan galur ayam hasil budidaya
teknologi yang memiliki karakteristik ekonomis dengan ciri khas yaitu pertumbuhan
yang cepat, konversi pakan yang baik dan dapat dipotong pada usia yang relatif muda
sehingga sirkulasi pemeliharaannya lebih cepat dan efisien serta menghasilkan daging
yang berkualitas baik (Rasyaf 2008).
Menurut Hardjoswaro dan Rukmiasih (2000), ayam pedaging dapat
digolongkan kedalam kelompok unggas penghasil daging artinya dipelihara khusus
untuk menghasilkan daging. Umumnya memiliki ciri-ciri sebagai berikut: kerangka
tubuh besar, pertumbuhan badan cepat, pertumbuhan bulu yang cepat, lebih efisien
dalam mengubah ransum menjadi daging.
Penyakit Infectious Bursa Disease (IBD)
Tahun 1957 AS Cosgrove menemukan sindrom yang terjadi di peternakan
ayam pedaging dekat Gumboro, Delaware. Sindrom ini kemudian dikenal dengan
penyakit Gumboro karena daerah tempat penyakit yang mula-mula terjadi.
Penyakit ini sangat penting di dunia perunggasan karena terjadi kematian
yang tinggi pada ayam muda (umur 3–6 minggu) dan merupakan penyakit
imunosupresif apabila terjadi secara subklinis akan mengakibatkan reaksi terhadap
vaksinasi rendah, serta ayam akan mudah terkena infeksi bakteri, protozoa, dan virus
Virus IBD tergolong kedalam keluarga Birnaviridae dari genus Abivirnavirus
(Huang et al. 2004). Nama genus Birnaviridae dimaksudkan untuk menggambarkan virus yang memiliki dua segmen RNA utas ganda (Muller et al. 2003) dan dikelilingi oleh protein capsid berbentuk icosahedral simetri (Van Den Berg et al. 2004). Panjang segment A adalah 3.2 Kb sementara segmen B lebih pendek yaitu 2.8 Kb.
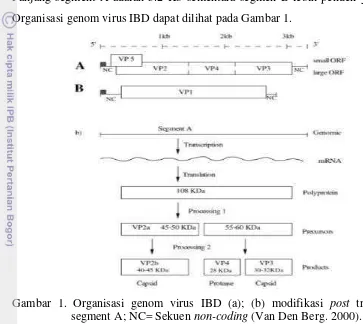
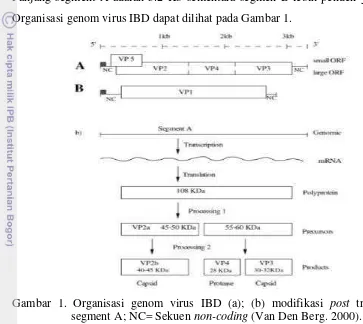
Organisasi genom virus IBD dapat dilihat pada Gambar 1.
Gambar 1. Organisasi genom virus IBD (a); (b) modifikasi post translasi ORF segment A; NC= Sekuen non-coding (Van Den Berg. 2000).
Pada segmen A terdapat dua open reading frames (ORF). Utas tambahan pada segmen A memiliki monocistronic ORF yang panjangnya 3.039 pb (Van Den Berg 2000). Mundt et al. (2003) mengemukakan bahwa ORF yang pendek dengan panjang basa 438 pb sebagian bertumpuk pada ujung 5’ ORF pertama dan menyandikan
protein nonstruktural VP5. Genome segmen B menyandikan VP1 (Boot et al. 2000). Protein ini bertanggung jawab terhadap sintesis mRNA dan replikasi genomnya, lebih
lanjut ditunjukkan bahwa VP1 memiliki pengaruh pada efisiensi replikasi viral dan
Lejal et al. (2000) mengkarakterisasi lima protein virus IBD melalui analisa SDS-PAGE, yaitu VP1 (90 Kd), VP2 (40 Kd), VP3 (35 Kd), VP4 (28 Kd) and VP5
(21 Kd). VP1 memiliki polymerase dan aktivitas penangkapan enzim (Boot et al.
2000). Protein VP2 mengandung daerah antigenik yang bertanggung jawab untuk
memicu netralisasi antibodi dan spesifisitas serotipe (Sharma et al. 2000).
Protein VP3 merupakan protein kedua dan menyusun sekitar 40% serta
mengandung kelompok antigen spesifik dan sumber netralisasi antibodi (Becht dan
Muller 1991). Baik protein VP2 maupun VP3 bertanggung jawab terhadap integritas
struktur virus. Protein VP4 (6%) dan VP1 (3%) merupakan protein yang kecil yang
menyusun protein virus. Protein VP5 dikodekan oleh ORF kedua yang sebagian
bertumpuk (overlapping) dengan ORF kedua (Yao dan Vakharia 2001). Lombardo et al. (2000) mengamati bahwa ekspresi VP5 pada sistem sel berbeda menyebabkan efek sitotoksis hebat yang menghasilkan sel lisis dan disimpulkan bahwa VP5
berfungsi sebagai mematikan protein dan fungsi pada pelepasan virus.
Struktur virus IBD adalah non-envelop dengan diameter 60nm dan memiliki berat jenis 1.336 g/ml di CsCl (Kibenge dan Dharma 1997). Capsid pada virion
mengandung lapisan tunggal 32 capsomer disusun dengan 5:3:2 secara asimetri (Hirai
dan Shimakura 1974). Visualisasi struktur virus IBD dapat dilihat pada Gambar 2.
Penyebaran Virus IBD pada ayam komersial melalui infeksi secara oral atau
pernafasan. Virus berpindah dari lambung ke jaringan lainnya lewat sel phagositis
seperti makrofag. Di dalam usus makrofag berasosiasi dengan jaringan yang dapat
dideteksi awal sekitar 4 jam setelah inokulasi oral menggunakan immunofluoresen
(Van Den Berg et al. 2000). Lebih lanjut dikatakan oleh Van Den Berg et al. (2000). Virus kemudian mencapai bursa lewat darah dimana virus akan bereplikasi. Setelah
13 jam PI (post inoculation) ditemukan bahwa folikel terdapat virus IBD selanjutnya
pada 16 jam PI kedua jelas terjadi viremia disertai dengan replikasi kedua pada organ lainnya yang dapat menyebabkan penyakit dan kematian.
Menurut Cereno (2004), sampai saat ini terdapat tiga galur virus IBD yang
dapat dibedakan dari gejala klinisnya yaitu galur klasik, galur variant dan galur sangat
virulen atau disebut juga vvIBD. Galur sangat virulen secara antigenik berhubungan dengan galur klasik dan secara antigenik berbeda dari galur varian dan virus serotipe
2 (Abdel-Alim and Saif 2001).
Organ target virus IBD adalah bursa fabricius (BF). BF mencapai perkembangan maksimum antara umur 3-6 minggu dan pada saat itu ayam rentan
terhadap penyakit. Infeksi menghasilkan mortalitas tinggi selama masa akut penyakit
atau penurunan sel B setelah masa penyembuhan dari penyakit (Van Den Berg 2000;
Lukert dan Saif 2003). Ayam yang terinfeksi dengan virus IBD ketika berumur lebih
dari 12 minggu tidak menunjukkan gejala klinis (Van Den Berg 2000).
Sel IgM termasuk target virus IBD. Selama fase akut penyakit IBD, bursa
akan atrofi disebabkan sel B folikel bursa kosong. Replikasi virus menyebabkan kerusakan yang luar biasa pada sel limfoid dalam medulla dan daerah cortical folikel. Apoptosis sel B tetangga menambah kerusakan pada morfologi bursa. Pada saat yang
bersamaan, sejumlah antigen viral dapat dideteksi pada organ lainnya (Kim et al.
2000).
Produksi antibodi distimulir pada situs awal replikasi viral didalam usus
cepatnya serbuan antibodi, foci necrosis yang terbentuk di dalam BF terhenti berkembang dan sepenuhnya dieliminasi (Van Den Berg et al. 2004)
Virus ini tahan terhadap keadaan fisika maupun bahan kimia. Sehubungan
dengan kestabilan dan kekuatannya, virus ini mempunyai resistensi terhadap berbagai
macam desinfektan dan faktor – faktor lingkungan lainnya. Virus IBD akan tetap
memiliki kemampuan menginfeksi sekurangnya selama 4 bulan di dalam lingkungan
kandang ayam (Butcher dan Miles 2009). Virus ini tidak aktif pada pH 12, tahan
terhadap suhu 370C selama 90 menit dan 560C selama 5 jam (Lukert and Saif 2003).
Virus IBD di Indonesia
Rudd et al. (2002) telah mendapatkan sekuen nukleotida yang lengkap dari virus IBD lapangan Indonesia isolat Tasik 94 serta sekuen asam amino dari segmen
genom A dan B. Hasil sekuen menunjukkan adanya kemiripan dengan galur vvIBD
yang beredar di Eropa, memiliki homologi nukleotida yang sangat besar (99,7 %)
dengan vvIBD galur Belanda, yaitu D6948.
Parede et al. (2003) juga telah mengkarakterisasi virus IBD di Indonesia sebagai galur sangat virulen berdasarkan keunikan perubahan genetiknya, sedangkan
Suwarno dan Rahardjo (2005) telah mengisolasi virus IBD di Lamongan dan Kediri,
Jawa Timur. Diketahui bahwa berat molekul VP2 virus IBD dari daerah Jawa Timur
adalah 44 kDa serta bersifat imunogenik yang dapat memicu produksi antibodi
spesifik.
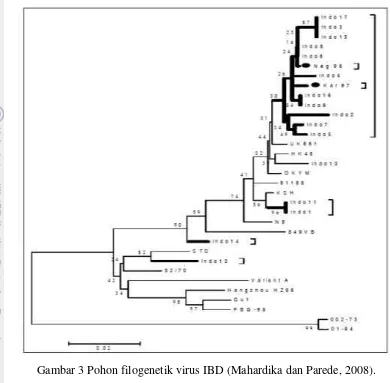
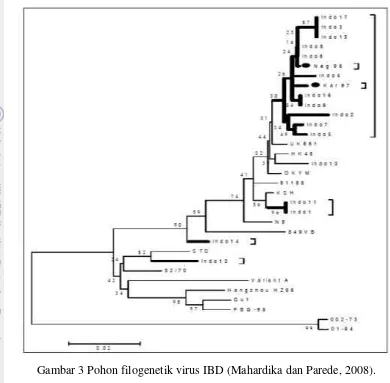
Mahardika dan Parede (2008), membandingkan sekuen virus IBD galur
BalKar97 dan Neg98 dengan sekuen virus IBD di Indonesia (Rudd et al. 2002) serta sekuen virus IBD berbagai negara pada GenBank menggunakan piranti lunak
CLUSTALW (MEGA3.1). Pada Gambar 3 dapat dilihat pohon filogenetik hasil
analisis yang membagi dua kelompok virus IBD yaitu kelompok Amerika-Eropa dan
Australia. Sebagian besar virus IBD Indonesia masuk dalam kelompok virus sangat
virulen (vv-IBD), satu galur Indo 13 masuk dalam kelompok klasik dan sangat dekat
dengan virus klasik Amerika, STC. Dikatakan bahwa keragaman virus IBD di
Gambar 3 Pohon filogenetik virus IBD (Mahardika dan Parede, 2008).
Imunosupresi
Imunosupresi adalah suatu kondisi terjadinya penurunan reaksi pembentukan
zat kebal tubuh atau antibodi akibat kerusakan organ limfoid. Penurunan jumlah
antibodi dalam tubuh, keadaan ini menyebabkan berbagai agen penyebab penyakit
akan lebih leluasa masuk dalam tubuh ayam dan terjadilah infeksi. Hal tersebut akan
menyebabkan adanya gangguan pertumbuhan dan produksi.
Tanda-tanda terjadinya kasus imunosupresi adalah performa produksi yang
jelek dari suatu flok peternakan, akibat terjadinya kematian dalam jumlah banyak,
pencapaian berat badan rendah, konversi pakan rendah dan keseragaman
meningkatnya gangguan pernafasan pada unggas setelah vaksinasi dan terjadinya
wabah penyakit pada suatu peternakan. Hal tersebut dapat disebabkan adanya reaksi
suboptimal terhadap vaksinasi. Gambaran perubahan patologi anatomi pada kasus
imunosupresi adalah terjadinya atrofi pada bursa fabricius dan rasio perbandingan ukuran antara bursa fabrisius dengan limpa. ukuran bursa fabrisius yang sama atau lebih kecil dari limpa, pada lima minggu pertama umur ayam, dapat mengindikasikan
bahwa telah terjadi kasus imunosupresi (Sharma et al. 2000).
Efek imunosupresi virus IBD bergantung pada galur virus yang
menginfeksinya. Ayam terinfeksi virus IBD pada umur muda dapat mengalami
kematian karena infeksi lain seperti hepatitis, reovirus, coccidiosis, Marek, hemorrhagic-aplastic anemia dan dermatitis, infectious laryngotracheitis, infectious bronchitis, chicken anemia agent, salmonellosis, Escherichia coli, colibacillosis, Mycoplasma synoviae dan Eimeria tenella (Ming et al. 2000).
Deteksi Virus IBD
Serologi
Uji secara serologi yang umum digunakan untuk mendeteksi virus IBD adalah
Enzymed Linked Immunosorbent Assay (ELISA), Virus Neutralization (VN) dan
Agarose Gel Precipitation (AGP). ELISA adalah uji yang paling umum digunakan untuk mendeteksi antibodi terhadap virus IBD. Uji ini ekonomis, sederhana, cepat
dan dapat menguji sampel dalam jumlah banyak pada waktu yang bersamaan dan
dapat diautomasikan pada perangkat lunak komputer (Alkhalaf 2009). ELISA juga
dapat mengkuantifikasi antibodi terhadap virus IBD sehingga dapat digunakan untuk
mengamati status kekebalan suatu populasi ayam untuk mengamati respon vaksinasi
serta ekspos alami di lapang dan titer ntibodi asal induk (Wang et al. 2008). ELISA tidak dapat membedakan antibodi spesifik dua serotipe virus, umumnya virus dengan
serotipe 2 yang tersebar pada ayam komersial dan dapat menimbulkan kesan
tingginya tingkat antibodi populasi ayam tersebut (Ashraf et al. 2006).
Uji VN dapat membedakan serotipe 1 dan 2 virus IBD serta dapat membedakan
serotipe 1 yang telah diidentifikasi dengan uji VN. Titer VN yang akurat
mencerminkan daya proteksi relatif ayam terhadap virus IBD. Penelitian proteksi
silang secara in vivo dapat digunakan untuk mendeteksi perbedaan antigenik antar galur virus dan mendeterminasi imunogenisitas virus dan mengamati respon inang
secara lengkap (Jackwood et al. 2001).
Metode lain yang digunakan untuk mendeteksi virus IBD adalah dengan uji
Agarose Gel Presipitasi (AGP), Uji ini merupakan uji kuantitatif yang cepat, tetapi
tidak sensitif. AGP tidak dapat mendeteksi perbedaan serotipe dan mengukur
permulaan antigen soluble kelompok-spesifik (Lukert dan Saif 2003).
Molekuler
Penelitian secara in vivo untuk membedakan galur virus IBD membutuhkan waktu lama dan mahal. Oleh karena itu karakterisasi galur virus IBD dilakukan secara
molekuler karena lebih efisien, cepat dan akurat (Jackwood dan Sommer-wagner
2010; Mardassi et al. 2004 dan Rudd et al. 2002). Penelitian terhadap galur virus yang virulen di Indonesia secara molekuler telah dilakukan oleh Parede et al. (2003) dan Rudd et al. (2002). Keduanya menyatakan bahwa virus IBD di Indonesia adalah virus galur virulen yang memiliki mutasi substitusi asam amino serin pada posisi 222.
Analisa RT-PCR dan RFLP telah secara ekstensif digunakan untuk mendeteksi dan
mendiagnosa galur virus IBD oleh Ozbey et al. (2003).
Jackwood dan Sommer-wagner (2002) membagi kelompok virus IBD
berdasarkan pada situs ensim restriksi, yang berasal dari mutasi nukleotida yang tidak
selalu merubah asam amino. Berdasarkan profil RFLP dan sekuen nukleotida dapat
digunakan untuk memprediksi perbedaan antara galur IBD, namun pengujian in vivo
penting untuk mendeteksi perbedaan antigenik yang aktual. Banda dan Villegas
(2004) menggunakan metode molekuler untuk membedakan antara galur klasik,
varian dan sangat virulen, selain itu juga dapat mendeteksi perbedaan subtipe antigen
Teknik ini lebih sensitif, spesifik, lebih murah serta dapat digunakan untuk diagnosis,
penapisan dan pengamatan pada populasi ayam (Caterina et al. 2004).
Vaksin dan Vaksinasi IBD
Prinsip utama vaksinasi terhadap penyakit adalah vaksin tersebut harus dapat
menstimulasi pembentukan antibodi secara cepat dan tinggi. Tindakan pencegahan
penyakit lainnya dilakukan dengan tindakan biosekuriti yang ketat untuk mencegah
jumlah virus lapang lebih besar dari jumlah antibodi yang terbentuk dalam tubuh
ayam. Jumlah virus lapang yang tidak dapat diperkecil oleh tindak biosekuriti akan
menyebabkan titer antibodi yang dihasilkan oleh vaksin akan tidak mampu untuk
mencegah terjadinya penyakit.
Butcher dan Miles (2009), telah membagi vaksin IBD menjadi tiga kategori
berdasarkan patogenisitas virus, yaitu mild, intermediate dan virulent. Tipe virus IBD
intermediate adalah yang paling umum digunakan sebagai seed vaksin. Vaksin ini dapat menstimulir ayam pedaging untuk menghasilkan antibodi lebih cepat daripada
vaksin tipe-mild, tanpa kerusakan yang signifikan pada bursa dibandingkan dengan penggunaan vaksin tipe virulent.
Pada umumnya vaksinasi IBD dilakukan pada umur muda, mulai telur/embrio
sampai ayam berumur 5 minggu. Vaksinasi dilakukan dengan tujuan mencegah atau
menurunkan masalah infeksi virus dari lapangan. Tujuan yang kedua adalah untuk
menaikkan status kebal dari ayam. Umumnya anak ayam mendapatkan perlindungan
antibodi asal induk sampai umur 2-5 minggu. Perkembangan sistem kekebalan
menjadi lebih matang dengan meningkatnya umur dan titer antibodi asal induk akan
turun hingga 0 secara alamiah. Kondisi inilah yang dinamakan dengan penurunan
antibodi asal induk (Saif 2002).
Tindakan pencegahan infeksi IBD lainnya adalah menggunakan vaksin virus
rekombinan. Vaksin ini dirancang untuk menghindari interferensi antibodi asal induk.
Vaksin rekombinan ini biasanya berdasarkan insersi gen yang mengkodekan protein
kedalam vector pET21a dan ditranformasikan ke dalam sel Eschericia coli. Vaksinasi dengan vaksin rekombinan ini digunakan secara intramuscular. Zhou et al. (2010) melakukan penelitian menggunakan vaksin protein rekombinan IBDV-VP2 pada
ayam pedaging dan ayam white leghorn (SPF) di Beijing. Dinyatakan bahwa ayam
SPF dan ayam pedaging yang divaksinasi oleh protein rekombinan memiliki daya
proteksi yang lebih stabil dan aman dibandingkan dengan ayam yang divaksin oleh
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Tempat penelitian dilakukan di Laboratorium Unit Pelayanan Mikrobiologi
Terpadu, Bagian Mikrobiologi Kesehatan, Departemen Ilmu Penyakit Hewan dan
Kesehatan masyarakat veteriner, Fakultas Kedokteran Hewan dan Kandang terpadu
Kampus IPB Dramaga, Bogor. Penelitian dilakukan mulai dari Bulan September –
November 2011
Bahan dan Alat Penelitian
Ayam pedaging umur sehari (DOC) beserta pakan, vaksin IBD Blend M galur intermediate komersial, Virus IBD isolat lapang (Balitvet), ELISA kit IBD (Biocheck), RNEasy Protect Mini Kit QIAGEN, Access quick RT-PCR System
(PROMEGA), Plat ELISA dan ELISA Reader
Metode Penelitian
Hewan coba.
Seratus enam puluh ekor DOC digunakan pada penelitian ini. Sebanyak dua
puluh ekor DOC ditimbang dan diambil sampel darahnya. Ayam dimatikan dan
diambil organ BFnya ditimbang dan diamati kondisinya. Selanjutnya sisa ayam
sebanyak 140 ekor dibagi menjadi empat kelompok dengan 35 ekor setiap
kelompoknya. Pembagian kelompok ayam percobaan dilakukan secara random
(Tabel 1).
Kelompok Percobaan dan Vaksinasi.
Kelompok K1, K2, dan K3 diberikan vaksin IBD aktif galur intermediate
dengan dosis vaksinasi 102 EID50 (untuk dosis penuh), 50 EID50 (dosis ½) dan 25
EID50 (dosis ¼), kelompok K4 divaksinasi dengan ND tetes tetapi tidak divaksin
Tabel 1 Perlakuan vaksinasi IBD dan ND pada masing-masing kelompok ayam
Uji Tantang dengan Virus IBD.
Isolat virus IBD lapang lokal diperoleh dari Balai Besar Penelitian Veteriner
(BBALITVET), Cimanggu, Bogor. Virus IBD diinfeksikan pada ayam umur 28 hari
sebanyak 0.2ml/oral/ekor. Ayam yang ditantang ditempatkan dalam kandang
terpisah.
Peubah yang diamati.
Parameter yang digunakan untuk mengamati efek vaksinasi dan uji tantang
dengan virus IBD adalah dengan mengambil sampel darah, penimbangan bobot
badan, sampling bursa fabricius, limpa. pengamatan gejala klinis dan kematian. Uji
serologi dengan uji HI untuk deteksi antibodi terhadap ND dan ELISA untuk deteksi
antibodi anti IBD serta konfirmasi keberadaan virus IBD secara molekuler.
Peubah yang diamati meliputi :
1. Bobot Badan dan Bursa Fabricius.
Penimbangan bobot badan (g) dan bursa (g) dilakukan pada setiap individu
kelompok percobaan seminggu sekali. Rasio bobot badan dan bursa dihitung
dalam satuan persen. Hasil perhitungan pada setiap kelompok percobaan dibuat
grafik. Rumus perhitungan ratio Bursa Fabricius menurut European Pharmacopoeia 5.0 (2005) dengan bobot badan sebagai berikut:
Ratio Bursa Fabricius dengan bobot badan = Bursa Fabricius (g) x 100%
2. Titer antibodi terhadap IBD
Pengambilan sampel darah dimulai pada hari ke-0 untuk mengetahui tingkat
antibodi asal induk (maternal antibody=MA). Masing-masing kelompok ayam
percobaan pada hari ke-7 dan 28 (sebelum diuji tantang) dan pada hari ke-42
(setelah uji tantang, akhir dari penelitian), diambil sepuluh ekor dan diambil
darahnya untuk dikoleksi serumnya. Darah yang dikoleksi disimpan dalam lemari
pendingin selama semalam supaya sel darah merah dan serum ayam terpisah.
Serum ayam disimpan dalam tabung mikro 1.5 ml steril pada suhu -20OC sampai
akan dianalisa selanjutnya.
3. Perubahan patologis
Gambaran patologis ayam percobaan diamati pada hari ke 7, 28 dan 42 setelah
vaksinasi dan penantangan. Perubahan patologi dicatat dan diskoring.
Uji Serologis
Uji Haemagglutinasi – Inhibisi (HI).
Seluruh sumur microplate V bottom 1-12 diisi dengan PBS steril masing-masing 25 l. Serum yang akan diuji dan masukkan kedalam sumur pertama sebanyak 25 l kemudian lakukan pencampuran serum dengan PBS pada sumur pertama
dengan cara mengambil dan mengeluarkan cairan tersebut dengan pipet mikro
sebanyak lima kali sebanyak 25 l dari sumur pertama kemudian pindahkan ke
sumur kedua dan lakukan pencampuran seperti di atas, selanjutnya pindahkan 25 l ke sumur ke- 3, begitu seterusnya sampai sumur ke 12. Larutan pada sumur
ke- 12 diambil 25 l dan dibuang. Seluruh sumur selanjutnya ditambahkan
suspensi virus standar (4 HAU) masing-masing 25 l Microplate digoyang-goyang kemudian diinkubasikan pada suhu 4oC selama 60 menit. Selanjutnya
ditambahkan 25 l suspensi sel darah merah 1% ke dalam seluruh sumur.
hasil saat kontrol positif sudah membentuk drop eye. Hasil pembacaan uji HI dihitung titernya dan dibuat nilai rata-rata Geometric Titre Mean (GMT).
Uji ELISA-IBD.
ELISA dilakukan mengikuti prosedur kit ELISA IBD dari Biocheck(Babiker,
2008b). Serum sampel diencerkan dengan perbandingan 1:500 dengan bufer
pengencer. Kontrol negatif dimasukkan pada lubang A1 dan A2 pada plate yang
sudah ditempeli dengan antigen, kontrol positif pada A3 dan A4. Reference
Kontrol berada pada lubang A5. Serum yang telah diencerkan dimasukkan pada
lubang A6, A7, A8 dan seterusnya. Plate tersebut diinkubasi pada suhu 22-270C selama 30 menit. Selanjutnya dicuci selama 3-5 kali dan ditambahkan konjugat
pada semua lubangnya. Inkubasi juga dilakukan selama 30 menit pada suhu yang
sama. Setelah itu plate dicuci 3-5 kali, dan diteruskan dengan penambahan substrat
dan diinkubasi selama 15 menit. Pada saat inkubasi tepat 15 menit, ditambahkan
stop solution untuk menghentikan reaksi pada plate. Selanjutnya plate dibaca absorbansinya, yang kemudian dikonversikan ke dalam titer. Pembacaan hasil
ELISA dilakukan dengan melewatkan plat ELISA pada mesin ELISA pada
panjang gelombang 405nm. Hasil absorbansi yang muncul dibandingkan dengan
standar yang sudah ditetapkan menurut petunjuk yang ada pada kit tersebut dan
dibuat rata-rata nilai Geometric Titre Mean (GMT).
Uji Molekuler
Pengujian secara molekuler dilakukan untuk mengkonfirmasi virus yang
menginfeksi ayam adalah virus IBD. Primer yang digunakan untuk pengujian ini
adalah spesifik untuk virus IBD.
Isolasi RNA. Total RNA diperoleh dari organ BF menggunakan kit RNEasy
Protect Mini Kit, QIAGEN mengikuti prosedur yang disarankan. Sebanyak 30 mg organ Bursa fabricius digerus bersama dengan nitrogen cair menggunakan mortar
500µl bufer lisis kemudian disentrifugasi dengan kecepatan 12.000rpm selama 1
menit. Supernatan yang terbentuk di pindahkan ke tabung mikro baru dan steril
secara hati-hati dengan pipet mikro. Ke dalam tabung ditambahkan 500µl bufer
RLT dan pipetted supaya homogen. Sebanyak 750 µl campuran ini dimasukkan kedalam kolom QIAGEN dan diinkubasi pada suhu ruang selama 1 menit
selanjutnya disentrifugasi dengan kecepatan 12.000 rpm selama 1 menit,
selanjutnya kedalam kolom ditambahkan 750 µl bufer pencuci RW dan
disentrifugasi kembali dengan kecepatan 12.000rpm selama 3 menit. Pencucian
kolom dilakukan sebanyak dua kali. Ke dalam kolom ditambahkan bufer elusi
sebanyak 50µl dan disentrifugasi dengan kecepatan 12.000 rpm selama 1 menit.
Hasil elusi (total RNA) digunakan untuk proses RT-PCR.
Reverse transcription-PCR (RT-PCR). Uji RT-PCR dilakukan menggunakan pasangan primer yang mengamplifikasi daerah 672pb vVP2 (Li et al. 2009).
Primer forward yang digunakan yaitu 5’-GCCGATGATTACCAATTCTCATC-3’
dan primer reverse 5’-CCGGATTATGTCTTTGAAGC-3’. Pereaksi RT-PCR menggunakan RT-PCR Access Quick (PROMEGA), sebagai berikut: 5x AMV Tfl PCR Buffer; 10mM dNTP mix; 25mM MgSO4; 10pmol Primer F; 10 pmol primer
R; 5U/ul Tfl Polymerase. Campuran PCR diinkubasi pada suhu 42oC selama 45 menit. cDNA sebagai cetakan DNA diamplifikasi pada PCR sebanyak 36 siklus
pada 95oC selama 1 menit , 56oC selama 45 detik dan 72oC selama 50 detik. Suhu
perpanjangan akhir 72oC selama 10 menit .
Hasil RT-PCR dilewatkan pada 2% gel agarose dalam 1x TBE, bufer yang
digunakan adalah 1x TBE. Voltage yang digunakan yaitu 100V selama 60 menit.
HASIL DAN PEMBAHASAN
Hasil pengamatan terhadap semua kelompok ayam sebelum vaksinasi
menunjukan bahwa ayam yang digunakan memiliki antibodi terhadap IBD cukup
tinggi dan seragam dengan titer antara 3.584–3.585. Antibodi yang terdeteksi tersebut
merupakan antibodi asal induk. Tingginya titer antibodi asal induk disebabkan anak
ayam masih memperoleh IgY yang berasal dari kuning telur yang diturunkan dari
induk ke anak melalui kuning telur (Lukert dan Saif 2003). Antibodi asal induk yang
tinggi dapat menetralisir serangan virus asal lapang/lingkungan.
Sebelum Uji Tantang
Hasil pengamatan bedah bangkai dan pemeriksaan patologis hari ke-0
(sebelum perlakukan dimulai) tidak menunjukkan adanya perubahan pada organ BF
(ayam dalam kondisi normal). Hal ini diperkuat dengan tidak adanya lesi pada bursa
(skor bursa lesi = 0). Selain itu pada ayam tidak tampak adanya paparan virus IBD
lapang maupun penyakit lainnya. Respon kekebalan tubuh ayam pada hari ke-7 dan
28 setelah vaksinasi dapat dilihat pada Gambar 4.
Gambar 4 Diagram batang titer antibodi terhadap IBD pada hari ke-7 dan 28.
Hasil pengamatan menunjukan bahwa rataan titer antibodi hari ke-7 pada
kelompok yang tidak divaksin (K4) lebih tinggi (4.608) dibandingkan dengan
kelompok K1 (2.894) dan K2 (3.860) dan K3 (2.976) yang divaksinasi. Tingginya
rataan titer antibodi pada ayam kelompok K4 (dosis 0) hari ke-7 disebabkan masih
terdapat antibodi asal induk dan bukan merupakan antibodi yang terbentuk dari hasil
dengan pernyataan Cookson (2011), bahwa paruh waktu antibodi asal induk (MA)
adalah 6-8 hari. Ayam yang divaksin (kelompok K1, K2 dan K3,) antibodi asal induk
mengalami penurunan diduga karena ada netralisasi virus vaksin yang masuk oleh
antibody asal induk sehingga menurunkan rataan titernya. Dengan demikian antibodi
menjadi lebih rendah dibandingkan K4.
Pada Gambar 4, menunjukkan hasil pemeriksaan titer antibodi IBD pada
pengamatan hari ke-28 dari kelompok K1 (dosis penuh) memiliki titer antibodi yang
paling tinggi (3.899), dibanding kelompok ayam yang divaksin dengan setengah dan
seperempat dosis. Kelompok 1 dengan dosis penuh akan memberikan repson
kekebalan tubuh yang maksimal dibandingkan kelompok lainnya. Rendahnya jumlah
antigen vaksin IBD yang diberikan pada ayam kelompok K2 dan K3 tidak mampu
menginduksi kekebalan yang cukup. Hal itu tampak dari titer antibodi kelompok K2
dan K3 yang rendah bahkan lebih rendah daripada kelompok ayam yang tidak
divaksin. Pada kelompok K4 titer antibodinya menurun karena antibodi induk telah
termetabolisme dan mulai menghilang setelah umur 14 hari. Rendahnya antibodi pada
kelompok K2 dan K3 selain berkaitan dengan rendahnya antigen vaksin yang masuk,
juga terkait dengan mengecilnya BF dari kelompok tersebut seperti tampak pada
Tabel 2.
Tabel 2 Rataan Berat Bursa Fabricius Kelompok Ayam
Kelompok
Tabel 3 Rataan Rasio Berat Bursa (g)/ Berat Badan Kelompok Ayam
Tabel 4 Rataan Skor Bursa Lesi Masing-masing Kelompok Ayam
Tabel 4, menunjukkan skor bursa lesi pada pengamatan hari ke-28 masih di
bawah 1, hal ini mengindikasikan belum terjadi perubahan pada organ bursa fabricius. Lesi bursa lebih besar sama dengan dua mengindikasikan kerusakan bursa fabricius yang parah. Pada ayam yang divaksinasi usia sehari umumnya mengalami atropi pada bursa akibat adanya infeksi virus vaksin.
Berdasarkan aturan FOHI (DitJen Bina Usaha Peternakan 2007), vaksin IBD
yang baik tidak menyebabkan atropi atau rasionya diatas 0.7. Pemberian vaksin hari
pertama dosis penuh dan setengah telah menyebabkan atrofi pada BF hari ke 28-42
setelah vaksinasi karena nilai rasionya dibawah 0.7. Atrofi ini terjadi akibat
kerusakan sel-sel B pada BF sehingga folikel limfoid menjadi mengecil. Kerusakan
pada organ BF akan menyebabkan penurunan kemampuan pembentukan kekebalan
terhadap antigen lainnya (Sharma et al. 2000). Selain itu, menurunnya titer antibodi IBD dapat disebabkan oleh terjadinya proses netralisasi. Netralisasi merupakan
proses terjadinya pengikatan antara antibodi dengan virus vaksin yang akan
mencegah virus mencapai sel target dengan cara mencegah interaksi dari ikatan
permukaan virus dengan sel reseptor atau menghalangi internalisasi pelepasan secara
intraseluler (Campbell et al. 2004)
Pemeriksaan bedah bangkai (necropsy) menunjukkan efek hasil akibat
vaksinasi, yaitu terdapatnya ptechiae pada otot dada dan paha, serta pada organ BF terdapat eksudat, kekuningan (yellowish) dan ptechiae. Menurut Alan et al. (2000) gejala tersebut merupakan efek samping vaksinasi jika menggunakan vaksin aktif,
yaitu berupa pembengkakan dan perdarahan pada organ bursa, penekanan sistem
Pasca Uji Tantang
Hasil rataan titer antibodi terhadap IBD pada hari ke-42 kelompok ayam yang
tidak ditantang maupun yang ditantang dapat dilihat pada Gambar 5. Hasil
pengamatan menunjukan rataan titer antibodi terhadap IBD paling tinggi adalah
kelompok K2 (dosis ½) sebesar 5.639, lalu K3 (4.771), sedangkan pada K1 rataan
titer antibodi lebih rendah 3.899.
Gambar 5 Diagram batang titer antibodi terhadap IBD pada hari ke-42
Peningkatan titer antibodi pada hari ke 42 (2 minggu setelah penantangan)
merupakan respon booster dari masuknya infeksi virus lapang yang di berikan. Pada ayam kelompok K1 titernya tidak setinggi kelompok K2 maupun K3 dan K4, karena
pada kelompok ini sebelum infeksi titer antibodinya cukup tinggi (3.899). Titer
tersebut termasuk protektif sehingga virus lapang yang masuk bisa di netralisasi,
dengan demikian titer virus booster-nya menurun sehingga antibodi yang dihasilkan lebih rendah. Berbeda dengan ke tiga kelompok lainnya, sebelum infeksi titer
antibodi terhadap IBDnya rendah (di bawah titer protektif 3000), sehingga ketika
virus tantang masuk, antigen virus tersebut bertindak sebagai booster kekebalan ayamnya sehingga titer antibodinya meningkat. Kondisi ini sesuai dengan pernyataan
(Van Den Berg 2000) yang menyatakan bahwa uji secara serologi tidak dapat
membedakan antara antbodi yang diinduksi oleh virus IBD patogen dan yang
diinduksi oleh virus vaksin yang dilemahkan, sehingga titer antibodi yang tinggi pada
suatu flok terinfeksi dapat disebabkan oleh respon infeksi virus .
Hasil pengujian titer antibodi ini sejalan dengan gambaran rasio bursa dengan
bobot badan (Tabel 3). Pada kelompok K1 yang ditantang memiliki rasio paling besar
bursa, yang ditunjukkan dengan berat bursa yang lebih ringan (Tabel 2).
Dibandingkan dengan kelompok yang tidak ditantang, semua kelompok tantang
mengalami atrofi bursa. Kejadian atrofi bursa disebabkan masuknya virus ke dalam
tubuh ayam mengikuti aliran darah menuju organ target yaitu BF. Didalam organ
bursa virus berproliferasi menyebabkan bursa atrofi pada hari pengamatan ke-42
(Tabel 2).
Selama masa uji tantang (hari ke-28 sampai hari ke-42), juga diamati
perubahan yang terjadi baik pada ayam yang ditantang maupun ayam yang tidak
ditantang. Pada ayam yang tidak ditantang, tidak ditemukan perubahan tingkah laku
ayam. Kelompok ayam yang ditantang di temukan perubahan pola nafsu makan,
minum serta performan yang berupa ayam lesu, kurang nafsu makan, selalu minum,
diarea dan bulu yang mengkerut.
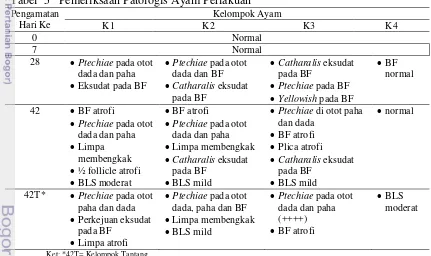
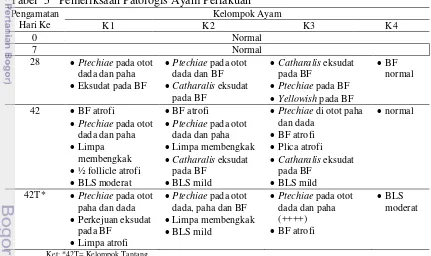
Tabel 5 Pemeriksaan Patologis Ayam Perlakuan Pengamatan
menunjukkan gejala yang sama dengan K4 (Tabel 5). Gambaran PA (Tabel 5) serta
data ratio bursa (Tabel 3) menunjukkan bahwa program vaksinasi yang dilakukan
pada ayam umur sehari belum efektif untuk menghadapi serangan virus IBD hasil uji
tantang yang merupakan galur lapang (virus isolat lokal).
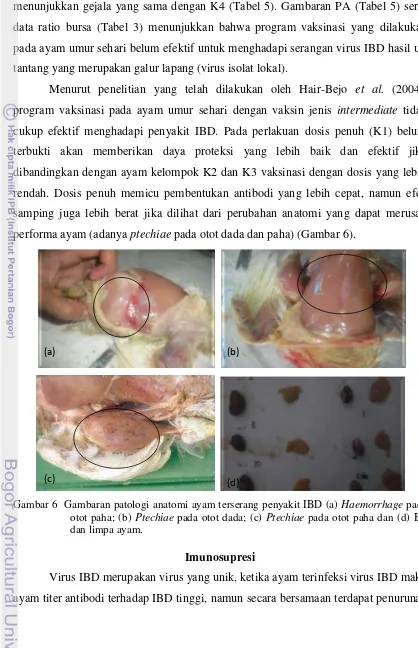
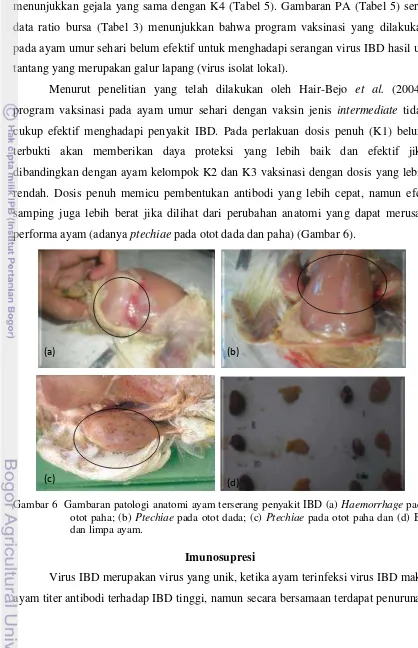
Menurut penelitian yang telah dilakukan oleh Hair-Bejo et al. (2004), program vaksinasi pada ayam umur sehari dengan vaksin jenis intermediate tidak cukup efektif menghadapi penyakit IBD. Pada perlakuan dosis penuh (K1) belum
terbukti akan memberikan daya proteksi yang lebih baik dan efektif jika
dibandingkan dengan ayam kelompok K2 dan K3 vaksinasi dengan dosis yang lebih
rendah. Dosis penuh memicu pembentukan antibodi yang lebih cepat, namun efek
samping juga lebih berat jika dilihat dari perubahan anatomi yang dapat merusak
performa ayam (adanya ptechiae pada otot dada dan paha) (Gambar 6).
Gambar 6 Gambaran patologi anatomi ayam terserang penyakit IBD (a) Haemorrhage pada otot paha; (b) Ptechiae pada otot dada; (c) Ptechiae pada otot paha dan (d) BF dan limpa ayam.
Imunosupresi
Virus IBD merupakan virus yang unik, ketika ayam terinfeksi virus IBD maka
ayam titer antibodi terhadap IBD tinggi, namun secara bersamaan terdapat penurunan
(a)
(d) (c)
titer antibodi terhadap penyakit lain. Pada Tabel 6 dapat dilihat pemeriksaan titer
antibodi terhadap ND, pada pengamatan hari ke 28 untuk K3 dan K4 tidak berubah
(2.40), sedangkan titer antibodi terhadap IBD masih tinggi (Gambar 4). Hal ini sesuai
dengan penelitian yang dilakukan oleh Ali et al. (2004), yaitu ayam yang di vaksinasi dengan vaksin virus ND galur LaSota memberikan pengaruh berlawanan dengan vaksin IBD live sehingga menurunkan titer antibodi terhadap ND.
Pada Hari ke-42 kelompok ayam yang tidak ditantang K1 dan K2 mengalami
peningkatan titer antibodi ND yaitu 1.63 dan 3.00 sedangkan titer antibodi IBD juga
tinggi (Gambar 3), hal ini mengindikasikan bahwa pada dosis vaksin IBD penuh dan
setengah masih mampu mnginduksi pembentukan antibodi terhadap ND maupun
IBD. Namun untuk kelompok ayam K3 dan K4 telah terjadi penurunan titer antibodi
terhadap ND berbanding terbalik dengan titer antibodi IBD yang tinggi (Gambar 5),
hal ini menunjukkan telah terjadi efek imunosupresi pada K3 dan K4.
Tabel 6 Rataan Titer Antibodi terhadap ND (log2)
Kelompok
Kesulitan keberhasilan program vaksinasi telah diteliti oleh Soejoedono
(1996) yang menyatakan bahwa terdapat 24 galur virus IBD di Indonesia yang
merupakan serotipe I dan berbeda secara antigennya dengan vaksin IBD impor.
Menurut Parede et al. (2003) virus IBD mudah bermutasi karena memiliki dua utas RNA, hingga saat ini virus IBD yang tersebar di Indonesia telah mengalami evolusi
dari vvIBD asalnya. Mutasi yang ditimbulkan dapat menyebabkan vaksin yang ada di pasaran(komersial) tidak secara optimal melindungi ayam terhadap infeksi virus IBD
Uji Molekuler
Konfirmasi keberadaan virus IBD dilakukan menggunakan metode Reverse-Transcriptase Polimerase Chain reaction (RT-PCR). Primer yang digunakan untuk konfirmasi adalah berasal dari sekuen VP2 yang merupakan daerah imunogenik pada
virus IBD. Hasil elektroforesis RT-PCR dapat dilihat pada Gambar 3.
Gambar 7 Hasil elektroforesis RT-PCR virus IBD (a) sampel 28 hari sebelum ditantang dan (b) setelah uji tantang hari ke-42 kelompok ditantang (Ket. M=DNA Ladder
kelompok. Vaksinasi pada saat titer antibodi asal induk tinggi menjadi tidak efektif
disebabkan vaksin virus dinetralisir oleh antibodi asal induk sehingga virus tidak
dapat bermultiplikasi, akibatnya respon kekebalan tidak muncul seperti yang
diharapkan (Ashraf et al. 2006; Suwarno dan Rahardjo 2005). Pada kondisi virus lapang mampu menembus sistem kekebalan tubuh ayam, kemungkinan kejadian IBD
akan muncul kembali artinya program vaksinasi tidak efektif. Pengaruh galur virus
uji tantang berhubungan dengan perbedaan homologi antara galur tantang secara
individual dan galur vaksin atau perbedaan virulensi galur virus tantang (Maas et al.
2001).
Menurut Hair-Bejo et al. (2004) vaksinasi yang diberikan pada saat ayam berumur sehari dengan dosis penuh menggunakan vaksin intermediate tidak efektif,
disebabkan titer antibodi asal induk yang masih tinggi sehingga terjadi netralisasi
antibodi asal vaksin oleh antibodi asal induk. Menurut Hussain et al. (2003) terdapat beberapa faktor yang mengakibatkan kegagalan vaksinasi, yaitu: vaksin itu sendiri
(tipe, penyimpanan, transportasi dan penanganan), kondisi ternak ayam dan
administrasi vaksin.
Selain itu, menurut hasil penelitian Wahyuwardani (2012) diketahui bahwa
virus IBD galur lokal ternyata berbeda satu asam amino dengan virus IBD-Indo-5,
sedangkan galur vaksin komersial telah banyak mengalami perubahan pada
sekuennya karena telah diatenuasi. Usaha pengembangan vaksin penyakit IBD di
Indonesia masih terus dilakukan dalam upaya menghasilkan vaksin yang mampu
memicu antibodi yang lebih protektif, namun disisi lain perlu penelitian lebih lanjut
mengenai adanya mutasi pada virus IBD yang menimbulkan perbedaan antigenik
antara virus vaksin dan virus yang ada dilapangan. Berdasarkan hasil penelitian ini,
diharapkan dapat memberikan gambaran letupan penyakit IBD yang masih terus
KESIMPULAN
Hasil yang dapat disimpulkan pada penelitian ini adalah bahwa berbagai dosis
vaksin jenis intermediate yang diberikan pada DOC tidak memberikan proteksi yang optimal untuk menghadapi uji tantang menggunakan virus IBD galur lapang lokal. Ke
tidak mampuan vaksin tersebut dalam mencegah infeksi isolat lapang ditunjukan dari
besarnya bursa score lesion, adanya atropi bursa dan penurunan titer antibodi terhadap ND pada ayam yang divaksin maupun tidak. Hal ini juga didukung oleh
adanya pita berukuran 672 pb pada semua sampel pool cDNA kelompok ayam percobaan, baik sebelum maupun sesudah percobaan.
SARAN
Berdasarkan hasil penelitian ini disarankan untuk mengidentifikasi galur virus
vaksin yang digunakan dan galur virus lapang secara molekuler, sehingga dapat
diidentifikasi galur virus IBD penyebab penyakit IBD secara tepat. Diharapkan dapat
dilakukan program vaksinasi yang sesuai dan memberikan proteksi yang lebih baik.
DAFTAR PUSTAKA
Abdel-Alim GA, Saif YM. 2001. Pathogenicity of cell culture-derived and bursa-derived Infectious Bursal Disease viruses in specific-pathogen-free chickens.
Avian Dis. 45:844-52.
Alan J, Rahman MM, Sil BK, Khan MSR, Giasuddin, Sarker MSK. 2002. Effect of maternally derived antibody on vaccination against Infectious Bursal Disease (Gumboro) with light vaccine in Brunei. Int’l J Poultry Sci. 1: 98-101
Ali AS, Abdalla MO, Mohammed MEH. 2004. Interaction between Newcastle Disease and Infectious Bursal Disease vaccines commonly used in Sudan. Int’l
J poultry Sci. 3(4): 300-304
Alkhalaf AN. 2009. Detection of variant strains of Infectious Bursal Disease virus in broiler flocks in Saudi Arabia using antigen capture Enzyme-Linked Immunosorbent Assay. Pakistan Vet. J. 29(4): 161-164
Ashraf S, Abdel-Alim G, Saif YM, 2006. Detection of antibodies against serotypes 1 and 2 Infectious Bursal Disease virus by commercial ELISA kits. Avian Dis. 50(1): 104-109
Babiker MAA, Yahia IE, Noura K, Manal ME. 2008. Evaluation of Commercial Anti- Infectious Bursal Disease IBD Vaccines under Sudan Condition. Int’l J
Poultry Sci. 7(6): 570-573
Bahri S, Kusumaningsih A. 2005. Potensi, peluang dan strategi pengembangan vaksin hewan di Indonesia. J. Litbang Pertanian. 24 (3): 113-120
Banda AP, Villegas. 2004. Genetic characterization of very virulent Infectious Bursal Disease viruses from Latin America. Avian Dis. 48:540–549
Becht H, Muller H.1991. Identification of a novel viral protein in Infectious Bursal disease virus-infected cells. J. Gen. Virol. 176: 437-443
Boot HJ, T er Huurne AHM, Peeters BPH. 2000. Generation of full-length cDNA of the two genomic dsRNA segments of Infectious Bursal Disease virus. J. Virol Meth. 84:49– 58
Campbell NA, Reece JB , Mitchell LG. 2004. Biologi. Edisi kelima. Jilid 3. Manalu W, Safitri A, penerjemah. Jakarta: Erlangga. Terjemahan dari: Biology.
Caterina KM. Frasco Jr S, Girshick T, Khan MI. 2004. Development of multiplex PCR for detection of avian adenovirus, Infectious Bursal Disease virus, and Chicken Anemia Virus. Mol. Cell. probes. 18(5):293-298
Cereno T. 2004. Infectious Bursal Disease (IBD): causative agent, diagnosis and prevention. http://www.canadianpoultry.ca/infectious_bursal_disease.htm
[Akses tanggal 15 Agustus 2011]
Coletti M, Del Rossi E, Franciosini MP, Passamonti F, Tacconi G, Marini G. 2001. Efficacy and safety of an Infectious Bursal Diseases Virus intermediate vaccine in ovo. Avian Dis.45 : 1036-1043.
Cookson K. 2011. Preventing immunosuppresive disease. Newsletter Pfizer. http://www.egg-cite.com/articles/single.aspx?pageID=50&contentID=201 [Akses tanggal 12 Oktober 2011]
Direktorat Jenderal Bina Produksi Peternakan. 2007. Farmakope Obat Hewan Indonesia (FOHI). Jilid I. Ed ke-3. Departemen Pertanian. P117-119
Hair-Bejo M, Ng MK, Ng HY. 2004. Day Old vaccination against Infectious Bursal Disease in broiler chickens. Int’l J Poultry Sci. 3(2):124-128.
Hardjosworo PS dan Rukmiasih MS. 2000. Meningkatkan Produksi Daging Unggas. Penebar Swadaya. Jakarta.
Hirai K, Shimakura S. 1974. Structure of Infectious Bursal Disease virus. J Virol. 14:957-64.
Huang Z, Elankumaran S, Yunus AS, Samal SK. 2004. A recombinant Newcastle Disease Virus (NDV) Expressing VP2 protein of Infectious Bursal Disease (IBDV) protects against NDV and IBDV. J. Virol. 78(24): 54-63
Hussain, I, Zahoor MA, Rasool MH, Mahmood MS, Mansoor MK, Riaz MN. 2003. Detection of Serum Antibody Levels Against Infectious Bursal Disease (IBD) Virus Using Indirect Hemagglutination (IHA) Test in Commercial Broilers.
Int’l J Poultry Sci. 2 (6): 442-445
Jackwood DJ, Sommer-Wagner SE. 2002. Identification of infectious bursal disease virus quasispecies in commercial vaccines and field isolates of this double-stranded RNA virus. Virology. 304:105-13.
Jackwood DJ, Sommer-Wagner SE. 2010. Detection and characterization of Infectious Bursal Disease viruses in broiler at processing. Prevent Vet Med. 97:45–50
Jackwood DJ, Byerley EH, Sommer-Wagner SE. 2001. Use of a genetic marker for wild-type potentially pathogenic Infectious Bursal Disease viruses. Avian Dis. 45:701-5.
Kibenge FS, Dhama V. 1997. Evidence that virion-associated VP1 of Avibirnaviruses contains viral RNA sequences. Arch Virol. 142:1227-36.
Kim IJ, You SK, Kim H, Yeh HY, Sharma JM. 2000. Characteristics of bursal T lymphocytes induced by Infectious Bursal Disease virus. J Virol. 74:8884-92. Lejal N, B da Costa, JC Huef, B Delmas. 2000. Role of 502-652 and Lys-692 in the
protease activity of Infectious Bursal Disease virus VP4 and identification of its substrage cleavage sites. J Gene of Virol. 81:983-992.
Li Y, Wu T, Cheng X and Zhang C. 2009. Molecular characteristic of VP2 gene of Infectious Bursal Disease viruses isolated from a farm in two decades. Virus Genes. 38:408–413
Liu M and Vakharia VN. 2004. VP1 protein of Infectious Bursal Disease virus modulates the virulence in vivo. Virology. 330:62-73.
Lombardo E, Maraver A, Espinosa I, Fernandez-Arias A, Rodriguez JF. 2000. VP5, the nonstructural polypeptide of Infectious Bursal Disease virus, accumulates within the host plasma membrane and induces cell lysis. Virology. 277:345-357.
Lukert PD, Saif YM. 2003. Infectious Bursal Disease. Didalam: YM Saif, HJ Barnes, AM Fadly, JR Glisson, LR McDougald, DE Swayne, Diseases of Poultry. Ed ke-11. Iowa State Press, Ames, Iowa. pp. 161-179.
Maas RA, Venema S, Ori HL, Pol JMA, Claassen IJTM, ter Huurne AAHM. 2001. Efficacy of inactivated Infectious Bursal Disease (IBD) vacines: comparison of serology with protection of progeny against IBD virus strains of varying virulence. Avian Path. 30 (4):345-354.
Mahardika IGNK, Parede L. 2008. Analisis filogenetik sekuen nukleotida bagain hipervariabel protein VP2 Virus Gumboro Isolat Indonesia. J vet. 9 (2): 60-64 Mardassi H, Khabouchi N, Ghram A, Manouchi A, Karboul . 2004. A very virulent
recurrent Infectious Bursal Disease outbreaks in Tunisian vaccinated flocks.
Avian Dis. 48: 829–840
Ming Y. 2000. Emerging immunosuppressive disease poultry. Idexx’s Technical
update Seminar. Surabaya Oct. 3
Muller H, Islam MR, Raue R. 2003. Research on Infectious Bursal Disease: the past, the present and the future. Vet Microbiol. 97:153-165.
Mundt E, de Haas N, Van Loon AA. 2003. Development of a vaccine for immunization against classical as well as variant strains of Infectious Bursal Disease virus using reverse genetics. Vaccine. 21:4616-4624
Ozbey G, Ertas HB, Muz A. 2003. Restriction fragment length polymorphism analysis of isolates of Infectious Bursal Disease viruses from Turkey. Vet. Med.
– Czech. 48(12): 359–362
Parede L, Sapats SI, Gould G, Rudd MF, Lowther S,Ignjatovic J. 2003. Characterization of Infectious Bursal Disease virus isolates from Indonesia indicates the existence of very virulent strains with unique genetic changes.
Avian Pathol. 32:511–518
Partadiredja M, Soejoedono RD. 1997. Cross protection study of chicken vaccinated with an imported IBD vaccine challenged with 3 pathogenic IBDV isolates in Indonesia. Hemera Zoa. 79:22-29
Partadiredja M, Rumawas W, Suharjanto I. 1981. Kasus penyakit IBD di Indonesia serta akibatnya bagi peternakan di Indonesia. Prosiding Seminar Penelitian Peternakan. Puslitbang Peternakan, Badan Litbang Pertanian
,
Rasyaf M. 2008. Panduan beternak ayam pedaging. Penerbit Swadaya, Jakarta. Pp Rong J, Cheng T, Liu X, Jiang T Gu H and Zou G. 2005. Development of
recombinant VP2 vaccine for the prevention of Infectious Bursal isease of chickens. Vaccine. 23(40):4844-51.
Rudd MF, Heine HG, Sapats SI, Parede L, and Ignjatovic J. 2002. Characterization of an Indonesian very virulent strain of Infectious Bursal Disease virus. Arch. Virol. 147: 1303–1322
Sharma JM, Kim IJ, Rautenschlein S and Yeh HY. 2000. Infectious Bursal Disease virus of chickens: pathogenesis and immunosuppression. Dev Comp Immunol. 24:223-235.
Statistik Peternakan. 2010. Direktorat Jendral Bina Peternakan. Departemen Pertanian
Soejoedono RD. 1996. Pengaruh beberapa subtype virus Infectious Bursal Disease
terhadap keberhasilan vaksinasi.[Disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor
Suwarno, Rahardjo AP. 2005. Imunogenitas Protein VP2 Virus Infectious Bursal Disease (IBD) Isolat Lokal Sebagai Dasar Pengembangan Vaksin Sub Unit,
Media Kedokteran Hewan. 21(1): 1-5.
Toro HVL, van Santen FJH, Breedlove C. 2009. Effects of Chicken Anemia virus and Infectious Bursal Disease virus in commercial chickens. Avian Dis. 53: 94-102
Van Den Berg TP, Morales D, Enterradossi N, Rivallan G, Toquin D, Raue R, Zierenberg K, Zhang MF, Zhu YP, Wang CQ, Zheng HJ, Wang X, Chen GC, Lim BL, Muller H. 2004. Assessment of genetic, antigenic and pathotypic criteria for the characterization of IBDV strains. Avian Pathol.1: 1–2.
Van Den Berg TP. 2000. An acute Infectious Bursal Bisease in poultry: a review.
Avian Pathol. 29:175-194.
Wahyuwardani S. 2012. Patogenesis infeksi virus Gumboro isolat lokal pada embryo dan ayam pedaging [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor
Wang MY, Hu HL, Suen SY, Chiu FY, Shien JH and Lai SY. 2008. Development of an Enzyme-Linked Immunosorbent Assay for detecting Infectious Bursal Disease Virus (IBDV) infection based on the VP3 structural protein. Vet. Microbiol. 131: 229-236.
Yao K and Vakharia VN. 2001. Induction of apoptosis in vitro by the 17-kDa nonstructural protein of Infectious Bursal Disease virus: possible role in viral pathogenesis. Virology. 285:50-58.
using Infectious Bursal Disease (IBD) vaccine in different doses.. Under direction of RETNO D. SOEJOEDONO and SRI MURTINI .
Disease of Infectious bursal disease (IBD) is a viral disease that causes economic losses to the poultry industry as it causes high mortality and immunosuppression. IBD disease prevention efforts carried out by means of vaccination and biosecurity. IBD vaccination of day old security needs to be investigated its ability to prevent infection. This study aimed to observe the serological response and clinical condition based on examination of molecular actively vaccinated with IBD vaccine at different dose levels of daily life and challenged with virus field isolates. A total of 180 chickens were divided into four groups: K1 (full dose), K2 (½ Dose), K3 (dose ¼) and K4 (Dose 0). The vaccine used was a live IBD vaccine strains intermediate. Observations carried out on five chickens from each group that includes: antibody titers, the ratio bursa weight/bodyweight and pathology images. Presence of field virus infection and the linical condition due to infection challenge was observed by PCR. Observations made on days 1, 7, 28 and 42. Observations showed that the full dose vaccinated chickens started to show positive antibody formation against IBD at day 28 after vaccination, while in chickens vaccinated with a half and a quarter dose positive antibody titers 42 days post-vaccination. Clinical observations showed that vaccinated chickens various dose levels showed the same clinical symptoms than the control group. Similarly to the results of PCR observations it appears that the chickens from the vaccinated group of IBD viruses detected. The results of this study suggest that active IBD day old vaccination is not effective in preventing infection of the field.