Uji Sitotoksisitas Ekstrak Etanol
Angiopteris angustifolia
C. Presl terhadap Kultur Sel
Kanker Payudara (MCF-7
Cell Line)
secara
In Vitro
SKRIPSI
STEVANI SITORUS
108102000073
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Uji Sitotoksisitas Ekstrak Etanol
Angiopteris angustifolia
C. Presl terhadap Kultur Sel
Kanker Payudara (MCF-7
Cell Line)
secara
In Vitro
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
STEVANI SITORUS
108102000073
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
JANUARI 2013
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama
: Stevani Sitorus
NIM
: 108102000073
Tanda Tangan
: ...
Nama : Stevani Sitorus Program Studi : Farmasi
Judul : UJI SITOTOKSISITAS EKSTRAK ETANOL Angiopteris angustifolia C. Presl TERHADAP KULTUR SEL KANKER PAYUDARA (MCF-7 CELL LINE) SECARA IN VITRO.
Kanker payudara merupakan jenis kanker yang paling banyak diderita oleh perempuan di seluruh dunia. Obat-obat kemoterapeutik yang ada, memiliki efek samping dengan merusak sel sehat penderita. Pencarian obat yang berasal dari tanaman diharapkan dapat menemukan antikanker yang efektif dengan efek samping yang minimal. Tanaman Paku Angiopteris angustifolia C. Presl, suku marattiaceae, merupakan tanaman yang digunakan oleh masyrakat Indonesia sebagai tanaman hias. Tujuan dari penelitian ini adalah untuk menguji aktivitas sitotoksik ekstrak etanol daun Angiopteris angustifolia C. Presl terhadap MCF-7
cell line. Metode penelitian yang digunakan adalah dengan melihat penghambatan proliferasi MCF-7 cell line secara in vitro dengan metode analisa MTT. Ekstraksi serbuk daun Angiopteris angustifolia C. Presl dilakukan dengan etanol 70%, pelarut ekstraksi diuapkan dengan vacuum evaporator dan ekstrak yang terbentuk dipekatkan menggunakan frezee drier. MCF-7 cell line dikultur menggunakan metode monolayer dalam medium RPMI 1640 yang mengandung 10% FBS. Absorbansi pada panjang gelombang 540 nm – 600 nm yang diperoleh dari pembacaan microplate reader dilakukan pengolahan data sehingga diperoleh nilai IC50. Nilai IC50 yang diperoleh adalah 91.52 µg/mL. Hasil penelitian ini
menunjukkan bahwa ekstrak etanol daun Angiopteris angustifolia C. Presl memiliki aktivitas sitotoksik.
Name : Stevani Sitorus Program Study : Pharmacy
Title : CYTOTOXIC ACTIVITY OF Angiopteris angustifolia C. Presl’s ETHANOLIC EXTRACT AGAINTS MCF-7 CELL LINEACCORDING TO IN VITRO METHOD.
Breast cancer is the commonest cause of cancer death in women worldwide. Current chemoterapeutic drugs for breast cancer have side effects. So, there have been an intense search on various biological source to find new anticancer to combat this diseases. In Indonesia, fern Angiopteris angustifolia C. Presl (marattiaceae) is used as ornamental. The aim of this reasearch is to examine the cytotoxic activity of ethanol extract of Angiopteris angustifolia C. Presl againts MCF-7 cell line. The cytotoxic activity was carried out by using MTT method.
Angiopteris angustifolia C. Presl (marattiaceae) leaf’s powder extraction was done using ethanol 70%, the solvent of extraction was evaporated by vacuum evaporator and frezee drier. MCF-7 cell line was cultured in RPMI 1640 medium which contained 10% of FBS (fetal bovine serum). The absorbance that was obtained from microplate reader was processed in order to get IC50 value. The
result showed that ethanol extract of Angiopteris angustifolia C. Presl inhibit MCF-7 cell line with the IC50 value 91.52 µg/mL.
Alhamdulillah, rasa syukur serta pujian senantiasa kita panjatkan kehadirat
Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya serta segala
anugerah-Nya berupa kesehatan, pemikiran dan ide sehingga penulis dapat
menyelesaikan skripsi ini. Salawat serta salam semoga selalu tercurah kepada
junjungan Nabi Muhammad SAW, keluarga, para sahabat dan pengikutnya yang
senantiasa mengikuti sunnahnya hingga akhir zaman.
Skripsi ini penulis susun untuk memenuhi salah satu syarat menempuh
ujian akhir guna memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta. Adapun judul skripsi ini adalah “Uji Sitotoksisitas Ekstrak Etanol Angiopteris angustifolia C. Presl Terhadap Kultur Sel Kanker Payudara (MCF-7 Cell Line) Secara In Vitro”.
Penulis menyadari bahwa skripsi ini tidak akan selesai dengan baik tanpa
bantuan dari berbagai pihak. Untuk itu, penulis mengucapkan terima kasih
kepada:
1. Ismiarni Komala, M.Sc., PhD., Apt selaku Pembimbing I dan drg. Laifa
Annisa H., PhD selaku Pembimbing II, yang telah meluangkan waktu, tenaga
dan pikiran serta dengan sabar membimbing dan mengajari sehingga penulis
dapat menyelesaikan skripsi ini.
2. Pemerintah Daerah Kabupaten Musi Banyuasin Sumatera Selatan selaku
pemberi beasiswa, sehingga penulis dapat mengenyam pendidikan di
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Hening Herawati, M.Biomed selaku kepala Laboratorium Kultur Pusat
Penelitian dan Pengembangan RSKD, yang telah mengajari penulis
mengkultur sel kanker dengan penuh kesabaran serta memberikan
pengalaman dan nasehatnya selama penulis penelitian.
4. Prof. Dr, (hc) dr. M. K. Tadjudin, Sp.And selaku dekan Fakultas Kedokteran
6. Ibu/Bapak Dosen dan Staf Akademika Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
7. Ayahanda tercinta M. Nimrot Sitorus dan Ibunda tercinta Yunita, terima kasih
atas doa yang selalu tercurah untukku, kasih sayang, semangat dan
dukungannya yang menguatkan penulis dalam menyelesaikan skripsi ini.
8. Adikku tersayang Erica Febriany Sitorus yang dengan canda tawanya mampu
mengusir kepenatan penulis dalam menyusun skripsi ini.
9. Teman–teman seperjuangan Farmasi Angkatan 2008, terimakasih atas sebuah persahabatan, kekeluargaan dan persaudaraan kita selama ini.
10. Dan kepada semua pihak yang telah membantu penulis selama ini yang tidak
dapat disebutkan namanya satu persatu.
Penulis menyadari bahwa dalam skripsi ini terdapat banyak kekurangan
dan masih jauh dari kesempurnaan. Penulis mengharapkan kritik dan saran dari
pembaca untuk perbaikan dalam pembuatan skripsi.
Ciputat, 15 Januari 2013
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatulllah Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Stevani Sitorus
NIM : 108102000073
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
UJI SITOTOKSISITAS EKSTRAK ETANOL Angiopteris angustifolia C. Presl TERHADAP KULTUR SEL KANKER PAYUDARA (MCF-7 CELL
LINE) SECARA IN VITRO.
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Ciputat
Pada Tanggal : 15 Januari 2013
Yang menyatakan,
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ...x
DAFTAR ISI ... xi
2.1.3. Aktivitas Biologi dan Kandungan Kimia ... 4
2.2. Simplisia ... 5
2.6.1. Faktor Etiologi Kanker Payudara ... 12
2.6.2. Faktor Risiko Kanker Payudara ... 12
2.6.3. Gejala Penyakit Kanker payudara ... 13
2.6.4. Pencegahan Kanker Payudara ... 14
2.7. MCF-7 Cell Line ... 14
2.8. Antikanker ... 14
2.8.1. Obat Antikanker ... 14
2.8.2. Mekanisme Kerja Obat Antikanker ... 15
2.8.3. Penggolongan Obat Antikanker ... 15
2.9. Kultur Sel ... 17
2.10. Uji Sitotoksisitas ... 18
2.11. Metode Pengujian Sitotoksik ... 19
3.2.1. Waktu Penelitian ... 22
3.4.10. Perhitungan Persentase Kematian Sel ... 30
3.4.11. Analisa Data ... 31
4.1.5. Hasil Pengujian Sitotoksik Ekstrak Etanol Angiopteris angustifolia terhadap Sel MCF-7 ... 33
Gambar 1. Pohon Angiopteris angustifolia C. Presl ... 49
Gambar 2. Daun Angiopteris angustifolia C. Presl ... 49
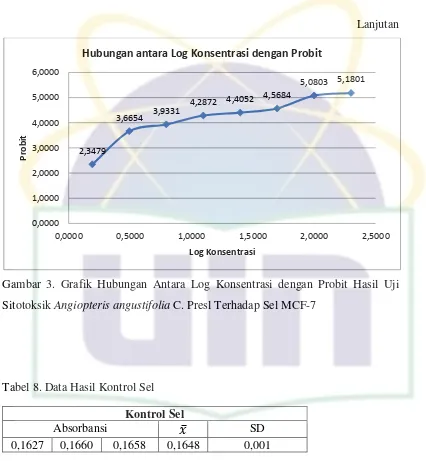
Gambar 3. Grafik Hubungan Antara Log Konsentrasi dengan Probit Hasil Uji Sitotoksik Angiopteris angustifolia C. Presl Terhadap Sel MCF-7... ... 69
Gambar 4. MCF-7 Cell Line Dalam Medium RPMI 1640 Berserum Pada Saat Inkubasi 0 jam ... 70
Gambar 5. MCF-7 Cell Line Dalam Medium RPMI 1640 Berserum Setelah Inkubasi 24 Jam. ... 71
Gambar 6. MCF-7 Cell Line Dalam Medium RPMI 1640 Berserum Setelah Inkubasi 48 Jam. ... 72
Gambar 7. MCF-7 Cell Line Setelah Penambahan Sampel Konsentrasi 200 ppm dan inkubasi 24 jam... 73
Gambar 8. Kristal Formazan yang Terbentuk Setelah Penambahan MTT Setelah Inkubasi 4 Jam. ... 74
Gambar 9. MCF-7 Cell Line Saat Dilakukan Perhitungan Dengan Pewarnaan Tripan Blue Menggunakan Haemocytometer... 75
Tabel 1. Hasil Ekstraksi ... 32
Tabel 2. Hasil Penapisan Fitokimia ... 32
Tabel 3. Hasil Pengujian Sitotoksik Angiopteris angustifolia ... 33
Tabel 4. Hasil Perhitungan Konsentrasi Sampel (Ekstrak Etanol)... 62
Tabel 5. Hasil Perhitungan Konsentrasi DMSO ... 63
Tabel 6. Hasil Pengujian Sitotoksik Angiopteris angustifolia C. Presl Terhadap Sel MCF-7 ... 67
Tabel 7. Hasil Pengujian Sitotoksik DMSO Terhadap Sel MCF-7... ... 67
Tabel 8. Hasil Pengujian Kontrol Sel ... 69
Lampiran 1. Hasil Determinasi Angiopteris angustifolia C. Presl ... 48
Lampiran 2. Pohon daun Daun Angiopteris angustifolia C. Presl ... 49
Lampiran 3. Hasil Perhitungan Rendemen Ekstrak Etanol Angiopteris angustifolia C. Presl ... 50
Lampiran 4. Hasil Pengamatan Penapisan Fitokimia ... 51
Lampiran 5. Skema Proses Ekstraksi Serbuk Angiopteris angustifolia C. Presl ... 54
Lampiran 6. Skema Kerja Thawing dan Kultur Sel MCF-7 ... 55
Lampiran 7. Skema Subkultivasi Sel MCF-7 ... 56
Lampiran 8. Skema Platting ... 57
Lampiran 9. Skema Uji MTT ... 58
Lampiran 10. Perhitungan Konsentrasi Sampel (Ekstrak Etanol) ... 60
Lampiran 11. Perhitungan Konsentrasi Kontrol DMSO ... 63
Lampiran 12. Perhitungan Kepadatan Sel ... 64
Lampiran 13. Skema pemetaan sampel... 65
Lampiran 14. Perhitungan dan Grafik Efek Sitotoksik Ekstrak Etanol Angiopteris angustifolia C. Presl Terhadap Sel MCF-7. ... 67
Lampiran 15. Gambar MCF-7 Cell Line dalam Medium RPMI 1640 Berserum... 70
Lampiran 16. Gambar MCF-7 Cell Line Dalam Medium RPMI 1640 Berserum Setelah Inkubasi 24 Jam... 71
Lampiran 17. Gambar MCF-7 Cell Line Dalam Medium RPMI 1640 Berserum Setelah Inkubasi 48 Jam... 72
Lampiran 18. Gambar MCF-7 Cell Line Setelah Penambahan Sampel Konsentrasi 200 ppm dan inkubasi 24 jam... 73
Lampiran 19. Kristal Formazan yang Terbentuk Setelah Penambahan MTT dan Inkubasi 4 Jam. ... 74
Lampiran 20. MCF-7 Cell Line Saat Dilakukan Perhitungan Dengan Pewarnaan Tripan Blue Menggunakan Haemocytometer. ... 75
Lampiran 21. Gambar Bahan dan Alat yang Digunakan... 76
Lampiran 22. Deskripsi Medium RPMI 1640... 80
Lampiran 23. Morfologi Sel MCF-7... 81
1.1 Latar Belakang
Kanker, umum disebut juga neoplasma, secara harfiah berarti
pertumbuhan baru. Suatu neoplasma, sesuai definisi Wilis, adalah massa
abnormal jaringan yang pertumbuhannya berlebihan dan tidak
terkoordinasi walaupun rangsangan yang memicu pertumbuhan tersebut
telah berhenti. (Robbins, 1999).
Menurut laporan WHO berdasarkan data statistik IARC
(International Agency for Research on Cancer), angka kejadian kanker payudara di Asia pada tahun 2008 terjadi sebanyak 528.927 kasus dengan
angka kematian sebanyak 193.497 juta jiwa setiap tahun (IARC, 2008).
Data rekam medis Rumah Sakit Kanker Dharmais (RSKD)
melaporkan insiden kanker payudara di Indonesia menduduki peringkat
pertama diantara jenis kanker lainnya. Pada tahun 2009 terjadi sebanyak
567 kasus, sedangkan pada tahun 2010 terjadi sebanyak 711 kasus.
Dimana pada setiap tahun terjadi peningkatan insiden kanker payudara
(Anonim, 2012).
Obat antikanker merupakan obat khusus dengan batas
keamanannya begitu sempit. Antikanker diharapkan memiliki toksisitas
selektif artinya menghancurkan sel kanker tanpa merusak sel jaringan
normal. Pada umumnya antikanker menekan pertumbuhan atau proliferasi
sel dan dapat menimbulkan toksisitas, karena menghambat pembelahan sel
normal yang proliferasinya cepat misalnya sumsum tulang, epitel
germinativum, mukosa saluran cerna, folikel rambut dan jaringan limfosit.
Terapi hanya dapat dikatakan berhasil baik, bila dosis yang digunakan
dapat mematikan sel tumor ganas dan tidak terlalu mengganggu sel normal
yang berproliferasi (Departemen Farmakologi dan Terapi, 2008). Hal
tersebut menjadi sebuah tantangan untuk terus melakukan studi dan
alam khususnya tumbuh-tumbuhan, dengan harapan dapat menemukan
antikanker yang efektif dan dapat mengurangi efek samping yang
berbahaya.
Tumbuhan paku (Pteridophyta) merupakan salah satu divisi tumbuhan yang menjadi kekayaan alam hayati Indonesia. Dari sekitar
10.000 spesies tumbuhan paku di dunia, diperkirakan 1.300 spesies di
antaranya tumbuh di kawasan Indonesia. Berbagai jenis spesies tumbuhan
paku telah dikenal dan dimanfaatkan oleh masyarakat Indonesia sebagai
tanaman hias, bahan obat tradisional, bahan makanan, tanaman pelindung,
dan pupuk hijau. Masyarakat pada umumnya telah mengenal manfaat
tumbuhan paku dan sebagian telah menggunakan tumbuhan ini sebagai
obat tradisional (Susiarti, 2009).
Adapun Msayoshi Hirohara, dkk telah menemukan senyawa
triterpenoid dari Goniophlebium mengtzeense dari suku Polypodiaceae, serta telah mengisolasi senyawa triterpenoid dari tumbuhan tersebut
(Msayoshi Hirohara,.et.al, 1996)
Beberapa jenis tumbuhan paku telah terbukti memiliki aktivitas
sitotoksik dari penelitian yang telah dilakukan. Berdasarkan penelitian
yang dilakukan oleh Zulnely, dkk pada jenis Dictyopteris irregularis Preal suku Gleicheniaceae menunjukkan aktivitas sitotoksik dengan nilai LC50
sebesar 0,46 ppm. Adapun penelitian Fitrya dan Lenny Anwar (2009) pada
uji aktivitas sitotoksik secara in vitro menggunakan sel Murine P-388 dari akar tumbuhan tunjuk langit Helmynthostachis zaeylanica (Linn) Hook
yaitu salah satu spesies tumbuhan paku dari Ophioglassaceae
menunjukkan aktivitas sitotoksik dengan LC50 sebesar 2,4 µg/mL.
Diantara tumbuhan paku yang banyak tumbuh di Indonesia adalah
Angiopteris angustifolia C. Presl. Penelitian tentang efek sitotoksik
Angiopteris angustifolia C. Presl. belum pernah dilakukan, sehingga perlu dilakukan penelitian efek sitotoksik dari tumbuhan paku Angiopteris angustifolia C. Presl. yang tumbuh di Indonesia secara in vitro terhadap sel kanker payudara (MCF-7) menggunakan metode kolorimetri dengan
1.2 Perumusan Masalah
Apakah ekstrak etanol tumbuhan paku Angiopteris angustifolia C. Presl. memiliki aktivitas sitotoksik terhadap kultur sel kanker payudara (MCF-7
cell line) secara in vitro?
1.3 Tujuan Penelitian
2.1 Tinjauan Botani
Angiopteris angustifolia C. Presl adalah sinonim dari Angiopteris angustifolia (Global Biodiversity Information Facility GBIF, 2010).
2.1.1 Klasifikasi Tanaman
Kingdom : Viridiplantae
Filum/Phylum : Streptophyta
Kelas/Class : Marattiopsida
Bangsa/Ordo : Marattiales
Suku/Family : Marattiaceae
Marga/Genus : Angiopteris
Jenis/Spesies : Angiopteris angustifolia
(Global Biodiversity Information Facility GBIF, 2010).
2.1.2 Deskripsi Tanaman
Merupakan paku yang besar, daun sampai 2-5 meter menyirip
ganda 2-4, anak daun menyerupai daun kedondong (spondias dulcis), sorus memanjang, sporangium didalamnya bebas, membuka dengan satu
celah (Tjitrosoepomo, 2003).
Suku dari Marattiaceae ini memiliki daun amat besar, meyirip
ganda sampai beberapa kali. Sporangium pada sisi bawah daun,
mempunyai dinding yang tebal, tidak mempunyai cincin, membuka
dengan suatu celah atau liang. Kebanyakan paku ini berupa paku tanah
yang isospor. Protalium berumur panjang, mempunyai mikoriza endofitik,
tumbuh di atas tanah, berwarna hijau, bentuknya menyerupai talus lumut
hati yang terdiri atas beberapa lapis sel (Tjitrosoepomo, 2003).
2.1.3 Aktivitas Biologi dan Kandungan Kimia
Informasi mengenai aktivitas biologi serta kandungan kimia dari
2.2 Simplisia
Simplisia adalah bahan alam yang digunakan sebagai obat yang
belum mengalami pengolahan apapun juga, kecuali dinyatakan lain,
berupa bahan yang telah dikeringkan. Simplisia dibedakan menjadi
simplisia nabati, simplisia hewani, simplisia pelikan atau mineral
(Farmakope Indonesia edisi III, 1979).
o Simplisia nabati
Simplisia nabati adalah simplisia berupa tanaman utuh, bagian tanaman
dan eksudat tanaman. Eksudat tanaman adalah isi yang spontan keluar dari
tanaman atau isi sel yang dikeluarkan dari selnya dengan cara tertentu atau
zat yang dipisahkan dari tanamannya dengan cara tertentu yang masih
belum berupa zat kimia murni (Farmakope Indonesia edisi III, 1979).
o Simplisia hewani
Simplisia hewani adalah simplisia berupa hewan utuh, bagian hewan atau
zat yang dihasilkan hewan yang masih belum berupa zat kimia murni
(Farmakope Indonesia edisi III, 1979).
o Simplisia mineral
Simplisia mineral adalah simplisia berasal dari bumi, baik yang telah
diolah atau belum, tidak berupa zat kimia murni (Farmakope Indonesia
edisi III, 1979).
Simplisia sebagai produk hasil pertanian atau pengumpulan
tumbuhan liar (wild crop) tentu saja kandungan kimianya tidak dapat dijamin selalu ajeg (konstan) karena disadari adanya variabel bibit, tempat
tumbuh, iklim, kondisi (umur dan cara) panen, serta proses pasca panen
dan preparasi akhir. Usaha untuk mengajegkan variabel tersebut dapat
dianggap sebagai usaha untuk menjaga keajegan mutu simplisia (DepKes,
2000).
2.2.1 Tahapan Pembuatan Simplisia
Pada umumnya pembuatan simplisia melalui tahapan seperti berikut :
a. Pengumpulan bahan baku
Pengumpulan bahan baku atau waktu pemanenan yang tepat adalah
pada saat bagian tanaman tersebut mengandung senyawa aktif
dalam jumlah terbesar.
b. Sortasi basah
Sortasi basah dilakukan untuk memisahkan kotoran – kotoran atau bahan asing lainnya dari bahan simplisia.
c. Pencucian
Pencucian dilakukan untuk menghilangkan tanah dan pengotor
lainnya yang melekat pada bahan simplisia. Pencucian dilakukan
dengan air bersih.
d. Perajangan
Perajangan simplisia dilakukan untuk mempermudah proses
pengeringan, pengepakan, dan penggilingan.
e. Pengeringan
Tujuan pengeringan adalah untuk mendapatkan simplisia yang
tidak mudah rusak, sehingga dapat disimpan dalam waktu yang
lebih lama. Dengan mengurangi kadar air dan menghentikan reaksi
enzimatik akan dicegah penurunan mutu dan perusakan simplisia.
f. Sortasi kering
Sortasi setelah pengeringan merupakan tahap akhir pembuatan
simplisia. Tujuannya adalah untuk memisahkan benda-benda asing
seperti bagian-bagian tanaman yang tidak diinginkan.
2.3 Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengektraksi
zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan
massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi
baku yang telah ditetapkan (Farmakope Indonesia edisi IV, 1995).
Ekstrak cair adalah sediaan cair simplisia nabati, yang
pelarut dan pengawet. Ekstrak cair yang cenderung membentuk endapan
dapat didiamkan dan disaring atau bagian yang bening dienaptuangkan.
Beningan yang diperoleh memenuhi persyaratan Farmakope (Farmakope
Indonesia edisi IV, 1995).
Proses pembuatan ekstrak terdiri dari beberapa tahap yaitu :
Pembuatan serbuk simplisia dan klasifikasinya, cairan pelarut, separasi dan
pemurnian, pemekatan / penguapan, dan pengeringan ekstrak (DepKes,
2000).
a) Pembuatan serbuk simplisia dan klasifikasinya
Proses awal pembuatan ekstrak adalah tahapan pembuatan serbuk
simplisia kering (penyerbukan). Dari simplisia dibuat serbuk simplisia
dengan peralatan tertentu sampai derajat kehalusan tertentu. Proses ini
dapat mempengaruhi mutu ekstrak dengan dasar beberapa hal. Seperti
semakin halus serbuk simplisia, maka proses ekstraksi makin efektif dan
efisien, namun makin halus serbuk, maka makin rumit secara teknologi
peralatan untuk tahap filtrasi (DepKes, 2000).
b) Cairan pelarut
Cairan pelarut dalam pembuatan ekstrak adalah pelarut yang baik
(optimal) untuk senyawa kandungan yang berkhasiat atau yang aktif,
dengan demikian senyawa tersebut dapat dipisahkan dari bahan dan dari
senyawa kandungan lainnya, serta ekstrak hanya mengandung sebagian
besar senyawa kandungan yang diinginkan. Dalam ekstrak total, maka
cairan pelarut dipilih yang melarutkan hampir semua metabolit sekunder
yang terkandung (DepKes, 2000).
c) Separasi dan pemurnian
Tujuan dari tahap ini adalah menghilangkan (memisahkan) senyawa yang
tidak dikendaki semaksimal mungkin tanpa berpengaruh pada senyawa
kandungan yang dikehendaki, sehingga diperoleh ekstrak yang lebih
murni. Proses – proses pada tahap ini adalah pengendapan, pemisahan dua cairan tak campur, sentrifugasi, dekantasi, filtrasi serta proses adsorbsi dan
d) Pemekatan / Penguapan (vaporasi dan evaporasi)
Pemekatan berarti peningkatan jumlah partial solute (senyawa terlarut)
secara penguapan pelarut tanpa sampai menjadi kondisi kering, ekstrak
hanya menjadi kental/pekat (DepKes, 2000).
e) Pengeringan ekstrak
Pengeringan berarti menghilangkan pelarut dari bahan sehingga
menghasilkan serbuk, massa kering–rapuh, tergantung proses dan peralatan yang digunakan (DepKes, 2000).
2.4 Metode Ekstraksi
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan 2 cara,
yaitu :
1. Cara Dingin, antara lain :
a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan
menggunakan pelarut beberapa kali pengocokan atau pengadukan
pada temperatur ruangan (kamar). Secara teknologi termasuk
ekstraksi dengan prinsip metode pencapaian konsentrasi pada
keseimbangan. Maserasi kinetik berarti dilakukan pengadukan
yang kontinu (terus–menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilkukan penyaringan
maserat pertama, dan seterusnya (DepKes, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru
sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan (DepKes, 2000).
2. Cara Panas
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur
titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas
yang relatif konstan dengan adanya pendingin balik (DepKes,
b. Soxlet
Soxlet adalah ekstraksi menggunakan pelarut yang selalu
baru yang umumnya dilakukan dengan alat khusus sehingga terjadi
ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan
adanya pendingin balik (DepKes, 2000).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan
kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan
(kamar), yaitu secara umum dilakukan pada temperatur 40 – 50 oC (DepKes, 2000).
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur
penangas air (bejana infus tercelup dalam penangas air mendidih,
temperatur terukur 96–98 oC) selama waktu tertentu (15-20 menit) (DepKes, 2000).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (> 30 menit) dan
temperatur sampai titik didih air (DepKes, 2000).
Faktor–faktor yang mempengaruhi mutu ekstrak, antara lain : (DepKes,
2000).
1. Faktor biologi
a) Identitas jenis (species). Jenis tumbuhan dari sudut keragaman
hayati dapat dikonfirmasi sampai informasi genetik sebagai
faktor internal untuk validasi jenis (species).
b) Lokasi tumbuhan asal. Lokasi berarti faktor eksternal, yaitu
lingkungan (tanah dan atmosfer) dimana tumbuhan berinteraksi
berupa energi (cuaca, temperatur, cahaya) dan materi (air,
senyawa organik dan anorganik).
c) Periode pemanenan hasil tumbuhan. Faktor ini menentukan
kapan senyawa kandungan mencapai kadar optimal dari proses
d) Penyimpanan bahan tumbuhan. Merupakan faktor eksternal
yang dapat diatur karena dapat berpengaruh pada stabilitas
bahan serta adanya kontaminasi.
e) Umur tumbuhan dan bagian yang digunakan.
2. Faktor kimia
a) Faktor internal, yaitu jenis senyawa aktif dalam bahan,
komposisi kualitatif senyawa aktif, komposisi kuantitatif
senyawa aktif, kadar total rata – rata senyawa aktif.
b) Faktor eksternal, yaitu metode ekstraksi, perbandingan ukuran
alat ekstraksi, kekerasan dan kekeringan bahan, pelarut yang
digunakan, kandungan logam berat dan pestisida.
2.5 Kanker
Kanker atau neoplasma ialah penyakit pertumbuhan sel yang
terjadi karena dalam tubuh timbul dan berkembang biak sel-sel baru yang
bentuk, sifat dan kinetikanya berbeda dari sel normal asalnya. Sel yang
baru itu pertumbuhannya liar, terlepas dari sistem kendali pertumbuhan
normal sehingga merusak bentuk dan atau fungsi organ yang terkena. Kata
neoplasma berasal dari bahasa Yunani neos yang berarti baru dan plasein
yang berarti bentukan, yaitu bentukan baru berupa sel baru yang berbeda
dari sel asalnya. Sel neoplasma itu terjadi karena ada mutasi atau
transformasi sel normal akibat adanya kerusakan gen yang mengatur
pertumbuhan dan diferensiasi sel (Sukardja, 2000).
Segala sesuatu yang menyebabkan terjadinya kanker disebut
karsinogen. Dari berbagai penelitian dapat diketahui bahwa karsinogen
dapat dibagi menjadi 4 golongan : (Pringgoutomo,S.dkk.,2002)
c. Karsinogen radiasi, contohnya : radiasi UV
d. Agen biologik, contohnya : beberapa jenis hormon, mikotoksin,
dan parasit.
Dari percobaan pada binatang diketahui bahwa terjadinya neoplasma
melalui 2 tahap transformasi sel yaitu tahap inisiasi dan tahap promosi
(Pringgoutomo,S.dkk.,2002)
Tahap Inisiasi
Pada tahap inisiasi sel normal berubah menjadi sel yang
mempunyai potensi untuk menjadi sel neoplastik. Pada tahap ini
karsinogen yang bekerja sebagai inisiator, cenderung berubah baik
langsung maupun melalui perubahan metabolik menjadi gugus
yang bereaksi dengan DNA, mengakibatkan DNA pecah,
mengalami metilasi atau hambatan perbaikan kerusakan DNA.
Tahap Promosi
Bahan kimia yang merangsang transformasi neoplastik pada sel
yang telah diinisiasi tetapi tidak menyebabkan transformasi
neoplastik oleh dirinya sendiri disebut promotor. Promotor bekerja
mengubah ekspresi informasi genetik sel. Promotor merangsang
proliferasi klonal pada sel yang telah diinisiasi dan mengubah cara
diferensiasi dan maturasi.
2.6 Kanker Payudara (Carsinoma Mammae)
Kanker payudara adalah keganasan yang bermula dari sel-sel
payudara. Kanker ini menyerang jaringan payudara, tumbuh di dalam
kelenjar susu, saluran susu, dan jaringan lemak. Terjadinya karena ada
pertumbuhan abnormal sel pada kelenjar payudara. Namun, pertumbuhan
kanker payudara jauh lebih lambat dibandingkan dengan jenis kanker
lainnya. Sistem getah bening adalah salah satu cara utama kanker payudara
menyebar. Sel-sel kanker payudara dapat memasuki pembuluh limfe dan
mulai tumbuh di kelenjar getah bening. Jika sel-sel kanker payudara telah
kemungkinan besar sel-sel kanker telah masuk ke aliran darah dan
menyebar ke organ tubuh lainnya (Soebachman, 2011).
2.6.1 Faktor Etiologi Kanker Payudara
Kanker payudara terjadi akibat adanya mutasi tertentu pada DNA
sel payudara. Sebagian mutasi gen bersifat diwariskan (genetic). Sementara sebagian yang lain tampak terjadi dengan sendirinya tanpa
diketahui penyebab pastinya (Soebachman, 2011).
2.6.2 Faktor Risiko Kanker Payudara (Dalimartha, 2004)
Penyebab pasti dari kanker payudara belum diketahui. Namun, ada
beberapa faktor risiko yang bisa meningkatkan kemungkinan terjadinya
kanker payudara. Beberapa diantaranya sebagai berikut :
Riwayat Keluarga
Beberapa riwayat keluarga yang dianjurkan untuk pemeriksaan
deteksi dini yaitu ibu atau saudara perempuan terkena kanker
payudara, atau kanker yang berhubungan dari ibu atau ayah, kanker
ovarium, endometrium, kolorektal, prostat, tumor otak, leukimia,
dan sarkoma.
Faktor Hormon
Faktor hormon merupakan faktor yang banyak berpengaruh pada
timbulnya kanker payudara, seperti mendapat haid pertama
(menarke) sebelum umur 10 tahun, mati haid (menopause) setelah
umur 55 tahun, tidak menikah atau tidak melahirkan anak,
melahirkan anak pertama setelah umur 35 tahun, dan tidak pernah
menyusui anak.
Faktor Umur
Wanita berusia di atas 30 tahun mempunyai kemungkinan lebih
besar mendapat kanker payudara dan kemungkinan tersebut terus
bertambah sampai setelah menopause.
Pernah mengalami infeksi, trauma/benturan, operasi payudara
akibat tumor jinak (kelainan fibrokistik dan fibroadenoma), atau
Pernah menggunakan obat hormonal yang lama, seperti terapi sulih
hormon atau hormonal replacement therapy (HRT), dan pengobatan kemandulan (infertilitas).
Pemakaian kontrasepsi oral pada penderita tumor payudara jinak
seperti kelainan fibrokistik.
Pernah mendapat radiasi sebelumnya pada payudara atau dinding
dada, misalnya untuk pengobatan keloid.
Peningkatan berat badan yang signifikan pada usia dewasa.
2.6.3 Gejala Penyakit Kanker Payudara (Dalimartha, 2004)
Kanker payudara pada tahap dini biasanya tidak menimbulkan keluhan. Penderita merasa sehat, tidak merasa nyeri, dan tidak terganggu
aktivitasnya. Tanda yang mungkin dirasakan pada stadium dini adalah
teraba benjolan kecil di payudara. Keluhan baru timbul bila penyakitnya
sudah lanjut. Beberapa keluhannya yaitu :
Teraba benjolan pada payudara.
Bentuk dan ukuran payudara berubah, berbeda dari sebelumnya.
Luka pada payudara sudah lama tidak sembuh walau diobati.
Eksim pada puting susu dan sekitarnya sudah lama tidak sembuh
walau diobati.
Keluar darah, nanah, atau cairan encer dari puting atau keluar air
susu pada wanita yang tidak sedang hamil atau tidak sedang
menyusui.
Puting susu tertarik kedalam.
Kulit payudara mengerut seperti kulit jeruk (peau d’orange).
2.6.4 Pencegahan Kanker Payudara (Dalimartha, 2004)
Kanker payudara bisa dicegah dengan beberapa tindakan seperti
berikut :
Penggunaan obat-obat hormonal harus dengan sepengetahuan
dokter.
Wanita dengan riwayat keluarga menderita kanker payudara atau
yang berhubungan, tidak menggunakan alat kontrasepsi yang
Melakukan pemeriksaan terhadap diri sendiri setiap bulan. Bagi
wanita berisiko tinggi, melakukan juga pemeriksaan mammografi
secara berkala, terutama pada usia di atas 49 tahun.
Memberikan air susu ibu (ASI) pada anak selama mungkin dapat
mengurangi faktor risiko terkena kanker payudara. Hal ini
disebabkan selama proses menyusui, tubuh akan memproduksi
hormon oksitosin yang dapat mengurangi produksi hormon
estrogen. Hormon estrogen dianggap memegang peranan penting
dalam perkembangan sel kanker payudara.
Mejaga kesehatan dengan mengonsumsi buah dan sayuran segar.
Kedelai beserta produk olahannya, seperti susu kedelai, tahu, dan
tempe, mengandung fitoestrogen bernama genistein yang dapat
menurunkan kejadian kanker payudara.
Menghindari makanan berkadar lemak tinggi. Dari hasil penelitian,
konsumsi makanan berkadar lemak tinggi berkorelasi dengan
peningkatan kanker payudara.
2.7 MCF-7 Cell line
Sel MCF-7 adalah salah satu model sel kanker payudara yang
banyak digunakan dalam penelitian. Sel ini diperoleh dari jaringan epitel
payudara dengan titik metastasis pleural effusion breast adenocarcinoma
seorang wanita berusia 69 tahun dengan etnis kaukasian bergolongan
darah O dengan Rh+. Sel MCF-7 bersifat adherent sehingga metode kultur yang tepat adalah metode monolayer. Akronim dari MCF-7 yaitu
Michigan Cancer Foundation-7 (ATCC, 2012).
2.8 Antikanker 2.8.1 Obat Antikanker
Obat antikanker adalah senyawa kemoterapetik yang digunakan untuk pengobatan tumor yang membahayakan kehidupan (kanker). Obat
pengobatan kanker adalah merusak secara selektif sel tumor yang
berbahaya tanpa menganggu sel normal (Siswandono, 2000)
2.8.2 Mekanisme Kerja Obat Antikanker
Banyak obat antikanker yang bekerja dengan cara mempengaruhi
metabolisme asam nukleat, terutama DNA, atau biosintesis protein. Obat
antikanker dapat mempengaruhi proses kehidupan sel (Siswandono, 2000)
Proses kehidupan sel merupakan suatu siklus yang terdiri dari
beberapa fase sebagai berikut : (Siswandono, 2000)
1. Fase mitotik (M) : fase dimana terjadi pembelahan sel aktif. Setelah
melalui fase ini ada 2 alternatif :
a. Menuju fase G1 dan memulai proses proliferasi.
b. Masuk ke fase istirahat (Go), pada fase istirahat (Go) kemampuan
sel untuk berproliferasi hilang,sel meninggalkan siklus secara tidak
terpulihkan.
2. Fase post mitotik (G1), pada fase ini tidak terjadi sintesis DNA, tetapi
terjadi sintesis RNA dan protein. Pada akhir fase G1 terjadi sintesis
RNA yang optimum.
3. Fase sintetik (S), pada fase ini terjadi replikasi DNA sel.
4. Fase post sintetik (G2), fase ini dimulai bila sel sudah menjadi
tetraploid dan mengandung 2 DNA, kemudian sintesis RNA dan
protein dilanjutkan. Selanjutnya sel kembali ke fase mitotik, demikian
seterusnya sehingga merupakan suatu siklus.
2.8.3 Penggolongan Obat Antikanker
Obat antikanker dibagi menjadi 5 kelompok yaitu senyawa
pengalkilasi, antimetabolit, antikanker produk alam, hormon dan golongan
lain-lain (Siswandono, 2000)
1) Senyawa Pengalkilasi
Senyawa pengalkilasi adalah senyawa reaktif yang dapat mengalkilasi
DNA, RNA dan enzim – enzim tertentu. Mekanisme kerjanya adalah membentuk senyawa kationik antara yang tidak stabil, diikuti
pemecahan cincin membentuk ion karbonium reaktif. Ion ini bereaksi,
gugus donor elektron, seperti gugus karboksilat, amin, fosfat dan tiol,
yang terdapat pada struktur asam amino, asam nukleat dan protein,
yang sangat dibutuhkan untuk proses biosintesis sel. Reaksi ini
membentuk hubungan melintang (cross linking) antara dua rangkaian
DNA, akibatnya proses pembentukan sel terganggu dan terjadi
hambatan pertumbuhan sel kanker.
2) Antimetabolit
Antimetabolik adalah senyawa yang dapat menghambat jalur
metabolik yang penting untuk kehidupan dan reproduksi sel kanker,
melalui penghambatan asam folat, purin, pirimidin dan asam amino,
serta jalur nukleosida pirimidin, yang diperlukan pada sintesis DNA.
Struktur antimetabolit berhubungan erat dengan struktur metabolit
normal dan bersifat sebagai antagonis.
3) Antikanker Produk Alam
Antikanker produk alam dibagi mejadi tiga kelompok yaitu antibiotika
antikanker, antikanker produk tanaman dan antikanker produk hewan.
Antibiotika Antikanker
Beberapa antibiotik yang mula – mula dikembangkan sebagai senyawa antibakteri ternyata didapatkan memiliki efek sitotoksik
tinggi. Efek samping tersebut dievaluasi dan kemudian
dikembangkan menjadi obat – obat antikanker.
Antikanker Produk Tanaman
Mekanisme kerjanya sebagai antikanker adalah mengikat tubuli
dan menghambat pembentukan komponen mikrotubuli pada
kumparan mitosis sehingga metafase berhenti.
Antikanker Produk Rekayasa Genetika
Contohnya : antineoplaston, interferon α-2a, interferon α-2b. 4) Hormon
Beberapa neoplasma dapat dikontrol baik oleh hormon seks, seperti
hormon androgen, progestin dan estrogen, serta hormon
adrenokortikoid. Biasanya untuk pengobatan tambahan sesudah
2.9 Kultur Sel(Malole, 1990)
Kultur sel adalah kultur sel-sel yang berasal dari organ atau
jaringan yang telah diuraikan secara mekanis dan atau secara enzimatis
menjadi suspensi sel. Suspensi sel tersebut kemudian dibiakkan menjadi
satu lapisan jaringan (monolayer) di atas permukaan yang keras (botol,
tabung, cawan) atau menjadi suspensi sel dalam media penumbuh.
Monolayer tersebut kemudian diperbanyak lagi sesudah melalui proses
pemisahan sel secara enzimatis dan diencerkan dengan media penumbuh.
Teknik ini disebut subkultur atau pasase. Apabila dipasase terus menerus
maka dihasilkan sel lestrai (cell line).
Sel lestari memiliki beberapa sifat, yaitu : terjadi peningkatan
jumlah sel, sel-sel tersebut memiliki daya tumbuh yang tinggi, sel-sel
tersebut seragam, dan biasanya sel-sel tersebut mengalami perubahan
fenotipe dan transformasi.
Sebelum penambahan sel medium harus dipanaskan dahulu pada
temperatur 37 oC dan pHnya distabilkan. Bibit yang digunakan untuk
produksi sel hendaknya sel yang berada pada fase akhir pertumbuhan
logaritmis agar dapat dicapai tingkat produktivitas yang tinggi karena sel
tersebut masih aktif berbiak. Jumlah sel yang digunakan sebagai bibit
bervariasi antara jenis sel dan tergantung pada keadaan medium yang
digunakan, secara umum biasanya jumlah sel tersebut antara 50.000
sampai 200.000 sel/mL atau 5.000 sampai 20.000 sel/cm2. Pengadukan suspensi sel dilakukan pada kecepatan yang optimum, walaupun kecepatan
tersebut bervariasi pada setiap jenis sel dan bentuk bejana, akan tetapi
secara umum dapat digunakan 100-500 rpm, untuk kultur yang memakai
microcarrier antara 20-100 rpm.
Produktivitas dari suatu sistem produksi sel dipengaruhi oleh
beberapa faktor, antara lain :
a. Medium dan Bahan Nutrisi
Kualitas dan kuantitas bahan nutrisi yang tersedia dalam
medium menentukan jumlah sel yang dapat ditumbuhkan pada
(mengandung suplemen dan asam lemak). Untuk mempertahankan
kehidupan atau kultur sel perlu ada tambahan bahan nutrien serta
penggantian medium yang lama dengan medium yang baru secara
keseluruhan atau hanya sebagian atau dengan perfusi.
b. pH dan Dapar (buffer)
sistem karbondioksida bikarbonat yang sama seperti dalam darah.
Daya buffer dari medium ditingkatkan dengan adanya ion fosfat
yang terdapat pada larutan garam seimbang.
c. Oksigen
Peningkatan produksi sel pada kultur sangat tergantung
pada kecukupan penyediaan oksigen. Pemberian oksigen pada
kultur dapat dilakukan dengan beberapa cara antara lain pemberian
udara pada permukaan medium, difusi membran, perfusi medium
dan pemompaan oksigen langsung kedalam media.
2.10 Uji Sitotoksisitas
Uji sitotoksik adalah uji toksisitas secara in vitro menggunakan kultur sel yang digunakan dalam evaluasi keamanan obat, kosmetik, zat
tambahan makanan, pestisida dan digunakan untuk mendeteksi adanya
aktivitas antineoplastik dari suatu senyawa (Freshney, 1992).
Metode in vitro memberikan berbagai keuntungan, seperti: dapat digunakan pada langkah awal pengembangan obat, hanya membutuhkan
sejumlah kecil bahan yang digunakan untuk kultur primer manusia dari
berbagai organ target (ginjal, liver, kulit) serta memberikan informasi
secara langsung efek potensial pada sel target manusia. Akhir dari uji
sitotoksik dapat memberikan informasi konsentrasi obat maksimal yang
yang masih bertahan hidup pada uji sitotoksisitas dapat dilakukan dengan
berbagai cara yang seringkali didasarkan pada parameter kerusakan
membran, gangguan sintesis dan degradasi makromolekul, modifikasi
kapasitas metabolisme serta perubahan morfologi sel. Metode lain yang
dapat digunakan adalah metode kolorimetrik menggunakan suatu substrat
yang akan dimetabolisme oleh sel menjadi produk berwarna misal MTT
{3-(4,5-dimetil tiazol-2-il)-2,5-difenil tetrazolium bromida). Uji sitotoksik
dapat menggunakan parameter lC50. Nilai lC50 menunjukkan nilai
konsentrasi yang menghasilkan hambatan pertumbuhan sel sebesar 50%
dari populasi. Nilai lC50 dapat menunjukkan potensi suatu senyawa sebagai
sitotoksik. Semakin besar nilai lC50 maka senyawa tersebut semakin tidak
toksik (Heti, 2008).
2.11 Metode Pengujian Sitotoksik
a. MTT assay
MTT assay adalah teknik yang sering dipakai pada umumnya, teknik ini menggunakan garam tetrazolium atau MTT {3-(4,5-dimetil
tiazol-2-il)-2,5-difenil tetrazolium bromida) yang berwarna kuning dimana
akan dimetabolisme oleh enzim suksinat dehidrogenase yang terdapat pada mitokondria sel menjadi kristal formazan berwarna ungu (Freshney, 1992). MTT dilarutkan dalam Phosphate Buffer Saline (PBS) 5 mg/ml dan disaring untuk menghilangkan residu yang tidak larut. MTT ditambahkan
secara langsung pada plate yang berisi medium kultur sebanyak 10-100 µl
dan diinkubasi selama kurang lebih 4 jam pada 37o C. Kristal formazan yang berwarna ungu yang terbentuk akan terlarut dengan penambahan
isopropanol asam (100 µl 0,04 N HCl dalam isopropanol) atau SDS 10%
dalam HCl 0,01 N. Selanjutnya dibaca absorbansinya pada panjang
gelombang 550 nm. Intensitas warna yang terbentuk berbanding langsung
dengan jumlah sel yang aktif melakukan metabolisme (Zakaria, 2010).
b. Metode Perhitungan Langsung
Metode Perhitungan Langsung dilakukan dengan pengecatan
tripan, sedangkan yang mati tidak. Hal ini disebabkan karena sel yang mati
mengalami kerusakan pada membran selnya, mengakibatkan protein
didalam sel keluar dan berikatan dengan biru tripan. Pemberian biru tripan
dilakukan secara bertahap untuk menghindari kemungkinan kematian sel
yang disebabkan oleh biru tripan dan hasilnya sel yang mati akan tampak
keruh tidak bercahaya (Agoes, 1994).
c. Perubahan Integritas Membran
Metode ini terutama digunakan untuk senyawa toksik yang
memberikan efek dengan merusak membran sel yang tidak terjadi dalam
keadaan normal (seperti biru tripan dan eritrosin) dan pengeluaran isotop
atau pewarna dalam keadaan normal tidak dikeluarkan oleh sel, seperti
15
Kromium dan diasetil fluoresin (Freshney, 1992).
d. Radioisotop
Pemasukan radioisotop seperti [3H]-timidin ke dalam DNA dan [3H]-uridin ke dalam RNA (Freshney, 1992).
2.12 Microplate Reader
Microplate reader adalah jenis spektrofotometer khusus. Prinsip kerjanya adalah cahaya lampu memancarkan panjang gelombang cahaya,
lalu disaring oleh monokromator menjadi cahaya monokromatik. Sebagian
cahaya tersebut kemudian diserap oleh sampel yang ada di dalam
microplate dan sebagian yang lainnya diteruskan oleh sampel menuju detektor fotolistrik. Dari detektor fotolistrik serapan diubah menjadi sinyal
listrik hingga akhirnya didapat nilai absorbansi yang tertera pada komputer
(Anonim, 2012).
Daun tumbuhan paku (Angiopteris angustifolia C. Presl.) 3.1. Alur Penelitian
Simplisia
Maserasi dengan etanol 70 %
Ekstrak etanol dipekatkan dengan evaporator
Ekstrak etanol kental
Uji sitotoksisitas dengan metode MTT
Perhitungan % penghambatan proliferasi
Analisa data lC50 Sel MCF-7
Thawing
Subkultivasi
Perhitungan kepadatan sel dengan
Haemocytometer
Analisa kandungan kimia : Alkaloid, Flavonoid, glikosida,
saponin, tanin, dll.
3.2 Waktu dan Tempat Penelitian 3.2.1 Waktu Penelitian
Penelitian ini dilakukan dari bulan Juni 2012 sampai bulan Desember
2012.
3.2.2 Tempat Penelitian
Pembuatan ekstrak etanol dilakukan di Laboratorium Product Natural Analysist (PNA) FKIK Jurusan Farmasi UIN Jakarta. Penelitian Uji Sitotoksisitas dilakukan di Laboratorium Litbang RS. Kanker Dharmais – Jakarta.
tabung reaksi, timbangan analitik (Kern), inkubator CO2 (Memmert),
autoklaf (Hirayama), sentrifuge (Hettich), sentrifuge tube 15 mL dan 50
mL (Corning), Laminar Air Flow cabinet (LAF), biological safety cabinet
II (Esco), mikroskop inverted (Olympus), tangki nitrogen cair (Thermo),
culture flask (Corning), cryogenic vials (Nalgene), mikro pipet (Eppendorf), pipet tips (Axygen), pipet tips 5 mL (Eppendorf), syiringe
200 cc (Terumo), syiringe filter (Minisart), vortex (Heidolph), tabung
conical (Nunclon), microplate 96 sumuran (Nunclon), haemocytometer
(Nebauer), microplate reader, tabung falcon, hot plate, kulkas 4 oC dan -20oC (Toshiba), kulkas -80oC (Thermo).
3.3.2 Bahan yang digunakan a. Simplisia
Bahan utama dalam uji sitotoksisitas ini adalah bagian daun dari
tumbuhan paku yaitu Angiopteris angustifolia [C.Presl] yang diperoleh dari hutan daerah bogor, dan telah diidentifikasi di Herbarium Bogoriense
b. Sel Uji
Sel yang digunakan untuk uji sitotoksik adalah sel MCF-7 yang
diperoleh dari stok Laboratorium Litbang RS. Kanker Dharmais Jakarta.
c. Bahan Kimia yang Digunakan
Bahan kimia yang digunakan pada penelitian ini adalah etanol
70%, klorofom, aquadest, HCl, dragendorf, meyer, serbuk Mg, amil
alkohol, FeCl3, pereaksi Stiasny (Formaldehid 30% : HCl pekat = 2 : 1),
Na asetat, NaOH, pereaksi Liebermann-Buchard (2 tetes asam asetat
anhidrat dan 1 tetes H2SO4 pekat), eter, ammonia (NH4OH) 10%, media
sel RPMI (Rosewell Park Memorial Institute) (Gibco), Phosphate Buffered Salina (PBS), Penicillin-streptomisin, Fetal Bovine Serum (FBS) (Sigma), Trypsin EDTA 5% (Sigma), MTT [3-(4,5 dimetiltiazol-2-yI)-2,5 difenil
tetrazolium bromide] (Sigma), Trypan Blue Stain 0,4% (Sigma), DMSO
(Dimetil Sulfoksida) (AppliChem), Sodium bikarbonat (NaHCO3).
3.4 Metode Penelitian 3.4.1 Persiapan Simplisia
Daun tumbuhan paku yang telah dipisahkan dari batang dan
tangkainya, kemudian dibersihkan menggunakan tissue untuk
menghilangkan kotoran yang melekat pada daun tumbuhan paku tersebut.
Kemudian dirajang dan dikering anginkan. Setelah kering, daun tumbuhan
paku diblender sehingga diperoleh simplisia halus.
3.4.2 Pembuatan Ekstrak
Pembuatan ekstrak etanol dilakukan dengan cara maserasi serbuk
daun tumbuhan paku Angiopteris angustifolia C. Presl. menggunakan etanol 70%. Maserasi dilakukan dengan cara merendam serbuk simplisia
dengan pelarut, penggantian pelarut dilakukan 3 hari sekali sampai cairan
pelarut tidak berwarna atau bening, dimana setiap hari labu maserasi
digoyang-goyangkanagar semua serbuk dapat menyentuh pelarut dengan
sempurna. Setelah semua filtrat terkumpul dilakukan pemekatan dengan
kemudian dilakukan teknik freezdry untuk mengangkat air tersebut sehingga didapat ekstrak kental. Proses freezdry dilakukan selama 12 jam.
3.4.3 Penapisan Fitokimia
Penapisan fitokimia bertujuan untuk mengetahui kandungan
senyawa kimia seperti alkaloid, flavonoid, saponin, tanin, fenol, glikosida,
dan triterpenoid yang terdapat pada ekstrak.
a. Pemeriksaan Ekstrak (Ayoola et al., 2008)
1) Gula Pereduksi (Uji Fehling)
Larutan ekstrak etanol (0,5 gram ekstrak dalam 5 mL aquadest) lalu
ditambahkan larutan Fehling A dan B kemudian dididihkan dalam tabung
reaksi. Perubahan warna yang terjadi pada larutan mengindikasikan
adanya gula pereduksi.
2) Terpenoid (Uji Salkowski)
Sebanyak 0,5 gram ekstrak ditambahkan 2 mL kloroform, kemudian
ditambahkan 3 mL asam sulfat (H2SO4) untuk membentuk lapisan.
Adanya warna merah kecoklatan diantara lapisan mengindikasikan adanya
terpenoid.
3) Triterpenoid (Tiwari, 2011)
Uji Salkowskii: Ekstrak dilarutkan dengan kloroform dan disaring. Filtrat
kemudian ditambahkan beberapa tetes larutan asam sulfat, lalu dikocok
dan didiamkan. Terbentuk warna kuning keemasan mengindikasikan
adanya triterpenoid.
4) Flavonoid
Terdapat 3 metode yang digunakan untuk menguji keberadaan flavonoid :
Pertama: 5 ml larutan ammonia ditambahkan ke dalam filtrat air dari
ekstrak, lalu ditambahkan 1 mL asam sulfat. Terbentuk warna kuning
menunjukkan adanya flavonoid.
Kedua: Beberapa tetes dari larutan ammonia 1% ditambahkan ke dalam
filtrat ekstrak. Terbentuk warna kuning menunjukkan adanya flavonoid.
Ketiga: Sejumlah cuplikan ekstrak ditambahkan 10 mL etil asetat dan
kemudian disaring, diambil 4 mL filtratnya dan ditambahkan dengan 1 mL
larutan ammonia. Terbentuk warna kuning menunjukkan adanya
flavonoid.
5) Saponin
0,5 gram ekstrak ditambahkan 5 mL aqua destilat dalam tabung reaksi.
Larutan kemudian dikocok dengan kuat, lalu diamati busa yang terbentuk
secara stabil. Ke dalam busa ditambahkan 3 tetes minyak zaitun lalu
dikocok kuat, terbentuknya emulsi mengindikasikan keberadaan saponin.
6) Tannin
0,5 gram ekstrak dididihkan dalam 10 mL aquadest dalam tabung reaksi,
lalu disaring. Kemudian kedalam filtrat ditambahkan beberapa tetes ferri
klorida 0,1%. Terbentuk warna hijau kecoklatan atau biru kehitaman
menunjukkan keberadaan tannin.
7) Alkaloid (Tiwari, 2011)
Ekstrak dilarutkan dalam HCl dan disaring, lalu filtratnya dikumpulkan.
Uji Meyer: Filtrat ditambahkan dengan reagent Meyer (potasium merkuri
iodida). Terbentuk endapan berwarna kuning mengindikasikan adanya
alkaloid.
Uji Dragendroff: Filtrat ditambahkan dengan reagent Dragendroff (larutan
potasium bismut iodida). Terbentuk endapan merah mengindikasikan
adanya alkaloid.
8) Glikosida Jantung (Uji Keller-Killani)
0,5 gram ekstrak dilarutkan dengan 5 mL aquadest dan ditambahkan 2 mL
asam asetat glasial yang mengandung satu tetes larutan ferri klorida. Lalu
ditambahkan pada lapisan bawah dengan asam sulfat. Terbentuknya cincin
coklat diantara lapisan menujukkan adanya deoxysugar yang merupakan
karakteristik dari kardeonolid. Cincin ungu dapat terlihat dibawah cincin
coklat, pada lapisan asam asetat dapat terbentuk cincin kehijauan sedikit
diatas cincin coklat lalu tersebar perlahan-lahan keseluruh lapisan tersebut.
9) Fenol (Tiwari, 2011)
Uji Ferri Klorida: Ekstrak ditambahkan 3-4 tetes larutan ferri klorida.
10) Protein (Tiwari, 2011)
Uji Xantoprotein: Ekstrak ditambahkan beberapa tetes dari larutan asam
nitrat. Terbentuk warna kuning mengindikasikan adanya protein.
b. Rendemen total ekstrak etanol tumbuhan paku
Rendemen ekstrak tumbuhan paku total dihitung dengan
membandingkan berat awal serbuk dengan berat akhir ekstrak tumbuhan
paku total yang dihasilkan.
3.4.4 Sterilisasi Alat
Alat-alat yang digunakan harus dalam keadaan steril. Untuk
senyawa yang tidak tahan terhadap pemanasan perlakuan dapat dilakukan
secara aseptis di dalam LAF (Laminar Air Flow), hal ini bukanlah proses
sterilisasi akan tetapi dilakukan untuk mencegah adanya kontaminasi.
Filter yang umumnya digunakan adalah syiringe filter membrane non pyrogenic dengan ukuran pori 0,2 µM. Untuk alat-alat gelas dicuci bersih lalu dikeringkan, selanjutnya dibungkus dengan kertas dan disterilkan
dalam autoklaf pada suhu 121 oC selama 15 menit.
3.4.5 Pembuatan Reagen
a. Pembuatan Larutan PBS (Phosphat Buffer Saline)
Ke dalam gelas becker dimasukkan aqua steril lalu ditambahkan
serbuk PBS secara perlahan-lahan dan diaduk menggunakan magnetic stirrer sampai serbuk terlarut sempurna. Dilakukan pengecekan pH (7,2). Kemudian dimasukkan ke dalam botol yang bertutup dan disterilisasi
menggunakan autoklaf selama 20 menit pada suhu 121o C. Lalu disimpan pada suhu ruangan (Freshney, 2010). Adapun pembuatan secara manual
adalah dengan Sebanyak 2.16 gram hidrogen fosfat (Na2HPO4) ditimbang,
kemudian ditambahkan 0.20 gram kalium fosfat (KH2PO4), 8.0 gram
natrium klorida (NaCl) dan 0.20 gram kalium klorida (KCl). Kemudian
dilarutkan dalam aquadest steril hingga 1 liter. Larutan distabilkan pada
pH 7.2 dengan menggunakan alat pH meter kemudian disterilkan dengan
b. Pembuatan Larutan MTT (3 – [4,5 – dimethylthiazol – 2Yi] – 2,5 – diphenyl tetrazolium bromide)
Melarutkan 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium
bromide (MTT) sebanyak 50 mg/mL dalam PBS. Kemudian disterilisasi
dengan filtrasi (Freshney, 2010). Filtrasi dilakukan menggunakan syiringe filtermembrane non pyrogenic dengan diameter pori sebesar 0.2 μM.
c. Pembuatan Larutan Trypsin
25 gram Trypsin ditimbang dan ditambahkan NaCl 0,14 M hingga
1 liter kemudian diaduk hingga larut menggunakan magnetic stirrer
selama 1 jam pada suhu ruangan. Lalu disterilisasi dengan filtrasi.
Kemudian dibagi ke dalam 10-20 ml bagian dan disimpan pada suhu -20o C. Sebelum digunakan dilarutkan terlebih dahulu dengan PBS
(perbandingan 1: 10). Larutan Trypsin yang disimpan pada suhu 4o C akan stabil maksimal 3 minggu (Freshney, 2010).
d. Pembuatan Larutan Trypan Blue
0.4 % Trypan Blue dilarutkan ke dalam PBS (Freshney, 2010).
e. Pembuatan Medium RPMI Berserum
Sebanyak 500 mL medium RPMI ditambahkan 10% FBS yaitu 50
mL dan Penstrep (Penisilin-Streptomisin) sebanyak 5 mL kemudian
dihomogenkan. Selanjutnya larutan medium RPMI berserum disaring
dengan syiringe filter membrane non pyrogenic dengan diameter pori sebesar 0.2 μM dan disimpan pada suhu 4oC.
3.4.6 Persiapan Larutan Uji dan Blangko DMSO a. Larutan Uji ekstrak etanol
200 mg ekstrak etanol ditimbang dalam microtube, kemudian dilarutkan dengan 1.000 µl DMSO 99,5%, lalu disentrifus sampai
homogen. Larutan ini dijadikan larutan induk dengan konsentrasi 200.000
ppm (larutan induk 1). Selanjutnya dari larutan induk 1 dibuat konsentrasi
200 ppm (larutan induk 2), lalu dibuat larutan uji dengan seri 100 μg/mL,
b. Kontrol DMSO (Kontrol Negatif)
Larutan DMSO dibuat dengan mengencerkan DMSO 99,5%
menjadi larutan DMSO dengan konsentrasi 0,1%. Selanjutnya larutan
DMSO disaring dengan syiringe filter membrane non pyrogenic dengan diameter pori sebesar 0.2 μM. Digunakan DMSO pro Analysis.
3.4.7 Persiapan Kultur sel MCF-7 (Freshney, 2010) a. Pengaktifan sel (Thawing Kultur Sel)
a) Bahan steril yang dibutuhkan : culture flask, tabung sentrifus, mikropipet & tips 1 mL-10 mL, syiringe.
b) Bahan nonsteril yang dibutuhkan : waterbath suhu 37oC, alkohol swab 70%.
1) Tabung yang berisi cell line MCF-7 dikeluarkan dari tabung nitrogen cair, kemudian dicairkan dalam waterbath pada suhu 37 oC sampai gumpalan di dalam vial mencair.
2) Bagian luar dari ampul dibersihkan dengan alkohol swab 70%.
3) Di dalam laminar air flow, cairan sel dipipet sebanyak 1 mL dan
dimasukkan ke dalam tabung sentrifus, ditambahkan 10 mL medium
RPMI secara perlahan-lahan kemudian disentrifus dengan kecepatan
1000 ppm selama 5 menit.
4) Supernatan yang diperoleh dipisahkan, sedangkan pelet yang terbentuk
disuspensikan dengan 6 mL medium kultur RPMI dan FBS 10%.
5) Suspensi sel dipipet dan dimasukkan ke dalam culture flask, lalu diinkubasi pada suhu 37oC dalam inkubator CO2 5% selama 24 jam,
medium diganti setiap 3 – 4 hari untuk mendapatkan jumlah sel yang cukup dengan tingkat kepadatan sekitar 70-80% menutupi culture flask.
b. Pengembangan sel (Sub Kultivasi)
1) Setelah diinkubasi selama 1 hari, cultur flask yang berisi sel dikeluarkan dari inkubator.
2) Medium yang ada di dalam cultur flask dibuang kemudian dicuci dengan PBS sebanyak ± 10-15 mL untuk mencuci sebanyak 3-4 kali. Larutan PBS
dibuang, lalu ditambahkan 2 mL tripsin yang telah diencerkan dengan PBS
3) Selanjutnya sel diinkubasi selama 3 menit dalam inkubator suhu 37 oC dengan sedikit membuka tutup cultur flask.
4) Setelah 3 menit, cultur flask dikeluarkan dari inkubator kemudian diketuk-ketuk bagian luar dari dinding cultur flask dengan tujuan agar sel terlepas dari permukaan cultur flask. Sel dilihat di mikroskop untuk memastikan bahwa sel sudah lepas dari permukaan dinding culture flask.
5) Culture flask kemudian dipindahkan ke dalam LAF ditambahkan RPMI berserum kedalam culture flask sebanyak 400 µL untuk menonaktifkan tripsin lalu dihomogenkan.
6) Larutan sel dimasukkan ke dalam tabung conical steril dan disentrifus selama 5 menit dengan kecepatan 1000 rpm.
7) Supernatan dibuang dan diganti dengan medium RPMI ± 1 mL, kemudian
dihomogenkan dengan pipet sehingga sel menyebar ke seluruh media.
8) Larutan sel tersebut diencerkan dengan tripan blue (10 µL tripan blue + 10
µL sel) dan dihitung jumlah selnya menggunakan Haemocytometer. Syarat jumlah sel dalam setiap sumuran adalah 5x103 sel.
9) Sel dihitung dari keempat bidang besar pada sudut seluruh permukaan
yang terbagi. Penghitungan dimulai dari sisi kiri atas kemudian ke kanan,
turun ke bawah dan dari kanan ke kiri. Cara tersebut dilakukan pada
keempat bidang besar. Sel yang menyinggung garis batas sebelah kiri atau
atas harus dihitung. Sebaliknya sel yang menyinggung garis batas sebelah
kanan atau bawah tidak dihitung. Jumlah sel per ml dihitung menggunakan
rumus:
n = Jumlah sel dalam keempat bidang besar
4 = Jumlah bilik haemocytometer yang dihitung P = Faktor pengenceran terhadap indikator warna
3.4.8 Pemeliharaan Terhadap Kultur Sel Kanker
Sel diamati setiap hari menggunakan mikroskop untuk memeriksa
kemungkinan adanya pencemaran mikroorganisme lain seperti bakteri dan
jamur. Apabila medium kultur telah berubah warna maka diganti dengan
3.4.9 Uji Sitotoksisitas
Uji sitotoksisitas menggunakan plat kultur jaringan 96 sumuran
sebagai media uji. Sebanyak 100 µL suspensi sel dalam medium RPMI
berserum dimasukkan kedalam setiap sumuran pada plat kultur jaringan,
lalu diinkubasi dalam inkubator CO2 5% pada suhu 37oC selama 48 jam
untuk mendapatkan pertumbuhan yang baik (Meiyanto, 2008). Setelah 48
jam sel akan melekat pada dasar mikroplate, lalu medium dibuang, ke
dalam masing-masing sumuran ditambahkan 200 µL larutan uji (ekstrak
etanol tumbuhan paku) dalam medium RPMI 1640 dan larutan kontrol
DMSO (kontrol negatif) dalam medium RPMI 1640 dengan konsentrasi
0,1% serta kontrol sel dalam medium sebanyak 200 µL (sebagai blanko).
Kemudian diinkubasi pada suhu 37oC dalam inkubator CO2 5% selama 24
jam. Sel diamati dengan mikroskop pada saat inkubasi 4, 8, dan 24 jam.
Didalam LAF masing-masing medium di dalam sumuran dibuang.
Kemudian ditambahkan 100 µL PBS lalu digoyang-goyangkan dan
dibuang. Sebanyak 100 µL RPMI berserum dan 10 µL MTT ditambahkan
ke dalam setiap sumur, kemudian diinkubasi dalam inkubator CO2 5%
pada suhu 37oC selama 4 jam, dikeluarkan dari inkubator dan dilihat kristal formazan ungu yang terbentuk dengan mikroskop. Selanjutnya
ditambahkan 100 µL DMSO pada masing-masing sumuran dan diaduk
sampai homogen, Masing-masing sumur dibaca secara langsung setelah
penambahan DMSO menggunakan microplate reader pada panjang gelombang 540-600 nm (CCRC, 2008).
3.4.10 Perhitungan Persentase Kematian Sel
Dengan menggunakan metode MTT presentasi kematian sel
merupakan selisih absorbansi kontrol negatif dengan absorbansi sampel uji
dibagi absorbansi kontrol negatif dikalikan 100%. Masing-masing
absorbansi telah dikoreksi dengan absorbansi dari larutan uji saja setiap
kadar. Perhitungan kematian sel dengan menggunakan metode MTT
menggunakan rumus sebagai berikut: (Zakaria, 2011)
3.4.11 Analisa Data
Dari hasil perhitungan jumlah sel yang hidup dapat digunakan
untuk menghitung presentase kematian sel dengan tujuan untuk
mendapatkan nilai IC50 dengan analisa probit. Dari data ini dibuat regresi
linier hubungan antara logaritma konsentrasi sebagai X dengan probit
sebagai Y. IC50 diperoleh dengan memasukkan nilai 5 sebagai probit ke
dalam persamaan regresi linier tersebut, kemudian hasil subtitusi ini
diantilogaritma dan hasil tersebut merupakan nilai IC50. Persentase
kematian yang dibuat ke dalam angka probit digambarkan hubungannya
dengan logaritma konsentrasi. Penarikan garis lurus yang paling baik
melalui titik-titik yang ada (berdasarkan penglihatan) dan konsentrasi pada
garis ini yang menyatakan 50% kematian (probit -5). Antilog titik ini
4.1 Hasil
4.1.1 Determinasi
Dari hasil determinasi yang diperoleh, tanaman yang digunakan
dalam penelitian ini adalah Angiopteris angustifolia C. Presl dengan famili Marattiaceae. Hasil determinasi dapat dilihat pada lampiran 1.
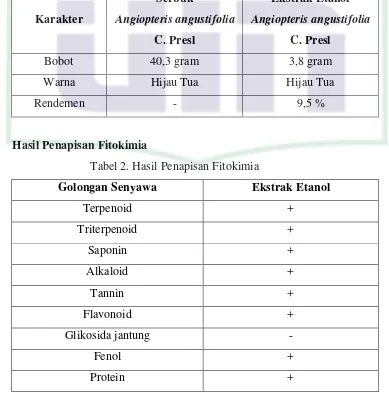
4.1.2 Hasil Ekstraksi
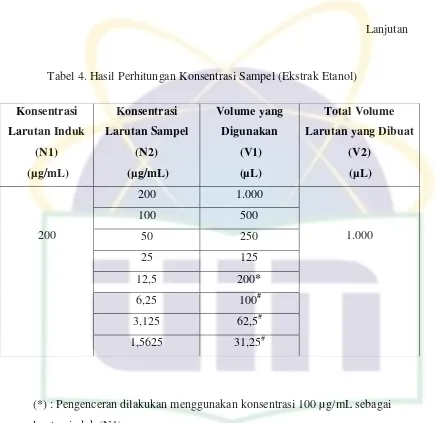
4.1.3 Hasil Penapisan Fitokimia
Tabel 2. Hasil Penapisan Fitokimia
Golongan Senyawa Ekstrak Etanol
Terpenoid +
Keterangan : (+) mengandung senyawa yang diuji
Proses penapisan fitokimia dapat dilihat pada lampiran 4.
4.1.4 Jumlah Kerapatan Sel
Jumlah kepadatan sel dihitung pada saat sel MCF-7 telah mecapai
kepadatan 80% menutupi permukaan culture flask. Yaitu setelah sel diinkubasi dalam inkubator CO2 5% dengan suhu 37o C selama 48 jam.
Perhitungan dilakukan dengan memipet 10 µL suspensi sel dan ditambah 10
µL trypan blue lalu diteteskan pada Haemocytometer (faktor pengenceran 2 kali). Jumlah kepadatan yang diperoleh adalah 1,97 x 106 sel/mL. Sedangkan syarat jumlah sel tiap sumuran adalah 5x103 sel/mL, sehingga jumlah sel yang harus dipipetkan tiap sumuran adalah 2,54 µL sel/sumuran. Namun, dalam
penelitian ini sel tidak dipipet satu per satu artinya sel tidak dimasukkan 2,54
µL sel/sumuran, tetapi sebanyak 254 µL sel (2,54 µL x 100 sumuran)
dilarutkan dalam medium RPMI 1640 berserum ad 10 mL. Lalu dipipet sebanyak 100 µL suspensi sel ke dalam setiap sumuran. Perhitungan
kepadatan sel dapat dilihat pada lampiran12.
4.1.5 Hasil Pengujian Sitotoksik Ekstrak Etanol Angiopteris angustifolia terhadap Sel MCF-7
Tabel 3. Hasil Pengujian Antiproliferatif Angiopteris angustifolia terhadap Sel MCF-7
*
Perhitungan analisa probit dan grafik uji antiproliferatif Angiopteris angustifolia dapat dilihat pada lampiran 14.