Siswa dapat menjelaskan dan menentukan nilai berbagai sifat koligatif larutan elektrolit dan nonelektrolit
1. Menjelaskan sifat-sifat koligatif larutan non-elektrolit dan non-elektrolit.
Standar Kompetensi Kompetensi Dasar Nilai Indikator
Kreatif Mengidentifikasi titik didih berbagai larutan.
Pada bab ini akan dipelajari:
1. Pengertian, Jenis Sifat Koligatif, dan Satuan Konsentrasi 2. Sifat Koligatif Larutan Nonelektrolit
3. Sifat Koligatif Larutan Elektrolit
Model Pengintegrasian Nilai Pendidikan Karakter
1.1 Menjelaskan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku larutan, dan tekanan osmosis termasuk sifat koligatif larutan. 1.2 Membandingkan antara sifat
koligatif larutan nonelektrolit dengan sifat koligatif larutan elektrolit yang konsentrasinya sama berdasarkan data percobaan.
Menjelaskan pengertian, jenis sifat koligatif, dan satuan konsentrasi
Menjelaskan sifat koligatif larutan nonelektrolit
Menjelaskan sifat koligatif larutan elektrolit
Menjelaskan satuan konsentrasi yang digunakan dalam perhitungan
sifat koligatif
• Menjelaskan pengertian sifat koligatif larutan nonelektrolit • Menjelaskan pengaruh zat
terlarut yang sukar menguap terhadap tekanan uap pelarut • Menghitung tekanan uap larutan
nonelektrolit berdasarkan data percobaan
• Menjelaskan diagram P-T untuk menafsirkan penurunan tekanan uap, titik beku, dan kenaikan titik didih larutan
• Menjelaskan pengertian osmosis dan tekanan osmotik serta terapannya
• Menghitung tekanan osmotik larutan nonelektrolit
• Menghitung tekanan uap larutan elektrolit menggunakan faktor-faktor Van’t Hoff berdasarkan data percobaan
• Menghitung penurunan titik beku larutan elektrolit dan nonelektrolit • Menentukan kenaikan titik didih suatu zat cair akibat penambah-an zat terlarut melalui percobapenambah-an • Menghitung kenaikan titik didih larutan elektrolit dan nonelektrolit • Menghitung tekanan osmotik
larutan elektrolit
• Menganalisis data percobaan untuk membandingkan sifat koligatif larutan elektrolit dan nonelektrolit
Siswa mampu menghitung konsentrasi suatu larutan yang
digunakan dalam sifat koligatif
Siswa mampu menjelaskan sifat-sifat larutan nonelektrolit melalui grafik dan
perhitungan
Siswa mampu menjelaskan sifat-sifat larutan elektrolit melalui pengamatan
dan perhitungan
A. Pilihan Ganda
1. Jawaban: e
m =
×
= ×
= 0,1 m 2. Jawaban: c
xmetanol =
+
= + = 0,64
Berat metanol = 0,64 × 100% = 64% 3. Jawaban: c
1 molal artinya 1 mol zat terlarut dalam 1.000 gram pelarut.
4. Jawaban: d
Fraksi mol NaOH = 0,05
Fraksi mol H2O = 1 – 0,05 = 0,95 Mr air = 18
Molalitas (m) = ×× = 2,92
5. Jawaban: c
46% massa etanol berarti 46 gram etanol dan 54 gram air.
m =
×
= ×
= 18,52 molal
B. Uraian
1. Larutan 6 gram urea dalam 200 gram air. Jumlah mol urea =
− = 0,1 mol Massa pelarut = 200 gram = 0,2 kg m = = = 0,5 mol kg–1
2. Mr CH3COOH = 60 g/mol Mr H2O = 18 g/mol nCH
3COOH =
= 0,25 mol = n1
nH
2O =
= 5 mol = n2
xCH
3COOH =
+ =
+ = 0,05 xH
2O = 1 – 0,05 = 0,95
3. Dalam 100 gram larutan urea 20% terdapat 20 gram urea dan 80 gram air.
Jumlah mol air =
− = 4,44 mol Jumlah mol urea = − = 0,33 mol
xurea =
+ = 0,069
4. Dalam 100 gram larutan glukosa 12% terdapat: glukosa 12% = × 100 g = 12 gram
air (pelarut) = 100 – 12 = 88 gram
Jumlah mol glukosa = − = 0,067 mol
Massa pelarut = 88 gram = 0,088 kg m = = = 0,76 mol kg–1
5. Mr HCl = 36,5 g/mol
Massa larutan = 1.000 ml × 1,1 gram/ml = 1.100 gram
Massa HCl = × 1.100 gram = 200,75 gram
Massa H2O = (1.100 – 200,75) gram = 889,25 gram
nHCl = = 5,50 mol
nH
2O =
= 49,96 mol xHCl = + = 0,1 xH
π=
× × R × T
0,947 =
×
× 0,082 × 328 Mr alkana = 71,8 = 72
Rumus alkana: CnH2n + 2 CnH2n + 2= 72 n(Ar C) + {(2n + 2)(Ar H)} = 72 12n + {(2n + 2)(1)} = 72 12n + 2n + 2 = 72 14n = 70 n = 5
Jadi, rumus molekul gas alkana tersebut C5H12. 6. Jawaban: d
π= M · R · T
π=
· R · T
Larutan yang memiliki tekanan osmotik paling besar yaitu larutan yang perbandingan
paling besar.
Larutan 1;
= 0,1 ×
= 0,5 Larutan 2; = 0,1 × = 0,25
Larutan 3; = 0,2 × = 0,67
Larutan 4; = 0,2 × = 0,8
Larutan 5; = 0,2 × = 0,4
Jadi, tekanan osmotik paling besar dimiliki oleh larutan 4.
7. Jawaban: e
Besarnya kenaikan titik didih larutan sebanding dengan konsentrasi molal (m) sehingga dalam pelarut yang sama, semakin tinggi konsentrasi molalnya, maka titik didih larutan itu juga semakin tinggi. Dengan demikian, larutan sukrosa 0,5 m mempunyai titik didih paling tinggi.
A. Pilihan Ganda
1. Jawaban: d
∆Tb = 100,026°C – 100°C = 0,026°C ∆Tb = Kb ×
×
0,026 = 0,52 ×
×
Mr = 342 g/mol
2. Jawaban: d
Oleh karena larutan isotonik, tekanan osmotik zat X sama dengan tekanan osmotik gula.
πzat X = πC
12H22O11
×
× 0,082 × T1 =
×
× 0,082 × T2
= 0,05
Mr X = Mr X = 180 g/mol 3. Jawaban: c
∆Tb = mKb
∆Tb =
−
× Kb
0,48°C = − × Kb
Kb =
!° × × −
= 3,84 °C kg mol–1
Tetapan titik didih molal kloroform Kb = 3,84°C kg mol–1.
4. Jawaban: d
Adanya zat terlarut nonvolatil dalam suatu pelarut cair mengakibatkan penurunan tekanan uap jenuh. Semakin besar konsentrasi zat terlarut nonvolatil yang ditambahkan, semakin besar penurunan tekanan uap jenuh yang teramati atau semakin kecil tekanan uap jenuh. Jadi, urutan larutan yang mempunyai tekanan uap dari yang paling kecil hingga paling besar yaitu R, Q, T, P, dan S. 5. Jawaban: b
Massa = ρ × volume = 2,53 g/L × 0,2 L = 0,506 gram π = 720 mmHg = 0,947 atm
Suhu 8. Jawaban: a
ρair = 1 g/ml
Jadi, besarnya Kb sukrosa 0,22°C/m. 9. Jawaban: c
∆Tb= 10. Jawaban: b
Adanya zat terlarut pada suatu larutan memengaruhi titik didih larutan, yaitu mengakibatkan titik didih larutan lebih tinggi dari titik didih pelarut murninya.
11. Jawaban: b
∆Tb= Tb larutan – Tb pelarut
Pelarut ditambah 250 gram p = (750 + 250) gram
Jika larutan ditambah pelarut, titik didih larutan mengalami penurunan.
12. Jawaban: b
∆Tb=
∆Tb= titik beku pelarut – titik beku larutan 0,36 = 0° – titik beku larutan
Jadi, titik beku larutan tersebut adalah –0,36°C. 13. Jawaban: b
200 ml = 0,2 liter dan 27°C = 300 K
14. Jawaban: b
∆Tf = 0 – (–0,28) = 0,28°
15. Jawaban: c
B. Uraiant!
1. ∆Tb= Kb ×
×
= 0,52 × ×
= 0,42°C
Tb larutan glukosa = ∆Tb air + ∆Tb = (100 + 0,42)°C = 100,42°C
2. nair = nA = = 55 P = xA – P0
= $
$ &
+ · P0 17,37 =
&
+ × 18 nB= 2
nB= nzat X 2 =
Mr= 60
3. ∆Tb = (100,65 – 100)°C = 0,65°C
Misal kadar gula dalam larutan = a% dalam 100 gram larutan:
– Gula = × 100 gram = a gram – Air = (100 – a) gram
∆Tb =
×
× Kb
0,65 = ×
− × 0,52 0,4275 = −
42,75 – 0,4275a = a 1,4275a = 42,75
a = 29,95 = 30
Jadi, kadar gula dalam larutan 30%.
4. ∆Tb= 101,3 – 100 = 1,3°C ∆Tb =
×
× Kb
1,3 =
×
× 0,52 Mr = 180
Rumus molekul = (CH2O)n Mr= (12 + 2 × 1 + 16) × n 180 = 30 × n
n = 6
Rumus molekul senyawa tersebut C6H12O6.
5. np (mol pelarut, H2O) =
−
×
= 5,56 mol
nt (mol terlarut formamid) =
'*< −
=
'*< mol ∆P = P° – P = xt × P°
xt = >° −>°>
= ? ?− ?
= 1,9 × 10–2
xt =
+
Untuk larutan encer, harga nt sangat kecil dibandingkan np. Oleh karena itu, harga nt + np dapat dianggap sama dengan np saja sehingga xt =
.
1,9 × 10–2 =
'*<
Mr formamid =
× −
= = 45,45
A. Pilihan Ganda
1. Jawaban: e
∆Tf terbesar terdapat dalam senyawa dengan jumlah ion terbanyak untuk Na2SO4·Al2(SO4)3 → n = 8.
2. Jawaban: e
Untuk larutan NaCl (elektrolit) akan terurai menurut reaksi:
NaCl Na+ + Cl– (n = 2)
Penurunan titik beku: n = 2, valensi 1, m = 0,4 m
∆Tf= m · Kf {1 + (n – 1)α} 1,488= 0,4 · 1,86 {1 + (2 – 1)α}
α= 1 3. Jawaban: a
Elektrolit biner → n = 2 ∆Tb= 100,175 – 100 = 0,75°C
∆Tb= {1 + (n – 1)α} ·
·
· Kb 0,75 = {1 + (2 – 1)0,5} ×
×
× 0,5 0,75 = 1,5 ×
0,75 =
Mr= = 60 4. Jawaban: b
AlCl3 Al3+ + 3Cl– (n = 4)
Mr AlCl3 = 27 + (3 × 35,5) = 133,5 ∆Tb =
·
· Kb ·{1 + (n – 1)α}
=
·
· Kb · {1 + (4 – 1)0,8}
= 0,3536 = 0,354°C 5. Jawaban: d
K2SO4(aq) 2K+(aq) + SO 4 2–(aq)
n = 3
K2SO4 terionisasi sempurna, berarti α = 1. ∆Tb= i(m · Kb)
= {1 + (n – 1)α}(m · Kb)
= {1 + (3 – 1)1} × 0,1 m × 0,52°C m–1
= 0,156°C
Titik didih larutan = (100 + 0,156)°C = 100,156°C
6. Jawaban: d
17,4 gram K2SO4 dilarutkan ke dalam 250 gram air (Kb air = 0,52°C/molal)
Untuk larutan elektrolit berlaku rumus: ∆Tb= m · Kb · i
i = {1 + (n – 1)α) m = konsentrasi molal α = derajat disosiasi i = faktor Vant Hoff
K2SO4 termasuk elektrolit kuat (terionisasi sempurna, α = 1), jadi:
K2SO4→ 2K+SO 4
–2 jadi n = 3
i = {1 + (3 – 1)1} i = 3
∆Tb= m · Kb · i
= ( × ) × 0,52 × 3 = 0,624°C
7. Jawaban: a
Isotonik ⇒ πdarah = πNaCl 7,626 = "@!
× 0,082 × 310 × {1 + (2 – 1)1} mol NaCl = 0,15
Massa NaCl = mol NaCl × Mr NaCl = 0,15 × 58,5
= 8,775 gram
Jadi, massa NaCl yang harus dilarutkan sebesar 8,775 g.
8. Jawaban: b
Urea merupakan nonelektrolit, sedangkan magne-sium sulfat (MgSO4) elektrolit kuat (n = 2). ∆Tb = Kb × (molurea + molMgSO4 · i) ×
= 0,5 × ( +
× 2) ×
= 0,5 × ( ) × 20 = 1°C Tb = (100 + 1)° C = 101°C 9. Jawaban: e
Dari rumus kenaikan titik didih terlihat bahwa jika i > 1, kenaikan titik didih untuk larutan elektrolit umumnya lebih besar daripada larutan nonelektrolit. Pada soal, yang merupakan larutan elektrolit adalah:
2) NaCl, dalam air terurai menjadi NaCl → Na+ + Cl– n = 2
3) alkohol, dalam air terurai menjadi C2H5OH → C2H5+ + OH– n = 2
Oleh karena harga n paling besar dimiliki MgCl2, kenaikan titik didihnya yang paling besar adalah larutan MgCl2 (molalitas sama).
10. Jawaban: c
Larutan isotonik adalah larutan yang memiliki tekanan osmotik sama. Larutan NaCl = larutan elektrolit kuat, α = 1 dan terurai menjadi:
π= M · R · T · i
= 0,3 · RT(1 + (2 – 1) · 1) = 0,6RT
1) Larutan 0,1 M urea (nonelektrolit) π = 0,1RT
2) Larutan KNO3, n = 2 π = 0,2 · RT · 0,2 = 0,4RT
3) Larutan 0,6 M glukosa (nonelektrolit) π = 0,6RT
4) Larutan asam sulfat H2SO4→ n = 3
π = 0,4 · RT · 3 = 1,2RT 5) Larutan 0,3 M natrium sulfat
Na2SO4→ n = 3
π = 0,3 · RT · 3 = 0,9RT
Jadi, larutan yang isotonik dengan NaCl 0,3 M adalah larutan glukosa 0,6 M.
11. Jawaban: e
Tekanan osmotik sama jika jumlah zat terlarut sama.
Jumlah ion = 0,1 mol NaCl 500 ml = 2 × 0,1 × = 0,4 mol/L
Jumlah mol urea = 0,4 × = 0,4 mol/L 12. Jawaban: b
iKCl = {1 + (2 – 1)1} = 2
Titik didih larutan = 100°C + 2,5°C = 102,5°C 13. Jawaban: d
Untuk 100 gram larutan:
– Massa NaOH = × 100 = 4 gram 14. Jawaban: c
NaCl → Na+ + Cl–
15. Jawaban: b
A. Pilihan Ganda
1. Jawaban: b
∆Td= Td – Td = 100,65 – 100 = 0,65
∆Td =
·
· Kd 0,65 =
· · 0,52 a = 450 gram
2. Jawaban: c
∆Tb= Tb – Tb = 0 – (–5) = 5 ∆Tb =
·
· Kd 5 =
·
· 1,86 Mr = 223
3. Jawaban: b
Isotonik → π1 = π2 C1 · R1 · T1 = C2 · R2 · T2 Jika T1 = T2 maka C1 = C2.
# =
#
n2=
# # × n1
= × mol
= mol
Mr X =
= 138 2. K2SO4 2K+(aq) + SO
4
2–(aq) n = 3
K2SO4 terionisasi sempurna, berarti α = 1. ∆Tb = i(m · Kb)
= {1 + (n – 1) α}(m · Kb)
= {1 + (3 – 1)1} × 0,1 m × 0,52°Cm–1
= 0,156°C
Titik didih larutan = (100 + 0,156)°C = 100,156°C
3. Jumlah mol MgCl2 = − = 0,011 mol
Molalitas larutan = = 0,022 mol kg–1
Molaritas larutan juga dapat dianggap = 0,022 mol/liter karena ρair = 1 kg/L.
i = 1 + (n – 1) α = 1 + (3 – 1) 0,9 = 2,8
1) ∆Tb= Kb · m · i = 0,52 · 0,22 · 2,8 = 0,032°C
Titik didih larutan = 100 + 0,032°C = 100,032°C
2) ∆Tf = Kf · m · i = 1,86 · 0,22 · 2,8 = 0,115°C
Titik beku larutan = 0 – 0,115°C = –0,115°C
3) Molaritas larutan juga dapat dianggap = 0,022 mol/liter.
π = M · R · T · i
= 0,22 · 0,08205 · 298 · 2,8 = 1,51 atm
4. NaCl → Na+ + Cl–; n = 2
π = {1 + (n – 1)α} ×
×
# × R × T 17,28 = {1 + (2 – 1)0,8} × × × 0,082 × 300 17,28 = (1,8) × × 2 × 24,6
g = × ×× = 11,4 gram
Jadi, massa NaCl yang dilarutkan sebanyak 11,4 gram.
5. ∆Tb= {(i × mol KCl) + (i × mol CaCl2) × × Kb = {(2 × ) + (3 ×
)} ×
× 0,5 = 1,5
4. Jawaban: c
Untuk 100 gram larutan NaCl, massa NaCl = × 100 gram = 10 gram. 5. Jawaban: b
Untuk 100 gram larutan etanol, massa etanol (C2H5OH) =
6. Jawaban: d
NaCl → Na+ + Cl–
7. Jawaban: a
Besar penurunan titik beku sebanding dengan konsentrasi molal (m). Semakin kecil penurunan titik beku larutan, maka titik beku larutan tersebut semakin tinggi sehingga titik beku tertinggi dimiliki larutan dengan konsentrasi molal (m) terkecil, yaitu pada glukosa 0,05 M.
8. Jawaban: e
∆Tf = 0 – (–3,1) = 3,1°C
9. Jawaban: d
35% massa etanol berarti 35 gram etanol dan 65 gram air.
10. Jawaban: b
K – L: perubahan titik beku larutan K – R: proses mencair larutan T – M: proses menguap pelarut M – N: perubahan titik uap larutan T – R: perubahan titik tripel larutan 11. Jawaban: c
Mr glukosa = 180 g/mol
12. Jawaban: d
Fungsi penambahan etilen glikol ke dalam radia-tor mobil adalah untuk menurunkan titik beku air dalam radiator. Proses desalinasi air laut adalah proses mengubah air laut menjadi air tawar dengan cara memisahkan garamnya. Proses desalinasi dapat dilakukan dengan teknik osmosis balik dengan tekanan tinggi. Proses ini menggunakan membran berskala molekul untuk memisahkan air dari pengotornya.
13. Jawaban: b
∆Tb = (102,6 – 100)°C = 2,6°C
Jadi, derajat ionisasi basa (Ca(OH)2) sebesar 75%. 14. Jawaban: b
15. Jawaban: e
αH
2SO4 = 1
p = 250 g Kb = 0,52°C g = 24,5 g Mr = 98 ∆Tb = . . .?
H2SO4→ 2H2+ + SO 42–
n = 2 + 1 = 3
∆Tb= m · Kb · {1 + (n – 1)α}
=
·
· 0,52 · {1 + (3 – 1) 1} = 1,56°C 16. Jawaban: a
mol urea = = 0,5 mol mol air = = 4,5 mol
xurea = + * = + = 0,10 17. Jawaban: c
Sifat koligatif larutan merupakan sifat fisik larutan yang bergantung dari banyaknya zat terlarut yang ada dalam larutan (molalitasnya), tetapi tidak bergantung pada jenis zat yang dilarutkan. 18. Jawaban: e
Larutan tersebut diukur pada keadaan yang sama saat 6 gram zat X dilarutkan dalam 12 liter gas etana pada tekanan 38 cmHg. Suhu etana: π = M · R · T (etana)
38 cmHg = 380 mmHg = 0,5 atm 0,5 = × × 0,082 × T T = 365,85 K
Mr zat X: π = M · R · T (zat X) 19 cmHg = 190 mmHg = 0,25 atm 0,25 =
×
× 0,082 × 365,85 Mr zat x = 95,9 ≈ 96
Jadi, Mr zat X adalah 96 gram/mol. 19. Jawaban: e
∆Tb = m · Kb
∆Tb=
−
× Kb
0,68 = − × K b
0,68 = × Kb
Kb= × = 5,44°C kg mol–1
Jadi, tetapan titik didih molal kloroform Kb = 5,44 °C kg mol–1.
20. Jawaban: d
Tekanan osmotik (π) dihitung dengan rumus: π = M ·
#· R · T
Jika volume semua larutan sama, misal dianggap 1 liter dan suhu perhitungan adalah tetap, tekanan osmotik berbanding lurus dengan jumlah mol zat terlarut. Semakin besar mol zat terlarut, tekanan osmotik semakin besar. Jadi, tekanan osmotik yang paling rendah terdapat pada gambar larutan S.
21. Jawaban: a
Untuk larutan gula dalam air: ∆Tb = 105,2 – 100 = 5,2°C
∆Tb= mgula · Kb
mgula= 1 ·
= 10 m 5,2 = 10 · Kb
Kb= 0,52 (pelarut air)
Untuk larutan alkohol dalam air, pelarutnya adalah air, Kb = 0,52.
Kenaikan titik didih = ∆Tb = 5,2.
Misalkan alkohol yang dilarutkan dalam 100 gram air = x mol, maka:
∆Tb= malkohol · Kb 5,2 = x ·
· 0,52 x = 1 mol
22. Jawaban: d
P° = 31,8 mmHg x = 0,056 mol
Tekanan uap jenuh larutan = tekanan uap pelarut → ∆P
∆P = x · P°
∆P = 0,056 · 31,8 = 1,7808 Tekanan uap larutan = 31,8 – 1,78
= 30,02 mmHg 23. Jawaban: b
∆Tb=
·
· Kb ∆Tb =
·
· 1,8
∆Tb= titik beku pelarut – titik beku larutan 0,36 = 0° – titik beku larutan
Titik beku larutan = –0,36°C. 24. Jawaban: d
jumlah partikel zat terlarut terbanyak adalah gambar 1 sehingga tekanan uap larutan terkecil terdapat pada larutan nomor 1. Urutan tekanan uap larutan dari yang kecil ke yang besar yaitu 1 < 3 < 2 < 5 < 4. Jadi, tekanan uap larutan terbesar terdapat pada larutan nomor 4.
25. Jawaban: d
Tekanan osmotik dirumuskan dengan π = M · R · T, di mana M =
·
atau M =
# , V dalam liter. Jika R = 0,082 L · atm · mol–1 K–1 dan T =
tetap maka π =
#.
a. π = = 0,5 atm
b. π = = 1 atm
c. π = = 0,67 atm
d. π = = 2 atm
e. π = = 0,4 atm
Jadi, tekanan osmotik terbesar terdapat pada larutan 4, yaitu sebesar 2 atm.
26. Jawaban: d
Jika ke dalam suatu pelarut dilarutkan suatu zat terlarut, titik didih larutan yang terbentuk akan lebih tinggi daripada titik didih pelarut murni. Hal ini disebut kenaikan titik didih (∆Tb). Untuk zat terlarut elektrolit besar kenaikan titik didih dapat dihitung sebagai berikut.
∆Tb = Kb × m × i = Kb × > ×
× i di mana: i = {1 + (n – 1)α}
n = jumlah ion α = derajat ionisasi Untuk Fe2(SO4)3:
n = 5, Mr = 400, dan α diketahui = 0,8 ∆Tb= 0,52 ×
×
× {1 + (5 – 1)0,8} = 0,437°C
27. Jawaban: a
∆Tb= m · Kb
Jadi, kenaikan titik didih larutan (∆Tb) = Kb apabila m (molalitas larutan) = 1 molal.
28. Jawaban: a
Larutan 1) dan 2) mempunyai titik beku yang sama karena kedua larutan merupakan larutan elektrolit yang molalitasnya sama.
29. Jawaban: a
i = 1 + (n – 1) α 3 = 1 + (n – 1) 1 n – 1 = 2
n = 3
∆Tb = (101,5 – 100)°C = 1,5°C ∆Tb=
·
· Kb · i
1,5 =
·
· 0,52 · 3 Mr = 97,76 ≈ 98
Jadi, senyawa tersebut mempunyai n = 3 dan Mr = 98.
H2SO4; n = 3 dan Mr = 98 HNO3; n = 2 dan Mr = 63 NaOH; n = 2 dan Mr = 40 CaCl2; n = 3 dan Mr = 111 Ba(OH)2; n = 3 dan Mr = 171 30. Jawaban: e
Meskipun kedua larutan mempunyai molalitas yang sama, tetapi penurunan titik beku dan kenaikan titik didih larutan garam lebih besar daripada larutan gula. Hal ini karena larutan garam merupakan larutan elektrolit kuat yang dapat terionisasi menjadi ion Na+ dan ion Cl–.
NaCl(s)→ Na+(aq) + Cl–(aq)
Dengan demikian, dalam larutan garam terdapat 1 mol ion Na+ dan 1 mol ion Cl– atau 2 mol garam.
Adapun dalam larutan gula (nonelektrolit) tidak dapat terionisasi.
C12H22O11(s)→ C12H22O11(aq)
Dengan demikian, dalam larutan gula hanya terdapat 1 mol gula.
B. Uraian
1. P° = 18 mmHg nA = 0,75 mol nB = 0,25 mol ∆P = xB · P°
= & $ &
+ · P°
= + · 18 mmHg = 4,5 mmHg
2. ∆Tf= m · Kf 0,372 = m · 1,86
m = 0,2 molal ∆Tb= m · Kb
= 0,2 · 0,52 = 0,104°C
Titik didih urea = 100 + 0,104 = 100,104°C 3. Massa larutan = 100 ml × 1,04 g/ml
= 104 gram ∆Tf =
·
· Kf 0 – (–3,44°C) = Z · −Z · 1,86°C
= 3,44°C
1.860x = 21.456,6 – 206,4x 2.066,4x = 21.465,6
x = 10,4 gram
% massa CO(NH2)2 = × 100% = 10%
4. ∆Tb=
·
· Kb
1 =
·
· Kb Kb = 1,22 °C/m
5. massa sukrosa = 6,84 gram Mr sukrosa = 342
R = 0,082 L atm mol–1K–1
Vlarutan = 2 L
Tlarutan = 25 + 273 = 298 K π = M × R × T
=
×
# × R × T
= ×
× 0,082 × 298 = 0,24 atm
Jadi, tekanan osmotik larutan sukrosa sebesar 0,24 atm.
6. ∆Tb = (100,416 – 100)°C = 0,416°C Misal: massa glukosa = x gram
massa urea = (27 – x) gram ∆Tb= {
× × Kb}
+ {
×
× Kb}
0,416 = {(Z ) + (−Z)} × × 0,52
0,416 = Z+ Z− × 2,08 74,88 = –4,16x + 168,48 4,16x = 93,6
x = 22,5 gram
Massa glukosa = x = 22,5 gram Massa urea = (27 – x)
= 27 – 22,5 = 4,5 gram
Jadi, perbandingan massa glukosa : urea = 22,5 : 4,5 = 5 : 1.
7.
∆Tb= m · Kb =
·
· Kb
(100,26 – 100) =
·
· 0,52 0,26 =
]
Mr= ] = 60
Jadi, massa molekul relatif zat itu = 60.
8. a. 0,300 g urea = −
= 5 · 10–3 mol
Molalitas larutan =
]
]
− −
= 0,5 mol kg–1
∆Tb= m · Kb
= 0,5 mol kg–1 · 0,512°C kg mol–1
= 0,256°C Titik didih larutan
= titik didih pelarut murni (H2O) + ∆Tb = 100,00°C + 0,256°C
= 100,256°C b. ∆Tf = m · Kf
= 0,5 mol kg–1 · 1,86°C kg mol–1
= 0,93°C Titik beku larutan
= titik beku pelarut murni (H2O) – ∆Tf = 0,00°C – 0,93°C
9. Larutan hipotonik merupakan larutan yang memiliki tekanan osmotik lebih rendah.
Larutan H2SO4 0,3 M π= 0,3 · R · T · i
= 0,3 · R · T · {1 + (3 – 1)1} = 0,9 · R · T
Larutan hipotonik berarti larutan yang memiliki tekanan osmotik kurang dari 0,9 RT.
a. Glukosa 0,9 M → nonelektrolit π= 0,9R · T (isotonik)
b. KNO3 0,6 M → n = 2 π= 0,6 · R · T · {1 + (2 – 1)1}
= 1,2R · T (hipertonik) c. urea 0,3 M → nonelektrolit
π= 0,3R · T (hipotonik) d. Na2SO4 0,2 M → n = 3
π= 0,2 · R · T · {1 + (3 – 1)1} = 0,6R · T (hipotonik)
Jadi, larutan yang bersifat hipotonik terhadap larutan H2SO4 0,3 M yaitu urea 0,3 M dan Na2SO4 0,2 M.
10. ρ = # → m = ρ · V = 1 kg/L · 12 L = 12 kg = 12.000 g
∆Tf =
·
· Kf
= ·
· 1,86 = 12,5°C
Jadi, titik beku mengalami penurunan sebesar 12,5°C atau titik bekunya menjadi –12,5°C. Jika zat yang ditambahkan berupa zerone
(methyl alcohol, CH3OH), untuk menghasilkan produk yang titik bekunya sama dibutuhkan massa
zerone sebagai berikut. ∆Tf=
·
· Kf
12,5 = ·
· 1,86 g = 2.580,6 g
= 2,58 kg
2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan ke-hidupan sehari-hari.
Standar Kompetensi Kompetensi Dasar Nilai Indikator
2.1 Menerapkan konsep reaksi oksidasi-reduksi dalam sistem elektro-kimia yang melibatkan energi listrik dan ke-gunaannya dalam mencegah korosi dan dalam industri.
Peduli lingkungan
Membuang baterai bekas ke tempat pembuangan sampah B3.
Pada bab ini akan dipelajari:
1. Persamaan Reaksi Redoks 2. Sel Elektrokimia
Model Pengintegrasian Nilai Pendidikan Karakter
Redoks dan Penerapannya
• Menentukan bilangan oksidasi dan persamaan reaksi redoks dengan cara setengah reaksi dan perubahan bilangan oksidasi • Mengamati peristiwa reaksi redoks
Menjelaskan sel elektrokimia
• Menjelaskan terjadinya reaksi redoks spontan berdasarkan harga potensial reduksi
• Menggambarkan rangkaian sel Volta dan menuliskan notasi selnya • Menuliskan lambang sel dan reaksi-reaksi yang terjadi pada sel Volta • Menentukan potensial sel dari data
potensial reduksinya
• Menjelaskan penerapan sel Volta dalam kehidupan
Siswa dapat menuliskan persamaan reaksi oksidasi-reduksi dalam sistem elektrokimia dan menentukan harga potensial sel Volta
berdasarkan harga potensial reduksinya Menjelaskan persamaan
reaksi redoks
Siswa mampu menjelaskan rangkaian sel Volta dan penerapannya Siswa mampu menjelaskan reaksi
A. Pilihan Ganda
1. Jawaban: d
Reaksi redoks adalah reaksi yang disertai dengan perubahan bilangan oksidasi (terjadi peristiwa reduksi dan oksidasi).
Fe2O3 + 2Al → Al2O3 + 2Fe +3 0 +3 0
Reduksi Oksidasi 2. Jawaban: a
MnO2 → K2MnO4 +4 –4 +2 +6 –8 3. Jawaban: b
Ion tiosulfat merupakan ion poliatom, yaitu ion yang terdiri atas beberapa atom. Bilangan oksidasi untuk oksigen dalam ion poliatom seperti NO3–,
S2O32–, atau Cr
2O72–, selalu –2.
4. Jawaban: a
CuS + NO3– → Cu2+ + S + NO
+2 –2 +5 –6 2+ 0 +2 –2
Bilangan oksidasi N berubah dari +5 menjadi +2 sehingga perubahan bilangan oksidasi pada N sebesar –3.
5. Jawaban: b
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 +4 –4 +4 –4 +2 –2 +4 –4 0
Reduksi
Oksidasi
Reduktor mengakibatkan terjadinya reaksi oksidasi. Jadi, yang bertindak sebagai reduktor adalah HCl.
6. Jawaban: c
aCu(s) + bNO3–(aq) + cH+(aq) → dCu2+(aq) + eNO(g)
+ fH2O( )
Misal Cu = 1, N = 2 Cu: a = d = 1 N: b = e = 2 O: 3b = e + f
3(2) = 2 + f f = 6 – 2 = 4 H: c = 2 · f = 2 · 4 = 8
Jumlah muatan Cu di ruas kanan = +2.
Dengan demikian koefisien Cu di ruas kiri = 3. Persamaan reaksi setaranya:
3Cu(s) + 2NO3–(aq) + 8H+(aq) → 3Cu2+(aq)
+ 2NO(g) + 4H2O( )
Jadi, a = 3, b = 2, c = 3, dan 4.
7. Jawaban: b
Setengah reaksi reduksi:
Cr2O72– + 14H+ + 6e–→ 2Cr3+ + 7H 2O
Jadi, reaksi tersebut disertai dengan penangkapan 6 elektron.
8. Jawaban: d
Cr2O72– + H+ + Cl–→ Cr3++ H 2O + Cl2
Reduksi : Cr2O72–+ 14H+ + 6e–→ 2Cr3++ 7H 2O × 2
Oksidasi: Cl– → Cl
2 + 2e– × 6 ––––––––––––––––––––––––––––––––––––––––––––– 2Cr2O72–+ 28H+ + 12Cl–→ 4Cr3++ 14H
2O + 6Cl2 Persamaan reaksi disederhanakan:
Cr2O72–+ 14H+ + 6Cl–→ 2Cr3++ 7H
2O + 3Cl2
9. Jawaban: a
Cr2O72–+ AsO
33– → Cr3++ AsO43–
Reduksi : Cr2O72–+ 14H+ + 6e–→ 2Cr3++ 7H 2O × 2 Oksidasi: AsO33– + H
2O → AsO43– + 2H+ + 2e– × 6 –––––––––––––––––––––––––––––––––––––––––––––
2Cr2O72–+ 28H+→ 4Cr3++ 14H 2O 6AsO33– + 6H
2O → 6AsO43– + 12H+
––––––––––––––––––––––––––––––––––––––––––––– 2Cr2O72–+ 6AsO
3
3– + 16H+→ 4Cr3++ 8H
2O + 6AsO43– Cr2O72– : AsO
4
3– = 2 : 6 = 1 : 3
10. Jawaban: b
MnO2, bilangan oksidasi Mn = +2. KMnO4, bilangan oksidasi Mn = +7 MnSO4, bilangan oksidasi Mn = +2 K2MnO4, bilangan oksidasi Mn = +6 Mn2O3, bilangan oksidasi Mn = +3
Jadi, bilangan oksidasi tertinggi terdapat dalam KMnO4.
B. Uraian
1. a. CuO + H2 → Cu + H2O
+2 0 0 +2
Bilangan oksidasi Cu berubah dari +2 menjadi 0. Bilangan oksidasi H2 berubah dari 0 menjadi +2. b. Zat yang bertindak sebagai reduktor adalah zat mengalami oksidasi atau kenaikan bilangan oksidasi, yaitu H2.
2. Penyetaraan reaksi redoks dengan metode setengah reaksi.
a. Reduksi : MnO4–→ Mn2+
Oksidasi : H2C2O4→ CO2
b. Penyetaraan jumlah atom dan jumlah muatan. MnO4– + 8H+ + 5e–→ Mn2+ + 4H
2O × 2
adalah Li – K – Ba – Sr – Ca – Na – La – Ce – Mg – Lu – Al – Mn – (H2O) – Zn – Cr – Fe – Cd – Co – Ni – Sn – Pb – H – Sb – Bi – Cu – Hg – Ag – Pt – Au. Jadi, oksidator yang lebih baik dari Ag adalah Pt. 4. Jawaban: d
Dapat mendesak berarti logam tersebut mempunyai harga potensial reduksi lebih kecil. Jadi, urutan potensial reduksi B > C > A. 5. Jawaban: e
E° Ag+ | Ag = +0,80 volt
E° Zn2+ | Zn = –0,76 volt
Reaksi:
Katode (reduksi) : Ag+ + e– Ag
E° = +0,80 volt
A. Pilihan Ganda
1. Jawaban: b
Pada sel Galvani (sel Volta) terjadi perubahan energi kimia menjadi energi listrik.
2. Jawaban: d
Harga potensial elektrode yang semakin positif, sifat oksidatornya semakin besar. Jadi, urutannya adalah Na, Mg, dan Al.
3. Jawaban: e
Oksidator yang lebih baik dari Ag berasal dari logam yang dalam deret Volta terletak di sebelah kanan Ag. Deret Volta merupakan deret reduksi, semakin ke kanan semakin mudah tereduksi, sifat oksidatornya semakin baik. Deret volta logam tersebut
3P + 12H2O → 3PO43– + 24H+ + 15e–
5NO3– + 20H+ + 15e–→ 5NO + 10H 2O
––––––––––––––––––––––––––––––––––––– 3P + 5NO3– + 2H
2O → 3PO43– + 5NO + 4H+
d. Oleh karena suasana basa, ditambahkan OH–
pada setiap ruas sebanyak H+ yang ada. H+
dan OH– membentuk H 2O.
3P + 5NO3– + 2H
2O + OH–→ 3PO43– + 5NO + 2H2O e. Setarakan kembali persamaan.
3P + 5NO3– + OH–→ 3PO 4
3– + 5NO + 2H 2O 5.a. Cara bilangan oksidasi.
Cr2O72– + C
2O42–→ 2Cr3+ + 2CO2
+6 +3 +3 +2 Mengikat 3e–
Melepas 1e–
Cr2O72– + 3C
2O42–→ 2Cr3+ + 6CO2
–8 +6
Cr2O72– + 3C
2O42– + 14H+→ 2Cr3+ + 6CO2 + 7H2O b. Cara setengah reaksi atau cara ion elektron. Oksidasi: C2O42– → 2CO
2+ 2e– × 3 Reduksi : Cr2O72– + 14H+ + 6e–→ 2Cr3++ 7H
2O × 1 ––––––––––––––––––––––––––––––––––––––––––––– 3C2O42– + Cr
2O72– + 14H+→ 6CO2 + 2Cr3++ 7H2O Masukkan kation dan anionnya hingga diperoleh persamaan reaksi akhir sebagai berikut.
3H2C2O4 + K2Cr2O7 + 4H2SO4→ 6CO2 + Cr2(SO4)3 + 7H2O + K2SO4 c. Jumlah kedua setengah reaksi:
2MnO4– + 16H+ + 10e–→ 2Mn2+ + 8H 2O
5H2C2O4→ 10CO2 + 10H+ + 10e–
––––––––––––––––––––––––––––––––––––– 2MnO4– + 6H+ + 5H
2C2O4→ 2Mn2+ + 8H2O + 10CO2 Jadi, nilai a, c, e, dan f berturut-turut yaitu 2, 5, 8, dan 10.
3. Persamaan reaksi redoks: Fe2+ + Cr
2O72–→ Fe3+ + 2Cr3+
+2 +12 +3 +6
Ion Fe2+ menjadi Fe3+ selisih 1 ion, sehingga
dikalikan 6. Sementara itu, ion Cr2O72– menjadi
Cr3+ selisih 6 ion sehingga dikalikan 1. Persamaan
reaksi setara: 6Fe2+ + Cr
2O72–→ 6Fe3+ + 2Cr3+
Dengan demikian, banyaknya ion Fe3+ yang dapat
dioksidasi oleh 1 mol Cr2O72– sebanyak 6 mol. Hal
ini sesuai perbandingan koefisien. 4. a. Persamaan setengah reaksi:
Oksidasi : P → PO43–
Reduksi : NO3–→ NO
b. Menyetarakan jumlah muatan reaksi dengan menambahkan koefisien reaksi dan menjumlahkan kedua persamaan setengah reaksi.
P + 4H2O → PO43– + 8H+ + 5e– × 3
NO3– + 4H+ + 3e–→ NO + 2H
2O × 5
c. Menyetarakan jumlah muatan reaksi dengan menambahkan koefisien reaksi dan men-jumlahkan kedua persamaan setengah reaksi:
Anode (oksidasi) : Zn Zn2++ 2e–
E° = +0,76 volt
Reaksi tersebut disetarakan agar muatannya sama. Katode (reduksi) : 2Ag+ + 2e– 2Ag
E° = +0,80 volt Anode (oksidasi) : Zn Zn2++ 2e–
E° = +0,76 volt –––––––––––––––––––––––––––––– + Reaksi sel (redoks) : 2Ag+ + Zn
2Ag + Zn2+ E° = +1,56 volt
Elektron mengalir dari anode (seng) ke katode (perak). Diagram sel dari reaksi tersebut yaitu Zn | Zn2+ || Ag+ | Ag.
6. Jawaban: c
E°sel berharga (+) = reaksi berlangsung E°sel berharga (–) = reaksi tidak berlangsung E°sel = E°reduksi – E°oksidasi
a) E°sel= E°Fe3+
| Fe2+ – E°Cl2 | Cl–
= 0,77 – 1,36 = –0,59 V b) E°sel= E°Fe3+
| Fe2+ – E°F2 | F–
= 0,77 – 2,87 = –2,1 V c) E°sel= E°Fe3+
| Fe2+ – E°I2 | I–
= 0,77 – 0,54 = +0,23 V
d) E°sel= E°Fe3+ | Fe2+ – E°Br 2| Br–
= 0,77 – 1,07 = –0,30 V
e) E°sel= E°Fe2+ | Fe3+ – E°Cl 2 | Cl–
= –0,77 – 1,36 = –2,13 V 7. Jawaban: e
Dalam deret Volta, logam Zn berada di sebelah kiri logam Ag. Oleh karena itu, Zn bertindak sebagai reduktor sehingga mengalami oksidasi di anode. Sementara itu, Ag berada di sebelah kanan Zn sehingga Ag bertindak sebagai oksidator sehingga mengalami reaksi reduksi. Reaksi yang terjadi di elektrode sebagai berikut.
2Ag+ + 2e– → 2Ag E° = +0,80
Zn → Zn2+ + 2e– E° = +0,76
–––––––––––––––––––––––––––––––––––– + Zn + 2Ag+ → Zn2+ + 2Ag E° = +1,56 V
8. Jawaban: b
Reaksi:
Katode (reduksi) : Ag+ + e–→ Ag E° = 0,80 volt × 2
Anode (oksidasi) : Zn → Zn2+ + 2e– E° = 0,76 volt × 1
––––––––––––––––––––––––––––––––––––––––––––––– + Reaksi sel (redoks): 2Ag+ + Zn → 2Ag + Zn2+ E° = 1,56 volt
Diagram sel: Zn | Zn2+ || Ag+ | Ag
9. Jawaban: b
E° sel = E° reaksi:
(Zn2+ + 2e–→ Zn) – (Ca2+ + 2e–→ Ca)
= (–0,76 – (–2,84) = 2,08 volt 10. Jawaban: b
Diagram (lambang) sel dituliskan berdasarkan notasi berikut.
Anode (–) | ion anode || ion katode | katode (+) Dengan demikian diagram/lambang untuk sel Daniel/Galvani di atas adalah
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
B. Uraian
1. E°sel= E°Ag+
| Ag – E°Fe2+ | Fe
1,24 = (0,80 V) – (E°Fe2+)
E°Fe2+= 0,80 V – 1,24 V = –0,44 V
2.
Reduksi : 2Ag+(aq) + 2e–→ 2Ag(s) E° = +0,79 V
Oksidasi : Mg(s) →Mg2+(aq) + 2e– E° = +2,34 V
––––––––––––––––––––––––––––––––––––––––––––––– Reaksi sel: Mg(s) + 2Ag+(aq) →Mg2+(aq) + 2Ag(s) E° = 3,13 V
3.
Ni2+ + 2e–→ Ni E° = –0,25 volt
Pb2+ + 2e– → Pb E° = –0,13 volt
Agar reaksi dapat berlangsung, maka potensial standar sel Volta (Esel) harus berharga positif. Oleh karena itu, reaksi selnya menjadi seperti berikut. Ni → Ni2+ + 2e– E° = +0,25 volt
Pb2+ + 2e– → Pb E° = –0,13 volt
–––––––––––––––––––––––––––––––––– + Ni + Pb2+→ Ni2+ + Pb E° sel = +0,12 V
Jadi, harga potensial sel Volta untuk elektrode Ni dan Pb sebesar 0,12 V.
4. a. Ag | Ag+ || Mn2+ | Mn
Reaksi yang terjadi di elektrode:
Ag → Ag+ + e– E° = –0,80 V × 2
Mn2+ + 2e– → Mn E° = –1,20 V × 1
––––––––––––––––––––––––––––––––––– + 2Ag + Mn2+ → 2Ag+ + Mn E° = –2,00 V
b. In | In3+ || Ag+ | Ag
Reaksi yang terjadi di elektrode
In → In3+ + 3e– E° = +0,34 V × 1
Ag+ + e– → Ag E° = +0,80 V × 3
––––––––––––––––––––––––––––––––––– + In + 3Ag+ → In3+ + 3Ag E° = +1,14 V
c. Mn | Mn2+ || Mg2+ | Mg
Reaksi yang terjadi di elektrode Mn → Mn2+ + 2e– E° = +1,20 V
Mg2+ + 2e– → Mg E° = –2,37 V
A. Pilihan Ganda
1. Jawaban: e
1) Bilangan oksidasi minimal Cl = –1, maka klor dengan biloks –1 tidak dapat direduksi lagi (biloks tidak bisa turun lagi).
2) Bilangan oksidasi maksimal Cl = +7, maka klor dengan biloks +7 tidak dapat dioksidasi lagi (biloks tidak bisa naik lagi).
3) Suatu zat dapat mengalami autoredoks jika dapat mengalami reduksi sekaligus oksidasi, dengan demikian klor dengan biloks maksimal (+7) dan minimal (–1) tidak akan dapat mengalami reaksi autoredoks.
Pasangan spesi Cl–(biloks minimal) dan
NaClO4 (biloks maksimal) tidak dapat mengalami reaksi autoredoks.
2. Jawaban: d
Cr2O72–+ H++ 2Cl–→ 2Cr3++ H
2O+ Cl2
+6 –1 +3 0 –1e– × 3
+3e– × 1
Reaksinya menjadi:
Cr2O72–(aq) + 14H+(aq) + 6Cl–→ 2Cr3+(aq) + 7H
2O( ) + 3Cl2(g)
Jadi, a, b, dan c berturut-turut adalah 1, 14,d an 6. 3. Jawaban: b
Reaksi redoks adalah reaksi yang mengalami kenaikan dan penurunan bilangan oksidasi. Reaksi (b) tidak mengalami kenaikan dan penurunan bilangan oksidasi sehingga bukan reaksi redoks. a. Zn + H2SO4→ ZnSO4 + H2
0 +1 +2 0 Oksidasi
Reduksi
b. SO3 + H2O → H2SO4
Tidak terjadi perubahan bilangan oksidasi. c. Cl2 + 2NaOH → NaCl + NaClO + H2O
0 +1 +1 +2 –1 +1 –2 Reduksi
Oksidasi d. Cu + CuCl2→ 2CuCl
0 +2 –2 +2 –1 Oksidasi
e. Cl2 + 2KBr → 2KCl + Br2 0 +1 –1 –1 –1 0 Reduksi Oksidasi 4. Jawaban: c
CuO + H2→ Cu + H2O +2 0 0 +2 Oksidasi Reduksi
Zat yang bertindak sebagai oksidator adalah yang mengalami reduksi, yaitu CuO atau Cu2+.
5. Jawaban: c
Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + 2H2O +3 +5 +6 –1
Oksidasi Reduksi 6. Jawaban: d
Jumlah bilangan oksidasi ion = muatan ion (2 × bilangan oksidasi H) + (2 × bilangan oksidasi P)
+ (7 × bilangan oksidasi O) = –2 (2 × 1) + (2 × P) + (7 × (–2)) = –2 2 + 2P – 14 = –2 2P – 12 = –2 2P = 10 P = 5 d. Ag | Ag+ || In3+ | In
Reaksi yang terjadi di elektrode
Ag → Ag+ + e– E° = –0,80 V × 3
In3+ + 3e– → In E° = –0,34 V × 1
––––––––––––––––––––––––––––––––––– + 3Ag + In3+ → 3Ag+ + In E° = –1,14 V
e. Mg | Mg2+ || Ag+ | Ag
Reaksi yang terjadi di elektrode
Mg → Mg2+ + 2e– E° = +2,37 V × 1
Ag+ + e– → Ag E° = +0,80 V × 2
––––––––––––––––––––––––––––––––––– + Mg + 2Ag+ → Mg2+ + 2Ag E° = +3,17 V
Jadi, diagram sel yang mempunyai perbedaan elektrode sebesar +1,14 adalah In | In3+ || Ag+ | Ag.
5. Reaksi di anode mengalami oksidasi dan di katode mengalami reduksi.
E° sel = E°Cu – E°Zn
= +0,34 – (–0,76) = +1,10 volt
Reduksi:
MnO4– → Mn2+ (BO Mn: +7 → +2; kanan
kurang 4 atom O)
2) Setarakan jumlah O dan H.
Oksidasi:
H2C2O4 → 2CO2 + 2H+ (kanan ditambah 2H+) Reduksi:
MnO4– + 8H+ → Mn2+ + 4H 2O
(kanan ditambah 4H2O, kiri ditambah 8H+)
3) Setarakan muatan dengan menambahkan elektron.
Oksidasi:
H2C2O4 → 2CO2 + 2H+ + 2e– Reduksi:
MnO4– + 8H+ + 5e– → Mn2+ + 4H 2O
4) Samakan jumlah elektron pada kedua reaksi paruh.
Oksidasi:
5H2C2O4 → 10CO2 + 10H+ + 10e– Reduksi:
2MnO4– + 16H+ + 10e–→ 2Mn2+ + 8H 2O
––––––––––––––––––––––––––––––––
Redoks:
2MnO4– + 6H+ + 5H
2C2O4 → 2Mn2+ + 8H2O +
10CO2
Jadi, nilai a, c, e, dan f berturut-turut yaitu 2, 5, 8, dan 10.
13. Jawaban: e
Reaksi yang terjadi pada penggunaan aki sebagai berikut.
Katode : PbO2(s) + 4H+(aq) + SO 4
2–(aq) + 2e–→ PbSO 4(s)
+ 2H2O( )
Anode : Pb(s) + SO42–(aq) → PbSO
4(s) + 2e–
Jadi, Pb dan PbO2 berubah menjadi PbSO4. 14. Jawaban: d
E°sel = E°reduksi – E°oksidasi
Jika harga potensial sel bertanda positif, reaksi dapat berlangsung spontan, sedangkan jika harga potensial sel negatif, reaksi tidak dapat berlangsung.
1) Zn dioksidasi; Mn2+ direduksi
E°sel = –1,20 – (–0,76) = –0,44 volt 2) Ag dioksidasi; In3+ direduksi
E°sel = –0,34 – (0,80) = –1,14 volt 3) In dioksidasi; Mn2+ direduksi
E°sel = –1,20 – (–0,34) = –0,86 volt 4) Zn dioksidasi; In3+ direduksi
E°sel = –0,34 – (–0,76) = +0,42 volt 5) Ag dioksidasi; Mn2+ direduksi
E°sel = –1,20 – (–0,80) = –2 volt
Jadi, reaksi yang dapat berlangsung spontan adalah 3Zn(s) + 2In3+(aq)→ 3Zn2+(aq) + 2In(s).
7. Jawaban: c
NO32– → NO
+4 +2
berkurang 2 8. Jawaban: a
2NaCl + 2H2O → H2 + Cl2 + 2NaOH –1 +1 0 0
Reduksi Oksidasi Oksidator : H2O Reduktor : NaCl 9. Jawaban: a
Persamaan reaksi yang sudah setara: H2SO4 + 8HI → H2S + 4I2 + 4H2O Dengan demikian:
Bila H2SO4 = 1,5 mol, maka HI yang dapat dioksidasi =
× 1,5 = 12 mol. 10. Jawaban: a
Persamaan reaksi pada soal adalah persamaan setengah reaksi dari MnO4– → MnO
2.
MnO4– + 4H+ → MnO
2 + 2H2O
Jumlah muatan di ruas kiri = –1 + 4 = 3
Jumlah muatan di ruas kanan = 0 sehingga ditambah 3e– di ruas kiri menjadi:
MnO4– + 4H+ + 3e– → MnO
2 + 2H2O
Oleh karena reaksinya dalam suasana basa, tambahkan pada kedua ruas ion OH– sebanyak
ion H+ = 4.
MnO4– + 4H+ + 4OH– + 3e– → MnO
2 + 2H2O + 4OH–
Persamaan reaksi menjadi sebagai berikut. MnO4– + 4H
2O + 3e– → MnO2 + 2H2O + 4OH–
MnO4– + 2H
2O + 3e– → MnO2 + 4OH–
Jadi, a = 2, n = 3, dan b = 4. 11. Jawaban: b
Reduksi : MnO4– + 8H+ + 5e–→ Mn2+ + 4H 2O × 1 Oksidasi : Fe2+ → Fe3+ + e– × 5 –––––––––––––––––––––––––––––––––––––––––––
MnO4– + 8H+ + 5Fe2+ → Mn2+ + 4H
2O + 5Fe3+ Perbandingan mol = perbandingan koefisien. Jadi, 5 mol H+ ~ 5 mol Fe3+, 5 mol Fe2+ ~ 4 mol
H2O, 1 mol MnO4– ~ 1 mol Mn2+.
12. Jawaban: c
Penyetaraan redoks dengan metode setengah reaksi. 1) Pisahkan reaksi paruh oksidasi dan reduksi.
Oksidasi:
15. Jawaban: d
Reaksi yang terjadi pada sel Volta: Katode : Al3+(aq) + 3e– → Al(s) × 2
Anode : Cu(s) → Cu2+(aq) + 2e– × 3
–––––––––––––––––––––––––––––––––––––– + 2Al3+(aq) + 3Cu(s) → 2Al(s) + 3Cu2+
Notasi sel : Anode | ion || ion | katode : Cu(s) | Cu2+(aq) || Al3+(aq) | Al(s)
16. Jawaban: b
Pada gambar sel Volta tersebut terjadi reaksi: Katode : Cu2+(aq) + 2e– → Cu(s)
Anode : Zn(s) → Zn2+(aq) + 2e–
––––––––––––––––––––––––––––––––––––– + Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq)
Penulisan diagram sel:
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
17. Jawaban: b
a. Katode berupa Ag2O dan anode berupa Zn digunakan pada sel perak oksida.
b. Katode berupa PbO2 dan anode berupa Pb digunakan pada sel aki timbal asam.
c. Katode berupa MnO2 dan NH4Cl serta anode berupa Zn digunakan pada sel kering karbon seng.
d. Katode berupa NiO2 dan anode berupa Cd di-gunakan pada sel nikel basa atau baterai nikad. e. Katode berupa O2 dan anode berupa H2
di-gunakan pada sel bahan bakar. 18. Jawaban: c
Dalam sel volta:
1) Logam yang memiliki E° lebih kecil (lebih negatif) berfungsi sebagai anode → Zn sebagai anode dan Ag sebagai katode.
2) E°sel = E°anode – E°katode
= +0,80 V – (–0,74 V) = 1,54 V 3) Reaksinya:
2Ag+(aq) + Zn(s) → Zn2+(aq) + 2Ag(s)
19. Jawaban: a
Memberi perlindungan katodik artinya bahwa logam tersebut yang akan lebih dahulu teroksidasi, bukannya besi. Logam yang mudah teroksidasi berada di sebelah kiri Fe dalam deret Volta. Jadi, logam yang paling mudah teroksidasi adalah logam Mg. 20. Jawaban: a
E°sel = E°reduksi – E°oksidasi = E°F
2 – E°I2 = 2,87 – 0,54 = 2,33 volt
21. Jawaban: d
Zn → Zn2+ + 2e– E° = 0,76 V
Fe2+ + 2e → Fe– E° = –0,44 V
––––––––––––––––––––––––––––––––– Zn + Fe2+ → Zn2+ + Fe E° = +0,32 V
Zn | Zn2+ || Fe2+ | Fe E° = +0,32 V
22. Jawaban: e
Reaksi berlangsung jika E° = (+). Cr3++ 3e–→ Cr E° = –0,71 V
Al → Al3++ 3e– E° = +1,66 V
––––––––––––––––––––––––––––––––– Cr3++ Al → Cr + Al3+ E° = +0,95 V
23. Jawaban: c
Logam yang paling mudah tereduksi adalah logam dengan potensial reduksinya (E°) paling positif, yaitu Ag.
24. Jawaban: e
Harga potensial elektrode yang lebih rendah daripada harga potensial Fe3+ sehingga Zn
cenderung mengalami reaksi oksidasi dan Fe3+
mengalami reduksi.
Oksidasi: Zn → Zn2+ + 2e– × 1
Reduksi : Fe3+ + e–→ Fe2+ × 2
–––––––––––––––––––––––––––––––––– + Zn + 2Fe3+→ Zn2+ + 2Fe2+
25. Jawaban: d
Anode (–) : Mg(s)→ Mg2+(aq) + 2e–
Katode (+) : Cu2+(aq) + 2e–→ Cu(s)
Mg(s) + Cu2+(aq)→ Mg2+(aq) + Cu(s)
Diagram sel:
Mg| Mg2+ || Cu2+ | Cu
26. Jawaban: a
Berdasarkan gambar sel Volta diperoleh data: Anode (–): Cu → Cu2+ + 2e– × 1 (oksidasi)
Katode (+): Ag+ + e–→ Ag × 2 (reduksi)
–––––––––––––––––––––––––––––––––––––– Cu + 2Ag+→ Cu2+ + 2Ag
E°sel= E°reduksi – E°oksidasi = +0,80 – (+0,34) = +0,46 V 27. Jawaban: c
E°sel = E°reduksi – E°oksidasi
1) E°sel = E°Br – E°Fe = +1,07 – (+0,77) = +0,3 volt 2) E°sel = E°Fe – E°Br = +0,77 – (+1,07) = –0,3 volt 3) E°sel = E°Fe – E°I = +0,77 – (+0,54) = +0,23 volt 4) E°sel = E°Br – E°I = +1,07 – (+0,54) = +0,53 volt 5) E°sel = E°cu – E°Zn = +0,34 – (–0,76) = +1,10 volt Reaksi pada pilihan b menghasilkan E°sel yang negatif. Hal ini berarti reaksi tidak berlangsung dan tidak menghasilkan potensial sel. Dengan demikian, reaksi yang menghasilkan potensial sel terkecil adalah reaksi pada pilihan c.
28. Jawaban: d
Reaksi dapat berlangsung jika E°sel berharga positif.
Anode : Zn → Zn2+ + 2e– E° = +0,76 volt
Katode: Pb2+ + 2e–→ Pb E° = –0,13 volt
––––––––––––––––––––––––––––––––––––––– + Zn + Pb2+→ Zn2+ + Pb E°
29. Jawaban: d
Reaksi yang terjadi:
Anode : Ni → Ni2+ + 2e– × 1
Katode : Ag+ + e– → Ag × 2
–––––––––––––––––––––––––––– + Ni + 2Ag+ → Ni2+ + 2Ag
Diagram sel: Ni | Ni2+ || Ag+ | Ag
30. Jawaban: a
Anode (–) : Al → Al3+ + 3e– × 2
Katode (+) : Ni2+ + 2e– → Ni × 3
––––––––––––––––––––––––––——–––– Redoks : 2Al + 3Ni2+ → 2Al3+ + 3Ni
Diagram sel : Al | Al3+ || Ni2+ | Ni
B. Uraian
1. Ruas kiri = ruas kanan Jumlah atom H 2a = d . . . (1) Jumlah atom O a + 8 = 4 + d
a = –4 + d . . . (2) Jumlah atom Cl b = 2c . . . (3)
Persamaan (1) dan (2)
2a = d × 1
a = –4 + d × 2 Persamaan reaksi menjadi: 2a = d
2a = –8 + 2d –––––––––––––– – 0 = d + 8 – 2d d = 8
2a = d 2a = 8 a = 4
Jumlah muatan di kiri = di kanan = 8, sehingga b = 6
b = 2c 6 = 2c c = 3
Jadi, a = 4, b = 6, c = 3, dan d = 8. 2. a. Menentukan reaksi oksidasi-reduksi.
Oksidasi : Cl–→ Cl 2
Reduksi : MnO4– → Mn2+
b. Menentukan bilangan oksidasi. MnO4– + Cl– → Mn2+ + Cl
2
+7 –2 –1 +2 0
c. Menentukan unsur yang mengalami peristiwa reduksi dan oksidasi.
MnO4– + Cl– → Mn2+ + Cl 2
+7 –2 –1 +2 0 Oksidasi (1) Reduksi (5)
Cl– dan Cl
2 dikalikan 5, sedangkan MnO4– dan
Mn2+ dikalikan 1 sehingga reaksinya sebagai
berikut.
MnO4– + 5Cl– → Mn2+ + 5Cl 2
d. Menyetarakan muatan dan jumlah atom. Jumlah muatan ruas kiri = –6
Jumlah muatan ruas kanan = +2
Oleh karena suasana asam, ruas kiri ditambah H+.
MnO4– + 5Cl– + 8H+ → Mn2+ + 5Cl 2
Jumlah atom H ruas kiri = 8 Jumlah atom H ruas kanan = 0
Oleh karena jumlah atom H belum setara, ruas kanan ditambah H2O.
MnO4– + 5Cl– + 8H+ → Mn2+ + 5Cl
2 + 4H2O
3.
a. Reduksi : KMnO4– + 8H+ + 5e–→Mn2+ + 4H 2O × 1
Oksidasi : Fe2+ → Fe3+ + e– × 5
––––––––––––––––––––––––––––––––––––––––––– Redoks : KMnO4– + 5Fe2+ + 8H+→Mn2+ + 5Fe3+ + 4H
2O
Reaksi akhir:
2KMnO4 + 10FeSO4 + 8H2SO4→2MnSO4 + 5Fe(SO4)3 + 8H2O + K2SO4
b. ZnS + HNO3→ ZnSO4 + NO + H2O –2 +6
–8e
+5 +3e +2 Reaksi akhir:
3ZnS + 8HNO3→ 3ZnSO4 + 8NO + 4H2O 4.
E°sel = E°Pb2+ | Pb – E°Ni2+ | Ni
= –0,13 V – (–0,25 V) = 0,12 V
5.
Oksidasi : Zn → Zn2+ + 2e– E° = –0,763 V
Reduksi : Cu2+ + 2e–→ Cu E° = +0,337 V
––––––––––––––––––––––––––––––––––––– Reaksi sel: Zn + Cu2+→ Zn2+ + Cu
E°sel = E°kanan – E°kiri
= +0,337 V – (–0,763 V) = +1.100 V
6. Reaksi di anode (mengalami oksidasi). Zn2+(aq) + 2e– → Zn(s) E° = –0,76 V
Reaksi di katode (mengalami reduksi). Cu2+(aq) + 2e–→ Cu(s) E° = +0,34 V
E°sel = E°Cu – E°Zn = +0,34 – (–0,76) = +0,34 + 0,76 = +1,10 V
7. Pada sel Volta terjadi reaksi redoks, yaitu di katode (kutub +) terjadi reaksi reduksi, sedangkan di anode (kutub –) terjadi reaksi oksidasi. Logam Zn terletak di sebelah kiri logam Ag sehingga logam Zn mampu mereduksi ion Ag+ menjadi Ag. Reaksi yang terjadi
sebagai berikut.
Katode (reduksi) : Ag+ + e– → Ag × 2
Anode (oksidasi) : Zn → Zn2+ + 2e– × 1
––––––––––––––––––––––––––––––––––––– + Redoks 2Ag+ + Zn → 2Ag + Zn2+
Penulisan diagram sel berdasarkan reaksi reduksi oksidasi sebagai berikut.
Zn(s)|| Zn2+(aq)|| Ag+(aq)| Ag(s)
8. Diketahui:
Cr2++ 2e–→ Cr E° = –0,91 volt
Mn2+ + 2e–→ Mn E° = –1,03 volt
Reaksi selnya:
Mn → Mn2+ + 2e– E° = +1,03 volt
Cr2++ 2e–→ Cr E° = –0,91 volt
–––––––––––––––––––––––––––––––– Mn + Cr2+→ Mn2++ Cr E° = 0,12 volt
Jadi, potensial sel standar = 0,12 volt.
9. a. E°sel = (E°2Ag + 2e–→ 2Ag)– (E°Mg → Mg2+ + 2e–)
= +0,79 – (–2,34) = +0,79 + 2,34 = +3,13 volt b. Reaksi selnya:
Katode (reduksi) : 2Ag+(aq) + 2e–→ 2Ag(s)E° = +0,79 volt
Anode (oksidasi) : Mg(s) → Mg2+(aq) + 2e– E° = +2,34 volt
––––––––––––––––––––––––––––––––––––––––––––––– Mg(s) + 2Ag+(aq) → Mg2+(aq) + 2Ag(s) E° = +3,13 volt
10. E°sel= q$ ` $° _ – q° _`
1,24 = (0,80 V) – (q° _` )
_
Standar Kompetensi
Model Pengintegrasian Nilai Pendidikan Karakter
Kompetensi Dasar Nilai Indikator
2. Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari.
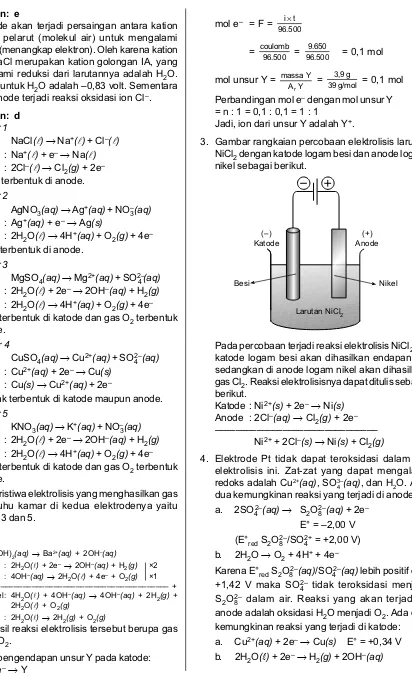
2.2 Menjelaskan reaksi o k s i d a s i - r e d u k s i dalam sel elektrolisis. 2.3 Menerapkan hukum Faraday untuk elek-trolisis larutan elektrolit.
Peduli lingkungan
Mencegah korosi pada benda-benda logam.
Dalam bab ini akan dipelajari:
1. Sel Elektrolisis dan Reaksi-Reaksi di Dalamnya 2. Korosi
3. Hukum Faraday dan Penerapannya
Elektrolisis
Menjelaskan konsep elektrolisis
Siswa dapat menjelaskan tentang elektrokimia, korosi, dan hukum Faraday serta penerapannya dalam kehidupan
Menjelaskan hukum Faraday dan Penerapannya
• Menggambarkan susunan sel Volta • Menjelaskan proses terjadinya listrik dari reaksi redoks dalam sel Volta • Menuliskan lambang sel dan
reaksi-reaksi yang terjadi pada sel Volta • Menghitung potensial sel
ber-dasarkan data potensial standar • Menjelaskan prinsip kerja sel Volta
yang banyak digunakan dalam kehidupan sehari-hari
• Melakukan percobaan untuk meng-amati reaksi yang terjadi di anode dan katode pada reaksi elektrolisis • Menuliskan reaksi yang terjadi di anode dan katode pada larutan dengan elektrode aktif ataupun elektrode inert
• Menjelaskan hukum Faraday dalam perhitungan sel elektrolisis • Melakukan percobaan penyepuhan
logam besi dengan tembaga • Menuliskan reaksi elektrolisis pada
penyepuhan dan pemurnian suatu logam
Siswa mampu menggambarkan, menuliskan reaksi sel, dan menghitung
potensial sel dalam sel Volta
Siswa mampu menjelaskan hukum Faraday melalui perhitungan sel
elektrolisis Siswa mampu menyebutkan
faktor-faktor yang memengaruhi korosi dan cara pencegahannya • Menjelaskan faktor-faktor yang
memengaruhi terjadinya korosi melalui percobaan
• Menjelaskan beberapa cara mencegah terjadinya korosi