Lampiran 2. Jadwal Kegiatan
No Kegiatan Minggu
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 1
Ploting
tanaman X
2
Pengerokan
kulit X X
3 Aplikasi X X X X X X X X X X X X X X X X
4 Peubah amatan
Analisis Thiol X X X
analisisi
sukrosa X X X
AnalisisFosfat
Anorganik(Pi) X X X
Analisis SOD X X
Analisis
Protein X X
Analisin IP X X
Analisis
Produksi X X X X X X X X
Lampiran 3. Data kandungan Thiol 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 4. Transformasi √ x Data kandunganThiol 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 5. Sidik Ragam kandunganThiol 0 bulan
Lampiran 6. Data kandunganThiol 2 bulan
Perlakuan Ulangan Total Rataan
1 2 3
K1A0 0,660 0,045 0,505 1,210 0,403
K1A1 0,319 0,554 0,654 1,527 0,509
K1A2 0,470 0,464 0,578 1,511 0,504
K1A3 0,501 0,479 0,637 1,618 0,539
K2A0 0,440 0,562 0,405 1,408 0,469
K2A1 0,973 0,440 0,675 2,088 0,696
K2A2 0,649 0,561 0,619 1,829 0,610
K2A3 0,698 0,651 0,655 2,004 0,668
Total 4,709 3,756 4,729 13,195 4,398
Lampiran 7. Sidik Ragamkandungan Thiol 2 bulan
Sumber Db JK KT F P
Block 2 0,07 0,0386 1,57 0,38
K 1 0,08 0,0890 3,62 0,19
Error (a) 2 0,04 0,0245
A 3 0,11 0,0372 1,39 0,29
A x K 3 0,01 0,0038 0,14 0,93
Error (b) 12 0,32 0,0267
Total 23 0,63
Lampiran 8. Data kandunganThiol 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
K1A0 0,785 0,945 0,819 2,549 0,850
K1A1 0,845 1,465 1,022 3,332 1,111
K1A2 0,601 0,890 0,922 2,413 0,804
K1A3 0,948 0,675 1,173 2,796 0,932
K2A0 0,634 0,743 0,542 1,919 0,640
K2A1 0,861 0,703 0,624 2,188 0,729
K2A2 0,554 0,642 0,900 2,096 0,699
K2A3 0,743 0,479 0,916 2,138 0,713
Total 5,971 6,542 6,918 19,431 6,477
Lampiran 9. Sidik Ragam kandunganThiol 4 bulan
Sumber Db JK KT F P
Block 2 0,05 0,0283 0,86 0,53
K 1 0,31 0,3146 9,59 0,09
Error (a) 2 0,06 0,0327
A 3 0,11 0,0399 0,96 0,43
A x K 3 0,05 0,0194 0,47 0,7
Error (b) 12 0,49 0,0411
Total 23 1,07
Lampiran 10. Data kandunganFosfat Anorganik(Pi) 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
K1A0 13,700 14,550 15,650 43,900 14,633 K1A1 11,950 16,100 18,050 46,100 15,367 K1A2 20,900 23,650 18,300 62,850 20,950 K1A3 18,250 14,250 23,500 56,000 18,667
K2A0 10,400 1,600 11,100 23,100 7,700
K2A1 7,950 10,900 12,300 31,150 10,383
K2A2 9,750 9,200 12,200 31,150 10,383
K2A3 9,500 9,900 12,200 31,600 10,533
Total 102,400 100,150 123,300 325,850 108,617
Lampiran 11. Sidik Ragam kandunganFosfat Anorganik (Pi) 0 bulan
Sumber db JK KT F P
Block 2 40,74 20,3707 5,4 0,15
K 1 351,51 351,5176 93,28 * 0,01
Error (a) 2 7,53 3,7682
A 3 70,29 23,4314 2,66 0,09
A x K 3 24,54 8,1826 0,92 0,45
Error (b) 12 105,67 8,8060
Total 23 600,28
Lampiran 12. Data kandunganFosfat Anorganik (Pi) 2 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 13. Transformasi √ x Data kandunganFosfat Anorganik (Pi) 2 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 14. Sidik Ragam kandunganFosfat Anorganik (Pi) 2 bulan
Lampiran 15. Data kandunganFosfat Anorganik (Pi) 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 16. Transformasi √ x Data kandunganFosfat Anorganik(Pi) 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 17. Sidik Ragam kandunganFosfat Anorganik (Pi) 4 bulan
Lampiran 18. Data kandunganSukrosa 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 19. Transformasi √ x Data kandunganSukrosa 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 20. Sidik Ragam kandunganSukrosa 0 bulan
Lampiran 21. Data kandunganSukroa 2 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 22. Tranformasi √ x Data kandunganSukroa 2 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 23. Sidik Ragam kandunganSukrosa 2 bulan
Lampiran 24. Data kandunganSukroa 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 25. Transformasi √ x Data kandunganSukroa 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 26. Sidik Ragam kandunganSukrosa 4 bulan
Lampiran 27. Data aktivitas superoksida dismutase (SOD) 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 28. Transformasi √ x Data aktivitas superoksida dismutase (SOD) 0 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 29. Sidik Ragam aktivitas superoksida dismutase (SOD) 0 bulan
Lampiran 30. Data aktivitas superoksida dismutase (SOD) 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 31. Transformasi √ x Data aktivitas superoksida dismutase (SOD) 4 bulan
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 32. Sidik Ragam aktivitas superoksida dismutase (SOD) 4 bulan
Lampiran 33. Data Produktivitas 1, di bulan ke-1
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 34. Transformasi √ x Data Produktivitaske-1, di bulan ke-1
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 35. Sidik Ragam Produktivitaske-1, di bulan ke-1
Lampiran 36. Data Produktivitas 2
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 37. Transformasi √ x Data Produktivitas 2
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 38. Sidik Ragam Produktivitas 2
Lampiran 39. Data Produktivitas 3
Perlakuan Ulangan Total Rataan
1 2 3
K1A0 1,23 1,60 0,99 3,82 1,27
K1A1 7,59 9,80 6,10 23,48 7,83
K1A2 9,14 8,56 11,76 29,47 9,82
K1A3 6,03 7,76 7,21 21,00 7,00
K2A0 1,26 0,64 1,90 3,80 1,27
K2A1 3,92 5,95 5,83 15,70 5,23
K2A2 7,38 2,75 2,50 12,63 4,21
K2A3 4,92 7,16 2,41 14,49 4,83
Total 41,47 44,22 38,69 124,38 41,46
Lampiran 40. Sidik Ragam Produktivitas 3
Sumber db JK KT F P
Block 2 1,91 0,9556 0,61 0,6194
K 1 40,41 40,4175 25,98 * 0,0364
Error (a) 2 3,11 1,5552
A 3 126,14 42,0491 12,85 ** 0,0005
A x K 3 23,99 7,998 2,44 0,1143
Error (b) 12 39,24 3,2705
Total 23 234,80
Lampiran 41. Data Produktivitas 4
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 42. Transformasi √ x Data Produktivitas 4
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 43. Sidik Ragam Produktivitas 4
Lampiran 44. Data Produktivitas 5
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 45. Transformasi √ x Data Produktivitas 5
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 46. Sidik Ragam Produktivitas 5
Lampiran 47. Data Produktivitas 6
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 48. Transformasi √ x Data Produktivitas 6
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 49. Sidik Ragam Produktivitas 6
Lampiran 50. Data Produktivitas 7
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 51. Transformasi √ x Data Produktivitas 7
Perlakuan Ulangan TOTAL Rataan
1 2 3
Lampiran 52. Sidik Ragam Produktivitas 7
Lampiran 53. Data Produktivitas 8
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 54. Transformasi √ x Data Produktivitas 8
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 55. Sidik Ragam Produktivitas 8
Lampiran 56. Data IP 1 ( 2 bulan aplikasi)
Perlakuan Ulangan Total Rataan
1 2 3
perlakuan Ulangan TOTAL Rataan
1 2 3
Lampiran 58. Sidik Ragam IP 1 ( 2 bulan aplikasi)
Lampiran 59. Data IP 2 ( 4 bulan aplikasi)
Perlakuan Ulangan Total Rataan
1 2 3
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 61. Sidik Ragam IP 2 ( 4 bulan aplikasi)
Lampiran 62. Data total solid content (TSC) 1
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 63. Data total solid content (TSC) 2
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 64. Data total solid content (TSC) 3
Perlakuan Ulangan Total Rataan
Lampiran 65. Data total solid content (TSC) 4
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 66. Data total solid content (TSC) 5
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran 67. Data total solid content (TSC) 6
Perlakuan Ulangan Total Rataan
Lampiran 68. Data total solid content (TSC) 7
Perlakuan Ulangan TOTAL Rataan
1 2 3
K1A0 21,90 40,74 23,46 86,10 28,70
K1A1 29,55 18,26 32,38 80,19 26,73
K1A2 27,02 20,00 34,68 81,69 27,23
K1A3 26,23 31,33 23,36 80,92 26,97
K2A0 51,44 39,43 34,40 125,27 41,76
K2A1 19,28 37,14 20,58 77,00 25,67
K2A2 21,25 59,26 36,93 117,44 39,15
K2A3 40,00 19,51 23,46 82,97 27,66
TOTAL 236,67 265,67 229,23 731,57 243,86
Lampiran 69. Data total solid content (TSC) 8
Perlakuan Ulangan Total Rataan
1 2 3
K1A0 36,55 29,39 17,70 83,63 27,88
K1A1 40,41 25,10 22,31 87,83 29,28
K1A2 18,07 25,31 28,16 71,54 23,85
K1A3 32,66 33,06 29,10 94,82 31,61
K2A0 26,97 20,00 29,39 76,36 25,45
K2A1 41,98 20,00 32,51 94,49 31,50
K2A2 19,34 27,57 26,03 72,95 24,32
K2A3 40,65 32,93 31,30 104,88 34,96
Lampiran 70. Data kandungan Protein 1
Perlakuan Ulangan TOTAL Rataan
1 2 3
K1A0 398,8 409,473 412,56 1220,85 406,95 K1A1 397,0 398,653 374,20 1169,88 389,96 K1A2 411,0 352,713 380,77 1144,49 381,50 K1A3 390,4 406,019 394,47 1190,89 396,96
K2A0 30,2 44,4 417,00 491,62 163,87
K2A1 6,2 93,5 394,91 494,58 164,86
K2A2 70,4 44,0 390,52 504,85 168,28
K2A3 78,2 46,0 364,28 488,50 162,83
TOTAL 1782,27 1794,67 3128,72 6705,66 2235,22
Lampiran 71. Data Kandungan Protein 2
Perlakuan Ulangan TOTAL Rataan
1 2 3
K1A0 70,36 45,97 39,50 155,84 51,95
K1A1 6,17 43,97 42,87 93,01 31,00
K1A2 30,24 44,37 66,71 141,32 47,11
K1A3 78,25 93,50 63,65 235,39 78,46
K2A0 38,82 80,22 42,27 161,31 53,77
K2A1 60,99 69,30 75,14 205,42 68,47
K2A2 50,86 48,77 94,66 194,28 64,76
K2A3 49,22 78,43 29,08 156,73 52,24
Lampiran Gambar 1
Tanaman KAS Parsial
Lampiran Gambar 2
Produksi PB 260 ,0 ppm Produksi PB 260, 150 ppm asam askorbat asam askorbat
Lampiran Gambar 3
Produksi IRR 42, 0 ppm Produksi IRR 42, 150 PPM asam askorbat asam askorbat
Lampiran Gambar 4
DAFTAR PUSTAKA
Abraham, T., J. Mathew, P. Srinivas, an C. K. Jacob. 2006. Incidence of taping panel drynes on populer rubber clones in southern rubber clones in southern rubber growing region of india. In Jacob, J., R R. Krishnakumar and N.M Mathew. (Eds). Taping Panel Dryness Of Rubber Research Institute of India. India. 55-63.
Andriyanto, M., Dan Tistama, R. 2014. Perkembangan Dan Upaya Pengendalian Kering Alur Sadap (Kas) pada Tanaman Karet (Hevea brasiliensis). Balai Penelitian Sei Putih.
Anwar C. 2001.Manajemen dan Teknologi Budidaya Karet.FABA Indonesia Konsultan.
Ardiansyah M., Mawarni L., Rahmawati N.2014. Respon Pertumbuhan dan Produksi Kedelai Hasil Seleksi Terhadap Pemberian Asam Askorbat dan Inokulasi Fungi Mikoriza Arbuskular di Tanah Salin. Univrsitas Sumatra Utara. Medan.
Ardianti, A., Guntarti, A., Zainab. 2014. Uji Aktivitas Antioksidan Fraksi Eter Hasil Hidrolisis Infusa Daun Binahong (Antedera cordifolia (Ten) steenis) Dengan Metode DPPH (1.1- Diphenil-2-Picryihydrazl) . Universitas Ahmad Dahlan. Yogyakarta.
Arif, B., dan Islan, B. 2006.Penanggulangan Alur Sadap dan Penyakit Lapuk Cabang dan Batang Pada Tanaman Karet Dengan Formula Antco F-96.Balai Penelitian Sumbawa.
Arlyny F, A.2008.Program Ekspresi Gen Responsif Terhadap ReactiveOxygen Species pada Hevea brasiliensis AkibatPelukaan dan Etilena Eksogen. Institut Pertanian Bogor. Bogor.
Astuti S. Muchtadi D., Astawan M., Purwantara B., and Wresdiyanti T. 2009. Pengaruh Pemberian Tepung Kedelai Kaya Isoflavon Terhadap Kadar Malonaldehid (MDA), Aktivitas Superoksida Dismutase (SOD) Testis dan Profil Cu,Zn- SOD Tubuli Seminiferi Testis Tikus Jantan. Fakultas Kedokteran Hewan. Institut Pertanian Bogor. Bogor.
Bangun, M. K. 1991. Rancangan Percobaan. Fakultas Pertanian USU. Medan. Bobbiliof, W. 1923. Anatomy and physiology of Hevea brasiliensis. Zurich.
Institute OrellFussli.
Formula Antico F-96. Prosiding Lokakarya Nasional Budidaya Tanaman Karet, 286-301.
Budiman, H. 2012. Budidaya Karet Unggul. Pustaka Baru. Yogyakarta.
Damanik, S. 2012.Pengembangan Karet (Hevea brasiliensis) Berkelanjutan Di Indonesia. Pusat Penelitian Dan Pengembangan Perkebunan.
Deka, H. K., J. Mathew, T. Abraham, and C. K. Jacob. 2006. Characterisation of TPD in Different clones of Hevea in Cut Panel. In Jacob, J., R. R. Krishnakumar and N. M. Mathew. (eds). Tapping Panel Dryness of Rubber Trees. Rubber Research Institute of India. India, 64-67.
Dische, Z, M. 1962. Carbohydrate Chem Acad. Press, I1:488
Gebelin V., Leclercq, J., Hu, S., Tang C., and Montoro P. 2013. Regulation of MIR Genes in Response to Abiotik Stress in Hevea brasiliensis Int. J. Mol. Sci. 2013.14, 19587-19604; doi: 10.3390?ijms 141019587. International Journal of Molecular Sciences ISSN 1422-0067 www.mdp.com/journal/ijms
Gohet, J., L. Prevot, J.M. Eschbach, A. Clement,and J.L. Jacob. 1996. Clone, Growth, and Stimulation : Latex Production Factors. Plantations3(1): 30−38.
Island,B, dan Dwi, S,A. 2013. Prospek Pengembangan Karet Diwilayah Daerah Aliran Sungai.Balai Penelitian Sumbawa.
Jacob, J. And . Krisnakumar. 2006. Tapping Panel Dryness Syndrome: What We Know And What We Do Not Know. In Jacob, J,R R. Krisnakumar and N. M. Mathew. (Eds). Tapping Panel Dryness Of Rubber Trees. Rubber Research Institute of India. India. 3-27.
Janudianto, Prahmono A, Napitupulu H, Rahayu S. 2013. Panduan budidaya karet untuk petani skala kecil.Rubber cultivation guide for small-scale farmers. Lembar Informasi AgFor 5. Bogor, Indonesia: World AgroforestryCentre (ICRAF) Southeast Asia Regional Program.
Julahir, H, S. 2009. Pengaruh Pemberian Vitamin C terhadap jumlah sel ledying dan jumlah sperma mancit dewasa yang dipapari Monosodium glutamate.Universitas Sumatra Utara. Medan.
Krishnakumar, R. R., Cornish, and J. Jacob. 2001. Rubber Biosynthesis in Tapping Panel Affected Hevea Trees. Journal of Rubber Research, 4(2), 131-139.
Kurniawan, M., Izzati, M., Nurchayati.(2010). Kandungan Klorofil, Karonenoid dan Vitamin C pada Beberapa Spesies Tumbuhan Aquatik. Universitas Dipenogoro. Semarang.
Lacote, R. 2007. Some Considerations Concerning the Yield Potential of Some Clones HB in IRC2007. IRRDB and CRRI : Siem Reap. Cambodia. Marchino, F,Yusrizal M.Z, dan Irfan S. 2010. Pertumbuhan Stum Mata Tidur
Beberapa Klon Entres Tanaman Karet (Hevea brasiliensis) Pada Batang Bawah PB 260 di Lapangan.Universitas Andalas, Padang.
Maryani. 2007. Aneka Tanaman Perkebunan, Pusat Pengembangan UniversitasRiau.Pekanbaru.
Maslachah L., Sugihartuti R.,dan Kurniasanti R .2008. Hambatan Produksi Reactive Oxygen Species Radikal Superoksida (O2.-) oleh Antioksidan Vitamin E (α- tocopherol ) pada Tikus Putih (Rattus norvegicus)yang Menerima Stressor Renjatan Listrik. Universitas Erlangga. Surabaya. Milford, G.FJ., E.C. Paarderkooper, And H.C. Yee. 1969. Latex Vessel Plugging :
Its Importance To Yeild Ang Clonal Behaviour. J.Rubb. Res. Inst. Malaya 21,274282
Nugroho P, S. 2010. Karakterisasi Biologi Isolat-isolat Rigidoporus Microporus Pada Tanaman Karet (Hevea brasiliensis). Universitas Sebelas Maret. Surakarta.
Peraturan Menteri Pertanian Republik Indonesia.2014. Pedoman Budidaya Karet (Hevea brasiliensis) yang Baik. Jakarta.
Rejab, I,B., Pastur V, and Mauch-Mani B. 2014.Plant Responses to Simultaneous Biotic and Abiotic Stress Molecular Mechanisms. University of Nechatel. Switzerland.
Sarvajeet Singh Gill, Narendra Tuteja. 2010. Plant Physiology and Biochemistry . Aruna Asaf Ali Marg, New Delhi. India.
Setiawan, D. H., danAndoko, A. 2005. Petunjuk Lengkap Budidaya Karet. Agromedia Pustaka. Jakarta.
Sulistyowati, Y. 2006. Pengaruh Pemberian Likopen Terhadap Status Antioksidan (Vitamin C dan Gluthathion Proksidase) Tikus (Rattus norvigatus galur sprague dowly) Hiperkolesterolemik. Universitas Diponogoro. Semarang.
Sumarmadji. 2005. Sistem Eksploitasi Tanaman Karet Yang Spesifik – Diskriminatif.Workshop Eksploitasi Tanaman Karet dan Pengendalian Penyakit Bidang Sadap. Medan.
Syukur.2013. Kajian Okulasi Benih Karet(Hevea BrasiliensisMuell. Arg) Dengan PerbedaanMata Tunas (Entres) dan Klon.Balai Pelatihan Pertanian Jambi Taussky H. Hand E. Shorr. 1953. A micro colorimetric methods for the
determination of inorganic phosphorus. J. Biol Chem 202: 675-685. Tistama, R., Sumarmadji., dan Siswanto. 2006.Kejadian Kering Alur Sadap dan
Teknik Pemulihannya pada Tanaman Karet.Balai Penelitian Sei Putih. Tistama, R. 2013. Faktor Histologis dan Fisiologis Yang Berkaitan Dengan
Produksi Lateks.Workshop Eksploitasi Tanaman Karet Menuju Produktivitas Tinggi dan Umur Ekonomis Optimal.Medan, 13.
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian dilaksanakan dikebun percobaan PB260 dan IR42tahun 2006-2007, Balai Penelitian Sungai Putih, Kecamatan Galang,Kabupaten Deli Serdang, tepatnya di ketinggian tempat ± 54 meter di atas permukaan laut, dari bulan Mei sampai dengan Oktober 2015.
Bahan dan Alat
Bahan yang digunakan merupakan tegakan tanaman karet berumur 7-8 tahun yang ditanam pada tahun 2006-2007 dengan jarak tanam 4 x 6 m dengan sistem sadap 1/2S d/3ET.2.5 (6/y 1/m), bahan kimia untuk diagnosis lateks, bahan kimia untuk melihat kandungan fisiologi lateks, asam askorbat.
Alat dan bahan yang diperlukan dalam penelitian ini adalah spidol marker,cat minyak, pisau, sadap, spektrofotometer, sentrifius, microskop cahaya, alat ukur seperti meteran dan timbangan, buku data, alat tulis, kamera beserta alat-alat lain yang mendukung penelitian ini.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Petak Terbagi (RPT/ Split Plot Design) dengan dua faktor perlakuan yaitu :
Petak utama : Klon Tanaman Karet (Main Plot) K1 : Klon PB 260
K2 : Klon IRR 42
Anak Petak :Konsentrasi Asam Askorbat (Sub Plot) A0 : 0 ppm
A2 : 300 ppm A3 : 450 ppm
Sehingga diperoleh 8 kombinasi perlakuan yaitu
K1A0 K1A1 K1A2 K1A3
K2A0 K2A1 K2A2 K2A3
Jumlah ulangan :3
Jumlah tanaman per perlakuan : 3 Jumlah kombinasi perlakuan :8 Jumlah seluruh tanaman : 72
Adapun model liner dari sidik ragam penelitian sebagai berikut: Yijk = µ + ρi + αj + δij + βk + (αβ)jk + εijk
i = 1,2,3 j = 1,2 k= 1,2,3,4
Yijk= Nilai pengamatan unit percobaaan pada perlakuan klon ke-j, terhadap taraf asam askorbat ke-k, pada blok ke-i
μ = Nilai tengah umum.
ρi =Pengaruh blok atau ulangan ke-i.
αj = Pengaruh klon (main plot) ke-j.
δij =Pengaruh acak yang disebabkan (klon) ke-j pada blok ke-i.
βk =Pengaruh faktor taraf asam askorbat (sub plot)ke-k.
(αβ)jk= Interaksi faktor klon tanaman ke-j dengan taraf asam askorbat taraf ke-k.
εijk= Efek eror yang disebabkan sub plot ke-k pada klon ke-j di blok ke-i.
PELAKSANAAN PENELITIAN Plotting area Penelitian
Tahap awal dari penelitian ini adalah ploting areal penelitian dimana akan dilakukan pengujian sampel. Tanaman akan dijadikan tanaman sampel ditandai dengan jelas dengan cat dan diberi tali untuk menghindari kesalahan pengamatan dan agar tanaman yang dijadikan tanaman sampel tidak disadap oleh penyadap. Pengerokan Bidang Sadap
Setelah didapatkan sampel tanaman sampel tanaman yang mengalami kejadian KAS maka sebelum pemberian asma askorbat terlebih dahulu bidang sadap yang akan diberi perlakuan dikerok (bark scarpping) dengan pisau kerok untuk menghilangkan kulit luarnya kurang lebih 1-2 mm.
Perlakuan Pemberian Asam Askorbat
Larutan asam askorbat yang diberikan sesuai dengan perlakuan, dicampur dengan gliserin dan dioleskan pada bidang sadap tanaman yang sudah dikerok.Interval pemberian perlakuan adalah 1 kali dalam 1 minggu selama 4 bulan.
Pengamatan kondisi fisiologi
Pengamatan kondisi tersebut diamati dengan cara mengambil sampel lateks yang telah di tampung dan di bawa ke lab menggunakan es. Lateks di ambil 1 ml kemudian di masukan ke dalam 9 ml TCA. Serum di keluarkan dari lateks dengan cara di gerus.
Parameter Pengamatan Fisiologis lateks
dilakukandengan cara mengambil sampel lateks.Pengamatan ini dilakukan pada saat, 0, 2, 4, bulan setelah aplikasi larutan asam askorbat.
Peubah Amatan Thiol (R – SH) (mM)
Pengamatan dilakukan pada sampel lateks yang diambil 1 ml langsung dari lapangan kemudian direndam pada larutan trikloro-asetat (TCA 2,5%) (2,5 g TCA dilarutkan dalam 100 ml akuades) sebanyak 9 ml pada botol ukur. Lateks yang menggumpal akibat perendaman diaduk berulang-ulang hingga serum pada lateks tercampur dengan larutan TCA kemudian dipipet campuran larutan TCA dengan serum lateks sebanyak 1,5 ml dengan menggunakan mikropipet setelah itu dicampurkan dengan larutan TCA 2,5% sebanyak 1,5 ml pada tabung reaksi kemudian dicampurkandengan pereaksi dithiobis-nitrobenzoat (DTNB) 10 mM (larutan dari DTNB 79,3 g + EDTA 148,8 g + buffer tris 0,5 M (tris 30,3 g dilarutkan dalam 500 ml aquades) 5 ml + aquades 5 ml) sebanyak 75 µ L setelah itu dicampurkan kembali dengan buffer tris 0,5 M sebanyak 1,5 ml dan divortex untuk membentuk nitrobenzoat (TNB) yang berwarna kuning yang terabsorbsi
pada λ 421 nm (nanometer) dengan spektrofotometer Beckman DU 650
(Bobbiliof, 1923). Pengamatan ini dilakukan pada saat, 0, 2 dan 4 bulan setelah aplikasi larutan asam askorbat.
Sukrosa (mM)
yang menggumpal akibat perendaman diaduk berulang-ulang hingga serum pada lateks tercampur dengan larutan TCA kemudian dipipet campuran larutanTCA dengan serum lateks sebanyak 150 µL dengan menggunakan mikropipet setelah itudicampurkan dengan larutan TCA 2,5% sebanyak 350 µL pada tabung reaksi kemudian dicampurkan kembali pada pereaksi anthrone (larutan dari 0,1 g anthrone + larutan asam sulfat pekat (H2SO4 70%) sebanyak 100 ml) sebanyak 3 ml dan divortex kemudian dipanaskan dengan merendamkannya pada air mendidih selama 15 menit sehingga menyebabkan dehidrasi sukrosa dimana akan memberikan turunan furfural yang bereaksi dengan terjadinya perubahan warna
larutan menjadi warna biru yang selanjutnya diamati absorbannya pada λ 627 nm
(nanometer) dengan spektrofotometer Beckman DU 650. Pengamatan ini dilakukan pada saat, 0, 2 dan 4 bulan setelah aplikasi larutan asam askorbat.
Fosfat Anorganik (Pi)(mM)
10 g + aquades 70 ml) 10 ml dan diterakan dengan menggunakan aquades hingga 100 ml) sebanyak 1 ml dan divortex kemudian didiamkan pada suhu kamar (25ºC) selama 10 menit sehingga tereduksi dalam reaksi asam yang menyebabkan perubahan warna pada larutan tersebut menjadi warna biru yang kemudian
diamati absorbannya pada λ 627 nm (nanometer) dengan spektrofotometer
Beckman DU 650.Pengamatan ini dilakukan pada saat, 0, 2 dan 4 bulan setelah aplikasi larutan asam askorbat.
Pengukuran indeks penyumbatan (IP)
Indeks penyumbatan merupakan perbandingan dari laju pengaliran lateks permenit dengan volume lateks total dikalikan 100 % (Milford, et al,1969). Pengamatan dilakukan di bulanke-2 dan ke-4, diamati pada saat mulai penyadapan (pukul 5.30 WIB) di ukur volume lateks pada 5 menit pertama dan volume lateks pada akhir atau total dengan gelas ukur pada setiap satuan percobaan.
Pengukuran kadar karet kering (KKK) /total solid content (TSC)
Pengukuran KKK dengan mengukur TSC (semua padatan selain partikel karet ikut diukur) pengamatan di lakukan dilakukan dengan cara mengambil beberapa tetes sampel lateks segar (1-3 gram) pada setiap unit percobaan diratakan dalampetridish kemudian dioven 1 x 24 jam dengan suhu 65 0C hingga berat konstan, lalu di timbang berat keringnya. Persentase TSC diperoleh dengan membandingkan berat kering dan berat basah dikalikan dengan 100% .
IP =
Vol total Vol 5menit
x 100 %
TSC= x 100 % Berat kering
Produktivitas
Pengamatan terhadap produktivitas tanaman karet dilakukan di bulan 1 dan 2, serta diamati setiap 10 hari sekalidi bulan 3 dan 4setelahaplikasi larutan asam askorbat,pengamatan di lakukan dengan cara menimbang berat lateks yang telah berhenti menetes dari alur sadap, kemudian di ambil sempel segar untuk mengukur TSC, lalu berat segar tadi di bandingkan dengan nilai TSC di kali 100%sehingga dapat dilihat apakah tanaman yang telah mendapat perlakuan dapat menghasilkan lateks layaknya tanaman yang sehat.
Superoksida dismutase (SOD)
Sampel lateks disentrifugasi 12 rpm selama 30 menitpada suhu 40C, jika serum belum terpisah sampel disentrifugasi kembali 12 rpm selama 15 menitpada suhu 40C, kemudiam setelah terpisah di ambil supernatannya 150 Mm dan di masukan larutan baffer yang di dalamnya terlarut bafer phosfat 750 µM, methionine 50 µM, NBT 50 µM, EDTA150 µM, ektrak enzim 100 µM, riboflavin 50 µM dan H2O 350 µM, lalu di baca di spektrofotometer Beckman DU 650 dengan absorbannya pada 595 λ nm (nanometer).Untuk kandungan protein lateks segar dikumpulkan dalam 1,5 ml tabung ependorf lalu sampel lateks di sentrifugase untuk memisahkan fraksi karet dari total serum, setelah terpisah di tambah regen bradfort, membuat regen bradfort yaitu timbng coomassie briviant blau 0,01 g, etanol 5 ml, phosporid acid 10 ml, lalu encerkan dengan aquades 75 ml setelah tercampur.Kemudian di baca di spektrofotometer Beckman DU 650.
TSC
HASIL DAN PEMBAHASAN Hasil
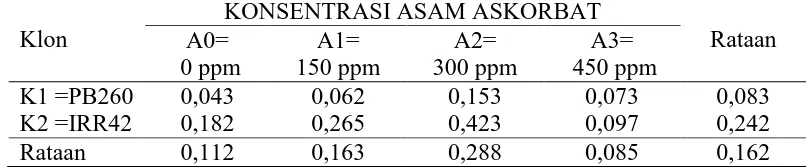
Kandungan thiol lateks karet 0 bulan
Pengamatan kandungan thiol lateks 0 bulan dari sidik ragam dapat dilihat pada Lampiran 5. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandungan thiol lateks 0 bulan dari klon tanamandan konsentrasi asam askorbat dapat dilihat pada Tabel 1.
Tabel 1.KandunganThiol Lateks 0 Bulan dengan Perlakuan Klon Tanaman dan KonsentrasiAsam Askorbat
Kandungan thiol lateks karet 2 bulan
Pengamatan kandungan thiol lateks 2 bulan dari sidik ragam dapat dilihat pada Lampiran 7. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandungan thiol lateks 2 bulan dari klon tanamandan konsentrasiasam askorbat dapat dilihat pada Tabel 2.
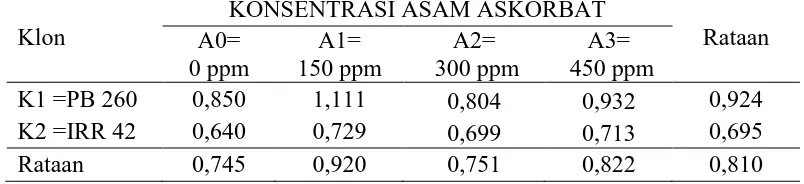
Kandungan thiol lateks karet 4 bulan
Pengamatan kandungan thiol lateks 4 bulan dari sidik ragam dapat dilihat pada Lampiran 9. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandungan thiol lateks 4 bulan dari klon tanamandan konsentrasi asam askorbat dapat dilihat pada Tabel 3.
Tabel 3. Kandungan Thiol Lateks 4 Bulan dengan Perlakuan Klon Tanaman dan KonsentrasiAsam Askorbat
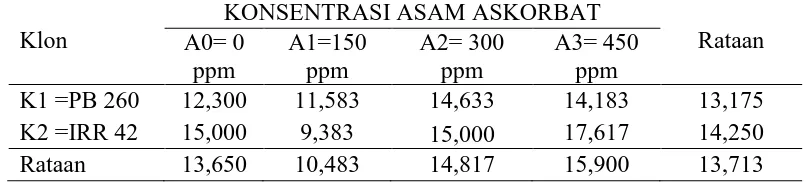
KandunganFosfat Anorganik(Pi) lateks karet 0 bulan
Pengamatan kandunganfosfat anorganik (Pi) lateks 0 bulan dari sidik ragam dapat dilihat pada Lampiran 11. Hasil sidik ragam diperoleh bahwa klon
tanaman menunjukan berbeda nyata pada kandungan fosfat anorganik (Pi) 0 bulan, sedangkan konsentrasi asam askorbat dan interaksi menunjukan tidak
berbeda nyata.
Rataan kandunganfosfat anorganik (Pi) lateks 0 bulan dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 4.
Tabel 4.KandunganFosfat Anorganik (Pi)Lateks 0 Bulan dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat
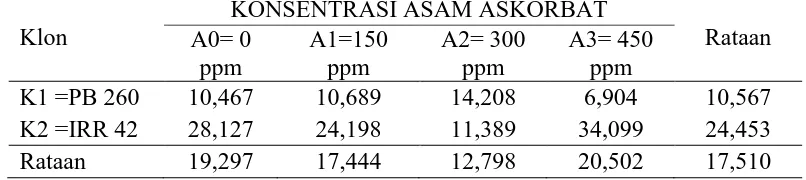
KandunganFosfat Anorganik (Pi) lateks karet 2 bulan
Pengamatan kandunganfosfat anorganik (Pi) lateks 2 bulan dari sidik ragam dapat dilihat pada Lampiran 14. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandunganfosfat anorganik (Pi)lateks 2 bulan dari klon tanaman dan konsentrasiasam askorbat dapat dilihat pada Tabel 5.
Tabel 5. KandunganFosfat Anorganik (Pi)Lateks 2 Bulan dengan Perlakuan Klon Tanaman dan KonsentrasiAsam Askorbat
Klon
KandunganFosfat Anorganik (Pi) lateks karet 4 bulan
Pengamatan Kandunganfosfat anorganik (Pi) lateks 4 bulan dari sidik ragam dapat dilihat pada Lampiran 17. Hasil sidik ragam diperoleh bahwa klon, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandunganfosfat anorganik (Pi)lateks 4 bulan dari klon tanamandan konsentrasiasam askorbat dapat dilihat pada Tabel 6.
Tabel 6.KandunganFosfat Anorganik (Pi) Lateks 4 Bulan dengan Perlakuan Klon Tanaman dan KonsentrasiAsam Askorbat
Kandungan sukrosa lateks karet 0 bulan
Pengamatan Kandungan sukrosa lateks 0 bulan dari sidik ragam dapat dilihat pada Lampiran 20.Hasil sidik ragam diperoleh bahwa klon tanaman dan konsentrasi asam askorbat terjadi interaksi berbeda nyata.
Rataan kandungan sukrosa lateks 0 bulan dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 7.
Tabel 7. Kandungan Sukrosa Lateks 0 Bulan dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Kandungan sukrosa lateks karet 2 bulan
Pengamatan kandungan sukrosa lateks 2 bulan dari sidik ragam dapat dilihat pada Lampiran 23.Hasil sidik ragam diperoleh bahwa klon tanaman,konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandungan sukrosa lateks 2 bulan dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 8.
Kandungan sukrosa lateks karet 4 bulan
Pengamatan kandungan sukrosa lateks 4 bulan dari sidik ragam dapat dilihat pada Lampiran 26. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan kandungan sukrosa lateks 4 bulan dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 9.
Tabel 9. Kandungan Sukrosa Lateks 4 Bulan dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Superoksida dismutase (SOD) 0 bulan
Pengamatan superoksida dismutase (SOD) lateks 0 bulan dari sidik ragam dapat dilihat pada Lampiran 29. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan superoksida dismutase (SOD)lateks 0 bulan dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 10.
Tabel 10. Superoksida Dismutase (SOD) Lateks 0 Bulan dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Superoksida dismutase (SOD) 4 bulan
Pengamatan superoksida dismutase (SOD) lateks 4 bulan dari sidik ragam dapat dilihat pada Lampiran 32. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan superoksida dismutase (SOD)lateks 4 bulan dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 11.
Tabel 11.Superoksida Dismutase (SOD)Lateks 4 Bulan dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Produktivitas lateks ke-1, di bulan ke-1
Pengamatan produktivitas lateks1, setelah 4 kali aplikasi di bulan ke-1dari sidik ragam dapat dilihat pada Lampiran 35. Hasil sidik ragam diperoleh bahwa klon tanaman menunjukan berbeda nyata pada produktivitas ke-1, setelah 4 kali aplikasi di bulan ke-1, sedangkankonsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan produktivitas latekske-1,di bulan ke-1dari klon tanaman dan konsetrasi asam askorbat dapat dilihat pada Tabel 12.
Tabel 12. Produktivitas Latekske-1,di Bulan ke-1dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Tabel 12dapat dilihat bahwa jenis klon tanaman rataan produktivitas tertinggi terdapat pada K2 (0,67 g) yang berbeda nyata dengan K1 (0,46 g).
Produktivitas lateks ke-2, di bulan ke-2
Pengamatan produktivitas latekske-2, di bulan ke-2dari sidik ragam dapat dilihat pada Lampiran 38. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan produktivitas latekske-2, di bulan ke-2dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 13.
Tabel 13.Produktivitas Latekske-2,di Bulan ke-2dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Produktivitas lateks ke-3, di bulanke-3
Pengamatan produktivitas latekske-3, di bulan ke-3 dari sidik ragam dapat dilihat pada Lampiran40. Hasil sidik ragam diperoleh bahwa klon tanaman dan konsentrasi asam askorbat menunjukan berbeda nyata pada produksi ke-3, di bulan ke-3.
Tabel 14. Produktivitas Latekske-3, di Bulan ke-3dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Keterangan : Data yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan Uji jarak berganda Duncan pada taraf 5%.
Tabel 14dapat dilihat bahwa rataan jenis klon tanaman produktivitas tertinggi di dapat pada K1 (6,48 g) yang berbeda nyata dengan K2 (3,89 g), sedangkan konsentrasi asam askorbat A2 (7,02 g), A1 ( 6,53 g) dan A3 (5,91 g) berbeda nyata denganA0 (3,25 g).
Produktivitas lateks ke-4, di bulan ke-3
Pengamatan produktivitas latekske-4, di bulan ke-3 dari sidik ragam dapat dilihat pada Lampiran 43. Hasil sidik ragam diperoleh bahwa terdapat interkasi antaraklon tanaman dan konsentrasi asam askorbat menunjukan berbeda nyata pada produksi ke-4, di bulan ke-3.
Rataan produktivitas latekske-4,di bulan ke-3dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 15.
Tabel 15. Produktivitas Lateks ke-4, di Bulan ke-3dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Tabel 15dapat dilihat bahwa interaksi terdapat pada kombinasi klon tanaman dan konsentrasi asam askorbat K1A2 (10,07 g), K1A1 (8,72 g), K1A3 (7,87 g) yang berbeda nyata dengan K2A1(6,15 g), K2A3 (6,03 g), K2A2 (3,38 g), K1A1 (1,41 g), K2A1 (1,08 g).
Produktivitas lateks ke-5, di bulan ke-3
Pengamatan produktivitas latekske-5, di bulan ke-3 dari sidik ragam dapat dilihat pada Lampiran 46. Hasil sidik ragam diperoleh bahwa konsentrasi asam askorbat menunjukan berbeda nyata pada produksi ke-5, di bulan ke-3, sedangkan jenis klon tanaman dan interaksi tidak berbeda nyata.
Rataan produktivitas latekske-5, di bulan ke-3 dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 16.
Tabel 16. Produktivitas Latekske-5, di Bulan ke-3dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Keterangan : Data yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan Uji jarak berganda Duncan pada taraf 5%.
Tabel 16 dapat dilihat bahwa rataan jenis klon tanaman tertinggi di dapat pada konsentrasi asam askorbat A1 (5,89 g), A3 (4,68 g) dan A2 (4,66 g) yang berbeda nyata dengan A0 (1,46 g).
Produktivitas lateks ke-6, di bulan ke-4
Rataan produktivitas latekske-6,di bulan ke-4dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 17.
Tabel 17. Produktivitas Latekske-6, di Bulan ke-4dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Keterangan : Data yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkanUji jarak berganda Duncan pada taraf 5%.
Tabel 17dapat dilihat bahwa interaksi terdapat pada kombinasi klon tanaman dan konsentrasi asam askorbat K1A1 (12,99 g), K1A3 (12.73 g), K1A2 (8,99 g) yang berbeda nyata dengan K2A3 (3,74 g), K2A1 (3,40 g), K2A2 (2,95g), K2A0 (1,54 g), K1A0 (1,16 g).
Produktivitas lateks ke-7, di bulan ke-4
Pengamatan produktivitas latekske-7, di bulan ke-4dari sidik ragam dapat dilihat pada Lampiran 52. Hasil sidik ragam diperoleh bahwa jenis klon tanaman dan konsentrasi asam askorbat menunjukan berbeda nyata pada produksi ke-7, di bulan ke-4, sedangkan interaksi tidak berbeda nyata.
Rataan produktivitas latekske-7,di bulan ke-4dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 18.
Tabel 18. Produktivitas Latekske-7, di Bulan ke-4dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Tabel 18 dapat dilihat bahwa rataan jenis klon tanaman tertinggi terdapat padaK1 (9,28 g) yang berbeda nyata dengan K2 (3,26 g) dan rataan konsentrasi tertinggi di dapat pada konsentrasi asam askorbat A2 (8,67 g) A1 ( 7,48 g) serta A3 (7,17 g) yang berbeda nyata dengan A0 (1,75 g).
Produktivitas lateks ke-8, di bulan ke-4
Pengamatan produktivitas latekske-8,di bulan ke-4dari sidik ragam dapat dilihat pada Lampiran 55. Hasil sidik ragam diperoleh bahwa terdapat interkasi antara klon tanaman dan konsentrasi asam askorbat menunjukan berbeda nyata pada produktivitaske-8, di bulan ke-4.
Rataan produktivitas latekske-8, di bulan ke-4dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 19.
Tabel 19. Produktivitas Latekske-8, di Bulan ke-4dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Keterangan : Data yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkanUji jarak berganda Duncan pada taraf 5%.
Tabel 19dapat dilihat bahwa interaksi terdapat pada kombinasi klon tanaman dan konsentrasi asam askorbat K1A1 (13,55 g),K1A3 (10.68 g),yang berbeda nyata dengan K1A2 (7,38 g), K2A2 (4,43 g), K2A3 (4,28 g),K2A1(2,57 g), K2A0(1,15 g), K1A0 (1,03 g).
Indeks Penyumbatan (IP) 2 bulan aplikasi
Rataan indeks penyumbatan (IP) 2 bulan aplikasi dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 20.
Tabel 20.Indeks Penyumbatan (IP) 2 Bulan Aplikasi dengan Perlakuan Klon Tanaman dan KonsentrasiAsam Askorbat.
Klon
IP (indeks penyumbatan) 4 bulan aplikasi
Pengamatan indeks penyumbatan (IP)4 bulan aplikasi dari sidik ragam dapat dilihat pada Lampiran 61. Hasil sidik ragam diperoleh bahwa klon tanaman, konsentrasi asam askorbat dan interaksi menunjukan tidak berbeda nyata.
Rataan indeks penyumbatan (IP) 4 bulan aplikasi dari klon tanaman dan konsentrasi asam askorbat dapat dilihat pada Tabel 21.
Tabel 21. Indeks Penyumbatan (IP)4 Bulan Aplikasi dengan Perlakuan Klon Tanaman dan Konsentrasi Asam Askorbat.
Klon
Respon pemberian konsentrasi asam askorbat pada klon yang berbeda terhadap status fisiologis tanaman karet yang terkena KAS parsial
aplikasi selama 4 bulan mengalami peningkatan hal ini sesuai dengan pernyataan Tistamaet al.,(2006) yang menyatakan komponen fisiologis lateks lainnya adalah thiol. Thiol (R-SH) berperan dalam mengaktifkan beberapa enzim yang berhubungan dengan cekaman lingkungan. Status thiol berhubungan pada saat mendapat tekanan sistem ekploitasi. Semakin tinggi intensitas eksploitasi semakin rendah status thiol dalam lateks. Pada tanaman yang mengalami KAS status thiolnya lebih rendah dibandingkan dengan tanaman sehat. Kemungkinan jaringan kulit mengalami proses keletihan yang dapat diikuti dengan kematian sel-sel pembuluh latekssecara parsial
Hasil pengamatan dan sidik ragam dapat dilihat bahwa jenis klon tanaman dan konsentrasi asam askorbat tidak berbeda nyata terhadap respon fisiologis kandungan fosfat anorganik (Pi). Nilai nilai fisiologis kandungan fosfat anorganik (Pi) yang dilakukan aplikasi selama 4 bulan mengalami peningkatan hal ini sesuai dengan pernyataan Krisnakumar et al.,(2001) yang menyatakan tanaman yang terkena KAS terjadi hambatan perubahan mevalonat menjadi isopenteril piroposfat (IPP). Hambatan tersebut terjadi akibat kurangnya suplai ATP sebagai sumber energi pada reaksi perubahan mevalonat menjadi IPP. Pada tahapan tersebut merupakan proses reaksi yang membutuhkan banyak energi. status ATP yang rendah juga diiringi dengan status fosfat anorganik yang rendah didalam lateks pada tanaman terserang KAS. Kandungan Pi memang cendrung menurun jika tanaman dieksploitasi dengan sistem sadap yang lebih intensif.
bulan mengalami penurunan hal ini sesuai dengan pernyataan tistama et al., (2006)yang menyatakan dari hasil pengamatan terhadap kandungan sukrosa pada tanaman yang sehat dan tanaman yang terkena KAS sebagian, ternyata kandungan sukrosa dari pada tanaman yang sehat lebih rendah, hal ini membuktikan dua hal, pertama: adanya suplai sukrosa yang normal pada tanaman yang terserang KAS, kedua: adanya hambatan biosintesis karet sehingga sukrosa tidak dimanfaatkan dalam proses tersebut sehingga terjadi penumpukan.
Respon pemberian konsentrasi asam askorbat pada klon yang berbeda terhadap status ROS tanaman karet yang terkena KAS parsial
Hasil pengamatan dan sidik ragam dapat dilihat bahwa jenis klon tanaman dan konsentrasi asam askorbat tidak berbeda nyata terhadap respon enzim SOD dan Indeks Penyumbata (IP). Hal ini dikarenakan fungsi enzim yang menghadapi ROS berbeda beda dan ketidakseimbangan aktifitas enzim SOD, APX, katalase serta Indek Penyumbatan (IP) terganggu karna tertekan toksisitas ROShal ini sesuai dengan pernyataan Arlyny(2008) yang menyatakanFungsi enzim yang berbeda-beda dalammenghadapi ROS mengakibatkan tingkatekspresi gen responsif terhadap ROS beragampada berbagai perlakuan. Seperti telahdisebutkan sebelumnya bahwa tingkat cekamanoksidatif dapat ditentukan dari jumlah ROSseperti superoksida, peroksida, dan radikalhidroksil. Oleh karena itu,keseimbangan aktifitas enzim SOD, APX, dankatalase sangat penting untuk menekan leveltoksisitas ROS di dalam sel. Saat aktifitaskatalase rendah di tanaman, aktifitas enzimlain, yaitu APX akan meningkat.
Jenis klon tanaman yang kondisi labil dikarenakan kekurangan gizi dan logam berat hal ini sesuai dengan pernyataan Sarvajeet dan Narendra (2010) dalam kondisilabil, molekulROSmengikatberbagaimekanisme pertahananantioksidan.Kesetimbangan antaraproduksidanpengikatan ROSmungkintergangguoleh berbagai faktorstresbiotikdanabiotikseperti salinitas,radiasiUV, kekeringan, logam berat, suhu ekstrim,kekurangan gizi dan udara. Melaluiberbagai reaksi, O2 mengarah padapembentukanH2O2, OHdanROS lainnya. ROSterdiriO2, H2O2, 1O2, HO2, OH,ROOH, ROO, dan RO yangsangat reaktifdanberacundan penyebabkerusakanprotein, lipid, karbohidrat, DNAyang akhirnya menghasilkan kematian sel.
Respon pemberian konsentrasi asam askorbat pada klon yang berbeda terhadap status produktivitas tanaman yang terkena KAS parsial
Hasil penelitian yang telah dilakukan menunjukan bahwa jenis klon tanaman pada tanaman yang terkena KAS parsial terhadap pemberian berbagai jenis konsentrasi asam askorbat menunjukan pengaruh yang nyata terhadap peubah amatan produktivitas 1,3 dan 7tetapi belum berpengaruh nyata terhadap peubah amatan produktivitas 2 dan 5.
Hal ini sesuai dengan pernyaatan Peraturan Menteri Pertanian Republik Indonesia (2013) yang menyatakan untuk Rekomendasi klon-klon karet untuk periode tahun 2010-2014 berdasarkan hasil rumusan Lokakarya Nasional Pemuliaan Tanaman Karet Tahun 2009, yaitu sebagai berikut: Klon Anjuran Komersial a.) klon penghasil lateks terdiri: IRR 104, IRR 112, IRR 118, IRR 220, BPM 24, PB 260, PB 330, dan PB 340; b.) klon penghasil lateks-kayu terdiri: IRR 5, IRR 39, IRR 42, IRR 107,dan RRIC 100.
Berdasarkan hasil penelitian yang telah dilakukan menunjukan bahwa jenis konsentrasi asam askorbat pada jenis klon tanaman yang terkena KASparsial menunjukan perbedaan yang nyata terhadap peubah amatan produktivitas3,5 dan 7 tetapi belum berbeda nyata terhadap peubah amatan produktivitas1dan2.
kerusakan-kerusakan yang terjadi. Radikal bebas merupakan atom atau melekul yang memiliki satu atau lebih elektron yang tidak berpasangan. Radikal bebas dianggap pasangan elektronnya. Radikal bebas dapat bereaksi dengan molekul sel tubuh dengan cara mengikat elektron dari melekul sel tersebut dan dapat menyebabkan reaksi berantai yang merusak tubuh.
KESIMPULAN DAN SARAN Kesimpulan
1. Ada pengaruh asam askorbat dengan konsentrasi 150 ppm dalam penyembuhan kering alur sadap parsial pada tanaman karet klon PB 260 dan IRR 42
2. Aplikasi asam askorbat menunjukkan perbedaan yang nyata pada produktivitas tanaman karet klon PB 260
3. Aplikasi asam askorbat pada tanaman karet klon PB 256 dan IRR 42 dapat memperbaiki keadaan fisiologis dan meningkatkan aktifitas enzim SOD
Saran
TINJAUAN PUSTAKA Botani Tanaman
MenurutSteeniset al., (2005) kedudukan tanaman karet dalam tatanama (sistematika) sebagai berikut: Kingdom: Plantae, Divisio: Spermatophyta, Sub-diivisio: Angiospermae, Kelas: Dicotyledoneae, Ordo: Euphorbiales, Famili: Euphorbiaceae, Genus:Hevea, Spesies : Hevea brassiliensis Muell. Arg.
Akar tanaman karet merupakan akar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi ke atas, dengan akar seperti itu pohon karet dapat berdiri kokoh, meskipun tingginya mencapai 25 meter (Setiawan danAndoko, 2005).
Karet merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa mencapai 15-25 meter. Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang tinggi. Dibeberapa kebun karet ada kecondongan arah tumbuh tanamanya agak miring ke arah utara. Batang tanaman ini mengandung getah yang dikenal dengan nama lateks (Nugroho, 2010).
Daun karet berselang-seling, tangkai daunnya panjang, terdiri dari 3 anak daun yang licin berkilat. Petiola tipis, hijau, panjang 3,5-30 cm. Helaian anak daun bertangkai pendek dan berbentuk lonjong-oblong atau oblong-obovate, pangkal sempit dan tegang, ujung runcing; sisi atas daun hijau tua dan sisi bawah agak cerah, panjangnya 5-35 cm dan lebar 2,5-12,5 cm (Sianturi, 2001).
mengandung bakal buah yang beruang tiga. Kepala putik yang akan dibuahi dalam posisi duduk juga berjumlah tiga buah. Bunga jantan mempunyai sepuluh benang sari yang tersusun menjadi suatu tiang. Kepala sari terbagi dalam dua karangan, tersusun sembilan satu lebih tinggi dari yang lain. Paling ujung adalah suatu bakal buah yang tidak tumbuh sempurna (Maryani, 2007).
Karet merupakan buah berpolong (diselaputi kulit yang keras) yang sewaktu masih muda buah berpaut erat dengan rantingnya.Buah karet dilapisi oleh kulit tipis berwarna hijau dan didalamnya terdapat kulit yang keras dan berkotak.Tiap kotak berisi sebuah biji yang dilapisi tempurung, setelah tua warna kulit buah berubah menjadi keabu-abuan dan kemudian mengering.Pada waktunya pecah dan jatuh, tiap ruas tersusun atas 2-4 kotak biji.Pada umumnya berisi tiga kotak biji dimana setiap kotak terdapat satu biji.Biji karet terdapat dalam setiap ruang buah.Jumlah biji biasanya ada tiga kadang empat(Budiman, 2012).
Buah beruang tiga, jarang yang beruang 4 hingga 6, diameter buah 3-5 cm dan terpisah 3,4,6. Coci berkatupdua, pericarp berbentuk endokarp berkayu. Biji besar, bulat persegi empat, tertekan pada satu atau dua sisinya, berkilat berwarna coklat muda, dengan noda noda coklat tua, panjang2-3,5 dan tebal 1,5-2,5 cm (Sianturi, 2001).
Syarat Tumbuh Iklim
haripertahun. Pada daerah yang sering hujan pada pagi hari akan mempengaruhi kegiatan penyadapan bahkan akan mengurangi hasil produktifitasnya. Keadaan daerah yang cocok untuk tanaman karet adalah daerah-daerah Indonesia bagian barat, yaitu Sumatera, Jawa dan Kalimatan, sebab iklimnya lebih basah (Budiman, 2012).
Tanaman karet memerlukan curah hujan optimal antara 2.500 mm sampai 4.000 mm/tahun,dengan hari hujan berkisar antara 100 sd. 150 hari kerja/tahun. Namun demikian, jika sering hujan pada pagi hari, produksi akan berkurang(Anwar, 2001).
Kelembaban nisbi (RH) yang sesuai untuk tanaman karet adalah rata - rata berkisar antara 75% - 90%.Kelembapan yang terlalu tinggi tidak baik untuk pertumbuhan karet, karena dapat membuat laju aliran transpirasi tanaman karet menjadi kecil sehingga absorbsi unsur hara dari tanah menjadi lambat. Selain itu tanaman sering mengalami gutasi dan terjadi kelelahan lateks akibat retakan kulit. Angin yang bertiup kencang dapat mengakibatkan patah batang, cabang atau tumbang. Angin kencang pada musim kemarau sangat berbahaya, laju evapotranspirasi menjadi besar (Sianturi, 2001).
Tanah
tanah berkisar antara pH 3,0 - pH 8,0 tetapi tidak sesuai pada pH < 3,0 dan pH > 8,0 (Anwar, 2001).
Tanaman karet bukanlah tanaman manja, dapat tumbuh pada tanah- tanahyang mempunyai sifat fisik baik, atau sifat fisiknya dapat diperbaiki. Tanah yang dikehendaki adalah bersolum dalam, kedalaman lapisan padas lebih dari 1 m, pemukaan air tanah rendah yaitu ± 10 – 20 cm. Sangat toleran terhadap kemasaman tanah, dapat tumbuh pada pH 3,8 hingga 8,0, tetapi pada pH yang lebih tinggi sangat menekan pertumbuhan (Sianturi, 2001).
Klon Tanaman Karet
Untuk meningkatkan produktivitas perkebunan karet rakyat, pemerintah telahmenempuh berbagai upaya antara lain perluasan tanaman, penyuluhan, intensifikasi, rehabilitasi dan peremajaan serta penyebaran klon – klon unggul benih karet. Dalammenunjang keberhasilan peningkatan produktivitas perkebunan karet, telah dilakukanusaha khususnya terhadap benih karet(Syukur, 2013).
Rekomendasi klon-klon karet untuk periode tahun 2010- 2014 berdasarkan hasil rumusan Lokakarya Nasional Pemuliaan Tanaman Karet Tahun 2009, yaitu sebagai berikut: Klon Anjuran Komersial a.) klon penghasil lateks terdiri: IRR 104, IRR 112, IRR 118, IRR 220, BPM 24, PB 260, PB 330, dan PB 340;b.) klon penghasil lateks-kayu terdiri: IRR 5, IRR 39, IRR 42, IRR 107,dan RRIC 100 (Peraturan Menteri Pertanian Republik Indonesia, 2013).
Potensi Klon PB260 penghasil lateks pertumbuhan jagur resisten : Corynespora Colletotrichum &Oidium. Produksi Lateks: 2.2-3.5 ton/ha/th. Warna
Klon dari jenis IRR ini terdiri dari klon penghasil lateks (IRR 104), lateks-kayu(IRR 5, IRR 32, IRR 39, IRR 42, IRR 107, IRR 112, dan IRR 118), dan penghasil kayu (IRR 70, IRR 71, dan IRR 72). Klon IRR termasuk dalam klon anjuran yang diharapkan dapat menjadi salah satu solusi untuk meningkatkan produktivitas tanaman karet yang ada di Indonesia. Klon IRR memiliki potensi produksi mencapai 2,9 – 3,2 ton karet kering per ha per tahun, sehingga sangat potensial untuk dijadikan sebagai batang atas (Marchinoet al., 2010).
Pada umumnya klon yang berproduksi tinggi tanpa stimulasi mempunyai kadar Pi tinggi dan sukrosa rendah, yang menunjukkan aktifitas metabolisme yang tinggi. Sebaliknya, kadar Pi rendah dan sukrosa tinggi pada klon berproduksi
rendah, yang menunjukkan rendahnya aktifitas metabolisme lateks (Lacote, 2007).
Thiol (R-SH) berfungsi sebagai antioksidan, sehingga stres oksidatif sebagai akibat aktifnya metabolisme dalam sel dapat ditekan.Kadar R-SH yang rendah menunjukkan terlalu intensifnya eksploitasi sehingga perlu dikurangi dengan menurunkan intensitas sadapan maupun stimulasi (Gohet et al.,1996). Kering Alur Sadap (KAS)
cokelat karena pada bagian ini terbentuk gum (blendok). Kekeringan kulit tersebut dapat meluas ke kulit lainnya yang seumur, tetapi tidak meluas dari kulit perawan ke kulit pulihan atau sebaliknya. Gejala lain yang ditimbulkan penyakit iniadalah terjadinya pecah-pecah pada kulit dan pembengkakan atau tonjolan pada batang tanaman (Anwar,2001).
Sel pembuluh lateks mengalami penyumbatan dan menjadi sel tilosoid. Sel tilosoid ini melebar ke arah sel sel tetangga dan meluas sehingga jaringan tilosoidpun berbentuk. Bidang sadap yang memiliki jaringan tilosoid ini bila disadap pada awalnya akan mengalami kekeringan alur sadap sebagian (KAS parsial), kemudian meluas dan dikenal sebagai KAS total (Tistamaet al., 2006).
Kejadian KAS menurut Abraham et al, (2006), diklasifikasikan menjadi tanaman tidak terserang KAS (0%), rendah (0-25%), sedang (25-50%), tinggi (50-75%), dan sangat tinggi (>75%). Klasifikasi tersebut digunakan untuk mengetahui luas kejadian KAS dibidang panel sadapan. Persentase kejadian KAS dapat diperoleh dari perbandingan panjang luas yang tidak mengeluarkan lateks dengan total panjang keseluruhan bidang sadap dikalikan 100%.
penyebaran sel-sel tilosoid bilatidak diidentifikasi sejak dini maka dapatdipastikan tanaman beberapa tahunselanjutnya tidak dapat mengeluarkan lateks saat disadap (Andriyanto dan Tistama, 2014).
Gambar 1. Pola penyerangan jaringan Tilasoid penyebab KAS Sumber : Andriyanto dan Tistama(2014)
Kering alur sadap dapat menyebar dengan cepat dalam angka waktu 2-4 bulan keseluruh kulit bidang sadap. Penyebaran KAS diduga mengikuti alur pembuluh lateks dan arah sadap. Proses penyebaran KAS pada bidang sadap BO-1 mengarah keseluruh BO-BO-1 dibawah irisan sadap. Penyebaran berikutnya menyebar ke bidang panel BO-2 dibagian bawah yang dilanjutkan ke bagian atas hingga bertemu mencapai HO-1. Pola penyebaran KAS di B1-1 hingga B1-2 kulit juga sama. Proses penyebaran yang cepat disebabkan oleh kecepatan terbentuknya tilasoid lebih tinggi dibandingkan dengan irisan sadap pada sadapan selanjutnya (Sumarmadji, 2005).
Kejadian KAS banyak terjadi di perkebunan karet akibat penerapan sistem eksploitasi yang tidak tepat. Fakta yang sering kali ditemukan di lapangan yaitu praktisi kebun tidak membedakan konsentrasi dan interval aplikasi stimulan untuk klon quick starter maupun klon slow starter, pemberian stimulan saat musim gugur daun ,banyak terdapat luka kayu, dan konsumsi kulit yang boros(Jacob and Krishnakumar, 2006).
Deteksi dini dampak intensitas exploitasi terhadap tanaman karet dapat dilakukan dengan analisis fisiologi berupa ukrosa, Pi (fosfat anorganik) dan thiol. Status ketiga unsur tersebut dapat digunakan untuk menilai kondisi keletihan fisiologis tanaman. Titik kritis status ketiga unsur tersebut sangat tergantung kepada klon, unsur dan dinamika fisiologis tanaman atau variasi musiman. Secara umum dapat digambarkan bahwa titik kritis untuk sukrosa < 4 mM, untuk Pi>25 mM dan untuk thiol < 0,4Mm. Dalam penilaian ini biasanya masih membutuhkan peubah-peubah yang lain seperti produksi g/p/s, kadar karet kering dan sebagainya. Namun cara ini dapat secara preventif mengatasi terjadinya KAS. Beberapa perkebunan menerapkan analisis lateks setahun sekali untuk menetapkan sistem sadap tahun berikutnya (Tistamaet al., 2006).
Gangguan fisiologis pada tanaman karet yaitu sebagian atau seluruh alur sadapnya kering dan tidak mengalir lateks, atau bisa disebut brown bast (BB) atau tapping dryness (TPD) atau kering alur sadap (KAS) dan sebagian petani pekebun ada yang menyebut mati kulit, diduga disebabkan oleh terjadinya ketidakseimbangan antara lateks yang terambil dan lateks yang terbentuk. Ketidakseimbangan tersebut di yakini antara lain disebabkan karena gangguan stimulanyang tidak mengikuti anjuran. Akibatnya antara lain menurunnya kemampuan pohon untuk memproduksi lateks (Arief dan Island, 2006).
hamabatan biosintesis karet sehingga sukrosa tidak dimanfaatkan dalam proses tersebut sehingga terjadi penumpukan(Tistama et al, 2006).
Kering Alur Sadap (KAS) mengakibatkan berkurangnya jumlah sel-sel latisifer yang terdapat dalam jaringanfloem. Sel-sel latisifer merupakan buluh getah yangmengalirkan lateks pada alur sadap. Selain itu KAS juga mengakibatkan koagulasi cairan lateks dengan waktu yang singkat sehingga dapat mengakibatkan penurunan produksi lateks yang diikuti oleh terjadinya degradasi sel-sel lateks yang masih baru terbentuk (Deka et al., 2006).
Munculnya KAS dipicu oleh ketidakseimbangan antara regenerasi lateks di dalam pembuluh lateks dengan pengambilannya melalui penyadapan.Tuntutan produksi yang cukup tinggi seringkali mendorong praktisi kebun melakukan penyadapan berlebihan melebihi kemampuan tanaman meregenerasi lateks. Upaya mencapai target produksi kebun pada umumnya dilakukan dengan meningkatkan jumlah ataupun frekuensi pemberian stimulan. frekuensi pemberian stimulan yang tidaksesuai dengan rekomendasi dapat menyebabkan gangguan fisiologis pada
tanaman karet sehingga dapat mengganggu biosintesis lateks (Budiman dan Boerhendhy, 2006).
cendrung menurun jika tanaman dieksploitasi dengan sistem sadap yang lebih intensif (Krisnakumar et al.,2001).
Komponen fisiologis lateks lainnya adalah thiol. Thiol (R-SH) berperan dalam mengaktifkan beberapa enzim yang berhubungan dengan cekaman lingkungan. Status thiol berhubungan pada saat mendapat tekanan sistem ekploitasi. Semakin tinggi intensitas eksploitasi semakin rendah status thiol dalam lateks. Pada tanaman yang mengalami KAS status thiolnya lebih rendah dibandingkan dengan tanaman sehat. Kemungkinan jaringan kulit mengalamiproses keletihan yang dapat diikuti dengan kematian secara parsial sel-sel pembuluh lateks (Tistama et al., 2006).
Reactive Oxygen Species(ROS)
Radikal bebas dibentuk oleh metabolisme xenobiot atau metabolismesel aerob secara normal. Reactive oxygen species (ROS) adalah radikal bebas yang berperan penting pada beberapa proses fisiologis organ tubuh. Pembentukan ROS dapat menginduksi peroksidasi lipid yang bersifat sitotoksik akibat inisiasi suatu reaksi rantai kedalam membran, diikuti reaksi propagasi sehingga secara keseluruhan akan mengakibatkan kerusakan sel(Astutiet al., 2009).
Dalam kondisilabil, molekulROSmengikat berbagaimekanisme pertahananantioksidan.Kesetimbangan
antaraproduksidanpengikatanROSmungkintergangguoleh berbagai faktorstresbiotikdan abiotikseperti salinitas,radiasi UV, kekeringan, logam
reaktifdanberacundan penyebabkerusakanprotein, lipid, karbohidrat, DNAyang akhirnya menghasilkankematian sel (Sarvajeet dan Narendra, 2010).
Reactive oxygen species (ROS) merupakan oksidan yang sangat reaktif
dan mempunyai aktivitas yang berbeda. Dampak negatif senyawa tersebut timbul karena aktivitasnya, sehingga dapat merusak komponen sel yang sangat penting untuk mempertahankan integritas sel. Setiap ROS yang terbentukdapat memulai suatu reaksi berantai yang terus berlanjut sampai ROS itu dihilangkan oleh ROS yang lain atau sistem antioksidannya (Maslachah et al., 2008).
Reactive oxygen species (ROS) secara alami dihasilkan didalam
metabolisme tanaman. Selama stress biotik dan abiotik, ROS tersebut terakumulasi di dalam jaringan jauh lebih cepat dibandingkan dengan reaksi yang dapat menghilangkan ROS tersebut. Detoksifiasi ROS melalui SOD peroksidase dan katalase secara enzimatik maupun melalui mekanisme non enzimatik lainnya mampu menghilangkan ROS dari jaringan tanpa menimbulkan kerusakan. Oleh karena peroksidase dan katalase memiliki peranan utama didalam proses penghilangan molekul H2O2 didalam jaringan biologis(Gebelin et al., 2013).
Fungsi enzim yang berbeda-beda dalammenghadapi ROS mengakibatkan tingkatekspresi gen responsif terhadap ROS beragampada berbagai perlakuan. Seperti telahdisebutkan sebelumnya bahwa tingkat cekamanoksidatif dapat ditentukan dari jumlah ROSseperti superoksida, peroksida, dan radikalhidroksil. Oleh karena itu,keseimbangan aktifitas enzim SOD, APX, dankatalase sangat penting untuk menekan leveltoksisitas ROS di dalam sel. Saat aktifitaskatalase
rendah di tanaman, aktifitas enzimlain, yaitu APX akan meningkat(Arlyny,
Asam Askorbat
Vitamin C dalam tubuh aktif dalam 2 bentuk yaitu asam askorbat dan dehidroaskorbic acid (DHA). Vitamin C dalam bentuk asam askorbat berperan
sebagai scavenger radikal bebas, selain itu juga mampu menghambat pembentukan radikal bebas, sedangkan dalam bentuk DHA akan menghambat secara langsung aktifasi nuclear factorkappabeta (NF-kB) faktor transkripsi inflamasi. Beberapa penelitian melaporkan bahwa vitamin C lebih efektif
dibandingkan dengan α-tokoferol dalam mengurangi proses patofisiologi akibat
stres oksidatif seperti aterosklerosis, karena vitamin C mempunyai kemampuan menangkap oksigen dan nitrogen reaktif secara efektif, dan vitamin ini
mempunyai kemampuan untuk regenerasi α-tokoferol sehingga avaibilitas vitamin
α-tokoferol ini dalam tubuh tetap terjaga.Setelah bereaksi dengan radikal
bebas,vitamin C pun akan menjadi produk radikal, namun karena degradasinya sangat singkat (10-5 detik) sehingga ia tidak reaktif, salah satu alasan vitamin C disukai sebagai antioksidan (Julahir, 2010).
Antioksidan merupakan senyawa yang mampu menghambat laju oksidasi. Antioksidan ini memiliki banyak komponen dan merupakan zat alami yang dihasilkan sendiri oleh tubuh atau didapat dari makanan yang kita makan. Antioksidan bekerja dengan cara menghentikan pembentukan radikal bebas, menetralisir serta memperbaiki kerusakan-kerusakan yang terjadi. Radikal bebas merupakan atom atau melekul yang memiliki satu atau lebih elektron yang tidak berpasangan. Radikal bebas dianggap pasangan elektronnya.Radikal bebas dapat bereaksi dengan molekul sel tubuh dengan cara mengikat elektron dari melekulsel tersebut dan dapat menyebabkanreaksi berantai yang merusak tubuh (Ardianti et al., 214).
Selain antioksidan tersebut, sumber-sumber antioksidan eksogen yang berasal dari makanan sehari-hari juga diperlukan untuk meminimalkan stres oksidatif, sepertivitamin-vitamin (vitamin C, vitamin E, ß–karoten), dan senyawa fitokimia (karotenoid, isoflavon, saponin, polifenol).Vitamin C merupakan vitamin larut dalam air, secara tunggal dapat menghambat proses oksidasi LDL.Vitamin C bekerja bersama-sama dengan vitamin E dalam menghambat reaksi oksidasi. VitaminC mengikat vitamin E radikal yang terbentuk pada proses pemutusan reaksi radikal bebas oleh vitamin E, menjadi vitamin E bebas yang berfungsi kembali sebagai antioksidan. Vitamin E merupakan vitamin larut dalam lemak, dapat memutuskanreaksi radikal bebas pada jaringan dan merupakan antioksidan yang dominan dalampartikel LDL (Sulistyowati, 2006).
PENDAHULUAN Latar Belakang
Hevea brasiliensis atau dikenal umum sebagai pohon karet merupakan
sumber utama karet alam. Pohon ini dibudidayakan dalam skala komersial besar di beberapa negara di daerah tropis sebesar 9,4 juta ha di seluruh dunia. Selain dari lateks, pohon karet juga telah dimanfaatkan untuk kayu untuk pembuatan mebel dan bijinya dibuat minyak biji karet yang digunakan untuk pembuatan sabun, cat, pernis, pupuk dan pakan ternak. Eksploitasi dari komponen lain dari pohon-pohon karet inilah yang memberikan nilai tambah lebih lanjut untuk penanaman pohon karet (Karintus, 2011).
Produksi karet alam dunia pada tahun 2020 diperkirakan mencapai 11,5 juta ton. Sebagai negara produsen karet alam terbesar kedua setelah Thailand, Indonesia ditargetkan dapat memasok 3,3 juta ton (29%) untuk mengisi pangsa pasar tersebut. Guna mencapai target tersebut, Direktorat Jenderal Perkebunan menerapkan kebijakan peningkatan produksi karet melalui perluasan dan peremajaan kebun maupun rehabilitasi tanaman dengan menggunakan bibit unggul.Pembangunan perkebunan karet juga berperan penting dalam pelestari lingkungan dan mendorong pertumbuhan sentra-sentra ekonomi baru diwilayah pengembangan (Island dan Dwi, 2013).
kemajuan seperti ini menyebabkan para konsumen mulai berpaling lagi ke karet alam (Damanik, 2012).
Karet (termasuk karet alam) merupakan kebutuhan yang vital bagikehidupan manusia sehari-hari, hal ini terkait dengan mobilitas manusia dan barang yang memerlukan komponen yang terbuat dari karet seperti ban kendaraan, conveyor belt, sabuk transmisi, dock fender, sepatu dan sandal karet. Kebutuhan karet alam maupun karet sintetik terus meningkat sejalan dengan meningkatnya standar hidup manusia. Kebutuhan karet sintetik relatiflebih mudah dipenuhi karena sumber bahan baku relatif tersedia walaupun harganya mahal, akan tetapi karet alam dikonsumsi sebagai bahan baku industri,tetapi diproduksi sebagai komoditi perkebunan (Anwar, 2001).
Seperti pada tanaman lain, berbagai kondisi fisiologis tanaman dan penyakit patogen mempengaruhi produksi karet alam. Kering Alur Sadap (KAS) atau tapping panel dryness (TPD) merupakan kejadian tanaman karet yang tidak menghasilkan atau mengalirkan lateks. Karena pengurasan yang begitu intensif, maka kemampuan tanaman meregenerasi lateks termasuk di dalamnya bahan-bahan organik menjadi tidak seimbang. Kondisi tanaman yang demikian disebut kelelahan fisiologis (physiological fatigue), dimana merupakan awal dari kejadian Kering Alur Sadap (KAS) (Tistama, 2013).
Kering Alur Sadap (KAS) adalah salah satu ancaman paling serius
terhadap produksi karet alam yang diperkirakan memberikan kontribusi 15% - 20% hilangnya produksi.Sementara pada tanaman produktif, kehilangan
berhentinyaaliran lateks (kulit kering) dan pengurangan bidang penyadapan(Jacob danKrishnakumar, 2006).
Penyakit kering alur sadap (KAS) sering dijumpai pada karet unggul PB260 yang disadap berlebihan, terutama apalagi jika disertai dengan penggunaan ethepon atau ethrel (obat perangsang lateks) yang tidak sesuai anjuran. Penyakit
KAS tidak menyebabkan kematian pada tanaman karet, namun lateks atau getah yang dihasilkan menjadi berkurang(Janudianto et al., 2013).
Penyadapan dan stimulasi etefon direspons oleh tanaman karet sebagai cekaman bagi kehidupannya. Cekaman lingkungan akan menyebabkan akumulasi reactive oxygen species (ROS) yang dapat menghancurkan makromolekul
penyusun membran organel atau sel. Kerusakan membran tersebut akan memicu kematian sel. Untuk mengatasi cekaman tersebut, tanaman karet meningkatkan aktivitas enzim askorbat peroksidase (APX; EC 1.11.1.9). Enzim tersebut berperan dalam detoksifikasi ROS invivo, dan berperan dalam ketahanan terhadap cekaman atau mengatur lamanya aliran lateks. Beberapa enzim yang berperan dalam detoksifikasi ROS antara lain, Mangan superoksida dismutase (MnSOD), Zn-Cu Superoksida dismutase (Zn-CuSOD), Glioksilatkarboligase kloroplastik (GCLkloroplastik),Glioksilatkarboligase sitosolik (GCLsitosolik), dan
katalase(Arlyny, 2008).