RESPONS IMUN DAN KINERJA PERTUMBUHAN IKAN LELE PADA BUDIDAYA SISTEM BIOFLOK DENGAN SUMBER KARBON BERBEDA
SERTA DIINFEKSI Aeromonas hydrophila
WINDU SUKENDAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul: Respons Imun dan Kinerja Pertumbuhan Ikan Lele pada Budidaya Sistem Bioflok dengan Sumber Karbon Berbeda serta Diinfeksi Aeromonas hydrophila adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
WINDU SUKENDAR. Respons Imun dan Kinerja Pertumbuhan Ikan Lele pada Budidaya Sistem Bioflok dengan Sumber Karbon Berbeda serta Diinfeksi Aeromonas hydrophila. Dibimbing oleh WIDANARNI dan MIA SETIAWATI.
Penyakit bakterial yang sering menyerang ikan lele adalah motile aeromonad septicaemia (MAS) yang disebabkan oleh bakteri Aeromonas hydrophila. Salah satu alternatif untuk mencegah infeksi bakteri A. hydrophila pada budidaya ikan lele adalah dengan menerapkan budidaya dengan teknologi bioflok (TBF). Bioflok yang terbentuk diduga dapat mengontrol bakteri patogen pada kolam budidaya dan sebagai pakan alami yang dapat meningkatkan sistem imun pada ikan. Teknologi ini didasarkan pada konversi amonia oleh bakteri heterotrof menjadi biomassa mikroba (flok) yang dapat dikonsumsi oleh ikan melalui penambahan sumber karbon. Penelitian ini bertujuan untuk mengevaluasi respons imun dan kinerja pertumbuhan ikan lele yang dipelihara dalam sistem bioflok dengan sumber karbon berbeda serta diinfeksi bakteri A. hydrophila.
Penelitian ini menggunakan rancangan acak lengkap, terdiri atas 5 perlakuan dan 3 ulangan yaitu TBF dengan penambahansumber karbon molase, tapioka, terigu dengan diinfeksi A. hydrophila, kontrol positif (tanpa TBF dan diinfeksi A. hydrophila) dan kontrol negatif (tanpa TBF dan tanpa diinfeksi A. hydrophila). Ikan lele (ukuran 4-5 cm) dipelihara selama 30 hari dalam akuarium (60x30x35 cm3) dengan kepadatan 180 ekor/akuarium. Setelah ikan ditebar, bakteri patogen A. hydrophila dengan kepadatan 103 sel mL-1 ditambahkan ke dalam media pemeliharaan untuk semua perlakuan kecuali kontrol negatif. Ikan diberi pakan komersil dengan kandungan protein 34,54% sebanyak dua kali sehari secara at satiation. Penambahan karbon dilakukan setiap hari yaitu 2 jam setelah pemberian pakan dengan estimasi C/N rasio 15. Pada perlakuan dengan penambahan sumber karbon berbeda ditambahkan juga bakteri Bacillus NP5 dengan kepadatan 104 setiap tujuh hari sekali. Parameter yang diuji antara lain penghitungan kelimpahan bakteri di air meliputi total bakteri, total Bacillus NP5 dan A. hydrophila, parameter kualitas air meliputi suhu, pH, oksigen terlarut, kekeruhan, TAN, nitrit dan volume flok, parameter respons imun meliputi kadar hematokrit, kadar hemoglobin, total eritrosit dan total leukosit, aktivitas fagositik, aktivitas respiratory burst, clearances efficiency, serta total A. hydrophila di organ target hati dan ginjal. Sedangkan parameter pertumbuhan meliputi survival, laju pertumbuhan harian, feed convertion ratio, jumlah konsumsi pakan, retensi protein dan retensi lemak, kelimpahan total bakteri dan Bacillus NP5 di usus.
hydrophila di organ hati dan ginjal. Kinerja pertumbuhan ikan lele meningkat pada pemeliharaan dengan sistem bioflok dengan sumber karbon berbeda yaitu kelangsungan hidup antara 82,78-89,44%, laju pertumbuhan harian 5,64-5,96%, rasio konversi pakan 0,49-0,53, retensi protein 56,99-59,67% dan retensi lemak 88,29-100,19%. Penambahan sumber karbon molase, tapioka dan terigu pada sistem bioflok dapat meningkatkan respons imun dan performa pertumbuhan ikan lele (p<0,05).
SUMMARY
WINDU SUKENDAR. Immune Response and Growth Performance of Catfish in Biofloc System with Different Carbon Sources which Infected by Aeromonas hydrophila. Supervised by WIDANARNI and MIA SETIAWATI.
Motile aeromonad septicemia (MAS) is bacterial disease that commonly infected catfish cause by Aeromonas hydrophila. One alternative way to prevent bacterial infection of A. hydrophila on catfish farming is using biofloc technology (BFT). Bioflocs formed are presumed to help control pathogen bacteria in culture ponds and its role as live feed that boost fish immune system. This technology is based on the conversion of ammonia into microbial biomass (floc) by heterotrophic bacteria that can be consumed by the fish through the addition of carbon source. This study was aimed to evaluate the immune response and growth performance of catfish reared in biofloc system with different carbon sources after infected by A. hydrophila bacteria.
This study was conducted using completely randomized design, consist of 5 treatments with different carbon sources and 3 replications. The differences among all treatments of BFT were the immersion of pathogenic bacteria and molasses, tapioca, wheat all treatment were infected with A. hydrophila, positive control (without BFT and infected with A. hydrophila) and negative control (without BFT and
not
infected with A. hydrophila) each treatment were 3 replications. Catfish (size 4-5 cm) were reared for 30 days in 15 aquarium (60×30×35 cm3) with density 180 fish/aquarium. After fish were stocked, 103 cells mL-1 of A. hydrophila was added into the rearing except for negative control. The fish were fed with commercial feed 34.54% protein, twice a day at satiation. The addition of carbon performed every day with estimated C/N ratio was 15, 2 hours after feeding. In molasses, tapioca and wheat treatments, 104 cells mL-1 NP5 Bacillus was also added every seven days. The observed parameters; the amount of bacteria abundance in water includes total bacteria, total of NP5 Bacillus and A. hydrophila, water quality, hematocrit, hemoglobin levels, total erythrocytes, total leukocytes, phagocytic activity, respiratory burst activity, clearances efficiency, observation of total bacteria abundance and NP5 Bacillus in intestines, total A. hydrophila in organs target liver and kidney, floc volume, survival rate, daily growth rate, feed convertion ratio, feed intake, protein retention and fat retention.89.44%, daily growth rate range from 5.64 to 5.96%, feed conversion ratio range from 0.49 to 0.53, protein retention from 56.99 to 59.67% and fat retention from 88.29 to 100.19%. The addition of carbon sources; molasses, tapioca and wheat in biofloc system could improved the immune response and growth performances of catfish.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
RESPONS IMUN DAN KINERJA PERTUMBUHAN IKAN LELE PADA BUDIDAYA SISTEM BIOFLOK DENGAN SUMBER KARBON BERBEDA
SERTA DIINFEKSI Aeromonas hydrophila.
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT, karena atas limpahan rahmat dan karunia-Nya sehingga penyusunan tesis dengan judul ” Respons Imun dan Kinerja Pertumbuhan Ikan Lele pada Budidaya Sistem Bioflok dengan Sumber Karbon Berbeda serta Diinfeksi Aeromonas hydrophila” sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada Program Studi Ilmu Akuakultur Sekolah Pascasarjana Institut Pertanian Bogor telah berhasil diselesaikan.
Terima kasih kepada semua pihak yang telah memberikan bantuan baik moral maupun materil, utamanya kepada :
1. Dr Ir Widanarni, MSi dan Dr Ir Mia Setiawati, MSi, sebagai komisi pembimbing, atas curahan waktu, perhatian, motivasi dan pikiran mengantarkan penelitian penulis hingga selesai. Kepada Ibu Dr Ir Iis Diatin, MM sebagai dosen penguji luar komisi dan Ibu Dr Dinamella Wahjuningrum, SSi MSi sebagai wakil dari komisi program studi yang telah memberikan saran dalam ujian sidang tesis ini.
2. Terima kasih yang tak terhingga kepada ayahanda Arsid dan ibunda Budiyanti yang telah membesarkan penulis, kakakku dan adik-adikku serta keluarga besarku atas segala doa, dukungan dan kasih sayangnya.
3. Pak Ranta atas segala bantuan selama analisis di Laboratorium Kesehatan Ikan serta dorongan semangat yang diberikan kepada penulis sehingga penelitian ini bisa selesai.
4. Teman-teman akuakultur 2013 Dendi Hidayatullah, Shavika Miranti, Haezy Satriani, Rifki Tamamdusturi, Lukman Anugrah Agung, Dwi Febrianti, Asep Akmal Anoullah, Erni Susanti, Sekar Ayu Khairunnisa, Ati Yunarti, Ardyen Saputra, Ika Wahyuni Putri, Teuku Muhammad Haja Almuqaramah, Radi Fadhila, Didi Humaedi Yusuf, Suhaiba Djai, Wiwik Hildayanti, Muhammad Herjayanto, Ita Apriyani, Nur Hikmah Mahasu, Andre Rachmat Scabra, Hasrah, Tuti Puji Lestari, Rudiansyah, Sophia NM, Aisyah Lukmini serta teman-teman yang tidak bisa disebut satu persatu atas segala bantuan dan dorongan semangat yang diberikan kepada penulis sehingga penelitian ini selesai.
5. Adik-adik BDP 48 khususnya anggota Laboratorium Kesehatan Ikan atas segala bantuan yang diberikan kepada penulis sehingga penelitian ini selesai.
Semoga hasil penelitian ini dapat berguna bagi kemajuan ilmu pengetahuan dan bermanfaat bagi semua pihak, khususnya kepada penulis.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 METODE 3
Waktu dan Tempat Penelitian 3
Desain Eksperimen dan Kondisi Pemeliharaan 3
Penambahan Sumber Karbon 4
Parameter Uji 4
Analisis statistik 10
3 HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 17
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
5 DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1. Total bakteri, Bacillus NP5 dan Aeromonas hydrophila di air pemeliharaan ikan lele Clarias sp. yang dibudidayakan pada sistem bioflok dengan sumber karbon berbeda serta diinfeksi A. hydrophila. 11 2. Parameter kualitas air media pemeliharaan ikan lele Clarias sp. selama
pemeliharaan dengan sistem bioflok. 12
3. Total eritrosit (TE), kadar hematokrit (Hc), kadar hemoglobin (Hb), total leukosit (TL), aktivitas fagositik (AF) dan respiratory burst (RB) pada ikan lele Clarias sp. yang dipelihara pada sistem bioflok dengan sumber
karbon berbeda serta diinfeksi A. hydrophila. 14
4. Tingkat kelangsungan hidup, kinerja pertumbuhan dan total bakteri di usus ikan lele Clarias sp. yang dibudidayakan pada sistem bioflok dengan sumber karbon berbeda serta diinfeksi A. hydrophila. 16
DAFTAR GAMBAR
1. Nilai total amonia nitrogen dalam media pemeliharaan ikan lele selama 30 hari. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan
tidak diinfeksi A. hydrophila. 12
2. Nilai nitrit dalam media pemeliharaan ikan lele selama 30 hari. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A.
hydrophila. 13
3. Volume flok di media pemeliharaan ikan lele selama 30 hari. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A.
hydrophila. 13
4. Clearances efficiency plasma darah ikan uji selama pemeliharaan. Huruf superscript yang berbeda ditiap bar menunjukkan perbedaan secara statistik (Uji jarak berganda Tuckey; p<0,05). A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A.
5. Total A. hydrophila di hati (a) dan di ginjal (b) ikan lele Clarias sp. yang dibudidayakan pada sistem bioflok dengan sumber karbon berbeda serta diinfeksi A. hydrophila. Huruf superscript yang berbeda ditiap bar pada hari yang sama menunjukkan perbedaan secara statistik (Uji jarak berganda Tuckey; p<0,05). A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A. hydrophila. 15
DAFTAR LAMPIRAN
1. Identifikasi Aeromonas hydrophila menggunakan KIT API 20E 25
2. Prosedur analisis proksimat (AOAC 1999) 26
3. Perhitungan jumlah karbon yang ditambahkan ke media pemeliharan
setiap hari 29
4. Gambar ikan yang terserang A. hydrophila (1,2) hemoragi pada tubuh
1
PENDAHULUAN
Latar Belakang
Ikan lele (Clarias sp.) merupakan salah satu jenis ikan air tawar yang banyak dibudidayakan secara komersial oleh masyarakat Indonesia terutama di Pulau Jawa. Pada tahun 2019 Dirjen Perikanan Budidaya menargetkan produksi ikan lele sebesar 1.770.600 ton (DJPB 2015). Upaya untuk memenuhi target produksi ikan lele tersebut maka perlu dilakukan suatu inovasi teknologi dalam budidaya lele, salah satunya adalah melakukan budidaya intensif dengan meningkatkan padat tebar ikan. Sistem ini dinilai memiliki kendala diantaranya akumulasi dari pakan yang tidak termakan, bahan organik dan anorganik yang menjadi limbah serta bersifat toksik pada ikan yang dibudidayakan. Media budidaya yang tercemar oleh limbah dari sisa pakan, ekskresi ikan dan feses menyebabkan ikan stres sehingga mudah terserang penyakit seperti infeksi bakteri, jamur atau virus. Salah satu penyakit yang sering menyerang ikan lele adalah bakteri Aeromonas hydrophila yang menimbulkan penyakit motile aeromonad septicaemia (MAS) (Vivas et al. 2004).
Teknologi bioflok (TBF) merupakan salah satu teknologi yang saat ini sedang dikembangkan dalam akuakultur yang bertujuan untuk memperbaiki kualitas air dan meningkatkan efisiensi pemanfaatan pakan. Teknologi ini didasarkan pada konversi nitrogen anorganik terutama amonia oleh bakteri heterotrof menjadi biomassa mikroba yang kemudian dapat dikonsumsi oleh organisme budidaya (Ekasari 2009). Teknologi ini meminimalkan pergantian air untuk memperbesar biosekuritas dengan memperkecil efek luar terhadap lingkungan budidaya (De Schryver et al. 2008).
2
yang lebih baik dari pada kontrol. Pada penelitian Ekasari et al. (2014), penambahan sumber karbon berbeda (molase, tapioka, onggok dan dedak) pada TBF mampu memberikan efek positif terhadap respons imun udang vannamei yang di uji tantang Infectious Myonecrosis Virus (IMNV).
Menurut Xu dan Pan (2013) bioflok dapat meningkatkan respons imun seluler pada udang (Litopenaeus vannamei) yang ditunjukkan dengan meningkatnya nilai total hemosit dan aktivitas fagositik, serta meningkatkan total antioksidan pada plasma dan hepatopankreas. Crab et al. (2010b) menyatakan bahwa bioflok dapat membantu untuk mengontrol infeksi bakteri Vibrio harveyi pada kolam budidaya dengan menghambat kemampuan quorum sensing (kemampuan bakteri untuk berkomunikasi antar sel-sel yang memungkinkan bakteri untuk berbagi informasi tentang kepadatan sel dan menyesuaikan ekspresi gen), sehingga dapat berperan sebagai agen biokontrol patogen (De Schryver et al. 2008). Pemeliharaan ikan nila pada sistem bioflok juga dapat meningkatkan indeks fagositasnya (Agustinus et al. 2010).
Penggunaan sumber karbon pada TBF selama proses budidaya dari fase pembenihan sampai fase pembesaran akan berpengaruh terhadap C/N rasio yang terdapat pada perairan, pengontrolan nitrogen anorganik yang terdapat pada kolam budidaya, kemampuan bakteri dalam menguraikan bahan yang ada diperaian dan respons imun organisme budidaya. Disamping itu perbedaan sumber karbon akan berpengaruh terhadap komposisi flok dan nutrisi flok. Oleh sebab itu, pemilihan sumber karbohidrat harus dilakukan dengan tepat karena berpengaruh terhadap sistim imun, kualitas air budidaya dan kinerja pertumbuhan organisme.
Rumusan Masalah
3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi respons imun dan kinerja pertumbuhan ikan lele yang dibudidayakan pada sistem bioflok dengan sumber karbon berbeda (molase, terigu dan tapioka) serta diinfeksi A. hydrophila.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai sumber karbon yang dapat digunakan untuk meningkatkan respons imun dan kinerja pertumbuhan ikan lele yang dipelihara pada sistem berbasis teknologi bioflok
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus – November 2015. Pemeliharaan hewan uji, analisis mikroba dan hematologi ikan dilakukan di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, sedangkan analisis proksimat daging ikan dilakukan di Laboratorium Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor.
Desain Eksperimen dan Kondisi Pemeliharaan
Penelitian ini terdiri dari lima perlakuan dengan tiga ulangan, yaitu pemeliharaan ikan pada teknologi bioflok (TBF) dengan penambahan sumber karbon molase (A), tepung tapioka (B), tepung terigu (C) dan diinfeksi bakteri patogen, kontrol positif tanpa menggunakan TBF dan diinfeksi bakteri patogen (D) dan kontrol negatif tanpa menggunakan TBF dan tanpa diinfeksi bakteri patogen (E). Pada TBF digunakan probiotik Bacillus NP5 yang berasal diisolasi dari saluran pencernaan ikan nila (Putra dan Widanarni 2015). Bakteri Bacillus NP5 ini terlebih dahulu diberi penanda resisten antibiotik rifampisin (Bacillus NP5 RifR) dengan menggunakan metode mutasi spontan. Bakteri patogen A. hydrophila yang digunakan merupakan koleksi dari Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Pemberian Bacillus NP5 dilakukan setiap tujuh hari sekali dengan kepadatan 104 sedangkan A. hydrophila hanya dilakukan di awal pemeliharaan dengan kepadatan 103.
4
bakteri, Bacillus NP5 dan A. hydrophila di air dilakukan setiap 10 hari sekali, pengamatan kualitas air dilakukan setiap 15 hari sekali, pengamatan respons imun ikan dilakukan setiap 10 hari sekali, pengamatan kelimpahan bakteri A. hydrophila di organ target dilakukan setiap 15 hari sekali, sedangkan pengamatan clearances efficiency, kinerja pertumbuhan, kelimpahan total bakteri dan isolat Bacillus NP5 di usus dilakukan di akhir penelitian.
Penambahan Sumber Karbon
Penambahan sumber karbon dilakukan setiap hari (2 jam setelah pemberian pakan) dengan estimasi C/N rasio 15. Penambahan jumlah karbon untuk mendukung proses pembentukan flok oleh bakteri heterotrof pada masing-masing perlakuan. Jumlah karbon yang ditambahkan ke dalam media pemeliharaan dihitung menggunakan persamaan De Schryver et al. (2008) (Lampiran 3) berikut:
∆ �= �� � �× % � � × % � ×
% � � ×
Keterangan:
∆CH : Jumlah karbon yang ditambahkan (g) Pakan X : Jumlah pakan yang diberikan perhari (g) %N pakan : Kandungan nitrogen dalam pakan (%)
%N eksresi : Kandungan nitrogen yang dibuang oleh ikan (%) C/N : C/N rasio yang diinginkan (15)
%C organik : Kandungan karbon dalam sumber karbon (%) E : Efisiensi konversi mikroba (%).
Parameter Uji
Total Kelimpahan Bakteri di Air
Perhitungan kelimpahan bakteri di dalam air pemeliharaan ikan meliputi jumlah total bakteri, jumlah bakteri Bacillus NP5 dan jumlah A. hydrophila dilakukan setiap 10 hari dengan cara mengambil sampel dari air pemeliharaan. Kemudian dihitung dengan menggunakan teknik total plate count (TPC) pada media Typticase Soy Agar (TSA) untuk total bakteri, TSA rif untuk Bacillus NP5 sedangkan Rimler-Shotts Medium Base (RS Medium) spesifik buat bakteri A. hydrophila. Setelah itu diinkubasi selama 24 jam kemudian dilakukan perhitungan jumlah koloni yang tumbuh dengan menggunakan rumus (Madigan et al. 2014)
5
Kualitas Air
Parameter kualitas air yang diamati meliputi total amonia nitrogen (TAN), nitrit, pH, suhu, oksigen terlarut dan kekeruhan. Metode pengukuran kualitas air didasarkan pada APHA (1989). Pengukuran kualitas air dilakukan di awal, tengah dan di akhir penelitian.
Volume Flok
Volume flok merupakan representasi dari kepadatan partikel flok dalam suatu kolom air (Avnilemech 2012). Sebanyak 50 mL sampel air diendapkan selama 30 menit dalam tabung conical 50 mL. Volume flok yang mengendap dicatat dan selanjutnya dihitung menggunakan rumus:
Volume flok (mL/L)= Volume endapan
Volume sampel air × 100
Parameter Hematologi
Pengamatan hematologi (gambaran darah) dilakukan pada hari ke 10, 20, dan 30. Sebelum darah ikan diambil, ikan dipingsankan terlebih dahulu menggunakan pembius ikan Ocean free special arowana stabilizer. Darah diambil sebanyak 0,2 mL per ekor ikan menggunakan syringe steril yang sebelumnya dibilas dengan antikoagulan (Na sitrat 3,8%). Sampel darah digunakan untuk pengukuran total sel darah merah (eritrosit), kadar hematokrit (Hc), kadar hemoglobin (Hb), total sel darah putih (leukosit), aktivitas fagositik (AF), respiratory burst (RB) dan clearances efficiency.
Total Eritrosit
Total eritrosit (TE) diukur menggunakan prosedur dari Blaxhall dan Daisley (1973). Sampel darah diambil menggunakan pipet yang berisi bulir berwarna merah sampai skala 0,5, kemudian ditambahkan larutan Hayem’s sampai skala 101, lalu dilakukan pengadukan dengan menggoyangkan pipet selama 3–5 menit
hingga darah dan larutan Hayem’s tercampur rata. Tetesan pertama dibuang dan
6
TE =ΣTE × 1
Vol. kotak×
1 fp
Keterangan :
Σ TE : Jumlah sel eritrosit yang teramati Vol. Kotak : Volume kotak hemasitometer Fp : Faktor pengenceran
Kadar Hematokrit
Kadar Hc diukur dengan mengambil sampel darah menggunakan tabung mikrohematokrit dan disentrifus dengan kecepatan 6000 rpm selama 5 menit. Kadar hematokrit diketahui dengan membandingkan panjang sel darah yang mengendap dengan panjang total volume darah pada tabung mikrohematokrit (Anderson dan Siwicki 1995).
Kadar Hemoglobin (Hb)
Kadar Hb diukur dengan metode Sahli menggunakan sahlinometer (Wedemeyer dan Yasutake 1977). Sampel darah dihisap menggunakan pipet Sahli hingga skala 20 cm3 atau 0,02 mL, kemudian dimasukkan ke dalam tabung Hb-meter yang telah diisi dengan HCl 0,1 N sampai skala 10 (merah), lalu dilakukan pengadukan dan didiamkan selama 3–5 menit. Selanjutnya, akuades dimasukkan ke dalam tabung Hb-meter hingga terjadi perubahan warna seperti warna larutan standar pada Hb-meter. Skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan skala tabung Sahli yang dilihat pada skala jalur g% (kuning) yang berarti banyaknya Hb per 100 mL darah.
Total Leukosit
Pengukuran sel leukosit (TL) dilakukan menurut Blaxhall dan Daisley (1973). Sampel darah diambil menggunakan pipet bulir putih sampai skala 0,5
kemudian ditambahkan larutan Turk’s sampai skala 11, lalu dilakukan
pengadukan dengan menggoyangkan pipet selama 3–5 menit hingga darah dan
larutan Turk’s tercampur rata. Tetesan pertama dibuang dan tetesan berikutnya
7 Vol. Kotak : Volume kotak hemasitometer Fp : Faktor pengenceran
Aktivitas Fagositik
Aktivitas fagositik diukur dengan membuat preparat ulas darah dari sampel darah yang dicampur dengan suspensi bakteri Staphylococcus aureus (107 CFU mL-1) dan diinkubasi selama 20 menit. Preparat ulas dikeringkan, difiksasi dengan metanol selama 5 menit dan dikeringkan kembali, kemudian diwarnai melalui perendaman dalam larutan giemsa selama 20 menit. Preparat ulas diamati menggunakan mikroskop dengan pembesaran 400x untuk mengetahui aktivitas fagositik yang didasarkan pada persentase dari 100 sel fagositik yang menujukkan proses fagositosis (Anderson dan Siwicki 1995).
Respiratory Burst
Respiratory burst diukur dengan mengisi lubang mikroplate dengan darah sebanyak 50µL lalu diinkubasi selama 1 jam didalam inkubator suhu 37ºC. Setelah 1 jam kemudian darah dibuang dan dibilas menggunakan phospate buffer saline (PBS) sebanyak 100µL. Ditambahkan larutan nitroblue tetrazolium (NBT) sebanyak 50µ l lalu diinkubasi kembali selama 1 jam pada suhu 37ºC. Setelah 1 jam diinkubasi, larutan NBT dibuang dan dibilas dengan metanol 100% sebanyak 100µ l. Sebelum metanol dibuang terlebih dahulu diinkubasikan selama 10 menit, kemudian dibilas dengan metanol 30%. Larutan KOH 60µL dan DMSO 70µL ditambahkan kedalam lubang mikroplate kemudian dibaca menggunakan alat mikroplate reader untuk memperoleh nilai respiratory burst (Divyagnaneswari et al. 2007).
Clearances Efficiency
8
diinkubasi di mikroplate steril selama 1 jam pada suhu 27ºC. Kemudian diambil 50 µL untuk di sebar pada media RS Medium yang merupakan media selektif A. hydrophila untuk menghitung jumlah bakteri (CFU mL-1). Persentase kemampuan menghambat dihitung menggunakan persamaan berikut (Adams 1991):
CE = 100− � � �
� � � � � × 100
Jumlah bakteri A. hydrophila pada organ target
Jumlah bakteri A. hydrophila di organ target dihitung dengan menggunakan metode TPC setiap 15 hari sekali dimulai setelah penebaran ikan. Organ target yang diamati adalah ginjal dan hati. Masing-masing organ target sebanyak 0,1 gram digerus dan dilarutkan dalam 1 mL PBS steril, divortex kemudian dilakukan pengenceran berseri. Selanjutnya diambil 50 µL dan disebar pada permukaan agar cawan RS Medium, diinkubasi selama 24 jam, lalu dilakukan penghitungan
Σ koloni : Jumlah koloni bakteri A. hydrophila yang terhitung
fp : Faktor pengenceran
Vol. Sebar : Volume sampel bakteri yang disebar di media cawan petri Parameter Kinerja Pertumbuhan
Parameter kinerja pertumbuhan yang diamati dalam penelitian ini meliputi tingkat kelangsungan hidup, laju pertumbuhan harian dan konversi pakan, jumlah konsumsi pakan, retensi protein, retensi lemak, jumlah total bakteri dan total Bacillus NP5 diusus ikan. Sampling parameter pertumbuhan dilakukan di akhir penelitian.
Tingkat Kelangsungan Hidup atau Survival Rate (SR)
Tingkat kelangsungan hidup dapat dihitung dengan menggunakan rumus (Goddard 1996) sebagai berikut:
= × 100
Keterangan:
SR : Tingkat kelangsungan hidup (%)
9
Laju Pertumbuhan Harian
Laju pertumbuhan harian ikan dihitung dengan menggunakan rumus (Huisman 1987) sebagai berikut:
LPH =ln Wt−ln Wo
t × 100
Keterangan:
LPH : Laju pertumbuhan harian (%)
Wo : Bobot tubuh ikan pada awal pemeliharaan (g) Wt : Bobot tubuh ikan pada akhir pemeliharaan (g) t : Waktu pemeliharaan (hari)
Rasio Konversi Pakan (Feed Conversion Ratio/ FCR)
Konversi pakan dihitung dengan menggunakan rumus (Huisman 1987) sebagai berikut:
= ∑pakan
+ − 0
Keterangan:
FCR : Konversi pakan
∑ Pakan : Jumlah pakan yang diberikan selama penelitian (g)
Bt : Biomassa ikan di akhir penelitian (g)
BM : Biomassa ikan yang mati selama penelitian (g) B0 : Biomassa ikan pada awal penelitian (g)
Retensi protein
Retensi protein dihitung melalui analisis proksimat protein tubuh ikan uji pada awal dan akhir pemeliharaan. Rumus perhitungan retensi protein adalah sebagai berikut (Takeuchi 1988):
RP =F−I
P × 100
Keterangan:
RP : Retensi protein (%)
10
Retensi lemak
Retensi lemak dihitung melalui analisis proksimat lemak tubuh ikan uji pada awal dan akhir pemeliharaan. Rumus perhitungan retensi lemak adalah sebagai berikut (Takeuchi 1988):
RL = F−I
L × 100
Keterangan:
RL : Retensi lemak (%)
F : Jumlah lemak ikan pada akhir pemeliharaan (g) I : Jumlah lemak ikan pada awal pemeliharaan (g) P : Jumlah lemak yang dikonsumsi ikan (g)
Kelimpahan Total Bakteri dan Bacillus NP5 di Usus
Perhitungan kelimpahan bakteri yang terdapat di dalam usus ikan dilakukan di akhir penelitian meliputi jumlah total bakteri dan Bacillus NP5. Usus sebanyak 0,1 gram digerus dan dilarutkan dalam 1 mL PBS steril, divortex lalu dilakukan pengenceran berseri. Selanjutnya diambil 50 µl dan disebar pada permukaan agar cawan dengan media TSA untuk total bakteri dan TSA Rif untuk Bacillus NP5. Setelah itu diinkubasi selama 24 jam kemudian dilakukan perhitungan jumlah koloni yang tumbuh dengan menggunakan rumus (Madigan et al. 2014) sebagai berikut:
Total kelimpahan bakteri = ∑ koloni × 1
Vol. Sebar (mL)×
1 fp
Keterangan:
fp : Faktor pengenceran
Vol. Sebar : Volume sampel bakteri yang disebar
Analisis statistik
11
3
HASIL DAN PEMBAHASAN
Hasil
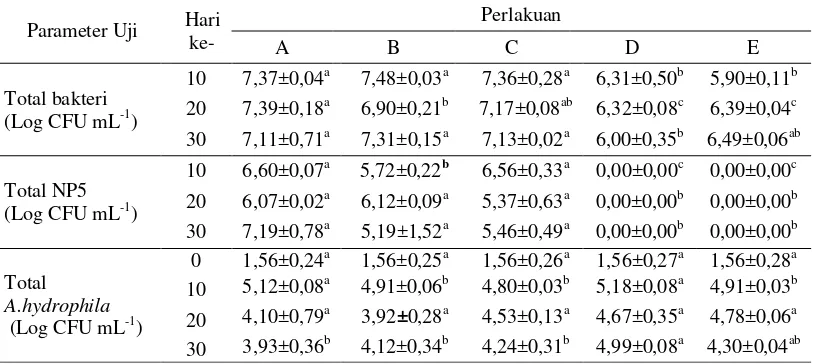
Total Kelimpahan bakteri, Bacillus NP5 dan Aeromonas hydrophila di air Setelah 30 hari masa pemeliharaan, perlakuan dengan pemberian sumber karbon menunjukkan total bakteri di air (Tabel 1) lebih tinggi dengan nilai (7,11– 7,31 Log CFU mL-1) dan berbeda nyata (p<0,05) terhadap perlakuan kontrol positif dan kontrol negatif. Total bakteri Bacillus NP5 di air (Tabel 1) pada semua perlakuan dengan penambahan sumber karbon tidak berbeda nyata sedangkan pada kontrol positif dan negatif tidak ditemukan Bacillus NP5. Total bakteri A. hydrophila di air hari ke 30 (Tabel 1) pada perlakuan kontrol positif menunjukkan nilai paling tinggi dan berbeda nyata (p<0,05) terhadap perlakuan dengan penambahan sumber karbon.
Tabel 1Total bakteri, Bacillus NP5 dan Aeromonas hydrophila di air pemeliharaan ikan lele Clarias sp. yang dibudidayakan pada sistem bioflok dengan sumber karbon berbeda serta diinfeksi A. hydrophila.
Parameter Uji Hari
10 7,37±0,04a 7,48±0,03a 7,36±0,28a 6,31±0,50b 5,90±0,11b
20 7,39±0,18a 6,90±0,21b 7,17±0,08ab 6,32±0,08c 6,39±0,04c
30 7,11±0,71a 7,31±0,15a 7,13±0,02a 6,00±0,35b 6,49±0,06ab
Total NP5
(Log CFU mL-1)
10 6,60±0,07a 5,72±0,22b 6,56±0,33a 0,00±0,00c 0,00±0,00c
20 6,07±0,02a 6,12±0,09a 5,37±0,63a 0,00±0,00b 0,00±0,00b
30 7,19±0,78a 5,19±1,52a 5,46±0,49a 0,00±0,00b 0,00±0,00b
Total
perbedaan secara statistik (Uji jarak berganda Tuckey; p<0,05). A, B, C masing – masing dengan
penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D =
kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif,
12
Kualitas Air
Selama penelitian dilakukan pengamatan parameter kualitas air media pemeliharaan seperti pH, suhu, kelarutan oksigen (DO) dan kekeruhan (Tabel 2).
Tabel 2 Parameter kualitas air media pemeliharaan ikan lele Clarias sp. selama
tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon
dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak
diinfeksi A. hydrophila.
Hasil pengukuran pH, suhu, DO dan kekeruhan pada Tabel 2 diatas, menunjukkan bahwa nilai pH, suhu dan DO masih dalam kondisi yang layak untuk kehidupan ikan dengan menggunakan teknologi bioflok. Nilai kekeruhan merupakan indikator telah terbentuknya bioflok pada media pemeliharaan.
Hasil pengukuran kandungan total amonia nitrogen (TAN) disajikan pada Gambar 1 di bawah ini yang menunjukkan bahwa nilai TAN selama 30 hari pemeliharaan cenderung menunjukkan peningkatan. Pada perlakuan penambahan sumber karbon terigu terjadi penurunan nilai TAN pada hari ke 30.
Gambar 1 Nilai total amonia nitrogen dalam media pemeliharaan ikan lele selama 30 hari. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A. hydrophila.
13
Gambar 2 Nilai nitrit dalam media pemeliharaan ikan lele selama 30 hari. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A. hydrophila.
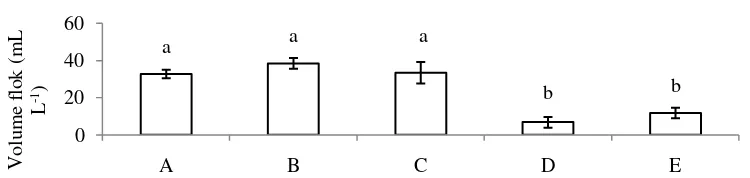
Penambahan sumber karbon juga berpengaruh terhadap pembentukan flok di media pemeliharaan. Volume flok di media pemeliharaan menunjukkan bahwa pemberian sumber karbon molase, tapioka dan terigu menunjukkan hasil yang lebih tinggi dan berbeda nyata (p<0,05) terhadap kontrol positif dan kontrol negatif (Gambar 3).
Gambar 3 Volume flok di media pemeliharaan ikan lele selama 30 hari. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A. hydrophila.
Respons Imun
14
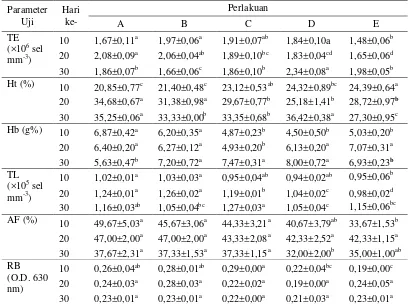
Tabel 3 Total eritrosit (TE), kadar hematokrit (Hc), kadar hemoglobin (Hb), total leukosit (TL), aktivitas fagositik (AF) dan respiratory burst (RB) pada ikan lele Clarias sp. yang dipelihara pada sistem bioflok dengan sumber karbon berbeda serta diinfeksi A. hydrophila.
Parameter
10 1,67±0,11a 1,97±0,06a 1,91±0,07ab 1,84±0,10a 1,48±0,06b
20 2,08±0,09a 2,06±0,04ab 1,89±0,10bc 1,83±0,04cd 1,65±0,06d
30 1,86±0,07b 1,66±0,06c 1,86±0,10b 2,34±0,08a 1,98±0,05b
Ht (%)
10 20,85±0,77c 21,40±0,48c 23,12±0,53ab 24,32±0,89bc 24,39±0,64a
20 34,68±0,67a 31,38±0,98a 29,67±0,77b 25,18±1,41b 28,72±0,97b
30 35,25±0,06a 33,33±0,00b 33,35±0,68b 36,42±0,38a 27,30±0,95c
Hb (g%) 10 6,87±0,42a
6,20±0,35a 4,87±0,23b 4,50±0,50b 5,03±0,20b
20 6,40±0,20a 6,27±0,12a 4,93±0,20b 6,13±0,20a 7,07±0,31a
30 5,63±0,47b 7,20±0,72a 7,47±0,31a 8,00±0,72a 6,93±0,23b
TL
(×105 sel
mm-3)
10 1,02±0,01a 1,03±0,03a 0,95±0,04ab 0,94±0,02ab 0,95±0,06b
20 1,24±0,01a 1,26±0,02a 1,19±0,01b 1,04±0,02c 0,98±0,02d
30 1,16±0,03ab 1,05±0,04bc 1,27±0,03a 1,05±0,04c 1,15±0,06bc
AF (%) 10 49,67±5,03a
45,67±3,06a 44,33±3,21a 40,67±3,79ab 33,67±1,53b
20 47,00±2,00a 47,00±2,00a 43,33±2,08a 42,33±2,52a 42,33±1,15a
30 37,67±2,31a 37,33±1,53a 37,33±1,15a 32,00±2,00b 35,00±1,00ab
RB (O.D. 630 nm)
10 0,26±0,04ab 0,28±0,01ab 0,29±0,00a 0,22±0,04bc 0,19±0,00c
20 0,24±0,03a 0,28±0,03a 0,22±0,02a 0,19±0,00a 0,24±0,05a
30 0,23±0,01a 0,23±0,01a 0,22±0,00a 0,21±0,03a 0,23±0,01a
Huruf superscript yang berbeda pada baris yang sama menunjukkan perbedaan secara statistik (Uji
jarak berganda Tuckey; p<0,05). A, B, C masing – masing dengan penambahan sumber karbon
molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa
penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan
sumber karbon dan tidak diinfeksi A. hydrophila. TE = Total eritrosit; Ht = kadar hematokrit; Hb =
kadar hemoglobin, TL = total leukosit; AF = aktivitas fagositik; RB = respiratory burst.
15
Gambar 4 Clearances efficiency plasma darah ikan uji selama pemeliharaan. Huruf superscript yang berbeda ditiap bar menunjukkan perbedaan secara statistik (Uji jarak berganda Tuckey; p<0,05). A, B, C masing
– masing dengan penambahan sumber karbon molase, tapioka dan tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak diinfeksi A. hydrophila.
.
Total bakteri A. hydrophila di organ target ikan uji
Hasil pengamatan A. hydrophila di hati (Gambar 5a) ikan uji menunjukkan ada penurunan di hari ke-30 dari pengamatan sebelumnya pada perlakuan sumber karbon molase dan tapioka, yang berbeda nyata (p<0,05) dengan perlakuan kontrol. Pada pengamatan di ginjal (Gambar 5b) juga menunjukkan sumber karbon molase dan tapioka mampu menekan pertumbuhan A. hydrophila yang berbeda nyata (p<0,05) terhadap perlakuan kontrol.
(a)
(b)
16
Kinerja pertumbuhan
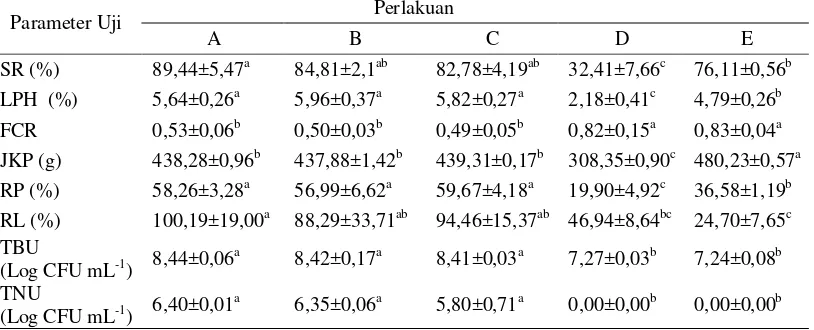
Berdasarkan Tabel 4, tingkat kelangsungan hidup ikan selama 30 hari pemeliharaan pada perlakuan pemberian molase menunjukkan nilai tertinggi (89,44±5,47%) dan berbeda nyata (p<0,05) terhadap perlakuan kontrol positif dan negatif, namun demikian tingkat kelangsungan hidup pada pemberian sumber karbon molase, tapioka dan terigu tidak berbeda nyata antar perlakuan (p>0,05). Nilai laju pertumbuhan harian pada perlakuan dengan pemberian sumber karbon molase, tapioka dan terigu menunjukkan hasil yang lebih tinggi (5,64 5,96%) dan berbeda nyata (p<0,05) dibandingkan perlakuan kontrol positif dan negatif. Hasil perlakuan pemberian molase, tapioka dan terigu pada rasio konversi pakan menunjukkan nilai yang lebih rendah (0,49-0,53) dan berbeda nyata (p<0,05) dengan perlakuan kontrol positif dan negatif. Nilai retensi protein pada perlakuan molase, tapioka dan terigu menunjukkan hasil yang lebih tinggi (56,99 - 59,67%) dan berbeda nyata (p<0,05) terhadap perlakuan kontrol positif dan negatif. Retensi lemak pada perlakuan molase menunjukkan nilai tertinggi (100,19%) yang berbeda nyata (p<0,05) terhadap kontrol namun demikian retensi lemak pada pemberian sumber karbon molase, tapioka dan terigu tidak berbeda nyata antar perlakuan (p>0,05). Total bakteri dan total bakteti Bacillus NP5 di usus ikan uji pada perlakuan dengan penambahan sumber karbon molase, tapioka dan terigu lebih tinggi dan berbeda nyata (p<0,05) terhadap kontrol.
Tabel 4 Tingkat kelangsungan hidup, kinerja pertumbuhan dan total bakteri di usus ikan lele Clarias sp. yang dibudidayakan pada sistem bioflok dengan sumber karbon berbeda serta diinfeksi A. hydrophila.
Parameter Uji Perlakuan
8,42±0,17a 8,41±0,03a 7,27±0,03b 7,24±0,08b
TNU
(Log CFU mL-1) 6,40±0,01
a
6,35±0,06a 5,80±0,71a 0,00±0,00b 0,00±0,00b
Huruf superscript yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang
berbeda nyata (uji Tuckey; p<0,05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. SR = Tingkat kelangsungan hidup; LPH = laju pertumbuhan harian; FCR = rasio konversi
pakan; RP = retensi protein; RL = retensi lemak; TBU = total bakteri di usus; TNU =Total Bacillus
NP5 di usus. A, B, C masing – masing dengan penambahan sumber karbon molase, tapioka dan
tepung terigu serta diinfeksi A. hydrophila; D = kontrol positif tanpa penambahan sumber karbon
dan diinfeksi A. hydrophila; E = kontrol negatif, tanpa penambahan sumber karbon dan tidak
17 Pembahasan
Penambahan sumber karbon berbeda telah meningkatkan total bakteri dan total Bacillus NP5 di media pemeliharaan (Tabel 1). Kim et al. (2014) menyatakan bahwa penggunaan media bioflok mampu meningkatkan total kepadatan bakteri dari 106 hingga 107. Hasil penelitian yang sama ditunjukkan oleh Ekasari et al. (2014), bahwa penambahan sumber karbon yang berbeda pada media bioflok mampu meningkatkan total bakteri pada media pemeliharaan.
Jumlah total bakteri A. hydrophila selama pemeliharaan mengalami penurunan pada perlakuan dengan penambahan sumber karbon. Penurunan ini diduga karena keberadaan Bacillus NP5 pada media bioflok yang mampu menekan pertumbuhan A.
hydrophila. Hasil penelitian Tamamdusturi et al. (2016) menunjukkan keberadaan
probiotik Bacillus NP5 mampu menghambat pertumbuhan A. hydrophila. Selain itu, menurut Crab et al. (2010b) bioflok mampu menghambat pertumbuhan berbagai jenis patogen dengan cara menghambat quorum sensing dari bakteri patogen tersebut. Hal ini dipertegas oleh Defoirdt et al. (2007) yang menyatakan probiotik dari golongan Bacillus sp. diketahui mampu menghasilkan senyawa poly-β -hydroxybutyrate (PHB) yang dapat menghambat pertumbuhan patogen Vibrio campbellii. Defoirdt et al. (2011) juga menambahkan bahwa Bacillus sp. mampu menghasilkan senyawa acyl homoserine lactonase yang dapat mencegah terjadinya quorum sensing dari bakteri patogen seperti A. hydrophila.
18
baik organik maupun anorganik dalam air pemeliharaan selain fitoplankton serta bakteri nitrifikasi. Nilai nitrit terendah diperoleh pada perlakuan dengan penambahan sumber karbon tapioka 0,67 mg L-1 dan tertinggi pada perlakuan kontrol positif 0,84 mg L-1. Apriyani et al. (2016) menyatakan bahwa menurunnya nilai nitrit pada perlakuan penambahan sumber karbon disebabkan karena senyawa TAN dirombak langsung menjadi nitrogen organik dalam bentuk koloni bakteri dan proses nitrifikasi diduga berlangsung cepat. Nilai kekeruhan dan volume flok mengindikasikan berhasilnya proses pembentukan flok (flokulasi) pada media pemeliharaan.
Status kesehatan ikan lele yang diamati berdasarkan nilai gambaran darah seperti total eritrosit (TE), kadar hemoglobin (Hb) dan kadar hematokrit (Hc) mengalami fluktuasi, penurunan dapat terjadi karena adanya infeksi bakteri A. hydrophila yang mampu menghasilkan eksotoksin dan endotoksin yang menyebabkan sel darah menjadi lisis (Hardi et al. 2014). Pada penelitian Yousr et al. (2007), Chirilia et al. (2008) serta Kumar dan Ramulu (2013) juga menegaskan bahwa A. hydrophila mampu menghasilkan produk ekstraseluler seperti aerolisin dan hemolisin yang mampu menimbulkan aktivitas haemolisis pada eritrosit. Pada penambahan sumber karbon, peningkatan terjadi kembali karena adanya kumpulan flok yang mampu mengganggu komunikasi antar sel patogen sehingga dapat menjadi agen biokontrol di media pemeliharaan (De Schryver et al. 2008). Selain itu, partikel bioflok juga diduga mengandung bakteri yang menguntungkan seperti Bacillus dan Lactobacillus (Anand et al. 2014). Hasil penelitian Tamamdusturi et al. (2016) dan Agung et al. (2015) menunjukkan bahwa pemberian probiotik Bacillus sp. mampu meningkatkan nilai TE, Hb dan Hc pada ikan patin dan ikan nila. Pada perlakuan kontrol positif pada hari 30 dapat dilihat bahwa nilai TE, Hb dan Hc terus meningkat hal ini diduga karena ikan dalam kondisi stres akibat infeksi bakteri. Hal ini dipertegas oleh Wedemeyer dan Yasutake (1977) yang menyatakan bahwa tingginya nilai total eritrosit pada ikan menunjukkan ikan berada dalam kondisi stres.
19 Meningkatnya respons imun ikan pada perlakuan dengan penambahan sumber karbon dapat juga dilihat dari hasil uji clearances efficiency dari plasma darah ikan terhadap bakteri A. hydrophila. Dari hasil uji clearances efficiency terhadap plasma darah menunjukkan hasil yang berbeda nyata antara perlakuan pemberian sumber karbon dengan perlakuan kontrol (p<0,05). Pada perlakuan dengan penambahan sumber karbon menunjukkan bahwa tingkat clearances dari bakteri patogen sangat baik hingga mencapai 100%. Hasil penelitian Adams (1991) menemukan bahwa tingkat kemampuan hemolim dalam clearances bakteri yang terbaik dapat mencapai 99%.
Berdasarkan hasil penelitian yang diperoleh, penambahan sumber karbon yang berbeda pada media bioflok terbukti mampu meningkatkan kelangsungan hidup ikan lele. Yusuf et al. (2015) menyatakan bahwa tingkat kelangsungan hidup ikan lele yang dipelihara pada media bioflok lebih besar mencapai (86,67 – 89,33%) dibandingkan yang tidak dipelihara pada media bioflok (50,65-75,33%). Tingginya tingkat kelangsungan hidup ikan yang dipelihara pada media bioflok disebabkan karena pada media bioflok terdapat mikroorganisme seperti protozoa, rotifera dan bakteri heterotrof (Azim et al. 2008) yang dapat menjadi sumber pakan bagi ikan sehingga dapat menekan sifat kanibalisme (Apriyani et al. 2016). Penambahan bakteri Bacillus NP5 pada media bioflok diyakini juga dapat meningkatkan kelangsungan hidup pada ikan. Hasil penelitian Widanarni et al. (2014) menunjukkan bahwa probiotik Bacillus NP5 mampu memperbaiki respons imun dan meningkatkan kelangsungan hidup udang yang diinfesi virus IMNV. Bakteri Bacillus NP5 yang ditambahkan pada media bioflok menjadi penyusun bioflok dan diketahui dapat mengakumulasikan senyawa poly-ß-hydroxybutyrate (PHB), bagian dari PHB mirip asam organik yang dapat memberikan efek menguntungkan bagi inang (Sinha et al. 2008).
Berdasarkan hasil penelitian diketahui bahwa JKP ikan pada perlakuan TBF menunjukkan nilai yang lebih besar (437,88-439,31 g) dan berbeda nyata (p<0,05) terhadap perlakuan kontrol positif (308,35 g) yang dipelihara tanpa TBF dengan diinfeksi A. hydrophila. Menurunya jumlah konsumsi pakan pada ikan kontrol positif diduga disebabkan ikan dalam kondisi stres akibat adanya infeksi bakteri patogen A. hydrophila sehingga mengurangi nafsu makan pada ikan, hal ini dapat dilihat dari jumlah bakteri patogen A. hydrophila yang ditemukan pada organ hati dan ginjal (Gambar 5).
20
media pemeliharaan. Hasil ini selaras dengan hasil penelitian Apriyani et al. (2016) yang menyatakan bahwa pemberian sumber karbon berbeda pada media bioflok mampu meningkatkan laju pertumbuhan dan menekan nilai konversi pakan benih ikan patin.
Nilai retensi protein dan retensi lemak ikan yang dipelihara pada media yang diberi sumber karbon lebih tinggi dibandingkan dengan kontrol postif dan kontrol negatif. Hal ini diduga karena TBF menyediakan pakan alami (flok), sebagai sumber nutrien dan energi bagi ikan, sehingga dapat meningkatkan retensi protein dan retensi lemak. Meningkatnya nilai retensi protein pada ikan yang dipelihara pada media bioflok disebabkan oleh adanya sumber makanan pada media bioflok (pakan alami) yang dimanfaatkan oleh ikan sebagai sumber protein selain dari pakan sehingga lebih banyak protein yang dapat disintesis menjadi protein tubuh (Apriyani et al. 2016). Semakin tinggi nilai retensi lemak yang dihasilkan maka semakin tinggi lemak dari pakan yang tersimpan sebagai cadangan energi. Hal ini dipertegas oleh Bureau et al. (2002) yang menyatakan bahwa lemak dari pakan dapat dimanfaatkan sebagai sumber energi yang penting bagi ikan sehingga protein yang dikonsumsi dari pakan dapat digunakan secara optimal untuk pertumbuhan ikan.
Penambahan sumber karbon berbeda memberikan pengaruh terhadap total bakteri dan Bacillus NP5 di usus ikan lele. Hal ini menunjukkan bahwa Bacillus NP5 yang ditambahkan menjadi bagian dari penyusun flok dan ikan mampu memanfaatkan flok yang ada di media sebagai sumber makanan. Hasil ini sesuai dengan Avnimelech (2007) yang menyatakan bahwa bioflok tersusun dari kumpulan mikroorganisme yang dapat dijadikan sebagai sumber makanan cadangan bagi ikan. Disamping itu keberadaan probiotik Bacillus NP5 di usus diduga dapat memberikan efek positif terhadap laju pertumbuhan dan konversi pakan. Hal ini sesuai dengan hasil penelitian Putra dan Widanarni (2015) yang menunjukkan bahwa Bacillus NP5 mampu meningkatkan aktivitas enzim pencernaan pada ikan sehingga dapat meningkatkan performa pertumbuhan ikan nila.
4
SIMPULAN DAN SARAN
Simpulan
Penambahan sumber karbon molase, tepung tapioka dan tepung terigu pada budidaya ikan lele dengan sistem bioflok mampu menekan jumlah bakteri patogen Aeromonas hydrophila pada media pemeliharaan, meningkatkan respons imun, kinerja pertumbuhan dan efisiensi pakan ikan lele. Nilai kelangsungan hidup tertinggi diperoleh dari sumber karbon molase (89,44%) yang berbeda nyata denagan kontrol positif dan kontrol negatif.
Saran
21
5
DAFTAR PUSTAKA
Adams A. 1991. Response of penaeid shrimp to exposure to Vibrio spesies. Fish and Shellfish Immunology. 1:59-70
Agung LA, Widanarni, Yuhana M. 2015. Application of micro-encapsulated probiotic Bacillus NP5 and prebiotic Mannan Oligosaccharide (MOS) to prevent Streptococcosis on Tilapia Oreochromis niloticus. Research Journal of Microbiology 10 (12):571-581
Agustinus F, Widanarni, Ekasari J. 2010. Microbial abundance and diversity in water, and immune parameters of Red Tilapia reared in bioflocs system with different fish density (25 fish/m3, 50 fish/m3 and 100 fish/m3). Jurnal Akuakultur Indonesia. 9(2):157-167.
Anand PSS, Kohli MPS, Kumar S, Sundaray JK, Dam Roy S, Venkateshwarlu G, Sinha A, Pailan GH. 2014. Effect of dietary supplementation of biofloc on growth performance and digestive enzyme activities in Penaeus monodon. Aquaculture. 418-419:108-115.
Anderson DP, Siwicki AK. 1995. Basic haemotology and serology for fish health programs. in: Shariff M, Arthur JR and Subasinghe RP (Eds). Diseases in Asian Aquaculture II. Fish Health Section, Asian Fisheries Society. Manila. Philippines. pp 185–202.
[AOAC] Association of Official Analytical Chemists. 1999. Official Methods of Analysis of AOAC Intl . 16th ed. Maryland (US): Association of Official Analytical Chemists.
[APHA] American Public Health Association. 1989. Standard Methods for the examination of Water and Wastewater. 20th ed. APPHA. AWWA. WPCF. Washington DC (US). 1192 p.
Apriyani I, Setiawati M, Budiardi T, Widanarni. 2016. Produksi benih ikan Patin Pangasianodon hypophthalmus (Sauvage 1878) pada sistem budi daya berbasis bioflok dengan penambahan sumber karbon berbeda. Jurnal Iktiologi Indonesia. 16(1).
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture. 264 (1-4): 140-147
Avnimelech Y. 2012. Biofloc Technology - a practical guide book, 2nd ed. The World Aquaculture Society. Baton Rouge. Louisiana. USA.
Azhar MH. 2013. Peranan sumber karbon ekternal yang berbeda dalam pembentukan bioflok dan pengaruhnya terhadap kualitas air serta produksi pada sistem budidaya udang vaname Litopenaeus vannamei. [Tesis]. Program Pascasarjana Institut Pertanian Bogor (ID).
22
Bakar NSA, Nasir NM, Lananan F, Hamid SHA, Lam SS, Jusoh A. 2015. Optimization of C/N ratios for nutrient removal in aquaculture system culturing African catfish, (Clarias gariepinus) utilizing bioflocs technology. International Biodeterioration & Biodegradation. 102 : 100-106.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. Journal of Fish Biology 5: 771-781.
Boyd CE. 2015. Water Quality An Introduction second edition. Springer International Publisher.
Brett, JR.1979. Environmental factors and growth. Academic Press. Inc. [ed] Hoar WS, Randall DJ, Brett JR. 1979. Fish Physiology. Volume VIII Bioenergetics and Growth. Academic Press Inc. Pp. 599-675.
Bureau DP, Kaushik SJ, Cho CY. 2002. Bioenergetics. In: Halver JE, Hardy RW (eds). 2002. Fish Nutrition, Third Edition. Academic Press. London. p 1-59
Chamberlain G, Avnimelech Y, Mcintosh RP, Velasco M. 2001. Advantages of aerated microbial reuse systems with balanced C:N. Global Aquaculture Alliance : April 2001:53-56.
Chirilia F, Fit N, Nadas G, Negrea O, Ranga R, 2008. Isolation and characterization of an Aeromonas hydrophila strain in carp (Cyrinus carpio) toxemia focus. Bulletin UASVM,Veterinary Medicine 65 (1):244-247.
Crab R, Chielens B, Wille M, Bossier P, Verstraete W. 2010a. The effect of different carbon sources on the nutritional value of bioflocs, a feed for Macrobrachium rosenbergii postlarvae. Aquaculture Research 41:559-567
Crab R, Lambert A, Defoirdt T, Bossier P, Verstraete W. 2010b. The application of bioflocs technology to protect brine shrimp (Artemia franciscana) from pathogenic Vibrio harveyi. Journal of Applied Microbiology, 109: 1643-1649.
De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W. 2008. The basics of bio-flocs technology: The added value for aquaculture. Aquaculture 277:125-137.
Defoirdt T, Halet D, Vervaeren H, Boon N, Van de Wiele T, Sorgeloos P, Bossier P, Verstraete W. 2007. The bacterial storage compound of poly- β -hydrobutyrate protects Artemia fransiseana from pathogenic Vibrio campbellii. Environmental Microbiology 9 (2): 445-452.
Defoirdt T, Thanh LD, Delsen BV, De Schryver P, Sorgeloos P, Boon N, Bossier P. 2011. N-acylhomoserine lactone-degrading Bacillus strains isolated from aquaculture animals. Aquaculture. 311:258-260.
Divyagnaneswari M, Chrstybapita D, Dinakaran MR. 2007. Enchancement of non specific immunity and disease resistance in Oreochromis mossambicus by Solanum trilobatum leaf fractions. Fish Shellfish Immunol. 22:249-59.
23 Ekasari J. 2009. Teknologi Bioflok: Teori dan Aplikasi dalam Perikanan Budidaya Sistem Intensif. Jurnal Akuakultur Indonesia 8(2): 117 – 126
Ekasari J, Azhar MH, Surawidjaja EH, Nuryati S. 2014. Immune response and disease resistance of shrimp fed biofloc grown on different carbon sources. Fish and Shellfish Immunology 41: 332-339.
Goddard S. 1996. Feed Management in Intensive Aquaculture. Chapman and Hall : New York.
Hardi EH, Catur AP, Triesna H, Rizki TH. 2014. Infeksi Aeromonas hydrophila melalui jalur berbeda pada ikan nila (Oreochromis niloticus) di Loa Kulu Kutai Kartanegara Kalimantan Timur. Jurnal Kedokteran Hewan 8(2):130-133.
Huisman EA. 1987. The principles of Fish Culture Production. Netherland: Development of Aquaculture. Wageningen University.
Kim SK, Pang Z, Seo HC, Cho YR, Samocha T, Jang IK. 2014. Effect of bioflocs on growth and immune activity of pasific white shrimp, Litopenaeus vannamei postlarvae. Aquaculture Research 45:362-371.
Kumar MP, Ramulu KS. 2013. Haematological changes in Pangasius hypophthalmus infected with Aeromonas hydrophila. International Journal of Food, Agriculture and Veterinary Sciences 3(1):70-75. Madigan MT, Martinko JM, Bender KS, Buckley DH, Stahl DA. 2014. Brock
Biology of Microorrganisms, Fourteenth Edition. Pearson.
Najdegerami EH, Bakhshi F, Lakani FB. 2015. Effect of biofloc on growth performance, digestive enzyme activities and liver histology of common carp (Cyprinus carpio L.) fingerlings in zero-water exchange system. Fish Physiology and Biochemistry. 42: 457-465
Purnomo PD. 2012. Pengaruh penambahan karbohidrat pada media pemeliharaan terhadap produksi budidaya intensif Nila (Oreochromis niloticus). Journal of Aquaculture Management and Technology 1(1):161-179. Putra AN, Widanarni. 2015. Screening of amylolytic bacteria as candidates of
probiotics in tilapia (Oreochromis sp.). Research Journal of Microbiology. 10(1): 1-13.
Ray AJ, Dillon KS, Lotz JM. 2011. Water quality dynamics and shrimp (Litopenaeus vannamei) production in intensive, mesohaline culture systems with two levels of biofloc management. Aquacultural Engineering 45:127-136.
24
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrients, In: Fish Nutrition and Mariculture, Watanabe T (ed). Tokyo University of Fisheries: Department of Aquatic Bioscience. p 179-225. Tamamdusturi R, Widanarni, Yuhana M. 2016. Administration of
microencapsulated probiotic Bacillus sp. NP5 and prebiotic Mannan Oligosaccharide for prevent of Aeromonas hydrophila infection on Pangasianodon hypophthalmus. Journal of Fisheries and Aquatic Science. 11(1):67-76
Wedemeyer G, Yasutake WT. 1977. Clinical methods for the assessment of the effects of environmental stress on fish health. Technical Paper, Vol. 89, U.S. Department of the Interior, Fish and Wildlife Service, Washington DC. USA.
Widanarni, Yuhana M, Muhammad A. 2014. Bacillus NP5 improvees growth performance and resistance against Infectious Myonecrosis Virus in White Shrimp (Litopenaeus vannamei). Ilmu Kelautan. 19(4):211-218. Vivas J, Carracedo B, Riano J, Razquin BE, Lopez-Fierro P, Acosta F, Naharro G,
Villena AJ. 2004. Behavior of an Aeromonas hydrophila aroA live vaccine in water microcosms. Applied and Environmental Microbiology. 70(5):2702–2708
Xu WJ, Pan LQ. 2013. Enhancement of immune response and antioxidant status of Litopenaeus vannamei juvenile in biofloc-based culture tanks manipulating high C/N ratio of feed input. Aquaculture 412–413 : 117–124.
Yousr AH, Napis S, Rusul GRA, Son R. 2007. Detection of aerolysin and hemolysin genes in Aeromonas spp. Isolated from enviromental and shellfish sources by polymerase chain reaction. ASEAN Food Journal 14:115-122
25 Lampiran 1 Identifikasi Aeromonas hydrophila menggunakan KIT API 20 E
Tests Active ingredients Hasil
ONPG 2-nitrophenyl ßdgalactopyranoside +
ADH L-arginine +
ODC L-lysine -
CIT L-ornithine -
H2S Trisodium citrate -
URE Sodium thiosulfate -
TDA Urea -
IND L-tryptophane -
VP Sodium pyruvate +
GEL Gelatin (bovine origin) +
GLU D-glucose +
MAN D-mannitol +
INO Inositol -
SOR D-sorbitol -
RHA L-rhamnose -
SAC D-sucrose +
MEL D-melibiose +
AMY Amygdalin +
ARA Amygdalin +
26
Lampiran 2 Prosedur analisis proksimat (AOAC 1999)
Kadar Air
1) Cawan dipanaskan dalam oven pada suhu 105oC-110oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1). 2) Bahan ditimbang 2-3 g (A).
3) Cawan dan bahan dipanaskan dalam oven pada suhu 105oC-110oC selama 4 jam kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2).
Kadar air (%) = [(X1+A)− X2]
A X 100
Kadar Abu
1) Cawan dipanaskan dalam oven pada suhu 105oC-110oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1). 2) Bahan ditimbang 2-3 g (A).
3) Cawan dan bahan dipanaskan dalam tanur pada suhu 600oC sampai menjadi abu kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2).
Kadar abu (%) =X2− X1
A X 100
Kadar Serat Kasar
1) Kertas saring dipanaskan dalam oven selama 1 jam pada suhu 105oC-110oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1). 2) Sampel ditimbang sebanyak 0,5 g (A) lalu dimasukkan ke dalam erlenmeyer
250 mL.
3) H2SO4 0,3 N sebanyak 50 mL ditambahkan ke dalam erlenmeyer lalu dipanaskan di atas pembakar bunsen selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 mL ditambahkan ke dalam erlenmeyer dan dipanaskan kembali selama 30 menit.
4) Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5) Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara
berturut-turut dengan 50 mL air panas, 50 mL H2SO4 0,3 N, 50 mL air panas dan 25 mL aseton.
6) Kertas saring dan isinya lalu dimasukkan ke dalam cawan porselin dan kemudian dipanaskan dalam oven 105-110oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
7) Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau abu-abu (+ selama 4 jam). Kemudian dimasukkan dalam oven 105-110oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
Kadar serat kasar =X2− X1−X3
27
Kadar Protein Tahap oksidasi
1) Sampel ditimbang sebanyak 0,5 g dan dimasukkan ke dalam labu Kjeldahl. 2) Katalis (K2SO4+CuSO4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 g
dan dimasukkan ke dalam labu Kjeldahl.
3) Sebanyak 10 mL H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu tersebut dipanaskan dalam rak oksidasi pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4) Larutan didinginkan lalu ditambah 100 mL air destilasi. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 mL. Larutan sampel siap untuk didestilasi. Tahap destilasi
1) Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi setengahnya dengan Aquades untuk menghindari kontaminasi oleh amonia lingkungan. Kemudian didihkan selama 10 menit
2) Erlenmeyer diisi 10 mL H2SO4 0,05 N dan ditambahkan 2 tetes indicator methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3) Sebanyak 5 mL larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan aquades dan ditambahkan 10 mL NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup. 4) Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10
menit hingga terjadi pengembunan pada kondensor.
5) Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu pada permukaan larutan. Kondensor dibilas dengan aquades selama 1-2 menit.
Tahap Titrasi
1) Larutan hasil destilasi dititrasi dengan larutan NaOH 0,05 N. 2) Volume hasil titrasi lalu dicatat.
3) Prosedur yang sama juga dilakukan pada blanko
28
Kadar Lemak
Metode ekstraksi Soxhlet
1) Labu ekstraksi dipanaskan dalam oven pada suhu 105oC-110oC dalam waktu 1 jam. Kemudian didinginkan dalam desikator selama 30 menit dan bobot labu ditimbang (X1).
2) Sampel ditimbang sebanyak 3-5 g (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan diletakkan pemberat di atasnya.
3) N-hexan 100-150 mL dimasukkan ke dalam soxhlet hingga selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4) Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath hingga cairan yang merendam sampel di dalam soxhlet berwarna bening.
5) Labu lalu dilepaskan dan tetap dipanaskan hingga N-hexan menguap. 6) Labu dan lemak yang tersisa dipanaskan dalam oven selama 15-60 menit,
kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2).
Metode Folch
1) Labu silinder dioven terlebih dahulu pada suhu 105oC-110oC selama 1 jam, lalu didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2) Sampel ditimbang sebanyak 2-3 g (A) dan dimasukkan ke dalam gelas homogen dan ditambahkan larutan kloroform/methanol (20 x A), sebagian disisakan untuk membilas pada saat penyaringan.
3) Sampel dihomogenkan selama 5 menit lalu disaring dengan vacuum pump. 4) Sampel yang telah disaring tersebut dimasukkan ke dalam labu pemisah
yang telah diberi larutan MgCI2 0,03 N (0,2 x C) lalu dikocok dengan kuat minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5) Lapisan bawah yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform/methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum lalu ditimbang (X2).
Kadar lemak (%) =X2− X1
A X 100
Hasi analisis proksimat pakan
Parameter (%) Hasil Proksimat (bobot basah)
29 Lampiran 3 Perhitungan jumlah karbon yang ditambahkan ke media pemeliharaan
setiap hari
Asumsi yang digunakan perlakuan molase:
Protein pakan 34,54%
Kadar nitrogen dalam protein 16%
Kadar nitrogen yang terbuang kemedia budidaya 75%
C/N rasio target 15
Kadar karbon dalam molase 36,15%
Misal jumlah pakan 10 g
Asumsi yang digunakan perlakuan tapioka:
Protein pakan 34,54%
Kadar nitrogen dalam protein 16%
Kadar nitrogen yang terbuang kemedia budidaya 75%
C/N rasio target 15
Kadar karbon dalam molase 48,89%
Misal jumlah pakan 10 g
Jumlah pakan per hari yang diberikan secara at (persamaan 1.)
Persamaan 1. x persentase kandungan protein pakan (persamaan 2.)
Persamaan 2. x 16% (persentase jumlah N dalam protein (persamaan
3.)
Persamaan 3. x 75% (nitrogen dalam pakan yang (persamaan4.)
Persamaan 4. x rasio C/N yang ditentukan (persamaan 5.)
30
Asumsi yang digunakan perlakuan terigu:
Protein pakan 34,54%
Kadar nitrogen dalam protein 16%
Kadar nitrogen yang terbuang kemedia budidaya 75%
C/N rasio target 15
Kadar karbon dalam molase 47,44%
Misal jumlah pakan 10 g
jumlah protein pakan 34,54% x 10 3,454 g
jumlah N 3,454 g x 0,16 0,553 g
jumlah N yang dibuang 0,553 g x 0,75 0,414 g
jumlah C yang ditambahkan 0,414 g x 15 6,217 g
C dari terigu 6,217/(100/47,44) x0,5 6,552 g
31 Lampiran 4 Gambar ikan yang terserang A. hydrophila (1,2) hemoragi pada tubuh