SEBARAN DIATOM KAITANNYA DENGAN KONDISI
LINGKUNGAN PERAIRAN SELAT RUPAT RIAU
CHANDRIKA EKA LARASATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Sebaran Diatom Kaitannya dengan Kondisi Lingkungan Perairan Selat Rupat Riau adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Chandrika Eka Larasati
RINGKASAN
CHANDRIKA EKA LARASATI. Sebaran Diatom Kaitannya dengan Kondisi Lingkungan Perairan Selat Rupat Riau. Dibimbing oleh MUJIZAT KAWAROE dan TRI PRARTONO.
Diatom memiliki kontribusi terhadap produktivitas primer yang mendukung jejaring makanan di perairan. Adanya aktivitas antropogenik yang berada di Selat Rupat seperti industri minyak kelapa sawit (CPO), dan pengolahan minyak bumi menyebabkan perairan tersebut mengalami tekanan terhadap kualitas air yang akan merusak dan merubah distribusi diatom karena responnya yang bervariasi terhadap kondisi perairan, mengganggu proses fotosintesa yang memicu pertumbuhan diatom secara cepat yang memungkinkan terjadinya blooming yang disebut dengan HAB (Harmful Algae Blooming). Penelitian ini bertujuan menganalisis parameter penting yang mempengaruhi kelimpahan diatom di Selat Rupat Riau. Pengambilan sampel dilakukan pada bulan Desember 2014 saat pasang dan surut di permukaan air (~1 m) dengan 3 kali ulangan. Lokasi sampling terbagi atas 5 stasiun penelitian berdasarkan keterwakilan wilayah aktivitas manusia. Parameter yang diambil yakni: parameter fisika perairan (kecepatan arus, salinitas, intensitas cahaya), kimia perairan (nitrat, fosfat, silikat, ammonia, Pb, oksigen terlarut, minyak dan lemak), dan kelimpahan diatom. Seluruh parameter dianalisis menggunakan PCA untuk melihat keterkaitan sebaran diatom dengan parameter lingkungan, sedangkan sebaran jenis diatom di setiap stasiun digunakan analisis CA.
Hasil menunjukkan bahwa jenis diatom yang didapat secara keseluruhan sebanyak 11 genus. Saat pasang, genus diatom yang ditemukan, yakni Biddulphia,
Coscinodiscus, Navicula, Nitzschia, Palmeria, Pleurosigma, Skeletonema,
Thalassionema, dan Thalassiosira, sedangkan saat surut jenis diatom yang ditemukan, yaitu Biddulphia, Coscinodiscus, Navicula, Nitzschia, Palmeria,
Pleurosigma, Skeletonema, Tabellaria, Thalassiosira, dan Triceratium. Genus
Coscinodiscus, dan Skeletonema dapat beradaptasi salinitas euryhaline, sehingga kelimpahannya lebih banyak dibandingkan dengan jenis lainnya (66 032 sel m-3 dan 64 027 sel m-3 saat pasang dan saat surut 69 507 sel m-3 dan 81 404 sel m-3).
Sebaran jenis diatom pada Stasiun 1 dan 2 cenderung relatif tinggi dibandingkan dengan stasiun lainnya. Hal ini tak terlepas dari lokasi sampling yang berdekatan dengan muara sungai dan kawasan mangrove yang memperkaya unsur hara di lokasi penelitian. Sebaran diatom yang didapat memiliki kecenderungan mengikuti pola nutrien yang berada di perairan Selat Rupat Riau. Sebaran diatom memiliki korelasi terhadap kondisi lingkungan di perairan tersebut khususnya konsentrasi nitrat dan intensitas cahaya yang mengikuti pola dinamika massa air pasang dan surut. Nitrat dibutuhkan diatom dalam pertumbuhannya, sedangkan intensitas cahaya matahari dibutuhkan dalam proses fotosintesa. Sebaran jenis diatom dapat mengkarakteristikkan setiap stasiunnya dengan mengikuti pola nutrien dan kemampuan beradaptasi pada kondisi perairan.
SUMMARY
CHANDRIKA EKA LARASATI. Distribution of Diatoms Relation to Environmental Conditions in Rupat Strait Riau. Supervised by MUJIZAT KAWAROE and TRI PRARTONO.
Diatoms have contributed to support primary productivity in the waters of the food chain. The existence of anthropogenic activities that are in the Strait Rupat such as industrial palm oil (CPO), and petroleum processing causes the waters to experience pressure on water quality will spoil and changing the distribution of diatoms because of the response that varies with the condition of the waters, disrupting photosynthesis process that triggers growth diatom quickly which allows the blooming of the so-called HAB (Harmful Algae Blooming).
This study aims to analyze critical parameters that influence the abundance of diatoms in the Strait Rupat Riau. Sampling was conducted in December 2014 when the ups and downs on the surface of the water (~ 1 m) with three replications. Sampling locations are divided into five research stations based representation of the area of human activity. The parameters taken are: physical parameters of water (current velocity, salinity, light intensity), chemical water (nitrate, phosphate, silicate, ammonia, Pb, dissolved oxygen, oils and fats), and the abundance of diatoms. All parameters were analyzed using PCA to see how the distribution of diatoms with environmental parameters, while the distribution of types of diatoms in each station to use the analysis CA.
The results showed that the types of diatoms obtained an overall total of 11 genera. At high tide, the genus diatoms are found, namely Biddulphia, Coscinodiscus, Navicula, Nitzschia, Palmeria, Pleurosigma, Skeletonema, Thalassionema, and Thalassiosira, whereas at low tide types of diatoms were found, namely Biddulphia, Coscinodiscus, Navicula, Nitzschia, Palmeria, Pleurosigma, Skeletonema, Tabellaria, Thalassiosira, and Triceratium. Genus
Coscinodiscus, and Skeletonema can adapt salinity euryhaline, so abundantly more than any other type (66 032 m-3 and 64 027 m-3 cells at high tide and low tide 69 507 m-3 and 81 404 m-3 cells).
Distribution of types of diatoms at Station 1 and 2 tend to be relatively high compared to other stations. It is inseparable from the sampling location adjacent to river mouths and mangrove areas that enrich the nutrient at the sites. Distribution of diatoms obtained have a tendency to follow the pattern of nutrients in the waters of the Strait of Rupat Riau. Distribution of diatom has a correlation to the environmental conditions in these waters especially nitrate concentration and intensity of light that follows the pattern of mass dynamics and low-tide. Nitrates are needed diatoms in growth, whereas the intensity of sunlight is needed in photosynthesis. Distribution of diatoms can characterize any type of the station by following the pattern of nutrient and adaptability on water conditions.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Kelautan
SEBARAN DIATOM KAITANNYA DENGAN KONDISI
LINGKUNGAN PERAIRAN SELAT RUPAT RIAU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Sebaran Diatom Kaitannya dengan Kondisi Lingkungan Perairan Selat Rupat Riau
Nama : Chandrika Eka Larasati NIM : C551130151
Disetujui oleh Komisi Pembimbing
Dr Ir Mujizat Kawaroe, MSi Ketua
Dr Ir Tri Prartono, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Kelautan
Dr Ir Neviaty P Zamani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur kehadirat Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga penulisan tesis mengenai Sebaran diatom kaitannya dengan kondisi lingkungan perairan Selat Rupat Riau berhasil diselesaikan dengan baik sebagai salah satu syarat menyelesaikan studi di Program Pascasarjana Program Studi Ilmu Kelautan Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Mujizat Kawaroe M.Si dan Bapak Dr Ir Tri Prartono M.Sc selaku pembimbing yang telah banyak memberi saran dan masukan dalam penyusunan tesis ini. Di samping itu, penulis juga berterima kasih kepada keluarga tercinta (Ayahanda Drs Musbir Rusman, MM, Ibunda Isnawerti Bukhari SPd, serta saudara Imam Bukhari SH, Fitria Nurul Hidayati, Kamilia, Fadhlur Rahman, Stefani Friska Nurul Fandhini) yang telah memberi doa, kasih sayang dan dukungan kepada penulis dalam menyelesaikan tesis ini. Rekan-rekan kuliah Pasca-IKL 2013, alumni FAPERIKA UR yang kuliah di IPB, teman-teman (Yusyam Leni, Fitri Ariani, Syahrial, Hayatun Nufus, Albida, Mujib, Lalang, Riska, Wira, Rhojim) yang telah menginspirasi dan telah menjadi teman diskusi serta sebagai sumber inspirasi maupun penyemangat bagi penulis.
Tesis ini tidak terlepas dari kesalahan dan kekeliruan dalam penyusunannya, untuk itu penulis mengharapkan kritik dan saran demi penyempurnaan isi dan tulisan dalam tesis ini.
Bogor, Maret 2016
DAFTAR ISI
Keterkaitan Parameter Fisika Kimia Perairan dan Sebaran Diatom 20
DAFTAR TABEL
1 Penentuan stasiun penelitian 5
2 Nilai NPP dan GPP rata-rata di permukaan Selat Rupat Riau 12
DAFTAR GAMBAR
1 Kerangka pendekatan masalah 3
2 Peta lokasi penelitian 4
3 Kelimpahan jenis diatom rata-rata saat pasang (a), dan surut (b) di Selat
Rupat Riau 10
4 Kelimpahan rata-rata jenis diatom saat surut di Selat Rupat Riau 11 5 Pola arus pada saat kondisi (a) menuju pasang (b) menuju surut
(Tarigan et al. 2014) 13
6 Fluktuasi pasang surut muka air laut Bulan Desember 2014, Perairan Selat Rupat, Riau (Pengolahan data Lanal Dumai 2014) 14 7 Parameter fisika rata-rata perairan Selat Rupat Riau:(a) intensitas
cahaya, (b) salinitas, dan (c) kecepatan arus 15 8 Parameter kimia rata-rata perairan Selat Rupat Riau: (a) nitrat, (b) fosfat,
(c) silikat, (d) ammonia, (e) Pb, (f) minyak dan lemak, (g) DO 18 9 Analisis komponen utama (PCA) keterkaitan antara kelimpahan diatom
dengan parameter fisika kimia perairan saat pasang (a), dan surut (b) 20 10 Analisis koresponden (CA) pada sumbu 1 (F1) dan sumbu 2 (F2) saat:
(a) pasang, dan (b) surut. 22
DAFTAR LAMPIRAN
1 Dokumentasi kondisi perairan pada masing-masing stasiun penelitian 30 2 Alat dan bahan yang digunakan selama penelitian 31 3 Parameter fisika kimia perairan pada saat pasang dan surut 32 4 Kelimpahan jenis diatom di lokasi penelitian pada saat pasang dan surut
(sel m-3) 34
5 Gambar genus diatom yang didapat selama penelitian 36
6 Matriks korelasi PCA 38
7 Data ramalan pasang surut air laut di perairan Selat Rupat Riau (Lanal
1
PENDAHULUAN
Latar Belakang
Diatom (Bacillariophyceae) merupakan jenis alga coklat keemasan yang berasal dari filum Chrysophyta yang memiliki kerangka dinding sel terbuat dari silika (frustule) (Kawaroe et al. 2010). Diatom dapat dijumpai di seluruh perairan, baik perairan tawar, payau maupun laut khususnya di perairan tropis yang dangkal, turbulen, dan upwelling (Nogueira 2000; Yerli et al. 2012; Madhavi et al. 2014), seperti di Laut Jawa, variasi jenis diatom terdiri atas 91 jenis diatom sentrik dan 36 jenis diatom penate (Hatta et al. 2010). Distribusi diatom sangat bervariasi secara temporal dan spasial (Nontji 2008). Diatom memiliki kontribusi terhadap produktivitas primer yang mendukung siklus jejaring makanan di suatu perairan (Fehling et al. 2012), dan sebagai awal rantai makanan (produsen primer) bagi jenjang trofik level di perairan, sumber pakan alami bagi ikan, dan penghasil oksigen melalui fotosintesa (Lovadi et al. 2015).
Faktor fisika (intensitas cahaya, salinitas, dan arus) dan kimia (nitrat, fosfat, dan silikat) memiliki peranan penting terkait dengan sebaran diatom (Kelly et al. 2007; Wu et al. 2011). Nutrien seperti nitrat, fosfat, dan silikat merupakan faktor pembatas yang dibutuhkan bagi pertumbuhan diatom. Silikat berperan penting dalam pembentukkan dinding sel tubuhnya (Ozdemir & Orhan 2012) dan sebagai regulator bagi kompetisi fitoplankton, dimana diatom selalu mendominasi populasi fitoplankton pada konsentrasi silikat yang tinggi (Beardall et al. 2001; Risamasu & Prayitno 2011). Diatom banyak digunakan sebagai bioindikator kualitas perairan, melalui pemantauan dalam jangka panjang, dan tingkat kepekaan pada spesies yang dominan, serta bagaimana hubungannya dengan perubahan kondisi lingkungan perairan (Zielinski & Gersonde 1997; Sahu et al.
2012; Gudmundsdottir et al. 2013; Madhavi et al. 2014). Alasan utama penggunaan diatom dalam menentukan kondisi perairan adalah penyebarannya yang kosmopolit serta ekologinya yang telah banyak dipelajari dengan baik (Potapova & Charles 2007).
di perairan (Fehling et al. 2012; Siregar et al. 2008). Pertumbuhan diatom yang tinggi akan berdampak adanya dominansi jenis tertentu yang dapat toleran terhadap perubahan faktor lingkungan yang akan menimbulkan adanya potensi HAB (Harm Algae Blooming) dan dapat mempengaruhi siklus rantai makanan di ekosistem perairan.
Perumusan Masalah
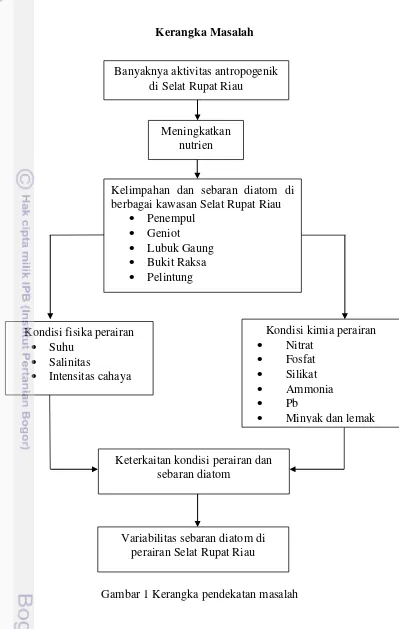
Selat Rupat memiliki 6 muara sungai besar yang kemungkinan akan memberikan tekanan terhadap pemanfaatan sumberdaya perairan. Sungai-sungai memberikan pasokan nutrien ke Selat Rupat dan pasokan lainnya yang berasal dari aktivitas antropogenik seperti pertambakan, aktivitas rumah tangga, pelabuhan, industri PT. PERTAMINA, kegiatan ekspor-impor minyak kelapa sawit (CPO), perkapalan, dan aktivitas perikanan dapat memengaruhi kualitas lingkungan serta proses biologi perairan termasuk menstimulasi pertumbuhan diatom secara cepat. Kegiatan industri minyak yang berada di Selat Rupat sering mengalami kejadian tumpahan minyak ke perairan yang dapat menutupi lapisan permukaan perairan dan menurunkan intensitas cahaya yang masuk ke zona euphotik dan mengganggu proses fotosintesa serta kelimpahan diatom. Pasokan materi ke laut berupa nutrien yang diikuti dengan dinamika massa air laut akan menyebabkan variabilitas spasial diatom sebagai produsen primer perairan, sehingga akan membentuk pola/gradien pada parameter fisika (suhu, salinitas, dan intensitas cahaya) dan kimia (nitrat, fosfat, silikat, ammonia, logam berat Pb, minyak dan lemak) perairan. Sehingga perlu diketahui dan dijelaskan mengenai sumber-sumber nutrien yang berada di Perairan Selat Rupat Riau dan faktor fisika kimia perairan yang mempengaruhi kelimpahan dan sebaran diatom (Gambar 1).
Tujuan Penelitian
Penelitian ini bertujuan untuk memecahkan / mencari solusi tentang sumber nutrien dan faktor fisika kimia perairan yang mempengaruhi pola kelimpahan dan sebaran diatom di Selat Rupat Riau.
Manfaat Penelitian
Penelitian ini diharapkan dapat membantu menentukan area yang cocok di Perairan Selat Rupat Riau untuk kawasan perikanan yang memanfaatkan diatom seperti kerang-kerangan dan ikan.
Ruang Lingkup Penelitian
Kerangka Masalah
Banyaknya aktivitas antropogenik di Selat Rupat Riau
Meningkatkan nutrien
Kondisi fisika perairan
Suhu
Salinitas
Intensitas cahaya
Kondisi kimia perairan
Nitrat
Fosfat
Silikat
Ammonia
Pb
Minyak dan lemak Kelimpahan dan sebaran diatom di
berbagai kawasan Selat Rupat Riau
Penempul
Geniot
Lubuk Gaung
Bukit Raksa
Pelintung
Variabilitas sebaran diatom di perairan Selat Rupat Riau Keterkaitan kondisi perairan dan
sebaran diatom
2
METODE
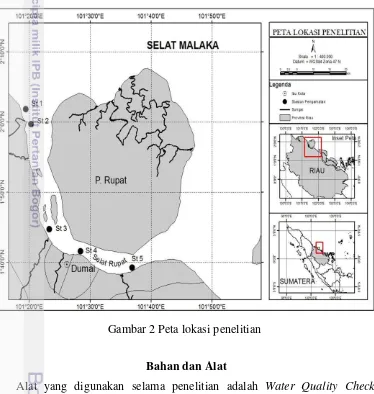
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada Bulan Desember 2014 – Maret 2015. Pengambilan sampel dilakukan pada Desember 2014 di Selat Rupat Provinsi Riau (Gambar 2). Analisis sampel parameter lingkungan dan penghitungan diatom dilakukan pada Januari-Maret 2015 di Laboratorium Kimia Laut, Fakultas Perikanan dan Ilmu Kelautan Jurusan Ilmu Kelautan Universitas Riau. Preparasi dan dekstruksi sampel logam berat Pb dilakukan di Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan Universitas Riau, dan pemakaian AAS dilakukan di Laboratorium Teknik Universitas Andalas Padang, serta preparasi sampel minyak dan lemak dilakukan di Laboratorium Produktivitas lingkungan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Bahan dan Alat
Alat yang digunakan selama penelitian adalah Water Quality Checker (WQC) seri 8603, current meter, lux meter, spektrofotometer Merk Thermo Spectronic 200+, AAS Merk Shimadzu Seri AA-7000, desikator, mikroskop CX21, plankton net, Sedgwick Rafter Cell, botol sampel, dan botol gelap-terang, sedangkan bahan yang dibutuhkan dalam penelitian ini yakni sampel air laut, HNO3 pekat, H2SO4 pekat dan larutan lugol 1% (Lampiran 2).
Metode Pengumpulan Data Penentuan Lokasi Sampling
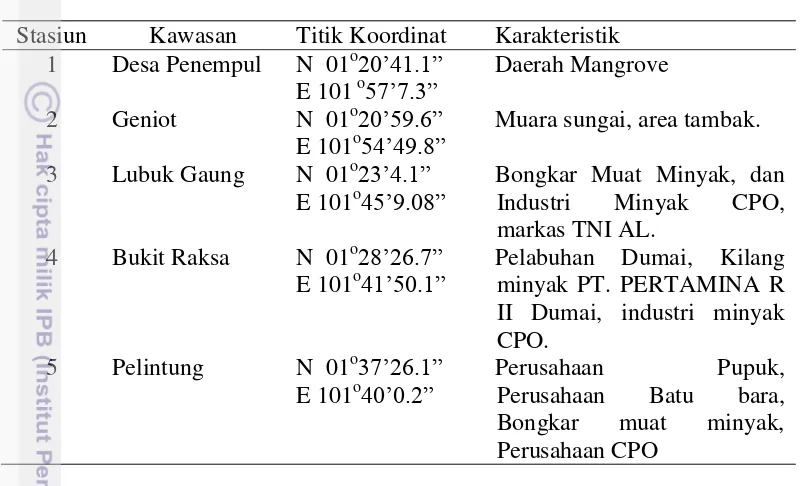
Lokasi sampling penelitian terbagi atas 5 stasiun yang ditentukan berdasarkan keterwakilan wilayah aktivitas manusia (Lampiran 1). Lokasi sampling dideskripsikan secara singkat yang disajikan pada Tabel 1.
Pengukuran Parameter Perairan
Parameter perairan meliputi arus diukur secara langsung dengan current meter, intensitas cahaya menggunakan lux meter, salinitas, dan oksigen terlarut dilakukan menggunakan alat WQC. Seluruh pengukuran dilakukan pada lapisan permukaan air (~1 m) pada kondisi pasang dan surut. Setiap pengambilan sampel, dilakukan pengulangan sebanyak 3 kali agar data yang didapat lebih akurat. Data pasang surut menggunakan data sekunder dari Pangkalan Angkatan Laut (LANAL) Dumai tahun 2014.
Pengambilan Sampel Air
Sampel air dilakukan untuk analisis nitrat, fosfat, silikat, ammonia, logam berat Pb, dan minyak dan lemak dilakukan dengan mengambil contoh air laut menggunakan Van Dorn Water Sampler. Contoh air laut diambil pada lapisan air permukaan (± 1 m) dan dimasukkan ke dalam botol sampel bersih yang sesuai standar (APHA 2005). Sampel nitrat dan ammonia dimasukkan ke dalam botol
polyetilen, sedangkan pada sampel minyak dan lemak dimasukkan ke dalam botol sampel kaca gelap yang kemudian diberi larutan H2SO4 hingga pH<2 dan suhu Stasiun Kawasan Titik Koordinat Karakteristik
Pengambilan Sampel Diatom
Sampel diatom didapat dengan menyaring sampel sebanyak 50 liter di permukaan perairan sekitar 0-1 m menggunakan plankton net dengan mesh size 20 µm. Setelah disaring, sampel diatom dimasukkan dalam botol polyetilen dengan volume 100 mL dan diberikan 4 tetes larutan Lugol 1% (Sahu et al. 2012). Setiap sampel yang diambil, dilakukan 3 kali pengulangan. Sampel disimpan ke dalam
icebox dan dibawa ke laboratorium untuk dianalisis. Pengukuran Produktivitas Primer di Permukaan Air
Pengukuran produktivitas primer dilakukan dengan metode oksigen (botol kaca gelap-terang) dengan prinsip mengetahui perubahan dari konsentrasi oksigen dalam botol sebelum dan sesudah inkubasi yang dilakukan dilapangan (Asriyana & Yuliana 2012). Inkubasi tersebut dilakukan di permukaan air pada pukul 10.00
– 14.00 WIB setiap harinya selama tiga hari berturut-turut pada lokasi yang sama. Pengukuran konsentrasi oksigen terlarut dilakukan dengan menggunakan elektroda dissolved oxygen yang berada pada alat WQC (Water Quality Checker). Asumsi yang terjadi pada metode ini, yakni: (1) botol terang terjadi proses fotosintesis dan respirasi, sedangkan dalam botol gelap hanya terjadi respirasi, (2) respirasi antara kedua botol adalah sama sehingga selisih antara kandungan oksigen pada botol terang dan gelap adalah GPP.
Hasil pengukuran konsentrasi oksigen terlarut kemudian dikonversi ke dalam satuan mg C m-3 jam-1 melalui persamaan (1) dan (2) yang telah dimodifikasi
0.375 = Koefisien konversi oksigen menjadi karbon (12/32) PQ = Photosynthetic Quotient = 1.2
t = Lama inkubasi (jam) Analisis Sampel Logam Berat Pb
Sebanyak 250 ml air laut disaring menggunakan filter selulosa dengan ukuran 0.45 µm, dan selanjutnya ditambahkan asam nitrat (HNO2) pekat hingga pH < 2, kemudian sampel diekstraksi dengan 5 ml Ammonium pyrolidin ditiokarbamat (APDC) dan 25 mL Metil isobutil keton (MIBK). Hasil ekstraksi dalam fase organik selanjutnya dilarutkan kembali dengan menambahkan 2 ml asam nitrat (HNO3) pekat sehingga terbentuk ion logam yang larut dalam fase air
Absorption Spectrophotometer (AAS) Merk Shimadzu Seri AA-7000 di sampel tersebut belum diasamkan, maka perlu ditambahkan larutan HCl 1:1. Sampel ditambahkan 30 ml pelarut organik (n-heksana), labu ditutup kemudian diekstraksi selama 2 menit. Larutan didiamkan hingga membentuk 2 lapisan, fase organik dikumpulkan dalam satu wadah. Sampel air dilakukan ekstraksi ulang (2x30 ml). Fase organik yang terkumpul tersebut dipindahkan ke dalam labu evaporasi dengan melewati Na2SO4 anhidrat. Wadah dibilas dengan pelarut
organik yang didestilasi, dan selanjutnya pelarut. Labu destilasi dimasukkan ke dalam oven selama 1 jam dengan suhu 85oC agar seluruh pelarut teruapkan. Setelah itu, labu destilasi dimasukkan ke dalam desikator untuk didinginkan, kemudian hitung konsentrasi minyak dan lemak yang didapat (APHA 2005).
Perhitungan kadar minyak lemak yang diperoleh dapat menggunakan rumus menurut (APHA 2005) sebagai berikut :
Kadar minyak dan lemak (mg l-1) = [(B-A)/C] x 1000 ………(4) dimana : B = Bobot wadah + residu (gram)
A = Bobot wadah kosong (gram) C = Volume sampel (liter) Perhitungan Kelimpahan Diatom
Analisis Data
3
HASIL DAN PEMBAHASAN
Kelimpahan Diatom
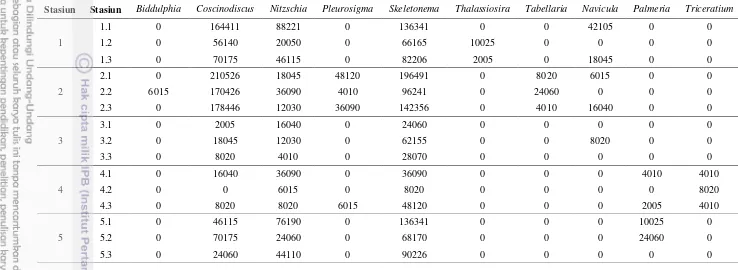
Hasil pengamatan menunjukkan bahwa terdapat sebanyak 11 genus diatom teridentifikasi dari keseluruhan sampel yang diambil baik saat pasang maupun surut (Lampiran 5). Diatom yang ditemukan saat pasang yakni genus Biddulphia, Coscinodiacus, Navicula, Nitzschia, Pleurosigma, Skeletonema, Thalassionema, Thalassiosira, dan Palmeria, sedangkan saat surut didapatkan genus Biddulphia, Coscinodiscus, Navicula, Nitzschia, Palmeria, Pleurosigma, Skeletonema, Tabellaria, Thalassiosira, dan Triceratium.
Genus diatom yang memiliki nilai tertinggi di setiap stasiunnya yaitu
Coscinodiscus, dan Skeletonema. Genus tersebut merupakan jenis yang paling banyak ditemukan di perairan tropis (Shahi et al. 2015). Pada penelitian ini,
Coscinodiscus, dan Skeletonema cenderung banyak ditemukan di Stasiun 1 dengan nilai berturut-turut sebesar 197 160 dan 106 266 sel m-3 saat pasang, sedangkan saat surut banyak ditemukan pada Stasiun 2 yakni berturut-turut sebesar 186 466 dan 145 029 sel m-3 (Gambar 3a dan 3b). Jenis tersebut memiliki nilai yang relatif tinggi dan selalu ditemukan di semua stasiun penelitian. Hal ini disebabkan oleh genus Coscinodiscus, (Mukherjee et al. 2013) dan Skeletonema
(Yamada et al. 2013) dapat beradaptasi pada tingkat variasi salinitas yang berbeda (euryhaline) dalam siklus hidupnya. Mereka mampu hidup pada salinitas 0 hingga 35 psu, sehingga jenis tersebut dapat melimpah di berbagai jenis perairan.
Tabellaria merupakan genus diatom yang memiliki kelimpahan terendah, dimana hanya ditemukan pada saat surut saja yaitu Stasiun 2 sebesar 12 030 sel m
-3
. Genus tersebut umumnya ditemukan di perairan tawar (Koppen 1973). Penemuan genus Tabellaria ditemukan di Stasiun ini diduga adanya muara sungai yang membawa diatom tersebut ke perairan laut (Potapova & Charles 2007).
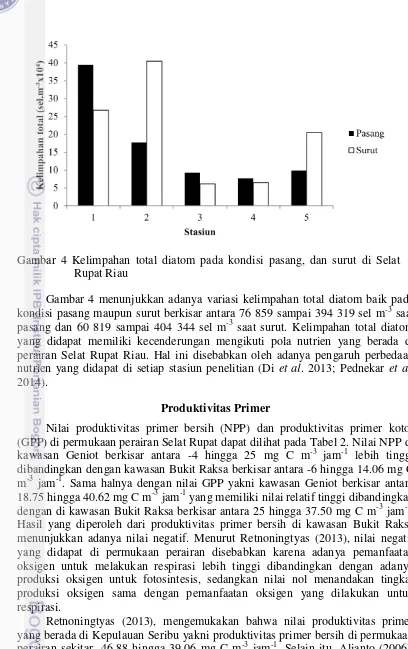
Gambar 4 menunjukkan adanya variasi kelimpahan total diatom baik pada kondisi pasang maupun surut berkisar antara 76 859 sampai 394 319 sel m-3 saat pasang dan 60 819 sampai 404 344 sel m-3 saat surut. Kelimpahan total diatom yang didapat memiliki kecenderungan mengikuti pola nutrien yang berada di perairan Selat Rupat Riau. Hal ini disebabkan oleh adanya pengaruh perbedaan nutrien yang didapat di setiap stasiun penelitian (Di et al. 2013; Pednekar et al. 2014).
Produktivitas Primer
Nilai produktivitas primer bersih (NPP) dan produktivitas primer kotor (GPP) di permukaan perairan Selat Rupat dapat dilihat pada Tabel 2. Nilai NPP di kawasan Geniot berkisar antara -4 hingga 25 mg C m-3 jam-1 lebih tinggi dibandingkan dengan kawasan Bukit Raksa berkisar antara -6 hingga 14.06 mg C m-3 jam-1. Sama halnya dengan nilai GPP yakni kawasan Geniot berkisar antara 18.75 hingga 40.62 mg C m-3 jam-1 yang memiliki nilai relatif tinggi dibandingkan dengan di kawasan Bukit Raksa berkisar antara 25 hingga 37.50 mg C m-3 jam-1. Hasil yang diperoleh dari produktivitas primer bersih di kawasan Bukit Raksa menunjukkan adanya nilai negatif. Menurut Retnoningtyas (2013), nilai negatif yang didapat di permukaan perairan disebabkan karena adanya pemanfaatan oksigen untuk melakukan respirasi lebih tinggi dibandingkan dengan adanya produksi oksigen untuk fotosintesis, sedangkan nilai nol menandakan tingkat produksi oksigen sama dengan pemanfaatan oksigen yang dilakukan untuk respirasi.
Retnoningtyas (2013), mengemukakan bahwa nilai produktivitas primer yang berada di Kepulauan Seribu yakni produktivitas primer bersih di permukaan perairan sekitar -46.88 hingga 39.06 mg C m-3 jam-1. Selain itu, Alianto (2006), melakukan penelitian yang sama mengenai produktivitas primer, namun berada di Teluk Banten yakni sekitar 14.15 hingga 29.59 mg C m-3 jam-1, di Pusat Samudera Arktik sebesar 15 g C m-2 yr-1 (Gosselin et al. 1997). Nilai produktivitas primer Gambar 4 Kelimpahan total diatom pada kondisi pasang, dan surut di Selat
bersih yang didapat dari berbagai penelitian memiliki nilai yang tidak terlalu jauh dengan penelitian yang dilakukan saat ini di Selat Rupat. Hal ini tidak terlepas dari keberadaan nutrien terlarut yang berada di permukaan perairan seperti ammonia, nitrat, dan silikat (Alianto 2006). Jika dibandingkan dengan daerah eutrofikasi seperti estuari di muara Sungai Neuse, produktivitas primer yang dihasilkan sebesar 360-531 g C m-2 yr-1 (Paerl et al. 1998), nilai PP yang diperoleh selama penelitian ini jauh lebih rendah.
Tabel 2 Nilai NPP dan GPP rata-rata di permukaan Selat Rupat Riau
Hari ke-
NPP Permukaan (mg C m-3 jam-1)
GPP Permukaan (mg C m-3 jam-1) Geniot Bukit Raksa Geniot Bukit Raksa
1 25.00 14.06 40.62 37.50
2 15.62 -6.25 23.43 25.00
3 -4.69 7.81 18.75 31.25
Estimasi produktivitas primer pada fitoplankton di daerah estuari umumnya berkisar antara 7-875 g C m-1 yr-1 (Underwood & Kromkamp 1999). Klasifikasi PP terbagi atas: oligotrofik (<100 g C m-2 yr-1), mesotrofik (100-300 g C m-2 yr-1), eutrofik (300-500 g C m-2 yr-1), dan hipertrofik (>500 g C m-2 yr-1) (Cloern et al. 2014). Perairan Selat Rupat dikategorikan sebagai perairan yang mesotrofik.
Kondisi Fisika Perairan
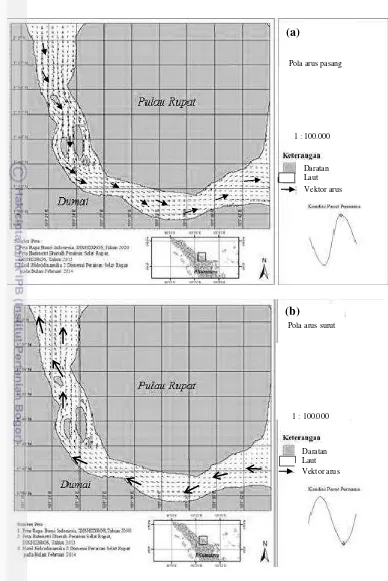
Gambar 5 Pola arus pada saat kondisi (a) menuju pasang (b) menuju surut (Tarigan et al. 2014)
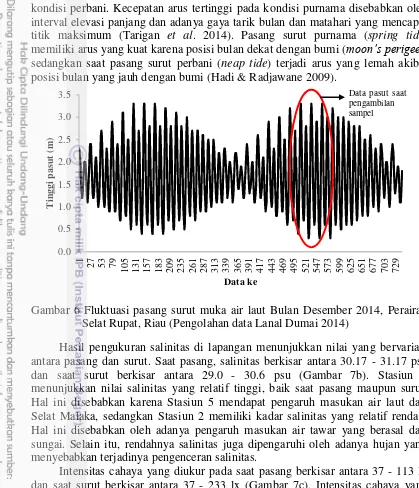
Gambar 6 menunjukkan bahwa adanya fluktuasi pola pasang surut muka air laut di Perairan Selat Rupat Riau berdasarkan data ramalan pasang surut yang diperoleh dari Lanal Dumai 2014 (Lampiran 7). Kecepatan arus yang terjadi saat penelitian dalam kondisi purnama, dimana arus maksimum mencapai 0.61 m s-1. Pada kondisi purnama, arus yang didapat lebih besar dibandingkan dengan
(a)
(b)
Daratan Laut Vektor arus 1 : 100.000 Pola arus pasang
Daratan Laut Pola arus surut
1 : 100.000
kondisi perbani. Kecepatan arus tertinggi pada kondisi purnama disebabkan oleh interval elevasi panjang dan adanya gaya tarik bulan dan matahari yang mencapai titik maksimum (Tarigan et al. 2014). Pasang surut purnama (spring tide) memiliki arus yang kuat karena posisi bulan dekat dengan bumi (moon’s perigee), sedangkan saat pasang surut perbani (neap tide) terjadi arus yang lemah akibat posisi bulan yang jauh dengan bumi (Hadi & Radjawane 2009).
Gambar 6 Fluktuasi pasang surut muka air laut Bulan Desember 2014, Perairan Selat Rupat, Riau (Pengolahan data Lanal Dumai 2014)
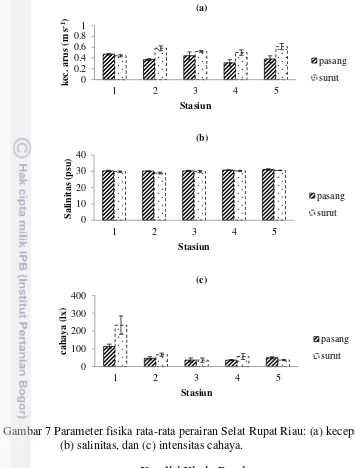
Hasil pengukuran salinitas di lapangan menunjukkan nilai yang bervariasi antara pasang dan surut. Saat pasang, salinitas berkisar antara 30.17 - 31.17 psu dan saat surut berkisar antara 29.0 - 30.6 psu (Gambar 7b). Stasiun 5 menunjukkan nilai salinitas yang relatif tinggi, baik saat pasang maupun surut. Hal ini disebabkan karena Stasiun 5 mendapat pengaruh masukan air laut dari Selat Malaka, sedangkan Stasiun 2 memiliki kadar salinitas yang relatif rendah. Hal ini disebabkan oleh adanya pengaruh masukan air tawar yang berasal dari sungai. Selain itu, rendahnya salinitas juga dipengaruhi oleh adanya hujan yang menyebabkan terjadinya pengenceran salinitas.
Intensitas cahaya yang diukur pada saat pasang berkisar antara 37 - 113 lx dan saat surut berkisar antara 37 - 233 lx (Gambar 7c). Intensitas cahaya yang tinggi pada Stasiun 1 dikarenakan kondisi pengambilan sampel yang cerah. Secara umum, intensitas cahaya matahari permukaan perairan ini tergolong rendah. Hal ini disebabkan oleh banyaknya muara sungai yang berada di sekitar pesisir Dumai, Riau dan dasar perairan gambut yang mengakibatkan perairan tersebut berwarna coklat dan keruh (Alkhatib et al. 2007).
Gambar 7 Parameter fisika rata-rata perairan Selat Rupat Riau: (a) kecepatan arus, (b) salinitas, dan (c) intensitas cahaya.
Kondisi Kimia Perairan
Parameter kimia perairan penting diukur untuk mengetahui bagaimana kondisi perairan yang berada di kawasan penelitian. Parameter kimia perairan seperti nitrat, fosfat, silikat, ammonia, logam berat Pb, minyak dan lemak memiliki nilai yang bervariasi (Lampiran 3).
Konsentrasi nitrat rata-rata di perairan selama penelitian berkisar 0.081 sampai 0.142 mg l-1 saat pasang dan 0.090 sampai 0.235 mg l-1 saat surut (Gambar 8a). Konsentrasi tersebut cenderung lebih tinggi dibandingkan dengan penelitian sebelumnya di perairan Selat Rupat yakni sebesar 0.045 mg l-1 (Alkhatib et al. 2007), sedangkan di Utara Laut Pasifik sebesar 0.000083 mg l-1 (Eppley et al. 1973). Saat surut konsentrasi nitrat di daerah penelitian cenderung relatih lebih tinggi daripada saat pasang. Perairan pasang biasanya diindikasikan dengan penambahan/masuknya air laut. Hal ini diduga berperan dalam mendilusi
konsentrasi nitrat, sebaliknya kondisi surut, terjadi penambahan/masuknya air tawar ke laut, sehingga input nitrat dari daratan sedikit meningkat. Konsentrasi nitrat yang tinggi saat surut diduga mengindikasikan adanya pasokan nutrien dari daratan yang berasal dari aktivitas antropogenik baik langsung maupun tidak langsung (Faizal et al. 2012). Nitrat dapat berasal dari penguraian bahan organik termasuk dalam limbah seperti adanya aktivitas pertanian dan tambak yang dapat menambah pasokan limbah dari buangan sisa pupuk dan sisa pakan tambak ke laut melalui aliran sungai (Huang et al. 2003). Pasokan nitrat di perairan Selat Rupat dapat diindikasikan oleh peningkatan nitrat di Stasiun 1 dan 2 yang merupakan area aktif dengan kegiatan tambak dan kawasan mangrove. Secara keseluruhan, wilayah penelitian mendapatkan pengaruh antropogenik, namun Stasiun 1 dan 2 diduga memberikan pengaruh yang signifikan terhadap peningkatan konsentrasi nitrat. Konsentrasi nitrat yang didapat berada dalam nilai yang wajar untuk mendukung pertumbuhan fitoplankton khususnya diatom yakni sebesar 0.01 hingga 1 mg l-1 (Agustiadi et al. 2013).
Konsentrasi fosfat rata-rata di perairan Selat Rupat berkisar 0.041 hingga 0.124 mg l-1 saat pasang dan 0.054 hingga 0.160 mg l-1 saat surut (Gambar 8b). Konsentrasi fosfat yang didapat di daerah penelitian tidak berbeda jauh dengan penelitian sebelumnya sebesar 0.056 mg l-1 (Alkhatib et al. 2007), kawasan Atlantik utara (0.011-0.045 mg l-1), dan Antartika (0.22 mg l-1) (Levitus et al. 1993). Konsentrasi fosfat yang tinggi di Stasiun 4 diduga karena kawasan tersebut berada pada kawasan padat akan industri, yakni: industri minyak, pelabuhan kapal dan aktivitas rumah tangga. Hal ini diduga bahwa aktivitas di daratan banyak membuang limbah ke perairan yang mengandung kadar fosfat. Menurut Purba dan Pranowo (2015), bahwa fosfat berasal dari pelapukan batuan yang terbawa oleh sungai, kegiatan pertanian, tambak, limbah industri atau bahkan dari aktivitas rumah tangga. Konsentrasi fosfat yang didapat selama penelitian lebih tinggi dari yang dibutuhkan oleh diatom pada umumnya sebesar <0.015 mg l-1 (Solihin et al.
2015). Kadar fosfat yang tinggi dapat memicu peningkatan populasi fitoplankton khususnya diatom di perairan (Pello et al. 2014).
akan digantikan oleh fitoplankton yang lebih berbahaya seperti dinoflagellata (Risamasu & Prayitno 2011).
Ammonia bersumber dari reduksi gas nitrogen yang berasal dari proses difusi udara atmosfer, dan limbah industri (Marpaung et al. 2015). Konsentrasi ammonia yang diperbolehkan untuk kehidupan biota laut khususnya diatom <0.3 mg l-1 (Simanjuntak 2009), namun rata-rata konsentrasi ammonia pada penelitian ini cenderung lebih tinggi yakni berkisar 0.092 hingga 0.599 mg l-1 saat pasang dan 0.161 hingga 0.724 mg l-1 saat surut (Gambar 8d). Kecenderungan konsentrasi ammonia yang tinggi pada Stasiun 5 diduga adanya aktivitas seperti industri pupuk. Konsentrasi ammonia yang tinggi disuatu perairan dapat menyebabkan penurunan oksigen terlarut dalam air yang dapat menimbulkan gangguan fungsi fisiologi serta metabolisme seperti respirasi (Zhang et al. 2012), disfungsi pada organel dan gangguan membran sel (Lage-Pinto et al. 2008), serta perubahan ukuran kloroplas yang semakin kecil, disorganisasi tilakoid yang menghambat proses fotosintesis (Kivimaenpaa et al. 2004).
Konsentrsi logam berat Pb terlarut di permukaan perairan Selat Rupat Riau menunjukkan nilai yang bervariasi dan tidak berbeda jauh dengan penelitian lainnya. Pb terlarut di daerah penelitian berkisar antara 0.0079 hingga 0.0093 mg l-1 saat pasang dan 0.0077 sampai 0.0089 mg l-1 saat surut (Gambar 8e). Penelitian lain menunjukkan nilai Pb terlarut di permukaan perairan berkisar 0.001 hingga 0.005 mg/l di Teluk Jakarta (Kusuma et al. 2014). Nilai konsentrasi Pb terlarut di permukaan perairan Selat Rupat Riau ini relatif lebih tinggi dibandingkan dengan penelitian lainnya. Sebaran Pb di lokasi penelitian terlihat cenderung tinggi pada Stasiun 4 dan 5 dibandingkan dengan Stasiun 1, 2, dan 3. Hal ini diduga adanya aktivitas pelabuhan dan industri minyak yang dapat memberikan kontribusi logam berat ke perairan. Aktivitas tersebut akan menyebabkan akumulasi logam berat yang semakin besar (Rochyatun & Razak 2007; Arifin & Fadhlina 2009; Shahi et al. 2015). Secara umum hasil penelitian menunjukkan bahwa sebaran Pb terlarut di daerah penelitian belum mampu menjelaskan secara rinci mengenai sumber logam berat tersebut di perairan Selat Rupat Riau, dimana kondisi permukaan laut bersifat dinamis yang dapat terjadi gangguan terhadap pengaruh hidro-oseanografi.
dekat dengan PT. PERTAMINA berkisar antara 6.92 sampai 12.17 mg l-1 saat pasang dan 6.17 hingga 15.42 mg l-1 saat surut (Nurrachmi & Amin 2013). Penelitian ini memiliki nilai kandungan minyak dan lemak yang tergolong rendah dibandingkan dengan penelitian sebelumnya. Hal ini disebabkan pada penelitian sebelumnya terjadi tumpahan minyak di sekitar kawasan tersebut, sehingga besar konsentrasi minyak dan lemak yang didapat. Semakin jauh dengan sumber limbah maka kandungan minyak dan lemak di perairan akan semakin menurun, begitu juga sebaliknya. Konsentrasi minyak dan lemak yang tinggi dapat menutupi intensitas cahaya matahari yang masuk ke perairan, sehingga dapat mengganggu proses fotosintesis yang dilakukan oleh diatom.
Gambar 8g memperlihatkan variasi rata-rata kandungan oksigen terlarut di daerah penelitian berkisar antara 5.6 - 6.8 mg l-1 saat pasang dan 5.2 sampai 6.6 mg l-1 saat surut. Keberadaan oksigen terlarut ditentukan dari proses difusi, turbulensi, dan biologi perairan (fotosintesis, dekomposisi) (Al-Hashmi et al. 2014). Stasiun 2 dan 4 terlihat sedikit lebih rendah daripada Stasiun 1, 3, dan 5. Hal ini diduga terdapat pengaruh terhadap pemanfaatan oksigen dalam proses biologi (dekomposisi) dari materi organik yang mungkin berada di sekitar pesisir.
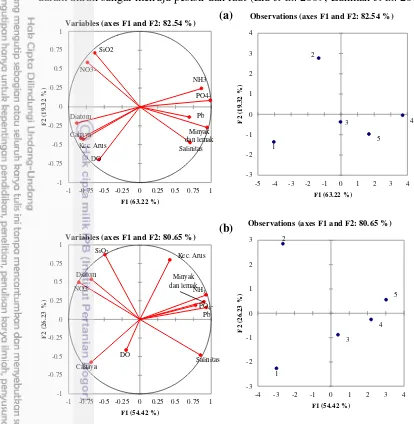
Keterkaitan Parameter Fisika Kimia Perairan dan Kelimpahan Diatom Hasil analisis komponen utama menunjukkan bahwa informasi yang menggambarkan korelasi antara parameter kimia perairan terhadap sebaran diatom di Selat Rupat saat pasang dan surut yang dibentuk oleh dua sumbu utama F1 dan F2 (Gambar 9). Hal ini mempunyai makna bahwa informasi didapatkan dari analisis yang menggunakan dua sumbu tersebut sebesar 82.54% saat pasang dan 80.65% saat surut dari total informasi.
Pada penelitian ini saat pasang, memiliki gambaran Stasiun 1 yang dicirikan oleh kelimpahan diatom, nitrat, cahaya matahari dan kecepatan arus, sedangkan saat surut dicirikan oleh kelimpahan diatom, nitrat dan intensitas cahaya matahari. Kelimpahan diatom akan meningkat seiring dengan peningkatan intensitas cahaya matahari yang masuk ke dalam perairan (Harrison 2000). Jika intensitas cahaya matahari rendah, maka akan mempengaruhi proses fotosintesa yang terjadi pada diatom. Stasiun 1 memiliki intensitas cahaya matahari yang relatif tinggi, yakni sebesar 110 lx, sehingga kelimpahan diatom yang didapat lebih banyak dibandingkan dengan stasiun lainnya. Konsentrasi nitrat yang tinggi menunjukkan adanya ketersediaan nitrogen yang melimpah bagi pertumbuhan dan perkembangbiakkan bagi fitoplankton khususnya diatom (Faizal et al. 2012). Saat pasang, arus yang didapat tergolong tinggi, karena berdekatan langsung dengan Selat Malaka. Arus pasang bergerak dari Utara (Selat Malaka) menuju Selatan yang masuk ke perairan Selat Rupat (Nedi et al. 2010; Tarigan et al. 2014)(Gambar 5a).
Stasiun 3 dicirikan oleh oksigen terlarut. Keberadaan oksigen terlarut ditentukan dari proses difusi, turbulensi, dan biologi perairan (fotosintesis, dekomposisi) (Al-Hashmi et al. 2014). Hal ini diduga terdapat pengaruh terhadap pemanfaatan oksigen dalam proses biologi (dekomposisi) dari materi organik yang mungkin berada di sekitar pesisir.
berasal dari hasil pelapukan mineral tanah yang mengandung silikat yang larut dalam aliran sungai menuju pesisir dan laut (Liu et al. 2009; Lukman et al. 2014).
Gambar 9 Analisis komponen utama (PCA) keterkaitan antara kelimpahan diatom dengan parameter fisika kimia perairan saat pasang (a), dan surut (b). Stasiun 4 dan 5 dicirikan oleh parameter fosfat, Pb, ammonia, salinitas, minyak dan lemak yang tinggi dibandingkan dengan stasiun lainnya baik saat pasang dan surut. Parameter tersebut memiliki korelasi yang negatif terhadap kelimpahan diatom. Korelasi antara sebaran diatom dengan parameter fisika kimia perairan (De Jonge et al. 2008) tidak terlepas pada pengaruh aktivitas masyarakat yang berada di Kota Dumai, seperti kawasan industri minyak kelapa sawit (CPO), dan kawasan pelabuhan yang dikelola oleh PT Pelabuhan Indonesia (BPTPM 2012). Aktivitas tersebut berkontribusi dalam membuang limbah ke laut. Industri minyak yang berada di kawasan tersebut diduga mempengaruhi organisme di perairan tersebut. Hal ini disebabkan adanya buangan limbah minyak yang berada di filem permukaan perairan akan menutupi intensitas cahaya matahari yang masuk ke perairan dan akan mengganggu proses fotosintesis dari diatom. Konsentrasi fosfat, dan ammonia disebabkan adanya proses eksresi oleh ikan
Diatom
Variables (axes F1 and F2: 82.54 %)
1
Observations (axes F1 and F2: 82.54 %)
Diatom
Variables (axes F1 and F2: 80.65 %)
1
Observations (axes F1 and F2: 80.65 %)
(a)
dalam bentuk feses, masukan limbah dari banyaknya aktivitas budidaya tambak, sehingga limbah tersebut dapat mengendap di dasar perairan dan terakumulasi di sedimen (Shahi et al. 2015). Ammonia yang tinggi yakni >0.3 mg l-1 dapat menyebabkan terjadinya kekeruhan pada perairan yang akan mengganggu masuknya cahaya matahari masuk ke perairan dan menghambat aktivitas fotosintesis pada diatom, dan dapat mengurangi konsentrasi oksigen terlarut, yang dapat menghambat proses nitrifikasi yang dimanfaatkan oleh bakteri pengurai (Harrison 2000). Kondisi tersebut akan bersifat anaerob dan mengganggu organisme tingkat tinggi untuk bernafas seperti ikan (Chakraborty et al. 2014).
Sebaran Jenis Diatom
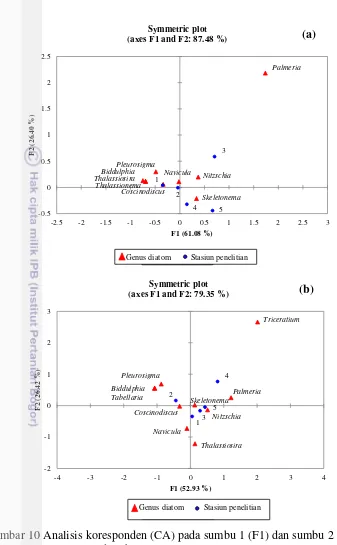
Hasil analisis koresponden (CA) menunjukkan adanya sebaran jenis diatom dan stasiun penelitian yang memberikan informasi distribusi terpusat pada sumbu F1 (61.08%), sumbu F2 (26.40%) saat pasang dan sumbu F1 (52.93%), sumbu F2 (26.42%) saat surut. Secara keseluruhan nilai ragam total dari data yang membentuk kedua sumbu sebesar 87.48% saat pasang (Gambar 10a) dan 79.35% saat surut (Gambar 10b).
Gambar 9a menunjukkan bahwa saat pasang, genus Biddulphia, Coscinodiscus, Pleurosigma, Thalassiosira, dan Thalassionema dicirikan oleh Stasiun 1 dan 2. Jenis tersebut memiliki kelimpahan tertinggi pada Stasiun 1 dan 2 (Gambar 3). Kelimpahan yang tinggi pada stasiun ini karena arus, cahaya nitrat, dan silikat yang cenderung tinggi dibandingkan dengan stasiun lainnya. Parameter tersebut dibutuhkan oleh jenis Biddulphia, Coscinodiscus, Thalassiosira, Pleurosigma, dan Thalassionema guna pertumbuhannya (Lueangthuwapranit et al. 2011), sehingga jenis diatom yang didapat pada stasiun ini cenderung tinggi dibandingkan dengan stasiun lainnya. Hal ini disebabkan oleh keberadaaan muara sungai dan kawasan mangrove yang kaya akan unsur hara, sehingga kelimpahan jenis diatom yang didapat melimpah.
Genus Palmeria tidak mengkarakteristikaan di stasiun manapun. Hal ini disebabkan oleh kelimpahan Palmeria yang tergolong rendah dan hanya ditemukan pada Stasiun 3. Selain itu, adanya arus juga dapat mempengaruhi genus
Palmeria yang kemungkinan terambil pada Stasiun 3.
Stasiun 3 dan 5 dikarakteristikkan dengan genus Nitzschia, dan
Skeletonema. Jenis ini mampu hidup di Stasiun 3, dan 5 yang memiliki konsentrasi ammonia, fosfat, Pb, salinitas, minyak dan lemak yang tergolong tinggi dibandingkan dengan stasiun lainnya. Nitzschia, dan Skeletonema, umumnya banyak ditemukan di kawasan tropis yang mampu beradaptasi pada salinitas yang tinggi (Yamada et al. 2013), seperti di Teluk Jakarta yang memiliki aktivitas antropogenik yang tinggi (Mulyani et al. 2012). Genus Nitzschia
merupakan jenis diatom yang berpotensi menyebabkan terjadinya HAB yang mengakibatkan masalah ASP (Amnesia Shellfish Poisoning) ke penderita (Hallegraeff 1993). Produksi toksin pada diatom merupakan cara diatom memproteksi dirinya dari predasi (Gleason et al. 2015). Skeletonema
Gambar 10 Analisis koresponden (CA) pada sumbu 1 (F1) dan sumbu 2 (F2) saat: (a) pasang, dan (b) surut.
Saat surut, genus Nitzschia, Palmeria, dan Skeletonema, dikarakteristikkan pada Stasiun 3, 4, dan 5 yang memiliki konsentrasi fosfat, ammonia, minyak, salinitas, dan Pb yang relatif tinggi dibandingkan stasiun lainnya (Gambar 9b). Jenis tersebut diduga mampu bertahan hidup pada tingginya parameter tersebut.
halnya dengan genus Tabellaria yang merupakan jenis diatom perairan tawar. Sungai akan membawa diatom tersebut ke muara sungai seiring dengan peningkatan nutrien yang didapat (Marlian et al. 2015).
Stasiun 1 dikarakteristikkan oleh genus Navicula, dan Thalassiosira yang memiliki konsentrasi nitrat, dan intensitas cahaya matahari yang cukup tinggi. Intensitas cahaya matahari yang cukup sangat dibutuhkan oleh diatom dalam menunjang kehidupannya yakni dalam proses fotosintesa.
Tidak berbeda jauh dengan genus Palmeria yang didapatkan saat pasang, genus Triceratium juga tidak mengkarakteristikan pada stasiun manapun. Hal ini diduga pada saat pengambilan sampel, genus Triceratium banyak didapatkan hanya pada Stasiun 4, namun kelimpahan yang diperoleh tergolong rendah.
Hasil analisis koresponden (CA) yang dilakukan selama penelitian menunjukkan adanya variasi jenis diatom yang didapat setiap stasiunnya baik saat pasang maupun surut, sehingga jenis diatom yang didapat memiliki perannya masing-masing dalam mengkarakteristikkan setiap stasiunnya dengan beradaptasi pada kondisi lingkungan perairan.
4
SIMPULAN DAN SARAN
Simpulan
Sebaran diatom di perairan Selat Rupat Riau bervariasi di setiap stasiun penelitian dengan genus Coscinodiscus dan Skeletonema yang ditemukan tertinggi baik saat pasang maupun surut. Sebaran datom sangat berkaitan dengan konsentrasi nitrat, intensitas cahaya dengan mengikuti pola dinamika massa air Selat Rupat khususnya pasang dan surut.
Saran
DAFTAR PUSTAKA
Agustiadi T, Hamzah F, Trenggono M. 2013. Struktur komunitas plankton di Perairan Selat Bali. Omniakuatika. 12(17):1-8.
Al-Hashmi KA, Goes J, Claereboudt, Piontkovski, Al-Azri A, Smith SL. 2014. Variability of dinoflagellates and diatoms in the surface waters of Muscat, Sea of Oman: comparison between enclosed and open ecosystem. IJOO. 8(2):137-152.
Alianto. 2006. Produktivitas primer fitoplankton dan keterkaitannya dengan unsur hara dan cahaya di perairan Teluk Banten [tesis]. Bogor (ID): Institut Pertanian Bogor.
Alkhatib M, Jennerjahn T, Samiaji J. 2007. Biogeochemistry of the Dumai River estuary, Sumatra, Indonesia, a tropical black‐water river. Limnol and Oceanog. 52(6): 2410-2417.
APHA. 2005. Standard methods for the examination of water and waste water. American Public Health Association, American Water Works Association, and Water Pollution Control Federation. 21th edition. Washington DC (USA).
Arifin Z, Fadhlina D. 2009. Fraksinasi logam berat Pb, Cd, Cu dan Zn dalam sedimen dan bioavailibitasnya bagi biota di perairan Teluk Jakarta. JIK.
14(1): 27-32.
Asriyana, Yuliana. 2012. Produktivitas perairan. Jakarta (ID):Bumi Aksara. Badrun Y. 2008. Analisis kualitas perairan Selat Rupat sekitar aktivitas industri
minyak bumi Kota Dumai. JIL. 2(1):17-25.
Beardall J, Young E, Roberts S. 2001. Approaches for determining phytoplankton nutrient limitation. Aquat sci. 63(1):44-69
Bengen DG. 2000. Teknik pengambilan contoh dan analisis data biofisik sumberdaya pesisir. Bogor (ID): Pusat Kajian Sumber Daya Pesisir dan Laut. Institut Pertanian Bogor.
BPTPM (Badan Pelayanan Terpadu dan Penanaman Modal Kota Dumai). 2012.
Potensi dan peluang investasi Kota Dumai. Dumai (ID): Dumai Indonesia. Chakraborty A, Padmavati G, Ghosh AK. 2014. Tidal variation of phytoplankton
in the coastal waters of South Andaman, India. JEB. 36: 207-214.
Cloern JE, Foster SQ, Kleckner AE. 2014. Phytoplankton primary production in
the world’s estu rine-coastal ecosystems. Biogeosciences. 11:2477-2501.doi:10.5194/bg.11.2477.2014.
Davis C. 1955. The marine and freshwater plankton. Chicago (USA): Michigan State University Press.
De Jonge M, Van de Vijver B, Blust R, Bervoests L. 2008. Responses of aquatic organisms to metal pollution in a lowland river in Flanders: a comparison of diatoms and macroinvertebrates. Sci Tot Environ. 407(1):615-629. Di B, Liu D, Wang Y, Dong Z, Li X, Shi Y. 2013. Diatom and silicoflagellate
assemblages in modern surface sediments associated with human activity: a case study in Sishili Bay, China. Ecol Indicat. 24:23-30.
Faizal A, Nessa N, Jompa J, Rani C. 2012. Dinamika spasio-temporal tingkat kesuburan perairan di kepulauan Spermonde, Sulawesi Selatan. Seminar Nasional Tahunan IX Perikanan dan Kelautan; 2012 Juli 14; Yogyakarta, Indonesia. Yogyakarta (ID): Semnaskan UGM.
Fehling J, Davidson K, Bolch CJ, Brand TD, Narayanaswamy BE. 2012. The relationship between phytoplankton distribution and water column characteristics in North West European shelf sea waters. Plos ONE.
7(3):1-16. doi: 10.1371/journal.pone.0034098.
Gleason FH, Jephcott TG, Küpper FC, Gerphagnon M, Sime-Ngando T, Karpov SA, Guillou L, van Ogtrop FF. 2015. Potential roles for recently discovered chytrid parasites in the dynamics of harmful algal blooms.
Fung Biol Rev. 29(1):20-33.
Gosselin M, Levasseir M, Wheeler PA, Horner RA, Booth BC. 1997. New measurements of phytoplankton and ice algal production in the Arctic Ocean. Deep-Sea Res II. 44(8): 1623-1644.
Gudmundsdottir R, Palsson S, Hannesdottir ER, Olafsson JS, Gislason GM, Moss B. 2013. Diatoms as indicators: The influences of experimental nitrogen enrichment on diatom assemblages in sub-Arctic streams. Ecol Indicat.
32:74-81.doi: 10.1016/j.ecolind.2013.03.015.
Hadi S, Radjawane IM. 2009. Arus laut. Bandung (ID): Institut Teknologi Bandung
Hallegraeff GM. 1993. A review of harmful algal blooms and their apparent global increase. Phycologia. 32(2):79-99.
Harrison PJ. 2000. Dynamics of nutrients and phytoplankton biomass in the Pearl River estuary and adjacent waters of Hongkong during Summer:preliminary evidence for phosphorous and silicon limitation. Mar Ecol Prog Ser. 194:295-305.
Hasle GR, Syvertsen EE, Steidinger KA, Tangen K. 1996. Identifying marine diatoms and dinoflagellates. San Diego (USA): Academic Press, Inc. Hatta M, Kaswadji RF, Purba M, Monintja DR. 2010. The relationship of
phytoplankton abundance and environment parameters in Barru Regency Coastal Water, Makassar Strait. Di dalam: Forum Pasca Sarjana.
Huang XP, Huang LM, Yue WZ. 2003. The characteristics of nutrients and eutrophication in the Pearl River estuary, South China. Mar poll bull. 47: 30-36.
Hutagalung, 1991. Pencemaran Laut oleh Logam Berat. Jakarta (ID): Puslitbang Oseanology-LIPI.
Kawaroe M, Prartono T, Sunuddin A, Sari D, Augustine D. 2010. Mikroalgae. Bogor (ID): PT. Penerbit IPB Press.
Kelly M, Juggins S, Guthie R, Pritchard S, Jamieson J, Rippey B, Hirst H, Yallop M. 2007. Assessment of ecological status in UK rivers using diatoms. Fresh Biol. 53:403-422. doi:10.1111/j.1365-2427.2007.01903.x.
Koppen JD. 1973. Distribution of the species of the diatom genus Tabellaria in a portion of the north-central United States [dissertations]. United Stated (US): Iowa State University.
Kusuma AH, Prartono T, Atmadipoera AS, Arifin T. 2014. Sebaran polutan logam berat terlarut dan sedimen di perairan Teluk Jakarta. Dalam: Dinamika Teluk Jakarta analisis prediksi dampak pembangunan tanggul laut Jakarta (Giant SeaWall). Jakarta (ID): IPB Press.
Lage-Pinto F, Oliveira JG, Cunha MD, Souza CMM, Rezende CE, Azevedo RA,
Vitori . 2008. Chlorophyll fluorescence nd ultr structur l ch nges
in chloroplast of water hyacinth as indicators of environmental stress.
Environ Exp Bot. 64:307–313. doi:10.1016/j.envexpbot.2008.07.007 Levitus S, Conkright ME, Reid JL, Najjar RG, Mantyla A. 1993. Distribution of
nitrate, phosphate and silicate in the world ocean. Prog Oceanog. 31:245-273.
Liu SM, Hong GH, Zhang J, Ye XW, Jiang XL. 2009. Nutrient budgets for large Chinese estuaries. Biogeosciences. 6:2245-2263.
Lueangthuwapranit C, Sampantarak U, Wongsai S. 2011. Distribution and abundance of phytoplankton: Influence of salinity and turbidity gradients in the Na Thap River, Songkhla Province, Thailand. JCOASTRES. 27(3):585-594.doi:10.2112/JCOASTRES.d.10.00123.1.
Lukman M, Nasir A, Amri K, Tambaru R, Hatta M, Nurfadilah, Noer RJ. 2014. Silikat terlarut di perairan pesisir Sulawesi Selatan. JITKT. 6(2):461-478. Lovadi I, Andriani S, Setyawati TR. 2015. Kelimpahan dan sebaran horisontal
fitoplankton di perairan Muara Sungai Kakap Kabupaten Kubu Raya.
Protobiont. 4(1):29-37.
Madhavi K, Gowda G, Jayaraj E, Lakshmipathi M, Sree CS. 2014. Distribution of diatoms in Riverine, Estuarine and Coastal Waters off Mangalore, Karnataka. JAIR. 3(3):142-147.
Marlian N, Damar A, Effendi H. 2015. Distribusi horizontal klorofil-a fitoplankton sebagai indikator tingkat kesuburan perairan di Teluk Meulaboh Aceh Barat. JIPI. 20(3):272-279.doi:10.18343/jipi.20.3.272. Marpaung FF, Pranowo WS, Purba NP, Yuliadi LPS, Syamsudin ML, Setyawidati
NAR. 2015. Kondisi perairan Teluk Ekas Lombok Timur pada musim peralihan. Akuatik. 6(2): 198-205.
Mukherjee A, Basu A, Chakraborty S, Das S, De TK. 2013. Salinity might be the most influential governing factor of cell surface size of Coscinodiscus in well mixed tropical estuarine waters. IJLSER. 1(2):81-90. E-ISSN:2321-1229.
Nontji A. 2007. Laut nusantara. Jakarta (ID): Penerbit Djambatan. Nontji A. 2008. Plankton laut. Jakarta (ID): LIPI Press.
Nurrachmi I, Amin B. 2013. Studi kandungan minyak dan struktur komunitas makrozoobenthos di perairan sekitar buangan limbah cair kilang minyak Pertamina UP II Dumai. JPK. 12(01):64-70.
Ozdemir GP, Orhan AK. 2012. Qualitative and quantitative changes of phytoplankton in the South East Black Sea (Trabzon Coast). Yunus Arast Bulten. 4: 13-25.
Pearl HW, Pinckney JL, Fear JM, Peierls BL. 1998. Ecosystem responses to internal and watershed organic matter loading: consequences for hypoxia in the eutrophying Neuse River Estuary, North Carolina, USA. Mar Ecol Prog Ser. 166:17-25.
Pednekar SM, Kerkar V, Matondkar SGP. 2014. Spatiotemporal distribution in phytoplankton community with distinct salinity regimes along the Mandovi estuary, Goa, India. Turkish J Bot. 38(4):800-818.
Pello F, Adiwilaga E, Huliselan N, Damar A. 2014. Effect of seasonal on nutrient load input the inner Ambon Bay. Bumi Lestari. 14(1):63-73.
Potapova M, Charles DF. 2007. Diatom metrics for monitoring eutrophication in rivers of the United States. Ecol Indicat. 7(1):48-70.
Purba NP, Pranowo WS. 2015. Dinamika oseanografi, deskripsi karakteristik massa air dan sirkulasi laut. Sumedang (ID): UNPAD Press.
Retnoningtyas H. 2013. Study of microphytobenthos primary productivity in Pulau Lancang, Kepulauan Seribu [tesis]. Bogor (ID): Institut Pertanian Bogor.
Risamasu FJ, Prayitno HB. 2011. Kajian zat hara fosfat, nitrit, nitrat dan silikat di Perairan Kepulauan Matasiri, Kalimantan Selatan. IJMS. 16(3):135-142. Rochyatun E, Rozak A. 2007. Pemantauan kadar logam berat dalam sedimen di
perairan Teluk Jakarta. Makara Sains. 11(1):28-36.
Sahu G, Satpathy K, Mohanty A, Sarkar S. 2012. Variations in community structure of phytoplankton in relation to physicochemical properties of coastal waters, southeast coast of India. IJGMS. 41(3):223.
Shahi N, Godhe A, Mallik SK, Härnström K, Nayak BB. 2015. The relationship between variation of phytoplankton species composition and physico-chemical parameters in northern coastal waters of Mumbai, India. IJGMS.
44:1-12.
Simanjuntak M. 2009. Hubungan faktor lingkungan kimia, fisika terhadap distribusi plankton di perairan Belitung Timur, Bangka Belitung. J Fish Sci. XI(1):31-45.ISSN:0853.6384.
Siregar SH, Mulyadi A, Hasibuan OJ. 2008. Struktur komunitas diatom epilitik (Bacillariophyceae) pada lambung kapal di Perairan Dumai Provinsi Riau.
J Environ Sci. 2(2):33-47.
Solihin A, Hasani Q, Yulianto H. 2015. Hubungan perubahan kualitas air dan pertumbuhan fitoplankton berbahaya pada lingkungan budidaya ikan di Perairan Ringgung Teluk Lampung. Aquasains. 3(2):289-296.
Tarigan TA, Prasetyawan IB, Wulandari SY. 2014. Studi pola sebaran tumpahan minyak dengan aplikasi model hidrodinamika dan spill analysis
Underwood GJC, Kromkamp J. 1999. Primary production of phytoplankton and microphytobenthos in estuaries. San Diego (USA): Academic Press, Inc. Wu N, Schmalz B, Fohrer N. 2011. Distribution of phytoplankton in a German
lowland river in relation to environmental factors. J Plankton res. 33(5):807-820.doi:10.1093/plankt/fbq139.
Yamada M, Otsubo M, Tsutsumi Y, Mizota C, Iida N, Okamura K, Kodama M, Umehara A. 2013. Species diversity of the marine diatom genus Skeletonema in Japanese brackish water areas. Fish Sci. (2013)79:923-934.doi:10.1007/s12562.013.0671.0.
Yamaji I. 1966. Illustration of marine plankton of Japan. Osaka (Japan): Hoikusha Publishin Co. Ltd.
Yerli SV, Kıvr k E, Gürbüz H, M n v E, M ngıt F, Türkec n . 2012. Phytoplankton community, nutrients and chlorophyll a in Lake Mogan (Turkey); with comparison between current and old data. Turkish J Fish and Aquat Sci. 12(1):95-104.
Zhang JY, Ni WM, Zhu YM, Pan YD. 2012. Effects of different nitrogen species on sensitivity and photosynthetic of three common freshwater diatoms.
Aquat Ecol. (2013)47:25-35.doi:10.1007/s10452.012.9422.z.
Lampiran 1 Dokumentasi kondisi perairan pada masing-masing stasiun penelitian
Stasiun 1 (Penempul) Stasiun 2 (Geniot)
Stasiun 3 (Lubuk Gaung) Stasiun 4 (Bukit Raksa)
Lampiran 2 Alat dan bahan yang digunakan selama penelitian
Plankton net Water sampler Current meter
Lux meter Lugol Botol terang-gelap
Lampiran 3 Parameter fisika kimia perairan pada saat pasang dan surut Pasang
Stasiun Substasiun Diatom NO3- PO4- SiO2 NH3 Pb Minyak dan lemak Cahaya DO Salinitas Arus
1
1.1 433083 0.075 0.020 0.068 0.082 0.007 0.097 100 6.9 31 0.5
1.2 388972 0.071 0.055 0.061 0.096 0.009 0.075 100 6.7 29.5 0.45
1.3 360902 0.217 0.049 0.063 0.096 0.008 0.089 140 6.8 30.5 0.46
2
2.1 172431 0.063 0.124 0.086 0.625 0.008 0.154 30 5.8 30 0.4
2.2 216541 0.083 0.051 0.078 0.177 0.008 0.124 60 5.7 30.5 0.35
2.3 140351 0.279 0.044 0.061 0.476 0.009 0.098 50 6 30 0.35
3
3.1 116291 0.083 0.099 0.068 0.184 0.007 0.493 30 6.3 31 0.3
3.2 92231 0.079 0.060 0.056 0.450 0.010 0.276 20 6.3 30 0.53
3.3 70175 0.100 0.069 0.053 0.454 0.007 0.297 60 6.4 30 0.5
4
4.1 100251 0.083 0.133 0.056 0.695 0.009 0.680 30 5.8 31 0.2
4.2 52130 0.067 0.159 0.053 0.319 0.010 0.346 40 5.5 31 0.34
4.3 78195 0.092 0.080 0.053 0.529 0.010 0.427 40 5.6 30.5 0.4
5
5.1 130326 0.113 0.129 0.061 0.695 0.009 0.523 60 6.2 30.5 0.35
5.2 76190 0.083 0.086 0.058 0.249 0.009 0.385 50 6.8 31 0.3
Lampiran 3 (Lanjutan) Surut
Stasiun Substasiun Diatom NO3- PO4- SiO2 NH3 Pb Minyak dan lemak Cahaya DO Salinitas Arus
1
1.1 431078 0.283 0.029 0.053 0.168 0.008 0.077 330 6.4 30.5 0.46
1.2 152381 0.142 0.071 0.056 0.182 0.007 0.061 150 6.7 30 0.4
1.3 218546 0.067 0.062 0.058 0.131 0.008 0.068 220 6.7 29 0.46
2
2.1 487218 0.275 0.055 0.071 0.503 0.010 0.443 70 5.7 28 0.5
2.2 336842 0.254 0.065 0.189 0.215 0.007 0.182 50 5.6 29 0.59
2.3 388972 0.175 0.058 0.101 0.335 0.007 0.098 80 5.8 30 0.65
3
3.1 42105 0.075 0.042 0.058 0.441 0.007 0.662 30 5.9 31 0.5
3.2 100251 0.113 0.055 0.056 0.300 0.008 0.243 20 5.8 29 0.52
3.3 40100 0.104 0.044 0.053 0.511 0.009 0.181 60 6.5 30 0.55
4
4.1 96241 0.094 0.099 0.061 0.466 0.008 0.514 40 5.1 31 0.4
4.2 22055 0.088 0.087 0.056 0.654 0.009 0.339 40 5.2 30 0.55
4.3 76190 0.096 0.110 0.063 0.511 0.009 0.687 90 5.2 30 0.55
5
5.1 268672 0.092 0.143 0.058 0.800 0.010 0.661 30 6.7 30.5 0.5
5.2 186466 0.088 0.193 0.066 0.398 0.008 0.312 40 6.6 30.8 0.65
Lampiran 4 Kelimpahan jenis diatom di lokasi penelitian pada saat pasang dan surut (sel m-3) Pasang
Stasiun
Sub-Stasiun Biddulphia Coscinodiscus Nitzschia Pleurosigma Skeletonema Thalassiosira Navicula Palmeria Thalassionema
1
1.1 4010 182456 36090 24060 130326 16040 10025 0 30075
1.2 10025 190476 24060 8020 142356 6015 8020 0 0
1.3 10025 218546 18045 18045 46115 18045 14035 0 18045
2
2.1 2005 30075 28070 12030 88221 0 4010 0 8020
2.2 0 140351 34085 0 22055 6015 14035 0 0
2.3 4010 50125 16040 0 66165 0 0 0 4010
3
3.1 0 24060 10025 6015 68170 0 0 8020 0
3.2 0 6015 44110 0 18045 0 12030 12030 0
3.3 0 30075 0 0 36090 0 0 4010 0
4
4.1 0 20050 0 0 70175 0 10025 0 0
4.2 0 30075 0 0 14035 0 8020 0 0
4.3 0 36090 0 0 42105 0 0 0 0
5
5.1 0 22055 12030 0 96241 0 0 0 0
5.2 0 10025 16040 0 50125 0 0 0 0
5.3 0 0 18045 0 70175 0 0 0 0
Lampiran 4 (Lanjutan) Surut
Stasiun Stasiun Biddulphia Coscinodiscus Nitzschia Pleurosigma Skeletonema Thalassiosira Tabellaria Navicula Palmeria Triceratium
1
1.1 0 164411 88221 0 136341 0 0 42105 0 0
1.2 0 56140 20050 0 66165 10025 0 0 0 0
1.3 0 70175 46115 0 82206 2005 0 18045 0 0
2
2.1 0 210526 18045 48120 196491 0 8020 6015 0 0
2.2 6015 170426 36090 4010 96241 0 24060 0 0 0
2.3 0 178446 12030 36090 142356 0 4010 16040 0 0
3
3.1 0 2005 16040 0 24060 0 0 0 0 0
3.2 0 18045 12030 0 62155 0 0 8020 0 0
3.3 0 8020 4010 0 28070 0 0 0 0 0
4
4.1 0 16040 36090 0 36090 0 0 0 4010 4010
4.2 0 0 6015 0 8020 0 0 0 0 8020
4.3 0 8020 8020 6015 48120 0 0 0 2005 4010
5
5.1 0 46115 76190 0 136341 0 0 0 10025 0
5.2 0 70175 24060 0 68170 0 0 0 24060 0
Lampiran 5 Gambar genus diatom yang didapat selama penelitian
Biddulphia Coscinodiscus
Navicula Nitzschia
Palmeria Pleurosigma
Skeletonema Tabellaria
0.01µm 0.01µm
0.01µm 0.01µm
0.01µm 0.01µm
Lampiran 5 (Lanjutan)
Thalassionema Thalassiosira
Triceratium
0.01µm 0.01µm
Lampiran 6 Matriks korelasi PCA Saat Pasang
Correlation matrix (Pearson (n)):
Variables Diatom NO3- PO4- SiO2 NH3 Pb
Minyak dan
lemak Cahaya DO Salinitas Arus
Diatom 1 0.130 -0.588 0.381 -0.630 -0.157 -0.642 0.837 0.490 -0.250 0.347
NO3- 0.130 1 -0.359 -0.105 -0.046 -0.027 -0.313 0.353 0.088 -0.207 -0.008
PO4- -0.588 -0.359 1 -0.103 0.463 0.385 0.684 -0.530 -0.559 0.210 -0.587
SiO2 0.381 -0.105 -0.103 1 -0.156 -0.330 -0.420 0.066 -0.063 -0.097 -0.025
NH3 -0.630 -0.046 0.463 -0.156 1 0.074 0.458 -0.607 -0.302 0.251 -0.101
Pb -0.157 -0.027 0.385 -0.330 0.074 1 0.189 -0.141 -0.355 -0.260 -0.198
Minyak dan
lemak -0.642 -0.313 0.684 -0.420 0.458 0.189 1 -0.555 -0.324 0.366 -0.621
Cahaya 0.837 0.353 -0.530 0.066 -0.607 -0.141 -0.555 1 0.558 -0.180 0.348
DO 0.490 0.088 -0.559 -0.063 -0.302 -0.355 -0.324 0.558 1 0.155 0.490
Salinitas -0.250 -0.207 0.210 -0.097 0.251 -0.260 0.366 -0.180 0.155 1 -0.202
Arus 0.347 -0.008 -0.587 -0.025 -0.101 -0.198 -0.621 0.348 0.490 -0.202 1
Lampiran 6 (Lanjutan) Saat surut
Correlation matrix (Pearson (n)):
Variables Diatom NO3- PO4- SiO2 NH3 Pb
Minyak dan
lemak Cahaya DO Salinitas Arus
Diatom 1 0.825 -0.183 0.397 -0.264 -0.061 -0.299 0.420 0.180 -0.426 -0.153
NO3- 0.825 1 -0.453 0.492 -0.372 -0.223 -0.335 0.410 -0.071 -0.461 -0.127
PO4- -0.183 -0.453 1 -0.121 0.545 0.453 0.345 -0.407 0.111 0.395 0.168
SiO2 0.397 0.492 -0.121 1 -0.292 -0.506 -0.189 -0.151 -0.250 -0.336 0.144
NH3 -0.264 -0.372 0.545 -0.292 1 0.720 0.545 -0.568 -0.166 0.297 0.289
Pb -0.061 -0.223 0.453 -0.506 0.720 1 0.458 -0.246 -0.070 -0.012 0.037
Minyak dan
lemak -0.299 -0.335 0.345 -0.189 0.545 0.458 1 -0.522 -0.404 0.288 -0.166
Cahaya 0.420 0.410 -0.407 -0.151 -0.568 -0.246 -0.522 1 0.383 -0.066 -0.448
DO 0.180 -0.071 0.111 -0.250 -0.166 -0.070 -0.404 0.383 1 0.083 0.009
Salinitas -0.426 -0.461 0.395 -0.336 0.297 -0.012 0.288 -0.066 0.083 1 -0.095
Arus -0.153 -0.127 0.168 0.144 0.289 0.037 -0.166 -0.448 0.009 -0.095 1