LINEARITAS DAN LIMIT DETEKSI
BIOSENSOR ARSEN DENGAN ELEKTRODE PASTA
KARBON TERMODIFIKASI ZEOLIT-Fe
ALI AULIA GHOZALI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi Linearitas dan Limit Deteksi Biosensor Arsen dengan Elektrode Pasta Karbon Termodifikasi Zeolit-Fe adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Ali Aulia Ghozali
ABSTRAK
ALI AULIA GHOZALI. Linearitas dan Limit Deteksi Biosensor Arsen dengan Elektrode Pasta Karbon Termodifikasi Zeolit-Fe. Dibimbing oleh DYAH ISWANTINI dan HENNY PURWANINGSIH.
Deteksi arsen dengan biosensor berbasis inhibisi enzim dapat menjadi alternatif metode analisis rutin mutu lingkungan akuatik. Biosensor dibuat dari elektrode pasta karbon yang termodifikasi zeolit-Fe dengan enzim piruvat dehidrogenase (PDH) sebagai agen pengenal hayati yang akan dihambat aktivitasnya oleh arsen. Hasil pengukuran biosensor dibandingkan dengan hasil pengukuran spektroskopi serapan atom (SSA). Linearitas dan nilai limit deteksi kedua metode dibandingkan. Hasil penelitian menunjukkan kinerja optimum biosensor didapat pada pH 7.00, suhu 33 °C, dan konsentrasi PDH 0.0142 U/mL. Linearitas terbaik didapat sebesar 97.70% pada rentang 2.50-20 ppb, sedangkan limit deteksi terbaik didapat sebesar 3.78 ppb. Nilai limit deteksi biosensor tersebut didapat lebih rendah dibandingkan nilai limit deteksi metode SSA sebesar 6.52 ppb. Uji data berpasangan menunjukkan tidak ada perbedaan yang nyata di antara kedua metode selang kepercayaan 95%. Reprodusibilitas fabrikasi biosensor masih rendah, sehingga perlu dilakukan peningkatan kinerja biosensor.
Kata kunci: elektrode pasta karbon, zeolit-Fe, biosensor, arsen, linearitas, limit deteksi
ABSTRACT
ALI AULIA GHOZALI. Linearity and Detection Limit of Arsenic Biosensor Fabricated from Carbon Paste Electrode Modified by Zeolite-Fe. Supervised by DYAH ISWANTINI and HENNY PURWANINGSIH.
Detection of arsenic using biosensor based on enzyme inhibition could be a routine alternative analysis method of aquatic environmental quality. Biosensors were fabricated from carbon paste electrode modified by zeolite-Fe with pyruvate dehydrogenase (PDH) enzyme as bioreceptor which was inhibited its activity by arsenic. Measurement results were compared to atomic absorption spectroscopy (AAS) measurement. Linearity and LOD value of both methods were compared. The results showed optimum performance of biosensor was at pH 7.00, 33 °C, and at PDH concentration of 0.0142 U/mL. The best linearity was around 97.70% in range of 2.50-20 ppb, meanwhile the best LOD achieved as low as 3.78 ppb.
Biosensor’s LOD was lower compared to AAS value of LOD measured as low as
6.52 ppb. Paired data test showed that there was no significant difference between the two methods at 95% confidence level. Reproducibility of fabricated biosensor was still low, hence it needs to enhance the biosensor performance.
© Hak Cipta milik IPB, tahun 2014
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
LINEARITAS DAN LIMIT DETEKSI
BIOSENSOR ARSEN DENGAN ELEKTRODE PASTA
KARBON TERMODIFIKASI ZEOLIT-Fe
ALI AULIA GHOZALI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Linearitas dan Limit Deteksi Pasta Karbon Biosensor
Arsen dengan Elektrode Pasta Karbon Termodifikasi Zeolit-Fe Nama : Ali Aulia Ghozali
NIM : G44100007
Disetujui oleh
Dr Henny Purwaningsih, MSi Pembimbing II
Prof Dr Dyah Iswantini Pradono, MSc Agr Pembimbing I
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
P
uji syukur penulis panjatkan kepada Allah SWT, atas berkat dan rahmat-Nya penulis dapat menyelesaikan laporan ilmiah yang berjudul “Linearitas dan Limit Deteksi Biosensor Arsen dengan Elektrode Pasta Karbon Termodifikasi Zeolit-Fe”. Laporan ilmiah ini penulis susun berdasarkan hasil penelitian yang penulis lakukan di Laboratorium Kimia Fisik dan Laboratorium Bersama, Departemen Kimia IPB.Penulis mengucapkan terima kasih kepada Prof Dr Dyah Iswantini Pradono, MSc Agr selaku pembimbing pertama, Dr Henny Purwaningsih S, MSi selaku pembimbing kedua, Prof Dr Purwatiningsih Sugita dan Dr Deden Saprudin MSi selaku penguji atas bimbingan, saran, serta kritik konstruktif selama proses penelitian dan penulisan karya ilmiah ini. Penulis mengucapkan terima kasih atas dukungan dari keluarga, segenap rekan, dan pihak terkait atas sokongan moral dan material serta semangat yang selalu diberikan kepada penulis.
Tiada gading yang tak retak, kritik serta saran atas penulisan karya ilmiah sangat penulis harapkan. Semoga karya ilmiah ini bermanfaat bagi pembaca. Akhir kata penulis ucapkan terima kasih.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR ISI xi
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Waktu dan Tempat Penelitian 2
METODE PENELITIAN 3
Alat dan Bahan 3
Metode 3
Preparasi dan Aktivasi Zeolit Alam 3
Penentuan Nilai Kapasitas Tukar Anion (KTA) Zeolit 3
Preparasi Elektrode Pasta Karbon 4
Pengaruh Komposisi Zeolit-Fe 4
Penentuan Kadar Fe Terjerap 4
Analisis SEM 4
Imobilisasi Enzim Piruvat Dehidrogenase pada Elektrode 5
Pengukuran Elektrokimia 5
Pencirian Elektrode 6
Linearitas 6
Limit Deteksi 6
Uji Data Berpasangan 6
HASIL DAN PEMBAHASAN 7
Preparasi, Aktivasi, Karakterisasi dan Identifikasi Zeolit 7 Elektrode Pasta Karbon Termodifikasi Zeolit-Fe 9
Optimasi Kinerja Biosensor Arsen 11
Biosensor Arsen 13
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
xii
DAFTAR GAMBAR
1 Reaksi dealuminasi zeolit dengan bantuan asam 7
2 Pengamatan visual zeolit 8
3 Hasil payaran SEM 9
4 Profil payaran voltamogram 6 EPK 10
5 Perbandingan profil arus voltamogram EPK dan EPK termodifikasi Fe 10
6 Plot kontur hasil optimasi 11
8 Profil voltamogram biosensor arsen 12
7 Mekanisme reaksi katalitik dan inhibisi enzim PDH 12 9 Kurva hubungan antara penurunan arus puncak terhadap konsentrasi arsen 13
10 Profil linearitas elektrode A, B, dan C 14
11 Kurva standar Fe dengan metode AAS 22
12 Profil voltamogram EPK termodifikasi zeolit-Fe 10 mg 23 13 Profil voltamogram EPK termodifikasi zeolit-Fe 15 mg 23 14 Profil voltamogram EPK termodifikasi zeolit-Fe 20 mg 23 15 Profil voltamogram EPK termodifikasi zeolit-Fe 25 mg 24 16 Grafik hubungan rerata arus puncak dengan jumlah zeolit-Fe dalam EPK 24 17 Profil arus puncak terhadap siklus pemayaran elektrode a 28 18 Profil arus puncak terhadap siklus pemayaran elektrode b 29 19 Profil arus puncak terhadap siklus pemayaran elektrode c 30
20 Profil linearitas elektrode a, b, dan c 31
21 Profil linearitas pengukuran As dengan AAS 33
DAFTAR LAMPIRAN
1 Diagram Alir Penelitian 19
2 Rancangan percobaan kombinasi 3 parameter dengan metode CCD 20
3 Nilai KTA Zeolit 21
4 Jumlah Fe terdsorpsi dalam zeolit 22
5 Profil hasil pemayaran EPK termodifikasi zeolit-Fe 23 6 Optimasi variabel pH, suhu, dan konsentrasi enzim 25
7 Regresi Response Surface Method 26
8 Data pembacaan arus oksidasi 3 elektrode 27
9 Perhitungan limit deteksi elektrode a, b, dan c 31 10 Perhitungan linearitas dan limit deteksi pengukuran As menggunakan AAS 33 11 Uji data berpasangan hasil pengukuran AAS dan biosensor arsen 35 12 Salinan Lampiran Permenkes No. 492/Menkes/Per/IV/2010 36
PENDAHULUAN
Latar Belakang
Arsen (As) adalah salah satu logam berat yang bersifat kontaminan dalam lingkungan akuatik. Logam ini dalam bentuk persenyawaannya banyak diaplikasikan pada bidang pertanian, medis, industri, furnitur, dan senjata. Keberadaan logam umumnya terdapat secara alami pada batuan beku. Namun, penggunaan senyawaan As secara intensif menyebabkan paparan As pada perairan menjadi cukup tinggi. Logam As memiliki efek toksik . Gejala-gejala yang ditimbulkannya berupa gangguan fungsi hati, sistem pernapasan, sistem endokrin, sistem syaraf, kulit, sistem hemopoitis, dan sistem kardiovaskuler (Widowati et al.
2008). Permenkes 492/Menkes/Per/IV/2010 memberikan batas minimum arsen dalam air minum 0.010 mg/L, sedangkan pada KepmenLH No. 51 tahun 2004 batas kadar arsen pada perairan laut sebesar 0.012 mg/L. Logam arsen bersifat toksik dan mampu memblokir jalur metabolisme tubuh. Oleh karena itu, deteksi keberadaan arsen sangat diperlukan untuk memonitor kualitas air lingkungan.
Untuk mendeteksi keberadaan As dalam sampel diperlukan suatu metode pengukuran yang cepat, akurat, presisi, dan sensitif. Beberapa metode yang dikembangkan antara lain teknik spektrofotometri (Agrawal et al. 1999) dan
Carbon Nano Tubes (CNTs) termodifikasi dengan platina (Daud et al. 2012). Metode-metode tersebut memiliki kelemahan sebab membutuhkan keahlian operator yang profesional, kurang portabel, dan waktu analisis yang relatif lama. Pengukuran menggunakan metode elektrokimia dengan elektrode biosensor memiliki potensi untuk dikembangkan dalam analisis pemantauan di lapangan secara rutin (Chaplin dan Bucke 1990).
Biosensor adalah alat deteksi yang memanfaatkan elemen-elemen biologis sebagai agen pengenal analit yang terkoneksi dengan transduser (Eggins 2002). Teknologi biosensor menyediakan kemudahan untuk analisis cepat, selektif, dan sensitif, sehingga dapat digunakan untuk keperluan analisis rutin. Salah satu prinsip teknologi biosensor adalah proses inhibisi aktivitas enzim. Inhibisi aktivitas enzim sebanding dengan konsentrasi substrat kompetitor yang menghalangi kinerja enzim sehingga, prinsip ini dapat digunakan untuk mengukur konsentrasi analit (dalam hal ini berupa polutan logam berat) dalam sampel. Aplikasi prinsip ini telah diterapkan pada pengukuran insektisida, pestisida, dan logam berat dengan biosensor (Souiru et al. 2009; Chauhan dan Pundir 2011; Shang et al. 2011). Hasil penelitian tersebut menunjukkan bahwa aplikasi biosensor sebagai metode deteksi logam berat untuk analisis cepat, selektif, dan akurat dapat menjadi alternatif pengembangan metode deteksi logam berat di lingkungan. Dengan demikian, penelitian ini akan diarahkan pada pengembangan metode deteksi dengan perangkat biosensor.
2
dimodifikasi, mudah dibuat, dan sensitif. Sehingga, banyak penelitian elektroanalisis yang memakai EPK sebagai elektrode kerja (Vytřas et al. 2009). Beberapa penelitian yang menggunakan EPK antara lain: parameter kinetika biosensor antioksidan dengan enzim SOD Deinococcus radiodurans (Trivadila 2011), biosensor kolesterol dengan mediator ferosena (Iswantini et al. 2009), dan sensor katekolamina dengan EPK termodifikasi Cu dan Ag (Sanghavi et al. 2013). Oleh karena itu, EPK digunakan sebagai alternatif elektrode yang ekonomis, cepat dipreparasi, dan mudah dibuat.
Biosensor arsen memiliki prinsip kerja biosensor berbasis inhibisi. Arsen akan menghambat aktivitas katalitik dari reaksi piruvat menjadi asetil-KoA dengan cara mengubah gugus ditiol pada kompleks enzim E2 menjadi bentuk
senyawa kompleks arsen (Voet, Voet 2010). Arsen berperan sebagai inhibitor nonkompetitif dengan menyerang gugus alosterik enzim. Penyerangan ini menyebabkan pengubahan struktur 3 dimensi enzim yang memperlambat kinerja katalitik enzim. Dengan mekanisme lain As menaikkan konsentrasi H2O2 yang
dapat menghambat kinerja PDH (Samikkanu et al. 2003).
Pengembangan elektrode sangat diperlukan untuk menghasilkan biosensor yang stabil dan memiliki kinerja yang baik. Salah satu matriks yang dapat dipakai untuk memodifikasi maupun sebagai tempat imobilisasi enzim adalah zeolit. Balal
et al. (2009) memaparkan bahwa modifikasi elektrode menggunakan zeolit dapat meningkatkan respon arus yang dihasilkan. Rocha et al. (2005) menemukan bahwa respon arus dan efisiensi pelekatan enzim tripsin pada zeolit NaY memiliki nilai yang paling baik di antara jenis zeolit sintetis NaX dan NaA. Penggunaan komposit zeolit dapat dilakukan untuk meningkatkan luas permukaan matriks pengimobilisasi, sehingga kapasitas imobilisasi akan meningkat. Diharapkan diperoleh respon arus yang baik dan aktivitas enzim terimobilisasi yang tinggi.
Tujuan Penelitian
Penelitian ini bertujuan membuat dan mengevaluasi linearitas dan limit deteksi biosensor As dengan enzim piruvat dehidrogenase sebagai agen pengenal hayati dengan zeolit-Fe sebagai matriks pemodifikasi sifat elektrode pasta karbon.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Januari hingga Juni 2014 di Laboratorium Kimia Fisik dan Laboratorium Terpadu Departemen Kimia Institut Pertanian Bogor (IPB).
Hipotesis
METODE PENELITIAN
Metode penelitian mengikuti diagram alir penelitian pada Lampiran 1. Metode penelitian dimulai dari tahap preparasi dan aktivasi zeolit, modifikasi zeolit dengan insersi Fe, karakterisasi zeolit yang digunakan, pembuatan EPK, uji hantar arus, imobilisasi enzim PDH, penentuan kondisi optimum kerja biosensor, dan penentuan limit deteksi serta linearitas.
Alat dan Bahan
Bahan-bahan pro analyst yang digunakan dalam penelitian ini adalah K3[Fe(CN)6] 0.1 mM, HCl (0.2, 3 M), NaOH (0.1 N), indikator fenolftalein,
EDTA 0.1 M, FeCl3·6H2O 0.1 M, enzim PDH dari hati sapi (Sigma Aldrich,
P7032), larutan substrat piruvat, As2O3 1000 ppb, AgNO3 0.1 M, dan larutan
dapar fosfat.
Bahan lainnya antara lain zeolit alam Cikalong, grafit, dan parafin cair. Sedangkan alat-alat yang digunakan selama proses penelitian antara lain kompartemen elektrode, mortar, membran dialisis, nilon, benang paranilon, pipet mikroliter, saringan 100 mesh, gelas piala, kertas minyak, dan seperangkat alat potensiostat/galvanostat eDAQ, AAS Shimadzu P-7000, dan komputer yang telah dipasang program pengolah data Echem v.2.1.0 serta MINITAB 16.
Metode
Preparasi dan Aktivasi Zeolit Alam (modifikasi SNI 13-3494-1994)
Zeolit alam dicuci, digerus, dan diayak dengan ayakan 100 mesh. Hasil ayakan kemudian dipanaskan dalam oven selama 3 jam pada suhu 300 °C. Zeolit lalu diaktivasi dengan cara asam. Sampel zeolit ditimbang sebanyak 100 g dan ditambah larutan 250 mL HCl 3.0 M. Campuran diaduk selama 60 menit disaring dan dibilas akuades hingga pH campuran netral. Zeolit kemudian dikeringkan dalam oven pada suhu 300 °C. Pencucian dihentikan bila tidak terbentuk endapan pada filtrat bila diteteskan AgNO3.
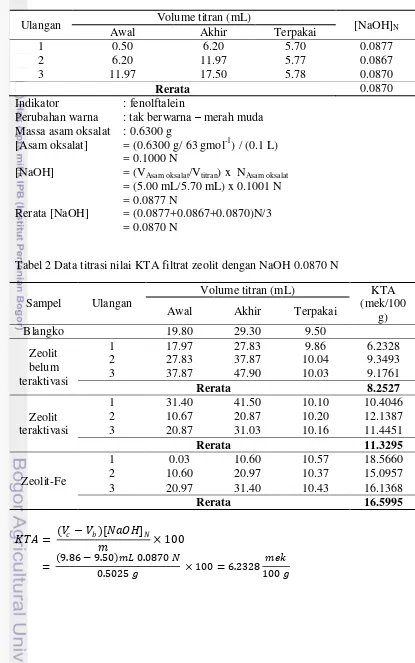
Penentuan Nilai Kapasitas Tukar Anion (KTA) Zeolit (modifikasi SNI 13-3494-1994)
Zeolit 0.5 g ditimbang dan dicampur dalam 100 mL HCl 0.2 M. Campuran kemudian diaduk selama 4 jam. Campuran disaring dan diambil filtratnya. Filtrat sebanyak 10 mL diambil dan ditempatkan dalam labu erlenmeyer. Filtrat lalu dititrasi dengan NaOH 0.1 N menggunakan indikator fenolftalein. Nilai KTA zeolit sebelum, setelah aktivasi, dan setelah insersi Fe dibandingkan. Nilai KTA dihitung berdasarkan rumus berikut:
4
Keterangan:
Vc : volume NaOH pada titrasi contoh (mL) Vb : volume NaOH pada titrasi blangko (mL) m : massa zeolit yang diuji (g)
[NaOH]N : konsentrasi NaOH (N)
Preparasi Elektrode Pasta Karbon
Satu gram zeolit yang telah diaktivasi direndam dalam FeCl3 0.01 M 250
mL dan diaduk selama 48 jam dengan bantuan pengaduk magnetik. Zeolit disaring dan dicuci dengan larutan HCl pH 2 dan air destilasi untuk menghilangkan ion klorida. Elektrode dipersiapkan dengan menggerus grafit dalam mortar. Serbuk grafit termodifikasi 55 mg kemudian dicampur dengan 35
μL parafin cair hingga merata. Zeolit yang telah termodifikasi Fe kemudian
dicampurkan bersama grafit lalu ditambahkan dietil eter 2 mL. Campuran kemudian diaduk hingga pelarut menguap (Balal et al. 2009).
Tabung kaca kemudian dimasukkan kawat tembaga berdiameter 3 mm sebagai penghubung elektrode dengan sumber arus listrik. Ruang sepanjang 5 mm disisakan pada ujung tabung sebagai tempat pasta karbon. Pasta karbon termodifikasi kemudian dimasukkan dalam elektrode hingga penuh, padat, dan rata. Kelebihan minyak parafin diserap dengan kertas minyak. Respon elektrode kemudian diamati dalam larutan K3[Fe(SCN)6] 1 mM dengan teknik voltametri
siklik. Kecepatan payaran yang ditetapkan sebesar 100 mVs-1 pada selang potensial 0.0 hingga 1.0 V (modifikasi Taufik 2013).
Pengaruh Komposisi Zeolit-Fe
Pengaruh komposisi zeolit-Fe diamati dengan mengukur arus puncak yang terukur. Zeolit-Fe sebanyak 10, 15, 20, dan 25 mg ditambahkan dalam campuran grafit dan parafin. Respon elektrode diamati dalam larutan K3[Fe(SCN)6] 1 mM
dengan teknik voltametri siklik dengan parameter kecepatan payaran dan selang potensial yang sama. Penambahan komposisi zeolit-Fe dengan respon arus terbaik dipilih sebagai kondisi pengukuran selanjutnya.
Penentuan Kadar Fe Terjerap (modifikasi Balal et al. 2009).
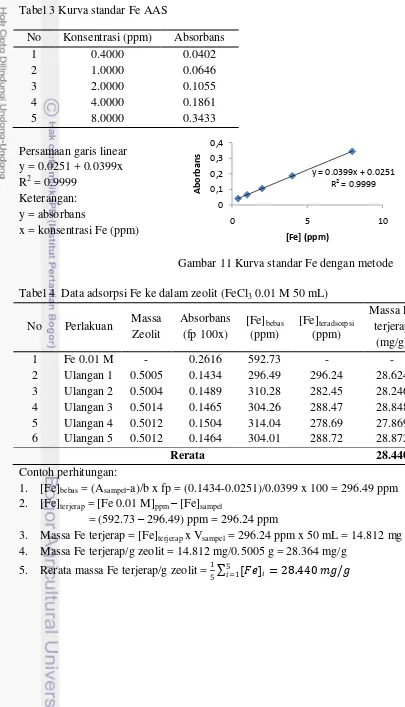
Sebanyak 0.5 g zeolit direndam dan diaduk dalam 50 mL FeCl3 0.01 M
selama 48 jam. Filtrat kemudian dipisahkan dan diencerkan 100 kali. Konsentrasi Fe bebas kemudian diukur menggunakan AAS. Larutan FeCl3 0.01 M tanpa
penambahan zeolit ditetapkan sebagai konsentrasi awal. Selisih pengukuran adalah kadar Fe yang telah terjerap dalam zeolit. Ulangan dilakukan 5 kali.
Analisis SEM
Imobilisasi Enzim Piruvat Dehidrogenase pada Elektrode (modifikasi Ikeda et al. 1998)
Larutan enzim PHD dengan konsentrasi tertentu diteteskan pada permukaan elektrode pasta karbon sebanyak 35 μL. Elektrode dibiarkan mengering dengan menguapnya pelarut. Ujung elektrode kemudian ditutup dengan membran dialisis, lalu jaring nilon, dan diikat dengan paranilon. Elektrode direndam dalam larutan dapar fosfat pH 7.4 kemudian dapat digunakan untuk pengukuran aktivitas PHD dengan metode elektrokimia.
Pengukuran Elektrokimia
Pengukuran elektrokimia voltametri siklik dilakukan dengan bantuan seperangkat alat potensiostat/galvanostat eDAQ dan komputer yang telah terpasang program pengolah data Echem v.2.1.0. Elektrode yang digunakan dalam penelitian ini adalah elektrode pasta karbon termodifikasi zeolit-Fe (elektrode kerja), elektrode Ag/AgCl (elektrode referensi), dan elektrode platina (elektrode pembantu). Parameter pengukuran pada program diatur sebagai berikut:
Mode : Cyclic
Dengan metode Response Surface Methodology: Central Composite Design
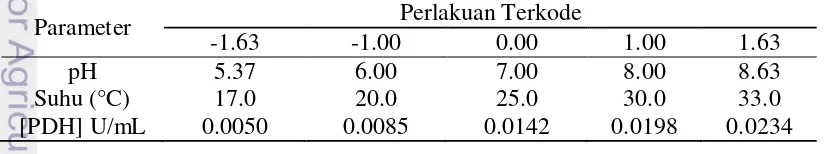
(RSM: CCD) kondisi optimum pengukuran logam arsen ditentukan. Kombinasi-kombinasi yang telah ditentukan dimasukkan ke dalam piranti lunak statistika MINITAB 14. Percobaan kemudian dilakukan sesuai dengan kombinasi yang telah diberikan. Terdapat 3 parameter yang diuji, yaitu: suhu, pH, dan konsentrasi enzim PDH. Perancangan ini digunakan untuk mencari nilai optimum aktivitas enzim PDH setelah diimobilisasi. Berikut di bawah ini adalah tabel perlakuan terkode antara pH dengan temperatur.
Larutan dapar fosfat dengan pH tertentu sebanyak 1.9 mL dan larutan PDH 0.0005 U/mL 100 μL ditambahkan ke dalam sel pengukuran. Puncak arus anode yang diamati ditetapkan sebagai blangko. Selanjutnya ditambahkan substrat piruvat 2.1 mM sebanyak 1 mL dan diukur perubahan arus puncak anode. (modifikasi Trivadilla 2011). Kombinasi rancangan antara pH dan suhu yang diterapkan ditulis pada Lampiran 2. Hasil kombinasi kemudian diplotkan terhadap arus yang dihasilkan membentuk kurva trimatra.
Tabel 1 Perlakuan terkode kondisi optimasi pengukuran
Parameter Perlakuan Terkode
-1.63 -1.00 0.00 1.00 1.63
pH 5.37 6.00 7.00 8.00 8.63
Suhu (°C) 17.0 20.0 25.0 30.0 33.0
6
Pencirian Elektrode
Biosensor yang telah dipersiapkan kemudian dikarakterisasi pada kondisi optimum pengukuran. Parameter karakterisasi yang digunakan adalah: linearitas dan limit deteksi (Nazaruddin 2007). Untuk menguji perbedaan kedua metode pengukuran, digunakan uji data berpasangan (Harvey 2000).
Linearitas (modifikasi Samphao et al. 2012)
Linearitas pengukuran diukur dengan mengukur respon tegangan terhadap logaritma konsentrasi As2O3 Konsentrasi masing-masing yang digunakan adalah:
0.63-30 μg/L sebanyak 1.00 mL. Larutan yang digunakan adalah larutan dapar dengan pH optimum, 1.00 mL piruvat 30 mM dan 100 μL enzim PDH 0.0005 U/mL. Setelah biosensor digunakan, elektrode direndam dalam EDTA 0.1 M selama 2-3 menit. Penurunan puncak arus anode kemudian diamati setelah arsen ditambahkan. Data kemudian diplot dalam kurva dengan sumbu-x adalah logaritma konsentrasi ion arsenit dan respon arus (mA) pada sumbu-y.
Limit Deteksi (Harmita 2004)
Limit deteksi diukur dengan rumus berikut
� � � �= 3 × �analit
Keterangan:
σanalit = simpangan baku respon analitik analit
b = kemiringan garis pada persamaan garis linear
Uji Data Berpasangan (Harvey 2000)
Pengukuran biosensor arsen dibandingkan dengan pengukuran AAS (Atomic Absorption Spectroscopy). Konsentrasi As2O3 yang terukur dalam rentang
linearitasnya dibandingkan dengan hasil pengukuran biosensor. Hasil data kemudian diuji secara statistik dengan metode uji data berpasangan pada selang kepercayaan 95%. Rumus yang digunakan:
=
�
Keterangan: t = nilai uji-t
= rerata perbedaan nilai dari kedua kelompok data N = jumlah data
HASIL DAN PEMBAHASAN
Preparasi, Aktivasi, Karakterisasi dan Identifikasi Zeolit
Zeolit alam Cikalong yang digunakan masih berbentuk bongkahan berwarna putih sedikit kehijauan dengan beberapa bintik kuning dan hijau. Tekstur zeolit alam Cikalong agak keras namun mudah hancur. Zeolit ini kemudian dibersihkan, dihancurkan dengan bantuan mortar, diayak dan disaring hingga 100 mesh untuk mendapatkan ukuran pori yang lebih seragam. Kandungan mineral zeolit yang dominan terdapat pada zeolit ini adalah modernit dengan sedikit pengotor berupa kuarsa (Wyantuti 2008).
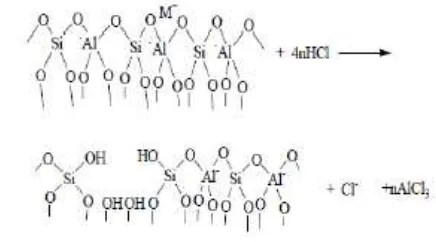
Zeolit alam Cikalong diaktivasi secara kimiawi dan fisis. Aktivasi bertujuan menghilangkan pengotor-pengotor mineral lain yang menyumbat pori-pori zeolit. Hilangnya pengotor menyebaban luas permukaan zeolit bertambah dan memiliki aktivitas adsorpsi yang lebih besar. Selama proses aktivasi zeolit, terjadi proses dealuminasi. Proses ini mengakibatkan Al dan beberapa logam pengotor lainnya keluar dari struktur rangka zeolit. Selama proses dealuminasi, spesi H+(aq) diserang
oleh atom oksigen yang terikat pada kerangka zeolit. Menurut Mutngimaturrohmah et al. (2003) terdapat dua kemungkinan mekanisme pemutusan ikatan, yaitu pemutusan ikatan Si-O dan Al-O. Berdasarkan harga energi disosiasi ikatan, energi ikatan Al-O (116 kkal/mol) lebih rendah daripada energi disosiasi Si-O (190 kkal/mol). Oleh karena itu, ikatan Al-O lebih mudah putus. Mekanisme pemutusan ikatan ditunjukkan pada Gambar 1. Pada proses ini secara visual filtrat cucian perendaman berwarna kuning kehijauan. Warna ini diakibatkan oleh spesi AlCl3 yang terbentuk selama proses dealuminasi. Setelah
proses pencucian secara berulang hingga pH mendekati netral dan anion klorida sisa telah tereliminasi, zeolit teraktivasi secara kimiawi kemudian ditempatkan dalam tanur 300-400 ºC selama 3-4 jam (modifikasi SNI 13-3494-1994). Perlakuan ini bertujuan membebaskan air yang terjerap, sehingga luas permukaan zeolit untuk penjerapan lebih meningkat. Zeolit yang telah dipanaskan dalam tanur kemudian dimodifikasi dengan penambahan ion Fe3+. Hal ini dilakukan dengan prinsip penukaran kation logam pada pori-pori zeolit. Penukaran kation logam pada zeolit tidak mengubah struktur kristal tetrahedron zeolit, melainkan mengubah sifat dan afinitas daya jerap zeolit. (Hanafiah 2005).
8
Preparasi zeolit-Fe dilakukan dengan penjerapan zeolit teraktivasi dalam larutan FeCl3 selama 48 jam (Balal et al. 2009). Larutan FeCl3 sebanyak 50 mL
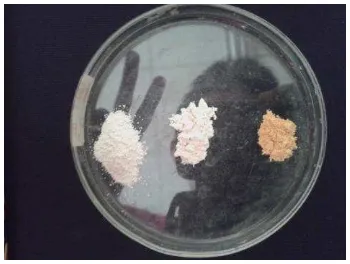
yang digunakan memiliki konsentrasi 0.01 M. Pengamatan visual menunjukkan zeolit-Fe memiliki warna jingga kekuningan, berbeda dengan zeolit teraktivasi yang memiliki warna putih. Sementara itu, zeolit yang belum teraktivasi berwarna putih dengan intensitas warna yang lebih rendah (Gambar 2). Untuk mengukur kadar Fe dalam zeolit-Fe, filtrat diambil dan kadar Fe bebas diukur dengan AAS. Setelah diberikan perlakuan, kadar zeolit terjerap sebanyak 28.440 mg/g zeolit (Lampiran 4). Jumlah Fe teradsorpsi pada permukaan zeolit sebanding dengan peningkatan kadar Fe pada permukaan zeolit. Dengan metode pembuatan dan analisis yang berbeda Agustina (2012) mendapatkan nilai Fe zeolit Cikalong bertambah sebanyak 4.7813 mg/g. Zeolit-Fe tersebut dibuat dengan penjerapan senyawa Fe(OH)3 dan analisis yang digunakan adalah desorpsi Fe dengan larutan
HNO3 5%.
Nilai KTA zeolit antarperlakuan diukur. Nilai KTA zeolit menandakan afinitas zeolit terhadap anion. Semakin besar nilai KTA, zeolit akan semakin mudah berinteraksi dengan anion (Hanafiah 2005). Hasil pengukuran KTA menunjukkan nilai rerata secara berturut-turut untuk zeolit belum teraktivasi, zeolit teraktivasi, dan zeolit-Fe adalah 8.2527, 11.3295, 16.5995 mek/100 g zeolit. Aktivasi zeolit secara asam mengubah karakter zeolit menjadi lebih positif. Sehingga, nilai KTA zeolit meningkat. Berubahnya karakter zeolit ini disebabkan terlepasnya Alselama proses aktivasi menjadi AlCl3 (Weitkamp, Puppe 1999).
Nilai KTA meningkat 2 kali lipat setelah zeolit diinsersi ion Fe(III). Insersi ion Fe(III) dapat dilakukan karena ion Fe(III) memiliki afinitas terhadap ligan mineral liat yang lebih kuat dibandingkan dengan ion yang bervalensi rendah dan atau ion dengan radius hidrasi yang tinggi (Hanafiah 2005). Karakter zeolit menjadi lebih positif sehingga memudahkan interaksi dengan muatan negatif, seperti gugus elektronegatif pada enzim. Permukaan zeolit yang cenderung positif juga diharapkan akan menguatkan interaksi antara enzim dengan permukaan elektrode. Sehingga, enzim tidak mudah mengalami ablasi dari permukaan elektrode.
Analisis morfologi zeolit dengan SEM menunjukkan rongga-rongga zeolit pada pembesaran 2500 kali (Gambar 3). Rongga pada zeolit yang belum termodifikasi terlihat tidak teratur. Beberapa substansi pengotor masih teramati menutupi pori-pori zeolit. Rongga zeolit semakin banyak dan terbuka pada zeolit teraktivasi asam. Hasil insersi atom Fe pada zeolit menyebabkan rongga semakin banyak dan teratur. Hal ini mengindikasikan luas permukaan zeolit semakin bertambah.
Elektrode Pasta Karbon Termodifikasi Zeolit-Fe
Elektrode pasta karbon (EPK) dibuat dengan komposisi 55 mg grafit dan
35μL parafin. Elektrode yang telah dibuat kemudian dikarakterisasi respon
arusnya menggunakan K3[Fe(CN)6] 1mM. Elektrode dengan respon arus yang
konstan dan menunjukkan puncak redoks di 0.4-0.6 V dipilih untuk pengukuran selanjutnya. Dari 30 EPK yang dibuat, hanya ada 6 EPK dengan respon terbaik. Hasil pengujian menunjukkan rerata respon arus dari 6 EPK tersebut sebesar ± 0.0006 mA (Gambar 4). Profil arus EPK terlihat seragam dengan rentang 0.0008-0.0006 mA dengan deviasi arus yang rendah. Hal ini menunjukkan keterulangan fabrikasi elektrode rendah namun memiliki presisi yang tinggi.
Gambar 3 Hasil payaran SEM perbesaran 2500×: (a) zeolit belumteraktivasi, (b) zeolit teraktivasi HCl 3 M, (c) zeolit-Fe.
(a) (b)
10
Modifikasi EPK dilakukan dengan menambahkan zeolit-Fe ke dalam campuran EPK. Bobot zeolit-Fe yang ditambahkan sebesar 10-25 mg. Profil elektrode setiap penambahan zeolit-Fe ditunjukkan pada Lampiran 5. Semakin banyak zeolit yang ditambahkan, bentuk voltamogram menunjukkan arus oksidasi yang semakin meningkat. Akan tetapi, penambahan zeolit-Fe di atas 15 mg tidak menghasilkan keterulangan arus puncak yang seragam, bahkan cenderung menurun. Balal (2009) menjelaskan bahwa penambahan zeolit-Fe yang lebih tinggi mengurangi konduktivitas permukaan elektrode. Dengan demikian, zeolit-Fe yang ditambahkan ke dalam EPK sebanyak 15 mg.
Optimasi Kinerja Biosensor Arsen
Biosensor arsen dibuat dengan penambahan enzim piruvat dehidrogenase (PDH) terimobilisasi pada permukaan elektrode. Imobilisasi enzim bertujuan meningkatkan stabilitas enzim selama proses enzimatik berlangsung (Eggins 2002). Sebelum menambahkan arsen dalam sampel, dibutuhkan optimasi kinerja biosensor. Bagian enzim terimobilisasi dimasukkan ke dalam larutan dapar fosfat dengan pH optimum kinerja enzim PDH pada pH 7.4 menurut spesifikasi produk enzim. Kondisi optimum kinerja biosensor (pH, suhu, dan konsentrasi enzim) dicari dengan metode Respon Surface Methodology: Central Composite Design.
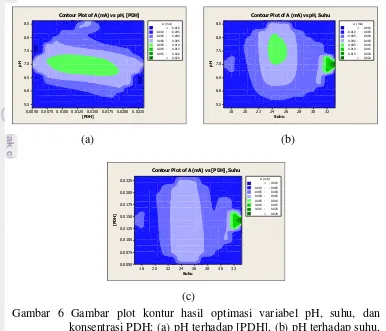
Hasil optimasi menunjukkan EPK zeolit-Fe memiliki kondisi optimum pada pH 7.00, suhu 33 °C, dan konsentrasi enzim 0.0142 U/mL (Gambar 6). Kondisi pH optimum yang diperoleh relatif sedikit bergeser dari pH optimum kinerja enzim antara 7.00-8.00 dalam keadaan bebas (Pawelczyk, Olson 1992). Pergeseran ini terjadi akibat perubahan lingkungan ionik di permukaan elektrode yang terimobilisasi enzim. Permukaan elektrode yang positif menarik anion ke permukaan untuk menetralkan muatan. Akibatnya, muatan negatif cenderung berkumpul di dekat enzim yang terimobilisasi dan mengubah pH optimum enzim menjadi lebih basa. Hal sebaliknya terjadi bila tempat imobilisasi enzim cenderung bersifat negatif (Bergamasco 2000).
[PDH]
Contour Plot of A (mA) vs pH, Suhu
Suhu
Contour Plot of A (mA) vs [PDH], Suhu
Gambar 6 Gambar plot kontur hasil optimasi variabel pH, suhu, dan konsentrasi PDH: (a) pH terhadap [PDH], (b) pH terhadap suhu, (c) [PDH] terhadap suhu.
(b) (a)
12
Gambar 8 Profil voltamogram biosensor arsen (a)
(b)
Gambar 7 (a) Mekanisme reaksi katalitik enzim PDH dengan substrat piruvat (Voet, Voet 2010)
(b) Mekanisme inhibisi arsen pada enzim PDH (Diwan 2007)
-0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 -0,25
-0,20 -0,15 -0,10 -0,05 0,00 0,05 0,10 0,15 0,20 0,25
Arus (mA)
Tegangan (V)
Akan tetapi, sifat permukaan diduga tidak banyak terpengaruh oleh keberadaan zeolit. Hal ini ditunjukkan oleh nilai pH optimum enzim terimobilisasi tidak meningkat dan masih berada pada rentang optimum kinerja enzim. Pengukuran karakterisasi biosensor arsen dengan enzim PDH lalu disesuaikan pada kondisi optimum yang telah diperoleh.
Hasil pengolahan data ANOVA regresi linear model CCD pada tingkat kepercayaan 95% menunjukkan model kurva memiliki lengkungan kurva (p=0.213). Model kurva yang dibangun diketahui juga belum memenuhi syarat untuk dibuat kontur 3 dimensinya (p=0.221). Hal ini ditandai dengan interaksi antarvariabel tidak berpengaruh secara nyata (p=0.440) terhadap arus yang dihasilkan dan masih timbulnya kurvatur pada model. Hanya pH yang memiliki pengaruh signifikan terhadap arus yang dihasilkan (p=0.023). Keadaan ini menunjukkan model RSM yang dibangun masih linear (p=0.213) dan belum bersifat kuadratik (p=0.066) Hal ini disebabkan oleh komponen pengenal hayati berupa enzim yang rentan terhadap perubahan kondisi pH lingkungan. Perubahan pH lingkungan dapat mengubah kondisi geometri 3 dimensi enzim sehingga menurunkan aktivitas katalitiknya (Eggins 2002).
Biosensor Arsen
Biosensor arsen bekerja dengan mendeteksi terjadinya penurunan arus akibat keberadaan arsen dalam sampel. Aktivitas enzim PDH terhalangi oleh keberadaan arsen (Gambar 7). Arsen menghalangi proses redoks enzim dengan cara berikatan dengan gugus ditiol visinal pada enzim, sehingga aktivitas katalitiknya mengalami penurunan (Samikkanu et al. 2003). Penurunan aktivitas ini dapat terdeteksi dengan melihat penurunan arus oksidasi antara pengukuran sampel dengan As dan tanpa As. Bereaksinya substrat piruvat dengan enzim PDH akan menghasilkan puncak arus oksidasi. Adanya arsen menyebabkan penurunan arus puncak Gambar 9 Kurva hubungan antara penurunan arus puncak terhadap
14
oksidasi pada potensial 0.0-0.2 V (Gambar 8). Profil penurunan arus puncak terhadap peningkatan konsentrasi arsen ditunjukkan pada Gambar 9.
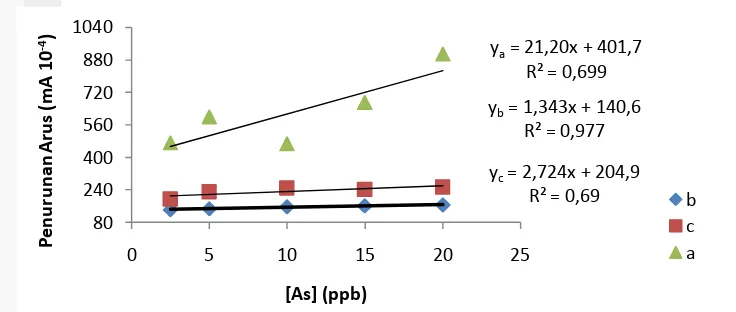
Pengukuran senyawa arsen dilakukan pada rentang 0.63-30 ppb. Pengukuran pada rentang ini bertujuan mengetahui linearitas dan limit deteksi biosensor arsen yang dibuat. Selain itu, linearitas arus, limit deteksi, dan limit kuantisasi biosensor dibandingkan dengan linearitas hasil pengukuran AAS. Hasil pengukuran pada 3 elektrode yang berbeda dengan ulangan 1 kali menunjukkan linearitas terbaik berada pada rentang penambahan arsen antara 2.50-20 ppb (Gambar 10). Dari 3 hasil pengukuran elektrode hanya elektrode B dan C yang memberikan profil arus yang serupa. Elektrode A memberikan respon arus yang jauh lebih besar namun tidak konstan pada rentang 0.63-2.50 ppb.
Hasil payaran voltamogram ini menunjukkan keterulangan fabrikasi elektrode masih rendah. Akibatnya, linearitas dan limit deteksi ketiga elektrode berbeda-beda. Hal ini disebabkan arus yang dihasilkan berbeda antara elektrode satu dengan yang lainnya. Perbedaan ini dapat terjadi akibat dari kesalahan acak proses fabrikasi elektrode atau proses imobilisasi yang kurang homogen (Švancara
et al. 2009).
Elektrode b menunjukkan koefisien determinasi dan limit deteksi terbaik secara berturut-turut sebesar 97.70% dan 3.78 ppb. Berdasarkan perhitungan nilai limit deteksi biosensor dengan linearitas terbaik ini masih tinggi sebesar 3.78 ppb (Lampiran 8). Namun, nilai limit deteksi elektrode B masih lebih rendah daripada limit deteksi metode AAS (Lampiran 9). Limit deteksi masing-masing elektrode masih belum seragam, sehingga nilai limit deteksi biosensor arsen yang telah dibuat diperkirakan berada pada rentang 2-16 ppb.
Bila hasil pengukuran biosensor ini dibandingkan dengan beberapa penelitian tentang deteksi As, metode biosensor berpotensi memberikan nilai limit deteksi relatif rendah. Sarkar et al. (2011) dengan perangkat field test kit dapat mendeteksi As hingga 10 ppb. Sementara itu, Tahir et al. (2008) dengan metode spektrofotometi dapat mendeteksi As hingga konsentrasi 1 ppb. Siddiki et al.
(2011) dengan metode biosensor GFP memiliki nilai limit deteksi sebesar 5 ppb As. Limit deteksi yang rendah sangat diperlukan karena nilai ambang batas
konsentrasi senyawaan arsenik yang diperbolehkan dalam regulasi antara 10-15 ppb.
Pengujian data berpasangan data masing-masing elektrode dengan hasil pengukuran AAS pada tingkat kepercayaan 95% dan konsentrasi arsen yang sama (Lampiran 10). Hasil uji menunjukkan kedua data memberikan hasil pengukuran yang tidak berbeda nyata pada hasil pengukuran biosensor terhadap hasil pengukuran AAS. Hal ini menunjukkan metode pengukuran arsen dengan biosensor berpotensi dapat sebagai alternatif metode pengukuran selain AAS pada rentang konsentrasi As yang rendah. Akan tetapi, mengingat nilai limit deteksi yang belum seragam antarelektrode akibat keterulangan imobilisasi enzim yang rendah dan rentang linearitas yang sempit (2.50-20 ppb) membuat metode pengukuran ini masih sulit untuk diaplikasikan.
SIMPULAN DAN SARAN
Simpulan
Penelitian menunjukkan penggunaan zeolit-Fe sebagai material pemodifikasi EPK mampu meningkatkan arus sebesar 3-7 kali. Jumlah zeolit-Fe yang dapat memberikan profil arus seragam dan maksimum diketahui sebesar 15 mg. Dengan kondisi jumlah zeolit optimum kinerja biosensor diketahui memiliki kondisi optimum saat pH larutan, suhu, dan konsentrasi enzim PDH sebesar 7.00, 33 °C, dan 0.0142 U/mL. Nilai limit deteksi dari tiga biosensor masih berbeda satu sama lain, sehingga reprodisibilitas fabrikasi biosensor masih rendah. Linearitas terbaik pengukuran As dengan biosensor berada pada rentang 2.50-20 ppb. Nilai limit deteksi terbaik dari 3 biosensor didapatkan sebesar 3.78 ppb. Nilai ini lebih rendah dibanding limit deteksi pengukuran AAS, namun masih tinggi untuk mendeteksi konsentrasi As di bawah 10 ppb. Rentang linearitas yang sempit dan limit deteksi yang relatif tinggi membuat analisis dengan biosensor As ini masih sulit.
Saran
16
DAFTAR PUSTAKA
[BSN] Badan Standardisasi Nasional. 1994. SNI 13-3494-1994: Mineral zeolit, Pengukuran kapasitas pertukaran kation, Jakarta (ID).
Agrawal O, Sunita G, Gupta VK. 1999. A sensitive colorimetric method for the determination of arsenic in environmental and biological samples. J. Chin. Chem. Soc. 46(4): 641-645.
Bae ZU, Park YC, Lee JH, Chang HY, Lee SH. 2000. Electrocatalytic properties of a modified electrode with an asymmetric nickel(II)-tetraaza(14)annulene complex. Bull. Korean Chem. Soc. 21(7):749-751
Balal M, Mohammad H, Bahareh B, Ali B, Maryam H, Mozhgan Z. 2009. Zeolite nanoparticle modified carbon paste electrode as a biosensor for simultanous determination of dopamine and tryptophan. J. Chin. Chem. Soc. 56(4): 789-796.
Bergamasco R, Basseti FJ, de Moraes FF, Zanin GM. 2000. Characterization of free and immobilized invertase regarding activity and energy of activation.
Braz. J. Chem. Eng. 17:4-7 http://dx.doi.erg/10.1590/S0104-66322000000400051
Chaplin MF, Bucke C. 1990. Enzyme Technology. Cambridge (GB): Cambridge University Press.
Chauhan N, Pundir CS. 2011. An amperometric biosensor based on acetylcholinesterase immobilized onto iron oxide nanoparticles/multi-walled carbon nanotubes modified gold electrode for measurement of organophosphorus insecticides Analytica Chimica Acta 701: 66-74
Daud N, Yusof NA, Tee TW, Abdullah AH. 2012. Electrochemical sensor for As (III) utilizing CNTs/leucine/nafion modified electrode. Int. J. Electrochem.
7(2012):175-185.
Diwan JJ. 2007. Pyruvate Dehydrogenase & Krebs Cycle. [terhubung berkala]. http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/part2/krebs.htm#l
ocaliz (19 Juli 2014)
Eggins BR. 2002. Chemical Sensors and Biosensors. New Jersey (US): John Wiley & Sons Inc.
Hanafiah KA. 2005. Dasar-Dasar Ilmu Tanah. Jakarta (ID): PT RajaGrafindo Persada
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya.
Majalah Ilmu Kefarmasian 1(3): 117-135
Harvey D. 2000. Modern Analytical Chemistry. Boston (US): Mc Graw Hill Co. Ikeda et al. 1998. Electrochemical monitoring of in vivo reconstruction of glucose
dehydrogenase in Escherichia coli cells with externally added pyrroloquinoline. J. Electroanal. Chem. 449:219-224.
Iswantini D, Saprudin D, Kibtiah. 2009. Penggunaan Metode Voltametri dalam Biosensor Kolesterol dengan Ferosen sebagai Mediator, Jurnal Biofisika. Mutngimaturrohmah, Gunawan, Khabibi. 2003. Aplikasi zeolit alam
terdealuminasi dan termodifikasi HDTMA sebagai adsorben fenol. [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Diponegoro: Semarang.
Powalczyk T , Olson MS. 1992. Regulation of pyruvate dehydrogenase kinase activity from pig kidney cortex. Biochem. J. (288):369-373
Rocha C, Cristina MR, Gonçalves MP, Teixeira JA. 2005.Spent-grains and zeolites as potential carriers for trypsin immobilization. Prosiding.
International Chemical Engineering Conference, Departamento de Engenharia Quimica da Universidade de Coimbra. http://hdl.handle.net/1822/3518
Samikkannu T, Chen C-H, Yih L-H. 2003. Reactive oxygen species are involved in arsenic trioxide inhibition of pyruvate dehydrogenase activity. Chemical Research in Toxicology 16(3):409-414.
Samphao A, Rerkchai H, Jitcharoen J, Nacaricha D, Kalcher K. 2012. Indirect determination of mercury by inhibition of glucose oxidase immobilized on a carbon paste electrode. Int. J. Electrochem. Sci. 7(2012): 1001-1010
Sanghavi BJ, Mobin SM, Mathur P, Lahiri GK, Srivastava AK. 2013. Biomimetic sensor for certain catecholamines employing copper(II) complex and silver nanoparticle modified glassy carbon paste electrode. Biosensors and Bioelectronics 39(1):124-132.
Sarkar B, Solaiman AHM, Das AK, Chowdhury DA. 2011. Comparative analysis of arsenic detection in water by field test kit and AAS method. JES 2(1):38-41
Shang Z, Xu Y, Gu Y, Wang Y, Wei D, Zhan L. 2011. A Rapid Detection of Pesticide Residue Based on Piezoelectric Biosensor Procedia Engineering
15: 4480-4485
Siddiki MSR, Kawakami Y, Ueda S, Maeda I. 2011. Solid phase biosensors for arsenic or cadmium composed of a trans factor and cis element complex.
Sensors (11):10063-10073 doi:10.3390/s111110063
Souiru M, Gammoudi I, Ouada HB, Mora L, Jouenne T, Jaffrezic-Renault N, Dejous C, Othmane A, Duncan AC. 2009. Escherichia coli-functionalized magnetic nanobeads as an ultrasensitive biosensor for heavymetals.
Procedia Chemistry . 1: 1027–1030
Švancara I, Vytřas K, Kalcher K, Walcarius A, Wang J. 2009. Carbon paste
electrodes in factsnumbers, and notes: a review on the occasion of the 50-years jubilee of carbon paste in electrochemistry and electroanalysis.
Electroanalysis (21): 7-28 doi:10.1002/elan.200804340
Tahir MA, Rasheed H, Malala A. 2008. Method development for arsenic analysis by modification in spectrophotometric technique. Drink. Water Eng. Sci. Discuss (1):135-154
Taufik M. 2013. Analisis Cu(II) pada bawang dayak (Eleutherine palmifolia (L.) Merr.) menggunakan elektrode pasta karbon termodifikasi kuersetin.
Skripsi. Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Bogor.
Trivadilla. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococcus radiodurans yang diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya [tesis]. Sekolah Pascasarjana,Institut Pertanian Bogor. Bogor.
18
Vytřas K, Švancara I, Metelka R. 2009. Carbon paste electrodes in
electroanalytical chemistry. J. Serb. Chem. Soc. 74(10): 1021-1033.
Weitkamp J, Puppe L. 1999. Catalysis and Zeolites: Fundamentals and Applications. Berlin (DE): Spinger-Verlag
Widowati W, Sastiono A, Jusuf R. 2008. Efek Toksik Logam. Yogyakarta (ID): Penerbit Andi.
LAMPIRAN
Lampiran 1 Diagram Alir PenelitianZeolit
Aktivasi
Zeolit teraktivasi Grafit + Parafin
Zeolit termodifikasi
Fe3+
FeCl3 0.01
M 250 mL
Imobilisasi enzim PHD
Biosensor Konsentrasi
tertentu
Uji RSM: CCD Kondisi
optimum
Validasi
ECP
ECP Uji hantar
arus
Limit deteksi
Linearitas
Uji Data Berpasangan
Campuran grafit+parafin yang telah halus 100
20
Lampiran 2 Rancangan percobaan kombinasi 3 parameter dengan metode CCD
No. pH Suhu (°C) [LDH] (U/mL)
1 6.00 20 0.0085
2 6.00 20 0.0198
3 6.00 30 0.0085
4 6.00 30 0.0198
5 8.00 20 0.0085
6 8.00 20 0.0198
7 8.00 30 0.0085
8 8.00 30 0.0198
9 7.00 25 0.0142
10 7.00 25 0.0142
11 7.00 25 0.0142
12 7.00 25 0.0142
13 7.00 25 0.0142
14 7.00 25 0.0142
15 7.00 17 0.0142
16 7.00 25 0.0050
17 7.00 25 0.0234
18 7.00 33 0.0142
19 8.63 25 0.0142
Lampiran 3 Nilai KTA Zeolit
Tabel 2 Standardisasi NaOH 0.1 N oleh asam oksalat 0.1 N 5 mL
Ulangan Volume titran (mL) [NaOH]N
Indikator : fenolftalein
Perubahan warna : tak berwarna – merah muda
Rerata [NaOH] = (0.0877+0.0867+0.0870)N/3 = 0.0870 N
Tabel 2 Data titrasi nilai KTA filtrat zeolit dengan NaOH 0.0870 N
22
Lampiran 4 Jumlah Fe terdsorpsi dalam zeolit
Tabel 3 Kurva standar Fe AAS
No Konsentrasi (ppm) Absorbans
1 0.4000 0.0402
4. Massa Fe terjerap/g zeolit = 14.812 mg/0.5005 g = 28.364 mg/g
5. Rerata massa Fe terjerap/g zeolit = 1
5 [� ]� = 28.440 �/�
5
�=1
Lampiran 5 Profil hasil pemayaran EPK termodifikasi zeolit-Fe dengan K3[Fe(CN)6] 1mM dalam KCl 0.1 M
Gambar 12 Profil voltamogram EPK termodifikasi zeolit-Fe 10 mg
0,0 0,2 0,4 0,6 0,8 1,0
Gambar 13 Profil voltamogram EPK termodifikasi zeolit-Fe 15 mg
0,0 0,2 0,4 0,6 0,8 1,0
Gambar 14 Profil voltamogram EPK termodifikasi zeolit-Fe 20 mg
24
Tabel 5 Data rerata arus oksidasi maksimum Arus oksidasi
*data yang diambil berdasarkan profil voltamogram terbaik
Gambar 15 Profil voltamogram EPK termodifikasi zeolit-Fe 25 mg
0,0 0,2 0,4 0,6 0,8 1,0
Gambar 16 Grafik hubungan rerata arus puncak dengan jumlah zeolit-Fe dalam EPK
Tabel 6 Perbandingan peningkatan arus puncak oksidasi (mA) antara EPK dan
Rerata 0.00062 0.00280
Standar
deviasi 0.00018 0.00050
Lampiran 6 Optimasi variabel pH, suhu, dan konsentrasi enzim
Tabel 7 Hasil optimasi variariael pH, suhu, dan konsentrasi enzim
No. pH Suhu
(°C)
[LDH] (U/mL)
Arus (mA)
Blanko Sampel Analit
26
Lampiran 7 Regresi Response Surface Method
Response Surface Regression: A (mA) versus pH, Suhu, [PDH] The analysis was done using uncoded units.
Estimated Regression Coefficients for A (mA)
Tabel 8 Perhitungan ANOVA Response Surface Method: Central Composite Design (Minitab 14)
Term Coef SE Coef T P
Constant -0.3946 0.1517 -2.601 0.026
pH 0.0826 0.0308 2.684 0.023
Suhu 0.0030 0.0054 0.554 0.592
[PDH] 8.5615 4.2021 2.037 0.069
pH*pH -0.0047 0.0020 -2.404 0.037
Suhu*Suhu -0.0000 0.0001 -0.060 0.954
[PDH]*[PDH] -97.9643 61.2948 -1.598 0.141
pH*Suhu -0.0002 0.0005 -0.429 0.677
pH*[PDH] -0.7146 0.4430 -1.613 0.138
Suhu*[PDH] -0.0355 0.0886 -0.400 0.697 S = 0.007080 R-Sq = 60.3% R-Sq(adj) = 24.6%
Analysis of Variance for A (mA)
Tabel 9 Perhitungan ANOVA model RSM yang dibangun
Source DF Seq SS Adj SS Adj MS F P
Regression 9 0.000762 0.000085 0.000762 1.69 0.213 Linear 3 0.000220 0.000498 0.000166 3.31 0.066 Square 3 0.000395 0.000395 0.000132 2.63 0.108 Interaction 3 0.000148 0.000148 0.000049 0.98 0.440 Residual
Error
10 0.000501 0.000501 0.000050 Lack of
Fit
5 0.000342 0.000342 0.000068 2.14 0.211
Pure Error 5 0.000160 0.000160 0.000032
Total 19 0.001264
Unusual Observations for A (mA)
Obs StdOrder A (mA) Fit SE Fit Residual St Resid 18 18 0.023 0.012 0.005 0.010 2.32 R
Lampiran 8 Data pembacaan arus oksidasi 3 elektrode
Tabel 10 Data pembacaan arus oksidasi elektrode a (dalam 10-4 mA)
Siklus ke- Blangko Piruvat 35 mM
[As] (ppb)
2.50 5.00 10.00 15.00 20.00
1 221 805 711 823 760 836 469
2 302 990 804 889 840 859 519
3 310 1209 882 916 898 869 547
4 313 1387 942 929 949 873 582
5 315 1484 983 929 988 869 605
6 318 1522 1020 918 1019 866 615
7 318 1524 1043 903 1036 859 614
8 319 1511 1052 884 1052 772 609
9 365 1487 1058 862 1064 825 602
10 418 1451 1058 840 1068 726 596
11 442 1416 1052 818 1067 697 590
12 462 1370 1042 792 936 700 581
13 477 1333 954 773 932 687 572
14 492 1293 931 754 910 702 561
15 506 1254 905 732 889 703 552
Rerata arus puncak maksimum
415 1519 1046 919 1051 848 609
Keterangan:
28
Gambar 17 Profil arus puncak terhadap siklus pemayaran elektrode a
Tabel 11 Data pembacaan arus oksidasi elektrode b (dalam 10-4 mA) Siklus
Keterangan: Data yang diambil untuk perhitungan rerata arus tercetak tebal pada tabel.
Gambar 18 Profil arus puncak terhadap siklus pemayaran elektrode b
Tabel 12 Data pembacaan arus oksidasi elektrode c Siklus
Keterangan: Data yang diambil untuk perhitungan rerata arus tercetak tebal pada tabel.
30
Gambar 19 Profil arus puncak terhadap siklus pemayaran elektrode c 0
100 200 300 400 500
0 10 20
A
ru
s
(1
0
^
-4
m
A
)
Siklus
ke-blangko
piruvat
2.50 ppb As
5.00 ppb As
10.00 ppb As
15.00 ppb As
Lampiran 9 Perhitungan limit deteksi elektrode a, b, dan c
Tabel 13 Data penurunan arus oksidasi terhadap konsentrasi As
[As] (ppb) 2.50 5.00 10.00 15.00 20.00
Gambar 20 Profil linearitas elektrode a, b, dan c
Tabel 14 Perhitungan kuadrat rerata selisih arus elektrode a, b, dan c
32
Keterangan: n = 5; a= nilai arus terukur pada elektrode a; ai = nilai arus menurut persamaan garis linear pada elektrode a.
Tabel 15 Perhitungan nilai limit deteksi biosensor arsen
Elektrode ��− � �
��= ��− � �
� − � �= ��
− � �
� − �
LOD (ppb)
a 39560.85 13186.95 114.83 16.25
b 8.60 2.87 1.69 3.78
c 683.68 227.89 15.10 16.63
Contoh perhitungan:
1. yi = 21.20x10-4 mA + 401.7(2.50 ppb)10-4 mA/ppb = 454.70x10-4 mA
2. (yi-y) = (454.70-473) 10-4 mA = -18.30x10-4 mA
3. (yi-y)2 = (-18.30)2 10-8 mA2 = 334.89x10-8 mA2
4. Σ(yi-y)2 = (334.89+...+7106.49) 10-8 mA2 = 39560.85x10-8 mA2
5. σ2 = 1/(n-2) (Σ(yi-y)2)= 39560.85 10-8 mA2/(5-2) = 13186.95x10-8 mA2
6. σ = (σ2)0.5 = 114.83x10-4 mA
7. �= 3 �
� � � � � =
3 ×114 .83 ∙ 10−4 �
21.20 ∙ 10−4 �
�� = 16.25 ��
Catatan:
Lampiran 10 Perhitungan linearitas dan limit deteksi pengukuran As menggunakan AAS
Gambar 21 Profil linearitas pengukuran As dengan AAS
Tabel 16 Perhitungan kuadrat selisih rerata pengukuran arsen dengan AAS
Absorbans Ulangan
Keterangan: n = 5; 1= nilai arus terukur pada ulangan ke-1; 1i = nilai arus menurut persamaan garis linear pada ulangan ke-1.
34
Tabel 17 Perhitungan nilai limit deteksi dan pengukuran arsen dengan AAS
Ulangan ��− � �
��= ��− � �
� − � �= ��− �
�
� − �
LOD (ppb)
1 1.2×10-5 4.0×10-6 0.0020 6.03
2 8.7×10-6 2.9×10-6 0.0017 5.67
3 1.7×10-5 5.6×10-6 0.0024 7.86
Rerata 6.52
Contoh perhitungan:
1. yi = -0.0010 + 0.0009(2.50 ppb)/ppb = -0.0001
2. (yi-y) = (-0.0001-0.0011) = -0.0012
3. (yi-y)2 = (-0.0012)2 = 1.4×10-6
4. Σ(yi-y)2 = (1.4+...+4.0) 10-6 = 1.2×10-5
5. σ2 = 1/(n-2) (Σ(yi-y)2)= 1.2×10-5 /(5-2) = 4.0×10-6
6. σ = (σ2)0.5 = 0.0020
7. �= 3 �
� � � � � =
3 ×0.0020
Lampiran 11 Uji data berpasangan hasil pengukuran AAS dan biosensor arsen
Tabel 18 Perhitungan uji data berpasangan antara metode AAS dengan biosensor
Sampel
*data yang dipakai ulangan ke-2 pengukuran AAS
Contoh perhitungan:
H0 = Tidak terdapat perbedaan hasil yang signifikan antara pengukuran
menggunakan metode AAS dan biosensor tipe-n.
H1 = Terdapat perbedaan hasil yang signifikan menggunakan metode AAS dan
biosensor tipe-n.
T-hitung < T-referensi, maka, H0 diterima
(tidak cukup bukti untuk menolak H0)
Simpulan:
36
38
RIWAYAT HIDUP
Penulis dilahirkan di Denpasar 25 Maret 1992 dari pasangan Iwan Baharudin dan Suyati. Penulis merupakan anak ketiga dari tiga bersaudara. Penulis menempuh pendidikan di SMA Negeri 4 Denpasar hingga tahun 2010 dan pada tahun yang sama diterima melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Kimia IPB.
Selama aktif di perkuliahan penulis bergabung ke dalam berbagai kepanitiaan dan dalam organisasi BEM FMIPA IPB sebagai staf Divisi Sosial Lingkungan (2012-2013). Selain itu, penulis juga aktif sebagai asisten laboratorium di Tingkat Persiapan Bersama (2011 dan 2012 semester gasal). asisten laboratorium Kimia Dasar Tingkat Persiapan Bersama (2013 semester gasal dan genap. 2014 semester genap). dan asisten mata kuliah PKF (2013 semester gasal. 2014 semester genap). Penulis juga pernah mengikuti perlombaan tingkat nasional seperti. Olimpiade Sains Tingkat Nasional bidang Kimia (2012 dan 2013) dan Olimpiade Sains Teknik tingkat Nasional (2013) sebagai peserta.
Selama masa aktif penulis pernah mendapatkan beasiswa dari Marga Jaya (2013) dan mendapatkan beberapa penghargaan. Penghargaan yang penulis terima antara lain: Mahasiswa Berprestasi Tingkat Persiapan Bersama (2011) dan finalis Tanoto Students Research Awards dalam presentasi beregu (2013) dengan
judul penelitian “Analisis Potensi dan Kondisi Optimum Tanaman Mata Lele (Lemna sp.) sebagai Absorben Logam Berat Cr dan Pb”. Kegiatan Praktik
Lapangan diikuti penulis di Balai Penelitian Tanah Bogor dan menulis laporan
yang berjudul “Korelasi Kandungan Fosforus Tersedia. Aluminium Dapat Tukar.
dan Kapasitas Tukar Kation terhadap Kesuburan Tanah” (2013). Penulis juga