EFEK PEMBERIAN MIKROKAPSUL SINBIOTIK DENGAN
FREKUENSI BERBEDA TERHADAP INFEKSI Vibrio harveyi
PADA UDANG VANAME (Litopenaeus vannamei)
WAODE MUNAENI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Efek Pemberian Mikrokapsul Sinbiotik dengan Frekuensi Berbeda terhadap Infeksi Vibrio harveyi
pada Udang Vaname (Litopenaeus vannamei) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Waode Munaeni
RINGKASAN
WAODE MUNAENI. Efek pemberian mikrokapsul sinbiotik dengan frekuensi berbeda terhadap infeksi Vibrio harveyi pada udang vaname (Litopenaeus
vannamei). Dibimbing oleh MUNTI YUHANA dan WIDANARNI.
Penerapan budidaya intensif untuk meningkatkan produksi udang telah berakibat pada penurunan kualitas perairan, sehingga menyebabkan stress yang berdampak pada serangan penyakit, salah satunya penyakit vibriosis. Penyakit ini terutama disebabkan oleh bakteri Vibrio harveyi. Satu strategi pengendalian secara biologis untuk meningkatkan resistensi penyakit pada organisme akuakultur adalah dengan pemberian sinbiotik. Hasil penelitian sebelumnya menunjukkan bahwa suplementasi sinbiotik fresh culture (tanpa enkapsulasi) dengan frekuensi setiap hari dapat meningkatkan pertumbuhan dan respon imun udang vaname (L. vannamei). Penelitian ini dilakukan untuk mengkaji efek pemberian mikrokapsul sinbiotik dengan frekuensi berbeda pada udang vaname (Litopenaeus vannamei) yang diinfeksi Vibrio harveyi. Sinbiotik yang digunakan merupakan kombinasi dari probiotikBacillus sp. NP5 RfRdan oligosakarida dari ubi jalar (Ipomea batatas L.) varietas jago yang dienkapsulasi dengan metode
spray drying. Percobaan dilakukan selama 40 hari dengan menambahkan mikrokapsul sinbiotik pada pakan. Perlakuan meliputi pemberian mikrokapsul sinbiotik dengan frekuensi satu kali seminggu (A), dua kali seminggu (B), setiap hari (C), dan tanpa mikrokapsul sinbiotik (kontrol). Perlakuan kontrol terdiri dari kontrol positif (K+) dan kontrol negatif (K-). Setelah 30 hari periode percobaan, semua udang diuji tantang dengan Vibrio harveyi RfR kosentrasi 106 CFU ml-1 kecuali kontrol negatif. Selanjutnya, udang dipelihara kembali selama 9 hari. Pengamatan populasi bakteri di usus (Bacillus sp. NP5 RfRcount, total bacterial count, V. harveyi RfR count dan total Vibrio count) dan respon imun (total hemocyte count, differential hemocyte, aktivitas phenoloxidase) dilakukan pada hari ke-0 (sebelum perlakuan), hari ke-30 (sebelum uji tantang), hari ke-32 (1 hari setelah uji tantang), hari ke-36 (4 hari setelah uji tantang), dan hari ke-40 (9 hari setelah uji tantang).
Hasil penelitian menunjukkan bahwa pemberian mikrokapsul sinbiotik perlakuan C mampu meningkatkan populasi Bacillus sp. NP5 RfR countdan total bacterial count serta mampu mengurangi V. harveyi RfR count dan total Vibrio countdi usus udang dibandingkan dengan perlakuan kontrol sebelum uji tantang dan setelah uji tantang. Populasi Bacillussp. NP5 RfR count perlakuan C pada hari ke-30 sebesar 7.29±0.02 log cfu g-1, menurun pada hari ke-32 sebesar 5.97±0.01 log cfu g-1, kemudian meningkat kembali pada hari ke-36 dan 40 sebesar 6.57±0.02 log cfu g-1dan 7.23±0.11 log cfu g-1. Total bacterial countperlakuan C pada hari ke-30 sebesar 8.82±0.04 log cfu g-1, menurun pada hari ke-32 sebesar 6.96±0.06 log cfu g-1, kemudian meningkat kembali pada hari 36 dan hari
ke-40 yaitu sebesar 6.96±0.06 log cfu g-1 dan 9.31±0.08 log cfu g-1. Populasi
tantang serta memberikan kelangsungan hidup yang lebih tinggi setelah uji tantang sebesar 63.33±5.77%. Total hemocyte count (THC) perlakuan C selama penelitian berturut-turut yaitu, 1.99±0.32x107 sel ml-1, 5.25±0.91x107 sel ml-1, 4.65±0.51x107 sel ml-1, 5.07±0.70x107 sel ml-1, 5.99±0.46x107 sel ml-1. Sedangkan aktivitas phenoloxidase perlakuan C selama penelitian berturut-turut yaitu 0.28±0.05, 0.56±0.10, 0.49±0.14, 0.44±0.10, 0.66±0.03. Persentase sel hialin setelah pemberian mikrokapsul sinbiotik selama 30 hari mengalami penurunan, selanjutnya meningkat pada hari 31 kemudian menurun kembali pada hari ke-36 dan 40. Sedangkan persentase sel granular/semigranular meningkat pada hari ke-30, kemudian menurun setelah hari ke-31, dan meningkat kembali pada hari ke-36 dan 40.
SUMMARY
WAODE MUNAENI. Effect of dietary supplementation of synbiotic micro-capsule at different frequencies for Vibrio harveyi control in white shrimp (Litopenaeus vannamei). Supervised by MUNTI YUHANA and WIDANARNI.
The application of intensive cultivation to increase shrimp production has resulted in deterioration of water quality which influences disease susceptibility. One of the important diseases in shrimp is vibriosis. This disease is mainly caused by luminous Vibrio harveyi. One of the biological control strategies to improve disease resistance of aquaculture organisms is synbiotic application. Previous research has showed that the application of fresh culture synbiotic at different frequencies resulted in different effects on the immune response of white shrimp (L. vannamei). The aim of this study was to evaluate the effect of micro-encapsulated synbiotic application at different frequencies for luminous disease control in white shrimp (Litopenaeus vannamei). The luminous disease is caused by Vibrio harveyi. In this experiment, a synbiotic which was a combination of the probiotic Bacillus sp. NP5 RfR and the oligosaccharides from sweet potato (Ipomea batatasL.) jago variety was apllied. The synbiotic was encapsulated by spray drying method. The in vivo experiment was conducted by supplementing the shrimp’s diet with the synbiotic micro-capsule for 40 days. Treatments included the administration synbiotic micro-capsule in different frequencies i.e. once a week (A), twice a week (B), daily (C), and without synbiotic micro-capsule (control treatment). The control treatment consisted of positive (K+) and negative (K-) controls. After 30 days period, all of the shrimp were challenged by intramuscular injection of pathogenic V. harveyi RfR at a concentration of 106 CFU ml-1 except the negative control. The shrimp were then kept for a further 9 days. The observation of the bacteria population in the intestines (Bacillus sp. NP5 RfRcount, total bacterial count, V. harveyiRfRcount and total Vibrio count) and the immune response (total hemocyte count, differential hemocyte, phenoloxidase activity) were done on day 0 (before treatment), day 30 (before the challenge test), day 32 (1 day post challenge test), day 36 (4 days post challenge test), and day 40 (9 days after challenge test).
63.33±5.77%. The total hemocyte count (THC) for treatment C during the duration of the study was, respectively, 1.99 ± 0.32 x 107 cells ml-1, 5.25 ± 0.91 x 107 cells ml-1, 4.65 ± 0.51 x 107 cells ml-1, 5.07 ± 0.70 x 107 cells ml-1, and 5.99 ± 0.46 x 107 cells ml-1. The phenoloxidase activity for treatment C during the duration of the study was, respectively, 0.28 ± 0.05, 0.56 ± 0.10, 0.49 ± 0.14, 0.44 ± 0.10, 0.66 ± 0.03. Hyaline cell percentage after synbiotic micro-capsule suplementation during 30 days decreased, and then increased on day 31 and decreased again on day 36 and day 40. Granular/semigranular cell percentage increased on day 30, and then decreased after on day 31, and which always tended to decrease up to day 40.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Penguji Luar Komisi pada Ujian Tesis: Dr Ir Mia Setiawati, MSi Dr Ir Drajat Martianto, MS
Penguji pada Ujian Terbuka: Prof Dr Ir Marimin, MS Dr Ir Naresworo Nugroho, MS
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EFEK PEMBERIAN MIKROKAPSUL SINBIOTIK DENGAN
FREKUENSI BERBEDA TERHADAP INFEKSI Vibrio harveyi
PADA UDANG VANAME (Litopenaeus vannamei)
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Judul Tesis : Efek Pemberian Mikrokapsul Sinbiotik dengan Frekuensi Berbeda terhadap Infeksi Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei)
Nama : Waode Munaeni
NIM : C151120081
Disetujui oleh
Komisi Pembimbing
Dr Munti Yuhana, SPi, MSi Ketua
Dr Ir Widanarni, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2013 ini ialah mikrokapsul sinbiotik untuk penyakit udang, dengan judul Efek Pemberian Mikrokapsul Sinbiotik dengan Frekuensi Berbeda terhadap Infeksi Vibrio harveyi
pada Udang Vaname (Litopenaeus vannamei).
Terima kasih penulis ucapkan kepada Ibu Dr Munti Yuhana, SPi, MSi dan Ibu Dr Ir Widanarni, MSi selaku pembimbing yang telah banyak meluangkan waktu dan pikiran untuk selalu membimbing dan memberi saran. Ucapan terima kasih kepada Bapak Bambang Hanggono, SPi, MSc selaku pembimbing lapang dari Balai Budidaya Air Payau (BBAP) Situbondo, yang telah membantu selama penelitian di BBAP. Di samping itu, penghargaan penulis sampaikan atas bantuan dana pendidikan magister yang diperoleh dari Beasiswa Unggulan DIKTI dan biaya penelitian yang diperoleh dari dana penelitian BOPTN DIKTI. Penulis juga mengucapkan terima kasih dan penghormatan yang sebesar-besarnya kepada Ayahanda La Ode Muhusini dan Ibunda tercinta Sarifa atas segala kasih sayang, perhatian, doa dan dukungan yang diberikan kepada penulis, serta saudara-saudaraku Wa Ode Mudiani, SH dan LM. Yamin yang telah banyak memberikan dukungan moril maupu materil kepada penulis. Penulis sampaikan pula terima kasih kepada teknisi laboratorium, teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2012.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 2
Rumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE 3
Waktu dan Tempat Penelitian 3
Persiapan Wadah dan Hewan Uji 3
Persiapan Mikroenkapsulasi Sinbiotik 4
Uji In Vivo 5
Perlakuan dan Rancangan Penelitian 6
Paramater Pengamatan 6
Analisis Data 8
3 HASIL DAN PEMBAHASAN 9
Populasi Bakteri di Usus 9
Laju Pertumbuhan Spesifik 12
Rasio Konversi Pakan 13
Respon Imun 14
Kelangsungan Hidup 18
Parameter Kualitas Air 19
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1 Kualitas air selama penelitian 20
DAFTAR GAMBAR
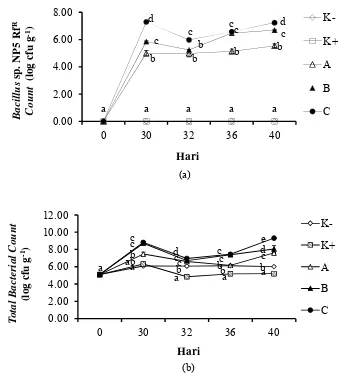
1 Populasi Bacillus sp. NP5 RfR count (a) dan total bacterial count (b) dari usus udang vaname (L. vannamei). Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali
seminggu (B), setiap hari (C). 10
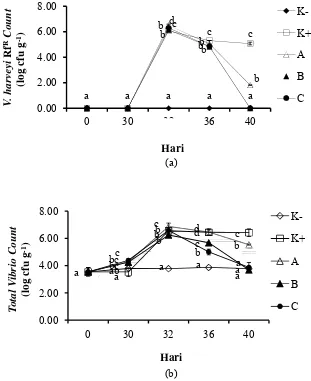
2 Populasi V. harveyiRfRcount(a) dan total Vibrio count (b) pada usus udang vaname (L. vannamei). Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K-(kontrol negatif), K+ K-(kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari
(C). 11
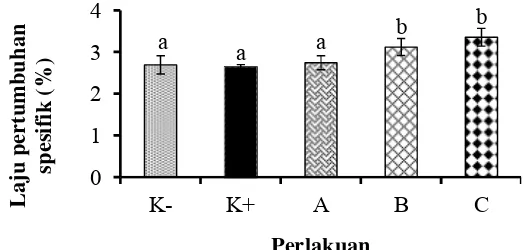
3 Laju pertumbuhan spesifik udang vaname (L. vannamei) selama 30 hari perlakuan. Data (rata-rata±SD) dengan huruf berbeda menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua
kali seminggu (B), setiap hari (C). 12
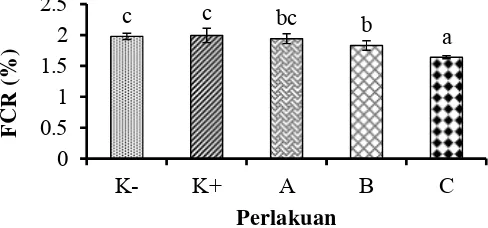
4 Rasio konversi pakan (FCR) udang vaname (L. vannamei) selama 30 hari. Data (rata-rata±SD) dengan huruf berbeda menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali
seminggu (B), setiap hari (C). 13
5 Total hemocyte count(THC) udang vaname (L. vannamei) sebelum dan setelah uji tantang dengan V. harveyi. Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K-(kontrol negatif), K+ K-(kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari
(C). 14
6 Aktivitas phenoloxydase (PO) udang vaname (L. vannamei) sebelum dan setelah uji tantang dengan V. harveyi. Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali
seminggu (B), setiap hari (C). 15
7 Persentase sel hialin (a) dan granular/semigranular (b) udang vaname (L. vannamei). Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C). 17 8 Kelangsungan hidup udang vaname (L. vannamei) sebelum uji tantang
berbeda menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C). 19
DAFTAR LAMPIRAN
1 Analisis statistik terhadap populasi Bacillussp. NP5 RfR count 25 2 Analisis statistik terhadap total bacterial count 27 3 Analisis statistik terhadap populasiVibrio harveyiRfR 30 4 Analisis statistik terhadap total Vibrio count 32 5 Analisis statistik terhadap laju pertumbuhan spesifik udang vaname 34 6 Analisis statistik terhadap rasio konversi pakan (FCR) udang vaname 35 7 Analisis statistik terhadap total hemocyte count(THC) udang vaname 36 8 Analisis statistik terhadap phenoloxidase(PO) udang vaname 39 9 Analisis statistik terhadap differential hemocyte(hialin) udang vaname 42 10 Analisis statistik terhadap differential hemocyte (granular) udang
vaname 45
1 PENDAHULUAN
Latar Belakang
Udang vaname (Litopenaeus vannamei) telah menjadi salah satu komoditas utama yang dibudidayakan saat ini di Indonesia karena bernilai ekonomis tinggi (KKP 2013). Penerapan budidaya intensif untuk meningkatkan produksi udang dapat berakibat pada penurunan kualitas perairan, sehingga memicu timbulnya penyakit (Chiu et al. 2007). Penyakit pada udang vaname (L. vannamei) dapat disebabkan oleh bakteri, virus, jamur, dan parasit. Salah satu spesies bakteri yang paling banyak menyebabkan penyakit dan kematian pada budidaya udang vaname adalah Vibrio harveyi (Hatmanti 2003). Bakteri ini merupakan penyebab penyakit vibriosis atau penyakit berpendar (Phuoc et al. 2009). Bakteri V. harveyi
merupakan mikroflora alami di air laut yang terdapat dalam saluran pencernaan inang yang dapat menyebabkan kematian pada larva udang di hatchery(Chrisolite
et al. 2008), mulai dari stadia nauplius, zoea, mysis dan post larva sampai pada udang dewasa di tambak pembesaran (Saulnier et al. 2000). Selain itu, V. harveyi
merupakan patogen serius untuk berbagai jenis organisme akuakultur di seluruh dunia (Soto-Rodriguez et al.2012).
Salah satu alternatif yang dapat dilakukan untuk menanggulangi penyakit vibriosis adalah dengan pemberian sinbiotik. Sinbiotik merupakan suplemen nutrisi kombinasi antara probiotik dan prebiotik yang dapat memberikan efek menguntungkan pada inang (Merrifieldet al. 2010, Nayak 2010, Cerezuela et al. 2011). Probiotik adalah suatu aplikasi mikroba hidup yang dapat memberikan keuntungan pada inangnya dengan cara memodifikasi mikroflora alami dalam saluran pencernaan inang atau lingkungannya, untuk meningkatkan efisiensi pakan inang, respon inang terhadap serangan penyakit dan kualitas lingkungan (Verschuere et al. 2000, Merrifield et al. 2010, Nayak 2010, Cerezuela et al. 2011). Prebiotik adalah bahan pangan yang tidak mampu dicerna oleh inang tetapi secara selektif dapat dimetabolisme oleh bakteri sehingga dapat meningkatkan sistem imun inang (Ringo et al. 2010). Pemanfaatan sinbiotik telah menjadi salah satu strategi pengendalian secara biologis untuk meningkatkan pertumbuhan dan resistensi penyakit pada organisme akuakultur (Cerezuela et al. 2011). Penggunaan probiotik dan prebiotik secara bersamaan dapat meningkatkan kelangsungan hidup dan sistem imun udang (Li et al. 2009) dan juga pada ikan koi (Lin et al. 2012). Penambahan sinbiotik dalam pakan dapat memberikan kelangsungan hidup dan respon imun tertinggi pada udang vaname dibandingkan dengan hanya diberikan dalam bentuk probiotik atau prebiotik saja (Arisa 2011).
2
juga dapat mengkonversi cairan menjadi bubuk padatan sehingga memudahkan penanganan dan pengemasannya (Yuliani et al. 2007). Beberapa metode yang dapat digunakan untuk mikroenkapsulasi bakteri probiotik yaitu dengan spray drying, extrusion, emulsion, dan fase separasi (Kailasapathy 2002). MetodeSpray drying merupakan metode mikroenkapsulasi yang tergolong murah dibanding metode lainnya (Jyothi et al. 2010). Mikroenkapsulasi dengan metode spray dryingtidak hanya terbatas pada bahan makanan saja tetapi juga dapat dilakukan pada makhluk hidup bersel tunggal seperti bakteri (Triana et al. 2006).
Bakteri probiotik yang dapat digunakan adalah bakteri dari genus Bacillus. Bakteri probiotik dari genus Bacillus memiliki daya tahan terhadap suhu dan tekanan tinggi serta telah digunakan secara luas dalam pakan akuakultur (Lin et al. 2012). Penggunaan probiotik Bacillus sp. NP5 telah dicobakan pada udang vaname (Muhammad 2013) dan pada ikan nila (Putra 2010, Tanbiyaskur 2011). Probiotik Bacillus sp. NP5 juga dapat beradaptasi terhadap salinitas yang tinggi (Azhar 2014).
Prebiotik yang dapat digunakan adalah oligosakarida dari tepung ubi jalar (Ipomea batatas L.) varietas jago. Ubi jalar (I. batatas L.) mengandung oligosakarida yang tidak dapat dicerna inang dan dapat berfungsi sebagai prebiotik (Marlis 2008). Bahan penyalut yang dapat digunakan untuk mikroenkapsulasi sinbiotik adalah protein whey (Weinbreck et al. 2010) dan maltodekstrin (Mu˜noz-Celaya et al. 2012, Wang et al. 2013). Protein whey
dipilih sebagai bahan enkapsulasi karena diketahui memiliki sifat permeabilitas oksigen yang relatif rendah (Weinbreck et al. 2010). Penggunaan mikrokapsul sinbiotik dari Bacillus sp. NP5 yang dikombinasikan dengan oligosakarida ubi jalar (I. batatas L.) varietas jago dengan dosis 2% mampu meningkatkan pertumbuhan, kelangsungan hidup, respon imun dan resistensi penyakit pada udang vaname yang diinfeksi V. harveyi(Zubaidah et al. 2014).
Penggunaan sinbiotik bergantung pada spesies, dosis, dan durasi pemberian serta jenis prebiotik dan probiotik yang diberikan (Merrifieldet al. 2010,Nayak 2010, Cerezuela et al. 2011). Frekuensi pemberian sinbiotik yang berbeda dapat mempengaruhi induksi repon imun terhadap inang (Nayak 2010). Pemberian sinbiotik dengan frekuensi berbeda dapat memberikan pengaruh berbeda pula terhadap pertumbuhan, respon imun dan resistensi penyakit pada udang vaname (Septiani 2011, Oktaviana et al. 2014). Oleh karena itu, penelitian tentang frekuensi pemberian mikrokapsul sinbiotik yang optimal pada udang vaname terhadap pertumbuhan, respon imun dan resistensi terhadap infeksi V. harveyi
perlu dilakukan.
Rumusan Masalah
3
Penambahan sinbiotik pada pakan udang vaname dipengaruhi oleh frekuensi pemberian. Pemberian sinbiotik dengan frekuensi berbeda dapat memberikan pertumbuhan, rasio konversi pakan, respon imun dan resistensi penyakit yang berbeda pada udang vaname. Penelitian ini mengkaji efek pemberian mikrokapsul sinbiotik dengan frekuensi berbeda dengan harapan dapat memperoleh frekuensi yang tepat untuk meningkatkan pertumbuhan, kelangsungan hidup, respon imun dan resistensi terhadap infeksiV. harveyipada udang vaname.
Tujuan Penelitian
Tujuan penelitian ini adalah mengkaji efek pemberian mikrokapsul sinbiotik dengan frekuensi berbeda pada udang vaname terhadap pertumbuhan, kelangsungan hidup, rasio konversi pakan, respon imun dan resistensi terhadap infeksiV. harveyi.
Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi tentang pemberian mikrokapsul sinbiotik dengan frekuensi yang tepat untuk meningkatkan pertumbuhan, kelangsungan hidup, respon imun dan resistensi terhadap infeksi V. harveyipada udang vaname.
Hipotesis
Hipotesis dalam penelitian ini adalah pemberian mikrokapsul sinbiotik dengan frekuensi tertentu pada udang vaname dapat meningkatkan pertumbuhan, kelangsungan hidup, rasio konversi pakan, respon imun dan resistensi penyakit terhadap infeksi V. harveyipada udang vaname.
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan selama 4 bulan, mulai Bulan November 2013-Maret 2014 bertempat di: (1) Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; (2) Laboratorium Pilot Plant SEAFAST (South East Asian Food and Agriculture Science and Technology) Center, Institut Pertanian Bogor; dan (3) Balai Budidaya Air Payau (BBAP) Situbondo.
Persiapan Wadah dan Hewan Uji
4
Hewan uji yang digunakan adalah udang vaname berukuran 2.6±0.3 g berasal dari Balai Budidaya Air Payau (BBAP) Situbondo, Jawa Timur. Udang diadaptasikan dan dipelihara selama 2 minggu sebelum diberi perlakuan. Kepadatan udang perlakuan sebanyak 10 ekor/bak. Selama pemeliharaan dilakukan penyiponan dan pergantian air sebanyak 50% setiap hari.
Persiapan Mikroenkapsulasi Sinbiotik
Tahap I: Persiapan Prebiotik Pembuatan Tepung Ubi Jalar
Pembuatan tepung ubi jalar mengacu pada metode Marlis (2008). Ubi jalar segar dari varietas jago dibersihkan dan dikupas, kemudian diiris dengan ketebalan ± 1 mm. Selanjutnya irisan ubi jalar dikeringkan dalam oven pengering dengan suhu 55oC selama 15 jam. Irisan ubi kemudian digiling dengan willey mill
dan diayak menggunakan ayakan ukuran 60 mesh. Tepung ubi jalar sebanyak 500 g dicampur air dengan perbandingan 1:1 (w/v) kemudian dikukus selama 30 menit pada suhu 100oC. Setelah dikukus, adonan dibuat kembali menjadi tepung dengan metode yang sama, selanjutnya dilakukan ekstraksi oligosakarida.
Ekstraksi Oligosakarida
Ekstraksi oligosakarida dan pengukuran total padatan terlarut mengacu pada metode Muchtadi (1989). Tepung ubi jalar disuspensikan dalam etanol 70% dengan perbandingan 1:10, diaduk selama 15 jam menggunakan magnetic stirrer
pada suhu ruang. Selanjutnya disaring dengan menggunakan kertas saring dan residu dibilas dengan etanol 70%. Filtrat yang dihasilkan dipekatkan pada
evaporator vacum pada suhu 40oC, selanjutnya dilakukan pengukuran total padatan terlarut.
Pengukuran Kosentrasi Oligosakarida (total padatan terlarut)
Cawan porselin dikeringkan dengan oven selama 2 jam pada suhu 100oC. Cawan tersebut didinginkan dalam desikator kemudian ditimbang (a gram). Selanjutnya, 1 ml oligosakarida hasil ekstraksi dimasukan dalam cawan dan ditimbang (b gram) kemudian dimasukan dalam oven pada suhu 100oC selama 24 jam. Setelah kering, cawan didinginkan selama 10 menit kemudian ditimbang (c gram). Perhitungan total padatan terlarut adalah membandingkan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan. Rumus yang digunakan sebagai berikut:
Keterangan :
TPT = Total padatan terlarut
a = Berat cawan sebelum diisi ekstrak oligosakarida b = Berat cawan setelah diisi ekstrak oligosakarida
5
Tahap II: Kultur Bakteri Probiotik
Bakteri probiotik yang digunakan adalah Bacillus sp. NP5 yang telah resisten terhadap 50 µg ml-1antibiotik rifampisin (rif 0.25 g, 9.5 ethanol absolute, 0.5 ml aquabidest) (Bacillussp. NP5 RfR). Probiotik Bacillussp. NP5 merupakan probiotik yang diisolasi dari saluran pencernaan ikan nila (Putra 2010). Sel probiotik Bacillussp. NP5 RfRdikultur pada media SWC (sea water complete: 5 g
bactopepton, 1 gyeast extract, 3 ml gliserol, 750 ml air laut, 250 ml aquades, 20 g
bactoagar) dan diinkubasi selama 24 jam pada suhu 29oC. Bakteri diinokulasi ke media SWC cair dan diinkubasi dalam waterbath shakerselama 18 jam pada suhu 29oC dengan kecepatan 140 rpm. Suspensi bakteri dipindahkan ke dalam tabung corning 25 ml dan disentrifuse dengan kecepatan 5.000 rpm selama 10 menit. Sel probiotik dicuci dengan 25 ml larutan PBS (phosphate buffer saline: 8 g NaCL, 0.2 g KH2PO4, 1.5 g Na2HPO4, 0.2 g KCL, 1000 ml aquades). Selanjutnya dihomogenkan dan disentrifuse kembali dengan kecepatan 5.000 rpm selama 10 menit. Hasil suspensi ini merupakan probiotik yang akan digunakan.
Tahap III: Persiapan Bahan Penyalut Mikroenkapsulasi
Bahan penyalut yang digunakan pada penelitian ini adalah whey dan maltodekstrin. Whey diperoleh dengan cara memisahkan protein kasein dan protein Whey dari susu sapi dengan menggunakan jeruk nipis. Susu sapi segar direbus hingga mendidih kemudian didinginkan. Selanjutnya dicampurkan dengan perasan jeruk nipis dengan perbandingan 40:1 (40 ml susu:1 ml perasan jeruk nipis), kemudian dihomogenkan dengan cara diaduk-aduk selama 10 menit hingga terbentuk gumpalan-gumpalan. Selanjutnya didiamkan sampai gumpalan tersebut mengendap, kemudian disaring. Cairan bening di atas gumpalan merupakan whey
yang akan digunakan.
Tahap IV: Mikroenkapsulasi Sinbiotik
Sinbiotik yang digunakan merupakan kombinasi dari sel Bacillus sp. NP5 RfR kosentrasi 108 cfu ml-1 sebanyak 1% dan prebiotik sebanyak 2% dari total larutan (v/v) (Mahious et al. 2006). Sinbiotik dicampur dengan bahan penyalut maltodekstrin dan whey dari susu sapi sampai homogen menggunakan mixer. Perbandingan sinbiotik, whey dan maltodekstrin adalah 1:1:0,1 (v/v/w). Selanjutnya dimikroenkapsulasi dengan spray dryer (Mini bunchi 190) pada suhu
inlet150oC dan suhu outlet70oC.
Uji In Vivo
Uji in vivo pada penelitian ini meliputi aplikasi mikrokapsul sinbiotik pada udang vaname melalui pakan dan pengujian resistensi udang vaname terhadap infeksi V. harveyi. Pakan uji yang digunakan berupa pakan pelet komersil merek
6
07.00, 11.00, 15.00, dan 19.00 WIB secara at satiation dengan feeding rate(FR) sebesar 10% dari biomassa udang. Pemberian perlakuan dilakukan selama 30 hari,
kemudian pada hari ke-31 udang diinfeksi V. harveyi 106 cfu g-1. Bakteri
V. harveyiyang digunakan untuk infeksi adalah V. harveyiRfR yaitu bakteri yang telah resisten terhadap antibiotik rifampisin dan ditingkatkan virulensinya dengan uji postulat koch. Infeksi dilakukan dengan metode injeksi. Kontrol negatif diinjeksi dengan PBS. Selanjutnya udang dipelihara kembali selama 9 hari dengan tetap diberikan pakan sesuai perlakuan kemudian dilakukan pengamatan setiap 4 hari.
Perlakuan dan Rancangan Penelitian
Rancangan penelitian menggunakan Rancangan Acak Lengkap dengan 5 perlakuan dan 4 ulangan.
Perlakuan K- : Pemberian pakan komersil tanpa penambahan mikrokapsul sinbiotik dan tidak diinfeksi V. harveyi(kontrol negatif)
Perlakuan K+ : Pemberian pakan komersil tanpa penambahan mikrokapsul sinbiotik dan diinfeksi V. harveyi(kontrol positif)
Perlakuan A : Pemberian pakan komersil dengan penambahan mikrokapsul sinbiotik satu kali seminggu dan diinfeksi V. harveyi
Perlakuan B : Pemberian pakan komersil dengan penambahan mikrokapsul sinbiotik dua kali seminggu dan diinfeksi V. harveyi
Perlakuan C : Pemberian pakan komersil dengan penambahan mikrokapsul sinbiotik setiap hari dan diinfeksi V. harveyi
Paramater Pengamatan
Parameter yang diamati meliputi penghitungan populasi bakteri di usus, laju pertumbuhan spesifik, rasio konversi pakan, respon imun, kelangsungan hidup, dan kualitas air.
Penghitungan Populasi Bakteri di Usus
Usus dari 2 ekor udang pada masing-masing perlakuan, ditimbang sebanyak 0.01 g dan dihomogenkan dalam 0.99 ml larutan PBS. Selanjutnya disebar pada media agar spesifik TCBS (Thiosulphate Citrate Bile-Salt Sucrose) menggunakan antibiotik rifampisin untuk pengamatan V. harveyi RfR Count dan TCBS tanpa antibiotik untuk total Vibrio count. Sedangkan pengamatan Bacillus
7
Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik atau specific growth rate (SGR) dihitung setelah 30 hari perlakuan dengan rumus yang digunakan dalam Daniels et al. (2010), Zokaeifar et al.(2012):
SGR (%) = 100 x (ln Wt - ln Wo)/t
Keterangan:
SGR : specific growth rate(%)
Wt : Bobot rata-rata udang pada akhir penelitian (gram) Wo : Bobot rata-rata udang pada awal penelitian (gram)
t : Periode penelitian (hari)
Rasio Konversi Pakan
Rasio konversi pakan atau feed conversion ratio(FCR) dihitung setelah 30 hari perlakuan dengan rumus yang digunakan dalam Daniels et al. (2010), Zokaeifar et al.(2012):
Keterangan :
FCR = Konversi pakan F = Jumlah pakan
Bt = Biomassa udang akhir penelitian (gram) Bo = Biomassa udang awal penelitian (gram)
Respon Imun
Parameter respon imun pada penelitian ini meliputi total hemocyte count
(THC), differential hemocyte, aktivitas phenoloxidase (PO). Pengamatan respon imun dilakukan pada hari ke-0 (sebelum perlakuan), hari ke-30 (sebelum uji tantang), hari ke-32 (1 hari setelah uji tantang), hari ke-36 (4 hari setelah uji tantang), dan hari ke-40 (9 hari setelah uji tantang).
Total Hemocyte Count(THC) (Blaxhall and Daishley 1973)
Prosedur perhitungan THC yaitu: hemolymph udang diambil sebanyak 0,1 ml dari pangkal kaki renang pertama dengan menggunakan syringe ukuran 1
ml yang telah diisi 0,3 ml antikoagulan Na-sitrat 3,8% kemudian dihomogenkan. Setelah homogen, tetesan pertama dibuang dan tetesan kedua diteteskan pada
hemocytometer. Selanjutnya, total hemocyte diamati dan dihitung jumlahnya selnya di bawah mikroskop. Rumus untuk menghitung total hemocyteyaitu:
8
Differential Hemocyte(Martin and Graves 1995)
Jumlah hemocytedihitung hingga mencapai 100 sel kemudian menentukan persentase tiap jenis selnya (hyalinedan granular). Persentase tiap jenis hemocyte
dihitung menggunakan rumus:
Phenoloxidase(PO) Activity(Chiu et al. 2007)
Prosedur pengukuran aktivitas phenoloxidase berdasarkan formasi
dopachrome yang dihasilkan oleh L-DOPA. Campuran haemolymph 0,1 ml dan 0,9 antikoagulan disentrifuse selama 10 menit pada 1.500 rpm dengan suhu 4oC. Selanjutnya supernatan dikeluarkan dan pelet disuspensikan ke dalam larutan
cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M triosodium citrate, pH 7) selajutnya disentrifuse kembali. Pelet kemudian disuspensikan kembali ke dalam 200 µl cacodylate-citrate buffer. Sebanyak 100 µl suspensi sel kemudian diinkubasi selama 10 menit menggunakan 50 µl trypsin
(1 mg ml-1 cacodylate buffer) pada suhu 25-26 oC. Setelah 5 menit, ditambahkan 50 µl L-DOPA (1 mg ml-1cacodylate buffer) dan 800 µl cacodylate-citrate buffer. Pengukuran densitas optikan (DO) menggunakan spektrofotometer dengan panjang gelombang 492 nm. Larutan standar yang digunakan mengandung 100 µl suspensi hemocyte, 50 µl cacodylate buffer (pengganti trypsin), dan 50 µl L-DOPA digunakan untuk pengukuran backgroundaktivitas PO pada larutan uji.
Kelangsungan Hidup
Kelangsungan hidup atau survival rate (SR) dihitung sebelum uji tantang dan 9 hari setelah uji tantang dengan rumus yang digunakan dalam Daniels et al. (2010):
Keterangan:
SR = Tingkat kelangsungan hidup (%)
Nt = Jumlah udang hidup pada akhir penelitian (ekor) No = Jumlah udang hidup pada awal penelitian (ekor)
Parameter Kualitas Air
Parameter kualitas air yang diamati pada penelitian ini adalah suhu, pH, salinitas, oksigen terlarut, dan TAN (Total Amonia Nitrogen). Pengukuran kualitas air dilakukan pada awal, tengah, dan akhir penelitian.
Analisis Data
Penelitian ini menggunakan rancangan percobaan rancangan acak lengkap (RAL). Data dianalisis menggunakan Microsoft Excel 2010 dan diuji dengan
9
ANOVA (Analisis of Varians), jika berpengaruh nyata dilanjutkan dengan uji lanjut Duncan dengan menggunakan program SPSS (Statistical Program Software System) versi 16.
3 HASIL DAN PEMBAHASAN
Populasi Bakteri di Usus
Penghitungan populasi bakteri di usus udang vaname meliputi Bacillussp.
NP5 RfR count (Gambar 1a) dan total bacterial count (Gambar 1b) serta
V. harveyi RfR count (Gambar 2a) dan total Vibrio count (Gambar 2b). Total Bacillussp. NP5 RfR counttertinggi selama penelitian terdapat pada perlakuan C, berbeda nyata (P<0.05) dengan semua perlakuan lainnya. Populasi Bacillus sp. NP5 RfR count perlakuan C pada hari ke-30 sebesar 7.29±0.02 log cfu g-1, berbeda nyata (P<0.05) dengan perlakuan lainnya (Lampiran 1). Selanjutnya menurun pada hari ke-32 (1 hari setelah uji tantang) sebesar 5.97±0.01 log cfu g-1, kemudian meningkat kembali pada hari ke-36 (4 hari setelah uji tantang) dan hari ke-40 (9 hari setelah uji tantang) sebesar 6.57±0.02 log cfu g-1 dan 7.23±0.11 log cfu g-1.
Total bacterial count pada hari ke-30, semua perlakuan mengalami peningkatan. Nilai tertinggi total bacterial count selama penelitian terdapat pada perlakuan C. Total bacterial countperlakuan C pada hari ke-30 sebesar 8.82±0.04 log cfu g-1, berbeda nyata (P<0.05) dengan perlakuan A, K+ dan K-, tetapi tidak berbeda nyata (P>0.05) dengan perlakuan B (Lampiran 2). Selanjutnya menurun pada hari ke-32 sebesar 6.96±0.06 log cfu g-1, kemudian meningkat kembali pada hari ke-36 dan hari ke-40 yaitu sebesar 6.96±0.06 log cfu g-1 dan 9.31±0.08 log cfu g-1.
Meningkatnya total bacterial count(Gambar 1b) pada perlakuan C dan B, diduga karena pengaruh penambahan probiotik Bacillus sp. NP5 RfR. Hal ini dapat dilihat dari tingginya nilai total bacterial count pada perlakuan dengan penambahan mikrokapsul sinbiotik dibanding dengan perlakuan kontrol. Menurut Chiu et al. (2007), setelah penambahan bakteri probiotik setelah periode tertentu pada udang diduga dapat meningkatkan level bakteri pada saluran pencernaan. Penelitian Li et al. (2009) juga melaporkan, bahwa pemberian Bacillus OJ secara signifikan mempengaruhi populasi mikroba usus pada udang vaname. Selain itu, meningkatnya total bacterial count juga diduga dipengaruhi oleh penambahan prebiotik dari oligosakarida ubi jalar (I. batatas L.) varietas jago yang mampu
meningkatkan pertumbuhan bakteri probiotik Bacillus sp. NP5 RfR. Ubi jalar (I. batatasL.) mengandung oligosakarida yang tidak dapat dicerna oleh inang dan
10
Gambar 1 Populasi Bacillus sp. NP5 RfR count (a) dan total bacterial count (b) dari usus udang vaname (L. vannamei). Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C).
Populasi V. harveyiRfR count (Gambar 2a) dan total Vibrio count(Gambar 2b) tertinggi setelah 1 hari uji tantang (hari ke-32) terdapat pada perlakuan A sebesar 6.49±0.10, berbeda nyata dengan perlakuan lainnya (Lampiran 3 dan 4). Hari ke-36 (4 hari setelah uji tantang), V. harveyiRfR count dan total Vibrio count
semua perlakuan menunjukkan penurunan sampai hari ke-40. Total V. harveyiRfR pada perlakuan C dan B mengalami penurunan signifikan dibanding perlakuan K+.
Penurunan populasi V. harveyi RfR count dan total Vibrio count diduga dipengaruhi oleh pemberian mikrokapsul sinbiotik. Hal ini ditegaskan pula oleh Cerezuela et al. (2011), bahwa bakteri probiotik dapat menghasilkan molekul antibakteri seperti bakteriosin yang secara langsung menghambat bakteri lain, aktif memerangi infeksi, menghambat pergerakan bakteri lain di dinding usus (translokasi), meningkatkan fungsi penghalang mukosa dengan meningkatkan
0.00 hidup, kecernaan pakan, aplikasi prebiotik jug meningkatkan sistem imun probiotik Bacillus OJ dan menurunkan populasi bakteri 2009).
Gambar 2 Populasi V. harveyi
udang vaname
selain dapat meningkatkan pertumbuhan, kelangsung pakan, efisiensi pakan, komposisi mikroflora dalam
juga dapat menghambat pertumbuhan patogen sistem imun. Penelitian lain melaporkan bahwa pemberian
OJ dan isomaltooligosakarida pada udang vaname bakteri Vibrio yang diduga sebagai bakteri patogen
V. harveyi RfR count (a) dan total vibrio count(b) vaname (L. vannamei). Data (rata-rata±SD) dengan berbeda pada hari yang sama menunjukkan berbeda nyata
12
Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik dihitung selama 30 hari perlakuan. Pengaruh penambahan mikrokapsul sinbiotik pada pakan udang terhadap laju pertumbuhan spesifik udang vaname disajikan pada Gambar 3. Laju pertumbuhan spesifik udang vaname selama 30 hari menunjukkan, bahwa perlakuan pemberian mikrokapsul sinbiotik perlakuan C memberikan laju pertumbuhan tertinggi sebesar 3.35±0.25%, berbeda nyata (p<0.05) dengan perlakuan A sebesar 2.74±0.48%, K+ sebesar 2.64±0.42% dan K- sebesar 2.69±0.35%, tetapi tidak berbeda nyata dengan perlakuan B (p>0.05) (3.05±0.5%) (Lampiran 5).
Gambar 3 Laju pertumbuhan spesifik udang vaname (L. vannamei) selama 30 hari perlakuan. Data (rata-rata±SD) dengan huruf berbeda menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C).
Tingginya nilai laju pertumbuhan spesifik pada perlakuan C dan B diduga dipengaruhi oleh pemberian sinbiotik dari probiotik Bacillus sp. NP5 RfR dan prebiotik oligosakarida dari ubi jalar (I. batatas L.) varietas jago. Bakteri probiotik Bacillus sp. NP5 RfR diduga mampu mensekresikan enzim exogenous
yang berperan penting dalam pencernaan, sedangkan prebiotik mampu menstimulir pertumbuhan probiotik di usus. Hal ini dikemukakkan oleh Wang (2007) bahwa meningkatnya aktivitas enzim pencernaan yang diinduksi oleh probiotik diduga dapat meningkatkan pertumbuhan udang. Aplikasi sinbiotik dapat memaksimalkan kecernaan pakan sehingga dapat meningkatkan pertumbuhan inang (Cerezuela et al. 2011).
Pemberian sinbiotik dapat menstimulir pertumbuhan mikrobiota di usus yang mungkin dapat merangsang sistem imun non spesifik dengan tanpa memberikan pengaruh negatif terhadap pertumbuhan inang (Ai et al. 2011). Hasil penelitian Putra (2010) melaporkan bahwa penambahan sinbiotik (bakteri probiotik Bacillus sp. NP5 dan prebiotik oligosakarida dari ubi jalar varietas sukuh) pada pakan dapat meningkatkan pertumbuhan, efisiensi pakan, aktivitas enzim, dan kecernaan pakan pada ikan nila (Oreochromis niloticus). Penelitian lain juga menunjukan bahwa penggunaan sinbiotik telah terbukti dapat meningkatkan pertumbuhan, efisiensi pakan, respon imun, dan resistensi penyakit pada inangnya. Seperti penelitian penggunaan bakteri probiotik Bacillus spp. dan
13
mannanoligosakarida (MOS) pada lobster Homarus gammarus L. (Daniels et al.
2010), pemberian probiotik Bacillus subtilis dan prebiotik fruktooligosakarida pada juvenil yellow croake (Ai et al. 2011).
Rasio Konversi Pakan
Rasio konversi pakan dihitung setelah 30 hari perlakuan. Pengaruh perlakuan terhadap rasio konversi pakan pada udang vaname dapat dilihat pada Gambar 4. Rasio konversi pakan yang terendah terdapat pada perlakuan C yaitu sebesar 1.63 ± 0.03. Hasil uji lanjut dengan Uji Duncan menunjukkan bahwa perlakuan C berbeda nyata (p<0.05) dengan perlakuan B, A, K+, dan K- yaitu sebesar 1.83±0.27, 1.95±0.07, 1.99±0.23, dan 1.98±0.05. Perlakuan B tidak berbeda nyata (p>0.05) dengan perlakuan A, namun berbeda nyata (p<0.05) dengan perlakuan lainnya. Perlakuan A, K+, dan K- tidak berbeda nyata (p>0.05) (Lampiran 6).
Gambar 4 Rasio konversi pakan (FCR) udang vaname (L. vannamei) selama 30 hari.Data (rata-rata±SD) dengan huruf berbeda menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C).
Perlakuan C dan B selama 30 hari mampu memberikan FCR yang lebih rendah dibanding kontrol. Penelitian lain juga menunjukkan, bahwa pemberian sinbiotik (probiotik SKT-b dan oligosakarida dari ubi jalar varietas sukuh) dengan frekuensi pemberian setiap hari selama 30 hari pada udang vaname dapat memberikan FCR yang rendah (Oktaviana et al. 2014). Rendahnya FCR pada penelitian ini, diduga karena peranan dari bakteri probiotik Bacillus sp. NP5 RfR yang mampu mensekresikan enzim exogenous. Enzim exogenous merupakan enzim yang dapat mengkatalisis makromolekul menjadi molekul sederhana sehingga lebih mudah dicerna oleh inang. Meningkatnya aktivitas enzim pencernaan yang diinduksi oleh bakteri probiotik (Wang 2007), seperti protease, lipase dan amilase dapat merangsang dan meningkatkan kecernaan inang (Zhang
et al. 2010). Bakteri probiotik Bacillus NP5 yang diisolasi dari ikan nila (Oreochromis niloticus) merupakan bakteri amilolitik yang berperan penting dalam pencernaan (Putra 2010). Penelitian lain juga melaporkan bahwa bakteri
Bacillus sp. yang diisolasi dari usus ikan mas (Cyprinus carpio) memiliki amilolitik ekstraselular, selulolitik, proteolitik dan lipolitik yang dapat meningkatkan nilai nutrisi pakan (Bairagi et al.2002).
14
Respon Imun
Total Hemocyte Count(THC)
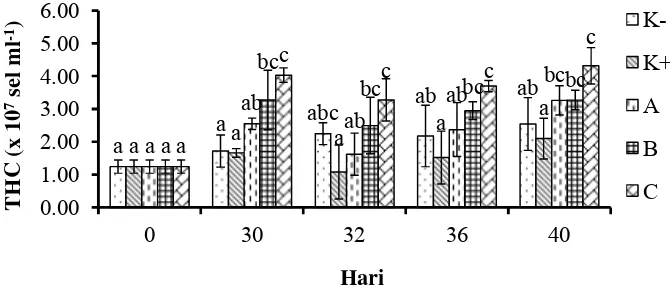
Pengukuran THC dilakukan sebelum perlakuan, sebelum uji tantang (30 hari perlakuan), 1 hari setelah uji tantang, 4 hari setelah uji tantang dan 9 hari setelah uji tantang. Hasil pengukuran THC disajikan pada Gambar 5. THC udang vaname mengalami peningkatan setelah 30 hari perlakuan, selanjutnya menurun setelah 1 hari uji tantang (hari ke 32) dan meningkat kembali pada hari ke-36 dan 40. Selama penelitian, perlakuan C berbeda nyata dengan perlakuan K+ (Lampiran 7). Niali THC perlakuan C selama penelitian yaitu pada 30 hari (4.03±0.22x107sel ml-1), 32 hari (3.28±0.64x107 sel ml-1), 36 hari (3.70±0.17x107 sel ml-1) dan 40 hari (4.32 ±0.55x107 sel ml-1).
Gambar 5 Total hemocyte count (THC) udang vaname (L. vannamei) sebelum dan setelah uji tantang dengan V. harveyi.Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C).
Hemocytememiliki peranan penting dalam sistem imun krustase. Hemocyte
berfungsi dalam mekanisme reaksi faktor selular, seperti fagositosis, enkapsulasi,
citotoxicity sedangkan pada faktor humoral seperti protein koagulasi, aglutinin hidrolitik (lektin), dan peptida antimikroba, yang diproduksi oleh faktor-faktor selular pada udang (Rodríguez et al. 2007). Penambahan mikrokapsul sinbiotik pada penelitian ini menunjukkan adanya peningkatan terhadap THC. Hal ini dapat dilihat setelah pemberian miroenkapsulasi sinbiotik selama 30 hari, menunjukkan adanya berbedaan signifikan antara perlakuan B dan C dibanding dengan kontrol.
Peningkatan THC ini memberikan peningkatan modulasi respon imun udang vaname sehingga mampu meningkatkan kelangsungan hidup dan resistensi terhadap patogen. Hal ini ditemukan juga pada penelitian lain bahwa penambahan probiotik mampu meningkatkan nilai THC sehingga dapat meningkatan respon imun selama periode stress karena infeksi patogen pada udang vaname (Chiu et al. 2007). Penelitian lain juga melaporkan bahwa penambahan sinbiotik (inulin dan
15
udang vaname dibanding dengan kontrol setelah dipapar dengan virus WSSV (White Spot Syndrome Virus) (Partida-Arangure et al. 2012). Menurut Nayak (2010) bahwa mekanisme probiotik untuk meningkatkan sistem imun dapat secara langsung dan tidak langsung. Probiotik secara langsung meningkatkan imunitas dengan cara melewati sel epitel usus dan berinteraksi langsung dengan jaringan limfoid, kemudian mengaktivasi respon imunitas. Sedangkan secara tidak langsung dengan cara melalui kontak antara sel epitel usus dengan GALT (gut associated limphoid tissue) mengaktifkan sitokin sehingga memungkinkan terjadinya komunikasi antar sel untuk dapat mengaktifkan respon imunitas.
Satu hari setelah uji tantang, THC semua perlakuan mengalami penurunan. Penurunan jumlah sel hemocyte merupakan efek berkerjanya mekanisme pertahanan tubuh udang seperti infiltrasi hemocytepada jaringan yang terinfeksi, kematian sel hemocyte udang vaname akibat apoptosis (Costa et al. 2009). Penurunan total hemocyte dapat mengalami penurunan sebesar 70% setelah adanya infeksi patogen (Song et al. 2003). Perbedaan jumlah hemocyte dapat disebabkan oleh respon imun terhadap infeksi patogen (Johansson et al. 2000, Chiu et al. 2007). Peningkatan THC pada hari ke-36 dan 40 diduga karena tubuh udang vaname telah kembali normal sehingga udang mampu memproduksi kembali sel-sel hemocyte(recovery). Hal ini sesuai dengan hasil penelitian Arisa (2011) bahwa jumlah hemocyte udang vaname meningkat pada hari ke-5 setelah diinfeksi dengan V. harveyi.
Aktivitas Phenoloxidase(PO)
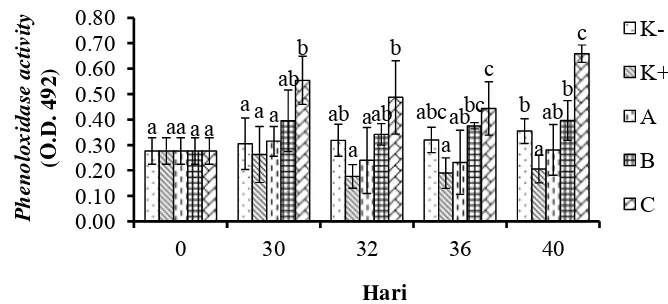
Pengukuran aktivitas enzim phenoloxydase dilakukan sebelum perlakuan, sebelum uji tantang (hari ke-30), 1 hari setelah uji tantang (hari ke-32), 4 hari setelah uji tantang (hari ke-36) dan 9 hari setelah uji tantang (hari ke-40). Nilai PO pada masing-masing perlakuan disajikan pada Gambar 6.
16
Nilai aktivitas phenoloxydase (PO) udang vaname sebelum perlakuan sebesar 0.28±0.05. Nilai PO tertinggi pada hari ke-30 terdapat pada perlakuan C yaitu sebesar 0.56±0.10, berbeda nyata dengan perlakuan A, K+, dan K-, tetapi tidak berbeda nyata dengan perlakuan B. Hari ke-32, PO semua perlakuan mengalami penurunan terkecuali perlakuan K-. Nilai tertinggi masih terdapat pada perlakuan C yaitu sebesar 0.49±0.14, berbeda nyata dengan perlakuan A dan K+, tetapi tidak berbeda nyata dengan perlakuan B dan K-. Nilai PO perlakuan C dan A pada hari ke-36 (4 hari setelah uji tantang), masih mengalami penurunan. Nilai tertinggi masih terdapat pada perlakuan C yaitu sebesar 0.44±0.10, berbeda nyata dengan perlakuan A dan K+, tetapi tidak berbeda nyata dengan perlakuan B dan K-. Nilai aktivitas phenoloxydasesemua perlakuan mengalami peningkatan pada hari ke-40 (9 hari setelah uji tantang). Nilai tertinggi masih terdapat pada perlakuan C yaitu sebesar 0.66±0.03, berbeda nyata dengan semua perlakuan (Lampiran 8).
Aktivitas phenoloxidase sangat penting dalam melawan infeksi mikroba (Vargas-Albores and Yepiz-Plascencia 2000, Chiu et al. 2007, Cerenius et al. 2010). Enzim phenoloxidase(PO) yang terdapat pada hemolymphsebagai inactive pro-enzymeatau disebut proPO. Transformasi dari proPO menjadi PO melibatkan beberapa reaksi yaitu proPO activing system (sistem aktivasi proPO) (Rodriquez and Le Moullac 2000). Sistem ProPO dapat diaktifkan oleh beberapa polisakarida mikroba dan specific pattern recognition proteins(PRPs), seperti LPS-dan β- 1, 3-glucan-binding protein (LGBP) dan peptidoglycan-binding proteins (PGBP) (Cheng et al. 2005, Wang et al. 2007). Sistem aktivasi proPO ini dipertimbangkan sebagai bagian dari sistem imun yang mungkin bertanggung jawab terhadap proses pengenalan benda asing dalam sistem imun krustase. Sistem proPO dapat digunakan sebagai marker kesehatan udang (Rodriquez and Le Moullac 2000).
Penambahan mikrokapsul sinbiotik frekuensi setiap hari dan dua kali seminggu selama 30 hari mampu meningkatkan nilai PO dibanding kontrol. Hal ini dilaporkan pula oleh Chiu et al. (2007), bahwa pemberian Lactobacillus plantarum dengan dosis 107 dan 1010 cfu (per kg pakan) dapat meningkatkan aktivitas PO udang vaname. Penurunan PO dapat menyebabkan penurunan kekebalan tubuh udang (Cerenius et al. 2010). Hari ke-32 (1 hari setelah uji tantang), nilai PO semua perlakuan mengalami penurunan, kemudian meningkat pada hari ke-36 dan 40. Hasil serupa juga diperoleh pada penelitian Chiu et al. (2007), bahwa penurunan PO dan THC udang vaname telah terjadi setelah 1 hari uji tantang dengan V. alginolyticus. Penurunan signifikan terjadi setelah hari ke-2, selanjutnya meningkat kembali pada hari ke-7. Penurunan PO ini diakibatkan oleh adanya reaksi pertahanan sistem imun untuk melawan patogen.
Tingginya respon imun pada perlakuan C dan B, diduga dipengaruhi oleh meningkatnya populasi Bacillus sp. NP5 RfR count (Gambar 1a) dan total bacterial count (Gambar 1b) di usus. Bakteri probiotk Bacillus NP5 RfRdiduga mampu meningkatkan β-1, 3-glucan-binding protein pada udang. Seperti dilaporkan oleh Hao et al. (2014), bahwa penggunaan probiotik dapat meningkatkan β-1, 3-glucan-binding protein pada udang vaname.
17
atau imunostimulan dapat memberikan hasil yang berbeda pada LGBP (Hao et al. 2014). Tingginya populasi Bacillus sp. NP5 RfR count di usus udang pada perlakuan frekuensi setiap hari dan dua kali seminggu, diduga menjadi penyebab tingginya nilai THC dan PO sehingga mempengaruhi nilai kelangsungan hidup udang setelah infeksi dengan V. harveyi RfR (Gambar 1). Penelitian lain melaporkan bahwa suplementasi pakan dengan Bacillus OJ secara signifikan mempengaruhi respon imun dan resistensi penyakit pada udang vaname (Li et al. 2009).
Differential Hemocyte
Jenis hemocyte yang diamati pada penelitian ini adalah sel hialin dan granular/semigranular. Hasil penghitungan differential hemocyte hialin dan granular/semigranular disajikan pada Gambar 7a dan Gambar 7b. Persentase sel hialin (Gambar 7a) berbanding terbalik dengan persentase sel granular/semigranular (7b).
Gambar 7 Persentase sel hialin (a) dan granular/semigranular (b) udang vaname (L. vannamei). Data (rata-rata±SD) dengan huruf berbeda pada hari yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C).
18
Hemocyte udang terdiri atas 3 jenis sel berdasarkan granul pada sitoplasmanya yaitu hialin, granular, dan semi granular. Ketiga jenis sel ini menghancurkan partikel asing yang masuk ke dalam tubuh udang dengan cara fagositosis, enkapsulasi, pembentukan nodul, dan produksi komponen-komponen humoral yang disimpan dalam granula hemocyte seperti protein antikoagulan, aglutinin, enzim PO, peptida antimikrobial, dan inhibitor protease (Jiravanichpaisal et al. 2006).
Hasil penelitian menunjukkan bahwa persentase sel hialin udang vaname sebelum perlakuan sebesar 66±6.08%. Setelah pemberian mikrokapsul selama 30 hari (sebelum uji tantang), persentase sel hialin mengalami penurunan selanjutnya meningkat pada 1 hari setelah uji tantang kemudian menurun kembali pada 4 dan 9 hari setelah uji tantang. Persentase sel hialin tertinggi sebelum uji tantang terdapat pada perlakuan K+ yaitu sebesar 65±4.36%, tidak berbeda nyata dengan perlakuan A, B, dan K- yaitu sebesar 62±9.54%, 60±3.21%, dan 63±3.21%, tetapi berbeda nyata dengan perlakuan C sebesar 48±6.00%. Persentase sel hialin tertinggi 1 hari setelah uji tantang terdapat pada perlakuan K+ yaitu sebesar 84±3.79%, berbeda nyata dengan perlakuan B, C, dan K- yaitu sebesar 70±3.21%, 56±5.51%, dan 67±10.02%, tetapi tidak berbeda nyata dengan perlakuan A sebesar 72±7.02% (Lampiran 9).
Meningkatnya sel granular/semigranular pada perlakuan C sebelum uji tantang diduga dipengaruhi oleh meningkatnya populasi Bacillus sp. NP5 RfR
count(Gambar 1a), sehingga mampu meningkatkan nilai PO (Gambar 6). Hal ini dikemukakkan oleh Smith et al. 2003 bahwa bakteri probiotik dapat mengaktifkan sel granular sehingga sel granular kemudian meningkatkan produksi enzim PO pada sistem imun krustase. Meningkatnya sel hialin perlakuan C pada 1 hari setelah uji tantang diduga karena meningkatnya aktifitas fagosit terhadap patogen. Hal ini dijelaskan oleh Hauton (2012) bahwa sel hialin berperan dalam fagositosis sedangkan sel granular berperan memproduksi melanin dan mengeluarkan peptida antimikroba dan terlibat dalam reaksi sitotoksik.
Kelangsungan Hidup
Pengamatan terhadap parameter kelangsungan hidup udang vaname pada penelitian ini terdiri atas dua tahap, yaitu sebelum uji tantang dan 9 hari setelah uji tantang dengan bakteri V. harveyi (Gambar 8). Kelangsungan hidup udang vaname sebelum uji tantang untuk semua perlakuan adalah 100%. Selanjutnya, pada 9 hari setelah uji tantang, kelangsungan hidup tertinggi terdapat pada perlakuan C sebesar 63.33±5.77% berbeda nyata (p<0.05) terhadap perlakuan A, K+ dan K- yaitu sebesar 43.33±11.54%, 36.66±11.54%, dan 100%, tetapi tidak berbeda nyata (p>0.05) terhadap perlakuan B yaitu sebesar 56.66±5.77% (Lampiran 11).
19
karbohidrat bakteri seperti lipopolisakarida (LPS), β-1 ,3-glukan (BG) atau peptidoglikan (PG) dapat memicu respon imun humoral (Cheng et al. 2005). Penelitian lain juga melaporkan, bahwa pemberian probiotik B. subtilis pada udang vaname dengan dosis 108cfu g-1 dapat memberikan tingkat kelangsungan hidup lebih tinggi dibanding tanpa pemberian probiotik. Sedangkan prebiotik oligosakarida yang diberikan diduga dapat menstimulir pertumbuhan bakteri probiotik di usus serta dapat menghambat bakteri patogen. Hal ini dilaporkan oleh Li et al. (2009), bahwa penggunaan sinbiotik (Bacillus OJ dan isomaltooligosakarida) mampu menyeimbangkan mikroflora usus pada udang vaname serta meningkatkan respon imun dan resistensi terhadap penyakit.
Gambar 8 Kelangsungan hidup udang vaname (L. vannamei) sebelum uji tantang dan 9 hari setelah uji tantang. Data (rata-rata±SD) dengan huruf berbeda pada warna grafik yang sama menunjukkan berbeda nyata (P<0.05). K- (kontrol negatif), K+ (kontrol positif), pemberian mikrokapsul sinbiotik frekuensi: satu kali seminggu (A), dua kali seminggu (B), setiap hari (C).
Hasil penelitian ini menunjukkan bahwa pemberian sinbiotik yang telah dienkapsulasi dengan spray dryermemberikan hasil yang sama dengan penelitian Oktaviana et al. (2014), dimana pemberian sinbiotik (probiotik SKT-b dan prebiotik dari ubi jalar varietas sukuh) tanpa enkapsulasi dengan frekuensi pemberian setiap hari, memberikan kelangsungan hidup yang lebih tinggi dibanding dengan kontrol untuk mencegah ko-infeksi IMV (infectious myonecrosis virus) dan V. harveyi pada udang vaname.
Parameter Kualitas Air
Hasil pengukuran kualitas air selama penelitian (Tabel 1) menunjukkan bahwa beberapa parameter kualitas air selama penelitian tidak berada dalam kisaran normal berdasarkan standar SNI tahun 2006 untuk udang vaname. Kiasaran nilai TAN (Total Amonia Nitrogen) pada penelitian ini tergolong tinggi dan suhu tergolong rendah dibandingkan dengan standar SNI tahun 2006. Meskipun demikian, kisaran kualitas air pada penelitian ini masih menunjang kelangsungan hidup udang vaname. Hal ini terbukti dengan tingginya kelangsungan hidup udang vaname sebelum uji tantang pada semua perlakuan.
a d a a a a
20
Tabel 1. Kualitas air selama penelitian
Perlakuan Suhu
K- 26.0-26.7 7.72-8.04 32-35 7.5-7.7 0.028 0.61-0.68 K+ 26.0-26.5 7.76-8.04 34-35 7.4-7.9 0.028 0.68-0.70
A 25.9-26.6 7.71-8.04 33-35 7.5-7.9 0.032 0.76
B 26.0-26.6 7.81-7.99 33-35 7.5-7.7 0.036 0.50-0.86 C
TAN tersusun atas kosentrasi ion amonia (NH4+) dan amonia bebas (NH3). Amonia bebas merupakan gas amonia yang bersifat toksik. Kesetimbangan antara NH4+ dengan NH3 dipengaruhi oleh pH dan suhu. Kisaran pH pada penelitian ini masih dalam kisaran normal. Hasil penelitian Wibowo (2009) menunjukkan bahwa kandungan TAN di tambak berkisar 0.096-1.792. Nilai ini masih tergolong baik untuk pertumbuhan udang di tambak. Tingginya TAN disebabkan oleh adanya penguraian bahan organik yang mengandung protein dan asam amino secara anaerobik. Bahan organik berasal dari sisa pakan dan sisa eksresi udang vaname.
4 SIMPULAN DAN SARAN
Simpulan
Simpulan pada penelitian ini yaitu:
1. Pemberian mikrokapsul sinbiotik dengan frekuensi setiap hari mampu meningkatkan populasi Bacillus sp. NP5 RfR count dan total bacterial count
serta mampu mengurangiV. harveyiRfRdan total Vibrio countdi usus udang dibandingkan dengan perlakuan kontrol.
2. Pemberian mikrokapsul sinbiotik dengan frekuensi setiap hari dapat memberikan nilai konversi rasio pakan yang rendah, meningkatkan nilai laju pertumbuhan spesifik, kelangsungan hidup, serta respon imun dan resistensi terhadap V. harveyi pada udang vaname dibandingkan dengan perlakuan kontrol.
Saran
Saran pada penelitian ini yaitu:
1. Penggunaan mikrokapsul sinbiotik setiap hari dapat diaplikasikan di tambak budidaya udang vaname.
21
DAFTAR PUSTAKA
Ai Q, Xu H, Mai K, Xu W, Wang J, Zhang W. 2011. Effects of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance, survival, non-specific immune response and disease resistance of juvenile large yellow croaker, Larimichthys crocea. Aquaculture 317: 155-161.
Arisa IK. 2011. Pemberian prebiotik, probiotik, dan sinbiotik untuk meningkatkan respon imun udang vaname Litopenaeus vannamei terhadap infeksi Vibrio harveyi. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Azhar F. 2014. Evaluasi pemberian probiotik, prebiotik, dan sinbiotik pada pakan untuk pencegahan penyakit vibriosis pada ikan kerapu bebek (Cromileptes altivelis). [tesis]. Bogor (ID): Institut Pertanian Bogor.
Bairagi A, Ghosh KS, Sen SK, Ray AK. 2002. Duckweed (Lemna polyrhiza) leaf meal as a source of feedstuff in formulated diets for rohu (Labeo rohita
Ham.) fingerlings after fermentation with a fish intestinal bacterium.
Bioresource Technology85:17-24.
Bakan JA. 1994. Mikroenkapsulasi. Di dalam: Lachman L, Lieberman HA, Kanig JL. Teori dan praktek farmasi industri II Edisi II. Jakarta (ID): Universitas Indonesia.
Blaxhall PC, Daishley KW. 1973. Routine haematological methods for use with fish blood.Journal Fish Biology5:577-581.
Cerenius L, Jiravanichpaisal P, Hai-peng L, Söderhälz I. 2010. Crustacean immunity in invertebrate immunity. Bioscience 13:239-259.
Cerezuela R, Meseguer J, dan Esteban MA. 2011. Current knowledge in synbiotic use for fish aquaculture. Review. Jurnal Aquatic Research Development. http://dx.doi.org/10.4172/2155-95546.S1-008.
Cheng W, Liu CH, Tsai CH, Chen JC. 2005. Molecular cloning and characterisation of a pattern recognition moleculer, lipopolysaccharide- and beta-1,3-glucan binding protein (LGBP) from the white shrimp Litopenaeus vannamei. Fish and Shellfish Immunology18: 297-310.
Chiu CH, Guu YK, Liu CH, Pan TM, Cheng W. 2007. Immune responses and gene expression in white shrimp, Litopenaeus vannamei, induced by
Lactobacillus plantarum. Fish and Shellfish Immunology23:364-377.
Chrisolite B, Thiyagarajan S, Alavandi SV, Abhilash EC, Kalaimani N, Vijayan KK, Santiago TC. 2008. Distribution of luminescent Vibrio harveyi and their bacteriophages in a commercial shrimp hatchery in South India.
Aquaculture275:13-19.
Costa AM, Buglione CC, Bezerra FL, Martins PCC, Barracco MA. 2009. Immune assessement of farm-reared Penaeus vannamei shrimp naturally infected by IMNV in NE Brazil. Aquaculture 291:141-146.
Daniels CL, Merrifield DL, Boothroyd DP, Davies SJ, Factor JR, Arnold KE. 2010. Effect of dietary Bacillus spp. and mannan oligosaccharides (MOS) on European lobster (Homarus gammarus L.) larvae growth performance, gut morphology and gut microbiota. Aquaculture304:49-57.
22
Hao K, Liu JY, Ling F, Liu XL, Lu L, Xia L, Wang GX.2014. Effects of dietary administration of Shewanella haliotis D4, Bacillus cereus D7 and
Aeromonas bivalvium D15, single or combined, on the growth, innate immunity and disease resistance of shrimp, Litopenaeus vannamei.
Aquaculture428:141-149.
Hauton C. 2012. The scope of the crustacean immune system for disease control.
Journal of Invertebrate Pathology 110:251-260.
Jiravanichpaisal P, Lee BL, Soderhall K. 2006. Cell-mediated immunity in arthropods: hematopoiesis, coagulation, melanization, and opsonization.
Immunobiology211:213-236.
Johansson MW, Keyser P, Sritunyalucksana K, Soderhall K. 2000. Krustasen hemocytes and hemotopoiesis. Aquaculture191:45-52.
Jyothi NVN, Prasanna PM, Suhas NS, Prabha KS, Ramaiah PS, Srawan GY. 2010. Microencapsulation techniques, factors influencing encapsulation efficiency. Review. Journal of Microencapsulation27:187-197.
KKP [Kementrian Kelautan dan Perikanan]. 2013. Statistik produksi udang indonesia. http://www.pusjui.kkp.go.id/index.php/warta/kliping/678-statistik-produksi-udang-indonesia. [19 April 2014].
Kailasapathy K. 2002. Microencapsulation of probiotic bacteria: technology and potential applications. Current Issues in Intestinal Microbiology 3:39-48. Li J, Beiping T and Kangsen M. 2009. Dietary probiotic Bacillus OJ and
isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei). Aquaculture291:35-40.
Lin S, Mao S, Guan Y, Luo Lin, Luo Li, Pan Y. 2012. Effects of dietary chitosan oligosaccharides and Bacillus coagulans on the growth, innate immunity and resistance of koi (Cyprinus carpio koi). Aquaculture342:36-31.
Mahious AS, Getesoupe, Hervi M, Mctailler R, Ollevier. 2006. Effect of dietary inulin and oligosaccarides as prebiotics for weaning turbot, Psetta maxima
(Linneaus C.1758). Aquaculture International14:219-229.
Marlis A. 2008. Isolasi oligosakarida ubi jalar (Ipomoea batasL.) dan pengaruh pengolahan terhadap potensi prebiotiknya. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Martin GG, Graves LB. 1995. Structure and classification of shrimp hemocytes.
Journal Morphologi185:339-348.
Merrifield DL, Dimitroglou A, Foey A, Davies SJ, Baker R TM, Bøgwald J, Castex M, Ringø E. 2010. The current status and future focus of probiotic and prebiotic applications for salmonids. Review. Aquaculture302:1-18. Muchtadi D. 1989. Evaluasi Nilai Gizi Pangan. Jakarta (ID): Depdikbud, Dirjen
Dikti-PAU IPB.
Muhammad A. 2013. Aplikasi probiotik dengan dosis berbeda untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) pada udang vaname
Litopenaeus vannamei.[Skripsi]. Bogor (ID): Institut Pertanian Bogor. Mu˜noz-Celaya AL, Ortiz-García M, Vernon-Carter EJ, Jauregui-Rincón J,
Galindo E, Serrano-Carreón L. 2012. Spray-drying microencapsulation of
Trichoderma harzianum conidias in carbohydrate polymers matrices.