MEMPERTAHANKAN MUTU DAN MEMPERPANJANG
UMUR SIMPAN
RAPEKA RELI
Dengan ini saya menyatakan bahwa tesis berjudul Modifikasi Pengolahan Durian Fermentasi (Tempoyak) dan Perbaikan Kemasan untuk Mempertahankan Mutu dan Memperpanjang Umur Simpan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2016
Rapeka Reli
NIM F351130381
* Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak
RAPEKA RELI. Modifikasi Pengolahan Durian Fermentasi (Tempoyak) dan Perbaikan Kemasan untuk Mempertahankan Mutu dan Memperpanjang Umur Simpan. Dibimbing oleh ENDANG WARSIKI dan MULYORINI RAHAYUNINGSIH.
Tempoyak merupakan makanan tradisional suku melayu yang berasal dari hasil fermentasi daging durian, yang melibatkan bakteri asam laktat dalam proses pembuatannya. Bakteri asam laktat akan mengalami fermentasi cepat melalui mitosis (proses membelah diri), yang akan menurunkan mutu produk dan menghasilkan alkohol serta CO2 sebagai hasil samping. Hal itu dapat mengakibatkan kerusakan pada tempoyak sehingga umur simpan pendek. Modifikasi pengolahan dan perbaikan kemasan diharapkan dapat mempertahankan mutu dan memperpanjang umur simpan tempoyak.
Tujuan dari penelitian ini secara umum adalah untuk mempertahankan mutu dan memperpanjang umur simpan tempoyak. Tujuan secara khusus yaitu Aplikasi modifikasi cara pengolahan dengan pasteurisasi untuk menghambat pertumbuhan bakteri asam laktat, mendapatkan jenis dan teknik pengemasan yang sesuai untuk memperpanjang umur simpan tempoyak, serta menentukan umur simpan tempoyak.
Tahapan penelitian dimulai dengan pembuatan tempoyak yang meliputi pengujian kandungan proksimat buah durian; fermentasi durian dengan penambahan garam sebanyak 3% (b/b) dan gula 1% (b/b); selanjutnya dilakukan pengujian mutu awal tempoyak meliputi warna, pH, kadar air, kadar gula, asam laktat, TPC, jumlah kapang, jumlah dan identifikasi BAL. Identifikasi BAL dilakukan dengan cara menginokulasi kultur pada media MRS dan diinkubasi selama 48 jam pada suhu 37 oC. Koloni yang membentuk zona bening diidentifikasi sebagai bakteri asam laktat. Tahap berikutnya, tempoyak dibagi menjadi dua bagian yaitu dipasteurisasi dan non pasteurisasi. Titik waktu pasteurisasi ditentukan melalui kurva pertumbuhan bakteri asam laktat yang diperoleh pada saat fermentasi. Suhu pasteurisasi yang digunakan yaitu 65 oC selama 30 menit. Tempoyak yang telah dipasteurisasi dilakukan pengujian mutu tempoyak.
Tempoyak pasteurisasi dan non pasteurisasi dikemas menggunakan jenis plastik PET (polyethylene terephthalate) dan polyamide. Jenis kemasan plastik PET menggunakan teknik pengemasan MAP (Modified Atmosfir Packaging)
dengan komposisi O2 sebesar 5% sampai 6% dan CO2 sebesar 67% sampai 69%. Jenis kemasan plastik polyamide menggunakan teknik pengemasan vakum. Tempoyak yang telah dikemas baik pasteurisasi dan non pasteurisasi disimpan pada suhu ruang. Parameter pengujian mutu akhir tempoyak sama dengan paramater pengujian mutu awal, dengan penambahan kadar alkohol. Pengamatan dilakukan setiap dua hari sekali selama satu minggu, satu minggu sekali selama dua minggu, dan dua minggu sekali sampai tempoyak mengalami kerusakan. Pengujian alkohol dilakukan pada akhir kerusakan tempoyak.
laktat yang teridentifikasi adalah Genus Lactobacillus dengan spesies L. plantarum, L. casei. dan L. fermentum yang tergolong bakteri heterofermentatif.
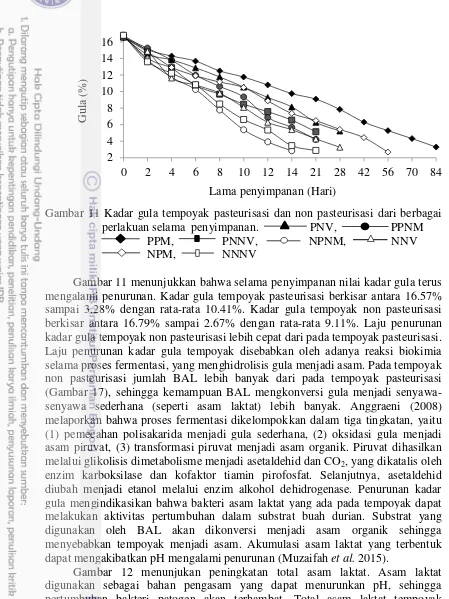
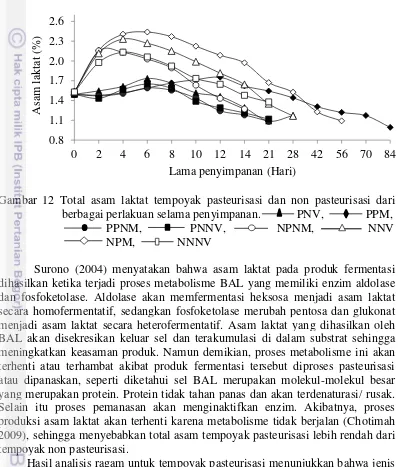
Hasil pengamatan terhadap sifat fisika, kimia dan mikrobiologi dari semua perlakuan menunjukkan jenis dan teknik pengemasan yang sesuai untuk memperpanjang umur simpan tempoyak adalah perlakuan PPM (tempoyak pasteurisasi) dan NPM (tempoyak non pasteurisasi) yang dikemas dalam plastik PET dengan teknik pengemasan Modified Atmosfir Packaging (MAP). Kedua perlakuan ini menghasilkan lama penyimpanan dengan kualitas tempoyak yang paling tinggi dibandingkan perlakuan lainnya hanya menghasilkan lama penyimpanan 14 hari hingga 21 hari (kondisi aerob yaitu perlakuan NPNM, PPNM, PNNV, dan NNNV) dan 28 hari (kondisi anaerob yaitu perlakuan NNV dan PNV).
Lama waktu penyimpanan untuk perlakuan PPM (kondisi anaerob fakultatif) sampai tempoyak mengalami kerusakkan adalah 84 hari. Penurunan mutu tempoyak ditunjukkan dengan perubahan warna tempoyak dari putih kekuningan menjadi coklat, nilai pH awal dari 3.97 turun menjadi 3.73, total asam laktat dari 1.49% turun menjadi 0.99%, kadar air dari 63.63% meningkat menjadi 67.76%, kadar gula dari 16.57% turun menjadi 3.28%, kadar alkohol sebesar 0.32%, jumlah bakteri asam laktat dari 174.30×104 cfu/g menjadi 8.60×102 cfu/g, total jumlah bakteri dari 177×104 cfu/g menjadi 182.30×103 cfu/g, dan total kapang dari 0.00 meningkat menjadi 53.67×101 cfu/g. Lama waktu penyimpanan untuk perlakuan NPM (kondisi anaerob fakultatif) sampai tempoyak mengalami kerusakkan adalah 56 hari. Pada kondisi ini mutu tempoyak ditunjukkan dengan perubahan warna tempoyak dari putih kekuningan menjadi coklat, nilai pH awal dari 4.00 turun menjadi 3.23, total asam laktat dari 1.53% turun menjadi 1.09%, kadar air dari 63.82% meningkat menjadi 71.21%, kadar gula dari 16.79 % turun menjadi 2.67%, kadar alkohol sebesar 0.61%, jumlah bakteri asam laktat dari 170.10×1018cfu/g turun menjadi 11.10×102 cfu/g, total jumlah bakteri 77.80×1019 cfu/g turun menjadi 65.40×104 cfu/g, total kapang dari 0.00 meningkat menjadi 161.30×101 cfu/g.
RAPEKA RELI.Process Modification and Packaging Improvement of Fermented Durian (Tempoyak) to Retain Quality and Prolong Shelf Life. Supervised by ENDANG WARSIKI and MULYORINI RAHAYUNINGSIH.
Tempoyak is traditional food of malay, and it is produced from durian meat fermented by lactic acid bacteria. Lactic acid bacteria would induce rapid the shelf life. Additionally, the special objectives were to implement modified processing using pasteurization to retard lactic acid bacteria, and to gain type and and technique of proper packaging for tempoyak preservation, as well as to determine its shelf life.
The research has been conducte through following steps, included proximate analysis of fresh durian, fermentation of durian by adding NaCl 3% (w/w) and sugar 1% (w/w). The quality of fresh tempoyak was observed through some parameters ie. color, pH, moisture content, sugar content, lactic acid content, TPC (cfu/g), total mold (cfu/g). It also counted and identified BAL. BAL identification was conducted by inoculating culture in MRS media, and it was incubated for 48 hours at 37oC. The colony that forms clear zone was indicated as lactic acid bacteria. The next stage, tempoyak was treated by two treatments ie. It was pasteurized and non pasteurized. Pasteurization time was determined by curve of lactic acid bacteria gowth at fermentation time. The temperature of pasteurization was 65 oC for 30 minutes. The quality of pasteurized tempoyak was observed.
The pasteurized and non pasteurized tempoyak were packed using PET (Polyethylene terephthalate) and polyamide plastics. MAP (Modified Atmosphere Packaging) was used for PET, where O2 and CO2 level were 5% to 6% and 67% to 69%, respectively. Meanwhile, vacuum packaging technique was applied in polyamide plastic. The tempoyak was then stored at room temperature. The parameters used for end product of tempoyak were similar to fresh tempoyak, with alcohol measurement as additional parameter. The quality of each tempoyak was observed three times for a week, two times for two weeks, and every two weeks until tempoyak was deteriorated. Alcohol content was observed at the end observation.
The results show that tempoyak fermented for 72-84 hours must be pasteurized to retard fermentation. The fermentation at 84 hours was a static phase, indicating the best time for inhibiting acid lactic bacteria gowth.
Lactobacillus genus with L. plantarum, L. casei and L. fermentum were identified as the dominant species of lactic acid bacteria gouped as heterofermentative bacteria.
NNNV) and 28 days anaerobic condition (NNV and PNV).
The storage of tempoyak for PPM (anaerobic facultative condition) was 84 days. The decreasing quality of tempoyak was indicated by several changes including color (from yelowness to brown), pH (from 3.97 to 3.73), moisture content (from 63.63% to 67.76%), sugar content (from 16.57% to 3.28%), lactic acid content (from 1.49% to 0.99%), number of mold (from 0 to 53,67×101 cfu/g), total plate count (from 177×104 cfu/g to 182.3×103 cfu/g), and number of lactic acid bacteria (from 174.3x104 cfu/g to 8.6×102 cfu/g), as well as alcohol of 0.32%. The shelf life NPM tempoyak (anaerob facultative) treatments was 56 days. The decreasing of tempoyak quality at 56 days was showed by some indicators such as color (from yelowness to brown), pH (from 4.00 to 3.23), moisture content (from 63.82% to 71.21%), sugar content (from 16.79% to 2.67%), lactic acid content (from 1.53% to 1.09%), number of mold (from 0 to 161,3×101 cfu/g), total plate count (from 77.8×1019 cfu/g to 65.4×104 cfu/g), number of lactic acid bacteria (from 170.1×1018cfu/g to 11.1×102 cfu/g), and alcohol content of 0.61%.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
(TEMPOYAK) DAN PERBAIKAN KEMASAN UNTUK
MEMPERTAHANKAN MUTU DAN MEMPERPANJANG
UMUR SIMPAN
RAPEKA RELI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
'#N
N #@,7#N,:4N
N N
,FI#NA?2$<NFK+4N
,9=?;?14N=+JDH4N,AG#=4#=N
$=00&N"64(N N@A4:N
4D,FI5I4N?:,3N
?<4E4N,<)4<)4=0N
47,F$3I4N?:,3N
#D*#D#B$=#N
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak Maret 2015 sampai Agustus 2015 ini adalah Modifikasi Pengolahan Durian Fermentasi (Tempoyak) dan Perbaikan Kemasan untuk Mempertahankan Mutu dan Memperpanjang Umur Simpan.
Terima kasih penulis ucapkan kepada Ibu Dr Endang Warsiki, STP MSi dan Ibu Dr Ir Mulyorini Rahayuningsih, MSi selaku pembimbing serta Ibu Dr. Ir. Titi Candra Sunarti, MSi dan Ibu Dr Indah Yuliasih, STP MSi selaku penguji. Penulis ucapkan terimakasih kepada papa tercinta Yanadi, mama tercinta Asmawati, saudara-saudari Raneka S.Fam Apt, Cica Kosmoyo SE, Agustian Aman Aroza SH, Heru Purnomo STP MSi, Zul Imran AMF, Adek Inara Shaqueen Adelia, dan keluarga besar papa serta mama atas doa, perhatian dan suportnya dalam proses meraih Master ini. Untuk sahabat-sahabat yang telah membantu dalam meraih master ini (Melati Pratama MSi, Erin Zurna STP, Fatur MSi, Diah MSi, Eny MSi, Umi MSi, Rozi Satria Utama MSi, Dian MSi, Tami MSi, Miko MSi, Nadia STP, Mujib STP, Priska Wisudawati MSi, Nurul Qisti MSi, Ika Rezvani MSi) dan teman-teman pasca TIP 2013. Penulis ucapkan terimakasih kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) dalam program BPPDN Dikti 2013 yang telah menjadi sponsor. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2016
DAFTAR TABEL xi
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiv
1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.3 Tujuan Penelitian 2
1.3 Ruang Lingkup 2
1.4 Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
2.1 Produk Hortikultura 3
2.2 Durian Fermentasi (Tempoyak) 4
2.3 Bakteri Asam Laktat (BAL) 6
2.4 Pasteurisasi 9
2.5 Pengemasan 10
2.6 Kinetika Fermentasi 12
3 METODOLOGI PENELITIAN 18
3.1 Bahan 18
3.2 Alat 18
3.3 Waktu dan Tempat 18
3.4 Metode Penelitian 18
3.5 Rancangan Percobaan 24
4 HASIL DAN PEMBAHASAN 25
4.1 Karakteristik Buah Durian 25
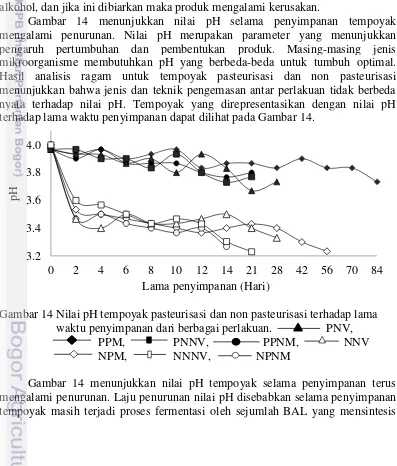
4.2 Kurva Pertumbuhan Bakteri Asam Laktat pada Tempoyak 27 4.3 Derajat Asam (pH), Kadar Gula, dan Total Asam 29
4.4 Bakteri Asam Laktat (BAL), dan Kadar Air 34
4.5 Total Jumlah Bakteri (TPC) dan Kapang 41
4.6 Warna 44
4.7 Alkohol 47
4.8 Dinamika Populasi Bakteri Asam Laktat Selama Penyimpanan 48
4.9 Estimasi Umur Simpan Tempoyak 53
5 KESIMPULAN DAN SARAN 57
5.1 Kesimpulan 57
5.2 Saran 57
DAFTAR PUSTAKA 58
LAMPIRAN 64
1 Kandungan gizi buah durian dan tempoyak dalam 100 g bahan 3
2 Kode sampel dari semua perlakuan 21
3 Hasil analisis kandungan proksimat buah durian basis basah 26 4 Spesies bakteri asam laktat dari genus Lactobacillus pada tempoyak
pasturisasi dan non pasteurisasi 39
5. Fermentasi karbohidrat spesies L. casei, L. plantarum, dan L. fermentum 40 6 Hasil pengamatan warna tempoyak pasteurisasi dan non pasteurisasi dari
berbagai perlakuan selama penyimpanan 46
7 Hasil analisis kandungan alkohol pada tempoyak pasteurisasi dan non
pasteurisasi dari semua perlakuan selama penyimpanan 47 8 Hasil perhitungan kinetika bakteri asam laktat pada tempoyak 49
9 Standar mutu tempoyak 53
10 Mutu tempoyak pada lama penyimpanan ke-14 hari 54 11 Mutu tempoyak pada lama penyimpanan ke-21 hari 54 12 Mutu tempoyak pada lama penyimpanan ke-28 hari 55 13 Mutu tempoyak pada lama penyimpanan ke-56 hari 55 14 Mutu tempoyak pada lama penyimpanan ke-84 hari 55 15 Estimasi Umur simpan tempoyak berdasarkan perlakuan 56
16 Penetapan gula menurut Luff Schrool 69
17 Hasil analisis ragam jenis dan teknik pengemasan terhadap asam laktat 73 18 Hasil analisis ragam jenis dan teknik pengemasan terhadap BAL 73 19 Hasil uji Duncan jenis dan teknik pengemasan terhadap BAL 73 20 Hasil analisis ragam jenis dan teknik pengemasan terhadap kapang 73 21 Hasil uji Duncan jenis dan teknik pengemasan terhadap kapang 73 22 Hasil analisis ragam jenis dan teknik pengemasan terhadap kadar gula 74 23 Hasil analisis ragam jenis dan teknik pengemasan terhadap TPC 74 24 Hasil uji Duncan jenis dan teknik pengemasan terhadap TPC 74 25 Hasil analisis ragam jenis dan teknik pengemasan terhadap kadar air 74 26 Hasil analisis ragam ragam jenis dan teknik pengemasan terhadap pH 74 27 Standar deviasi BAL, kapang, TPC, kadar air, kadar gula dan pH 75 28 Hasil analisis ragam jenis dan teknik pengemasan terhadap asam laktat 76 29 Hasil uji Duncan jenis dan teknik pengemasan terhadap asam laktat 76 30 Hasil analisis ragam jenis dan teknik pengemasan terhadap BAL 76 31 Hasil uji Duncan jenis dan teknik pengemasan terhadap BAL 76 32 Hasil analisis ragam jenis dan teknik pengemasan terhadap kapang 76 33 Hasil uji Duncan jenis dan teknik pengemasan terhadap kapang 77 34 Hasil analisis ragam jenis dan teknik pengemasan terhadap kadar gula 77 35 Hasil analisis ragam jenis dan teknik pengemasan terhadap TPC 77 36 Hasil analisis ragam jenis dan teknik pengemasan terhadap kadar air 77 37 Hasil uji Duncan jenis dan teknik pengemasan terhadap kadar air 77 38 Hasil analisis ragam ragam jenis dan teknik pengemasan terhadap pH 78 39 Standar deviasi BAL, kapang, TPC, kadar air, kadar gula dan pH 78
40 Kinetika bakteri asam laktat perlakuan PPM 79
45 Kinetika fermentasi perlakuan NPNM 81
46 Kinetika fermentasi perlakuan NNV 81
47 Kinetika fermentasi perlakuan NNNV 81
DAFTAR GAMBAR
1 Jalur utama dari fermentasi glukosa: (A) fermentasi homofermentatif (glikolisis, Embden-Meyerhof pathway) dan (B) heterofermentatif
(6-fosfoglukonat/ phosphoketolase) 8
2 Perpindahan gas dalam kemasan atmosfir termodifikasi 10
3 Kurva pertumbuhan mikroba 13
4 Pengaruh konsentrasi substrat terhadap laju pertumbuhan spesifik 14
5 Model Monod pertumbuhan mikroba 15
6 Contoh kinetika pertumbuhan dan pembentukan produk 17
7 Tahapan penelitian 19
8 Pengisian gas CO2 kedalam kemasan plastik PET 22 9 Pengukuran komposisi gas CO2 dan O2 dalam kemasan PET 23 10 Kurva pertumbuhan bakteri asam laktat selama proses fermentasi durian 28 11 Kadar gula tempoyak pasteurisasi dan non pasteurisasi dari berbagai
perlakuan selama penyimpanan 30
12 Total asam laktat tempoyak pasteurisasi dan non pasteurisasi dari
berbagai perlakuan selama penyimpanan 31
13 Pathway fermentasi bakteri asam homofermentatif dan heterofermentatif 32 14 Nilai pH tempoyak pasteurisasi dan non pasteurisasi terhadap lama waktu
penyimpanan dari berbagai perlakuan 33
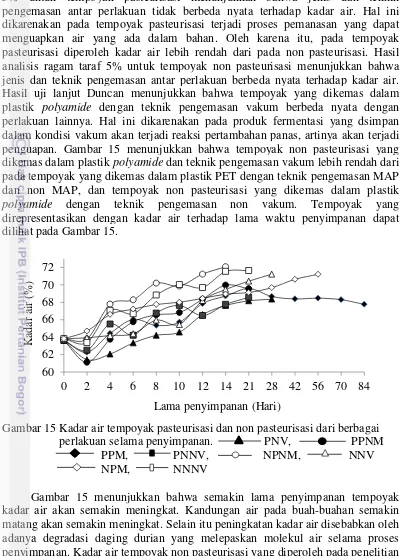
15 Kadar air tempoyak pasteurisasi dan non pasteurisasi dari berbagai
perlakuan selama penyimpanan 35 16 Model fisik proses respirasi metabolisme sistem atmosfir termodifikasi 38
17 Jumlah BAL tempoyak pasteurisasi dan non pasteurisasi dari berbagai
perlakuan selama penyimpanan 38
18 Mikroskopis dan makroskopis bakteri genus Lactobacillus 39 19 Jumlah bakteri tempoyak pasteurisasi dan non pasteurisasi dari
berbagai perlakuan selama penyimpanan 42
20 Staphylococcus sp 43
21 Candida parapsilosis 43
22 Oidiodendran sp 43
23 Aspergilus niger 43
24 Jumlah kapang pada tempoyak pasteurisasi dan non pasteurisasi dari
berbagai perlakuan selama penyimpanan 44
25 Perubahan warna tempoyak pateurisasi dari berbagai perlakuan selama
perlakuan PPM (A) dan laju penurunan spesifik maksimum pada
tempoyak non pasteurisasi perlakuan NPM (B) 50
28 Laju pertumbuhan spesifik maksimum pada tempoyak pasteurisasi perlakuan PNV (A) dan laju penurunan spesifik maksimum pada
tempoyak non pasteurisasi perlakuan NNV (B) 51
29 Laju pertumbuhan dan penurunan spesifik maksimum tempoyak
pasteurisasi dan non pasteurisasi pada perlakuan PPNM (A), NPNM (B),
PNNV (C), dan NNNV (D) 52
DAFTAR LAMPIRAN
1 Diag Alir Proses Produksi dan Pengemasan Tempoyak 65
2 Prosedur Analisa 66
3 Hasil Analisa Ragam Tempoyak Pasteurisasi 73
4 Hasil Analisa Ragam Tempoyak Non Pasteurisasi 76
1.1 Latar Belakang
Durian merupakan jenis buah klimaterik yang dicirikan dengan produksi CO2 dan etilen yang cepat selama pematangan sehingga mudah mengalami kerusakan akibat perubahan kimia, aktifitas enzim, dan mikroba (Yuliana 2005). Oleh karena itu durian perlu diolah menjadi produk yang tahan simpan dan bernilai ekonomi tinggi seperti tempoyak. Tempoyak merupakan produk olahan daging buah durian yang melibatkan bakteri asam laktat dengan penambahan sedikit garam yang dikenal dengan proses fermentasi spontan, yang dimanfaatkan sebagai bumbu masak oleh masyarakat khas melayu seperti Lampung, Jambi, Sumatera Selatan, Bengkulu, Kalimantan Barat, Sumatera Barat, dan Aceh. Amin
et al. (2004) melaporkan bahwa penambahan kadar garam terbaik untuk tempoyak adalah sekitar 2% hingga 3% (b/b). Fermentasi tempoyak secara spontan pada umumnya terjadi sekitar 4 hingga 7 hari (Leisner et al. 2001) dan daging durian berubah dari massa yang padat ke semisolid disertai dengan aroma asam yang kuat (Yuliana et al. 2011).
Hasil riset terdahulu (Leisner et al. 2001) melaporkan bahwa BAL yang terlibat di dalam tempoyak umumnya adalah bakteri yang bersifat heterofermentatif. Bakteri heterofermentatif adalah jenis bakteri yang selain penghasil asam-asam organik juga menghasilkan alkohol dan CO2. Minarni et al. (2013) menyatakan bahwa laju fermentasi yang terus berlangsung dengan cepat akan menghasilkan alkohol dengan hasil samping CO2. Kandungan alkohol yang tinggi tidak diinginkan pada tempoyak karena dapat merusak citrarasa. Selain faktor laju fermentasi yang cepat, faktor yang menyebabkan kerusakan dan kebusukan pada tempoyak adalah proses pengemasan yang kurang sesuai. Faktor-faktor tersebut dapat mempercepat terjadinya penurunan mutu tempoyak, yang secara fisik ditandai dengan (1) perubahan warna menjadi coklat, (2) bau alkohol menyengat, dan (3) adanya serangga seperti belatung. Oleh karena itu diperlukan suatu usaha untuk mempertahankan mutu tempoyak dan memperpanjang umur simpan dengan cara menghambat atau memperlambat aktivitas mikroorganisme penghasil asam. Kandungan asam organik yang tinggi dihasilkan ketika bakteri asam laktat berada pada fase stasioner (Nur 2005). Asam organik dapat menyebabkan terjadinya penurunan pH. Nilai pH yang rendah dapat menghambat pertumbuhan bakteri patogen. Sampai saat ini penelitian tempoyak yang ada seperti identifikasi bakteri (Wirawati 2002), penambahan garam (Amin et al.
2004), identifikasi asam organik (Nur 2005), dan pengolahan tempoyak (Yuliana 2007a), tetapi penelitian tentang usaha memperpanjang umur simpan tempoyak belum ditemukan.
rendah yang tidak atau sedikit mengubah sifat fisiko-kimia bahan pangan, selain itu proses pasteurisasi dapat mematikan bakteri pembentuk spora serta inaktivasi enzim (Estiasih dan Ahmadi 2011). Selain proses pengolahan, teknik pengemasan harus sesuai untuk tempoyak. Teknik pengemasan vakum dan modified atmosfir packaging merupakan alternatif yang baik, karena dapat menyebabkan laju metabolisme bakteri lebih lambat, mengurangi pertumbuhan mikroba, mengurangi kerusakan oleh enzim, memberikan efek visual yang baik bagi produk, dan memperpanjang umur simpan produk (Sianipar 2010, Putu 2011).
1.2 Tujuan Penelitian
Tujuan penelitian secara umum adalah untuk mempertahankan mutu dan memperpanjang umur simpan tempoyak. Tujuan secara khusus dalam penelitian ini adalah
1. Aplikasi modifikasi cara pengolahan dengan pasteurisasi untuk menghambat pertumbuhan mikroba agar dapat memperbaiki mutu tempoyak.
2. Mendapatkan jenis dan teknik pengemasan yang sesuai untuk memperpanjang umur simpan tempoyak.
3. Menentukan umur simpan tempoyak pasteurisasi dan non pasteurisasi.
1.3 Ruang Lingkup
Ruang lingkup penelitian ini dibatasi pada (i) tempoyak dibuat dari jenis buah durian lokal yang dimodifikasi dengan cara pasteurisasi pada suhu 65 oC selama 30 menit; (ii) jenis dan teknik pengemasan yang digunakan adalah jenis plastik polyetylene terephtalate (PET) dengan teknik pengemasan Modified Atmosfir Packaging (MAP) dan jenis kemasan plastik polyamide menggunakan teknik pengemasan vakum; (iii) menentukan umur simpan tempoyak pasteurisasi dan non pasteurisasi yang dikemas dalam plastik PET dan polyamide.
1.4 Manfaat Penelitian
1. Memberikan informasi proses produksi tempoyak yang bisa mempertahankan mutu dan memperpanjang umur simpan tempoyak.
2. Memperbaiki mutu tempoyak agar memenuhi Standar Nasional Indonesia (SNI) dan dapat didistribusikan secara luas dikalangan masyarakat.
3. Mengangkat citra makanan tradisional (tempoyak) agar dikenal masyarakat luas dan memiliki nilai jual.
2 TINJAUAN PUSTAKA
2.1 Produk Hortikultura
Durian (Durio zibethinus Murr.) sering kali disebut king of fruit yang semakin dikenal masyarakat luas karena mempunyai rasa enak. Buah durian tumbuh baik di Asia Tenggara, khususnya banyak terdapat di Malaysia, Indonesia, Philipina, dan Thailand (Voon et al. 2006). Direktorat Jendral Hortikultura Kementrian Pertanian (2013) melaporkan bahwa produksi buah durian di Indonesia lima tahun terakhir terus meningkat yaitu 797.798 ton (2009), 492.139 ton (2010), 883.969 ton (2011), 812.433 ton (2012), dan 859.318 ton (2013). Buah durian merupakan salah satu jenis buah tropis asli Indonesia. Di Indonesia sendiri ada 21 kultivar durian unggul yang dirilis oleh Dinas Pertanian yaitu petruk, sukun, sitokong, kani, otong, simas, sunan, sihijau, sijapang, siriwig, bokor, perwira, sidodol, bantal mas, hepe, matahari, aspar, sawah mas, raja mabah, kalapet, dan lai mansau (Untung 2003).
Durian termasuk jenis buah klimaterik didasarkan terhadap pengukuran gas CO2 dan produksi etilen yang cepat selama pematangan, yang artinya memiliki sifat mudah rusak dan umur simpan yang pendek pada suhu ruang, sehingga jika tidak diolah dengan benar dan cepat akan menurunkan mutu dan berpotensi merugikan petani durian dan pelaku usaha lainnya (Yuliana 2005). Pada suhu ruang durian hanya mampu bertahan 2 sampai 4 hari. Setelah 4 hari, terjadi perubahan kualitas buah seperti penurunan nilai pH dari 7 menjadi 5.5, berair dan lunak, penurunan vitamin C dan peningkatan jumlah mikroba (Yuliana 2004).
Buah durian yang telah matang selain enak dikonsumsi segar, juga dapat diolah lebih lanjut menjadi berbagai jenis makanan olahan segar (kolak, bubur, penambah citra rasa ice cream) dan pengawetan (keripik, dodol, tempoyak). Buah durian mengandung gizi yang cukup tinggi dan komposisinya lengkap, seperti disajikan pada Tabel 1.
Tabel 1 Kandungan gizi buah durian dan tempoyak dalam 100 g bahan
Kandungan gizi Durian segar (%) Tempoyak (%)
Energi 147.01 126.00
Air 61.58 63.73
Karbohidrat 36.10 25.70
Lemak 1.20 2.20
Protein 2.00 1.10
Vitamin C 0.44 0.26
Fosfor 0.56 8.50
Kalsium 0.18 0.18
Zat Besi (Fe) 0.11 0.11
Serat 1.90 -
2.2 Durian Fermentasi (Tempoyak)
Pengolahan makanan tradisional dapat dilakukan dengan beberapa cara seperti fermentasi, pengasinan, pengasapan, dan perendaman dalam larutan gula atau garam. Pengolahan ini bertujuan untuk mengawetkan makanan dan memberikan rasa yang spesifik sehingga dapat meningkatkan nilai guna dan nilai jual bahan pangan. Manfaat lain yang dapat diperoleh secara tidak langsung adalah peningkatan nilai cerna bahan pangan, menurunkan kandungan antigizi atau bahan lain yang tidak dikehendaki, dan dapat menghasilkan produk atau senyawa turunan yang bermanfaat bagi kehidupan manusia. Makanan tradisional tersebut dapat berupa manisan berbagai buah atau berbagai hasil fermentasi seperti terasi, dadih, dan tempoyak (Hestiningtyas 2008).
Tempoyak adalah makanan tradisional yang diperoleh dengan cara memfermentasi daging buah durian, sehingga dihasilkan produk seperti pasta berwarna putih kekuningan hingga orange, memiliki aroma dan citra rasa yang khas dan tajam. Oleh karena aroma dan rasa yang khas, maka konsumsi tempoyak hanya terbatas pada penduduk melayu yang terbiasa dengan aroma dan rasanya. Berbeda dengan durian segar, tempoyak biasanya dikonsumsi sebagai makanan pembangkit selera, bahan makanan utama, maupun sebagai bumbu masakan bersama rempah-rempah lainnya. Cita rasa ini terbentuk karena keseimbangan antara komponen gula dari buah, asam laktat yang terbentuk selama fermentasi, dan garam yang ditambahkan sebagai faktor pengkondisi mikroba saat fermentasi. Kandungan gula dalam daging durian mengalami penurunan pada saat fermentasi sehingga menyebabkan rasa manisnya menurun. Selanjutnya metabolisme asam-asam organik juga ikut memberikan flavor spesifik pada tempoyak. Selain itu, adanya aktivitas enzim yang dimiliki BAL juga dapat mempengaruhi perubahan tekstur produk fermentasi (Wouters et al. 2002). Hasil penelitian Nur (2005) dan Yuliana (2005) melaporkan bahwa asam-asam organik pada tempoyak yang teridentifikasi seperti asam laktat, asam asetat, asam malat, asam sitrat dan asam butirat. Asam-asam yang dihasilkan tersebut dapat mencegah pertumbuhan mikroba lain seperti bakteri patogen, yang tidak dikehendaki selama proses fermentasi berlangsung. Selain asam-asam organik, diproduksi juga senyawa organik rantai pendek yang jumlahnya lebih kecil, seperti asam format, asam lemak bebas, diasetil, aseton 2.3-butanadiol, asetaldehida, enzim bakteriolitik, bakteriosin, antibiotik dan beberapa senyawa penghambat lain (Wirawati 2002).
Fermentasi durian yang mengikuti kebiasaan masyarakat adalah fermentasi spontan yakni tanpa penambahan starter (Yuliana 2008). Pembuatan tempoyak dengan metode ini dilakukan dengan cara daging durian ditaburi garam secara homogen sampai wadah atau toples mendekati penuh, selanjutnya ditutup rapat dan diinkubasi pada suhu ruang selama satu minggu (Gandjar 2000). Leisner et al.
tutup oleh gas yang dihasilkan selama fermentasi, sedangkan jika terlalu banyak ruang kosong kondisi anaerobik kurang terbentuk akibatnya terjadi peluang kontaminasi.
Penambahan garam pada pembuatan tempoyak di masyarakat sangat bervariasi 1% sampai 5% (b/b). Hasil penelitian Amin et al. (2004) melaporkan bahwa penambahan kadar garam terbaik untuk tempoyak adalah 2% sampai 3% (b/b). Secara garis besar kandungan garam yang ditambahkan dapat menghasilkan dua jenis tempoyak yang berbeda yaitu tempoyak asam jika kandungan garam kurang dari 5% dan tempoyak asin jika diberi penambahan garam lebih dari 5%. Kandungan garam yang rendah akan lebih mendukung pertumbuhan bakteri asam laktat sehingga produk akhir mempunyai tingkat keasaman tinggi dalam waktu yang relatif lebih cepat dibandingkan dengan tempoyak yang diberi garam tinggi. Sedangkan pada tempoyak yang diberi garam tinggi, hanya bakteri asam laktat selektif yang dapat hidup sehingga tingkat keasaman berkurang dan secara sensori, rasa asin menjadi dominan. Penambahan garam pada bahan akan menyebabkan pelepasan cairan dari bahan dasar. Cairan tersebut mengandung gula, protein terlarut, mineral dan zat-zat lain yang dapat digunakan sebagai substrat oleh bakteri asam laktat. Yuliana (2008) melaporkan bahwa penambahan garam bertujuan untuk menarik air dan bahan gizi dari jaringan bahan yang difermentasi, yang selanjutnya akan digunakan sebagai substrat untuk pertumbuhan bakteri yang terlibat dalam proses fermentasi.
Mikroba yang aktif selama fermentasi tempoyak adalah genus Lactobacillus
yang merupakan kelompok bakteri asam laktat (Nurmalinda et al. 2013). Ragam bakteri asam laktat yang dilaporkan beberapa peneliti yang terdapat pada tempoyak adalah L. plantarum, L. brevis, L. mali, L. fermentum dari tempoyak Malaysia (Leisner et al. 2001). Wirawati (2002) berhasil mengisolasi L. plantarum, L. casei, dan L. corynebacterium dari tempoyak Indonesia. Leisner et al. (2002) melaporkan jenis baru bakteri asam laktat Lactobacillus, L. duriansis sp. yang diisolasi dari tempoyak Malaysia. Yuliana et al. (2004) melaporkan bakteri asam laktat yang ada pada tempoyak adalah Pediococcus acidilactice dan
Weissella mesenteroides. Sedangkan Yuliana dan Dizon (2011) melaporkan bakteri asam laktat yang terkandung pada tempoyak jenis L. plantarum, L. sp, Weissella paramesenteroides, dan Pediococcus acidilactice. Hasanuddin (2010) melaporkan isolat bakteri yang teridentifikasi pada tempoyak sebanyak enam spesies yaitu: P. acidilactici, L. plantarum, L. curvatus, Leu. mesentroides, S. saprophyticus dan M. varians. Dari keenam spesies tersebut empat spesies yang berperanan positif pada fermentasi tempoyak yaitu P. acidilactici, L. plantarum, L. curvatus dan Leu. mesentroides. Dua spesies yang merugikan adalah
Staphylococcus saprophyticus dan Micrococcus varians. Karena adanya dua spesies bakteri yang tidak menguntungkan pada tempoyak disarankan agar masyarakat jangan mengkonsumsi langsung tempoyak tanpa dimasak. Khamir yang teridentifikasi dari tempoyak adalah K. marxianus. Ada tiga spesies jamur yang terlibat dalam proses fermentasi tempoyak dalam memproduksi asam laktat yaitu: Rhizopus oryzae, Monilia sitophila, dan Mucor roxii.
sebagai makanan tradisional baik secara fisik, kimia maupun mikrobiologis sangat diperlukan sehingga mempunyai peluang besar menjadi produk komersial. Sebagaimana yang dikemukakan oleh Wirawati (2002), bahwa fermentasi asam laktat pada prinsipnya dapat meningkatkan kandungan asam amino esensial. Sifat awet yang ditunjukkan oleh tempoyak baik untuk kesehatan, karena pengawetan yang terjadi tidak menggunakan bahan kimia yang akhir-akhir ini dihindari oleh konsumen karena dikahwatirkan dapat menimbulkan efek karsinogenik.
2.3 Bakteri Asam Laktat (BAL)
Pada umumnya BAL merupakan jenis mikroba alami yang dapat diperoleh dari makanan tradisional hasil dari fermentasi. BAL termasuk dalam kelompok mikroorganisme yang aman jika ditambahkan dalam pangan karena sifatnya tidak toksik dan dapat digunakan sebagai stateruntuk fermentasi minuman, daging dan sayuran. BAL merupakan salah satu contoh mikroorganisme yang menguntungkan dan mempunyai peran penting dalam industri pangan untuk mengawetkan bahan makanan (Adnan dan Tan 2006) dengan menghasilkan sebagian besar asam laktat dan asam-asam organik lainnya yang berpengaruh terhadap cita rasa produk fermentasi. Adanya aktivitas enzim yang dimiliki oleh BAL juga dapat mempengaruhi perubahan tekstur produk fermentasi. Asam laktat yang dihasilkan dapat menyebabkan terjadinya penurunan pH lingkungan. pH yang rendah dapat menghambat kontaminasi mikroba pembusuk dan patogen (Sari et al. 2012).
BAL merupakan bakteri mikroaerofilik, yang memiliki ciri-ciri khas seperti: tidak membentuk spora, gram positif, bereaksi negatif dengan katalase, berbentuk batang atau bulat, bersifat non motil dan dapat mengubah karbohidrat menjadi asam laktat (Korhenen 2010)serta tumbuh pada medium deMannRogosaSharpe
(MRS). Jenis mikroorganisme yang termasuk dalam kelompok BAL adalah mikroorganisme dari genus Lactobacillus, Leuconostoc, Streptococcus dan
Pediocococcus. BAL berdasarkan bentuknya terbagi dalam dua kelompok yaitu basil dan kokus. BAL yang berbentuk batang dapat digolongkan ke dalam 2 jenis genus yaitu genus Lactobacillus dan Carnobacterium. BAL yang berbentuk kokus (bulat) digolongkan ke dalam genus Streptococcus, Leuconostoc, Vagococcus, Lactococcus, Aerococcus, Tetragenococcus, Enterococcus, dan Pediococcus) (Lawalata 2012).
BAL bersifat homofermentatif dan heterofermentatif. Bakteri homofermentatif memecah gula menjadi asam laktat. Bakteri ini berbentuk bulat, bersifat katalase negatif dan mikroaerofilik. Jenis bakteri homofermentatif adalah
Lactobacillus, Pediococcus, dan Streptococcus. Beberapa spesies dari genus
Pediococcus ini adalah P. cereviceae (fermentasi sosis), P. pentosaeus, P. acidactili dan P. halophilicus yang dapat tumbuh pada konsentrasi NaCl 7%. Bakteri Pediococcus sering ditemukan pada fermentasi daging, susu dan sayuran dan pada umumnya berbentuk tetrad, tetapi beberapa spesies lainnya berbentuk rantai pendek. Bakteri Streptococcus merupakan bakteri yang berbentuk bulat yang hidup secara berpasangan atau membentuk rantai pendek dan panjang. Bakteri ini bersifat homofermentatif, proteolitik dan biasanya lipolitik. Bakteri
viridan (S.thermophilus dan S. bovis), gup laktat (S. lactis dan S. cremoris), dan gup enterokokus (S. faecalis dan S. durans). Suhu pertumbuhan optimum sebesar 30 °C (Sastra 2008).
Bakteri heterofermentatif dapat memecah glukosa menjadi asam laktat 50%, asam asetat 25%, etanol dan CO2 25% serta bakteriosin (Dizon 2002). BAL yang tergolong heterofermentatif adalah Lactobacillus dan Leuconostoc. Spesies dari genus Leuconostoc antara lain adalah L. cremoris, L. dextranicum dan L. Mesenteroide. Jenis bakteri L. cremoris dan L. dextranicum yang dapat memfermentasi asam sitrat menjadi diasetil yang digunakan dalam pembuatan keju untuk meningkatkan citarasa (Lawalata 2012).
Pertumbuhan BAL dipengaruhi oleh berbagai faktor seperti, nutrisi (karbohidrat atau gula), suhu, pH, kadar air, keberadaan oksigen, dan perlakuan panas. Salah satu faktor penting dalam pertumbuhan BAL adalah pH. Bakteri asam laktat dapat tumbuh pada pH antara 3.0 sampai 8.0. Namun, pH yang dibutuhkan masing-masing genus BAL berbeda-beda. Bakteri genus
Carnobacterium dan Tetragenococcus sangat toleran pada pH 4.6, sedangkan bakteri genus Lactobacillus dan Pediococcus sangat toleran pada pH dibawah 4.6. Produk makanan yang mempunyai nilai pH rendah (dibawah 4.5) umumnya tidak dapat ditumbuhi oleh bakteri patogen, tetapi dapat menjadi rusak karena pertumbuhan khamir dan kapang. Khamir dapat tumbuh pada kisaran nilai pH 2.5 sampai 8.5 dan tumbuh optimum pada pH 4.0 sampai 5.0, sedangkan kapang dapat tumbuh optimum pada nilai pH 5.0 sampai 7.0. Oleh karena itu, makanan yang mempunyai nilai pH rendah relatif lebih tahan selama penyimpanan dibandingkan dengan makanan yang mempunyai nilai pH netral atau mendekati netral (Buckle et al. 2010).
2.3.1 Karakter Lactobacillus
BAL pada produk tempoyak digolongkan ke dalam famili Lactobacillaceae, yaitu spesies dari genus Lactobacillus. Genus Lactobacillus memiliki ciri-ciri g postif, non spora, bentuk basil, paling tahan terhadap asam (masih bisa tumbuh pada nilai pH 3.0), anaerobik fakultatif, tidak tahan panas, katalase negatif dan ditandai dengan pembentukan asam laktat sebagai produk utama dari metabolisme karbohidrat. Suhu optimum pertumbuhan Lactobacillus sekitar 30 oC sampai 37 o
C. Lactobacillus banyak digunakan dalam industri makanan dengan beberapa spesies berfungsi sebagai probiotik seperti spesies L. acidophilus, L. delbrueckii subsp. bulgaricus, L. fermentum, L. casei, dan L. reuteri. Ketika heksosa (seperti glukosa) digunakan sebagai sumber karbon, maka genus Lactobacillus yang terlibat. Lactobacillus memproduksi gas dan senyawa volatil lainnya yang penting sebagai pembentuk cita rasa dalam makanan fermentasi (Candra dan Iryadi 2006).
Berdasarkan kemampuanya menghasilkan produk akhir berupa asam laktat,
Lactobacillus dapat dikelompokkan menjadi dua yaitu homofermentatif dan heterofermentatif. Spesies dari genus Lactobacillus yang tergolong homofermentatif meliputi L. acidophilus, L. bulgaricus, L. lactis, L. delbrueckii, dan L. thermophilus. Spesies dari genus Lactobacillus yang tergolong heterofermentatif adalah L. plantarum, L. buchneri, L. fermentum (fermentasi keju) dan L. brevis (fermentasi kecap dan sayuran), L. leichmanii, dan L. Casei
(Lawalata 2012). Proses biokimia pembentukan asam laktat Lactobacillus
Gambar A Gambar B
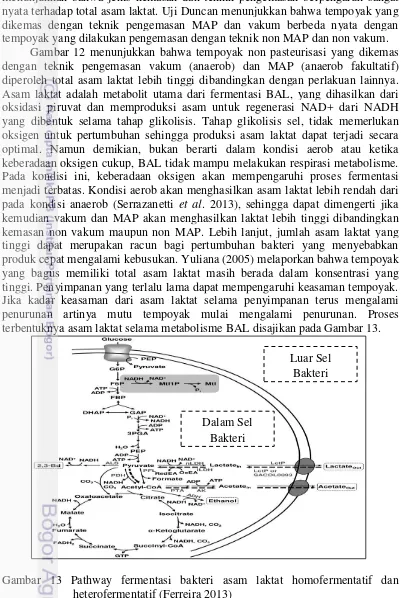
Secara umum, bakteri BAL yang bersifat homofermentatif menggunakan jalur glikolisis (Embeden-Meyerhof Pathway) untuk fermentasi glukosa. Tahapan glikolisis adalah pembentukan fruktosa-1.6-difosfat (FDP), yang dibagi oleh FDP aldolase menjadi dihidroksiaseton fosfat (DHA-P) dan gliseraldehida-3-fosfat (GAP). Selanjutnya dalam proses metabolisme ini, GAP dan DHAP dikonversi menjadi piruvat. Dalam kondisi standar yaitu kelebihan glukosa dan oksigen yang terbatas, piruvat direduksi menjadi asam laktat oleh NAD+- tergantung pada laktat dehidrogenase (LDH), sehingga pengoksidasi NADH dibentuk selama tahap awal glikolisis. Produk akhir yang dihasilkan pada tahap glikolisis adalah dua mol asam laktat dan dua ATP per glukosa mol sebagai sumber energi. Jalur fermentasi utama lainnya adalah phosphoketolase (jalur pentosa fosfat). Ditandai tahap dehidrogenasi awal dengan pembentukan 6-fosfoglukonat, diikuti oleh dekarboksilasi. Sisanya pentosa-5-fosfat dibagi menjadi phosphoketolase oleh GAP dan asetil fosfat. GAP dimetabolisme dengan cara yang sama seperti pada jalur glikolisis dan menghasilkan asam laktat. Ketika tidak ada penambahan elektron akseptor maka asetil fosfat berkurang menjadi etanol melalui asetil CoA dan asetaldehida. Proses metabolisme yang menghasilkan produk akhir etanol disebut heterofermentatif. Jalur heterofermentatif akan mengasilkan satu mol masing-masing asam laktat, etanol, CO2 dan satu ATP per glukosa (Putra 2013).
2.4 Pasteurisasi
Pengolahan panas merupakan salah satu cara paling penting yang telah dikembangkan untuk memperpanjang umur simpan bahan pangan. Tujuan dari pasteurisasi adalah untuk membunuh bakteri patogen dan bakteri non patogen (pembusuk atau perusak) jenis g negatif dan ada beberapa gram positif, sekaligus untuk meningkatkan mutu dan memperpanjang umur simpan bahan pangan (Nurliana et al. 2009). Penyebab utama kerusakan mikrobiologi adalah bakteri, kapang, dan khamir. Organisme-organisme tersebut memecah komponen organik kompleks dalam pangan menjadi senyawa lebih sederhana yang dapat menyebabkan perubahan terhadap flavor, tekstur, warna, dan bau. Haryadi (2000) melaporkan bahwa proses pasteurisasi efektif membunuh bakteri-bakteri yang berpotensi patogenik di dalam susu, namun proses ini ternyata tidak dapat mematikan sporanya, terutama spora bakteri yang bersifat termoresisten atau tahan terhadap suhu tinggi.
Pemanasan dapat dilakukan dengan uap air, air panas, panas kering, atau aliran listrik. Prinsip pasteurisasi adalah pemanasan dibawah suhu 100 oC. Pasteurisasi dibawah 100 oC yang sering digunakan oleh industri pengolahan pangan adalah HTST (High Temperature Short Time) dan LTH (Low Temperature Holding). Pada HTST menggunakan suhu tinggi dengan waktu yang singkat, yaitu 85 oC sampai 95 oC selama 1 sampai 2 menit. Sedangkan LTH menggunakan suhu rendah dengan waktu yang relatif lama yaitu 62 oC sampai 65 o
C selama 30 menit (Winarno 2007).
2.5 Pengemasan
Fungsi suatu kemasan menurut Buckle et al. (2010) adalah (1) mempertahankan produk agar bersih dan memberikan perlindungan terhadap kotoran dan pencemaran lainnya; (2) memberikan perlindungan pada bahan pangan terhadap kerusakan fisik, air, oksigen dan cahaya; (3) memiliki fungsi secara benar, efisien dan ekonomis dalam proses pengemasan yaitu selama pemasukan bahan pangan ke dalam kemasan. Kemasan harus sudah dirancang untuk siap pakai pada mesin-mesin yang ada; (4) mempunyai tingkat kemudahan untuk dibentuk menurut rancangan dan memberikan kemudahan bagi konsumen; dan (5) memberikan pengenalan, keterangan, dan daya tarik penjualan.
Pengemasan produk yang mudah rusak seperti buah-buahan, dengan menggunakan film plastik akan memperpanjang masa simpannya. Pada kemasan film plastik yang tertutup rapat, produk pertanian sering tampak dalam keadaan lebih baik dan tahan lama dari pada produk yang disimpan dalam kemasan yang diberi lubang-lubang kecil. Hal ini terjadi karena termodifikasinya udara disekitar bahan yang dikemas rapat, akan tetapi bau dan rasa yang tidak dikehendaki dapat timbul dalam kemasan. Bau dan rasa yang tidak diinginkan dapat timbul apabila penurunan O2 dan akumulasi CO2 akibat respirasi melebihi batas sehingga proses respirasi berubah dari aerobik menjadi anaerobik (Hadiana 2004).
Pengemasan produk pertanian dalam film permeabel merupakan sistem dinamik dan meliputi dua proses yang terjadi bersamaan yaitu proses pernafasan gas CO2 dan O2 ke luar dan ke dalam kemasan. Oksigen secara terus menerus digunakan oleh buah-buahan dan sayuran untuk kegiatan pernapasannya, dan menghasilkan CO2, H2O dan energi panas. Sebagai akibatnya terjadi perbedaan konsentrasi antara bagian dalam dan luar kemasan sehingga O2 mulai merembes ke dalam kemasan. Konsentrasi CO2 pada saat yang sama akan semakin meningkat akibat kegiatan respirasi dan merembes keluar kemasan melalui film pengemas. Gambar 2 mengilustrasikan proses yang akan terjadi.
dengan
ya : konsentrasi O2 diudara (21%) y : konsentrasi O2 dalam kemasan RO2 : Laju konsumsi O2
za : konsentrasi CO2 di udara (0.03%) z : konsentrasi CO2 dalam kemasan RCO2 : laju produksi CO2
Salah satu jenis bahan pengemasan makanan yang umum digunakan adalah plastik. Kemasan plastik memiliki beberapa keunggulan seperti sifat yang kuat tapi ringan, tidak berkarat dan bersifat termoplastis. Sifat-sifat daya tembus plastik dipengaruhi oleh suhu, ketebalan lapisan, komposisi, kondisi atmosfir (seperti kelembaban) dan faktor lainnya. Plastik tipis yang bersifat fleksibel mempunyai sifat-sifat yang berbeda dalam daya tembusnya terhadap gas, seperti nitrogen, oksigen, belerang dioksida dan uap air. Karena fungsi bahan pengemas dalam menurunkan tingkat pembusukan dari beberapa bahan pangan sangat erat hubungannya dengan penembusan gas baik ke dalam maupun ke luar dari kemasan. Pemilihan bahan kemasan terhadap permeabilitas gas untuk produk sangat mempengaruhi mutu dan umur simpan produk (Buckle et al. 2010). Penelitian ini menggunakan kemasan plastik polyethylene terephthalate (PET) dan plastik polyamide.
Buckle et al. (2010) melaporkan bahwa kemasan plastik PET memiliki sifat kuat, permeabilitas terhadap gas, aroma, maupun air rendah. Sampurno (2006) melaporkan bahwa sifat dan karakteristik plastik PET adalah memiliki densitas 1.38 g/cm3, ketebalan 12 mikron, mengkilap, transparan, barrier gas yang baik, sangat lentur, dan mudah dilaminasi. Sedangkan sifat dan karakteristik plastik
polyamide memiliki densitas 1.15 g/cm3, ketebalan 15 mikron, transparansi, tahan terhadap tusukan, tarikan, benturan, gesekan, stabil terhadap perubahan suhu, permeabilitas yang baik terhadap gas dan aroma, tahan terhadap minyak dan bahan kimia. Mujiarto (2005) melaporkan bahwa plastik polyamide merupakan jenis kemasan yang paling bagus untuk teknik pengemasan vakum.
Penggunaan beberapa jenis kemasan yang berbeda dapat memberikan umur simpan yang berbeda, demikian juga dengan teknik pengemasannya (Murad etal.
2010). Salah satu teknik pengemasan yang efektif untuk memperpanjang umur simpan produk adalah vakum dan modified atmosfir packaging.
2.5.1 Teknik Pengemasan Vakum
Pengemasan vakum didefenisikan sebagai suatu pengemasan terhadap produk pangan sehingga produk di dalamnya terlindung dari pertukaran gas atau air dari luar. Kemasan dalam kondisi vakum dapat mencegah pertumbuhan kapang dan serangga. Mikroorganisme aerobik akan mati dengan sendirinya akibat habisnya O2 dan meningkatnya konsentrasi CO2 yang dihasilkan selama respirasi oleh serangga atau mikroorganisme lain maupun dari produk bahan, dapat mengurangi jumlah oksigen dalam kemasan, mencegah kontaminasi mikroorganisme, memperpanjang umur simpan produk pangan, dan memberikan efek visual yang baik bagi makanan (Putu 2011). Berdasarkan sifat-sifat yang dimiliki oleh plastik polyamide seperti permeabilitas, kekuatan sobek, dan kekuatan tarik, maka dimungkinkan plastik polyamide dapat memberikan pengaruh yangram positif terhadap produk yang akan dikemas secara vakum (Renate 2009).
2.5.2 Teknik Pengemasan Modified Atmosfir Packaging (MAP)
menggunakan bahan kemasan yang dapat menahan keluar masuknya gas sehingga konsentrasi gas di dalam kemasan berubah dan menyebabkan laju respirasi produk menurun, mengurangi pertumbuhan mikrobia, mengurangi kerusakan oleh enzim serta memperpanjang umur simpan (Puspitasari 2006).
Pengemasan MAP merupakan teknik modifikasi udara yang merupakan suatu cara penyimpanan dimana konsentrasi gas O2 lebih rendah dan konsentrasi gas CO2 lebih tinggi, bila dibandingkan udara normal. Hal ini dapat dicapai melalui pengaturan kemasan. Teknik modifikasi atmosfer ada dua cara yaitu aktif dan pasif. Modifikasi atmosfer cara pasif, harus mengetahui karakteriktik film kemasan, konsumsi O2 dan produksi CO2 hasil respirasi. Kesetimbangan antara CO2 dan O2didapatkan melalui pertukaran udara di dalam kemasan melalui film kemasan. Jadi kesetimbangan yang diinginkan tidak dikontrol pada awalnya, melainkan hanya mengandalkan film kemasan yang digunakan. Modifikasi atmosfir cara aktif adalah penyimpanan dengan modifikasi atmosfer dimana udara di dalam kemasan pada awalnya dikontrol dengan cara menarik semua udara dalam kemasan, kemudian diisi kembali dengan udara dimana konsentrasi gas yang dibutuhkan telah diatur menggunakan alat, sehingga kesetimbangan langsung tercapai. Namun, tujuan dari kedua cara tersebut adalah untuk menciptakan kesetimbangan gas yang optimal dalam kemasan, dimana aktifitas respirasi produk dapat berlangsung serendah mungkin tetapi tingkat konsentrasi oksigen dan karbondioksida tidak sampai merugikan bagi produk. Faktor yang menentukan keefektifan MAP dapat memperpanjang umur simpan tergantung pada jenis produk, kualitas awal bahan, konsentrasi gas, suhu penyimpanan, higenis selama penanganan dan pengemasan, jumlah gas yang diproduksi dan sifat permeabilitas kemasan (Sivertsvik et al. 2002).
Keuntungan menggunakan MAP adalah gas yang terdapat dalam kemasan dapat menjadi lapisan pelindung yang dapat mempersulit perubahan suhu, berpotensi meningkatkan umur simpan 50% sampai 100%, produk dapat didistribusikan pada area pemasaran yang lebih luas, menyediakan produk bermutu tinggi, memperbaiki penampilan, dan sedikit/ bahkan tidak memerlukan pengawet. Kekurangan kemasan MAP adalah menambah biaya pengemasan, memerlukan kontrol suhu, komposisi gas berbeda untuk setiap produk dan memerlukan peralatan khusus dan operator yang terlatih (Sianipar 2010).
MAP yang baik untuk penyimpanan produk segar terolah minimal pada konsentrasi O2 sebanyak 2% sampai 8% dan konsentrasi CO2 sebanyak 5% sampai 15%. Konsentrasi CO2 minimal 5% sampai 10% dan tingkat oksigen rendah (< 10%), secara umum dapat menghambat terjadinya browning dan pertumbuhan mikroba. Toleransi relatif buah-buahan dan sayur-sayuran terhadap penurunan O2 dan peningkatan CO2 sangat penting untuk tercapainya kondisi atmosfir termodifikasi yang terjadi akibat metabolisme atau respirasi (Muhdarsyah 2007).
2.6 Kinetika Fermentasi
Pertumbuhan mikroba dan aktifitas-aktifitas fisiologi lainnya pada kenyataanya merupakan tanggapan (respon) terhadap lingkungan fisika kimia. Dengan mempelajari kinetika fermentasi akan didapat gambaran perubahan yang terjadi, yaitu pertumbuhan dan pembentukkan produk oleh mikroba. Tidak hanya sel aktif tetapi juga sel yang istirahat bahkan juga sel-sel yang mati, karena banyak produk-produk komersial yang dihasilkan setelah berhentinya pertumbuhan. Kinetika pertumbuhan dan pembentukkan produk menunjukkan kemampuan sel dalam memberikan respon terhadap lingkungannya. Model kinetika terdiri dari kinetika pertumbuhan, penggunaan substrat dan pembentukan produk (Busairi dan Mat 2006).
2.6.1 Kinetika Pertumbuhan Sel
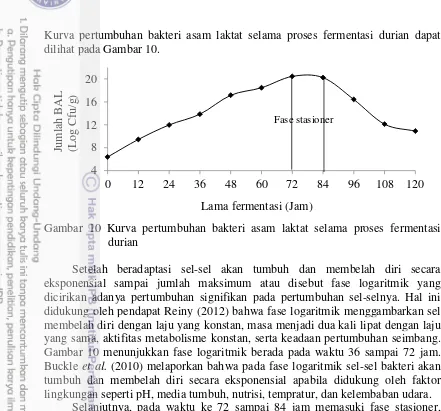
Pertumbuhan mikroba akan melalui tahap-tahap berikut (1) fase lag, (2) fase eksponensial, (3) fase perlambatan pertumbuhan, (4) fase stasioner dan (5) fase kematian. Fase lag segera terjadi setelah inokulasi, disebut juga sebagai masa adaptasi terhadap lingkungan baru. Mikroorganisme mereorganisasi komponen molekularnya pada saat menyerap nutrien baru. Komposisi dan jenis nutrien akan mempengaruhi jenis enzim yang disintesa, enzim yang dibutuhkan akan dibentuk,
enzim yang tidak diperlukan akan ditekan. “Mesin” proses di dalam sel
menyesuaikan diri dengan kondisi lingkungan baru. Perubahan ini akan terefleksikan dalam mekanisme sel melalui pengaturan proses metabolisme. Selama fase ini massa sel bertambah sedikit tanpa merubah densitas sel. Konsentrasi yang rendah beberapa nutrien dan faktor pertumbuhan akan menghasilkan fase lag yang panjang. Perioda fase lag sangat bergantung pada umur dari inokulum. Inokulum yang optimum akan menghasilkan fase lag yang minimum (Manfaaty 2010). Gambar 3 menjelaskan fase-fase pertumbuhan mikroba.
Gambar 3 Kurva pertumbuhan mikroba (Suprihatin 2010)
fase ini besar, maka laju pertumbuhan tidak dipengaruhi oleh konsentrasi nutrien. Laju pertumbuhan pada fase eksponensial mengikuti persamaan diferensial orde pertama (Manfaaty 2010), seperti pada persamaan 1.
d dt
dengan
X = X0 pada t = 0
X adalah konsentrasi biomassa (g/l), t adalah waktu (jam)
μ adalah laju pertumbuhan spesifik (jam-1 ).
Integasi persaman di atas menghasilkan persamaan 2.
ln t ln
Pada fermentasi, laju pertumbuhan spesifik (µ) adalah konstan dan dipengaruhi oleh perubahan konsentrasi nutrien. Pada konsentrasi nutrien awal yang rendah akan menghasilkan laju pertumbuhan yang lebih kecil dari laju pertumbuhan spesifiknya. Hubungan laju pertumbuhan dengan konsentrasi substrat (S) ditunjukkan oleh Gambar 4 pada daerah A terdapat pembatasan oleh substrat. Pada kondisi ini peningkatan konsentrasi substrat akan meningkatkan laju pertumbuhan mikroba. Pada daerah B tak terdapat pembatasan, dijumpai pada fasa eksponensial. Pada daerah C terjadi penghambatan oleh substrat. Pada saat S
mendekati , μ berbanding lurus dengan S, sedangkan jika S berlebihan μ tidak bergantung pada S, μ μm (laju pertumbuhan spesifik maksimum) (Mangunwidjaja 1994 dalam Amin 1999).
Gambar 4 Pengaruh konsentrasi substrat terhadap laju pertumbuhan spesifik (Mangunwidjaja 1994 dalam Amin 1999)
Model persamaan kinetika pertumbuhan yang digunakan adalah persamaan Monod. Model ini mengekspresikan bahwa laju pertumbuhan spesifik mikroba akan meningkat jika konsentrasi substrat meningkat. Namun laju pertumbuhan spesifik akan turun pada konsentrasi substrat yang terlalu tinggi. Persamaan Monod menggambarkan laju pertumbuhan spesifik merupakan fungsi dari konsentrasi substrat pembatas (S).
... (1)
Model Monod ditunjukkan oleh Gambar 5. Ks adalah tetapan kejenuhan, yaitu
konsentrasi substrat pada μ ½ μm. Nilai Ks bergantung pada jenis mikroba dan jenis substrat yang digunakan. Untuk substrat gula, nilai Ks berkisar 1-100 mg/l. Sedangkan untuk substrat nitrogen nilai Ks lebih rendah dari substrat gula. Secara umum, bila S > 3Ks, maka μ μm (Mangunwidjaja 1994 dalam Amin 1999). Modifikasi persamaan menghasilkan bentuk persamaan 4.
Ks
m S m
Fase perlambatan pertumbuhan terjadi setelah fase eksponensial. Pada fase ini perlambatan pertumbuhan terjadi karena berkurangnya konsentrasi satu atau lebih nutrien esensial dan terakumulasinya produk yang bersifat toksik terhadap pertumbuhan. Perubahan lingkungan yang cepat menyebabkan terjadinya
imbalance gowth. Pada fase eksponensial sistem pengendali proses metabolisme selular ditunjukan menghasilkan laju reproduksi yang maksimum, namun pada fase perlambatan pertumbuhan tekanan yang diakibatkan oleh terbatasnya nutrien dan lingkungan yang toksik akan merubah sistem pengendali proses metabolisme selular agar bisa tetap bertahan pada kondisi yang tidak menguntungkan (Manfaaty 2010).
Gambar 5 Model Monod pertumbuhan mikroba (Altiok 2004)
Setelah fase perlambatan pertumbuhan selesai dimulailah fase stasioner. Pada fase ini laju pertumbuhan adalah nol (tidak ada pembelahan sel) atau laju pertumbuhan sama dengan laju kematian. Konsentrasi massa sel tetap, namun jumlah sel yang hidup akan berkurang, terjadi lisis sel dan sebagian sel dapat tumbuh pada produk hasil lisis sel tersebut. Walaupun laju pertumbuhan adalah nol selama fase stasioner tetapi metabolisme sel masih aktif dan menghasilkan metabolit sekunder, sebagai hasil dari perubahan pengendalian selular karena terbatasnya konsentrasi nutrien esensial. Produksi metabolit sekunder (antibiotik, hormon) justru meningkat pada fase stasioner. Selama fase stasioner, sel mengkatabolisme nutrisi yang tersimpan dalam sel (endogenous metabolism) sehingga diperoleh energi (maintenance energy) untuk pemeliharaan membrane
... (3)
sel, transportasi nutrien, gerak dan perbaikan struktur sel yang rusak. Pertumbuhan mikroba akan terhenti selain disebabkan oleh terbatasnya konsentrasi nutrien esensial dan terakumulasinya produk yang bersifat toksik juga disebabkan oleh terbentuknya produk yang menghambat.
Penghambatan ini tergantung pada jenis dan konsentrasi produk penghambatnya. Produksi etanol oleh ragi merupakan contoh produk penghambat pertumbuhan. Hal tersebut dapat dicegah dengan cara mengencerkan medium yang tercemar toksik, menambahkan komponen kimia yang membentuk kompleks dengan produk penghambat dan tidak termetabolisme, dan memindahkan secara berkesinambungan produk penghambat dari dalam reaktor (Manfaaty 2010).
Fasa kematian kemudian akan terjadi setelah fasa stasioner. Namun kematian sel sebenarnya telah terjadi selama fase stasioner sehingga batas yang jelas untuk kedua fase tersebut tidak ada (Manfaaty 2010).
Parameter kinetika lain dapat dirumuskan untuk menjelaskan lebih lanjut tentang kinetika pertumbuhan mikroba yaitu koefisien perolehan/yield. Koefisien yield pertumbuhan dirumuskan sebagai jumlah sel kering yang dihasilkan per jumlah substrat yang dikonsumsi (YX/S).
s S
2.6.2 Kinetika Penggunaan Substrat
Kinetika penggunaan substrat fermentasi asam laktat telah dikembangkan dengan mempertimbangkan bahwa substrat yang dikonsumsi dikonversi menjadi biomass dan pembentukan asam laktat juga digunakan untuk pemeliharaan (Busairi 2002). Persamaannya mengikuti bentuk berikut.
dS
dt s d
dt p s d
dt m
Parameter yield biomassa terhadap substrat (YX/S), yield produk terhadap substrat (YP/S) dan koefisien pemeliharaan (m) diestimasi dengan analisa nonlinier. YP/S juga dapat didefinisikan sebagai jumlah produk yang dihasilkan perjumlah substrat yang dikonsumsi.
p s
S
Persamaan yang lebih sederhana diusulkan dengan mengasumsikan bahwa koefisien untuk pemeliharaan sangat kecil dibandingkan dengan laju pertumbuhan spesifik, sehingga bisa diabaikan. Substrat digunakan untuk pembentukan biomassa dan produk saja.
... (5)
... (6)
2.6.3 Kinetika Pembentukan Produk
Kinetika pembentukan produk mengikuti pola umum pembentukan produk setelah pertumbuhan mikroorganisme (metabolit sekunder). Kinetika pembentukan produk ada tiga macam bentuk dan dapat dilihat pada Gambar 6.
dengan
X = konsentrasi sel kering (g/l)
P = konsentrasi produk (g/l) ---
1. Pertumbuhan berkait dengan pembentukan produk 2. Pertumbuhan tidak berkait dengan pembentukan produk 3. Campuran
3 METODOLOGI PENELITIAN
3.1 Bahan
Bahan yang digunakan pada penelitian ini meliputi bahan untuk aplikasi tempoyak yaitu daging buah durian lokal berwarna putih kekuningan yang diperoleh dari Parung Bogor, plastik polyethyleneterephthalate (PET), dan plastik
polyamide. Selanjutnya, bahan untuk analisis seperti Man Rogosa Shape agar,
PlateCount Agar, Potato Dextrose Agar, NaCl, Na2SO4, H2SO4, fenolftalein, KI, sodium tiosulfat, Pb-asetat, (NH4)2 HPO4, larutan luff schoorl, NaOH, safranin, alkohol, kristal violet, dan iodin.
3.2 Alat
Alat yang digunakan pada penelitian ini meliputi alat gelas yaitu cawan petri, tabung reaksi, corong, gelas piala, kaca preparat, labu erlenmeyer, seperangkat alat destilasi dan titrasi. Alat digital yaitu pH meter merek ATC pH-009(I)A, mixar gas, gas analyzer CO2 dan O2 merek cosmotektor, Gas Kromatogafi Shimadzu (GC-17A). Alat pendukung lainnya seperti mikroskop,
vakumpacker (model lapack 550/s), sealer, inkubator.
3.3 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2015 hingga bulan Agustus 2015. Pembuatan tempoyak dan pengemasan dilakukan di laboratorium pengemasan Teknologi Industri Pertanian Institut Pertanian Bogor. Pengujian mutu fisik dan kimia tempoyak dilakukan di Laboratorium Dasar Ilmu Terapan TIN, Laboratorium Mutu TIN dan Laboratorium Kimia Terpadu Baranasiang Institut Pertanian Bogor. Selanjutnya, untuk pengujian mikrobiologi dilakukan di Laboratorium Bakteriologi Kedokteran Hewan Institut Pertanian Bogor.
3.4 Metode Penelitian
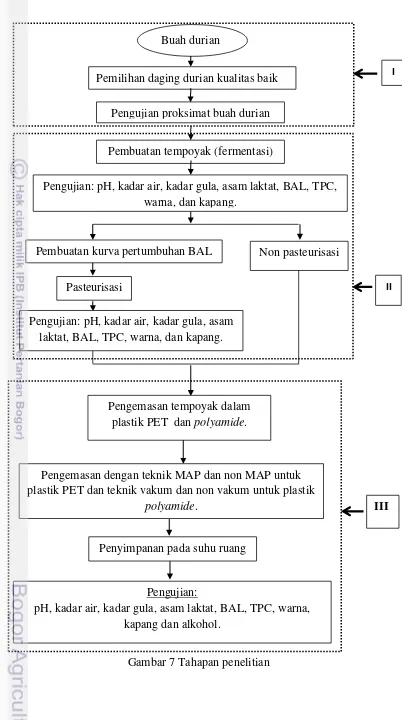
Gambar 7 Tahapan penelitian
III
Pengujian:
pH, kadar air, kadar gula, asam laktat, BAL, TPC, warna, kapang dan alkohol.
Pengemasan tempoyak dalam plastik PET dan polyamide.
Pengemasan dengan teknik MAP dan non MAP untuk plastik PET dan teknik vakum dan non vakum untuk plastik
polyamide.
Penyimpanan pada suhu ruang
Non pasteurisasi
Pasteurisasi
Pengujian: pH, kadar air, kadar gula, asam laktat, BAL, TPC, warna, dan kapang.
II
Pembuatan kurva pertumbuhan BAL Buah durian Masak
Pembuatan tempoyak (fermentasi)
Pengujian: pH, kadar air, kadar gula, asam laktat, BAL, TPC, warna, dan kapang.
I
3.4.1 Karakteristik Buah Durian
Buah durian yang masak disortasi dan dikupas untuk mendapatkan daging durian kualitas baik. Durian kualitas baik akan menentukan mutu tempoyak. Buah durian yang digunakan berwarna putih hingga kuning. Proses selanjutnya daging durian dipisahkan dari bijinya, bagian biji dikumpulkan sebagai limbah dan daging buah digunakan untuk proses berikutnya dan dilakukan uji komposisi kimia yaitu kadar air, serat, abu, protein, lemak, dan karbohidrat (AOAC 2005). Prosedur analisa disajikan pada Lampiran 2.
3.4.2 Persiapan Tempoyak
3.4.2.1 Pembuatan tempoyak
Metode yang digunakan dalam penelitian ini adalah fermentasi secara spontan. Daging buah durian kualitas baik selanjutnya ditimbang, kemudian ditaburi garam 3% (b/b) dan gula 1% (b/b) secara berlapis hingga homogen, selanjutnya sampel difermentasi. Diagram alir pembuatan tempoyak disajikan pada Lampiran 1.
3.4.2.2 Pembuatan kurva pertumbuhan bakteri asam laktat
Kurva pertumbuhan BAL dengan media daging durian ditujukan untuk penentuan rentang waktu pasteurisasi yang tepat yaitu waktu ketika pertumbuhan BAL berada pada fase stasioner. Uji ini dilakukan dengan cara menginokulasikan kultur pada media de Man Ragosa Shape (MRS) agar dan diinkubasikan selama 24 jam pada suhu 37 oC. Pengamatan dilakukan pada jam ke-0 dan setiap 12 jam, yaitu pada jam 0, 12, 24, 36, 48, 60, 72, 84, 96, 108, 120. Jumlah total bakteri dihitung dengan persamaan 8.
otal bakteri (cfu umlah koloni perca an faktor pengenceran
3.4.2.3 Pasteurisasi tempoyak
Tempoyak dipasteurisasi pada suhu 65 oC selama 30 menit pada saat bakteri pembentuk tempoyak berada pada fase stasioner. Fase stasioner didapatkan dari hasil kurva pertumbuhan mikroba. Tempoyak hasil fermentasi sebelum dan sesudah pasteurisasi diuji mutunya. Kemudian, tempoyak hasil pasteurisasi harus segera dilakukan pengemasan dan disimpan dengan baik. Pengemasan yang tidak sesuai dapat mempercepat terjadinya penurunan mutu tempoyak, yang dapat mengakibatkan kerusakan dan kebusukan tempoyak.
3.4.2.4 Identifikasi jenis bakteri asam laktat
Penentuan BAL dilakukan dengan cara menginokulasikan kultur dari tempoyak hasil fermentasi pada media MRS dan diinkubasikan selama 48 jam pada suhu 37 oC. Perhitungan koloni yang tumbuh dilakukan setelah 48 jam. Koloni yang membentuk zona bening diidentifikasi sebagai bakteri asam laktat. Setiap koloni yang terbentuk diamati dan diidentifikasi dengan mereaksikan
beberapa jenis gula (seperti maltosa, sorbitol, arabinosa, dan lain-lain). Jumlah koloni dihitung dengan persamaan 8.
3.4.2.5 Pengujian mutu tempoyak sebelum dan setelah pasteurisasi
Variabel yang diamati adalah pH (SNI 06-6989.11-2004), kadar air (AOAC 2005), total gula (SNI 0l-2892-1992), asam laktat (AOAC 2000), BAL (Lindayani dan Hartayanie 2013), TPC (SNI 01-2332.3-2006), warna, dan kapang. Prosedur analisa disajikan pada Lampiran 2. Pengujian mutu digunakan untuk melihat mutu awal tempoyak.
3.4.3 Pengemasan Tempoyak
Tempoyak hasil pasteurisasi segera dilakukan pengemasan untuk menghindari terjadinya kontaminasi oleh mikroorganisme. Jenis kemasan yang digunakan adalah plastik polyetylene terephtalate dan polyamide. Plastik
polyamide yang sudah diisi tempoyak dikemas dengan teknik vakum dan non vakum, sedangkan plastik PET dikemas dengan teknik MAP dan non MAP. Tabel 2 disajikan kode sampel dari semua perlakuan.
Tabel 2 Kode sampel dari semua perlakuan
Kode sampel Arti kode
PPM Tempoyak pasteurisasi, jenis kemasan polyetylene terephtalate, dan teknik pengemasan Modified Atmosfir Packaging
PPNM Tempoyak pasteurisasi, jenis kemasan polyetylene terephtalate, dan teknik pengemasan non Modified Atmosfir Packaging
PNV Tempoyak pasteurisasi, jenis kemasan polyamide, dan teknik pengemasan vakum
PNNV Tempoyak pasteurisasi, jenis kemasan polyamide, dan teknik pengemasan non vakum
NPM Tempoyak non pasteurisasi, jenis kemasan polyetylene terephtalate, dan teknik pengemasan Modified Atmosfir Packaging
NPNM Tempoyak non pasteurisasi, jenis kemasan polyetylene terephtalate, dan teknik pengemasan non Modified Atmosfir Packaging
NNV Tempoyak non pasteurisasi, jenis kemasan polyamide, dan teknik pengemasan vakum
NNNV Tempoyak non pasteurisasi, jenis kemasan polyamide, dan teknik pengemasan non vakum
3.4.3.1 Teknik pengemasan Modified Atmosfir Packaging (MAP)
3.4.3.1.1 Pengisian gas O2 dan CO2 dalam kemasan plastik PET
menginjeksikan gas CO2 ke dalam kemasan atau untuk menurunkan komposisi O2 maka gas N2 dapat diinjeksikan. Proses teknik pengemasan modified atmosfir packaging untuk tempoyak pada penelitian ini dapat dilihat pada Gambar 8.
Gambar 8 Pengisian gas O2 dan CO2 kedalam kemasan plastik PET
Teknik pengemasan modified atmosfir pada penelitian ini adalah dengan meningkatkan konsentrasi gas CO2 dan menurunkan konsentrasi gas O2 dalam kemasan. Caranya dengan mengeluarkan seluruh komposisi gas O2 dalam kemasanmelalui lubang yang telah dipasang selang plastik dan dilengkapi dengan tutup (pentil) atau penjepit (Gambar 8). Selanjutnya, diinjeksikan gas CO2 sebanyak 67% sampai 69% dan O2 sebanyak 5% sampai 6% dengan cara memompa nozel selama 30 detik melalui lubang pada tutup kemasan yang dihubungkan dengan selang plastik, kemudian ujung selang ditutup rapat dengan penjepit untuk mencegah kebocoran atau mencegah masuknya O2 dan keluarnya CO2 secara bebas. Tempoyak yang telah dilakukan pengemasan disimpan pada suhu ruang. Pengukuran dan pengontrolan konsentrasi gas dilakukan setiap tiga hari sekali.
3.4.3.1.2 Pengukuran konsentrasi gas CO2 dan O2 dalam kemasan PET
Gambar 9 Pengukuran komposisi gas CO2 dan O2 dalam kemasan PET
3.4.3.2 Teknik pengemasan vakum
Prinsip teknik pengemasan vakum adalah pengeluaran udara dari kemasan sehingga tidak ada udara dalam kemasan yang dapat menyebabkan produk yang dikemas menjadi rusak. Mekanismenya kemasan yang telah berisi tempoyak dikosongkan udaranya, ditutup dan direkatkan. Dengan tidak ada udara didalam kemasan, maka kerusakan akibat oksidasi dapat dihilangkan sehingga produk yang dikemas akan lebih tahan lama.
Pada penelitian ini jenis plastik yang akan divakum adalah polyamide,
dengan menggunakan pengemasan vakum bertekanan. Prinsipnya adalah memberi tekanan pada kemasan hingga kemasan tersebut menggembung. Sebelum dilakukan pengemasan, dilakukan penambahan gas nitrogen yang berguna untuk melindungi bahan agar tidak rusak ketika diberi tekanan. Mekanisme pengemasanya yaitu dengan meletakkan pengemas yang berisi bahan secara horizontal pada alas pengemas bertekanan, posisi saluran gas berada diantara plastik, kemudian alat ditutup. Secara otomatis alat tersebut akan menambahkan gas, tekanan, dan kemudian proses sealing. Caranya adalah meletakkan bagian kemasan yang akan digabungkan, kemudian menekannya dengan tangan dari mesin tersebut. Panas yang terdistribusi pada alat vakum bagian alas dan head mesin yang mengakibatkan plastik tersebut lengket dan bergabung.
3.4.3.3 Pengujian mutu akhir tempoyak dalam kemasan